Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Asociación Argentina de Sedimentología
Print version ISSN 1853-6360
Rev. Asoc. Argent. Sedimentol. vol.3 no.2 La Plata Dec. 1996
ARTÍCULOS
Los biohermos de la Formación San Juan (Ordovícico temprano, Precordillera Argentina): paleoecología y comparaciones
Marcelo G. Carrera * y Fernando L. Cañas *
* CONICET. Cátedra de Estratigrafía y Geología Histórica Facultad de Ciencias Exactas, Físicas y Naturales de la Universidad Nacional de Córdoba. Av. Vélez Sársfield 299, 5000 Córdoba. Casilla de correo 395, República Argentina.
Resumen
La Formación San Juan, en el Ordovícico de la Precordillera Argentina, presenta dos horizontes biohermales claramente diferenciables. El primero se desarrolla en la base de la unidad (Tremadociano tardío) y está compuesto por un complejo biohermal que alcanza hasta 5 metros de potencia con la participación de esponjas lithistidas, el receptaculítido Calathium y comunidades microbianas. El segundo, ubicado en el tercio superior de la formación (Arenigiano tardío), comprende dos tipos de estructuras: arrecifes de estromatoporoideos y estructuras mixtas de estromatoporoideos, comunidades microbianas, esponjas lithistidas y Calathium.
El complejo biohermal inferior se desarrolla en el inicio de un cortejo transgresivo, sobre una caliza fenestral con características de exposición subaérea y que corresponde al evento regresivo previo. Las litofacies biohermales corresponden a "boundstones" microbianos y "wackestones-packstones" lito/bioclásticos, disectadas por profundos canales de "grainstones" lito/bioclásticos.
La comunidad de estos biohermos está dominada por comunidades microbianas, esponjas lithistidas y Calathium que en conjunto ocupan entre el 60 y 70 % del volumen de la roca. La cadena trófica de las estructuras biohermales estaría compuesta por productores primarios como organismos microbianos (cianobacterias, algas, fitoplancton) y algas bénticas como Calathium. Los consumidores secundarios están representados por los organismos suspensívoros heterótrofos (esponjas, crinoideos, braquiópodos) y por los hervívoros como los gastrópodos. El rol de carnívoros lo ocupan los nautiloideos. De acuerdo a las características litofaciales y paleontológicas estos biohermos se desarrollaron en ambientes someros afectados por las olas normales en sectores de rampa proximal.
Los arrecifes de estromatoporoideos están compuestos por una estructura rígida ("framestone") de 8 a 10 metros de potencia, con variados morfotipos de estromatoporoideos entre los que predominan las formas laminares y globulares. Entre los montículos de estromatoporoideos se presentan áreas dominadas por un "packstone" esqueletal a bioclástico y una facies interarrecifal compuesta por "grainstone" de pelmatozoos con estructuras como estratificación entrecruzada de bajo ángulo. Las esponjas lithistidas y las estructuras microbianas están casi ausentes y en algunos casos se restringen a la facies de flancos.
Las estructuras mixtas son pequeños cuerpos lenticulares y cabezas arrecifales separados por una facies interarrecifal de grainstones y rudstones que también presentan canales de grainstones lito/bioclásticos que cortan las estructuras.
Los estromatoporoideos, organismos relacionados con las esponjas calcáreas, dominan ampliamente la facies arrecifal y constituyen entre el 80 y 90 % del volumen de la roca. Estudios recientes con esponjas calcáreas han determinado su asociación simbiótica con cianobacterias y de esta manera actúan como productores primarios aprovechando la nutrición extra a partir de la fotosíntesis cianobacteriana. Si bien la extrapolación de esta característica a los estromatoporoideos no ha podido ser comprobada fehacientemente, podría explicarse de esta manera la fuente de la importante energía necesaria para la construcción de la estructura esqueletal de los estromatoporoideos, teniendo en cuenta la escasez de otros organismos productores como algas bénticas y considerando que, el fitoplancton y las comunidades microbianas aportan como máximo el 40% de la producción primaria. Se considera que la forma de crecimiento de los estromatoporoideos y su condición de organismos clonales, les han permitido ocupar y desarrollar estructuras arrecifales en ambientes agitados y de sustratos duros. Por el contrario, los organismos solitarios como las esponjas lithistidas ocuparían ambientes tranquilos con sustrato blando. Sin embargo, tanto el horizonte biohermal inferior como los arrecifes de estromatoporoideos caracterizan, a grandes rasgos, condiciones paleoambientales similares (ambientes someros de rampa interna) y sustratos duros, aunque en forma local los arrecifes de estromatoporoideos podrían estar influenciados por las mareas o cambios periódicos en la tasa de sedimentación, no parece ser esta característica la causante del importante cambio en las comunidades constructoras.
Los organismos solitarios, heterótrofos se ven favorecidos cuando hay una abundancia de nutrientes y por ende de fitoplancton (condiciones heterotróficas). Los organismos clonales (multiseriados) corresponden a ambientes con escasez de nutrientes (condiciones oligotróficas) y aguas claras. Este aumento o disminución de los nutrientes puede obedecer a distintas causas, entre las más importantes el ascenso relativo del nivel del mar produce, según su magnitud, el aporte de corrientes provenientes de estratos de agua más profundos cargados con nutrientes. El ascenso del nivel del mar en la base de la Formación San Juan sumado al importante cambio tectosedimentario con el desarrollo de una rampa abierta sobre la anterior plataforma restringida, podría explicar el desarrollo de biohermos dominados por heterótrofos. Las condiciones tectosedimentarias más estables que presentan los arrecifes de estromatoporoideos y con una fluctuación del nivel del mar no tan marcada impedirían la mezcla con aguas más profundas y podrían ser algunas de las causas de la disminución de los nutrientes.
Las estructuras mixtas coetáneas con los arrecifes de estromatoporoideos corresponderían a sectores algo más profundos o protegidos que normalmente presentan una concentración mayor de nutrientes.
Palabras clave: Biohermos; Formación San Juan; Ordovícico; Facies; Paleoecología.
Extended abstract
The San Juan Formation is a thick sequence of limestones in the Ordovician of the Argentine Precordillera. Two distinctive biohermal horizons occur. The lower horizon (Late Tremadoc) is characterized by a four meter thick complex of reef-mounds built by lithistid sponges, the receptaculitid Calathium and microbial benthic communities. The reef-mounds exhibit two main rock types: (a) massive skeletal and lithoclastic wackestone/packstone, mostly of sponges and Calathium with Girvanella tubules encrusting and binding sponges and bioclasts; lithoclastic wackestones to grainstones were deposited on the irregular mound surface. (b) microbial boundstones, including stromatolitic structures, non-laminated peloidal micritic boundstone and Girvanella crusts. The reef-mounds are dissected by conspicuous channels filled with coarse crinoidal grainstone and lithoclastic rudstone.
The upper horizon (Late Arenig) exhibits three types of reef structures: patch-reefs with an organic framework of stromatoporoids, biostromal accumulations of stromatoporoids, algae and sponges, and stromatoporoid-algal mounds. The patch reefs form structures up to ten meters in diameter and 5 meters height with a framework of often more than 90 % globular stromatoporoids in the nucleus and a combination of laminar and globular types in the flank facies. Laterally, the reefs interfinger with high energy deposits (pelmatozoan grainstone/packstones).
The biostromes and the stromatoporoid-algal mounds are combined structures with varying amounts of frame-building organisms. Stromatoporoids, lithistid sponges, Calathium and microbial structures occur.
Stromatoporoids are the major components of the biostromal accumulations. In these structures the laminar and globular stromatoporoids dominate over the algae and the lithistid sponges. Grainstone and packstones with cross-bedding and channeled structures are the most common lithologies.
The stromatoporoid-algal mounds are mainly composed by microbial structures, stromatoporoids and Calathium but also show isolated and scarce lithistid sponges. The most common lithologies in the mounds are wackestone/packestones baffled and bound by the stromatoporoids, microbial comunities, Calathium and lithistids. These structures are developed in and above coarse bio/lithoclastic grainstones.
According to the sedimentological and paleontological features, an inner ramp setting has been suggested for all the reef structures. The change in the community composition, especially the constructor guild, was analyzed taking into account local sedimentological variations or biotic interactions among the principal reef builders. The reef-mounds at the base of the formation are dominated by lithistid sponges, while the patch-reefs in the upper horizon were constructed entirely by the stromatoporoids. The paleoecological requirements of both groups may answer the question of whether the biotic, physical or both factors influenced the distribution of these reef structures.
The lithistid sponges are solitary organisms, which obtain theirs nutrition from suspended organic matter and bacteria. This heterotrophic condition suggests a preference for nutrient-rich waters. Several authors have pointed out the generally low turbulence and soft substrate settings of these sponges. However the sedimentological features of the sponge-algal mounds from the Precordillera basin suggest a hard substrate (tidal rock terrace) and high energy conditions.
The stromatoporoids are clonal organisms with no clear feeding strategy, a mixotroph condition has been suggested by many authors via a symbiotic relationship with cyanobacteria, as well as most of the modern reef building sponges in oligotrophic waters. A trophic analysis of the stromatoporoid patch-reef community shows a very low proportion of primary producers. Taking into account that the benthic macroalgae are almost absent and the phytoplankton and the benthic microbial communities supply a maximum of 40 % of the total primary production, extra photosymbiotic nutrition is suggested in order to maintain the high rate of skeletal production. A hard substrate and very shallow conditions are inferred for these organisms.
Although there are local variations, an inner ramp setting is inferred for all the reef structures present in the San Juan Formation. A minor gradient is inferred from the shallower stromatoporiod patch-reefs, the sponge-algal reef-mounds to the combined structures (stromatoporoid-algal mounds or biostromes). It is difficult to explain the important change in the entire reef community considering only local variations of water motion. According to the trofic strategies of the reef-building groups, nutrient fluctuations are suggested as the main factor that controls the distribution of and the change in reef communities. The development of the lower reef horizon follows a Late Tremadoc transgression, representing the first appearance of an open marine fauna. The restricted platform developed in the underling La Silla Formation changes to an open carbonate ramp after the Late Tremadoc transgresive event. These important changes in the basin may have contributed to the runoff of nutrient-bearing currents from nearby land masses and favored the upwelling of nutrient rich waters from the deep basin.
The widespread ramp system present at the time of the stromatoporoid-reefs developed and the comparatively minor rise in sea level, may have helped to diminish the amount of nutrients, at least in the inner ramp environment. The stromatoporoid-algal mounds may have developed in a slightly deeper or more protected environment with relatively high amounts of nutrients.
Key words: Bioherms; San Juan Formation; Ordovician; Facies; Paleoecology.
INTRODUCCIÓN
Una de las características sobresalientes de los ambientes marinos tropicales a subtropicales es la presencia de una gran variedad de estructuras órgano-sedimentarias. Estas estructuras se distinguen del resto de las sedimentitas por la participación activa de organismos en la construcción de cuerpos sedimentarios, que a su vez influyen sobre la sedimentación en las áreas circundantes. Un amplio espectro de estas bioconstrucciones han sido reconocidas en las calizas cambro-ordovícicas de la Precordillera Argentina e incluyen desde finas laminaciones milimétricas, estromatolitos decimétricos y montículos calcifangolíticos que resultan de la interacción entre comunidades de microorganismos y sedimentos (principalmente desarrollados en las calizas cámbricas; Keller et al., 1989 Cañas, 1990; Armella, 1994), hasta biohermos con la participación de metazoarios esqueletales (principalmente en las calizas ordovícicas). Si bien el Tremadociano presenta estructuras organo-sedimentarias como trombolitos y laminitas criptoalgales (Formación La Silla, Cañas, 1995a,b), los biohermos de metazoarios se concentran en el intervalo Tremadociano tardío-Arenigianotardío (Formación San Juan; Lenhert, 1994).
Los biohermos y biostromas de la Formación San Juan han sido mencionados o estudiados en detalle por Carrera (1991, 1994), Cañas (1995b), Cañas & Carrera (1993), Cañas & Keller (1993), Keller & Bordonaro (1993), Keller et al. (1993), Keller & Flügel (1996). Sin embargo, no se han dado a conocer aún estudios paleoecológicos detallados ni estudios comparativos entre los distintos tipos de estructuras biohermales. El propósito de esta contribución es realizar el análisis paleoecológico, complementar el análisis de los ambientes depositacionales y establecer comparaciones entre los distintos biohermos de la Formación San Juan.
Pueden distinguirse dos tramos claramente diferenciados de la Formación San Juan en donde las estructuras biohermales se encuentran representadas. La base de la unidad (Tremadociano tardío; Lehnert, 1994) presenta estructuras biohermales del tipo "reef-mound" (James, 1984), con la participación de esponjas Lithistidas, el receptaculítido Calathium y organismos microbianos, que denominaremos horizonte biohermal inferior (HBI) y que ha sido reconocido en las secciones de los cerros La Silla y Viejo de San Roque (Fig. 1). El tramo medio a superior de la formación (Arenigiano tardío, Lehnert, 1994) presenta dos niveles muy próximos de biohermos y biostromas dominados por estromatoporoideos que se denominará horizonte biohermal superior (HBS). Los biohermos o arrecifes de estromatoporoideos se encuentran principalmente en las localidades de las quebradas Las Lajas y Los Berros (Sierra Chica de Zonda) mientras que los biostromas se ubican en los Cerros La Silla Cerro Viejo de Huaco y Sierra de Villicúm (Fig. 1).
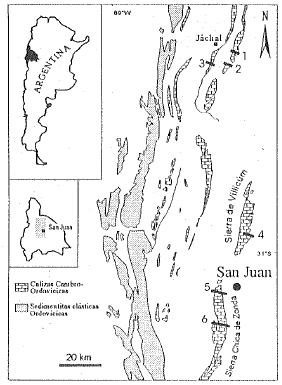
Figura 1. Mapa geológico simplificado con la ubicación de las secciones estudiadas. 1. Cerro Viejo 2. Cerro La Silla 3. Cerro San Roque 4. Don Braulio 5. Las Lajas 6. Los Berros.
Figure 1. Simplified geologic map showing the location of the estudied sections 1. Cerro Viejo 2. Cerro La Silla 3. Cerro San Roque 4. Don Braulio 5. Las Lajas 6. Los Berros.
ESTRATIGRAFÍA
A partir del reciente trabajo de Keller et al. (1994) la Formación San Juan se restringe a una sucesión de espesor variable de aproximadamente 320 a 350 metros compuesta principalmente por calizas, dolomías y margas con abundante fauna, que se extiende desde el Tremadociano tardío hasta el Llanvirniano temprano (Fig. 2). La subyacente Formación La Silla (Keller et al., 1994) es una unidad calcárea con dolomías subordinadas en laminaciones finas y con características de ambientes restringidos, que culmina con un horizonte de calizas fenestrales con claras evidencias de exposición subaérea (Cañas & Carrera, 1993, Cañas, 1995). Sobre este sustrato endurecido se desarrolló el horizonte biohermal inferior que da inicio a la fauna con características marinas abiertas de la Formación San Juan.
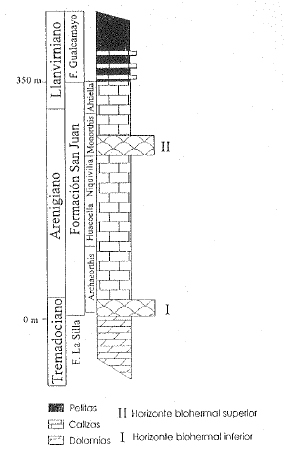
Herrera & Benedetto (1991) dividieron a la Formación San Juan en cuatro intervalos aproximadamente coincidentes con biozonas de braquiópodos reconocidas por estos autores. El primer intervalo (60-90 m) corresponde a la Biozona de Archaeorthis en la base de la Formación y está compuesto principalmente por capas medias a gruesas de "packstones" y "grainstones" biolitoclásticos y "wackestones" esqueletales a bioclásticos. Presenta calizas fenestrales y "boundstones" macizos biohermales del HBI en la base de la unidad.
El segundo intervalo (70-90 m) comprende las Biozonas de Huacoella y Niquivilia. Está constituido por capas finas de calizas y dolomías grises a amarillentas con una marcada pseudoestratificación debido a superficies de presión-disolución. Las calizas son mayoritariamente "wackestones" litoclásticos o bioclásticos y "grainstones" intraclásticos subordinados (depósitos de tormenta; Cañas, 1995).
El tercer intervalo (80-100 m) corresponde a la Biozona de Monorthis y exhibe gruesas capas de "grainstones" litobioclásticos asociados con "framestones" de estromatoporpoideos o "boundstones" de lithistidas y estromatoporoideos del HBS. El tramo superior de esta unidad presenta capas gruesas y macizas de "wackestones" bioclásticos.
El intervalo superior (Biozona de Ahtiella) presenta en la mayoría de las secciones unos 50 metros con una alternancia de capas finas de "wackestones" bioclásticos y "mudstones" nodulares con abundantes restos esqueletales y "grainstones" bioclásticos subordinados que pasan rápidamente o a través de una delgada transición a las sucesiones de pelitas negras de las equivalentes Formaciones Los Azules y Gualcamayo (Astini, 1994).
HORIZONTE BIOHERMAL INFERIOR (HBI)
Morfología y litofacies de los biohermos
Los biohermos en la base de la Formación San Juan (Tremadociano tardío, Lehnert, 1994) forman un complejo de estructuras biohermales aisladas o coalescentes de aproximadamente 600 metros de largo paralelo al rumbo depositacional, 150 metros de ancho perpendicular a dicho rumbo y 4 metros de potencia. Pueden diferenciarse claramente facies de fundación de las estructuras, facies de biohermo, facies de flancos y facies de canales (Cañas & Carrera, 1993).
Facies de fundación. Corresponde a unos 4 metros de calizas fenestrales con pequeñas intercalaciones de "rudstones" intraclásticos. En las fenestras se observa un relleno geopetal bien seleccionado de peloides y cemento de calcita isopáquica y ecuante, característicos de ambientes intertidales a supratidales. Esta facies es truncada por una superficie erosiva con un importante relieve de erosión-disolución e interpretada como producto de exposición subaérea (Read & Grover, 1977), sobre la cual se asienta directamente la facies de biohermo.
Facies de biohermo. En los afloramientos esta facies se presenta como una caliza masiva de color gris con macrofósiles de gran tamaño aislados o densamente agrupados (Figs. 3, 4 y 5) Estos corresponden principalmente a esponjas lithistidas, el receptaculítido Calathium y estructuras microbialíticas (nomenclatura de Burne & Moore, 1987). Dos tipos litológicos principales se presentan en esta facies: (a) "bio/lithoclastic wackestone/packstone" y (b)" boundstone" microbiano.
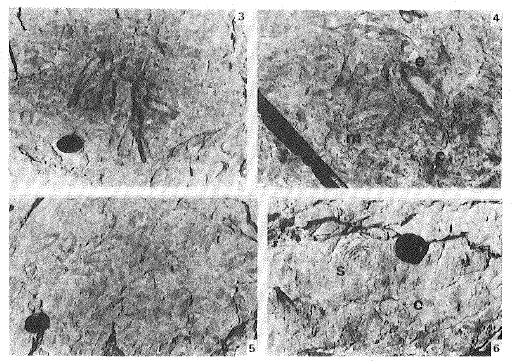
Figura 3. Esponjas lithistidas, cilíndricas y de gran tamaño en la superficie de un montículo arrecifal del horizonte biohermal inferior.
Figure 3. Large cylindrical lithistid sponges in a reef-mound surface of the lower biohermal horizon.
Figura 4. Superficie de un montículo arrecifal mostrando la estrecha relación entre estructuras microbianas (m), Calathium (c) y esponjas lithistidas (e) en el horizonte biohermal inferior.
Figure 4. Outcrop photograph of the reef-mound surface showing the association of microbial structures (m), Calathium (c) and lithistid sponges (e), in the lower biohermal horizon.
Figura 5. Esponjas lithistidas, cónicas a cilíndricas, en la superficie de un montículo arrecifal del horizonte biohermal inferior.
Figure 5. Conical to cylindrical lithistid sponges in a reef-mound surface of the lower biohermal horizon.
Figura 6. Montículos arrecifales de estromatoporoideos y algas en el horizonte biohermal superior, s: estromatoporoideo aislado, c: Calathium
Figure 6. Stromatoporoid-algal reef-mounds of the upper biohermal horizon, s: isolated stromatoporoid, c: Calathium.
(a) "bio/lithoclastic wackestone/packstone": Esta roca presenta una fábrica maciza en la que los macrofósiles en forma desordenada se mezclan con granos algales, peloides y litoclastos. Las microfacies más importantes tienen una disposición en parches o en mosaico y corresponden a micritas peloidales y bioclásticas entre y dentro de las esponjas y Calathium. El alga Girvanella sp. (Fig. 7) se encuentra incrustando esponjas y bioclastos como también formando nódulos y oncoides. Entre los macro y microfósiles más importantes se presentan trilobites, gastrópodos pelmatozoos, ortocónidos y en forma menos abundante braquiópodos y el alga problemática Nuia sp. Las espículas y fragmentos de esponjas son también importantes (Fig. 8) Las microfacies de "wackestone" litoclásticos y "grainstone" se presentan en forma aislada entre la litología anterior en finos bancos y rellenando perforaciones. Presenta litoclastos redondeados entre 1 y 2 mm, fragmentos de esponjas, nódulos de Girvanella y bioclastos entre los componentes más importantes.

Figura 7. "Boundstone" de Girvanella en el horizonte biohermal inferior, (x 40). Escala 0,5 mm.
Figure 7. Girvanella boundstones from the lower biohermal horizon, (x40). Scale bar = 0.5 mm.
Figura 8. "Wackestone-packestone" esqueletal bioturbado que incluye un fragmento de una esponja lithistida del horizonte biohermal inferior, (x 3). Escala 5 mm.
Figure 8. A fragment of a lithistid sponge included in a skeletal bioturbated wackestone-packestone from the lower biohermal horizon, (x 3). Scale bar = 5 mm.
Figura 9. "Wackestone-packestone" esqueletal que incluye un fragmento del receptaculítido Calathium del horizonte biohermal inferior, (x 2). Escala 10 mm.
Figure 9. A fragment of the receptaculitid Calathium included in an skeletal wackestone-packestone of the lower biohermal horizon, (x 2). Scale bar = 10 mm.
Figura 10. Corte delgado de un estromatoporoideo del horizonte biohermal superior mostrando las láminas y pilares. En la parte central las láminas son interrumpidas por sedimento que presenta algunas perforaciones biogénicas, (x 14). Escala 1mm.
Figure 10. Thin section showing laminae and pillars of a stromatoporoid from the upper biohermal horizon. In the central part the lamina is interrupted by bioturbated sediment, (x 14). Scale bar = 1 mm.
(b) "boundstone" microbiano: Esta subfacies contituye grandes parches de hasta 1 metro donde representa más de 70 % de la roca. Comprende costras algales, micríticas y peloidales de 5 cm de espesor asociadas o no con esponjas y Calathium. Estas estructuras de origen microbiano presentan láminas estromatoides (Kennard & James, 1986) subhorizontales a subverticales, pequeños estromatolitos digitados de 1 a 2 cm de ancho y 5 cm de alto compuestos por láminas milimétricas de micrita oscura, microesparita y peloides y costras laminadas de Girvanella (Fig. 7) y horizontes que presentan una fábrica moteada con algunos componentes de trombolitos como estromatoides o "mesoclots" aislados.
Facies de flancos. Los biohermos gradan lateralmente a calizas de bancos delgados en las que pueden distinguirse: (a) "Wackestone" esqueletales con estructura maciza fuertemente bioturbada con macrofósiles, bioclastos y peloides. (b) "Wackestone/packstone" peloidal/esqueletal normalmente preservado sobre superficies de erosión incluídas en la facies anterior, con la presencia de grandes intraclastos (>5mm) redondeados provenientes del biohermo. (c) "Grainstone" litoclástico/bioclástico con geometrías lentiformes de 1-2 m de ancho por 30 cm de espesor con bases erosivas.
Facies de canales. Los biohermos se encuentran disectados por numerosos canales relativamente angostos y con márgenes irregulares. Algunos macrofósiles están seccionados por estos canales lo que revela la temprana litificación de las estructuras biohermales. Se pueden distinguir dos tipos de relleno presentes en los mismos: (a): Bancos macizos de "grainstone/rudstone" pobremente seleccionados con litoclastos bien redondeados (1-7mm), derivados del biohermo. (b): "Grainstones" bien seleccionados compuestos por litoclastos bien redondeados fragmentos de pelmatozoos y bioclastos que incluyen fragmentos de esponjas, trilobites y nódulos de Girvanella.
Contenido paleontológico
Esponjas. Las esponjas de estos niveles han sido descriptas por Cañas & Carrera (1993), por lo que se realizará una breve reseña de las mismas incluyendo la mención de aquéllas que se reconocen por primera vez en este estudio. Cabe mencionar que la deficiente preservación de los poríferos, debido a una fuerte recristalización de las espículas o a la total disolución de las mismas, impidió en muchos casos la identificación del material fosilífero por lo que algunos taxones serán referidos a la morfología que presentan (ej.: discoidal indet.). A pesar de esta deficiente preservación puede indicarse con bastante precisión que la gran mayoría de las esponjas corresponden a la Familia Anthaspidellidae del Orden Lithistida. Se puede distinguir claramente, mediante los conteos realizados sobre la superficie de los biohermos, que en forma mayoritaria dominan los géneros Archaeoscyphia y Calicocoelia, mientras que Rhopalocoelia, Hudsonospongia y los discoidales indet. aparecen con menor representación. Archaeoscyphia y Calicocoelia varían entre pequeños cilindros y conos de 4-8 cm hasta formas elongadas de 20-30 cm, simples o ramificadas, suaves o fuertemente anuladas. Rhopalocoelia presenta una forma cilíndrica de 4 a 8 cm mientras que Hudsonospongia es un género de forma cónica a subglobosa que en estos niveles presenta reducidas dimensiones.
En secciones delgadas se observan importantes porcentajes de espículas monaxonas orientadas en forma aleatoria o con ciertos patrones radiales. En este último caso, cuando se observan en rellenos de cavidades o perforaciones con paredes festoneadas, están referidas a esponjas endolíticas (Kobluk, 1981). La presencia aislada de espículas triactinidas y heteractinidas revela la presencia de esponjas calcáreas (Cañas & Carrera, 1993).
Estromatoporoideos: Una referencia especial merecen algunos estromatoporoideos aislados y muy escasos que han sido reconocidos recientemente en este horizonte inferior y que por sus características serían similares a los que se presentan en forma conspicua en el HBS.
Algas. El alga cyanophyta Girvanella sp. (Fig. 7) aparece representada en casi todas las secciones delgadas realizadas en la roca del biohermo. Se encuentra formando costras en el sedimento en litoclastos, bioclastos o sobre otros organismos, principalmente las esponjas, también se las observa como acumulaciones aisladas en la matriz o formando oncolitos. Además se observa Nuia sp. que es un alga de posición incierta y posee algunas afinidades con las clorofitas (Mamet & Roux, 1982); se presenta en forma aislada y escasa en algunas secciones delgadas de la roca del biohermo.
Calathium. Este receptaculítido ha sido incluído indistintamente entre las esponjas y las algas verdes, aunque en la actualidad se lo refiere principalmente a estas últimas (Nitecki & Toomey, 1979; Carrera, 1991). Es un componente importante entre los macrofósiles presentes en las estructuras biohermales (Fig. 9), superando en algunos sectores a los poríferos. Presenta en general tamaños que no superan los 12 cm de alto siendo en promedio algo menores (6-9 cm). La forma general varía entre talos cónicos a subglobosos pedunculados y en ambos casos pueden presentarse ramificados
Organismos accesorios: Entre estos organismos los más abundantes son los pelmatozoos. Sus fragmentos, principalmente artejos de crinoideos, son muy abundantes tanto en la facies de biohermo como en el relleno de los canales. Los gastrópodos son también importantes. Entre éstos, el género Maclurites (gastrópodo planispiralado) es el más conspicuo aunque también son abundantes los gastrópodos turbinados y espiralados. Los cefalópodos están representados por ortocónidos que son comunes tanto en los biohermos como en los canales y en la facies de flancos. Se han reconocido también fragmentos de trilobites, pigidios y cranidios correspondientes a las familias Bathyuriidae y Leiostegiidae (Vaccari, 1994). Los braquiópodos son comunes en secciones delgadas de la facies del biohermo y de los flancos. En cortes delgados y principalmente en el relleno de los canales, se ha detectado la presencia de pequeños y escasos fragmentos de briozoos trepostomados al igual que probables bivalvos y ostrácodos.
Paleoecología
Los estudios paleoecológicos previos realizados en la Formación San Juan (Sánchez et al., 1993 y en prensa; Carrera, en prensa) se basaron en el censo poblacional a partir del biovolumen de cada uno de los ejemplares colectados. La imposibilidad de colectar individuos aislados en rocas macizas sin estratificación, hizo que la metodología empleada fuera la que normalmente se utiliza en este tipo de estructuras: conteo de los ejemplares mediante cuadrículas en superficies de 1 m2. Se prefiere en este caso el uso de volumen de roca ocupado por los organismos que sostienen la estructura y para los organismos accesorios el censo poblacional ordinario. De esta manera, los conteos muestran un predominio de las esponjas y Calathium que en conjunto constituyen aproximadamente el 45% de la roca aunque en algunos sectores este porcentaje puede disminuir a 15% o aumentar incluso hasta el 60%. A los valores de estos macrofósiles deben sumarse los volúmenes ocupados por las estructuras microbialíticas que se encuentran representadas con porcentajes elevados, difíciles de estimar cuatitativamente, en todos los sectores de la estructura biohermal.
Estos análisis muestran que la distribución de los organismos en el complejo biohermal es bastante homogénea entre los distintos biohermos y podría afirmarse que todos los organismos mencionados se encuentran presentes en los mismos. Sin embargo, puede observarse que algunos se encuentran dominados por Calathium mientras que otros muestran un predominio de los poríferos. Las estructuras de origen microbiano parecen mantener su abundancia relativa en ambos casos. También presentan una pobre variación vertical, la que está indicada por la disposición de esponjas discoidales o cilíndricas de reducido tamaño en la base de los biohermos, mientras que hacia el tope de los mismos predominan las esponjas cilíndricas a cónicas de gran tamaño y se observa un aumento en el número de ejemplares de Calathium. Hacia los flancos la frecuencia de los organismos disminuye abruptamente.
Puede dividirse a los organismos de los biohermos en distintos grupos o "guilds" (Fagerstrom, 1987) de acuerdo a las características y funciones que tienen dentro de las estructuras. Así, el grupo constructor estaría representado por los organismos que forman y sostienen la estructura ("framebuilders"). Mientras que un segundo grupo corresponde a aquellos que entrampan y fijan el sedimento ("binders", "baflers"). Sin embargo, en estructuras biohermales de este tipo ("reef-mounds", James 1983), que carecen de un núcleo formado por metazoos que secretan estructuras esqueletales rígidas, la diferencia entre las funciones de uno y otro grupo no es muy clara. La construcción de estos biohermos estaría más bien relacionada con una combinación de estructuras microbianas (cianobacterias contructoras) que fijan el sedimento y una asociación de esponjas y Calathium que lo entrampan, favorecidos por una cementación marina temprana
De los conteos realizados surge que la comunidad del biohermo está dominada por una cadena trófica en la que intervienen productores primarios autótrofos como organismos microbianos (cianobacterias-algas-fitoplancton) y algas bénticas calcáreas como Calathium. Entre los consumidores secundarios predominan los organismos suspensívoros heterótrofos como las esponjas, crinoideos y braquiópodos ocupando distintos niveles de alimentación sobre el sustrato ("tiering"). Los gastrópodos son también consumidores secundarios y ocupan el rol de hervíboros ya que se alimentan a partir de algas. Los nautiloideos cumplen el rol de carnívoros en ambos grupos.
La abundancia de suspensívoros implica una abundancia de plancton, bacterias y partículas orgánicas en suspensión. Las esponjas se diferencian claramente como suspensívoros pasivos ya que se alimentan por filtración de bacterias, partículas orgánicas disueltas y más raramente de fitoplancton. Los crinoideos y braquiópodos por el contrario son suspensívoros colectores y seleccionan principalmente zoo y fitoplancton. Los trilobites y ostrácodos corresponden a los organismos saprófagos y pueden ser responsables también de la abundancia de perforaciones y madrigueras que se observan en la estructura biohermal. A éstos deben sumarse esponjas perforantes reconocidas también en los biohermos (Cañas & Carrera, 1993) y posibles organismos de cuerpo blando. Por otra parte, estos organismos corresponden a los principales destructores ("bioeroders"), al igual que las cianobacterias que cumplen un rol importante en la destrucción de cristales de calcita como por ejemplo Girvanella (Klement & Toomey, 1967).
Interpretación paleoambiental
Las condiciones paleoambientales han sido descriptas por Cañas & Carrera (1993) por lo que no se abundará en mayores detalles. Sin embargo, a manera de resumen estos autores han propuesto en base a las características litofaciales y paleontológicas, que el medio en el que se desarrollaron estas estructuras corresponde a ambientes subtidales someros afectados por olas normales en sectores de rampa interna con circulación normal. Las estructuras se desarrollan sobre una caliza fenestral con evidencias de exposición subaérea, y luego de un evento transgresivo. Los organismos de reducidas dimensiones incluyendo esponjas cónicas a hemisféricas y crinoideos comienzan a desarrollarse sobre este sustrato duro y bajo la influencia de condiciones energéticas elevadas, lo que queda evidenciado por la asociación con facies gruesas y el retrabajo que presentan algunos de los bioclastos. La acción entrampadora de sedimento por parte de estos organismos ("baffling") y la acción de fijación y retención por parte de las comunidades microbianas, y las algas incrustantes ("binding"), crearon montículos o parches de "wackestones" y "bindstones". En este relieve irregular de montículos y áreas intermonticulares se desarrollaron esponjas cilíndricas a cónicas de mayor tamaño, el receptaculítido Calathium y estromatoporoideos globulares aislados. La incisión de los canales se produce en forma casi simultánea con el desarrollo de estos montículos, ya que es un fenómeno restringido al complejo biohermal y por el hecho de que estos canales presentan casi exclusivamente lito y bioclastos derivados de los biohermos.
HORIZONTE BIOHERMAL SUPERIOR (HBS)
Este segundo intervalo biohermal presenta una variedad de estructuras según las asociaciones de organismos que los componen y las distintas texturas y estructuras dominantes (Cañas & Keller, 1993; Cañas, 1995). Pese a esta distinta tipología y la dispersión geográfica que presentan, aparecen restringidos a un intervalo de tiempo que comprende la parte superior de la Biozona de Oepikodus evae hasta la Biozona de Microzarkodina flabellum parva, ambas comprendidas aproximadamente en el Arenigiano tardío (Lehnert & Keller, 1993). Se distinguen básicamente dos tipos principales: arrecifes de estromatoporoideos y estructuras mixtas.
Arrecifes de estromatoporoideos
Estos arrecifes se encuentran en todo el ámbito de las Sierra Chica de Zonda y Villicum (Cañas & Keller, 1993) donde aparecen en dos niveles distintos del tramo intermedio de la Formación San Juan. Forman montículos aislados de hasta 5 m de potencia y 10 m de diámetro, distanciados decenas de metros unos de otros. La potencia de cada uno de los niveles varía entre 4-15 m y se distinguen en ellos tres facies:
Facies arrecifal. Está compuesta por una estructura rígida ("framestone") de varios tipos de estromatoporoideos (Keller & Bordonaro, 1993; Keller & Flügel, 1996) En ésta predominan las formas globulares sobre las laminares (Fig. 11). Las primeras corresponden a formas hemiesferoidales cuya dimensión varía entre algunos centímetros y casi 80 cm de diámetro. Las formas laminares están constituídas por láminas finas ondulosas que varían desde costras delgadas de 10 cm de potencia hasta paquetes gruesos de 50 cm de espesor. Tambien se observan formas columnares que alcanzan una altura de 50-60 cm, mientras que la base no supera los 15 cm de diámetro.
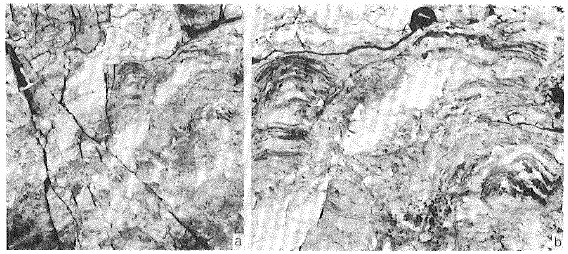
Figura 11a. Arrecifes de estromatoporoideos del horizonte biohermal superior. 11b. Detalle mostrando el importante crecimiento vertical de los estromatoporoideos con bordes digitados interrumpidos por la sedimentación.
Figure 11a. Stromatoporoid reefs from the upper biohemal horizon. 11b. Detailed showing ragged margins of stromatoporoids and sediment interruptions.
Los estromatoporoideos presentan una alternancia de capas de calcita y una estructura de crecimiento con pequeñas láminas y escasos pilares o tabiques (Fig. 10). Entre las capas anteriores se presentan láminas irregulares de micrita de posible origen microbacteriano, evidenciado no sólo por la presencia de estructuras y texturas de este tipo (mesoclots, costras y nódulos de Girvanella, entre otros) sino por la posición inestable de las láminas de micrita sobre el tope de estromatoporoideos globulares lo que revela la retención y fijación de este sedimento. Entre los montículos de estromatoporoideos se observan superficies irregulares con áreas deprimidas en las que predominan gastrópodos y nautiloideos en un "packstone" esqueletal a bioclástico en el que también son frecuentes los fragmentos de pelmatozoos y esponjas lithistidas
Facies de flancos. presenta contactos bien diferenciados, subverticales y consisten de "grainstone" hasta "packstones" de pelmatozoos con clastos subordinados de braquiópodos y trilobites. En esta facies se observan estromatoporoideos aislados en aparente posición de vida, tanto globulares como laminares.
Facies interarrecifal. Se compone de "grainstone" de composición similar a la facies de flancos, pero los estromatoporoideos son muy escasos y presentan evidencias de transporte. Por otra parte predominan las estructuras mecánicas como la estratificación y laminación cruzada de dunas y ondulitas respectivamente.
Estructuras mixtas
Estas estructuras fueron encontradas en los cerros La Silla, Viejo de San Roque y del Fuerte (Fig. 1). Son pequeños cuerpos lenticulares y cabezas arrecifales separados por una facies interarrecifal en horizontes de hasta 10 m de potencia. Texturalmente son "boundstones" formados por estromatoporoideos (dómicos y laminares), comunidades microbianas, Calathium y esponjas lithistidas con abundantes espacios rellenos por sedimentos micríticos (Fig. 6). La fauna acompañante incluye braquiópodos, pelmatozoos, trilobites y diversas formas de algas como Girvanella y Halysis. Los estromatoporoideos y las comunidades microbianas son los organismos que prevalecen en la construción de estos montículos arrecifales fijando el sedimento ("binders") mientras que Calathium y las esponjas lithistidas actúan como constructores accesorios entrampando el sedimento ("bafflers").
La facies interarrecifal está compuesta por capas de "rudstone" y "grainstone" de intraclastos derivados de las bioconstrucciones y bioclastos de pelmatozoos, también es frecuente la estratificación cruzada de bajo ángulo.
Contenido paleontológico
Esponjas. Las distintas formas de estromatoporoideos son comparadas por Keller & Bordonaro (1993) con el género Pulchrilamina Toomey & Ham, (1967). En sección longitudinal o vertical, el material de Precordillera (Fig. 10) muestra un conjunto de láminas cortas irregularmente alineadas que en conjunto forman laminaciones mayores que se encuentran unidas o disectadas por escasos pilares o tabiques comparables con las espinas descriptas por Toomey & Ham (1967) en el material tipo de Pulchrilamina. Desafortunadamente este material presenta una fuerte recristalización de las láminas por lo que la comparación con el de la Precordillera es dificultosa. Tanto Pulchrilamina spinosa (Toomey & Ham, 1967) como los ejemplares de la Precordillera podrían incluirse, teniendo en cuenta la revisión del grupo propuesta por Stearn (1993), entre los estromatoporoideos dominandos por láminas (Coenostrom-dominant). La sección tangencial u horizontal, muestra una distribución irregular de las láminas y pilares con intricados canales y poros, algunos de los cuales están dispuestos radialmente y estarían relacionados con las estructuras esteladas (astrorhizae) que en forma más desarrollada y regular se presentan en los estromatoporoideos más evolucionados (Wood, 1990).
En la facies arrecifal se han identificado pequeños fragmentos de esponjas lithistidas en los sedimentos presentes entre los estromatoporoideos. Sin embargo, los únicos ejemplares completos de lithistidas, correspondientes al género Archaeoscyphia, se encuentran en forma aislada en la facies de flancos.
Algas. El receptaculítido Calathium se encuentra restringido a la facies de flancos y en forma muy subordinada. El alga cianófita Girvanella se presenta principalmente en forma de nódulos o en pequeñas costras próximas a los estromatoporoideos. Halisis y Nuia aparecen en forma aislada y con bajos porcentajes. También se encuentra presente una forma afín al género Sphaerocodium.
Organismos accesorios. Los pelmatozoos (principalmente crinoideos) presentan porcentajes elevados y son uno de los componentes principales en las facies interarrecifales, de los flancos y de los canales. Entre los gastrópodos dominan los espiralados y turbinados, aunque también son conspicuos los planiespiralados de gran tamaño y aparecen en estos biohermos los posibles opérculos de gastrópodos (Fiscella, Carrera, 1994). Los fragmentos de trilobites y braquiópodos son importantes al igual que los restos de ortocónidos.
Paleoecología
El estudio paleoecológico en este horizonte superior refleja la dominancia de los estromatoporoideos como los organismos constructores formando una estructura rígida de metazoos, característica básica que muchos autores hacen referencia en la definición de arrecife. Estos organismos fueron incluídos entre los celenterados, sin embargo, son ahora considerados como una nueva clase de esponjas con esqueletos calcáreos macizos, Sclerospongiae (Hartman & Goreau, 1970) o como un nuevo grupo dentro de la clase Calcarea (Vacelet, 1970). Este grupo de esponjas son formas clonales multiseriadas e integradas que en muchos casos poseen bacterias fotosimbióticas (Wilkinson, 1983). Los estromatoporoideos podrían relacionarse con organismos fototróficos cumpliendo el doble rol de productores primarios y, al igual que los corales hermatípicos, el de supensívoros. Otros productores primarios además del fitoplancton estarían representados por cianobacterias y algas, que aunque su abundancia es difícil de estimar, puede afirmarse al menos que no llegan a formar estructuras microbialíticas de importancia. Calathium se encuentra escasamente representado y se restringe a los flancos de las estructuras. Al igual que las esponjas lithistidas que aparecen en porcentajes muy bajos, aunque algunos fragmentos aislados también lo hacen en la facies arrecifal; por lo que entre los suspensívoros predominan los crinoideos y braquiópodos. Los gastrópodos muestran ligeros cambios: abundan los coniespiralados de reducidas dimensiones, mientras que Maclurites sp. se retrae. Sin embargo, otros planispiralados indeterminados abundan al igual que probables opérculos de gastrópodos (Carrera, 1991), que no se encuentran presentes en el HBI. Si bien esta diferencia no implica un cambio de rol en la estructura arrecifal (mantienen su posición de herbívoros), la disminución de las algas puede haber llevado a un cambio en la dieta alimentaria. Estudios con gastrópodos actuales han mostrado diferencias en la composición de los mismos de acuerdo a si la cadena trófica tiene como productores primarios a macroalgas o fitoplancton (en Wood, 1993). Entre los organismos destructores aparecen los trilobites y posibles organismos de cuerpo blando responsables por ejemplo de las perforaciones en la matriz micrítica entre los estromatoporoideos. Las esponjas perforantes no parecen estar representadas.
Si bien no ha podido determinarse fehacientemente la participación de simbiontes en los estromatoporoideos, como se verá más adelante, lo que puede indicarse es que de no ser así se establecería un desbalance en la estructura trófica y de la producción calcárea de la comunidad del HBS. La facies arrecifal está compuesta en un 80 a 90 % por un "framestone" de estromatoporoideos que utilizan un gran porcentaje de la energía en la construcción del armazón calcáreo. Los ecosistemas arrecifales son sistemas que poseen una productividad primaria muy elevada pero que se contrarresta con lo que se consume en el metabolismo (principalmente respiración); el flujo de carbono y nutrientes es muy importante pero es reciclado continuamente dentro del ecosistema con muy poca exportación. Representan los sitios de mayor producción de carbonatos (Smith & Kinsey, 1976; Hallock, 1988)., basándose principalmente en la actividad fotosintética de las algas en forma directa o como simbiontes de invertebrados marinos. Teniendo en cuenta que como máximo el 10 % de la productividad primaria corresponde al fitoplancton (Kinsey, 1985; Cowen, 1988) y que las algas bénticas microscópicas en sistemas de gran producción como estuarios, comprenden aproximadamente el 30 % de la productividad total (Cowen, 1983), el resto comprendería a la producción de algas macroscópicas. La casi ausencia de las mismas en el HBS implica un desbalance entre la cantidad de organismos autótrofos y la elevada producción del armazón calcáreo de los estromatoporoideos, por lo que la insuficiente producción primaria podría ser complementada por la asociación simbiótica de cianobacterias y los estromatoporoideos.
Interpretación paleoambiental
El estudio de estas estructuras desde un punto de vista litofacial (Cañas & Keller, 1993; Cañas, 1995; Keller & Bordonaro, 1993) ha permitido determinar algunas diferencias en las características paleoambientales entre los arrecifes y las estructuras mixtas. Aunque ambas corresponden a ambientes someros de alta energía, las primeras se ubicarían en los sectores más internos de la rampa mientras que las segundas podrían situarse en ambientes más protegidos o algo más profundos entre cuerpos de arena. La disposición en sectores más occidentales de las estructuras mixtas (Cerro La Silla, Viejo de San Roque, y Viejo del Fuerte; Fig. 1) podría avalar esta hipótesis considerando una probable línea de costa norte-sur (Keller & Bordonaro, 1993). Lo que se desprende claramente de estos estudios es que en ningún caso estas acumulaciones biohermales corresponden al margen de plataforma.
En este trabajo ha podido reconocerse que los arrecifes de estromatoporoideos presentan características de ambientes muy someros afectados por las olas de buen tiempo. Las perforaciones truncadas por superficies erosivas entre las láminas de los estromatoporoideos (Fig. 10) y sus formas dómicas de gran desarrollo vertical con bordes interdigitados con el sedimento (Fig. 11), sugieren condiciones de estrés ambiental y tasas de sedimentación elevadas, en el que eventos de energía mayores (ej: tormentas) retrabajan el sustrato periódicamente. Los montículos de estromatoporoideos y algas presentes en las estructuras mixtas (Fig. 6) poseen por el contrario estromatoporoideos aislados, dómicos de escaso desarrollo vertical y bordes continuos y estromatoporoideos laminares, estas características podrían indicar también ambientes de energía elevada, pero con una baja tasa de sedimentación en ambientes de mayor estabilidad.
COMPARACIÓN DE LOS HORIZONTES BIOHERMALES
Los estudios sedimentológicos previos en estas estructuras (Cañas & Keller, 1993; Cañas & Carrera, 1993; Keller & Bordonaro, 1993) demuestran que ambos horizontes biohermales se desarrollaron en el inicio de respectivos cortejos transgresivos, en un ambiente somero, de rampa interna a media (Fig. 12); por lo que las características físicas del ambiente, al menos en una escala mayor, son comparables y pueden haber tenido una influencia similar sobre la fauna.

Figura 12. Modelo paleambiental con la distribución de las distintas estructuras arrecifales de la Formación San Juan.
Figura 12. Paleoenvironmental model showing the distribution of the different reef structures in the San Juan Formation.
Las diferencias más marcadas entre ambos horizontes están dadas por el cambio en el grupo constructor que pasa de una asociación constructora de Lithistidas-Calathium y cianobacterias a la de estromatoporoideos. Esta evolución de las comunidades constructoras en arrecifes es una característica común en la historia geológica, al menos a partir del Cámbrico. Para el Ordovícico el cambio más importante es el que se verifica entre los ecosistemas arrecifales dominados por esponjas y algas en el Ordovícico temprano a asociaciones dominadas por briozoos o por estromatoporoideos y corales en el Ordovícico medio y tardío (Webby, 1984). Las estructuras dominadas por Lithistidas, algas y cianobacterias prácticamente desaparecen a finales del Arenigiano con escasas excepciones de pequeños biohermos dominados por esponjas en el Llanvirniano del norte de los Apalaches (Klappa & James, 1980; Webby, 1984). El Arenigiano tardío y Llanvirniano temprano a medio representan un período de reorganización en el que los biohermos son escasos y en los que ningún grupo se impone entre los organismos constructores (Cooper, 1988). A partir del Llanvirniano tardío sólo prevalecen dos grupos claramente diferenciados: briozoos y estromatoporoideos-corales. Para muchos autores estos ciclos normalmente se inician con biohermos fangodominados de algas y cianobacterias ("mud-mounds") seguidos por biohermos de organismos solitarios heterótrofos ("baflestone patch-reefs") y final- mente arrecifes de organismos multiseriados como corales o esponjas ("Framework-dominated reefs"). De esto se desprende que, sorpresivamente durante el Fanerozoico, los episodios dominados por organismos fototróficos formadores de arrecifes propiamente dichos (Cámbrico: archaeocyátidos; Ordovícico-Devónico: estromatoporoideos y tabulados; Mesozoico: escleractínidos) son menores que los dominados por algas, microbios y organismos heterótrofos solitarios (Wood, 1993).
Lithistidas versus estromatoporoideos
Si como se expresó anteriormente, la posición en la rampa carbonática es comparable en ambos horizontes biohermales, los factores bióticos u otras características físicas locales influyeron en la diferenciación faunística de estos biohermos. El estudio de los requerimientos autoecológicos de los grupos constructores pueden indicar las causas que originaron la dominancia de uno u otro grupo.
La primera diferencia importante entre ambos grupos surge a partir de sus estilos de crecimiento. Mientras que las esponjas lithistidas son formas aclonales (solitarias), los estromatoporoideos son organismos clonales (multiseriados o modulares). El término clonal se usa actualmente en reemplazo de colonial siendo un término más generalizado que incluye organismos que poseen un nivel de integración de sus unidades funcionales sin necesidad de que éstas representen un individuo completo, como por ejemplo, varios ósculos con sus respectivos sistemas de canales en una misma esponja (Simpson, 1973; Jackson, 1985; Wood et al., 1992). La adquisición de modularidad en un organismo representa una evolución adaptativa a diferentes condiciones ecológicas. Un organismo clonal es competitivamente superior en la ocupación del sustrato, su forma laminar o incrustante le permite desarrollarse con mayor facilidad en sustratos duros. De la misma forma, estos organismos poseen mejores defensas ante los predadores o ante eventos catastróficos de alta energía. Se regeneran con mayor facilidad ante una destrucción parcial, alcazan un tamaño muy importante, poseen una indeterminada dirección de crecimiento y gran longevidad (de 100 a 1000 años, Wood et al., 1992). Además, los organismos clonales presentan las características propicias para su asociación con fotosimbiontes (Cowen, 1983, 1988; Talent, 1988; Jackson & McKinney, 1991). No obstante, se ven limitados en ambientes donde la tasa de sedimentación supera la velocidad de crecimiento que normalmente es menor a la de los organismos solitarios. De esta manera se ven favorecidos también por períodos con interrupciones en la sedimentación. Tanto una tasa de sedimentación como las interrupciones de la misma tienen influencia importante en la forma que desarrolle el estromatoporoideo, así las formas dómicas a globulares contrarrestan las tasas elevadas (Swan & Kershaw, 1994). Según Wood (1990) estas innovaciones evolutivas fueron las que permitieron a los estromatoporoideos conquistar los ambientes someros de elevada energía, siendo los constructores de arrecifes más exitosos en gran parte del Paleozoico y del Mesozoico. Para esta autora, los estromatoporoideos fueron desplazados recién a fines del Mesozoico por los corales escleractínidos que poseen una mayor velocidad de crecimiento merced a una eficaz relación fotosimbiótica con un alga dinoflagelada (Zooxanthellae). Los estudios recientes con esponjas clonales de esqueleto macizo calcáreo, como las esclerospongeas entre otras, demuestran que gran parte de estos organismos poseen una alimentación a partir de bacterias fotosimbióticas (Vacelet & Donadey, 1978; Wilkinson, 1978) es decir que la sola filtración de partículas orgánicas no es eficiente para mantener a toda la estructura calcárea de estos organismos y requieren, como los actuales corales escleractínidos, de una asimilación fototrófica extra. La extrapolación de esta característica a los estromatoporoideos del Paleozoico y Mesozoico no es todavía un hecho demostrado. Sin embargo, la incorporación de los mismos a las esponjas calcáreas, el reconocimiento de simbiontes cianobacterianos específicos en las distintas clases de esponjas, inclusive en especies de distantes áreas geográficas y el hecho de que estos simbiontes no se encuentran en las aguas donde habitan estas esponjas, ha inducido a muchos autores a pensar que la simbiosis bacteriana ya se producía por lo menos desde el Cámbrico (Wilkinson, 1984; Wilkinson et al., 1984; Brunton & Dixon, 1994), (Tabla 1). No obstante, datos preliminares con isotopos de carbono realizados con estromatoporoideos silúrico-devónicos no muestran signos de fraccionamiento a partir de algas simbióticas (en Wood, 1993). Sin embargo, algunos autores como Cowen (1988), remarcan las dificultades que presentan estos análisis debido a problemas diagenéticos del material esqueletal o a fluctuaciones en la temperatura o productividad del océano original.
Tabla 1. Categorías tróficas para los principales grupos constructores de estructuras arrecifales
Table 1. Trophic categories for main groups of reef-builders.

Los organismos solitarios son considerados como una etapa primitiva o nula de integración, se relacionaron normalmente con sustratos blandos y ambientes tranquilos. Algunos autores como Fagerstrom (1987), Narbonne & Dixon (1984), Rigby & Ausich (1981), entre otros, sugirieron que las esponjas lithistidas se ven favorecidas en los primeros estadios de la formación de los biohermos en ambientes con sustrato blando, aguas calmas, con deficiencia de luz y baja turbidez. Recientemente, otros estudios en esponjas modernas han evaluado las características alimenticias, de crecimiento, competitividad por el espacio, y distribución en ambientes arrecifales tropicales a subtropicales, indicando que una característica importante en las esponjas lithistidas es que normalmente se desarrollan en ambientes con un cierto contenido de nutrientes que inducen el desarrollo del fitoplancton y de la presencia de materia orgánica en general. Estos nutrientes provienen normalmente de las áreas continentales cercanas o son removidos y elevados desde los fondos oceánicos a partir del movimiento de corrientes marinas ("upwelling"). Estas esponjas basan su nutrición exclusivamente en la filtración y asimilación de partículas orgánicas incluyendo una pequeña parte del fitoplancton, células y bacterias en suspención que normalmente se encuentran en la fracción menor a 1 micrón (Reiswig, 1975; Wilkinson et al., 1984). Mientras que los corales, crinoideos, y braquiópodos consumen normalmente Zoo y fitoplancton y por lo tanto no compiten con las esponjas.
Recientemente, Hallock & Schlager (1986), Hallock (1988) y Wood (1993) relacionaron estas características diferenciales entre la nutrición de los organismos solitarios (esponjas lithistidas) y los organismos clonales como los estromatoporoideos o corales, señalando que los complejos arrecifales con la participación de escleractínidos no se desarrollan en aguas cargadas de nutrientes o en aquellas sujetas a pulsos que cíclicamente introduzcan nutrientes, incluso en áreas donde la temperatura es óptima para estos organismos constructores. Wilkinson (1983, 1987) ha demostrado que en áreas donde predominan condiciones oligotróficas es decir escasez de nutrientes y por ende de fitoplancton, la mayoría de las esponjas se caracterizan por poseer fotosimbiontes, mientras que en áreas con exceso de nutrientes no presentan esta característica basando su nutrición exclusivamente a partir de la filtración. Teniendo en cuenta estas características Hallock & Schlager (1986), Hallock (1988) y Wood (1993), proponen un modelo de ecosistemas arrecifales y sus litofacies asociadas a partir de la proporción de nutrientes y todas las consecuencias y cambios en la comunidad arrecifal que esto desencadena. En el mismo se presentan las diferentes características de los ecosistemas arrecifales según las diferentes proporciones de nutrientes. Se sintetizarán aquí las condiciones extremas reconociendo que existen posibles subdivisiones o variaciones intermedias, como los autores mencionados han planteado.
Condiciones oligotróficas. En aguas con escasez de nutrientes (N, P, Fe) la producción de materia orgánica es mínima al igual que la productividad primaria a partir de la fotosíntesis. La transparencia del agua es máxima y la zona fótica se amplia a mayores profundidades. En estas condiciones los organismos clonales que poseen fotosimbiontes se ven favorecidos, ya que poseen una alimentación alternativa que reemplaza la asimilación a partir de la filtración. Entre las litologías abundan los "framestones" (terminología de Embry & Klovan, 1971) en la facies arrecifal y en general los "grainstones", "rudstones" y "packstones" en la interarrecifal y en los flancos. Este predominio de las litologías gruesas se debe a la reducida bioerosión que se produce en ambientes con estas características. Los principales organismos destructores (esponjas perforantes, bivalvos, celenterados, microorganismos y la fauna críptica en general) se ven favorecidos por el aumento de nutrientes, la supervivencia de las larvas de estos organismos es mayor al aumentar la concentración del plancton y es muy baja a casi nula en ambientes con condiciones oligotróficas (Hallock, 1988). De la misma forma, las larvas de los organismos predadores y competidores de los corales disminuyen sensiblemente en aguas con escasez de nutrientes y baja productividad (Birkeland, 1977).
Condiciones mesotróficas.
Con el aumento de nutrientes y correlativamente del plancton la claridad del agua disminuye, las algas macroscópicas comienzan a crecer por encima de los organismos clonales y conforman la base de la cadena trófica con un incremento mayor de los nutrientes; el fitoplancton aumenta y capta la mayor cantidad de la energía solar, las algas bénticas se retraen y el fitoplancton ocupa la base de la cadena trófica. La mayor cantidad de partículas orgánicas en suspensión favorece a los organismos suspensívoros-heterótrofos que tienden a dominar el benthos. La bioerosión se incrementa al igual que los organismos predadores, la tasa de bioerosión tiende a equiparse a la de producción y aparecen litologías más finas, dominan los "bafflestones" y "boundstones" entre las litofacies arrecifales. Los depósitos de flancos e interarrecifales tienden a aumentar ya que existe un mayor aporte de material desde el núcleo del biohermo. Las estructuras biohermales son en general del tipo "reef-mounds" (James, 1984).
Condiciones eutróficas.
Podrían subdividirse en subeutróficas y eutróficas, por ejemplo, según Hallock (1988), cuando el 1% de la luz solar penetra hasta los 30 metros muy poco del nucleo biohermal "framework" queda preservado; la mayoría se pierde por la erosión mecánica y química. La micritización es intensa y el fango calcáreo supera a las otras litologías. Sin embargo, parte del mismo se preserva con el estilo de montículos de fango ("mud-mounds") en los que algas, microbios y escasos metazoos predominan.
Las condiciones eutróficas donde el 1% de la luz solar llega hasta los 10 metros, impide la formación de cualquier tipo de estructura biohermal o si la hubo su preservación es nula ya que las tasas de bioerosión exceden el metro cada 1000 años. Además, bajo estas circunstancias el oxígeno disuelto tiende a disminuir por la alta productividad en las aguas superficiales lo que lleva al agotamiento del mismo en las aguas profundas (Margalef, 1977). Si estas condiciones se llevan a un máximo favorecidas por la anoxia generalizada del medio, no sólo desaparece la formación de estructuras biohermales sino la producción misma de carbonatos (Vogt, 1989).
DISCUSIÓN Y CONCLUSIONES
Las condiciones fisicas en ambos horizontes biohermales son comparables y características de la posición que ocupan en la rampa (Fig. 12). Tanto el HBI como los arrecifes de estromatoporoideos del HBS se desarrollaron en los sectores internos de la misma próximos al nivel de base de olas normales. Los montículos de estromatoporoideos y comunidades microbianas de las estructuras mixtas en el HBS pueden corresponder a sectores algo más profundos o protegidos. Las cmndiciones hidrodinámicas son similares a grandes rasgos, sin embargo, se ha observado una mayor fluctuación de las condiciones de sedimentación en los arrecifes de estromatoporoideos como interrupciones, erosión y sepultamiento entre las distintas láminas de crecimiento de los mismos y bordes discontinuos (Fig. 6 y 10). Estas características podrían indicar que estas estructuras se desarrollaron en ambientes con una mayor influencia de tormentas o de mareas como lo sugieren Keller et al. (1993) analizando las características sedimentológicas que presenta el HBS. No obstante, se han reconocido arrecifes de organismos solitarios (Demospongeas) en este tipo de ambientes (Palmer & Fürsich, 1981) por lo que estas variaciones hidrodinámicas periódicas no influirían, al menos en gran medida, en el desarrollo de estos grupos.
El tipo de sustrato que podría favorecer a uno u otro grupo es también comparable: el sustrato duro o de partículas que beneficia a los estromatoporoideos en el HBS, es también duro o rígido en el HBI. Las primeras esponjas lithistidas en este último horizonte se asientan sobre la caliza fenestral con características de exposición subaérea (ver facies de fundación).
Otras características físicas como la temperatura o salinidad son similares en ambos horizontes por lo que pueden excluirse como una de las causas que determinaron el cambio del grupo constructor.
El cambio del grupo constructor no sólo implica que la producción de carbonato, para producir una estructura rígida de metazoos debe ser mayor, sino que representa un cambio en el ecosistema arrecifal. La base de la estructura trófica (fotosintetizadores) es dominada por algas filamentosas, macroalgas y fitoplancton en los biohermos inferiores, mientras que en los arrecifes de estromatoporoideos, este rol estaría ocupado principalmente por organismos con características mixtas ("mixotrophs"): fotosimbióticos-suspensívoros. La estructura clonal de los estromatoporoideos sumada a la escasez de algas bénticas y de estructuras microbianas macroscópicas y el desbalance de la cadena trófica como se expresó en el estudio paleoecológico del HBS, son hechos significativos y avalarían la condición fotosimbiótica de los estromatoporoideos. Si bien es difícil evaluar el grado de bioerosión en ambos biohermos, la mayor abundancia de fango y la presencia de esponjas endolíticas en el biohermo inferior podrían indicar una mayor degradación de la estructura acorde con la condición heterotrófica del sistema. Aunque, como lo plantea Cañas (1995), la formación de este fango micrítico en el núcleo de la estructura biohermal no es muy clara y puede también obedecer a otras causas, la mayoría están relacionadas con procesos biológicos. Otro dato a tener en cuenta son las diferencias en las poblaciones de gastrópodos entre ambos horizontes, que como se manifestara anteriormente, muestran cambios composicionales de acuerdo al tipo de productor primario de cada cadena trófica.
La estructura trófica con la presencia dominante de suspensívoros en el HBI, indica la abundancia de partículas orgánicas en suspensión que permite la subsistencia de organismos heterótrofos. La forma de explicar este volumen importante de materia orgánica es a partir del aumento de la producción primaria por un incremento en los valores de los nutrientes. Analizar las causas de este aumento es una tarea más complicada, pero en forma preliminar se pueden exponer algunas de las más probables. El desarrollo del HBI sigue al evento transgresivo que se desarrolla en la base de la Formación San Juan (Cañas, 1995), donde por encima de calizas fenestrales depositadas en ambientes supratidales aparecen los biohermos en sectores subtidales. Si bien, no se desarrolla en este intervalo un hiato estratigráfico importante ya que este límite queda incluído en la Biozona de P. deltifer (Lehnert, 1994), este evento transgresivo representa la primera aparición de fauna marina abierta; pasando de ambientes de plataforma restringida que funcionaban como tales desde el Cámbrico, a los de rampa abierta (Cañas & Carrera, 1993; Cañas, 1995). Este cambio en las condiciones sedimentarias de la cuenca produjo una variación importante en la circulación marina principalmente al producirse el ascenso del nivel del mar que aproxima corrientes cargadas de nutrientes desde estratos de agua inferiores (Parrish, 1982, Vogt, 1989) y por otra parte, al finalizar la restricción en la plataforma, aguas cargadas con nutrientes pudieron provenir desde estos sectores más internos o de áreas emergidas cercanas.
El HBS también aparece relacionado a un ascenso del nivel del mar, sin embargo, como lo sugiere Cañas (1995), éste no parece ser tan marcado ya que el límite de secuencia no es tan evidente y los biohermos podrían situarse también en el tope de la secuencia regresiva. Los arrecifes de estromatoporoideos se establecen en un ambiente de rampa proximal, mientras que las litologías subyacentes corresponden a ambientes de rampa media dominada por tormentas. Este ascenso relativo de menor escala impediría una posible mezcla con aguas más profundas o al menos ésta sería de menor magnitud. Por otra parte el HBS se instala en un ambiente sedimentario más estable por lo que no puede suponerse un aporte de nutrientes desde áreas más proximales. Además, este sector de la rampa ya funcionaba como productor y exportador de material más que como receptor, antes del establecimiento del HBS. El ambiente de rampa, sin la presencia de sectores restringidos en la parte interna, no permite la acumulación de nutrientes o sedimentos finos que normalmente son esparcidos luego hacia zonas más externas por medio de tormentas.
Las estructuras mixtas con la participación de estromatoporoideos, cianobacterias Calathium y lithistidas presentes en el HBS son interpretadas por Cañas (1995) y Cañas & Keller (1993) como parches o cabezas arrecifales ("patch-reefs") en ambientes protegidos o más profundos, entre cuerpos de arena. De la misma forma que los arrecifes son dominadas por estromatoporoideos pero en este caso las estructuras microbianas comparten el rol de constructores de los montículos, mientras que Calathium y en menor medidalas esponjas lithistidas son constructores accesorios. Esta diferencia de las comunidades puede también ser el producto de la diferencia de nutrientes por desarollarse en estos sectores más estables o más próximos a sectores más profundos de la cuenca. En un complejo arrecifal existen sectores diferenciales donde normalmente la proporción de nutrientes es mayor (Hallock, 1988) como por ejemplo en el "lagoon" ("backreef"), en zonas protegidas o más profundas del talud arrecifal ("forereef") o incluso en bahías. James y Bourque (1992) sintetizan esta distribución de los distintos tipos de estructuras arrecifales, incluso dentro del mismo complejo arrecifal, en función de distintos factores. La disposición y proximidad a las corrientes cargadas con nutrientes se mencionan entre los más importantes (Fig. 13). Podría pensarse que el gradiente de las facies en sistemas arrecifales sería en realidad desde los de alta a baja energía o como lo sugiere Hallock (1988) entre los de baja proporción de nutrientes y los de alta, que serían inversos a los anteriores. De la misma forma, Wilkinson (1987) ha descripto diferencias importantes en las proporciones de nutrientes y sus correspondientes ecosistemas en arrecifes modernos, que presentan la misma posición en la plataforma y una energía del medio comparable.

Figura 13. Esquema mostrando la zonación y distribución de arrecifes y montículos arrecifales ante las distintas variables ambientales (modificado de James y Bourque, 1992).
Figura 13. A sketch showing zonation and distribution of reef and reef-mounds according to different environmental variables. (modified from James & Bourque, 1992).
Las diferencias de la sedimentación en ambos horizontes biohermales (dominancia de las tormentas o diferencias batimétricas menores) parecen de menor envergadura ante el importante cambio que se produce en las comunidades de ambos horizontes y que sería acorde con el hecho de considerar a los estromatoporoideos como organismos con características fototróficas, siendo la disminución de los nutrientes el factor desencadenante de este cambio.
El registro de los biohermos dominados por esponjas lithistidas y comunidades microbianas durante el Fanerozoico aparece relacionado, según Brunton & Dixon (1994), con episodios de aperturas y colisiones continentales donde las masas continentales son abundantes y las plataformas carbonáticas alcanzan grandes dimensiones. Estos cortos intervalos corresponden también a incrementos de nutrientes que promueven el establecimiento de comunidades heterotróficas. El desarrollo inicial de estructuras dominadas por estromatoporoideos primitivos en la Precordillera debe haber representado un primer intento evolutivo de estos organismos en la conquista de ecosistemas arrecifales, ya que el predominio de estas formas se registra con bastante posterioridad. Estos complejos arrecifales del Ordovícico temprano de la Precordillera son una excepción en la etapa de biohermos dominados por lithistidas y comunidades calci-microbianas en la historia cíclica de los ecosistemas arrecifales propuesta por Wood (1993) y Brunton & Dixon (1994) para el Fanerozoico.
Agradecimientos
Al Conicet, Conicor, y Secretaría de Ciencia y Técnica de la Universidad Nacional de Córdoba por su apoyo económico. A los Dres. Teresa M. Sánchez y Ricardo Astini por sus sugerencias y consejos brindados durante la lectura crítica del manuscrito. A los Dres. Ricardo Palma y Sergio Matheos por sus constructivas sugerencias en la revisión del manuscrito, que enriquecieron el presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. ASTINI, R. A., 1994. Sucesiones calcáreo-silicoclásticas coetáneas del Ordovícico Inferior de la Precordillera y su significado en la evolución de la cuenca. V Reunión Argentina de Sedimentología: 113-118. Tucumán [ Links ]
2. ARMELLA, C. 1994. Thrombolitic-stromatolitic cycles of the Cambro-Ordovician boundary sequence, Precordillera oriental basin, western Argentina. En: Bertrand-Sarfati J. & C. Monty (eds.), Phanerozoic Stromatolites II: 421-441. Kluwer Academic publishers, Netherlands. [ Links ]
3. BIRKELAND, C., 1977. The importance of rate of biomass accumulation in early succecional stages of benthic communities to the survival of coral recruits. Proceedings of the Third International Coral Reef Symposium I: 16-21. Miami. [ Links ]
4. BRUNTON, F & O. DIXON, 1994. Siliceous sponge-microbe biotic associations and their recurrence through the Phanerozoic as reef mound constructors. Palaios 9: 370-387. [ Links ]
5. BURNE, R. & L. MOORE, 1987. Microbialites: organosedimentary deposits of benthic microbial communities. Palaios 2: 241-254. [ Links ]
6. CAÑAS, F. L.,1990. Biolititos microbianos (microbialitos) del Cámbrico tardío, Formación Los Sapitos, Precordillera de la Rioja. III Reunión Argentina de Sedimentología, Actas: 81-86. San Juan. [ Links ]
7. CAÑAS, F. L., 1995a. Estratigrafía y evolución paleoambiental de las suceciones carbonáticas del Cámbrico tardío y Ordovícico temprano de la Precordillera Septentrional, República Argentina. Tesis Doctoral Facultad de Ciencias Exactas Físicas y Naturales Universidad Nacional de Córdoba, 177 pp. (Inédito) [ Links ]
8. CAÑAS, F. L., 1995b. Early Ordovician carbonate platform facies of the Argentine Precordillera: restricted shelf to open platform evolution. En: Cooper, J.,Drosser M.L. & S. Finney (Eds.) Seven International Symposium on the Ordovician System: 221-224. Las Vegas. [ Links ]
9. CAÑAS, F. & M. KELLER, 1993. Arrecifes y montículos arrecifales en la Formación San Juan (Precordillera Sanjuanina Argentina): Los arrecifes más antiguos de Sudamérica. Boletín de la Real Sociedad Española de Historia Natural (Geol.) 88(1-4): 127-136. [ Links ]
10. CAÑAS, F. & M. CARRERA, 1993. Early Ordovician microbial-sponge-receptaculitid bioherms of the Precordillera basin, Western Argentina. Facies, 29: 169-178. Erlangen. [ Links ]
11. CARRERA, M. G., 1991. Los géneros Selenoides Owen y Calathium Billings (Receptaculitaceae) en el Ordovícico de la Precordillera de San Juan, Argentina. Ameghiniana 28(3-4): 375-380. [ Links ]
12. CARRERA, M. G., 1994. Fiscella, un nuevo género de afinidades inciertas del Ordovícico de la Precordillera Argentina. Ameghiniana 31(2): 195-200. [ Links ]
13. CARRERA, M. G., en prensa. Significado paleoambiental de los poríferos y briozoos de la Formación San Juan (Ordovícico), Precordillera Argentina. Ameghiniana. [ Links ]
14. COOPER, P., 1988. Ecological succession in Phanerozoic reef ecosistems: Is it real? Palaios 3: 136-151. [ Links ]
15. COWEN, R., 1983. Algal simbiosis and its recognition in the fossil record. En M.J. Tevesz & P. McCall (Eds.), Biotic interactions in recent and fossil benthic communities: 432-478. New York. [ Links ]
16. COWEN, R., 1988. The role of algal simbiosis in reefs through time. Palaios 3: 221-227. [ Links ]
17. EMBRY, A. & J. KOBLAN, 1971. A Late Devonian reef tract on the northeastern banks island, N.W.T. Bulletin of the Canadian Petroleum Geology 19: 730-781. [ Links ]
18. FAGERSTROM, J. A., 1987. The Evolution of reef Communities. Wiley & Sons, New York. 600 pp. [ Links ]
19. HALLOCK, P., 1988. The role of nutrient availability in bioerosion: Consequences to carbonate buidups. Palaeogeography, Palaeoclimatology, Palaeoecology 63: 275-291. [ Links ]
20. HALLOCK, P. & W. SCHLAGER, 1986. Nutrient excess and the demise of reefs and carbonate platforms. Palaios 1: 389-398. [ Links ]
21. HARTMAN, W. D. & T. F. GOREAU, 1970. Jamaican coralline sponges: Their morphology, ecology and fossil relatives. Symposium Zoological Society of London 25: 205-243. [ Links ]
22. HERRERA, Z. & J. L. BENEDETTO, 1991. Early Ordovician brachiopods fauna of the Precordillera basin, western Argentina: biostratigraphy and paleobiogeographical affinities. En D. Mackinnon, D. Lee & J. Campbell (Eds.), Proceedins of the 2nd International Brachiopod Congress 1: 283-301.Dunedin, New Zealand. Brachiopods through time, Balkema, Rotterdam. [ Links ]
23. JAMES, N. P., 1983. Reef Environment, En P. Scholle, D. Bebout & C. Moore (Eds.), Carbonate depositional environments. American Associations of Petroleum Geologists Memoir 33: 345-462. [ Links ]
24. JAMES, N. P., 1984. Reefs. En R.G. Walker (Ed.), Facies models. Geociences, Canada, 2nd : 299-244. Toronto. [ Links ]
25. JAMES, N. P. & P. A. BOURQUE, 1992. Reefs and Mounds. En R.G. Walker & N.P. James (Eds.), Facies Models. Geological Association of Canada: 323-347. [ Links ]
26. JACKSON, J. B., 1985. Distribution and ecology of clonal and aclonal benthic invertebrates. En J.B. Jackson, L.W. Buss & R. Cook (Eds.), Population Biology and Evolution of Clonal Organisms. Yale University Press, New Haven: 297-355. [ Links ]
27. JACKSON, J. B. & F. MCKINNEY, 1991. Ecological processes and progressive macroevolution of marine clonal benthos. En R.M. Ross & W.D. Allon (Eds.), Causes of Evolution. University of Chicago press: 173-209. [ Links ]
28. KELLER, M., W. BUGGISH & F. BERCOWSKI, 1989. Facies and sedimentoogy of upper Cambrian Shallowing-Upward Cycles in the La Flecha Formation (Argentine Precordillera). Zblt. Geologie Paläontologie, Teil I: 999-1011.Stuttgart. [ Links ]
29. KELLER, M. & O. BORDONARO, 1993. Arrecifes de estromatoporoideos en el Ordovícico inferior del Oeste Argentino y sus implicancias paleogeográficas. Revista Española de Paleontología 8(2):165-169. [ Links ]
30. KELLER, M., O. BORDONARO & F. CAÑAS, 1993. Some plate tectonic aspects of Early Ordovician reefs, Western Argentine Precordillera. XII Congreso Geológico Argentino y II Congreso de Exploración de Hidrocarburos, Actas I: 235-240. Mendoza. [ Links ]
31. KELLER, M., F. CAÑAS, O. LEHNERT & N. VACCARI, 1994. The Upper Cambrian and Lower Ordovician of the Precordillera (Western Argentina): Some stratigraphic reconsiderations. Newsletters on Stratigraphy 31(2): 115-132. Stuttgart. [ Links ]
32. KELLER, M. & E. FLUGEL, 1996. Early Ordovician reefs from Argentina: Stromatopotroid vs. Stromatolite origin. Facies 34: 177-192. [ Links ]
33. KINSEY, D. W. 1985. Metabolism, calcification and carbon production I. System level studies. Proccedings Fifth International Coral Reef Congress 4: 505-526. Tahiti. [ Links ]
34. ENNARD J. & N. P. JAMES, 1986. Thrombolites and stromatolites: Two distinct types of microbial structures. Palaios 1: 492-503. [ Links ]
35. KLAPPA, F. & N. P. JAMES, 1980. Small lithistid sponge bioherms, early Middle Ordovician Table head Group, Western Newfounland. Bulletin Canadian Petroleoum Geologists 28: 425-451. Calgary. [ Links ]
36. KLEMENT, K. & D. F. TOOMEY, 1967. Role of the blue-green alga Girvanella in skeletal grain destruction and lime-mud formation in the Lower Ordovician of West Texas. Journal of Sedimentary Petrology 37(4): 1045-1051. [ Links ]
37. KOBLUK, D. R., 1981. Lower Cambrian cavity-dwelling endolithic (boring) sponges. Canadian Journal of Earth Sciences 18: 972-980. [ Links ]
38. LEHNERT, O., 1994. Ordovizische Conodonten aus der Präkordillere Westargentiniens: Ihre Bedeutung für Stratigraphie und Palaogeographie. Erlanger Geologische Abhandlungen 125: 1-93. Erlangen. [ Links ]
39. LEHNERT, O. & M. KELLER, 1993. Posición estratigráfica de los arrecifes arenigianos en la Precordillera Argentina. Documents Laboratoires Géologie, Lyon 125: 263-275. [ Links ]
40. MAMET, B. & A. ROUX, 1982. Sur le mode de croissance de Nuia Algae incertae sedis. Geobios 15(6): 959-965. [ Links ]
41. MARGALEF, R., 1977. Ecología. Ed.Omega. Barcelona, 951 pp. [ Links ]
42. NARBONNE, G. M. & O. DIXON, 1984. Upper Silurian Lithistid sponge reefs on Somerset Island, Arctic Canada. Sedimentology 31: 25-50. [ Links ]
43. NITECKI, M. & D. F. TOOMEY, 1979. Nature and classification of receptaculitids. En H. Oertli (Ed.), Deuxieme Symp. Intern. sur les algues fossiles. Bulletin des centres de recherches explor-prod., Elf-Aquitaine, 3(2): 725-732. [ Links ]
44. PALMER, T. J. & F.T. FURSICH, 1981. Ecology of sponge reefs from the Upper Bathonian of Normandy. Palaeontology 24: 1-23. [ Links ]
45. PARRISH, J. T., 1982. Upwelling and petroleum source beds, with reference to paleozoic. American Association of Petroleum Geologists Bulletin 66: 750-774. [ Links ]
46. READ, J. F. & G. A. GROEVER, 1977. Scalloped and planar erosion surfaces, middle Ordovician limestons, Virginia; analogues of Holocene exposed karst or tidal rock platforms. Journal of Sedimentary Petrology 47: 956-972. [ Links ]
47. REISWIG, H. M., 1975. Bacteria as food for temperate-water marine sponges. Canadian Journal of Zoology. 53: 582-589. [ Links ]
48. RIGBY, J. K & W. I. AUSICH, 1981. Lower Mississipian sponges from the Edwardsville Formation, Southern Indiana. Journal of Paleontology 55 (2): 370-382. [ Links ]
49. SÁNCHEZ, T., B. WAISFELD, M. CARRERA & S. TOFFOLO, 1993. Comunidades bentónicas en facies carbonáticas del Ordovícico temprano de la Precordillera Argentina. Conferencia internacional Paleozoico inferior de Ibero-América. Mérida, España. Coloquios de Palentología 45: 139-161. Universidad Complutense de Madrid. [ Links ]
50. SÁNCHEZ, T., M. CARRERA & J.L. BENEDETTO, en prensa. Variaciones faunísticas en el Techo de la Formación San Juan (Ordovícico temprano, Precordillera Argentina): Significado paleoambiental. Ameghiniana. [ Links ]
51. SIMPSON, T. L., 1973. Coloniality among the porifera. En Boardman,R.S., Cheetham, A. y Oliver, W. Jr. (Eds.), Animal colonies, Developments and Function through time. Dowden, Hutchison and Ross: 549-565. Stroudsburg, Pennsylvania. [ Links ]
52. SMITH, S. V. & D. W. KINSEY, 1976. Calcium carbonate production, coral reef growth, and sea level change. Science 194: 937-939. [ Links ]
53. STEARN, C. W., 1993. Revision of the Order Stromatoporida. Paleontology 36: 201-229. [ Links ]
54. SWAN, A. R. & S. KERSHAW, 1994. A computer model for skeletal growth of stromatoporoids. Paleontology 37: 409-423. [ Links ]
55. TALENT, J. A., 1988. Organic reef-building: episodes of extinction and symbiosis?. Senckenbergiana lethaea 69 (3/4): 315-368. [ Links ]
56. TOOMEY, D. F. & W. E. HAM, 1967. Pulchrilamina, a new mound-building organism from the Lower Ordovician rocks of West Texas and Southern Oklahoma. Journal of Paleontology 41(4): 981-987. [ Links ]
57. VACCARI, N. E., 1994. Trilobitofaunas Cambro-Ordovícicas de las facies calcáreas del norte de La Precordillera (Provincias de San Juan y La Rioja). Tesis Doctoral, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba, 271 pp. (Inédito). [ Links ]
58. VACELET, J., 1970. Les sponges Pharétronides actuelles. Zoological Society of London Symp. 25: 189-204. [ Links ]
59. VACELET, J. & C. DONADEY, 1978. Electron microscope study of the association between some sponges and bacteria. Journal of Experimental marine biology and Ecology 30: 301-314. [ Links ]
60. VOGT, P. R., 1989. Volcanogenic upwelling of anoxic, nutrient-rich water: A possible factor in carbonate bank/reef demise and benthic faunal extinctions? Geological Society of America Bulletin 101 (10): 1225-1245. [ Links ]
61. WEBBY, B. D., 1984. Ordovician reefs and climate: a review. En D.L. Bruton (Ed.), Aspects of the Ordovician System: 89-100. Oslo. [ Links ]
62. WILKINSON, C. R., 1978. Microbial associations in sponges: Ecology, physiology and microbial populations of coral reef sponges: Marine biology 49: 161-167. [ Links ]
63. WILKINSON, C. R., 1983. Net primary productivity in coral reef sponges. Science 219: 410-412. [ Links ]
64. WILKINSON, C. R., 1984. Immunological evidence for the Precambrian origin of bacterial symbiosis in marine sponges. Proceedings Royal Society of London B220: 509-517. [ Links ]
65. WILKINSON, C. R., 1987. Interocean differences in size and nutrition of coral reef sponge populations. Science 236: 1654-1657. [ Links ]
66. WILKINSON, C. R., R. GARRONE & J. VACELET, 1984. Marine sponges discriminate between food bacteria and bacterial symbionts: Electron microscope radioautography and in situ evidence. Proceedings Royal Society of London B 220: 519-528. [ Links ]
67. WOOD, R., 1990. Reef building sponges. American Scientist 78: 224-235. [ Links ]
68. WOOD, R., 1993. Nutrients, Predation and the History of reef-building. Palaios 8(6): 526-543. [ Links ]
69. WOOD, R., A. ZHURAVLEV & F. DEBRENNE, 1992. Functional biology and Ecology of Archaeocyatha. Palaios 7 (2): 131-156. [ Links ]
Recibido: 12 de agosto de 1996.
Aceptado: 19 de mayo de 1997.














