Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Argentina de Salud Pública
Print version ISSN 1852-7513On-line version ISSN 1853-810X
Rev. argent. salud pública vol.8 no.31 Buenos Aires June 2017
ARTÍCULOS ORIGINALES
Costo-efectividad del rastreo de cáncer colorrectal en provincias argentinas seleccionadas
Cost-Effectiveness of Colorectal Cancer Screening in Selected Argentine Provinces
Santiago Hasdeu1, Laura Lamfre2, Juan Altuna3, Santiago Torales4, Joaquín Caporale5, Julián Sánchez Viamonte6, Florencia Hutter6, Mercedes MacMullen7
1. Ministerio de Salud de Neuquén.
2. Facultad de Economía de la Universidad Nacional del Comahue.
3. Dirección de Economía de la Salud, Ministerio de Salud de la Nación.
4. Ministerio de Salud de la Provincia de Santa Fe.
5. Instituto de Efectividad Clínica y Sanitaria, Ciudad de Buenos Aires.
6. Ministerio de Salud de la Provincia de Buenos Aires.
7. Instituto de Farmacología de la Facultad de Medicina de la Universidad de Buenos Aires
FUENTE DE FINANCIAMIENTO: Beca "Carrillo-Oñativia", categoría Perfeccionamiento en Salud Pública, otorgada por la Comisión Nacional Salud Investiga, Ministerio de Salud de la Nación, Argentina.
FECHA DE RECEPCIÓN: 4 de enero de 2017
FECHA DE ACEPTACIÓN: 18 de abril de 2017
Correspondencia a: Santiago Hasdeu
Correo electrónico: hasdeusanti@gmail.com
Registro ReNIS N°: 001103
RESUMEN. INTRODUCCIÓN: El cáncer colorrectal (CCR) es una de las principales causas de mortalidad en adultos. En Argentina es la segunda entre las neoplasias, y se observan diferencias en la mortalidad entre las distintas provincias. El rastreo de CCR es subutilizado en Argentina, donde el sistema de salud se encuentra fragmentado. OBJETIVOS: Analizar la costo-efectividad (CE) de diversas estrategias de rastreo basadas en el test de sangre oculta en materia fecal inmunohistoquímico (SOMFihq) anual desde distintos subsectores provinciales. MÉTODOS: Se construyó un modelo de Markov, que permitió comparar tres estrategias: rastreo en población de 50 a 74 años, rastreo en población de 50 a 64 años y no rastreo. RESULTADOS: Se encontraron diferencias de costos y variabilidad clínica. El rastreo a población de 50-74 años presentó una razón de CE incremental levemente mayor que el rastreo en población de 50-64 años, con valores inferiores al producto bruto geográfico per cápita. Este resultado se mostró robusto en el análisis de sensibilidad. CONCLUSIONES: Los resultados comparados en siete subsectores de salud regionales de Argentina -con diferencias epidemiológicas, organizacionales, de capacidad instalada y de recursos, con su variabilidad de práctica clínica y sus diferentes costos- indican de manera robusta que el rastreo de CCR se mantiene costo-efectivo en diversos escenarios. Analizar la CE de intervenciones sanitarias en Argentina requiere tener en cuenta el contexto local de los diferentes subsectores de salud.
PALABRAS CLAVE: Neoplasias Colorrectales; Tamzaje Masivo; Análisis Costo-Beneficio; Economía de la Salud; Sangre Oculta.
ABSTRACT. INTRODUCTION: Colorectal cancer (CRC) is one of the main causes of mortality in adults. In Argentina it is the second among tumors, and there are differences between province mortality rates. CRC screening is underutilized in Argentina, where there is an important fragmentation of the health care system. OBJECTIVES: To assess the cost-effectiveness (CE) of different screening strategies based on annual immunochemical fecal occult blood test (IFOBT) for different health subsectors in the country. METHODS: A Markov model was developed, which allowed to compare three different strategies: screening population aged 50 to 74 years, screening population aged 50 to 64 years, and no screening. RESULTS: Differences in costs and clinical variability were found. Screening the population aged 50 to 74 years showed a slightly higher incremental CE ratio than screening the population aged 50 to 64, with values lower than per capita gross regional product. This result was robust in the sensitivity analysis. CONCLUSIONS: The compared results from seven regional health subsectors in Argentina, with their differences in epidemiology, organization, installed capacity and resources, as well as clinical variability and differences in costs, are robust in showing that CRC screening remains cost-effective under different scenarios. In order to analyze the CE in Argentina, it is necessary to take into account the local context of different health subsectors.
KEY WORDS: Colorectal Neoplasms; Mass Screening; Cost-Benefit Analysis; Health Economics; Occult Blood.
INTRODUCCIÓN
El cáncer colorrectal (CCR) es una de las principales causas de mortalidad en adultos1. En Argentina es la segunda entre las neoplasias, con una incidencia anual de 50 casos/100 000 habitantes, que provocan unas 20 muertes/100 000 habi-tantes/año2, 32 451 años de vida ajustados por discapacidad (AVAD) perdidos por año en hombres y 28 151 en mujeres3. La tasa de mortalidad masculina mantiene una tendencia ascendente, a diferencia de otros países donde ha comenzado a declinar. Entre las provincias de Argentina se observan diferencias en la tasa de mortalidad ajustada por sexo: es más alta en la región sur del país, en la Ciudad Autónoma de Buenos Aires (CABA) y en la provincia de Santa Fe2.
Al igual que otros tumores, el CCR puede ser detectado, tratado y curado en estadios tempranos mediante rastreo poblacional. Existen métodos seguros, efectivos y con aceptabilidad demostrada4. El Instituto Nacional del Cáncer (INC) recomienda realizar el rastreo de CCR entre los 50 y 74 años. Sugiere que podría implementarse un programa nacional basado en el test de sangre oculta en materia fecal inmunohistoquímico (SOMFihq cada uno o dos años), con la opción de aplicarlo en etapas, comenzando por la población de 50 a 64 años y continuando con la de 65 a 74 años5. Publicaciones recientes muestran que el rastreo de CCR en Argentina se realiza de forma oportunista y con escasa cobertura5,6.
El Programa de las Naciones Unidas para el Desarrollo considera que en Argentina la concreción del derecho a recibir una cobertura básica de salud difiere mucho según el lugar de residencia7. Esto se debe al elevado grado de descentralización que presenta el sector público y a la significativa brecha de desarrollo y capacidades entre provincias. La heterogeneidad y fragmentación de las instituciones que componen el sistema de salud argentino se constituye en un rasgo distintivo8. No obstante, dada la expansión del sector público y de la seguridad social, la población cuenta con un elevado grado de cobertura en relación con otros países de la región7. La importancia de las obras sociales provinciales (OSP) en materia de población cubierta y nivel de gasto es tan grande que las convierte en posibles ejes de una estrategia para articular los sistemas provinciales en torno a seguros a su cargo7. La cobertura de salud dependiente de políticas públicas provinciales abarca al 52,3% de la población argentina.
La evaluación económica (EE) en salud es un análisis comparativo de cursos alternativos de acción, que se realiza tanto en términos de sus costos como de sus resultados y se mide en función de los efectos sobre la salud. Constituye una herramienta de decisión, que tiene por objeto mejorar la utilización de los recursos a través de su asignación eficiente. Dado que todos los sistemas de salud cuentan con recursos limitados, es fundamental saber qué estrategias optimizan su aprovechamiento. La costo-efectividad (CE) es un criterio fundamental promovido por la Organización Mundial de la Salud (OMS) para lograr la cobertura universal9.
Los resultados provenientes de las EE sobre los métodos de rastreo de CCR han servido en diversos países para determinar la implementación de las estrategias más convenientes en términos de eficiencia o CE410. En las EE sobre técnicas de rastreo para el CCR, el método de SOMFihq parece ser el más costo-efectivo en comparación con las otras técnicas, como la SOMF por guayaco, la fibrocolonoscopía y la rectosigmoi-doscopía4. Basados en los resultados de EE, algunos sistemas de salud establecieron estrategias secuenciales, cubriendo en etapas distintas franjas etarias de la población blanco10.
En Argentina, recientemente se han presentado los resultados de una evaluación de CE del rastreo de CCR, cuya perspectiva es la del tercer pagador, tomando un promedio ponderado de los costos de salud pública, seguridad social y sector privado nacional11.
Dada la elevada incidencia y mortalidad, la tendencia creciente, los elevados costos para el sector salud y la sociedad, la posibilidad de detección temprana y curación mediante un rastreo5, la evidencia de que este rastreo no se realiza en forma adecuada en Argentina56 y la ausencia de EE desde perspectivas subnacionales, se llevó a cabo este estudio. El objetivo fue analizar la CE del rastreo del CCR desde la perspectiva del sector público de salud y de las OSP de distintas provincias del país.
MÉTODOS
Se construyó un modelo de Markov con el software Data TreeAge® versión 2 011, que permitió comparar tres estrategias: rastreo en población de 50 a 74 años, rastreo en población de 50 a 64 años y no rastreo. La metodología exigió fraccionar el proceso de enfermedad en un número finito de estados de salud mutuamente excluyentes. En las estrategias de rastreo se modeló la utilización del test de SOMFihq anual en adultos de 50-74 y de 50-64 años de edad.
El tercer comparador fue no realizar rastreo, lo cual merece una discusión. Los estudios de CE publicados utilizan este comparador o la situación actual de rastreo de ese sistema de salud. Esta última es la más deseable, pero muchos sistemas de salud incluidos en este estudio desconocen su grado de cobertura (y en los que se conoce, esta es muy baja6). Por ambos motivos se decidió utilizar el comparador de no rastreo.
Los pacientes ingresaron al modelo a la edad de 50 años en alguno de los siguientes siete estados de salud, de acuerdo con las prevalencias publicadas: normal, pólipo de bajo riesgo, pólipo de alto riesgo, CCR estadio Dukes A, B, C y D.
Dado que todas las personas que ingresaban al modelo podían fallecer por causas generales no asociadas a CCR en cualquier ciclo, se tomaron los valores de la base de datos de la Dirección de Estadística e Información en Salud, a los que se restó la mortalidad por CCR. Se consideró que los pacientes sólo podían morir por CCR si lo tenían en cualquiera de sus distintos estadios. La mortalidad específica por CCR para cada estadio fue tomada de la bibliografía publicada.
Se consideró un horizonte temporal con un seguimiento hasta los 100 años de edad y 50 ciclos anuales, y se observó una sobrevida menor al 1% para ese momento (ver Tabla 1).
TABLA 1. Valores de los parámetros utilizados para el caso base, rangos utilizados para el análisis de sensibilidad y fuentes.

La adherencia al rastreo es una de las variables más importantes del modelo, ya que puede cambiar sustancialmente según las políticas públicas instrumentadas y por su impacto en los resultados. La adherencia al rastreo en Argentina es baja56 y no se conoce con exactitud en los subsectores analizados. Se asumió una adherencia del 60% al programa de rastreo, que luego fue sometida al análisis de sensibilidad (AS).
La información sobre costos fue tomada de los nomencladores de OSP (Instituto de Seguridad Social del Neuquén, Instituto Autárquico Provincial de Obra Social y hospitales públicos de gestión descentralizada -HPGD-) y de los ministerios de Salud de las cuatro provincias como aproximación a la práctica. Aunque los nomencladores no siempre representan el costo real, fueron utilizados ya que un microcosteo excedía los objetivos de este estudio. Todos los costos fueron calculados para 2015.
La Obra Social de la Ciudad de Buenos Aires debió ser excluida ya que no fue posible acceder a información de costos ni a su nomenclador.
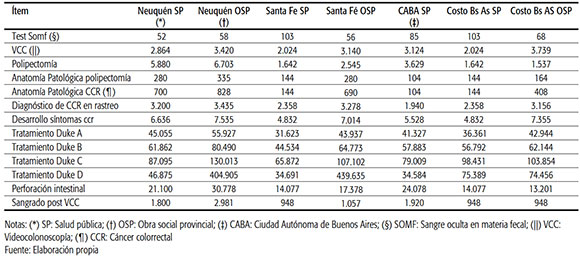
Los hospitales públicos de Santa Fe utilizan el Nomenclador HPGD, con datos actualizados a febrero de 2015. En la provincia de Buenos Aires, los hospitales públicos recuperan costos en base a este y otros dos nomencladores diferentes. Se tomaron los valores del nomenclador HPGD, considerado como el más actualizado y, por ende, el más cercano a los costos reales. Los principales ítems de costos incluidos se encuentran en la Tabla 2. Dado que la perspectiva fue la del financiador, se tuvo en cuenta si los medicamentos eran comprados o no por el subsector público, o si eran financiados por el Ministerio de Salud de la Nación. En el estudio no se incluyeron salarios, costos de equipamiento ni el costo de la estrategia de captación. Se investigaron aspectos de variabilidad clínica en los algoritmos de diagnóstico y tratamiento con potencial incidencia en los costos.
TABLA 2. Costos de las prácticas de cada uno de los subsectores de salud expresado en pesos ($).
Se modificaron las variables clínicas y de costos para cada uno de los siete subsectores analizados. Se aplicó una tasa de descuento del 3% por igual a costos y resultados sanitarios, con la corrección de mitad de ciclo.
Los puntos finales considerados fueron: años de vida ganados (AVG), costo por año de vida ganado ($/AVG) y razón de costo-efectividad incremental (RCEI).
No se incluyeron como medidas de desenlace los años de vida ajustados por calidad, dado que la bibliografía publicada no ha sido validada en este contexto.
Para valorar la CE, se relacionó la RCEI con un umbral de disponibilidad a pagar de cada provincia, estimado sobre la base de su producto bruto geográfico per cápita (PBGpc). El PBGpc fue tomado a partir de las respectivas Direcciones Provinciales de Estadística. Se utilizó el dato de 2014, que era el más actualizado disponible.
Se realizó un análisis de sensibilidad determinístico de las principales variables para establecer la robustez de los resultados. Se efectuó un análisis de tornado y de una vía. Las variables incluidas se encuentran en la Tabla 1.
RESULTADOS
Los costos de las prácticas de cada subsector se ilustran en la Tabla 2.
Algunas prácticas, como la polipectomía o el tratamiento del CCR en estadio D, muestran marcadas diferencias entre algunos subsectores.
Se llevó a cabo un proceso de calibración, que reveló que el modelo se ajustaba al comportamiento esperado, tanto de la historia natural de la enfermedad como de la implementa-ción del rastreo. En Gráfico 1 se muestra el impacto clínico y epidemiológico que tendría en 10 años el programa de rastreo, basado en SOMFihq, en personas de 50-74 años, comparado con la no realización.

GRÁFICO 1. Distribución de estadios tumorales al inicio y a los 10 años de funcionamiento del programa, con una adherencia del 60% en población de 50-74 años de edad.
Luego de 10 años de implementado el programa de rastreo, se reducirían significativamente los casos nuevos de CCR avanzado (estadios C y D) y aumentaría el porcentaje de estadios tempranos (A y B) detectados.
En la Tabla 3 se describen los resultados de efectividad, costos, RCEI y relación con el PBGpc para cada subsector.
TABLA 3. Resultados de efectividad, costos, razón de costo efectividad incremental (RCEI) y relación con el producto bruto per cápita (PBGpc) del rastreo con distintas estrategias por subsector.

En todos los casos, el rastreo de 50-74 años tiene una RCEI levemente mayor que el de 50-64 años, con valores que oscilan entre 0,13 y 0,42 PBGpc según la jurisdicción. Esto implica que en ningún caso la RCEI supera el umbral de 1 PBGpc, y ni siquiera el de 0,5 PBGpc.
Al comparar ambos subsectores dentro de cada provincia, se observan menores costos en el sector público que en el de las OSP.
En el Gráfico 2 se ilustra la CE comparativa de las tres estrategias para salud pública de Neuquén.

GRÁFICO 2. Análisis de costo efectividad incremental de las estrategias de rastreo mediante sangre oculta en materia fecal (SOMF) a población de 50 a 64 años o a población de 50 a 74 años, en comparación con no realizar rastreo*.
Ambas estrategias de rastreo se encuentran sobre la frontera de eficiencia (la misma línea en el plano de CE). Rastrear a una franja etaria más reducida (50-64 años) salva menos vidas y es menos costosa que hacerlo en toda la población (50-74 años), pero no se encuentra dominada.
En el AS, la variable que más impacta en el resultado del RCEI es la probabilidad de progresión de pólipo de bajo riesgo (PBR) a pólipo de alto riesgo (PAR), seguida por la probabilidad de transición de Dukes B a Dukes C y el costo de la videocolonoscopia (VCC) en tercer lugar. En todos los casos la RCEI se mantiene en un valor inferior a 1 PBGpc, lo que permite asumir la robustez de los resultados obtenidos.
DISCUSIÓN
El rastreo de CCR con SOMFihq anual en personas de bajo riesgo de 50-74 años de edad es costo-efectivo en todos los subsectores de salud analizados, tomando como umbral de disponibilidad a pagar el equivalente a uno, o medio PBI per cápita provincial, denominado PBGpc. Los valores de RCEI, comparados con no rastrear, representan entre 0,13 y 0,32 del PBGpc. El rastreo en la franja etaria de 50-64 años es menos costoso, pero logra menos AVG que el rastreo en la población de 50-74 años. En términos de RCEI la diferencia es mínima, lo que sugiere que la estrategia de 50-74 años podría ser más conveniente que la de 50-64; esta información debería complementarse con el análisis de impacto presupuestario y la capacidad de pago de cada subsector.
La conveniencia de establecer umbrales en los estudios de CE es un área de controversia en las EE en salud12. El umbral recomendado por la OMS (para aquellos países que no habían definido su propio umbral) surgió del Informe sobre la Salud en el Mundo 13, donde se citaba el trabajo de la Comisión de Macroeconomía y Salud como precursor del valor del umbral14. Dicho Informe sugería que las intervenciones con un costo inferior a 3 PBI per cápita (PBIpc) por AVAD evitado representaban una buena inversión. Basado en ese principio, clasificó las intervenciones como muy costo-efectivas cuando el valor de un AVAD evitado era inferior a 1 PBlpc y como costo-efectivas cuando el valor de un AVAD evitado era de entre 1 y 3 PBlpc; por encima de ese umbral, no debían ser consideradas como costo-efectivas.
Sin embargo, esto ha recibido numerosas críticas. Algunos autores sugieren utilizar umbrales cercanos a 0,5 PBlpc12 u otros enfoques diferentes15,16. La misma OMS publicó recientemente un documento donde desalienta el límite de 3 PBI como umbral para definir la disponibilidad a pagar17. Entre las limitaciones asociadas al empleo del PBI (o PBG) para la construcción de umbrales, cabe además señalar que en países como Argentina el PBI nacional es un promedio que esconde importantes diferencias subregionales. El PBGpc, presenta diferencias de hasta 11 veces entre el distrito más rico y el más pobre del país, lo que denota las dificultades de aplicar este tipo de umbral para todas las provincias. Esto adquiere especial interés en un sistema de salud fragmentado como el de Argentina. Las diferentes estructuras de costos también indican que los análisis subregionales pueden ser más representativos que la evaluación desde una perspectiva nacional única en Argentina. Este estudio explora, probablemente por primera vez, los umbrales regionales con el fin de evidenciar diferencias que pueden afectar la toma de decisiones a nivel subnacional. A su vez, deja abierta la discusión sobre la comparabilidad entre salud pública y obras sociales a la hora de establecer umbrales de disponibilidad a pagar.
La variabilidad clínica es un importante parámetro de los costos y resultados sanitarios. Una práctica que presentó variabilidad inadecuada es la realización de una primera VCC diagnóstica luego de tener una SOMFihq positiva, que en caso de encontrar una lesión polipoidea o tumoral es seguida de una segunda VCC con material descartable para la biopsia (pinzas, ansas). Esto se observó como práctica habitual en dos subsectores, acompañada de una duplicación de costos y uso de recursos (anestesia, personal, endoscopia, etc.) y riesgos para el paciente. Otra práctica cuya variabilidad se destaca es el uso de anticuerpos monoclonales en el tratamiento del CCR en estadio metastásico; en Salud Pública de CABA y Neuquén no son utilizados de rutina, mientras que forman parte de la práctica estándar en los otros subsectores incluidos. En Santa Fe es marcada la diferente tasa de uso de anticuerpos monoclonales entre la OSP y SP (con una utilización muy superior en la primera). Otro aspecto que surgió de los informantes clave fue que las recomendaciones de las guías y protocolos vigentes no se cumplen en un gran porcentaje de los casos. Determinadas prácticas, como el intervalo entre VCC para la vigilancia de pacientes con lesiones, muestran una importante variabilidad, lo que plantea los pros y contras de modelar la práctica ideal que figura en las guías o la práctica real en los estudios de CE. En ese sentido, la discusión sobre la utilización de datos biomédicos de la vida real se encuentra muy vigente en la actualidad18.
RELEVANCIA PARA LA INVESTIGACIÓN EN SALUD
Sería deseable realizar estudios similares en otras provincias con menor PBGpc, considerando también sus diferencias demográficas, epidemiológicas y su variabilidad clínica. Los estudios de CE deberían tener en cuenta la heterogeneidad subnacional en países como Argentina.
1. Globocan. Fact Sheets. Agencia Internacional para la Investigación del Cáncer, Organización Mundial de la Salud; 2013. [Disponible en: http://globocan.iarc.fr/Pages/fact_sheets_cancer.aspx] [Último acceso: 09/05/2017]
2. Abriata MG. Sistema de Vigilancia Epidemiológica y Reporte del INC. Ministerio de Salud de la Nación; 2011. [ Links ]
3. Borruel MA, Mas IP, Borruel G. Estudio de carga de enfermedad: Argentina. Ministerio de Salud de la Nación; 2010. [ Links ]
4. Segnan N, Patnick J, Von Karsa L. European Guidelines for Quality Assurance in Colorectal Cancer Screening and Diagnosis. Publications Office of the European Union; 2012. [ Links ]
5. Gualdrini U, lummato L. Cáncer colorrectal en la Argentina. Organización, cobertura y calidad de las acciones de prevención y control. Informe final, Diciembre 2011: Diagnóstico de situación de la Argentina. Instituto Nacional del Cáncer, Ministerio de Salud de la Nación; 2011. [Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000880cnt-DiagnsticosituacionaldelcancercolorrectalenArgentina.pdf] [Último acceso: 23/05/2017]
6. Tercera Encuesta Nacional de Factores de Riesgo para Enfermedades No Transmisibles. Ministerio de Salud de la Nación. Instituto Nacional de Estadísticas y Censos; 2015. [ Links ]
7. El sistema de salud argentino y su trayectoria de largo plazo: logros alcanzados y desafíos futuros, aportes para el desarrollo humano en Argentina. Programa de las Naciones Unidas para el Desarrollo; 2011. [Disponible en: http://www.ar.undp.org/content/dam/argentina/Publications/Desarrollo%20Humano/El%20sistema%20de%20salud%20argentino%20-%20%20pnud%20ops%20cepal%20version%20final.pdf?download] [Último acceso: 23/05/2017]
8. Tobar F Para reducir la fragmentación del sistema de salud. Revista Isalud. 2010;4(20):54-55. [ Links ]
9. Using Health Technology Assessment for Universal Health Coverage and Reimbursement Systems. Ginebra. Organización Mundial de la Salud; 2015. [ Links ]
10. Sharp L, Tilson L, Whyte S, Ceilleachair AO, Walsh C, Usher C, et al. Using Resource Modelling to Inform Decision Making and Service Planning: The Case of Colorectal Cancer Screening in Ireland. BMC Health Services Research. 2013;13(1):1. [ Links ]
11. Espínola N, Maceira D, Palacios A. Costo-efectividad de las pruebas de tamizaje del cáncer colorrectal en la Argentina. Acta GastroenterolLatinoam. 2016;46(1):8-17 [ Links ]
12. Claxton K, Martin S, Soares M, Rice N, Spackman E, Hinde S, et al. Methods for the Estimation of the National Institute for Health and Care Excellence Cost-Effectiveness Threshold. Health Technol Assess. 2015;19(14):1-503. [ Links ]
13. Informe sobre la salud en el mundo 2002: Reducir los riesgos y promover una vida sana. Organización Mundial de la Salud; 2002. [ Links ]
14. Sachs JD. Macroeconomics and Health: Investing in Health for Economic Development. Revista Panamericana de Salud Pública. 2002;12(2):143-144. [ Links ]
15. Pichon-Riviere A, Augustovski F, Garcia MS, Caporale J. The Efficiency Path: An Estimation of Cost-Effectiveness Thresholds for 185 Countries Based on Per Capita Health Expenditures and Life Expectancy. Value in Health: The Journal of the International Society for Pharmacoeconomics and Outcomes Research. 2015;18(7):A695. [ Links ]
16. Woods B, Revill P, Sculpher M, Claxton K. Country-Level Cost-Effectiveness Thresholds: Initial Estimates and the Need for Further Research. Centre for Health Economics, CHE Research Paper 109. Universidad de York, Reino Unido; 2015. [ Links ]
17. Marseille E, Larson B, Kazi DS, Kahn JG, Rosen S. Thresholds for the Cost-Effectiveness of Interventions: Alternative Approaches. Bulletin of the World Health Organization. 2015;93(2):118-124. [ Links ]
18. Sáez C, Martínez-Miranda J, Robles M, García-Gómez JM. Organizing Data Quality Assessment of Shifting Biomedical Data. Studies in Health Technology and Informatics. 2011;180:721-725. [ Links ]














