Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Argentina de Salud Pública
versión impresa ISSN 1852-7513versión On-line ISSN 1853-810X
Rev. argent. salud pública vol.8 no.31 Buenos Aires jun. 2017
SALUD INVESTIGA
Estrategias para el fortalecimiento de la revisión ética de las investigaciones en salud
Strategies for Strengthening the Ethical Review of Health-Related Research
Ana Palmero1, Sebastián Etchevers2
1. Comité Nacional Asesor de Ética en Investigación, Subsecretaría de Políticas, Regulación y Fiscalización, Ministerio de Salud de la Nación
2. Dirección de Investigación para la Salud, Subsecretaría de Políticas, Regulación y Fiscalización, Ministerio de Salud de la Nación
El fortalecimiento y armonización de los criterios de evaluación de los comités de ética en investigación del país son objetivos de la Dirección de Investigación para la salud y del Comité Nacional Asesor de Ética en investigación. el presente artículo se propone describir las fortalezas y debilidades que han sido identificadas en el sistema de revisión ética de las provincias y que ayudarán a definir las próximas estrategias en la materia.
PALABRAS CLAVE: Proyectos de Investigación; Salud; Revisión Ética; Comités de Ética en Investigación
KEY WORDS: Research Projects; Health; Ethical Review; Research Ethics Committees.
El componente esencial para garantizar la protección de los derechos fundamentales de los participantes de las investigaciones es la evaluación ética previa por parte de un comité de ética en investigación (CE1). Se trata de un requisito común de los principales documentos internacionales de ética en investigación y de las normas nacionales en la materia. Entre estas últimas puede referirse el Código Civil y Comercial que en pos de proteger los derechos personalísi-mos de los participantes exige, además, que la evaluación sea realizada por un CE1 acreditado1.
Un CE1 correctamente conformado garantiza una evaluación independiente y competente de los aspectos éticos, científicos, sociales y operativos de los proyectos propuestos, que está destinada a proteger a las personas contra riesgos de daños y a facilitar la realización de estudios beneficiosos para la sociedad2. Entre otras cosas, evalúa el balance entre riesgos y beneficios para los participantes, que la selección de los participantes sea equitativa, que el procedimiento para la obtención del consentimiento sea apropiado, que el investigador y su equipo sean idóneos y que el centro sea el adecuado para la investigación. Sin embargo, la evaluación de un CE1 no resulta suficiente si su tarea no se realiza dentro del marco de un sistema apropiado de protección de los participantes, que garantice la calidad y efectividad de su trabajo. En esta línea, en las Pautas y orientación operativa para la revisión ética de la investigación en salud con seres humanos3, la Organización Mundial de la Salud fijó como responsabilidad de los Estados Miembros el establecimiento de un sistema de revisión ética de la investigación con el fin de evitar que los CE1 queden aislados o que no puedan operar correctamente. Este sistema debe contar con un marco jurídico acorde a las pautas y a las normas internacionales, con la existencia de CE1 que realicen una revisión competente de las investigaciones y garanticen una supervisión adecuada de su tarea.
Dadas las características federales del país y la inexistencia de una ley nacional establecida en esta materia, la regulación de la investigación en las provincias -incluida la revisión ética- resulta desigual.
En respuesta a esta situación la Dirección de 1nvestigación para la Salud (D1S), junto al Proyecto de Funciones Esenciales y Programas de Salud Pública (FESP 11), implementó en 2012 un plan estratégico de gestión de Actividades de Salud Pública (ASP). Particularmente, las acciones orientadas al fortalecimiento de los CE1 fueron las ASP 5 (Creación de un Comité Provincial de Ética en 1nvesti-gación) y ASP 6 (Registro, Acreditación y Supervisión de CE1). Estas últimas dos actividades fueron incluidas en 2014 y 2016, respectivamente, y actualmente se encuentran en vigencia4.
Con la ASP 5 (ver Tabla 1) se esperaba que las provincias presentasen normativa para acreditar la creación de un Comité Provincial de Ética en Investigación en un organismo o unidad funcional del Ministerio de Salud provincial, dirigido a: evaluar de forma independiente (libre de conflicto de intereses), competente y oportuna los aspectos éticos y metodológicos de todo tipo de proyectos de investigación en salud, promover la creación y acreditar los CEI institucionales que se constituyan. A la fecha de elaboración del presente artículo se contabilizan 16 provincias que han presentado su creación ante la DIS, lo que equivale al 67% del total del país (ver Mapa 1). De ellas, 14 tienen en funcionamiento los comités provinciales.
TABLA 1. Distribución de cumplimiento de la ASP 5, por año y provincia.


MAPA 1. Provincias que presentaron la creación de un Comité de Ética en Investigación.
La ASP 6 fue incorporada con el objetivo de propiciar el fortalecimiento de la gestión de los comités provinciales de ética en investigación a través de la creación de una normativa que les otorgue la responsabilidad de la acreditación y supervisión de los CEI públicos y privados en el ámbito local. Mediante esta actividad, la DIS se propone incentivar a los comités provinciales a confeccionar los Procedimientos Operativos Estándar (POE), como marco para llevar a cabo la tarea de acreditar y supervisar los diferentes CEI institucionales que existan o se creen en cada lugar.
Por su parte, la creación del Comité Nacional Asesor de Ética en Investigación terminó de definir la importancia del fortalecimiento de la revisión ética de las investigaciones. Uno de sus propósitos, con vistas a establecer un sistema nacional de protección de los participantes, es armonizar los estándares éticos en investigación y fortalecer la capacidad de su evaluación en todo el país, en un marco de consenso entre los expertos y referentes de los comités provinciales de ética en Investigación que forman parte del Comité Nacional5 (ver Mapa 2).
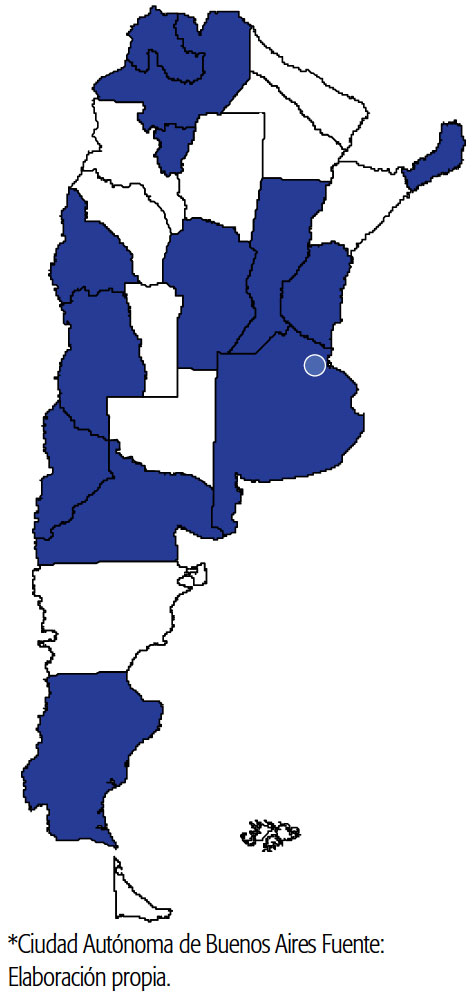
MAPA 2. Provincias que conforman el Comité Nacional Asesor de Ética en Investigación.
ESTADO DE SITUACIÓN DE LA REVISIÓN ÉTICA EN LAS PROVINCIAS
Como punto de partida para definir estrategias que permitan optimizar y unificar los criterios de la revisión ética de las investigaciones, desde la Coordinación del Comité Nacional se realizó un cuestionario dirigido a los comités provinciales de ética en investigación. El objetivo fue identificar las estrategias existentes útiles para estandarizar la evaluación y, asimismo, detectar aquellas áreas que requieren fortalecimiento, con el propósito de desarrollar herramientas de evaluación unificadas para todo el país.
El cuestionario se basó en cuatro áreas, que deben ser fortalecidas para establecer un sistema de revisión ética de la investigación: 1) el conocimiento y contralor sobre los CEI de la provincia; 2) las pautas para evaluación de protocolos, consentimientos informados, investigador principal e instituciones en las que se desarrolla la investigación; 3) las exigencias de capacitación de miembros de CEI; y 4) la comunicación con los CEI para el registro de las investigaciones (ver Tabla 2).
TABLA 2. Porcentaje de establecimiento de requisitos estandarizados, por área a fortalecer.
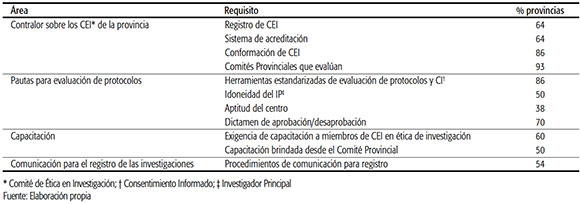
Con relación al contralor que ejercen los comités provinciales, se preguntó acerca de la existencia de un registro y sistemas de acreditación de CEI. Según los resultados obtenidos,
9 de las 14 provincias que cuentan con comités provinciales poseen un registro de CEI; a su vez, esas 9 son las que tienen un sistema de acreditación de CEI que abarca tanto los del ámbito público como privado.
Por otro lado, 12 de las 14 provincias con comité provincial establecieron requisitos de funciones, conformación de miembros y funcionamiento de los CEI. Cabe destacar que entre esas 12 están incluidas todas las que acreditan a los CEI y 3 que no acreditan.
El 50% de las provincias con comité provincial acepta dictámenes de aprobación de CEI de otra jurisdicción. De ellas, tres son provincias con sistema de acreditación.
Acerca de la estructura de evaluación de protocolos, 13 de los 14 comités provinciales evalúan proyectos de investigación; 10 de ellos lo hacen como segunda instancia luego de la primera realizada por el CEI institucional, y 3 como única instancia.
Respecto a las herramientas de evaluación de protocolos, el 86% de los Comités Provinciales aprobó alguna herramienta que establece los puntos a evaluar en estos documentos. Todos incluyen los requisitos esenciales del protocolo y del consentimiento informado.
Con relación a los investigadores, se indagó si los comités provinciales establecieron los requisitos necesarios para constatar su idoneidad. El 50% de los comités fijó requisitos: evalúa el currículum vitae, el título habilitante y, en menor medida, la matrícula profesional, la experiencia en investigación, el título de especialista (acorde al objetivo del estudio) y la formación en ética en investigación y buenas prácticas clínicas en la materia.
En cuanto a la institución en la que se desarrolla la investigación, se indagó sobre la existencia de estándares para evaluar si resultan aptas para realizar el estudio. Sólo el 38% (5 de 14) de los Comités Provinciales los había establecido. Los 5 en cuestión comprueban la habilitación del centro y, en menor medida, los recursos necesarios para la investigación y para dar respuesta a las emergencias que puedan suscitarse.
Respecto a los dictámenes de aprobación (o desaprobación) de los proyectos de investigación, el 70% de los comités provinciales estableció los requisitos del dictamen del CEI, que incluye la justificación de la aproba-ción/desaprobación, los documentos revisados y el listado de miembros presentes.
Asimismo, se consultó acerca de los procedimientos de comunicación con los CEI para el registro de las investigaciones, con el fin de determinar si los comités provinciales toman conocimiento de los estudios que se realizan en su ámbito. En este caso, el 54% (8 de 14) cuenta con estos procedimientos tanto para las investigaciones aprobadas como las no aprobadas. Este registro se realiza con una frecuencia menor a la anual.
Finalmente, se indagó respecto a la capacitación exigida a los miembros de los CEI y la brindada por el comité provincial. De los resultados surge que el 40% de los comités provinciales no exige capacitación a los miembros de CEI. Del 60% que exige capacitación, la totalidad lo hace en ética en investigación y, en menor medida, en buenas prácticas clínicas y en normativas de investigación aprobadas por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT).
Por su parte, el 50% de los comités provinciales brinda capacitación, que está dirigida tanto a miembros de CEI como a investigadores y se observa principalmente en aquellas provincias que cuentan con un sistema de acreditación.
CONCLUSIONES
El análisis de los resultados obtenidos revela las fortalezas y debilidades existentes en el sistema de evaluación ética del país.
Como fortaleza se destaca, en primer lugar, el hecho de que existen normas que definen las funciones y la conformación específica de los CEI en la mayoría de las provincias que integran el Comité Nacional. Este punto representa un avance en la división de tareas del CEI y del comité de ética asistencial: históricamente las funciones confluían en este último, lo que dificultaba una evaluación eficiente.
En segundo lugar, resulta auspicioso que la mayoría de los comités provinciales evalúen los proyectos, aun como segunda instancia, ya que eso facilita la promoción de pautas de evaluación a los CEI locales.
Otro punto favorable es que en nueve provincias se hayan establecido sistemas de acreditación de CEI, que permiten ejercer un mayor grado de contralor sobre su funcionamiento.
Por último, se destaca la existencia de herramientas de evaluación de protocolos y consentimientos informados en la mayoría de las provincias para unificar los criterios y consensuar un único instrumento de evaluación, optimizado y estandarizado para todo el país.
En cuanto a las debilidades identificadas, es necesario fortalecer los requisitos para evaluar la idoneidad de los investigadores, particularmente la formación exigida para la realización de investigaciones en las que participan seres humanos.
Por otro lado, resulta primordial reforzar la exigencia de formación en ética en investigación de los miembros de los CEI y, por ende, asumir el compromiso de brindar la capacitación que resulte necesaria.
Asimismo, es esencial mejorar la comunicación entre los CEI y los comités provinciales en cuanto el registro de las investigaciones para desarrollar criterios de evaluación comunes y detectar dictámenes disímiles.
Finalmente, otra de las cuestiones a resolver está vinculada al establecimiento de requisitos estandarizados para la evaluación de los centros en los que se realiza la investigación, con el fin de asegurar la calidad de atención de los participantes, especialmente en situaciones de emergencia.
Estos hallazgos se suman a las acciones ya existentes orientadas a la creación de un comité provincial de ética en investigación y la promoción de sistemas de acreditación de CEI en todas las provincias. Se convierten así en el puntapié inicial, que ayudará a definir el desarrollo de las próximas estrategias de fortalecimiento de la revisión ética del Comité Nacional y de la DIS, tendientes a lograr un sistema apropiado y sostenible para la vigilancia de la calidad y la efectividad de la revisión ética en la investigación.
1. Ley N° 26994, Artículo 58. Código Civil y Comercial de la Nación. 2015 [ Links ]
2. Resolución N° 1480/2011. Guía para Investigaciones con Seres Humanos. Ministerio de Salud de la Nación; 2011. [ Links ]
3. Pautas y orientación operativa para la revisión ética de la investigación en salud con seres humanos. Organización Mundial de la Salud; 2012. [Disponible en: http://apps.who.inyiris/bitstream/10665/89644/1/9789275317259_spa.pdf] [Último acceso: 07/08/2017]
4. Faletty C, Leston A, O'Donnell C. Red ministerial de áreas de investigación para la salud en Argentina: estrategia de fortalecimiento del Sistema Nacional de Investigación para la Salud. Rev Argent Salud Pública. 2015;6(22):46-48. [Disponible en: http://rasp.msal.gov.ar/rasp/articulos/volumen22/46-48.pdf] [Último acceso: 07/08/2017]
5 Palmero A, O'Donnell C, Eiguchi K. El rol del Comité Nacional Asesor de Ética en Investigación como parte del Sistema de Investigaciones para la Salud. Rev Argent: Salud Pública. 2016;7(28):43-45. [Disponible en: http://rasp.msal.gov.ar/rasp/articulos/volumen28/43-45.pdf] [Último acceso: 07/08/2017]














