Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Argentina de Salud Pública
Print version ISSN 1852-7513On-line version ISSN 1853-810X
Rev. argent. salud pública vol.8 no.32 Buenos Aires Dec. 2017
ARTÍCULOS ORIGINALES
Caracterización de cepas de Virus Sincitial Respiratorio en el Gran Buenos Aires y aspectos de su diseminación
Characterization of Respiratory Syncytial Virus Strains in the Greater Buenos Aires and Spreading Aspects
Alejandro Castello1,2, Alberto Rodriguez Pérez3, Gabriel Lihue Rojo4, Daniela Alvarez1,5, Alejandra Musto1,6, César Montali5, Andrea Sancilio5,6, Gabriela Hamilton1, Carolina Garcia7, Lilian Sosa3, Mariana Orellana1,2, Mariana Viegas4
1 Universidad Nacional Arturo Jauretche;
2 Universidad Nacional de Quilmes;
3 Hospital Dr. Alberto Eurnekian, Ezeiza;
4 Hospital de Ninos Ricardo Gutiérrez, Ciudad Autónoma de Buenos Aires;
5 Hospital El Cruce, Dr. Néstor C. Kirchner, Florencio Varela;
6 Hospital Evita, Lanús;
7 Hospital Evita Pueblo, Berazategui.
FUENTE DE FINANCIAMIENTO: Beca "Carrillo-Onativia", Ministerio de Salud de la Nación (Argentina), Univ. Nac. de Quilmes, Hosp. de Ninos Ricardo Gutiérrez.
FECHA DE RECEPCIÓN: 21 de diciembre de 2016
FECHA DE ACEPTACIÓN: 22 de mayo de 2017
CORRESPONDENCIA A: Alejandro Castello - castelloaa@gmail.com
Registro RENIS N° IS001357
RESUMEN. INTRODUCCIÓN: El virus sincitial respiratorio (VSR) es el agente viral más frecuente de infecciones respiratorias agudas bajas (IRAB) en la primera infancia y el mayor responsable de las hospitalizaciones en el período invernal. OBJETIVOS: Describir las características de los brotes de VSR en la Zona Sanitaria VI de la provincia de Buenos Aires, establecer la diversidad de las cepas circulantes y realizar el análisis bioinformático y filogeográfico de las secuencias de la glicoproteína G. MÉTODOS: Se estudió a pacientes pediátricos internados con presentación compatible con IRAB durante dos picos epidémicos (2014-2015) en cuatro hospitales. Se recopilaron datos clínicos, demográficos y socio-sanitarios, y se detectaron patógenos virales en aspirados nasofaríngeos de estos pacientes por inmunofluorescencia (IF), obteniéndose la secuencia del gen de la proteína G en los VSR positivos. RESULTADOS: De 1296 casos estudiados, 317 fueron positivos para algún agente viral. De ellos, 266 (84%) fueron VSR positivos. Se hallaron asociaciones significativas entre las poblaciones positivas y negativas para VSR. Una tendencia al hacinamiento y vivienda precaria en los casos VSR positivos fue reflejada en los estudios filogeográficos. CONCLUSIONES: Los datos de firma molecular permitieron trazar orígenes y vías de diseminación del VSR. Esto ayuda a senalar zonas y situaciones de vulnerabilidad, estableciendo la población primaria blanco de planes de vacunación u otras medidas profilácticas.
PALABRAS CLAVE: Virus Sincitial Respiratorio; Infección Respiratoria Aguda Baja; Vulnerabilidad, Epidemiología Molecular; Genotipo.
ABSTRACT. INTRODUCTION: The respiratory syncytial virus (RSV) is the most frequent viral agent associated to acute lower respiratory infections (ALRIs) in early childhood, being the main responsible for hospitalizations during winter. OBJECTIVES: To describe the characteristics of RSV outbreaks in the Health Area VI of Buenos Aires Province, to establish the diversity of circulating strains and to perform a bioinformatic and phylogeographic analysis of glycoprotein G sequences. METHODS: Pediatric inpatients with ALRI-compatible ^presentation during two epidemic peaks (2014-2015) were studied in four hospitals. Clinical, demographic and socio-sanitary data were collected, viral pathogens were detected by immunofluorescence (IF), and the sequence of the G protein gene was obtained in the positive RSVs. RESULTS: From 1296 cases, 317 were positive for some viral agent and 266 (84%) out of these were RSV positive. Significant associations were found among the positive and negative populations for RSV. A trend towards overcrowding and precarious housing in positive RSV cases was reflected in phylogeographic studies. CONCLUSIONS: The molecular signature data allowed tracing origins and routes of RSV dissemination. This helps identify areas and situations of vulnerability, establishing the primary target population for vaccination plans or other prophylactic measures.
KEY WORDS: Respiratory Syncytial Virus; Acute Lower Respiratory Infection, Vulnerability; Molecular Epidemiology; Genotype.
INTRODUCCIÓN
Las infecciones respiratorias constituyen una de las principales causas de morbilidad y mortalidad, y presentan la tasa de mortalidad más alta en niños menores de 5 años de edad. En particular, las infecciones respiratorias agudas bajas (IRAB) predisponen al desarrollo futuro de enfermedades crónicas y severas, incrementando el riesgo de mortalidad en casi 70 veces en los países en vías de desarrollo como Argentina1. Los síndromes clínicos más asociados con IRAB incluyen bronquiolitis, neumonía, neumonitis y síndrome coqueluchoide. La bronquiolitis es la IRAB más frecuentemente causada por virus respiratorios en los lactantes. Se han realizado numerosos estudios sobre la etiología viral de las IRAB en pacientes pediátricos menores de 5 años, y todos coinciden en que el virus sincitial respiratorio (VSR) es el agente más frecuente y el mayor responsable de las hospitalizaciones en el período invernal2'5. Por otro lado, los recién nacidos muy prematuros, lactantes y niños pequenos con enfermedad pulmonar crónica, cardiopatías, inmunodeficiencias o inmunosupresión son los huéspedes que sufren mayor riesgo de adquirir infecciones graves producidas por este virus y con una alta mortalidad. Por lo tanto, en las poblaciones susceptibles, el VSR es la principal causa de bronquiolitis y una de las principales de neumonía durante el primer año de vida, y produce un 23-40% de todas las IRAB5.
La bronquiolitis y la neumonía provocadas por VSR se producen más frecuentemente entre las 6 semanas y los 9 meses de vida, y el pico de incidencia de la IRAB ocurre entre los 2 y los 7 meses6, lo que se corresponde con la disminución del título de anticuerpos maternos. Estudios de relevamiento serológico han demostrado que aproximadamente la mitad de los lactantes que están en riesgo durante una epidemia de VSR se infectan con el virus. La reinfección en los adultos también es común, particularmente bajo condiciones en las cuales la exposición al virus es elevada, y es probable que el VSR contribuya considerablemente a las enfermedades del tracto respiratorio en este grupo etario7. La incidencia estacional del VSR está normalmente limitada al invierno5'8.
El VSR se contagia mediante el contacto con secreciones respiratorias. El principal modo de diseminación es a partir de las grandes gotas de secreciones respiratorias o a través de la contaminación por fómites, más que por el contacto con pequenas partículas aerosolizadas. Varios estudios han demostrado que el personal de los hospitales pediátricos tiene una tasa de infección del 25 al 50% durante un brote de VSR9. Esta población juega un rol importante en la propagación de la infección por VSR en esos establecimientos10,11, mientras que en las familias el virus se introduce primariamente por los niños pequenos de edad escolar y luego se disemina con alta frecuencia a los hermanos mayores y adultos. Según un estudio prospectivo, aproximadamente el 40% de los miembros de una familia mayores de un año se habían infectado tras la introducción de VSR10.
En lo concerniente a sus aspectos específicos, el VSR posee un genoma de ARN no segmentado de polaridad negativa (orden mononegavirales) y ha sido clasificado como miembro del género pneumovirus, dentro de la familia Paramyxoviridae12. El genoma ARN del VSR contiene 10 genes que codifican para 11 proteínas. Entre ellas se encuentran las tres glicoproteínas de superficie: pequena proteína hidrofóbica SH, la proteína de fijación a la superficie celular G, y la proteína F, que permite la fusión de la cubierta del virus a la membrana celular durante el ingreso del virus a la célula. Las tres se encuentran insertas en la envoltura del virus12. Las proteínas G y F han demostrado ser los principales antígenos generadores de anticuerpos neutralizantes y protectivos13. La mayor diferencia a nivel genético ha sido encontrada en la proteína G, que difiere en más del 45% en su secuencia de aminoácidos entre los dos subtipos antigénicos del VSR A y B, en tanto que la proteína F no presenta en sus regiones antigénicas gran variabilidad, 96-99,9% de identidad de aminoácidos entre aislamientos de VSR analizados en un estudio en Corea14. Es por ello que la proteína G se ha utilizado para clasificar molecularmente al virus. El VSR existe como un solo serotipo, pero tiene dos subtipos antigénicos A y B; estos se han podido clasificar mediante diferentes paneles de anticuerpos monoclonales (AcMos) dirigidos contra las proteínas P, F y G15, los cuales se correlacionan con dos grupos genéticamente distintos16. Las epidemias son comúnmente producidas por los dos subtipos antigénicos A y B, clasificados en más de un genotipo. Las razones que explican las múltiples reinfecciones por VSR todavía no han sido completamente establecidas. Sin embargo, numerosos estudios sobre aislamientos clínicos han demostrado que existe una considerable variación genética y antigénica17-21, que surgiría como respuesta a la presión de selección inmune102203. Aunque la variación genética no es necesaria para la reinfección, la evidencia sugiere que los cambios antigénicos podrían contribuir a las infecciones repetidas23.
Generalmente, la información recogida respecto a la enfermedad por VSR se organiza de modo fragmentado (clínica, virológica, epidemiológica, sanitaria, socio-ambiental, etc.). La epidemiología molecular es una herramienta poderosa para el seguimiento minucioso de un brote epidémico: permite identificar a los miembros de un mismo linaje y, junto con datos geográficos y temporales, describir vías de diseminación en una población. Si bien abundan los estudios sobre la diversidad genética del VSR y sobre la susceptibilidad de huéspedes y poblaciones hacia las presentaciones severas, en pocos casos ambos aspectos se asocian en un mismo trabajo. Dado este déficit, se desarrolló una base de datos integrando distinto tipo de información sobre infecciones respiratorias graves en niños, de manera de abordar la complejidad de esta problemática de salud pública. La base de datos recogió información epidemiológica, clínica y sobre determinantes conocidos de vulnerabilidad a la infección severa por VSR con datos de secuencia de los virus infectantes. El estudio se realizó sobre pacientes pediátricos internados con diagnóstico de IRAB durante dos picos epidémicos invernales en la región sanitaria VI de la Provincia de Buenos Aires.
El presente trabajo utilizó dicha base de datos para describir las características de los brotes de VSR en esta región, establecer la diversidad de las cepas circulantes y realizar el análisis bioinformático y filogeográfico de las secuencias de la glicoproteína G, con el fin de establecer mapas de seguimiento de cepas intentando relacionar su diseminación con aspectos de vulnerabilidad individual o del contexto epidemiológico o socio-sanitario.
MÉTODOS
Se estudiaron variables dentro de las siguientes categorías: clínicas, virológicas, sanitarias y socio-demográficas. Por su período temporal y la modalidad de colecta de datos, se trató de un estudio transversal y prospectivo.
La población objetivo del presente estudio fueron niños de entre 30 días y 13 años y 12 meses de vida que habían estado internados en los hospitales Evita Pueblo de Berazategui, El Cruce de Florencio Varela, Evita de Lanús y Eurnekian de Ezeiza (todos pertenecientes a la Región Sanitaria VI, que abarca los municipios de Berazategui, Florencio Varela, Quilmes, Avellaneda, Lanús, Lomas de Zamora, Almirante Brown y Ezeiza) con 1RAB entre junio de 2014 y julio de 2015, y que cumplían los criterios de internación detallados en la muestra.
Las unidades de análisis fueron todos los niños internados con diagnóstico de 1RAB en los hospitales incluidos en este estudio durante el período determinado, previo consentimiento informado.
En lo que respecta a los criterios de inclusión/exclusión, dado que el estudio fue disenado para seguir el desarrollo de brotes epidémicos por VSR y para identificar grupos vulnerables, focos iniciales y diseminadores, se intentó ampliar al máximo la población de estudio sin excluir por ningún criterio de normalidad (como condiciones patológicas previas o desnutrición). De esta manera se trabajó sobre la población pediátrica total con la presentación descrita sugerente de infección por VSR y confirmada por test de inmunofluores-cencia directa o indirecta para la detección de antígenos virales (1F) en muestras de aspirado nasofaríngeo (ANF).
La muestra estuvo compuesta por pacientes con patología respiratoria internados en los servicios de Pediatría de los hospitales participantes en el estudio entre junio de 2014 y julio de 2015. Entre lunes y viernes, previo consentimiento informado, se los encuestó y se tomaron muestras de secreción nasofaríngea para su estudio. Se propuso reclutar por día para el estudio sólo a los tres primeros que reunieran las condiciones y aceptaran participar, lo que resultó en un máximo de 60 incorporaciones mensuales por hospital o 240 reclutados teóricos mensuales en el pico de incidencia. De esta forma se tendió a garantizar un número total adecuado de muestras aleatorias y una representatividad homogénea durante todo el año. La información clínica, sanitaria y socio-demográfica se recabó mediante la aplicación de una ficha-encuesta, que incluyó las variables de estudio referidas. Esta encuesta fue disenada a los fines de esta investigación, estuvo conformada en dos bloques (uno de datos clínicos y otro de preguntas sobre aspectos socio-sanitarios) y fue realizada a todos los pacientes que cumplían los criterios del estudio y tenían el consentimiento informado de participación de los padres.
En el laboratorio se utilizaron como especímenes clínicos los ANF tomados de forma regular a los pacientes con presentación compatible con 1RAB. El ANF se fraccionó en tres alícuotas de 1 ml, una de las cuales fue sometida al estudio de rutina por 1F y dos fueron conservadas en freezer a -70°C para el estudio molecular y muestra de respaldo.
En cuanto a la identificación y caracterización, los especímenes de interés fueron seleccionados sobre la base del estudio inicial por 1F (muestras positivas para VSR, en lo sucesivo VSR+) y los criterios de aleatoriedad descriptos más arriba. Estas muestras fueron sometidas a la extracción del material genético del virus (extracción de ARN), amplificación por RT-PCR (reverse transcription polymerase chain reaction) del ectodominio del gen de la proteína G (región hipervariable) y secuenciamiento del mismo. El análisis de los resultados se dio a distintos niveles de acuerdo con el tipo de dato, para posteriormente cruzar la información de manera relativamente libre para hallar asociaciones.
Los datos obtenidos se agruparon según lo descripto en: datos de identificación viral más datos de secuencia; datos clínicos; datos ambientales; y datos socio-demográficos.
En lo que respecta a las herramientas estadísticas utilizadas, los datos fueron ingresados en archivos Excel e inicialmente graficados y analizados en forma visual para verificar su distribución. Se realizaron análisis de tendencia central y dispersión de las variables numéricas y cálculo de frecuencias de las variables cualitativas. Las diferencias de proporciones entre los casos (VSR+) y controles (otros virus o 1F negativa según cada caso) se analizaron con el test de chi cuadrado como prueba de independencia. Las medias de variables cuantitativas de distribución normal fueron analizadas mediante la prueba t de Student para verificar la probabilidad de su independencia. En ambos casos se informa la probabilidad a niveles de significación del 95% y 99%.
En el ámbito del análisis bioinformático, primeramente se utilizó el programa Seqscape (AppliedBiosystems) para evaluar los electroferogramas obtenidos del procedimiento de secuenciación. Además, se empleó Clustal X v2.0.524 para alinear las secuencias. Para la construcción de árboles filogenéticos se usó el programa MrBayes v3.2 y MEGA 5.025-27. Para el análisis filogeográfico y su visualización, se recurrió al paquete Beast28 y al programa SPREAD (Spatial Phylogenetic Reconstruction of Evolutionary Dynamics)29.
El estudio fue evaluado y aprobado el 13 de junio de 2014 por el Comité de Ética en 1nvestigación del Hospital El Cruce Néstor C. Kirchner de Florencio Varela, bajo el título del proyecto presentado a la Comisión Salud 1nvestiga: "Enfermedades transmisibles en menores de 15 años: análisis territorial de la vulnerabilidad a infecciones respiratorias graves en la Región Sanitaria V1 de la provincia de Buenos Aires mediante la integración de determinantes socio-sanitarios y trazadores moleculares del virus sincitial respiratorio".
RESULTADOS
La recolección y reclutamiento de pacientes dio comienzo el 7 de junio de 2014 y finalizó el 7 de julio de 2015. Los datos de las encuestas fueron cargados en un archivo Excel, que recopiló todas las preguntas e información de manera procesable.
Del total de las 1 296 muestras obtenidas, 1193 fueron sometidas al estudio de 1F para detección de virus respiratorios. En las Figuras 1 y 2 se describen los estadísticos para agentes detectados y edades de los pacientes.

FIGURA 1. Etiología viral (técnica de inmunofluorescencia), niños hospitalizados con IRAB, GBA, zona VI, 2014-2015. N=317

FIGURA 2. Comparación de edades según resultados de inmunofluorescencia para virus, pacientes internados por IRAB, GBA Zona VI, 2014-2015.
En la Figura 1 se describe la etiología viral para las muestras positivas para IF, los valores son expresados como porcentajes sobre un total de 317 muestras positivas para virus, con los siguientes valores absolutos: VSR, 266 muestras positivas; adenovirus, 2 muestras positivas; parainfluenza 1, 4 muestras positivas; parainfluenza 2, 1 muestra positiva; parainfluenza 3, 21 muestras positivas; metapneumovirus, 16 muestras positivas; Influenza A, 7 muestras positivas. Se hallaron diferencias significativas (p<0,001) entre las edades de los pacientes con resultado negativo para IF y aquellos con IF+ para VSR y entre los IF- y aquellos con IF+ para los parainfluenzavirus (ver Figura 2). Asimismo, se encontraron diferencias no significativas entre los pacientes infectados por VSR y aquellos infectados por el resto de los agentes virales (ver Figura 2).
En la Figura 3 se representan los datos obtenidos de frecuencia (n) en relación con el mes de ocurrencia de las infecciones. Se observó la típica estacionalidad de VSR en meses fríos y una tendencia a la aparición primaveral de los demás paramixovirus detectados en este estudio (metapneumovirus y parainfluenzavirus 1-3).
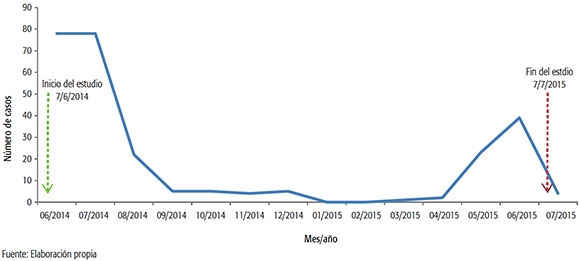
FIGURA 3. Estacionalidad, número de casos positivos para Virus Sincitial Respiratorio por mes entre niños hospitalizados por IRAB, zona VI, 2014-2015.
En lo que respecta a los datos perinatológicos, no se hallaron diferencias significativas entre diferentes agentes etiológicos virales para retraso de crecimiento intrauterino e internaciones neonatales, así como prematurez, peso al nacer, score de apgar, índice de Bierman Pierson, gravedad al ingreso y otras morbilidades maternas. Sin embargo, la serología materna para VIH resultó positiva en el 1,1% de los casos de infecciones virales positivas por IF (n=288) contra 0,3% del total de negativos (n=800), aunque las frecuencias observadas (y esperadas) son muy bajas (<5), por lo que el test estadístico no es aplicable por baja sensibilidad. Habiendo restringido a menores de 12 meses el análisis del ítem lactancia materna exclusiva, este aparece en un porcentaje significativamente menor en los pacientes con infección por VSR (y con etiología viral en general) que en los que resultaron negativos para IF de virus respiratorios (68,8% frente a 75,9%, p<0,05 en prueba de chi cuadrado). Asimismo, se registró un menor porcentaje de pacientes con el plan de vacunación completo en los pacientes con 1F+ para VSR (o con etiología viral en general) que en los que resultaron negativos para virus por 1F (53,6% frente a 68%, p<0,001 en prueba de chi cuadrado), con un resultado similar obtenido con vacunación antigripal individualmente.
En cuanto a los antecedentes patológicos, se encontraron diferencias significativas entre los niveles de desnutrición y antecedentes de broncoespasmos a repetición entre las poblaciones VSR positivas y negativas, con mayores porcentajes para VSR negativos (8,4% frente a 4,2%, p<0,001 para desnutrición y 47,3% frente a 27,3% para broncoespasmo a repetición), lo que probablemente esté relacionado con factores predisponentes o con otras co-morbilidades. Lo propio ocurrió con cardiopatías congénitas, inmunodeficiencias y fibrosis quística, que presentaron valores mayores para VSR negativos.
Los resultados socio-demográficos no reflejaron diferencias significativas entre los porcentajes de muestras con VSR+ y - en variables dirigidas a establecer calidad de la vivienda, como tipo de calle, tipo de piso, agua de consumo, disposición de excretas y tipo de calefacción. Con respecto a la ubicación de la vivienda, se observó un porcentaje mayor de pacientes con domicilio en villas de emergencia entre los VSR positivos que en los negativos (5,29% frente a 3,75%) aunque esta diferencia es poco significativa analizada mediante chi cuadrado. En referencia a la calefacción que provoca exposición al humo (gas, lena, kerosene) frente a la generada por electricidad (aires acondicionados y estufas), se observó para los VSR+ un 41,7% y 58,3% y, en el caso de los VSR-, 39,7% y 60,3%, respectivamente, sin diferencias significativas. Tampoco hubo grandes disparidades entre ambos al considerar si la madre o padre era fumador/a. Con respecto a los convivientes (número de personas, fumadores y niños menores de 10 años), no se hallaron diferencias significativas. Sin embargo, al considerar el número de personas por habitación, se observó un aumento en los porcentajes de VSR+ respecto a los negativos a partir de las tres personas por habitación, y esta relación resultó significativamente mayor para pacientes con VSR+ que para - (2,86% frente a 2,67%, p<0,05, test de Student). También se observaron diferencias cualitativas en el nivel educativo materno, sobre todo en el nivel medio.
Se realizaron las secuencias del gen de la proteína G para 168 muestras, y mediante análisis filogenético se determinó una predominancia del subtipo B por sobre el A (112 frente a 56). Los linajes genéticos cocirculantes fueron ON1 para VSR subtipo A y BA9 y BA10 para el subtipo B (Tabla 1). Los análisis filogeográficos demostraron que existía una circulación a distintos niveles: global, regional y local. Se observó que el origen de algunas cepas analizadas en este estudio presentaban ancestros de circulación local, mientras que otras habían sido originadas por ancestros ingresados al país en años previos. Por otro lado, se caracterizó la transmisión espacio-temporal de las cepas locales, las cuales en todos los casos partieron desde un área relativamente restringida ubicada en zonas del oeste de Lomas de Zamora y este de Almirante Brown y Lanús. Independientemente del clado estudiado, los sitios desde donde se originan las dispersiones coinciden aproximadamente como se observa en la Figura 4 en la cual se ilustran las localizaciones de los ancestros comunes más recientes (MRCA) para los clados hallados de VSR según los resultados del análisis filogeográfico. Se trata de distritos de alta densidad poblacional y características de alta criticidad en cuanto a vivienda y hacinamiento. Posteriormente, cepas derivadas de éstas se dispersaron hacia el norte, sudeste y sudoeste (Ver Figura 5 en anexo electrónico http://rasp.msal.gov.ar/rasp/articulos/volumen32/anexo1_castello.pdf) visualizándose un patrón de transmisión que sigue aproximadamente las regiones más pobladas y las vías de transporte que las conectan independientemente del clado del cual se trate.
TABLA 1. Análisis filogenéticos de las cepas circulantes en zona VI durante 2014 y 2015.


FIGURA 4. Puntos de origen para la dispersión de cepas de VSR según el estudio filogeográfico en relación con la densidad poblacional.
DISCUSIÓN
Dado que se estudió una población de pacientes seleccionados por una presentación clínica compatible con IRAB cuya severidad requirió internación, cabe destacar ciertas características diferenciales entre la parte de la población que resultó positiva y negativa para etiología viral. La etiología viral aparece asociada significativamente a edades menores, hacinamiento, ubicación de vivienda crítica y vacunación incompleta y, menos fuertemente, a menor lactancia materna exclusiva, ciertas serologías y nivel educativo materno. Los casos con IF negativa para virus respiratorios se asocian significativamente con antecedentes de broncoespasmos a repetición (otros, como cardiopatías congénitas, inmunosupresión o desnutrición, presentaron tendencias similares pero con un n muy bajo para ser analizados estadísticamente). Los rangos etarios superiores y los antecedentes compatibles con alergia u otras patologías evidencian probablemente etiologías infecciosas no virales o complicaciones asmáticas.
Con relación al hábitat, se observó que las viviendas de los pacientes con IRAB reclutados en este estudio están por debajo de los porcentajes establecidos como promedio para la región. En particular, los pacientes con infección por VSR cuentan con agua de red y cloacas en un 60% y un 24%, respectivamente, lo cual es un indicador de su mayor vulnerabilidad en cuanto a riesgo sanitario. El hacinamiento contribuye a la transmisión de las infecciones mediante gotas de secreciones, y su asociación con el riesgo de hospitalización por infección severa por VSR ha sido reportado previamente30. En este estudio se observa una asociación con infección por VSR a medida que aumenta la relación del número de personas por habitación. El nivel de 1 y 2 personas por habitación registra un mayor porcentaje de resultados negativos en la IF, situación que se revierte a partir de 3 personas.
En referencia a la posible exposición al humo que provocan las calefacciones de gas, la lena y el kerosene, se observa que para los VSR positivos este tipo de calefacción es de uso más frecuente que para los negativos para virus (41,7% frente a 39,7%). En el caso de la calefacción eléctrica (aires acondicionados y estufas), esta relación se invierte y resulta menor en los VSR (58,3% frente a 60,3%). Si bien esto se condice con la asociación existente entre la exposición a la contaminación aérea doméstica y las infecciones respiratorias agudas31, las diferencias no llegan a ser significativas en este estudio, lo que refleja probablemente una población control compuesta por pacientes con la misma presentación clínica y en muchos casos con asma bronquial, que frente a la exposición al humo sería afectada de forma similar.
Al relacionar los niveles educativos de las madres de los niños con IRAB estudiados con la detección de VSR y las muestras con IF negativas, se observó una tendencia a menores niveles educativos en la población con VSR positivo, siendo más patente este sesgo cuando se compara en el rango de niveles por debajo del nivel secundario completo. Este patrón se correlaciona con reportes previos, que hallan una asociación de menores niveles educativos de las madres con un incremento en el riesgo de hospitalización y mortalidad por IRAB32.
Los estudios filogenéticos permitieron caracterizar por primera vez las variantes circulantes en esta región y sus relaciones locales y externas. Las investigaciones filogeo-gráficas sugieren que la densidad poblacional alta en áreas de recursos limitados (villas de emergencia) y el hacinamiento son factores determinantes para la iniciación de la dispersión de VSR.
RELEVANCIA PARA POLÍTICAS E INTERVENCIONES SANITARIAS
La internación de niños y lactantes con presentación respiratoria severa compatible con IRAB puede obedecer a etiologías muy disímiles. En la población en estudio se hallaron características diferenciales entre las poblaciones afectadas por etiología viral y los pacientes negativos, lo cual podría servir como guía en la práctica para orientar las causas de una presentación tipo IRAB. Los estudios filogeográficos ubicaron consistentemente orígenes de dispersión de distintas cepas en zonas densamente pobladas, que incluyen áreas de nivel socioeconómico bajo y con deficiencias en lo habitacional y en servicios. Los resultados obtenidos sugieren que la conjugación de estos factores con altos niveles de hacinamiento son determinantes para la iniciación de la dispersión de VSR. Esta información podría ayudar a establecer la población primaria blanco para planes de vacunación u otras medidas de intervención en medicina preventiva.
RELEVANCIA PARA LA FORMACIÓN DE RECURSOS HUMANOS EN SALUD
Este estudio puede ser utilizado como referencia para relacionar la bibliografía existente con los resultados obtenidos en la población que es asistida cotidianamente por el personal a formar en servicios hospitalarios. El uso de una población control diferente a una población sana (negativos para IF) permite debatir los distintos resultados en uno y otro tipo de estudio. Finalmente, los hallazgos originales que se presentan inducen a profundizar la discusión con nuevas propuestas dirigidas a continuar la investigación.
RELEVANCIA PARA LA INVESTIGACIÓN EN SALUD
Ciertas observaciones de este trabajo ameritan estudios adicionales para confirmarlas con mayor número de casos (asociaciones con conductas de lactancia, cumplimiento de esquemas de vacunación y antecedentes infectológicos maternos). En el aspecto molecular, si bien los datos de secuencia y desplazamiento de cepas permiten obtener interesantes conclusiones, se debe continuar el análisis de los resultados y el estudio del ensamblaje entre determinantes de vulnerabilidad y datos de diseminación de cepas. En parte, el estudio fue disenado para incluir todas las edades pediátricas con el objeto de individualizar casos tempranos y severos de infección por VSR que pudieran funcionar como diseminadores eficientes y/o tempranos durante el brote epidémico. En virtud de esta lógica, se deberán estudiar especialmente los pocos casos de individuos de edades mayores a la típica. Es posible que los pacientes en cuestión tengan algún tipo de susceptibilidad particular y que actúen como reservorios entre temporadas o diseminadores eficientes de VSR. Los datos de secuencia de estos aislados -en conjunto con el resto de los datos demográficos y epidemiológicos y los estudios filogeográ-ficos- podrían aclarar este punto.
DECLARACIÓN DE CONFLICTO DE INTERESES: No hubo conflicto de intereses durante la realización del estudio.
1. Bengulgul Y, et al. (Ed.) Washington DC: Organización Panamericana de la Salud; 1997. [ Links ]
2. Shay D.K., et al. Bronchiolitis-Associated Hospitalizations among US Children, 1980-1996. JAMA. 1999;282:1440-1446. [ Links ]
3. Weissenbacher M, et al. Etiologic and Clinical Evaluation of Acute Lower Respiratory Tract Infections in Young Argentinean Children: An Overview. Rev Infect Dis. 1990;12:S889-S898. [ Links ]
4. Straliotto SM, et al. Viral Etiology of Acute Respiratory Infections among Children in Porto Alegre, 28. RS, Brazil. Rev Soc Bras Med Trop. 2002;35:283-291. [ Links ]
5. Viegas M, et al. Respiratory Virus Seasonality in Children under Five Years of Age in Buenos Aires, Argentina: A Five-Year Analysis. J Infect. 2004;49:222-228. [ Links ]
6. Gardner PS. Respiratory Syncytial Virus Infections. Postgrad Med J. 1973;49:788-791. [ Links ]
7. Murry AR, Dowell SF. Respiratory Syncytial Virus: Not Just for Kids. Hosp Pract. 1997;32(7):87-88, 91-94, 98 passim [ Links ]
8. Cooper DL, et al. The Contribution of Respiratory Pathogens to the Seasonality of NHS Direct Calls. J Infect. 2007;55:240-248. [ Links ]
9. Graman PS and Hall CB. Epidemiology and control of nosocomial viral infections. Infect Dis Clin North Am 1989;3:815-841. [ Links ]
10. Hall CB, et al. Nosocomial Respiratory Syncytial Virus Infections. N Engl J Med. 1975;293:1343-1346. [ Links ]
11. Bont L. Nosocomial RSV Infection Control and Outbreak Management. Paediatr Respir Rev. 2009;10(1):16-17 [ Links ]
12. Collins PL and Karron R. Respiratory Syncytial Virus and Metapneumovirus. En: Knipe D, Howley P (Ed.). Fields Virology. Filadelfia: LWW; 2013. [ Links ]
13. Hall CB, et al. Immunity to and Frequency of Reinfection with Respiratory Syncytial Virus. J Infect Dis. 1991;163:693-698. [ Links ]
14. Kim YK, et al. Genetic Variability of the Fusion Protein and Circulation Patterns of Genotypes of the Respiratory Syncytial Virus. J Med Virol. 2007;79:820-828. [ Links ]
15. Anderson L, et al. Antigenic Characterization of Respiratory Syncytial Virus Strains with Monoclonal Antibodies. J Infect Dis. 1985;151:626-633. [ Links ]
16. Cristina J, et al. Analysis of Genetic Variability in Human Respiratory Syncytial Virus by the RNase A Mismatch Cleavage Method: Subtype Divergence and Heterogeneity. Virology. 1990;174:126-134. [ Links ]
17. Sullender W. Respiratory Syncytial Virus Genetic and Antigenic Diversity. Clin Microbiol Rev. 2000;13(1):1-15. [ Links ]
18. Cane PA. Molecular Epidemiology of Respiratory Syncytial Virus. Rev Med Virol. 2001;11(2):103-116. [ Links ]
19. Zlateva K, et al. Subgroup Prevalence and Genotype Circulation Patterns of Human Respiratory Syncytial Virus in Belgium during Ten Successive Epidemic Seasons. J Clin Microbiol. 2007;45:3022-3030. [ Links ]
20. Viegas M. and Mistchenko AS. Molecular Epidemiology of Human Respiratory Syncytial Virus Subgroup A over a Six-Year Period (1999-2004) in Argentina. J Med Virol. 2005;77(2):302-310. [ Links ]
21. Trento A, Viegas M, et al. Natural History of Human Respiratory Syncytial Virus Inferred from Phylogenetic Analysis of the Attachment (G) Glycoprotein with a 60-Nucleotide Duplication. J Virol. 2006;80:975-984. [ Links ]
22. Cane PA, Pringle CR. Evolution of Subgroup A Respiratory Syncytial Virus: Evidence for Progressive Accumulation of Amino Acid Changes in the Attachment Protein. J Virol. 1995;69:2918-2925. [ Links ]
23. Melero JA, et al. Antigenic Structure, Evolution and Immunobiology of Human Respiratory Syncytial Virus Attachment (G) Protein. J Gen Virol. 1997;78(10):2411-2418. [ Links ]
24. Larkin MA, et al. Clustal W and Clustal X Version 2.0. Bioinformatics. 2007;23:2947-2948. [ Links ]
25. Rozas J, et al. DnaSP, DNA Polymorphism Analyses by the Coalescent and other Methods. Bioinformatics. 2003;19:2496-2497 [ Links ]
26. Tamura K, et al. MEGA5: Molecular Evolutionary Genetics Analysis Using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Mol Biol Evol. 2011;28(10):2731-2739. [ Links ]
27. Huelsenbeck JP, Ronquist F. Bayesian Inference of Phylogenetic Trees. Bioinformatics. 2001;17:754-755. [ Links ]
28. Drummond J, Rambaut A. BEAST: Bayesian Evolutionary Analysis by Sampling Trees. BMC Evol Biol. 2007;7:214-222. [ Links ]
29. Bielejec F, et al. SPREAD: Spatial Phylogenetic Reconstruction of Evolutionary Dynamics. Bioinformatics. 2011;27(20):2910-2912. Doi: 10.1093/bioinformatics/btr481. [ Links ]
30. Colosia AD, et al. Residential crowding and severe respiratory syncytial virus disease among infants and young children: a systematic literature review. BMC Infect Dis. 2012;12:95. [ Links ]
31. Chauhan AJ, Johnston SL. Air Pollution and Infection in Respiratory Illness. Br Med Bull. 2003;68(1):95-112. [ Links ]
32. Bauer G, et al. Infección por virus sincicial respiratorio en poblaciones vulnerables: riesgo biológico contra riesgo social. Arch Argent Pediatr. 2005;103(3):198-204. [ Links ]














