Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Argentina de Salud Pública
versión impresa ISSN 1852-7513versión On-line ISSN 1853-810X
Rev. argent. salud pública vol.8 no.33 Buenos Aires dic. 2017
REVISIONES
Informe de Evaluación de Tecnología Sanitaria y metaanálisis: comparación entre las formas farmacéuticas de tacrolimus
Health Technology Assessment Report and Meta-Analysis: Comparison among Pharmaceutical Forms of Tacrolimus
Verónica Sanguine1, Silvia Chaves1, Giselle Balaciano1
1. Dirección de Calidad en Servicios de Salud, Ministerio de Salud de la Nación, Argentina.
El tratamiento inmunosupresor es uno de los pilares del éxito luego de un trasplante de órganos. El tacrolimus (fármaco de la familia de los inhibidores de la calcineurina) es una de las drogas más utilizadas luego de un trasplante. La hipótesis de que la forma farmacéutica de liberación prolongada es superior a la de liberación inmediata, de uso habitual, es analizada en el presente trabajo.
PALABRAS CLAVE: Tacrolimus - Rechazo de Injerto - Preparaciones de Acción Retardada - Inmunosupresión
KEY WORDS: Tacrolimus - Graft Rejection - Delayed-Action Preparations - Immunosuppression
INTRODUCCIÓN
Se estima que cada año se realizan más de 100 000 trasplantes de órganos a nivel mundial1. La escasez de órganos es la limitación más significativa para la realización de trasplantes1. En la evolución natural de los pacientes trasplantados, el rechazo agudo se considera un factor predictor de pérdida del injerto. En la actualidad, los índices de rechazo agudo se encuentran en el orden del 10% en un año2.
En el caso del tratamiento inmunosupresor post-trasplante, su complejidad y la necesidad de sostenerlo de por vida son factores que atentan contra la continuidad y adherencia. A su vez, la mala adherencia al tratamiento constituye un factor de riesgo prevenible de rechazo3.
El tacrolimus pertenece al grupo de inmunosupresores inhibidores de la calcineurina, que inhiben la formación de linfocitos citotóxicos, principales responsables del rechazo del injerto. Se encuentra indicado tanto para la profilaxis del rechazo de trasplantes de órganos sólidos como para el tratamiento del rechazo de los injertos en caso de resistencia a otros medicamentos4.
Los posibles efectos adversos incluyen riesgo de infecciones en general y oportunistas. En particular, con el tacrolimus se describen: aumento del riesgo de miocardiopatía hipertrófica, alteraciones linfoproliferativas, insuficiencia renal, hiperglucemia, diabetes, hipertensión arterial, alteraciones de la función hepática, etc4.
El precio de venta al público al día 1 de febrero de 20175 para tacrolimus forma farmacéutica de liberación prolongada (FFLP) era de $2805,55 (0,5 mg) y de $4281,51 (1 mg); para tacrolimus forma farmacéutica de liberación inmediata (FFLI), oscilaba entre $2372,66 y $2468,92 para la presentación de 50 mg (todos por 50 cápsulas).
Se ha argumentado que la FFLP presenta mejores resultados clínicos porque tiene menor tasa de abandono del tratamiento debido a la mayor comodidad para el paciente. El objetivo de este trabajo fue comparar la efectividad y seguridad de ambas formas farmacéuticas. Se buscó determinar si el tratamiento con tacrolimus FFLP es efectivo y seguro en comparación con tacrolimus FFLI en términos de sobrevida global al final del seguimiento, sobrevida del injerto al final del seguimiento, rechazo agudo probado por biopsia o enfermedad de injerto contra huésped y calidad de vida del paciente, así como respecto a enfermedad renal crónica al final del seguimiento, diabetes de diagnóstico posterior al trasplante (que requiera tratamiento médico con insulina y/o hipoglucemiantes orales) e hipertensión arterial de novo.
MÉTODOS
Se definieron operativamente los resultados en salud de la siguiente manera:
• Sobrevida del paciente: Número de pacientes que siguen vivos desde el trasplante hasta el fin del seguimiento, o hasta la fecha del último control.
• Sobrevida del Injerto: Desde la fecha del trasplante hasta la fecha del diagnóstico de falla irreversible del injerto, o hasta la fecha del último control con injerto funcionante. En caso de muerte del paciente, esto no se analizó como falla del injerto, sino que se consideró la muerte como dato censurado6.
• Rechazo de injerto confirmado por biopsia: Al final del seguimiento y/o enfermedad de injerto contra huésped7.
• Hipertensión arterial de novo: Hipertensión arterial probablemente relacionada con el tratamiento inmunosupresor.
• Diabetes de diagnóstico post-trasplante: Glucosa plasmática en ayunas mayor o igual a 126 mg/dl, hemoglobina glicosilada: HbAlc, mayor a 6,5% al menos 3 meses luego de la randomización, requerimiento de insulina por 30 días o más, o necesidad de un agente hipoglucemiante oral, en pacientes sin historia previa de diabetes8.
• Enfermedad renal crónica al final del seguimiento: Volumen de filtrado glomerular menor a 60 ml/min/1,73 m2 por tres meses o más, independientemente de la causa, y valores de aclaramiento de creatinina y de creatinina sérica.
• Calidad de vida y apego al tratamiento.
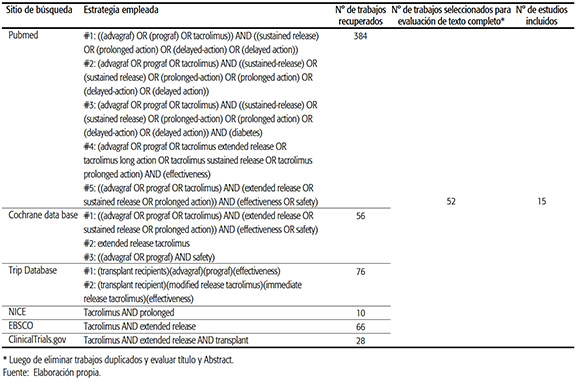
La búsqueda sistemática de evidencia científica fue realizada por dos revisoras de manera independiente en Medline, Cochrane, Trip Database, EBSCO, N1CE y clinicaltrials.gov.
Se incluyeron ECA en inglés, español, francés y portugués, con datos sobre los desenlaces enunciados. Se excluyeron textos que estaban en otro idioma o que aportaban datos sobre desenlaces exclusivamente farmacocinéticos. Adicionalmente se revisaron las referencias de los estudios incluidos, a fin de identificar trabajos no evaluados. Para obtener mayor sensibilidad, no se utilizaron filtros temporales o por estado de publicación.
El detalle de las estrategias empleadas y el resultado de la búsqueda se sintetizan en la Tabla 1.
TABLA 1. Estrategia y resultados de búsqueda.
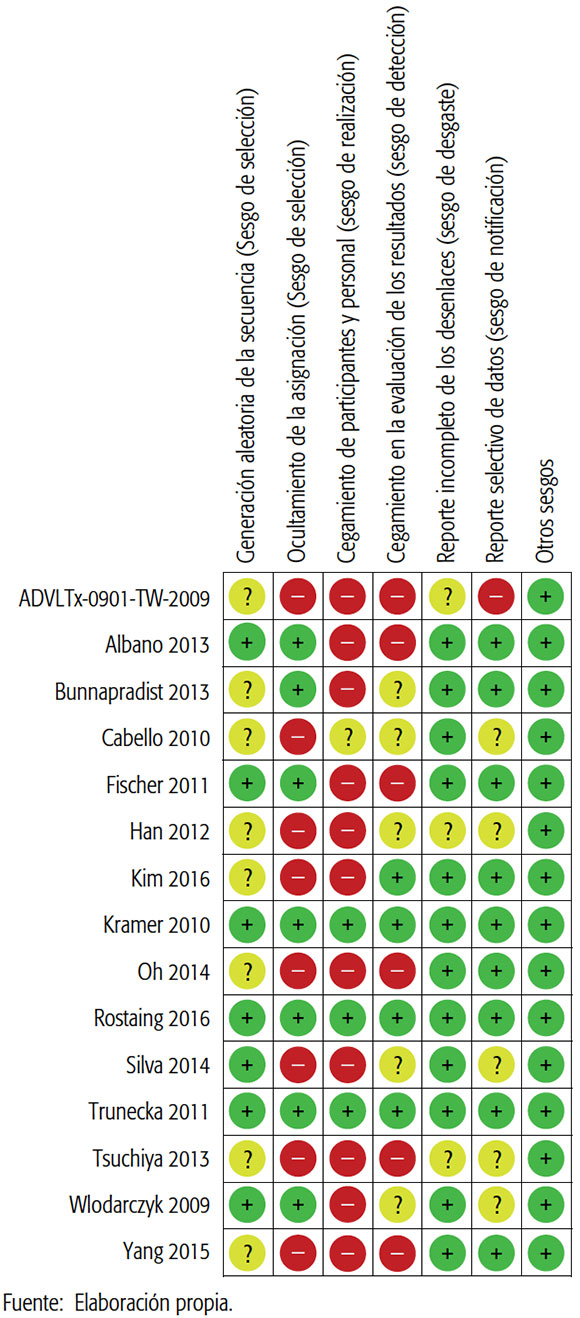
La valoración del riesgo de sesgos fue realizada de manera independiente por dos revisoras usando la herramienta propuesta por el Manual Cochrane para los estudios individuales. Los desacuerdos se resolvieron mediante la evaluación de una tercera revisora. La valoración de la calidad del cuerpo de la evidencia para cada desenlace, en tanto, se realizó siguiendo los postulados del grupo GRADE.
El análisis de los datos se llevó a cabo usando el software del grupo GRADE, de acceso libre.
RESULTADOS
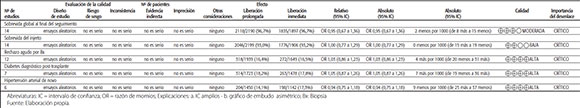
Se incluyó un total de 15 ECA, que consignaron información proveniente de 4131 pacientes. Los estudios fueron: Kim 20163, Bunnapradist 20138, Albano 20139, Cabello 201010, Wlodarczyk 200911, Fischer 201212, Han 201213, Kramer 201014, Tedesco Silva 201415, Tsuchiya 201316, Yang 201517, Rostaing 201618, Oh 201419, Trunecka 201020 y ADVLTx-0901-TW (finalizado en 2010, no publicado)21. (Tabla 2)
TABLA 2. Evaluación del riesgo de sesgos de los estudios Individuales.
La síntesis de los resultados se llevó a cabo mediante la realización de metaanálisis en los puntos finales en los que esto se consideró adecuado (1 a 5), utilizando el programa de la Colaboración Cochrane: Review Manager versión 5.3. En el caso de los desenlaces para los cuales no fue posible realizar una combinación de los datos (5 y 6), el análisis fue descriptivo. (Tablas 3A, 3B, 3C y 4A, 4B)
TABLA 3A. Sobrevida del paciente al final del seguimiento.
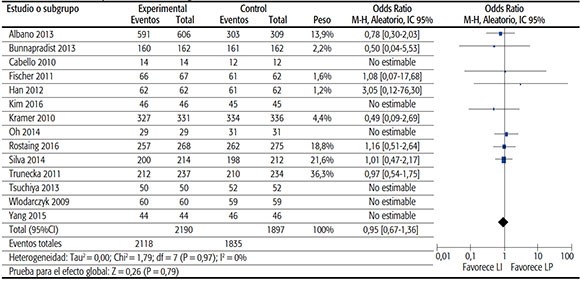
TABLA 3B. Sobrevida del injerto al final del seguimiento.
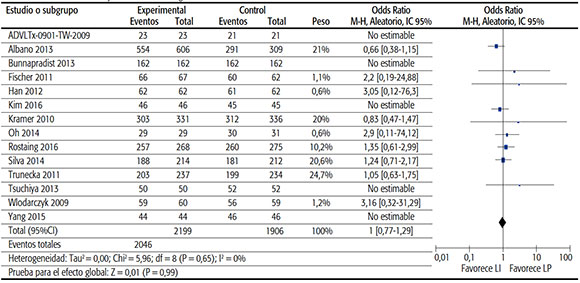
TABLA 3C. Rechazo agudo probado por biopsia.

TABLA 4A. Diabetes de diagnóstico post-transplante.
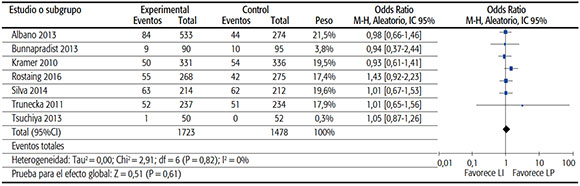
TABLA 4B. Hipertensión arterial de novo.

• Sobrevida global: Se incluyeron datos de 14 estudios. Este análisis incluyó un total de 4087 pacientes, con una sobrevida global de 96%. La medida de efecto sumaria OR (Odds Ratio) fue de 0,95 (IC95% de 0,67 a 1,36; p 0,79), lo que muestra que la diferencia entre ambos grupos no resultó estadísticamente significativa.
• Sobrevida del injerto al final del seguimiento: Se incluyeron datos de 14 estudios con un total de 4105 pacientes, que presentaron globalmente una sobrevida del injerto del 93%. La medida de efecto sumaria OR fue de 1 (IC95% de 0,77 a 1,29; p 0,99), es decir, en la población estudiada la diferencia del efecto entre las dos formas farmacéuticas no resultó significativa.
• Rechazo agudo probado por biopsia: Se incluyeron datos de 12 estudios con un total de 3588 pacientes, que presentaron globalmente una frecuencia de rechazo de 16%. La medida de efecto sumaria OR fue de 1,04 (IC95% de 0,86 a 1,24; p 0,71), lo que indica un nivel no significativo estadísticamente.
• Diabetes diagnosticada post-trasplante: Para el análisis de este punto final se incluyeron 7 estudios con datos de 3201 pacientes, que presentaron en conjunto una frecuencia de diabetes post-trasplante de 18%. La medida de efecto sumaria OR fue de 1,05 (IC95% de 0,87 a 1,26; p 0,61), es decir, no fue significativamente diferente entre los grupos.
• Hipertensión arterial: Para evaluar la hipertensión arterial de comienzo luego del trasplante como efecto adverso, se incluyeron los datos de 6 estudios con un total de 2592 pacientes. La frecuencia promedio de hipertensión arterial fue de 15,5%. La estimación sumaria mostró un OR de 0,94 (IC95% 0,75 a 1,18; p 0,61). No se detectó una diferencia estadísticamente significativa entre ambos grupos.
• Función renal/enfermedad renal crónica: El impacto sobre la función renal fue reportado en 13 de los estudios incluidos. Los métodos y definiciones utilizados para caracterizar este desenlace fueron heterogéneos entre los trabajos, por lo que se consideró inapropiado sintetizar los resultados mediante la realización de un metaanálisis. En ninguno de los estudios valorados se reportó una diferencia estadísticamente significativa en la función renal.
• Calidad de vida y apego al tratamiento: Fueron evaluados en el estudio de Yang 17. Los pacientes fueron encuestados utilizando el cuestionario Short Form-36 (SF-36) y el Subject Questionnaire (SQ). El cumplimiento del tratamiento se evaluó en cada visita. Los resultados del cuestionario SF-36 mostraron que la variación en relación con la línea de base entre la semana 0 y la 24 fue significativamente diferente (p=0,027) a favor de la forma de liberación inmediata solamente en el dominio de vitalidad. En todos los demás dominios la variación no fue significativa desde el punto de vista estadístico. Los resultados del cuestionario SQ no fueron estadísticamente diferentes para ninguno de los dominios.
En cuanto a la adherencia al tratamiento, no fue significativa la diferencia entre grupos.17
En el estudio de Albano se evaluó la calidad de vida reportada por los pacientes mediante el cuestionario EQ-5D, y no se hallaron diferencias significativas entre las ramas tratadas. La adherencia al tratamiento fue evaluada a través de la escala de adherencia a la medicación de Morisky, con un nivel similar (60-63%) en ambos grupos9.
En el estudio de Oh19 se evaluó la adherencia al tratamiento mediante la escala de barreras a la terapia inmu-nosupresora. La diferencia en los grupos incluidos no fue significativa desde el punto de vista estadístico.
La tabla 5 sintetiza el análisis de resultados de la evidencia encontrada, organizando los datos por desenlace y la evaluación de la calidad del conjunto de la evidencia para cada desenlace.
Tabla 5. Resumen de resultados GRADE.
Se realizó una búsqueda sobre la aprobación y las políticas de cobertura de la FFLP de tacrolimus, que hasta 2012 había sido autorizada para su comercialización en 69 países22.
• ANMAT (Administración Nacional de Medicamentos, Alimentos y Tecnología Médica): El tacrolimus FFLP fue aprobado en abril de 2008 en sus presentaciones de 0,5, 1 y 5 mg (Prograf XL, Laboratorio Gador SA)23.
• ANV1SA (Agencia Nacional de Vigilancia Sanitaria) (Brasil): Se aprobó la comercialización de tacrolimus FFLP en abril de 200724.
• FDA (Food and Drug Administration, EE.UU.): Una revisión clínica de 2012 concluyó que tacrolimus FFLP provee una protección contra el rechazo del injerto comparable a FFL1, con un perfil de seguridad comparable22.
• HAS (Haute Autorité de Santé, Francia): Desde 2008 la FFLP se incluye en la lista de medicamentos reembolsados por el Seguro Nacional y en la lista aprobada para el uso en hospitales y servicios públicos25.
• NICE (National Institute of Clinical Excellence, Reino Unido): No se encontraron reportes de evaluación de efectividad y seguridad de las dos formas farmacéuticas de tacrolimus.
• Scottish Medicines Consortium (Escocia): Realizó en 2015 una evaluación de datos de efectividad provistos por el fabricante. Recomienda el uso de la FFLP en pacientes adultos, considerándolo adecuado para quienes tienen indicado un tratamiento con tacrolimus. Señala que los costos por dosis son equivalentes a la FFL126.
DISCUSIÓN
De acuerdo con los datos analizados para el punto final crítico "sobrevida global", la abundante evidencia de calidad moderada no detectó una diferencia significativa entre los grupos. Existe una confianza moderada en que el verdadero efecto se encuentra muy cercano al valor reportado en este análisis, aunque cabe la posibilidad de que el verdadero efecto sea diferente.
Para el punto final crítico "sobrevida del injerto" existe abundante evidencia de baja calidad, cuyo análisis encontró que la diferencia no era significativa. Se registra una baja confianza en este resultado, ya que el verdadero podría ser muy diferente al reportado en el análisis.
Para el desenlace crítico "rechazo agudo probado por biopsia", una gran cantidad de evidencia determinó que el efecto de tacrolimus FFLP y el de tacrolimus FFLI no eran diferentes desde el punto de vista estadístico. El cuerpo de la evidencia en este punto final fue de alta calidad. Esto significa que existe una elevada confianza en que el verdadero efecto se encuentre muy próximo al reportado en este análisis.
En el caso del punto final "diabetes de diagnóstico posterior al trasplante" se encontró una moderada cantidad de evidencia, que mostró que la diferencia no era estadísticamente significativa. Esta evidencia se valoró como de calidad alta, lo que implica una confianza elevada en que el verdadero efecto se encuentre muy próximo al consignado en este estudio.
Finalmente, en el caso del desenlace "hipertensión arterial de novo", una moderada cantidad de evidencia mostró que la diferencia no era significativa desde el punto de vista estadístico. Es sumamente probable que el verdadero efecto se encuentre muy próximo al reportado en este análisis, es decir, se puede tener alta confianza en este efecto estimado.
Es importante recalcar que la mayoría de los estudios presenta un tiempo de seguimiento relativamente breve (de 6 meses a 4 años). Esto podría disminuir la confianza de los efectos reportados.
De acuerdo con la evidencia y el análisis realizado, la efectividad y la seguridad de tacrolimus de ambas formas farmacéuticas no son diferentes desde el punto de vista estadístico para ninguno de los resultados considerados. La elección de una u otra forma farmacéutica debe basarse en otros criterios, como la preferencia de los pacientes o los costos asociados.
DECLARACIÓN DE CONFLICTO DE INTERESES: No hubo conflicto de intereses durante la realización del estudio.
1. Memoria 2015. Incucai. 2015. [Disponible en: http://www.incucai.gov.ar/index.php/materiales-y-recursos/informes-estadisticos] [Último acceso: 03/01/2018]
2. Krisl J, Alloway R, Shield A, Govll A, Mogilishetty G, Cardl M, et al. Acute Rejection Clinically Defined Phenotypes Correlate with Long-Term Renal Allograft Survival. Transplantation. 2015;99:2167-2173. [ Links ]
3. Kim J, Kwon C, Joh J, Sinn D, Lee S, Cho G, et al. Conversion of Once-Daily Extended-Release Tacrolimus Is Safe in Stable Liver Transplant Recipients: A Randomized Prospective Study. Lver Transplantation. 2016;22:209-216. [ Links ]
4. Información para prescribir: Tacrolimus Sandoz -Sandoz Sociedad Anónima- y Prograf XL -Laboratorio Gador SA. Vademécum Nacional de Medicamentos. ANMAT. [Disponible en: https://servicios.pami.org.ar/vademecum/views/consultaPublica/listado.zul:] [Último acceso: 08/01/2018]
5. Vademécum Nacional de Medicamentos.ANMAT. [Disponible en: https:// servicios.pami.org.ar/vademecum/views/consultaPublica/listado.zul] [Último acceso: 04/01/2018]
6. IV.13 Analysis of Patient and Graft Survival. Nephrol Dial Transplant. 2002;17(supl. 4):60-67. doi: 10.1093/ndt/17suppl_4.60. [Disponible en: https://academic.oup.com/ndt/article/17/suppl_4/60/1813985/IV-13-Analysis-of-patient-and-graft-survival] [Último acceso: 04/01/2018]
7. Solez K, Colvin R, Racusen L, Haas M, Sis B, Mengel M, et al. Banff 07 Classification of Renal Allograft Pathology: Updates and Future Directions. American Journal of Transplantation. 2008;8:753-760. [ Links ]
8. Bunnapradlst S, Clechanowskl K, West-Thlelke P, Mulgaonkar S, Rostalng L, Vasudev B, et al. Conversion From Twice-Daily Tacrolimus to Once-Daily Extended Release Tacrolimus (LCPT): The Phase III Randomized MELT Trial. American Journal of Transplantation. 2013;13:760-769. [ Links ]
9. Albano L, Banas B, Klempnauer J, Glyda M, Vlkllcky O, Kamar N. OSAKA Trial: A Randomized, Controlled Trial Comparing Tacrolimus QD and BD in Kidney Transplantation. Transplantation. 2013;96:897-903. [ Links ]
10. Cabello M, García P, González-Mollna M, Diez de los Rios M, García-Sálz, Gutiérrez C, et al. Pharmacokinetics of Once- Versus Twice-Daily Tacrolimus Formulations ln Kidney Transplant Patients Receiving Expanded Criteria Deceased Donor Organs: A Single-Center, Randomized Study. Transplantation Proceedings. 2010;42:3038-3040. [ Links ]
11. Wlodarczyk Z, Squlfflet J, Ostrowski M, Rlgottl P, Steffonl S, Cltterlo F, et al. Pharmacokinetics for Once- Versus Twice-Daily Tacrolimus Formulations in De Novo Kidney Transplantation: A Randomized, Open-Label Trial. American Journal of Transplantation. 2009;9:2505-2513. [ Links ]
12. Fischer L, Trunecka P, Grldelll B, Roy A, Vitale A, Valdivieso A, et al. Pharmacokinetics for Once-Daily Versus Twice-Daily Tacrolimus Formulations in De Novo Liver Transplantation: A Randomized, Open-Label Trial. Lver Transpl. 2011;17:167-177 [ Links ]
13. Han D, Park J, Kim Y, Klm S, Ha J, Kim H, et al. A 39-Month Follow-up Study to Evaluate the Safety and Efficacy in Kidney Transplant Recipients Treated with Modified-Release Tacrolimus (FK506E)-Based Immunosuppression Regimen. Transplantation Proceedings. 2012;44:115-117 [ Links ]
14. Kramer B, Charpentier B, Backman L, Tedesco Silva H, Mondragon-Ramlrez G, Cassuto-Vlguler E, et al. Tacrolimus Once Dally (ADVAGRAF) Versus Twice Dally (PROGRAF) in De Novo Renal Transplantation: A Randomized Phase III Study. American Journal of Transplantation. 2010;10:2632-2643. [ Links ]
15. Tedesco Silva H, Yang H, Meler-Krlesche H, Croy R, Holman J, Fitzsimmons W, et al. Long-Term Follow-Up of a Phase III Clinical Trial Comparing Tacrolimus Extended-Release/MMF, Tacrollmus/MMF, and Cyclosporlne/MMF in De Novo Kidney Transplant Recipients. Transplantation. 2014;97:636-641. [ Links ]
16. Tsuchlya T, Ishlda H, Tanabe T, Shimizu T, Honda K, Omoto K, et al. Comparison of Pharmacokinetics and Pathology for Low-Dose Tacrolimus Once-Daily and Twice-Daily in Living Kidney Transplantation: Prospective Trial in Once-Daily Versus Twice-Daily Tacrolimus. Transplantation. 2013;96:198-204. [ Links ]
17. Yang S, Choi J, Cho W, Park J, Klm S. A Single Center, Open-Label, Randomized Pilot Study to Evaluate the Safety and Efficacy of Tacrolimus Modified Release, ADVAGRAF, Versus Tacrolimus Twice Daily, PROGRAF, in Stable Renal Recipients (SINGLE). Transplantation Proceedings. 2015;47:617-621. [ Links ]
18. Rostalng L, Bunnapradlst S, Grlnyó J, Clechanowskl K, Denny J, Tedesco Silva H, et al. Novel Once-Daily Extended-Release Tacrolimus Versus Twice-Daily Tacrolimus in De Novo Kidney Transplant Recipients: Two-Year Results of Phase 3, Double-Blind, Randomized Trial. Am J Kidney Dis. 2016;67(4):648-659. [ Links ]
19. Oh C, Huh K, Lee J, Cho H, Kim Y Safety and Efficacy of Conversion from Twice-Daily Tacrolimus to Once-Daily Tacrolimus One Month after Transplantation: Randomized Controlled Trial in Adult Renal Transplantation. Yonsei Med J. 2014;55(5):1341-1347 [ Links ]
20. Trunecka P, Boillot O, Seehofer A, Pinna A, Fischer L, Ericzon B, et al. Once-Dally Prolonged-Release Tacrolimus (ADVAGRAF) Versus Twice-Daily Tacrolimus (PROGRAF) in Liver Transplantation. American Journal of Transplantation. 2010;10:2313-2323. [ Links ]
21. ADVLTx-0901-TW. A Study to Compare Safety and Efficacy of Prograf + Myfortlc and Advagraf + Myfortlc in Liver Transplantation Patients. Estudio no publicado. [Disponible en: https://www.astellascllnlcalstudyresults.com/hcp/studyaspx?ID=84] [Último acceso: 04/01/2018]
22. Summary Review for Regulatory Action. FDA. 2013. [Disponible en: http://www.accessdata.fda.gov/drugsatfda_docs/label/2013/204096Orlg1s000SumR.pdf] [Último acceso: 04/01/2018]
23. Productos autorizados para comercialización. Monofármacos. ANMAT. 2008. [Disponible en: http://www.anmat.gov.ar/EspecMed/abril/especmed_monofarmacos_08.asp] [Último acceso: 04/01/2018]
24. Medicamento para transplantado tem aprovaçào da Anvlsa. Portal da Secretarla de Saúde do CE. ANVISA. 2008. [Disponible en: http://www.institutocanguru.org.br/artigos/reportagens_2008/25.pdf] [Último acceso: 04/01/2018]
25. Opinions on Drugs. ADVAGRAF Haute Autorité de Santé. 2009. [Disponible en: http://www.has-sante.fr/portail/jcms/c_642440/en/advagraf] [Último acceso: 04/01/2018]
26. tacrolimus (Envarsus). Scottish Medicines Consortium. 2015. [Disponible en: https://www.scottishmedicines.org.uk/SMC_Advice/Advice/1041_15_tacrolimus_Envarsus] [Último acceso: 04/01/2018]














