INTRODUCCIÓN
Los coronavirus son virus de ácido ribonucleico1. La infección con cuatro de las cepas de coronavirus más comunes suele causar cuadros leves y autolimitados del tracto respiratorio superior2. Sin embargo, otros coronavirus se asocian con el síndrome respiratorio agudo severo (SARS-CoV) y el síndrome respiratorio del Medio Oriente (MERS-CoV).
En marzo de 2020, la Organización Mundial de la Salud (OMS) declaró al brote de la enfermedad por el nuevo coronavirus (COVID-19) como una pandemia mundial. La COVID-19 es causada por el SARS-CoV-2, otra cepa de coronavirus. Hasta el 9 de agosto de 2020, se confirmaron más de 19,7 millones de casos en más de 216 países y áreas, con aproximadamente 729 000 muertes hasta el momento1.
Durante la epidemia de SARS-CoV de 2003, se administraron corticosteroides sistémicos como parte del tratamiento en pacientes infectados y que desarrollaron una enfermedad respiratoria grave. En un metaanálisis sobre el uso de corticosteroides en pacientes con SARS, sólo cuatro estudios proporcionaron datos concluyentes y en todos ellos se informaba una mortalidad más elevada2.
Las evidencias acumuladas3 han demostrado que la infección por el SARS-CoV-2 progresa en diferentes etapas. Los síndromes de dificultad respiratoria aguda (SDRA) se observan en una proporción significativa de pacientes frágiles, aproximadamente después de la segunda semana, y no se relacionan solo con la replicación viral no controlada, sino con la respuesta del huésped. En la respuesta inmunitaria inicial participan receptores toll like (TLR), el gen inducible por ácido retinoico (RIGI), receptores NODlike (NLR) y otros receptores de virus en las células epiteliales respiratorias que son críticos para reducir la carga viral y alertar al huésped4. La respuesta comienza con el reclutamiento de inmunidad innata. Si la autopropagación viral no se ve limitada, el número creciente de células epiteliales infectadas y los restos celulares desencadenan una liberación masiva de citocinas: la llamada "tormenta de citocinas", con hiperinflamación e inmunosupresión, caracterizada por un aumento de Th17 y actividad cito-tóxica CD8 y disminución de la memoria CD4+ T células auxiliares5. La respuesta inmunitaria antiviral representa un delicado equilibrio entre la eliminación del virus y la lesión pulmonar inmunomediada.
Dos informes recientes publicados en The Lancet informaron que los corticosteroides no deberían usarse para el tratamiento de COVID-196. Sin embargo, estos supuestos se basan principalmente en los hallazgos de los metaanálisis arriba citados y en la enfermedad causada por otros virus, pero no en la investigación específica sobre COVID-19.
La publicación, hace poco tiempo, de los resultados de un ensayo aleatorizado multicéntrico (RECOVERY) que informan la efectividad del tratamiento con dexametasona en pacientes con infección grave por SARS-CoV-2, plantea la necesidad de realizar una revisión exhaustiva de la literatura disponible, que permita la identificación y valoración crítica de la evidencia sobre la eficacia y seguridad de la terapia con glucocorticoides en pacientes con COVID-19.
DESCRIPCIÓN DE LA TECNOLOGÍA
Los glucocorticoides exógenos (GC) se suelen asociar con la supresión inmunitaria; por esta razón, se desaconsejó su uso durante los primeros días de la pandemia, debido al temor de que pudieran favorecer la propagación viral y limitar así la primera línea de defensa: la inmunidad innata. Según esta hipótesis, sería esperable encontrar más pacientes con enfermedad pulmonar obstructiva crónica, asma o trastornos reumatológicos con un mayor riesgo de presentación grave de COVID-19. Sorprendentemente, estas comorbilidades aparecen subrepresentadas en pacientes con COVID-19 grave o crítica7. Un estudio retrospectivo de 201 pacientes con SDRA mostraron una menor mortalidad entre aquellos que recibieron metil-prednisolona8. Debido a su eficacia probada en diferentes enfermedades respiratorias, su biodisponibilidad pulmonar alta y sus propiedades antiinflamatorias, la mayoría de los ensayos en curso se centran en la metilprednisolona, dexametasona y budesonide (solas o en combinación con otros antiinflamatorios como el siltuximab y el tracoli-mús) (ver Cuadro 1).
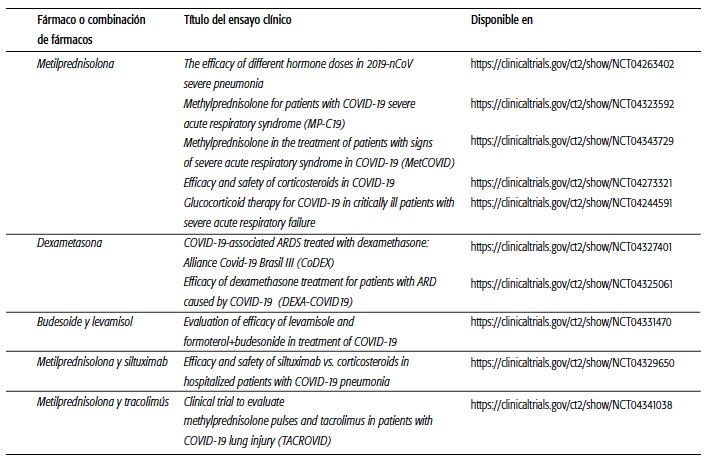
CUADRO 1 Ensayos clínicos en curso sobre el uso de glucocorticoides sistémicos solos o asociados a otros fármacos para el tratamiento de COVID-19.
Hoy en día, se reconoce que los GC tienen un efecto estimulante e inhibitorio sobre la respuesta inmunitaria de acuerdo con el momento en cual se administran y sus niveles circulantes. Hasta el momento, la capacidad de los GC para reducir la inflamación e, idealmente, la fibrosis, ha sido la justificación para su uso con el fin de evitar el daño pulmonar. Sin embargo, las complicaciones asociadas y la falta de un beneficio real en la supervivencia global, así como los posibles eventos adversos como el sangrado gastrointestinal, la insuficiencia hepática y la tromboembolia, han relegado su uso al shock refractario o, según algunos autores, al SDRA, cuando el daño pulmonar se acerca a un grado irreversible9. Del mismo modo, los estudios con dosis altas de GC en cuadros de sepsis son controversiales, como es el caso del estudio REGARDS10 y el ensayo clínico más reciente ADRENAL (en el que se comparaba la administración de 200 mg de hidrocortisona al día versus placebo) que no muestran efectos beneficiosos sobre la mortalidad a los 90 días11. Esto no sucede en el ensayo APROCCHS, que muestra una reducción en la mortalidad a los 28 días en pacientes con sepsis que recibieron hidrocortisona y fludrocorti-sona12. Una de las razones que sustentan las evidencias conflictivas publicadas hasta la fecha sobre la terapia con esteroides en infecciones virales respiratorias y neumonía, podría ser la heterogeneidad de los estudios incluidos en los metaanálisis que evaluaron, en general, los resultados de los efectos de diferentes formulaciones de GC (de acción corta y de acción prolongada) en el mismo análisis, sin considerar las diferentes fases fisiopatológicas de la infección. De hecho, si por un lado dosis suprafisiológi-cas de GC exógenos han mostrado ejercer efectos perjudiciales en la fase inicial (al aumentar la carga viral en plasma), se puede argumentar la posibilidad de contener la tormenta de citocinas de la segunda fase, más perjudicial, que suprime la reacción inmunitaria exagerada por el tratamiento con esteroides13. Aunque la respuesta fisiopa-tológica y la progresión clínica de COVID-19 se parecen a las observadas en otras infecciones por coronavirus para las que se han propuesto varios protocolos estandarizados de esteroides, en las recomendaciones iniciales de la OMS sobre el manejo clínico de COVID-19 se desaconsejó el uso de los corticosteroides como terapia específica, a menos que tuvieran otra indicación14.
MÉTODOS
PREGUNTAS DE INVESTIGACIÓN
P: pacientes con neumonía grave infectados por COVID-19. I: dexametasona.
C: tratamiento de soporte habitual.
O: mortalidad intrahospitalaria relacionada a SARS-CoV-2, mortalidad global, requerimiento de AVM, tiempo de AVM, tiempo de estadía hospitalaria, eventos adversos.
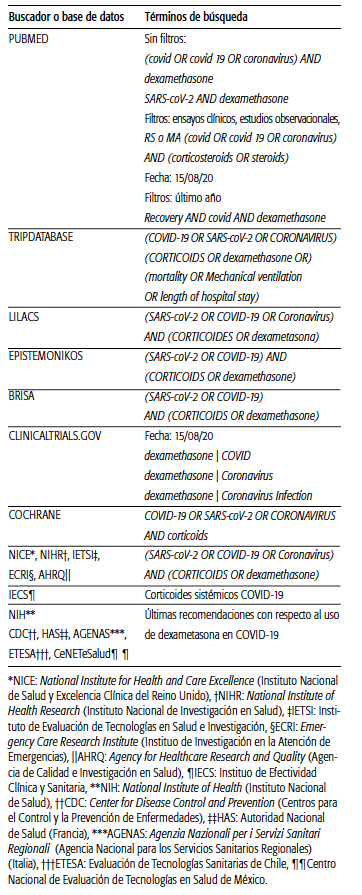
Se conformó un equipo multidisciplinario y sin conflictos de interés para realizar un informe de evaluación de tecnología sanitaria (ETS). Se realizó una búsqueda amplia, no sistemática, en las siguientes bases de datos bibliográficas: repositorio y página de la OMS y de la Organización Panamericana de la Salud (OPS), BRISA, RedETSA, sitios de agencias de evaluación de tecnologías sanitarias y agencias nacionales e internacionales reguladoras de alimentos, medicamentos y dispositivos, distintas bases de datos biomédicos y bibliotecas (Tripdatabase, Epistemonikos, Cochrane Library, LILACS, PUBMED) y buscadores genéricos de internet como Google académico. Se buscaron, además, guías de práctica clínica de distintas sociedades científicas que abordan el uso de corticoides en COVID-19, y se dio prioridad a las del Ministerio de Salud de la Nación Argentina. Se incluyeron estudios publicados en español, portugués e inglés desde el 15 de septiembre de 2014 hasta el 15 de septiembre de 2020. Se complementó la búsqueda en registro de investigaciones clínicas en marcha en Clinical Trials.
CRITERIOS DE INCLUSIÓN Y EXCLUSIÓN
Para la valoración de la efectividad se consideraron como criterios de inclusión los ensayos controlados aleatoriza-dos (ECA), la dexametasona como corticoide evaluado y la COVID-19 como entidad patológica en estudio; como criterios de exclusión se consideraron otros diseños de investigación, la imposibilidad de acceder al texto completo del estudio y otras patologías en estudio.
Para la valoración de la seguridad, se consideraron como criterios de inclusión los ECA, los estudios obser-vacionales controlados, la dexametasona como corticoide evaluado y la COVID-19 como entidad patológica en estudio; como criterios de exclusión se consideraron otros diseños de investigación y la imposibilidad de acceder al texto completo del estudio.
Los desenlaces clínicos considerados y su importancia relativa fueron: mortalidad intrahospitalaria, dentro de los 28 días, relacionada con SARS-CoV-2 (crítico), mortalidad global (crítico), requerimiento de AVM (crítico), tiempo de AVM (crítico), tiempo de estadía hospitalaria (no importante) y eventos adversos que ocasionen la discontinuación del tratamiento (importante).
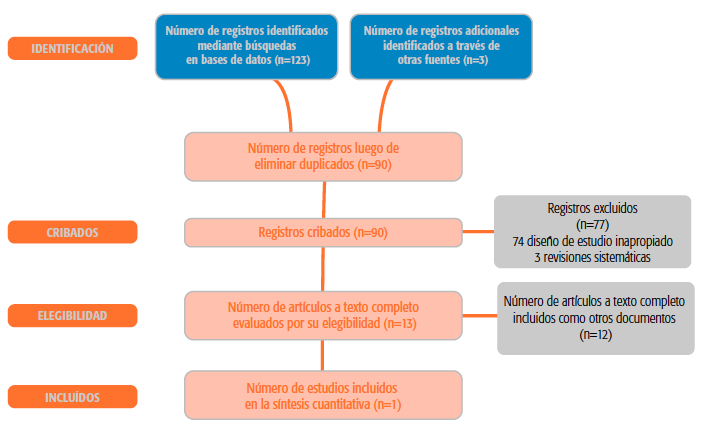
Se realizó una matriz de evidencia a fin de identificar, entre los estudios primarios que integraban las distintas revisiones sistemáticas seleccionadas al inicio, los trabajos que no hubieran surgido de otras estrategias de búsqueda. La síntesis de los resultados de la búsqueda se presenta en el Gráfico 1 (diagrama de flujo). Se utilizó la metodología GRADE para valoración de la calidad y certeza en la evidencia seleccionada para cada desenlace15.
RESULTADOS
Si bien se ha sugerido la utilización de glucocorticoides como parte del tratamiento de la neumonía por SARS-CoV-2, existen pocos estudios que sean comparables con el estudio RECOVERY, principalmente por el esquema y las dosis de esteroides administradas16. El resto de las evaluaciones de tecnologías sanitarias y síntesis de eficacia se presentan en la Tabla 1. Los ensayos clínicos revisados incluyeron pacientes en quienes se utilizaron dosis de glucocorticoides muy superiores a las usadas en el estudio RECOVERY y presentaron también una gran heterogeneidad en cuanto a las características de los pacientes, los tipos de corticoides, las dosis y la duración del tratamiento17-19. El resto de la evidencia fue indirecta, proveniente de otras patologías infecciosas como el MERS, SARS y la gripe, o bien entidades clínicas de pacientes en cuidados críticos, como es el caso de los SDRA.
El uso de glucocorticoides (dexametasona en dosis de 6 mg/día por 10 días) en pacientes con neumonía por COVID-19 mostró una reducción de la mortalidad global a los 28 días (22,9% versus 25,7%; RR: 0,83; IC95%: 0,750,93), lo cual implica que sería necesario tratar a 33 pacientes para evitar una muerte. Por otra parte, se observó una disminución global significativa de progresión del cuadro respiratorio con requerimiento de AVM de los pacientes tratados (5,7% versus 7,8%; RR: 0,77; IC95%: 0,62-0,95). Se analizaron los resultados en los siguientes subgrupos, definidos adhoc en el estudio de la siguiente manera:
• Pacientes con neumonía grave con requerimientos de AVM invasiva, en quienes se observó el mayor impacto beneficioso de la intervención sobre la mortalidad (29,3% versus 41,4%; RR: 0,64; IC95%: 0,51-0,81 (certeza moderada), lo que indica un NNT de 8,5. En cuanto al impacto del tratamiento sobre el tiempo de AVM invasiva, no se encontró evidencia que permitiera valorar este desenlace.
• Pacientes con neumonía grave con requerimientos de oxigenoterapia, sin requerimiento de AVM invasiva, que también evidenciaron beneficio, con reducción de la mortalidad con la intervención, aunque de menor magnitud que el subgrupo anterior (23,3% versus 26,2%; RR: 0,82; IC95%: 0,72-0,94) (certeza moderada), con un NNT de 29.
• Pacientes con neumonía leve y sin requerimientos de oxigenoterapia: en este grupo existe incertidumbre respecto del efecto del tratamiento. En principio, no parece modificar la evolución (mortalidad 17,8% versus 14,0%; RR: 1,19; IC95%: 0,91-1,55). Se informó que hubo pacientes que no se beneficiaron e incluso se perjudicaron con la intervención. La certeza en este grupo es baja debido a que representa un análisis de subgrupo y a la imprecisión de la estimación del efecto (incluye tanto beneficios como riesgos).
Existe evidencia de alta confianza que muestra una disminución de la mortalidad en pacientes con neumonía grave por COVID con insuficiencia respiratoria aguda grave (IRAG) y requerimientos de oxigenoterapia o AVM con el uso de dexametasona en dosis de 6 mg/día durante 10 días.
Se evaluó el desenlace "tiempo de AVM", referido a la duración de la ventilación mecánica en pacientes críticos, mediante evidencia indirecta de ensayos clínicos en pacientes con SDRA de otras etiologías. La duración media del tratamiento con corticoides fue de 14,5 días. La diferencia media entre ambos grupos fue de -4,8 días (entre -2,6 y -7 días). Existe una baja certeza en la magnitud del efecto, principalmente porque la información proviene de evidencia indirecta, como se mencionó antes. De este modo, los corticoides podrían reducir el tiempo de AVM en pacientes con SDRA y COVID-19.
Los resultados de la evaluación se sintetizan en los perfiles de evidencia presentados en la Tabla 2.
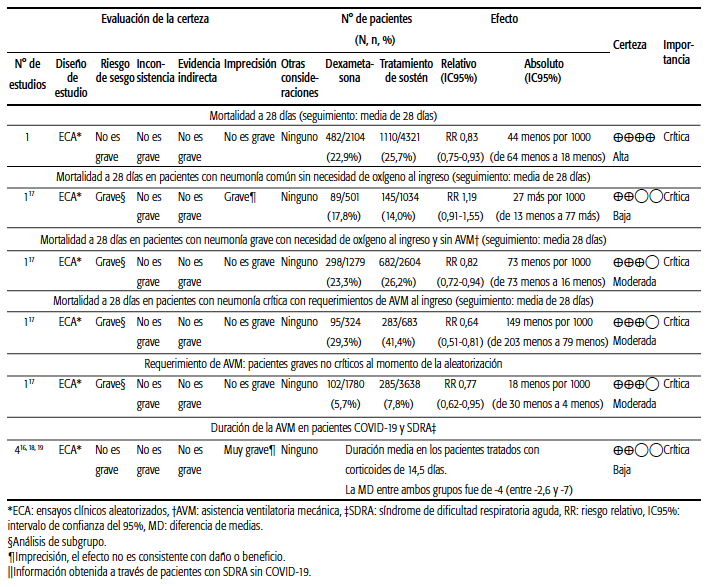
TABLA 2 Perfil de evidencia sobre el uso de dexametasona en comparación con el tratamiento habitual en pacientes con COVID-19.
EVIDENCIA SOBRE EFECTOS ADVERSOS
El informe del estudio RECOVERY16 no reporta la frecuencia, el tipo o el análisis acerca de los efectos adversos atribuibles al tratamiento con dexametasona en dosis de 6 mg/día, durante 10 días. En este sentido, si bien los efectos adversos de los distintos glucocorticoides sistémi-cos pueden considerarse muy similares en cuanto a su naturaleza (hiperglucemia, inmunosupresión, debilidad muscular, entre otros eventos), su probabilidad de aparición y gravedad está determinada por la dosis empleada y la duración del tratamiento, así como por la existencia de comorbilidades previas en los pacientes.
La dosis de 6 mg de dexametasona equivale, aproximadamente, a 30 mg de metilprednisolona, 38 mg de prednisona y 150 mg de hidrocortisona.
Con base en estas equivalencias, los resultados del estudio de Wu, en el cual los pacientes con COVID-19 grave recibieron 40 mg de metilprednisolona por un tiempo variable (3 a 10 días), pueden considerarse como evidencia indirecta20. En dicho trabajo sólo se informó la presencia de hiperglucemia, que fue más frecuente en los pacientes que recibieron corticoides, aunque los autores informan que los grupos en comparación estaban desbalanceados en cuanto a sexo, edad, hipertensión arterial y severidad de su presentación al ingreso antes de la intervención.
EVALUACIONES DE TECNOLOGÍA SANITARIA
La ETS del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) de Perú describió, en abril de 2020, que la evidencia era proveniente de estudios ob-servacionales y no se dispuso de resultados de ensayos clínicos aleatorizados (ECA) que evaluaran la efectividad o eficacia y seguridad, existiendo incertidumbre en el efecto de los corticoides en el tratamiento de COVID-1912. A la espera de los resultados de ECA en desarrollo, concluye que, debido a la limitada evidencia disponible, no se cuenta con argumentos técnicos para realizar una recomendación a favor del uso de corticoides en el manejo de pacientes con COVID-19.
El informe reciente de ETS de González y col21 incluyó un ECA, una revisión sistemática, dos estudios observacionales, una ETS, 12 guías de práctica clínica y recomendaciones de organismos gubernamentales o sociedades científicas acerca del uso de corticoides sistémicos en pacientes con diagnóstico de COVID-19.
GUÍAS DE PRÁCTICA CLÍNICA
Las guías de los Institutos Nacionales de Salud de los
EEUU (NIH, según su sigla en inglés) publicadas en julio de 202022, recomiendan la administración de dexame-tasona en dosis de 6 mg/día durante un máximo de 10 días para el tratamiento de pacientes con COVID-19 en AVM (recomendación fuerte, sobre evidencia de uno o más ensayos aleatorios con resultados clínicos, puntos finales de laboratorio validados o ambos) y en pacientes que requieren oxígeno suplementario pero que no estén en AVM (recomendación moderada, sobre evidencia de uno o más ensayos aleatorios con resultados clínicos, puntos finales de laboratorio validados o ambos). Las guías recomiendan NO administrar dexametasona a pacientes con COVID-19 que no requieren oxígeno suplementario (recomendación fuerte).
El documento de Manejo clínico de pacientes con enfermedad por el nuevo coronavirus (COVID-19) del Ministerio de Salud de Paraguay23 no recomienda, en general, la administración de corticoides sistémicos. Se puede valorar en casos de SDRA, shock séptico refractario, encefalitis, síndrome hemofagocítico y broncoespasmo franco con sibilancias.
Las Recomendaciones condicionales para el abordaje terapéutico de COVID-19 del Ministerio de Salud de Brasil24 indican no administrar habitualmente corticosteroides sistémicos para el tratamiento de la neumonía viral o la insuficiencia respiratoria, a menos que se indique lo contrario, como el uso crónico, y sugiere la individualización de los casos para decidir sobre el uso de corticoides. Por otra parte, en un documento publicado en junio de 202025 se recomienda considerar la terapia con pulso con corticosteroides para los pacientes hospitalizados con signos de gravedad y evidencia por laboratorio de una "tormenta de citocinas", con profilaxis antihelmíntica antes del primer pulso de corticoterapia.
Las guías rápidas de COVID-19 del National Institute for Health and Care Excellence (NICE) de Inglaterra26 no mencionan la dexametasona como tratamiento del COVID-19.
En el documento Evidencias sobre el tratamiento farmacológico del COVID-19 del Ministerio de Salud de la Nación de Argentina publicado en julio de 202027 se recomienda el tratamiento con dexametasona en dosis de 6 mg/día durante 10 días en pacientes con hipoxemia o enfermedad moderada o grave.
El Documento de prevención, diagnóstico y tratamiento de personas afectadas por COVID-19 del Ministerio de Salud y Protección Social de Perú28 no menciona el uso de los corticoides.
Los Lineamientos para el manejo clínico de pacientes con infección por el nuevo coronavirus COVID-19 del Ministerio de Salud y Protección Social de Colombia30 publicado en julio de 2020 recomienda no administrar de forma rutinaria corticoides sistémicos para el tratamiento de la neumonía viral a no ser que estén indicados por alguna otra razón.
DISCUSIÓN
Si bien se ha sugerido la utilización de glucocorticoides como parte del tratamiento de la neumonía por SARS-CoV-2, existen pocos estudios comparables con el estudio RECOVERY, principalmente por el esquema y las dosis de esteroides administradas. Los efectos adversos de los corticoides en los pacientes críticos se han descrito en múltiples estudios; sin embargo, las dosis utilizadas en ellos son mucho más altas que las administradas en el ensayo clínico RECOVERY. Si bien el tipo de eventos adversos (y, por lo tanto, las medidas de control sugeridas) podría ser similar al del resto de los corticoides, dado que su ocurrencia y gravedad guardan una clara relación con la dosis, se podría inferir que el impacto negativo de la dexametasona utilizada en la dosis mencionada podría ser significativamente menor.
Existe evidencia de alta confianza que muestra una reducción en la mortalidad en pacientes con neumonía grave por COVID-19 con IRAG y requerimientos de oxigeno-terapia o AVM con el uso de dexametasona en dosis de 6 mg/día durante 10 días.
El desenlace "tiempo de AVM", referido a la duración de la ventilación mecánica en pacientes críticos en AVM, se evaluó a través de evidencia indirecta de ensayos clínicos en pacientes con SDRA. La duración media del tratamiento en los pacientes que recibieron corticoides fue de 14,5 días. La diferencia media entre ambos grupos fue de -4,8 días (entre -2,6 y -7 días), existe una baja certeza en la magnitud del efecto debido principalmente a que se debe a evidencia indirecta, como se mencionó. De este modo, los corticoides podrían reducir el tiempo de AVM en pacientes con SDRA y COVID-19.
Se recomienda la administración de dexametasona en dosis de 6 mg/día durante 10 días en los pacientes con neumonía grave por COVID-19 y requerimientos de oxi-genoterapia o AVM, con las precauciones habituales para el uso de dosis bajas de corticoides (recomendación fuerte, certeza alta).