INTRODUCCIÓN
En los últimos años se ha demostrado el rol de CMV como patógeno productor de importante morbimortalidad en pacientes inmunocomprometidos. Sin embargo, es poco considerado el hecho de que también causa infecciones congénitas con gran impacto socioeconómico por la pérdida de audición en la niñez y el retraso del neurodesarrollo1. Cabe destacar que, aun teniendo inmunidad, la reactivación del virus latente o la reinfección de embarazadas por una cepa viral antigénicamente diferente -lo que se denomina infección no primaria- también pueden producir infección fetal2.
Según lo reportado, la seroprevalencia de CMV en adultos y la incidencia de infección congénita por CMV (cCMV) son mayores en los países de escasos recursos que en los desarrollados. Los datos de países con altas seroprevalencias (>70%) sugieren no solo que la tasa de cCMV es mayor, sino que además es causa importante de pérdida de la audición3'4. Faltan estudios poblacionales que estimen carga de enfermedad, discapacidad y mortalidad en zonas con bajos recursos2. El seguimiento de niños con esta condición ha demostrado un impacto considerable en su desarrollo, desempeño escolar y calidad de vida de la familia5.
Teniendo en cuenta que un alto porcentaje de casos de cCMV no son diagnosticados, muchos autores sugieren un programa de screening neonatal que permita detectar de forma temprana la infección para disminuir el impacto a largo plazo6.
En Argentina se han realizado algunos estudios serológicos y moleculares, pero en general es escasa la información epidemiológica 7 8.
Aunque la mayoría de las infecciones por CMV son asintomáticas o causan enfermedad leve, el virus puede producir una afección grave en recién nacidos (RN) y pacientes inmunocomprometidos. El espectro de la enfermedad es diverso y depende mayoritariamente del hospedador 9.
En neonatos, la infección adquirida durante el período fetal presenta elevada morbimortalidad en aproximadamente 10% de los casos; en el resto, pasa inadvertida, pero alrededor del 90% de la población sintomática y hasta un 15% de los asintomáticos desarrollan secuelas progresivas durante la infancia 10.
Si bien el CMV es ubicuo, su distribución presenta diferencias significativas dentro de las distintas regiones y entre ellas. En países industrializados, hasta un 50% de mujeres en edad fértil son seronegativas. En esta población, la se-roconversión está relacionada con el contacto frecuente y prolongado con niños pequeños. En cambio, en zonas de escasos recursos, el CMV es adquirido a muy temprana edad por lactancia materna y condiciones de hacinamiento. La incidencia de infección in utero depende de la población estudiada. Diferentes escenarios de infección determinarían distintos grados de viremia materna, lo que a su vez influye en el riesgo de infección placentaria o fetal 2.
En países con seroprevalencias relativamente bajas, las tasas de cCMV van de 0,6 a 0,7% de los nacidos vivos11.
Sin embargo, aun dentro de una región geográfica, las tasas variables de seroprevalencia en distintos grupos étnicos, raciales o socioeconómicos dan como resultado diferentes patrones epidemiológicos de infección congénita 12. En países en desarrollo se han reportado altas tasas de infección congénita, que van de 1 a 5% 2,3.
Los objetivos de este trabajo fueron estimar la prevalencia de infección congénita por CMV y la seroprevalencia materna, y comparar si existen diferencias en las variables estudiadas según nivel socioeconómico, determinado por un índice de carencias y tipo de institución pública o privada.
MÉTODOS
Se realizó un estudio observacional de corte transversal. El período de recolección de muestras y relevamiento de información duró 10 meses (desde julio de 2018 hasta abril de 2019). Participaron 8 unidades de Neonatología de la provincia de Tucumán: 4 pertenecientes a hospitales públicos y 4 a instituciones privadas.
Los neonatólogos reclutaron el primer nacido vivo y su madre, es decir, un binomio madre-hijo (BMH) de un día fijo de cada semana por un período de 25 semanas. La inclusión de los BMH fue independiente de la condición materna, tipo de parto (natural o cesárea), edad gestacio-nal, características clínicas del nacimiento y presencia o no de signos/síntomas específicos. El neonatólogo realizó el cuestionario a la madre o familiar presente para completar la Ficha de Recolección de Datos diseñada para este estudio, donde se registró información clínica, epidemiológica y socioeconómica (ver Anexo 1 en: http://rasp.msal.gov.ar/ rasp/articulos/vol13/AO Salmeron Anexo1.pdf).
De cada BMH se obtuvieron muestras de suero de la madre y orina del RN, dentro de las 48 horas del nacimiento y antes del alta del BMH. Todas las muestras fueron enviadas en condiciones adecuadas al Laboratorio de Salud Pública de Tucumán para su procesamiento. Ante la falta de información epidemiológica en Argentina, el tamaño de la muestra se estimó sobre la base de datos de seroprevalencia materna y prevalencia de cCMV de Chile y Brasil. Se tomaron como referencia estudios que cumplían criterios de inclusión para una revisión sistemática en cuanto a la realización con muestras no sesgadas y métodos diagnósticos adecuados. En ellos se reportaron seroprevalencias maternas en un rango de 90-98%. En cuanto a cCMV, el rango fue de 1,0-3,2%13.
El cálculo del tamaño de muestra para estimar infección congénita por CMV se basó en el reporte de Indicadores Básicos (2016) del Ministerio de Salud de la Nación, disponible al momento de presentación de este proyecto, el cual indica que se produjeron 30 393 nacimientos en 2014 en la provincia de Tucumán. Considerando un nivel de confianza del 95%, una precisión del 2% y una prevalencia estimada de infección congénita por CMV del 2%, el N resultante a testear fue de 187 RN.
Para estimar la seroprevalencia materna, se consideró el Censo Nacional de Población, Hogares y Viviendas 2010, que presenta una población de mujeres en Tucumán de 740 801 y de mujeres mayores de 14 años de 551 430 (Instituto Nacional de Estadística y Censos, 1NDEC). Considerando un nivel de confianza del 99%, una precisión del 5% y una seroprevalencia materna estimada de 95%, la muestra recomendada para estimar seroprevalencia materna fue de 126 mujeres.
La población blanco fueron mujeres embarazadas que habían concurrido a las instituciones seleccionadas para dar a luz durante el período de reclutamiento. Las participantes se seleccionaron de forma aleatoria, como se detalló previamente, y se incluyeron los binomios de aquellas mujeres que aceptaron participar de manera voluntaria en el estudio.
Según el reporte nacional de indicadores básicos de 2018, Tucumán presentaba en 2016 una población total estimada de 1 613 476 habitantes (ambos sexos), con 28 306 nacidos vivos 14.
De acuerdo con los registros de 2012 del Departamento de Estadísticas de Salud de la Provincia, el 54,4% del total de nacimientos se produjo en instituciones privadas y el 45,6%, en públicas.
Los criterios para la inclusión de los BMH fueron: consentimiento informado de la madre; obtención de muestra de orina del RN y suero de la madre (set completo); y residencia de la madre en Tucumán.
Ante el no cumplimiento de cualquier criterio de inclusión o la imposibilidad de obtener las muestras correspondientes, el binomio quedaba excluido automáticamente del estudio.
En los casos de nacimiento múltiple, se reclutaron todos los RN vivos y su respectiva madre. A fines del registro, se asignó a cada RN un número diferente y se completó una Ficha de Recolección de Datos independiente.
Se estudiaron las siguientes variables:
Variables de resultado:
• Infección congénita del RN por CMV: condición del RN respecto a la infección por CMV adquirida durante la gestación. Se consideró evidencia de cCMV la detección de genoma viral en muestra de orina del RN.
• Estado seroinmune de la madre respecto a CMV: determinado por la presencia o ausencia de anticuerpos IgG
anti-CMV en suero.
• Clínico-epidemiológicas: peso, edad gestacional, perímetro cefálico, presencia de signos/síntomas al nacer, realización o no y resultados de otros diagnósticos (VIH madre/RN, sífilis, toxoplasmosis).
Variables demográficas:
• Socioeconómicas: edad, nivel de instrucción y condición de ocupación materna/paterna, sistema de atención de salud, número de niños de hasta 5 años que convivían con la madre, sus edades y asistencia o no a salas maternales.
En lo que respecta al diagnóstico de laboratorio, la detección de genoma de CMV en orina se realizó por PCR (reacción en cadena de la polimerasa) en tiempo real, con cebadores y sonda dirigidos a una región del gen de proteína de membrana US17. La extracción de ácidos nucleicos se efectuó dentro de las 72 horas de obtenida la muestra, con el kit de extracción QIAamp Viral RNA Mini Kit, de QIAGEN, de acuerdo con las instrucciones del fabricante. Se trabajó con volumen de extracción de 200 pl de orina y elución en 50 pl.
La utilidad de la técnica de PCR en tiempo real en orina del RN como herramienta para el diagnóstico de cCMV ha sido estudiada y validada con el método gold standard de cultivo viral15. Presenta una sensibilidad de 100% y una especificidad del 99%16. Por lo tanto, una muestra de orina negativa es criterio suficiente para descartar infección. Debido a que las técnicas de PCR son cada vez más sensibles, se recomienda el testeo antes de los 14 días de nacido, porque un resultado positivo en orina recolectada luego de ese periodo podría deberse a infección intraparto o posnatal17.
La detección de anticuerpos en suero materno se realizó con la técnica inmunoenzimática automatizada VIDAS de Biomerieux.
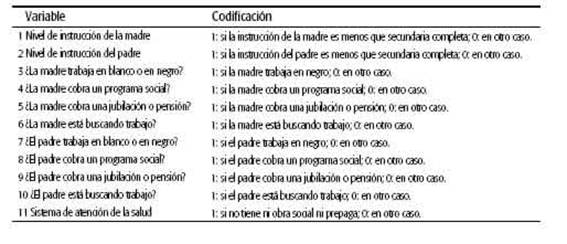
Para evaluar el nivel socioeconómico, se recodificaron 11 variables del cuestionario con el objeto de confeccionar un índice que reflejara el nivel de carencias de la madre (ver Tabla 1). Dado que la recodificación estaba dirigida a registrar la carencia y que el índice se construyó simplemente como la suma de las 11 variables consideradas, el índice contó entre 0 y 11 las carencias registradas.
Se definieron dos categorías: a) hasta dos carencias; b) tres o más carencias. El punto de corte fueron dos carencias porque la variable no tiene una distribución normal y ese número es la mediana de la distribución de todos los casos según el número de carencias declaradas.
Luego se evaluaron los casos en función de dos criterios de clasificación: a) dependencia de tipo de maternidad (privada o pública); 2) cantidad de carencias.
En cuanto al análisis estadístico, para evaluar si las medias o porcentajes de las variables estudiadas diferían entre pacientes de establecimientos públicos o privados y entre pacientes con menos o más carencias, se realizaron los test t de diferencia de medias y los test z de diferencia de proporciones. En los casos de variables con frecuencia muy baja en alguna categoría, se empleó el test exacto de Fisher. Para el análisis de los datos se utilizó el software R (R Core Team, 2018).
Al comparar medias o porcentajes, se consideró diferencia significativa un valor p <0,05.
El presente estudio fue evaluado y aprobado para su realización por el Comité de Ética Central de la Provincia de Tucumán y por los comités de cada institución participante. Cada madre enrolada o su representante legal firmó el Formulario de Consentimiento Informado antes de su inclusión en el estudio. Se cumplió con la Ley 25326 de Protección de los Datos Personales.
RESULTADOS
De un total de 204 BMH evaluados, se reclutaron 201, con 2 nacimientos gemelares (201 RN/199 madres) y una distribución de 101 (50,25%) en el sector privado y 100 (49,75%) en el público. Quedaron excluidos tres binomios: uno porque la madre era menor de edad y faltaba la firma del apoderado legal en el consentimiento informado; otro porque la madre tenía el domicilio fuera de la provincia de Tucumán; y el tercero por falta de información general en la Ficha de Recolección de Datos.
De los 201 RN estudiados, en apenas uno del sector público se detectó genoma de CMV en orina, con una prevalencia de cCMV de 0,50% (IC95%: 0,07-3,50).
De las 199 madres participantes, se obtuvieron resultados de anticuerpos IgG anti-CMV en 197, dado que un test resultó dudoso y una muestra no se pudo analizar. Se alcanzó una seroprevalencia general de 96,95% (IC95%: 93,34-98,64), con 98,97% en el sector público y 95% en el privado. Al comparar ambos sectores, no se observó diferencia significativa de seroprevalencia materna.
En el Anexo 2 (http://rasp.msal.gov.ar/rasp/articulos/ vol13/AO_Salmeron_Anexo2.pdf)puede observarse la distribución de frecuencias de las 197 madres clasificadas de acuerdo con la dependencia de la maternidad donde se asistió el parto (privada, pública) y al diagnóstico de IgG anti-CMV versus su edad.
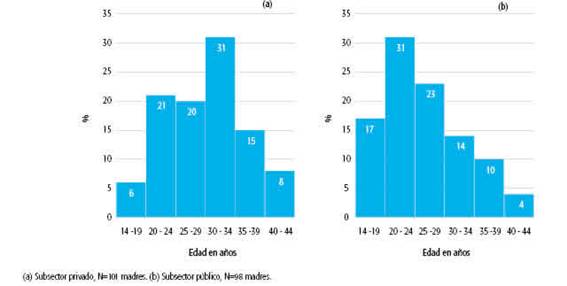
Para mostrar la distribución de las edades maternas entre la población enrolada en el ámbito público y el privado se hizo una división en intervalos de 5 años de amplitud y fácil lectura. El primer intervalo fue de 6 años simplemente para poder incluir a una única madre de 14 años de edad del ámbito público (ver Gráfico 1).
La mediana de edad de todas las madres estudiadas fue 27 años (RI: 22-33). Se seleccionó este valor como punto de corte para evaluar si había diferencia en la seroprevalencia entre los dos grupos. Se obtuvo una seroprevalencia de 97,89% en el grupo de hasta 26 años y de 96,08% en el de 27 o más. No se evidenció una diferencia estadísticamente significativa.
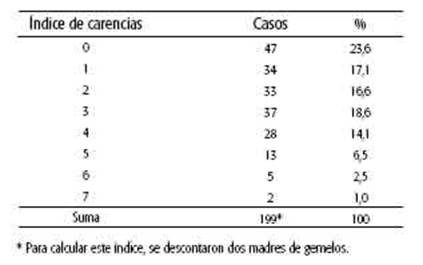
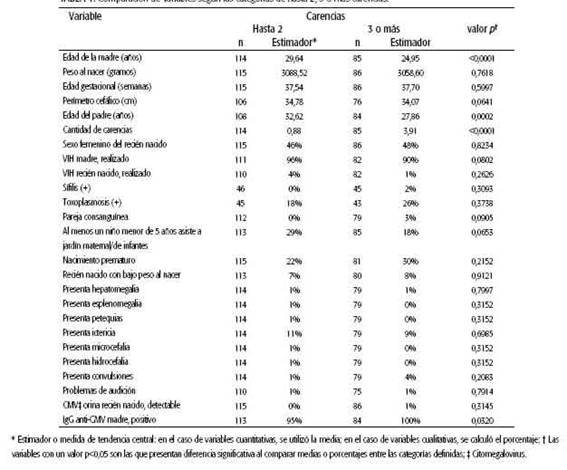
En cuanto al nivel socioeconómico, la máxima cantidad de carencias registradas en los casos estudiados fue de 7. Aproximadamente una cuarta parte de los casos analizados no presentó carencia alguna, y otra cuarta parte registró por lo menos 4 de las 11 carencias consideradas. (ver Tabla 2). Se observa que 2 carencias o menos acumularon la mitad o más de los casos con menos carencias (114) y que simultáneamente 2 carencias o más acumularon la mitad o más de los casos con más carencias (118).
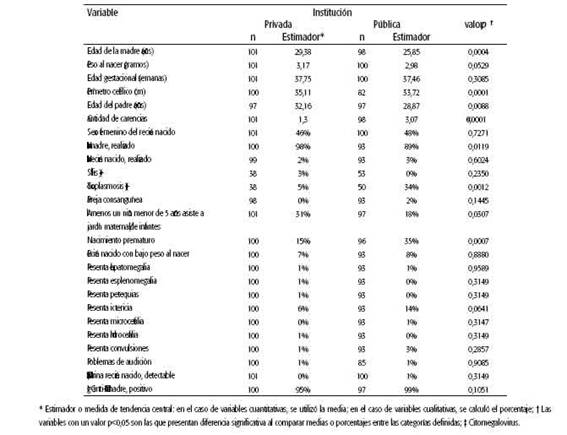
La carencia promedio por caso fue de 2,17 (Sd: 1,76). De forma general, se puede decir que las maternidades del subsector público presentaron un promedio mayor de carencias (media: 3,07, Sd: 1,64) que las del subsector privado (media: 1,30, Sd: 1,40).
En las Tablas 3 y 4 se muestra la comparación de variables según tipo de institución y cantidad de carencias.
DISCUSIÓN
El presente trabajo resulta ser la primera evidencia concreta sobre infección congénita y prevalencia de CMV en Tucumán.
El valor obtenido de cCMV (0,5%) puede considerarse bajo, teniendo en cuenta la alta seroprevalencia materna encontrada en esta población (96,95%).
Las prevalencias de cCMV de entre 0,3 y 0,6% se asocian en general con tasas de seroprevalencia materna relativamente bajas (50-70%)2.
La incidencia de infección in utero es altamente dependiente del tipo de población y se correlaciona, en general, con la seroprevalencia materna. Así, mayores tasas de seroprevalencia en una población implican mayor riesgo de infección materna, tanto primaria como no primaria. Sin embargo, aun dentro de una misma región geográfica, las diferencias raciales, étnicas y principalmente socioeconómicas pueden generar patrones epidemiológicos variables de infección congénita y, además, los niveles de seroprevalencia de una población pueden también reflejar variaciones en los hospederos y factores ambientales no bien establecidos aún, que a su vez influencian el riesgo materno de infección y transmisión vertical2.
La distribución geográfica de prevalencia en el nacimiento a nivel mundial sigue un patrón poco claro. En una revisión sistemática en EE.UU., se observó que los estudios conducidos en grupos con menor nivel socioeconómico reportaban mayores tasas de prevalencia de infección congénita que aquellos efectuados en poblaciones con condiciones socioeconómicas más diversas11. Esto coincide con lo observado en la población de este estudio.
Por otro lado, se ha reportado una característica particular de la cCMV, que aún no ha sido explicada: su prevalencia aumenta al aumentar la seroprevalencia materna y no alcanza un nivel en el cual disminuya18. Esto contrasta, por ejemplo, con lo que ocurre con el síndrome de rubeola congénito (SRC); en dicho caso, cuando la tasa de seroinmunidad materna alcanza un 80-85%, la incidencia del SRC cae drásticamente 19. De igual modo, en el noreste de Brasil se observó que la prevalencia del síndrome congénito por virus Zika disminuía precipitadamente cuando la seroprevalencia superaba el 60% en esa población20.
En la población evaluada en este estudio se obtuvo un valor alto de seroprevalencia de CMV (96,95%), semejante a niveles reportados por países como Brasil, Chile, Turquía, Sudáfrica e India 2.
La seroprevalencia de CMV se caracteriza por un aumento dependiente de la edad de las personas y se correlaciona principalmente con el nivel socioeconómico y la raza 21.
En la población evaluada en este estudio, se observó una diferencia estadísticamente significativa en la sero-prevalencia materna de CMV entre la categoría de hasta dos carencias y la de tres o más, lo que reflejaría la correlación de este parámetro con el nivel socioeconómico. Sin embargo, en ambos grupos los valores son altos y, al comparar los sectores público y privado, no se encontró una diferencia significativa.
No se hallaron diferencias en la seroprevalencia según los dos grupos de edades definidos, lo que indicaría que en ambos subsectores la infección primaria se produce a temprana edad o, en su defecto, en el inicio de la vida sexual de las personas.
En un estudio realizado en una población de Brasil se obtuvo una seroprevalencia casi universal de CMV de 97%, que fue similar en mujeres embarazadas de 4 grupos etarios determinados dentro del rango de 12 a 46 años, lo que sugiere que la mayoría de las infecciones primarias en esa población ocurren a temprana edad 22.
Las diferencias encontradas entre el sector público y privado, en variables como perímetro cefálico al nacer, realización o no del test de VIH en la madre, resultado de toxoplasmosis positivo, nacimiento prematuro y evaluación socioeconómica a través del promedio de carencias, pueden considerarse indicadores generales de mayor vulnerabilidad del sector público.
Con respecto al nacimiento prematuro, se ha estudiado su relación con cCMV; aunque no se ha demostrado que la tasa sea significativamente mayor que en los nacidos a término, el screening de CMV en prematuros es aconsejable debido a las posibles consecuencias neurológicas23. En este estudio se encontró una mayor proporción de nacimientos prematuros en el sector público.
Otro factor de riesgo establecido para cCMV es la presencia de niños preescolares en el hogar 24.
Según este estudio, en el sector privado hay mayor proporción de la variable "presencia en el hogar de al menos un niño menor de 5 años que asiste a sala maternal/jardín de infantes". Se trata de un factor de riesgo que influye, sobre todo, en poblaciones con bajas tasas de seroprevalencia materna, donde se ha reportado que la asistencia a guarderías de los hermanos mayores tiene impacto en la incidencia de cCMV. Por esto la denominan "enfermedad del hermano mayor", dado que la madre puede contagiarse de otro hijo asintomático que se ha infectado en la guardería. Los niños de entre 1 y 2 años de edad presentan las mayores tasas de excreción viral, lo que representa un riesgo de transmisión clave para mujeres embarazadas25. Este patrón difiere del observado en poblaciones con menor nivel socioeconómico, donde las tasas de seroprevalencia son mayores y el CMV es adquirido a temprana edad2, con menor riesgo de primoinfección durante el embarazo.
En la población del sector privado de este estudio, la presencia de un niño menor de 5 años que asiste a sala maternal/jardín de infantes no representaría un factor de riesgo para la infección primaria por CMV durante el embarazo, dado que este grupo muestra, al igual que el sector público, una alta tasa de seroprevalencia.
En cuanto a la edad de las madres, se encontró una diferencia significativa en los promedios según la pertenencia al sector público o privado, con madres más jóvenes en el ámbito público.
En las madres con inmunidad previa (seropositivas), los factores de riesgo para la infección congénita del feto están menos definidos, aunque en un estudio reciente de mujeres polacas embarazadas, aproximadamente el 22% de las madres seropositivas que habían transmitido la infección al neonato estaban infectadas con múltiples cepas de CMV 26. Estudios adicionales han demostrado que varios genes de CMV presentan regiones altamente variables, pero falta determinar aún el rol de la infección por diversos genotipos en la transmisión y respuesta inmune 27.
La población estudiada presenta un valor muy elevado de seroprevalencia general (96,95%), que no se correlaciona con el valor de infección congénita de CMV hallado de 0,5%, de acuerdo con la bibliografía publicada. Podría considerarse que la alta seroprevalencia materna estaría actuando más como un factor de protección que de riesgo para la transmisión de CMV in utero, como sucede con otras patologías como el SRC y el síndrome congénito por virus Zika.
Observaciones realizadas en varios estudios ilustran la complejidad que existe en las interacciones CMV/hospe-dador, así como la relación entre inmunidad adaptativa materna y el virus en las infecciones congénitas. Es necesario efectuar estudios adicionales para evaluar más casos de RN con cCMV y poder establecer el patrón de infección vertical en esta población.
En cuanto al RN con cCMV de este estudio, se constató un déficit de audición. El bebé no presentó al momento de nacimiento ninguno de los signos/síntomas indicativos de cCMV clínicamente detectables, representando un ejemplo de la población que sería beneficiada con el screening neonatal universal. La pérdida de audición neurosensorial es una enfermedad progresiva, responsable de secuelas a largo plazo. La infección congénita por CMV asintomática es probablemente una de las principales responsables. El continuo deterioro de la audición y su presentación tardía, hasta 6 años después, enfatizan la necesidad de llevar a cabo un monitoreo continuo en estos niños. Por lo tanto, resulta esencial identificarlos en el período neonatal, cuando la infección congénita puede ser documentada 28 29.
Desde hace años se ha señalado que un screening neonatal de CMV podría beneficiar a miles de niños. La detección temprana constituye una prioridad, dado que las intervenciones oportunas proporcionan una ventaja sustancial. Sin embargo, esto no ha sido implementado globalmente, según lo reportado por Emery 27, debido a que se requiere una mejora en las metodologías disponibles, principalmente en lo que respecta a protocolos más simples y menos costosos.
En cuanto al tratamiento indicado, no hay aún trabajos que hayan evaluado a esta población específica, pero un estudio observacional de cohorte no randomizado evalúa los efectos del vanganciclovir en casos aislados de pérdida de audición neurosensorial (clinicaltrials.gov NCT02005822) 17.
Por último, y en vista de que varias vacunas en desarrollo para prevenir la infección primaria por CMV están siendo evaluadas, debe tenerse en cuenta que quizás no representen una solución para evitar infección congénita en poblaciones como esta, con altas tasas de seroprevalencia, donde la infección primaria se produce a temprana edad. Se necesitan estudios adicionales para evaluar factores de riesgo de infección primaria y no primaria en mujeres de edad fértil y embarazadas. Esta información es crucial antes de implementar estrategias específicas de prevención de infección y/o enfermedad congénita por CMV, como la inmunización con vacunas actualmente en desarrollo22.
Se considera que las maternidades públicas representaban al subsector dado que, de acuerdo con los datos estadísticos de 2012, 3 de los 4 centros participantes reunían el 95,8% de los nacimientos del ámbito público de la provincia. A esto se suma que en este estudio también participó un nuevo hospital, inaugurado en 2013.
En cambio, como limitación de este estudio, quizás el sector privado no haya sido correctamente representado, dado que los 4 centros participantes reunían el 59,5% de los nacimientos de ese ámbito, mientras que el resto se había producido en diversas clínicas y sanatorios distribuidos por la provincia.
Por cuestiones prácticas, algunas maternidades decidieron reclutar binomios de RN internados en las unidades de Neonatología por cualquier condición y manteniendo el criterio de aleatoriedad para la elección. Si bien esta metodología pudo haber generado cierto sesgo en la muestra al favorecer la inclusión de RN con condiciones patológicas, su variedad -atribuible a una amplia gama de causas- denota que ese sesgo no tiene mayor relevancia en cuanto a la estimación de la prevalencia de infección congénita por CMV.
RELEVANCIA PARA POLÍTICAS E INTERVENCIONES SANITARIAS
El conocimiento de la epidemiología local de CMV es importante para evaluar el costo-beneficio de un programa de screening neonatal, que permitiría tomar acciones oportunas a partir del diagnóstico temprano en RN que cursan una infección subclínica. Se evitarían así secuelas progresivas a largo plazo y con impacto para toda la vida.
FUENTE DE FINANCIAMIENTO: Beca Salud Investiga “Dr. Abraam Sonis", categoría individual, otorgada por el Ministerio de Salud de la Nación a través de la Dirección de Investigación para la Salud.