INTRODUCCIÓN
Los pacientes recuperados de la enfermedad por el nuevo coronavlrus (COVID-19) poseen anticuerpos en su sangre que los protegen de futuros episodios causados por el mismo agente infeccioso. Estos anticuerpos pueden obtenerse desde el plasma sanguíneo, que, en este contexto, se denomina plasma de convaleciente.
Los mecanismos de acción del plasma de convaleciente transfundido a una persona con una infección viral son la neutralización viral (mediada solo por anticuerpos) o la citotoxicidad celular mediada por anticuerpos, opsonización, activación de complemento y fagocitosis (como resultado de la interacción entre anticuerpos y células o complemento). De esta forma, se podría neutralizar el microorganismo patógeno que lo afecta y así darle tiempo a esa persona de poner en marcha una respuesta inmune activa, es decir, generada por su propio sistema inmunológico.
Esta terapia tuvo un papel fundamental en la época en que no se contaba con vacunas o medicamentos efectivos para la mayoría de las enfermedades. El antecedente de su uso exitoso en Argentina surge con el tratamiento de la fiebre hemorrágica argentina1,2. En el contexto de la pandemia por la COVID-19, ha resurgido el interés por utilizarla. Existen dificultades prácticas para la obtención de plasma que, a su vez, limita su disponibilidad. Lo más importante para tener en cuenta es que podría ser una alternativa para el tratamiento de la COVID-19 mientras los científicos investigan y encuentran una mejor opción.
Se realizó una revisión sistemática con el objetivo de evaluar los efectos del tratamiento con plasma de convaleciente en pacientes con COVID-19 moderada a grave en comparación con el tratamiento estándar o placebo. Se evaluó y estimó su efecto en desenlaces importantes y críticos como la mortalidad, el ingreso a asistencia ventilatoria mecánica invasiva, el tiempo de hospitalización y eventos adversos graves.
MÉTODOS
Este estudio se realizó con base en los lineamientos PRISMA (para la realización y publicación de revisiones sistemáticas3.
El protocolo fue registrado en PROSPERO con el número CRD42020226735 y bajo el título Use of convalescent plasma in patients with coronavlrus dlsease (COVID-19): systematlc review and meta-analysis.
PREGUNTA CLÍNICA
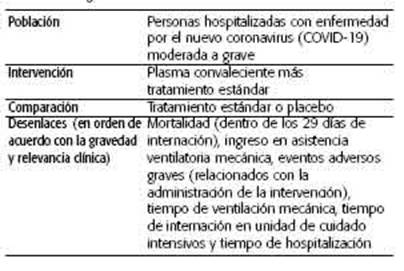
¿Debería usarse plasma de convaleciente en personas hospitalizadas con enfermedad por coronavirus (COVID-19) moderada a grave en comparación con el tratamiento estándar solo o placebo? La pregunta PICO se formula en el Cuadro 1.
DISEÑO
Se trata de una revisión sistemática y metaanálisis.
FUENTES DE DATOS
Se realizaron búsquedas sistemáticas en la plataforma L-OVE (Living OVerview of Evidence) de COVID-19, un sistema que mapea las preguntas PICO a un repositorio desarrollado por la Fundación Epistemonikos. Este repositorio se actualiza de manera continua mediante búsquedas en las bases de datos electrónicas, preimpresión de servidores, registros de prueba y otros recursos relevantes para COVID-19. También se realizó, por duplicado, la búsqueda en las bases de datos electrónicas PubMed, LILACS, Cochrane Library y en el registro de ensayos clínicos clinicaltrials.gov. Los detalles de la búsqueda pueden encontrarse en el Cuadro 2.
No se impusieron restricciones de búsqueda en bases de datos electrónicas. La última búsqueda se realizó el día 15 de enero de 2021.
Se amplió la búsqueda revisando las referencias de los estudios seleccionados (incluidas las revisiones sistemáticas que respondieran a la pregunta de investigación) y con la herramienta “citado por” de Google Académico®.
SELECCIÓN DE ESTUDIOS
Para esta intervención terapéutica, se seleccionaron ensayos controlados aleatorizados (ECA) sin restricción de edad en pacientes con COVID-19 y se incluyeron ensayos que comparasen esta intervención cabeza a cabeza o con ninguna intervención o placebo, o que proporcionasen evidencia sobre desenlaces críticos, ordenados de acuerdo con su relevancia clínica y gravedad (mortalidad, ventilación mecánica, síntomas de resolución o mejoría clínica y eventos adversos graves).
Dos revisores examinaron de forma independiente todos los títulos y resúmenes, seguidos de los textos completos de los ensayos que se identificaron como potencialmente elegibles. Los desacuerdos se resolvieron por consenso.
RECOLECCIÓN DE DATOS
Para cada ensayo elegible, pares de revisores extrajeron los datos de forma independiente mediante un formulario de extracción de datos.
Los revisores recopilaron Información sobre las características de los ensayos (registro del ensayo, estado de publicación, estado del estudio y diseño), características de los participantes y resultados de interés. Los revisores resolvieron discrepancias mediante discusión y, cuando fue necesario, con la intervención de un tercer revisor.
RIESGO DE SESGO DE LOS ESTUDIOS INCLUIDOS
Se aplicó una evaluación del riesgo de sesgo a los ECA con base en la aleatorización, la asignación, la ocultación, el cegamiento u otros sesgos relevantes para las fuentes del riesgo de sesgo. Para cada ensayo y resultado elegible, los revisores utilizaron una revisión con la herramienta Cochrane para evaluar el riesgo de sesgo en ECA (RoB 2.0®)4 y calificar los ensayos en los siguientes dominios: sesgo que surge del proceso de asignación al azar, sesgo debido a desviaciones de la intervención prevista, sesgo debido a datos de resultado faltantes, sesgo en la medición del resultado, sesgo en la selección de los informes de los resultados (incluidas las desviaciones del protocolo registrado) y sesgo que surge de la terminación anticipada en beneficio de la intervención. Se calificaron los ensayos con alto riesgo de sesgo en general si uno o más dominios se calificaron como “algunas preocupaciones o probablemente alto riesgo de sesgo” o como “alto riesgo de sesgo”, y como bajo riesgo de sesgo en general si todos los dominios se calificaron como “algunas preocupaciones, probablemente bajo riesgo de sesgo”. Los revisores resolvieron las discrepancias mediante discusión y, cuando no fue posible, fueron resueltas por un tercero.
MEDIDAS DE EFECTO Y ANÁLISIS ESTADÍSTICO
Se resumió el efecto de las intervenciones sobre los resultados dicotómicos mediante los riesgos relativos (RR) y los correspondientes intervalos de confianza del 95% (IC95%).
Se calculó el efecto relativo mediante un metaanálisis de riesgos relativos utilizando el método de Mantel y Haenszel con un modelo de efectos aleatorios. Se estimó el efecto absoluto a partir del riesgo relativo y el riesgo observado en grupos controles de los estudios incluidos.
Se realizó el metaanálisis de comparaciones directas y el resto de los cálculos mediante el paquete “meta” en RStudio Versión 1.3.1093.14®5.
Para evaluar los efectos absolutos de la intervención, se definieron los riesgos iniciales (riesgos sin intervención) para los desenlaces mortalidad y ventilación mecánica, y para los eventos adversos y la resolución y mejoría de los síntomas se utilizó el riesgo observado en los grupos control o tratamiento estándar de los ECA incluidos6.
CERTEZA EN LA EVIDENCIA
La certeza de la evidencia se estudió mediante la clasificación de la evaluación de recomendaciones, enfoque de desarrollo y evaluación (GRADE)7. Dos metodólogos con experiencia en el uso de GRADE calificaron cada dominio para cada comparación por separado y resolvieron las discrepancias por consenso. Se valoró la certeza para cada comparación y resultado como alta, moderada, baja o muy baja, con base en consideraciones de riesgo de sesgo, inconsistencia, riesgo de evidencia indirecta, sesgo de publicación e imprecisión.
ANÁLISIS DE SENSIBILIDAD, DE SUBGRUPO Y DE SESGO DE PUBLICACIÓN
Se plantearon, como potenciales efectos de subgrupo o modificadores de efecto, el riesgo de sesgo (RoB alto o bajo) según los estándares actuales para las intervenciones farmacológicas en COVID-19, y la calidad del plasma infundido (alto título de anticuerpos versus bajo título de anticuerpos) con base en la concentración de anticuerpos neutralizantes requerida en los estándares descritos en los ensayos clínicos.
PODER DE LA MUESTRA
Se realizó un cálculo del tamaño muestra! para determinar si el número total de pacientes incluidos en el metaanálisis fue menor que el número requerido de pacientes para alcanzar el poder de la muestra, y para determinar si se cumplió el tamaño óptimo de información para un poder del 80%.
Este trabajo se encuentra eximido de la valoración por un comité de ética, dado que, al tratarse de una revisión sistemática, utiliza fuentes secundarias de datos.
RESULTADOS
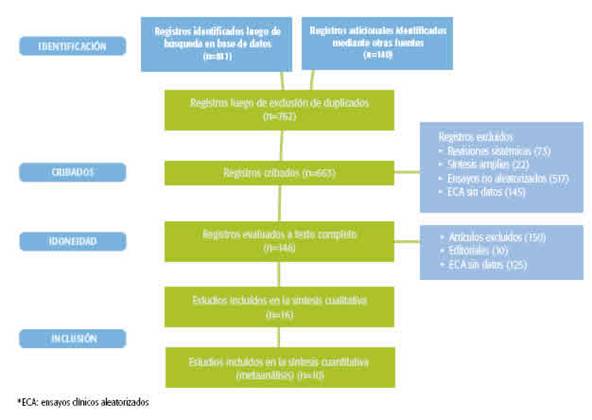
Se identificaron 10 ECA8-17 que incluyeron 11 854 pacientes en los que se comparó el tratamiento con plasma de convaleciente con el tratamiento estándar u otros tratamientos. En el Gráfico 1 se muestra el flujograma con los estudios incluidos.
Todos los estudios incluyeron pacientes moderados y graves, con excepción del trabajo de Libster y col.14, que incluyó pacientes leves y moderados. La mortalidad en los brazos de control osciló entre el 10% y el 25,6%.
En la mayoría de los estudios incluidos, la edad promedio de los pacientes fue de 60 años o más, con predominio del sexo masculino (60-80% de la población incluida), mientras que en el trabajo publicado por Libster y col.14, la edad media fue de 76 años en el grupo intervención y de 78 años en el grupo placebo y, además, cerca del 60% de los pacientes incluidos fueron mujeres.
Se administró plasma de convaleciente con títulos altos de anticuerpos (inmunoglobulina Ig G total y anticuerpos neutralizantes) en los estudios de Horby y col.17, Libster y col.14, Li y col.9 y Simonovich y col.11, mientras que, en el resto de los ensayos aleatorizados, se administró plasma con títulos bajos o no se midieron títulos de anticuerpos neutralizantes.
En relación con el momento de la aplicación del plasma de convaleciente, en los estudios publicados por Libster y col.14, Bajpai y col.15 y Horby y col.17, el plasma se administró en algún grupo o subgrupo en forma temprana (menos de 72 horas después del inicio de los síntomas). En el resto de los estudios incluidos, el rango de tiempo de administración media de plasma fue de 8 días, y osciló entre los 5 y los 30 días posteriores a la fecha de inicio de síntomas.
Las características de los estudios incluidos pueden observarse en en Anexo Tabla 1: http://rasp.msal.gov.ar/rasp/arti-culos/vol13supl/Rev_Tortosa_Anexo1.pdf
El riesgo de sesgo de los estudios fue bajo en forma global para muerte o ingreso en AVM, y alto para el resto de los desenlaces. Esto ocurrió por problemas en la aleatorización y el cegamiento en la mayoría de los estudios, la presencia de múltiples cointervenciones y el informe de los resultados. En la Tabla 2 se muestra el riesgo de sesgo.
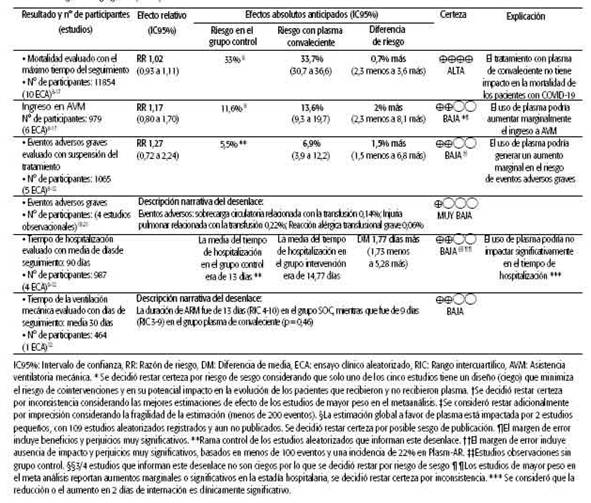
Desenlace mortalidadEl uso de plasma de convaleciente no tiene impacto en la mortalidad de pacientes internados con COVID-19: RR 1,02 (IC95%: 0,94-1,12); DR (diferencia de riesgo) 0,2% (IC95%: de 0,6% menos a 1% menos); certeza alta ® ® ® ® (Gráfico 2).
Desenlace ingreso a asistencia ventilatoria mecánicaEl plasma de convaleciente podría producir un aumento marginal en el ingreso a AVM: RR 1,17 (IC95%: 0,80 a 1,70); DR 2% (IC95%: de 2% menos a 8% más); certeza baja ®® O O.
Desenlace eventos adversos gravesEl plasma de convaleciente podría producir un aumento marginal de los eventos adversos graves: RR 1,27 (IC95%: 0,72-2,24); DR 1,4% (IC95%: -1,6 menos a 6,7 más); certeza baja ®® OO.
Desenlace tiempo de hospitalizaciónEl uso de plasma de convaleciente podría no impactar en forma significativa en el tiempo de hospitalización: diferencia promedio de 1,7 días más (IC95%: de 1,7% menos a 5,28% más).
Desenlace tiempo de ventilación mecánicaLa duración de AVM fue de 13 días (QR 4-10) en el grupo cuidados estándar, mientras que fue de 9 días (QR 3-9) en el grupo que recibió plasma de convaleciente (p = 0,46). En la Tabla 3 se muestra un resumen de los hallazgos.
DISCUSIÓN
Los resultados de la presente revisión sistemática muestran, con certeza alta, que la administración de plasma de convaleciente no disminuye la mortalidad de pacientes con COVID-19, y no disminuiría el ingreso a AVM ni la cantidad de días de internación. En relación con la seguridad de dicha intervención, los estudios aleatorizados analizados sugieren, con certeza baja, un incremento en los eventos adversos graves. Sin embargo, el cuerpo de evidencia proveniente de estudios no aleatorizados18-21 en los que se administró plasma de convaleciente en forma abierta, (es decir, sin grupo control y sin mediar enmascaramiento en la administración de la intervención) a un gran número de personas, sugiere que los eventos adversos graves asociados a la infusión de plasma de convaleciente posiblemente sean excepcionales.

GRÁFICO 2: Efecto del uso de plasma de convaleciente en ECA (desenlace estudiado: mortalidad a los 30 días).
A pesar de esto, y dadas las características clínicas en la evolución de la COVID-19 (en ocasiones, con manifestaciones clínicas y hallazgos en los estudios por imágenes difíciles de distinguir, por ejemplo, de una lesión pulmonar relacionada con la transfusión) y la escasa rigurosidad en los informes de eventos adversos en este tipo de registros19 (o sustancialmente menor a la de un ensayo clínico), es que se prefiere priorizar la certeza en la evidencia en los eventos adversos ocurrida en ensayos clínicos (Tabla 3).
Cabe destacar que la mayoría de los estudios analizados en la presente revisión sistemática incluyeron pacientes hospitalizados por COVID-19. En este sentido, los resultados publicados por Libster y col.14 plantean un posible efecto diferencial y sugieren que el plasma de convaleciente podría ser efectivo cuando se utiliza en forma temprana (pacientes con síntomas de menos de 72 horas de evolución). Sin embargo, este estudio presenta problemas metodológicos que impiden sacar conclusiones certeras: 1) el desenlace primario fue un subrogado, la “enfermedad grave” (definida como taquipnea o hipoxemia) es un resultado sustituto cuyo significado es incierto. Su asociación con la muerte es necesaria pero no suficiente para considerarla un sustituto válido; 2) de los 38 pacientes que desarrollaron el desenlace primario (“enfermedad grave”) solo 10 (26%) recibieron tratamiento con flujo elevado de oxígeno; es incierto cómo la reducción informada en este desenlace subrogado, de gravedad definida en forma imprecisa, se traduciría en un efecto sobre otros desenlaces críticos como el requerimiento de asistencia ventilatoria mecánica o la muerte; 3) el desenlace primario está definido por mediciones como la frecuencia respiratoria o la saturación arterial de oxígeno, que tienen una gran variabilidad en períodos cortos, lo que lo hace particularmente vulnerable al sesgo de medición; y 4) la estimación de efecto informada es frágil, ya que, si tan solo un paciente del grupo experimental pasa de no tener enfermedad grave a tenerla, la estimación del efecto perdería significancia estadística.
Además, el estudio publicado por Balcells y col.22, un ensayo clínico en el que se administró en forma aleatoria plasma de convaleciente con títulos elevados de anticuerpos en forma temprana (dentro de las 72 horas de inicio de síntomas) versus tardía (en caso de deterioro clínico) a pacientes con COVID-19 moderada, no mostró diferencias en la mortalidad, la duración de la hospitalización o la necesidad de ventilación mecánica. Más recientemente, el estudio publicado por Horby y col.17 como parte del grupo colaborativo RECOVERY en su rama de tratamiento con plasma y sobre 11 558 pacientes internados por CO-VID-19 (moderados, graves y críticos) no encontraron diferencias en la mortalidad o en otros desenlaces importantes, ni estimaciones de efecto que sugieran un beneficio, en aquellos en los que se administró la intervención antes de las 72 horas en comparación con la administración tardía. En consonancia, los análisis de subgrupo realizados en el presente estudio, con base en el título de anticuerpos y el momento de administración (temprana frente a tardía), no mostraron evidencias de un posible efecto de subgrupo en ninguno de los desenlaces evaluados.
Con base en lo antes descrito, se considera poco probable que el plasma de convaleciente indicado en forma temprana proporcione grandes beneficios, por lo que los hallazgos de la presente revisión sistemática aplican a todo el universo de pacientes con COVID-19.
Por otro lado, como afirman Katz y col.23, identificar y tratar a pacientes de alto riesgo con síntomas tempranos sin criterios de gravedad, podría no ser factible, ya que probablemente generaría una presión importante sobre el sistema de salud al desviar recursos a un subgrupo de pacientes que no desarrollará enfermedad grave, aún si no fueran tratados. Otras barreras potenciales incluyen las preferencias de los pacientes, los problemas de logística para administrar el plasma a tiempo y el suministro insuficiente de plasma para tratar a todos los pacientes con factores de riesgo y síntomas tempranos.
Otras revisiones sistemáticas actualizadas y de alta calidad metodológica, como las realizadas por Chai y col.24 del grupo Cochrane y la Organización Panamericana de la Salud25, mostraron incertidumbre en el efecto del plasma sobre la mortalidad, el ingreso a ventilación mecánica o la ocurrencia de eventos adversos graves.
CONCLUSIONES
El plasma de convaleciente no reduce la mortalidad en pacientes con COVID-19 y posiblemente no reduzca la necesidad de ventilación mecánica invasiva. Para algunos desenlaces, la certeza en la evidencia todavía es baja. Existe incertidumbre en el efecto del uso de plasma convalenciente en la ocurrencia de eventos adversos graves.