INTRODUCCIÓN
La enfermedad respiratoria aguda por el nuevo coronavirus (COVID-19) es causada por el virus SARS-CoV-2. Des de su identificación en Wuhan (China), en diciembre de 2019, se ha extendido por todo el mundo en una pandemia que lleva más de 148 millones de casos reportados y tres millones de decesos a mayo de 2021.
Luego de un período de latencia, la infección se manifiesta de manera gradual con una serie de síntomas cada vez más amplia que incluye fiebre, tos seca, fatiga, dolor de cabeza, anosmia, congestión nasal, conjuntivitis, dolor de garganta y, con menos frecuencia, síntomas digestivos o manifestaciones cutáneas. Sin embargo, no todas las personas infectadas presentan síntomas. Aún no se conoce cuál es la proporción de personas asintomáticas, y los valores notificados en la literatura son muy variados. Una revisión de trabajos publicados sobre la prevalencia de personas asintomáticas sugiere que representan entre el 40% y el 45% de las personas infectadas1, con una estimación más conservadora de aproximadamente el 30%. Aunque está establecido que las personas asintomáticas pueden transmitir el SARS-CoV-2, su papel en el contagio todavía no es claro. Mientras algunos estudios epidemiológicos su gieren que la transmisibilidad es similar en personas sinto máticas y en asintomáticas2, otros autores encuentran una tasa de transmisión más baja entre estas últimas3.
El grupo vulnerable está compuesto de adultos mayores y personas con comorbilidades como problemas pul monares, cardíacos, diabetes e hipertensión arterial. La tasa de hospitalización es de aproximadamente el 20% y la tasa de letalidad se estima entre 1% y 5%.
La infección de un individuo con el SARS-CoV-2 puede ocurrir en simultáneo con otras infecciones virales, bacterianas o fúngicas. De hecho, el hallazgo de pacientes con COVID-19 y otras patologías respiratorias es bastante frecuente4. En cambio, los casos de pacientes con coinfección de dengue y COVID-19 están menos documen tados5-8. Recientemente, se han notificado 13 casos de coinfección de dengue y COVID-19 identificados de ma nera retrospectiva en la Ciudad Autónoma de Buenos Aires (Argentina) y alrededores9.
La concurrencia de la COVID-19 con el dengue es de particular interés en la Región de las Américas. Según la Organización Panamericana de la Salud (OPS), en 2019 se notificaron en la Región 3 139 335 casos de dengue (con una tasa de incidencia de 321,58 casos cada 100 000 habitantes), de los cuales el 0,9% correspondió a dengue grave. La tasa de letalidad fue del 0,049%10. En el caso de Argentina, en la temporada 2019-2020 se ha superado en más del 40% el mayor de los brotes registrados antes11.
En abril de 2020, la Organización Mundial de la Salud (OMS) se expresó sobre la situación de transmisión simultánea de ambas enfermedades, y alertó sobre una posible coinfección que conduce a la superposición de síntomas, al diagnóstico erróneo y a una dificultad extra en el manejo de los casos12. Esta coepidemia resultó un motivo de preocupación en varios países de América Latina y Asia, y expuso la necesidad de estrategias de abordaje sanitario13-17. En julio de 2020, la OPS declaró el alerta epidemiológico por la situación del dengue en el contexto de la pandemia18. Sin embargo, el impacto en la salud y en los sistemas sanitarios no está claro aún.
El agente etiológico del dengue es el arbovirus DENV, de la familia Flaviviridae, que tiene cuatro serotipos. La infección con un serotipo provee inmunidad de por vida contra ese serotipo y una protección de corta duración contra los serotipos heterólogos. El vector principal del dengue es el mosquito Aedes aegypti, también transmisor de otros arbovirus causantes de zika y chikunguña. La enfermedad causada por estos virus se clasifica en dengue y dengue grave. Este último incluye el dengue hemorrágico, el síndrome de shock y otras formas graves. La presenta ción más usual es con síntomas leves como fiebre, dolor de cabeza, malestar general, náuseas, dolor abdominal y manifestaciones cutáneas (exantema); sin embargo, hasta un 80% puede cursarla de modo asintomático. La recomendación para evitar el contagio es el aislamiento ento mológico del paciente y, en algunos casos, la fumigación domiciliaria en las zonas que son focos de contagio.
Si bien el dengue y la COVID-19 no comparten el agente etiológico ni el modo de contagio, sí presentan similitudes, sobre todo en etapas tempranas. Su epidemiología tiene algunos puntos en común. Por un lado, en ambas enfermedades una gran parte de los infectados cursa con sintomatología nula o leve: fiebre, dolores musculares y malestar general19. Por otra parte, ambas presentan la mayor mortalidad en los pacientes de más de 65 años. Algunos hallazgos de laboratorio también son similares, se pueden observar leucopenia, alteración de enzimas hepáticas y plaquetopenia. En un trabajo reciente, se informó que al menos el 3,8% de los primeros 116 974 casos confirmados de COVID-19 en Argentina presentó síntomas compatibles con ambas enfermedades20.
La similitud en las etapas tempranas de ambas enfermedades podría causar, en caso de coepidemia, demoras en el diagnóstico de la infección por dengue, por SARS-CoV-2 o por ambas21. Se describieron resultados falsos positivos en las pruebas serológicas para dengue en pacientes con COVID-19 en Singapur e Indonesia. Esto agrega una dificultad adicional al diagnóstico y sugiere que no resultaría suficiente un resultado positivo de serología IgM o IgG para la confirmación definitiva de dengue8.
Por otra parte, la pandemia por COVID-19 podría impactar de manera negativa sobre el control del dengue. Uno de los factores es que la población evita o retrasa la asistencia a centros de salud debido al alerta generado en la sociedad sobre los riesgos de contagio y la saturación del sistema de salud18. En estas condiciones, una parte importante de los afectados por dengue no recibiría diagnóstico y, por lo tanto, no realizaría el aislamiento entomológico ni el control de caso adecuado. Además, el Aedes aegypti es un mosquito con hábitos peridomiciliarios, por lo que los contagios de dengue ocurren sobre todo en el hogar. La mayor permanencia en los hogares dictada por las medidas de aislamiento social obligatorio que se está implementando en regiones afectadas por COVID-19 podría causar un incremento en el contagio. Como tercer factor, el flujo de recursos sanitarios y económicos hacia la COVID-19 podría afectar las campañas informativas y de saneamiento ambiental que se requieren para controlar un brote de dengue22. La Sociedad Brasilera de Medicina Tropical alertó sobre la posibilidad de que el aumento de los casos de dengue que se registró en Brasil en los primeros meses de este año respecto de 2019 tuviera relación con la epidemia por la COVID-1923.
Aunque el manejo de pacientes con coinfección reviste mayor complejidad, no hay aún evidencia concluyente de que dicha condición represente un riesgo adicio nal. En un estudio se ha informado que la coinfección no empeora el estado de los pacientes9; sin embargo, en otro estudio se describe una fuerte asociación entre la coinfección y el descenso de glóbulos blancos, neutrófilos, linfocitos y plaquetas y también se comunica un aumento de la mortalidad24. El número de casos estudiados es aún muy bajo, de modo que no se puede descartar que se trate de un problema grave.
En resumen, el desarrollo simultáneo de epidemias de dengue y COVID-19 ocasionaría diversas dificultades. En tre ellas, la existencia de una fracción de pacientes con ambas infecciones en simultáneo, y un peor manejo de la epidemia de dengue, que podría incluir el retraso en el diagnóstico correcto y el aumento de casos debido a la discontinuidad de las medidas de control.
Los modelos matemáticos han demostrado ser una herramienta útil para explorar distintas situaciones en la propagación de enfermedades, tanto endémicas como epidémicas. En el caso de la actual pandemia por la COVID-19, las proyecciones realizadas mediante modelado han cobrado relevancia por su potencial ilustrativo, ya que permiten visualizar tendencias. En este trabajo, se presenta un modelo matemático combinado que describe las dinámicas de propagación de dengue y COVID-19 en distintas condiciones epidemiológicas, y que permite, además, describir la dinámica de la población de interés en este trabajo: la que desarrolla ambas infecciones en simultáneo. Además, el modelo permite estimar el impacto de posibles efectos relacionados con la simultaneidad de ambas enfermedades, como la implementación de cuarentena, en la dinámica de la población con coinfección.
MATERIALES Y MÉTODOS
MODELADO MATEMÁTICO DE LA COINFECCIÓN
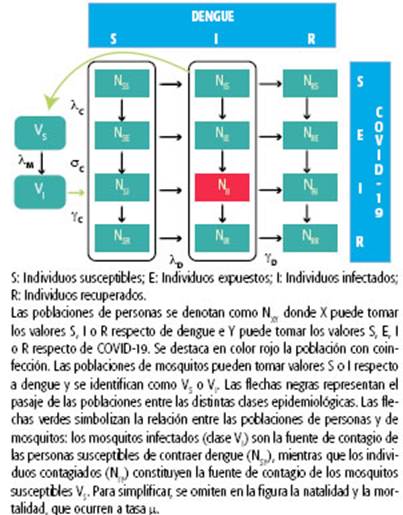
El modelo de coinfección presentado aquí es de tipo compartimental, con dinámica vital (nacimientos y muertes) pero sin estructura etaria (ver Gráfico 1). Su aplicación es determinista y de tiempo continuo, y su dinámica está descrita por un conjunto de ecuaciones diferenciales cuya resolución describe la evolución de los distintos estados epidemiológicos de la población en el tiempo. En su diseño, se utilizaron como base dos modelos matemáticos simples, también de tipo deterministas, compartimentales y sin estructura etaria. El modelo combinado presentado aquí reproduce así la dinámica de cada infección por separado, pero permite la existencia de estados epidemiológicos combinados, en particular, la coinfección por las dos enfermedades. En el modelo, el estado epidemiológico del huésped respecto del dengue es independiente de su estado respecto de la COVID-19. Por ejemplo, una parte de la población podrá estar simultáneamente infectada de dengue y recuperada de COVID-19.
MODELOS BASE
Para la dinámica de COVID-19 se utilizó un modelo con cuatro clases para describir los estados epidemiológicos de la población: susceptible, expuesto, infectado o recu perado (conocido como modelo SEIR26). Se consideró la dinámica vital (es decir, nacimientos y muertes) pero sin dividir a la población en grupos etarios. Se utilizaron modelos similares para el modelado de COVID-1927 y resultan una primera aproximación ante la falta de informa ción epidemiológica precisa que permita un modelado más realista y detallado.
Para la dinámica de dengue, se utilizó como base el modelo de Derouich et al.1que considera tres estados epidemiológicos para la población de seres humanos: susceptible, infectado o recuperado, conocido como modelo SIR26; y dos estados para la población de mosquitos: susceptibles o infectados (modelo SI). El modelo considera nacimientos y muertes para la población de seres humanos y no tiene en cuenta su edad.
MODELO COMBINADO
El modelo combinado construido a partir de los modelos base considera 12 compartimentos epidemiológicos que describen los estados posibles de la población huésped (las combinaciones entre los tres estados posibles para dengue y los cuatro estados posibles para COVID-19) y dos compartimentos que describen los estados posibles del vector. El diagrama de flujo del modelo se muestra en el Gráfico 1. Se utilizaron subíndices para hacer referencia al estado en relación con las infecciones; en el caso de la población humana, el primer subíndice corresponde a dengue (S, I o R) y el segundo, a COVID-19 (S, E I o R). La transición de los individuos entre los distintos estados ocurre de acuerdo con las tasas que se parametrizan según los tiempos propios de cada enfermedad. El tamaño de las poblaciones de humanos infectados de dengue, de COVID-19 y ambas enfermedades es
identificado por ND, NC y NDC, respectivamente. El sistema completo de ecuaciones diferenciales del sistema y la parametrización empleada se describen en las secciones 1 y 3 del Anexo disponible en: http://rasp.msal.gov.ar/rasp/ articulos/vol13supl/REV_Bergero_Anexo1.pdf. El modelo de coinfección diseñado es el más simple posible, ya que las tasas de contagio (o fuerzas de infección) de dengue y de COVID-19 son independientes; es decir, adquirir una infección no aumenta el riesgo de adquirir la otra, como ocurre con otras enfermedades. En ausencia de evidencia que sugiera lo contrario, la hipótesis de susceptibilidad mutua, o sea, que la infección por dengue facilite la infección por coronavirus a través de una tasa de contagio diferencial, y viceversa, no ha sido explorada. Tampoco se incluye la inmunidad cruzada entre ambas infecciones. Sin embargo, en el estudio se incluye la posibilidad de un aumento en la fuerza de infección de dengue y también de la duración del período de contagio debido a las condiciones que surgen de la epidemia por el nuevo coronavirus. En este trabajo no se considera una mortalidad inducida por dengue o por COVID-19, dado que la tasa de mortalidad para cada enfermedad es baja. Como el modelo combinado fue planteado de modo que ninguna de las tasas de una enfermedad sea afectada por la otra, al analizar las poblaciones para cada enfermedad por separado, la dinámica que muestra el modelo combinado para cada una de ellas resulta idéntica a lo esperable para cada modelo base, tanto en el rango epidémico como en los valores de equilibrio25.
Las infecciones de individuos con dengue y COVID-19 ocurren con las fuerzas de infección 1D y 1C respectivamen te. La transición del estado expuesto a infectado para CO- VID-19 ocurre a tasa oC. Las recuperaciones de individuos con dengue y COVID-19 ocurren a tasas gD y gC, respecti vamente, definidas como el inverso del período infectivo. Una magnitud que resulta de interés es C(t), que da cuen ta de los casos acumulados de coinfección en función del tiempo. El número de nuevos casos de coinfección genera dos entre el tiempo 0 y el tiempo t será, entonces:
C(t)=/ot (Id (u).Ns |(u) +S; (u).NE(u)).du
CONDICIONES INICIALES
Para ilustrar la dinámica de coinfección se parte de un estado inicial que resulte una primera infección respec to de COVID-19 (es decir, toda la población está en la clase Susceptible respecto de COVID-19) mientras que para dengue se considera una población que ya ha sido expuesta, es decir, parte de los individuos están en es tado Recuperado respecto del dengue. Con el objetivo de iniciar las epidemias, son introducidos individuos in fectados de COVID-19 el día 1 de la simulación, mientras que introducimos mosquitos infectados de dengue el día 10 (ver detalles en la sección 3 del Anexo disponible en: http://rasp.msal.gov.ar/rasp/articulos/vol13supl/REV_Bergero_Ane- xo1.pdf).
ESCENARIOS EPIDEMIOLÓGICOS
Para los análisis se consideraron tres escenarios posibles de contagio de COVID-19, según el número reproductivo R0, que representa la cantidad de casos secundarios producidos por un infectado en una población susceptible. La tasa a la que ocurren los contagios, es decir, la fuerza de infección 1C, está relacionada con R0 según 1C= R0(m+ aC)(m+yC)(1/aC) (Ns+ N„+ Nri)(1/N).
Los valores de R0 empleados son: R0= 2,0; R0= 2,5 y R0= 4,0 según los escenarios desarrollados por los Centros para el Control y Prevención de Enfermedades (CDC, por su sigla en inglés) para el modelado mate mático de la pandemia28. El caso R0= 2,5 se considera como el escenario de referencia.
En el momento en que se inicia la cuarentena de COVID-19, se imponen reglas sanitarias y de aislamiento social que reducen los contagios. En términos del modelado, la reducción en la tasa de contagio de COVID-19 debido a la implementación de medidas sanitarias ocurre mediante una función de contagio dependiente del tiempo, representada por bC(t), que disminuye exponencialmente la tasa de contagio. Esta función modela la reducción en la contagiosidad desde un valor inicial bCinicial (definido para cada escenario de R0 considerado), hasta llegar a una tasa de contagio final e igual para todos escenarios, bCfinal y su comportamiento temporal depende del tiempo de inicio de la cuarentena (ver secciones 2 y 3.1 del Anexo disponible en: http://rasp. msal.gov.ar/rasp/articulos/vol13supl/REV_Bergero_Anexo1.pdf).
También, por tratarse del estudio de efectos dinámicos, en el caso de modelar los efectos del aislamiento social domiciliario como medida de control, se considerarán dos diferentes escenarios: inicio temprano e inicio tardío, que se describen en la siguiente sección.
Además del efecto reductor sobre la tasa de contagio de COVID-19, se modeló un escenario en que el aisla miento social obligatorio tiene dos efectos sobre la diná mica de la transmisión de dengue:
El retraso en el diagnóstico de dengue, que se modela aumentando el período infectivo de la enfermedad (1/g d).
El incremento en casos de dengue por descuido en el control del vector, que se modela mediante un incremento en la fuerza de infección 1D a través de un aumento en el número de picaduras diarias (b).
En este escenario, al iniciarse las medidas sanitarias, el período infectivo 1/gD se incrementa en dos días y el número de picaduras diarias (b) se incrementa en 0,25 respecto de los valores considerados como referencia.

GRÁFICO 2: Fracción de infectados de dengue, infectados de COVID-19 y coinfectados para distintos valores de R0.
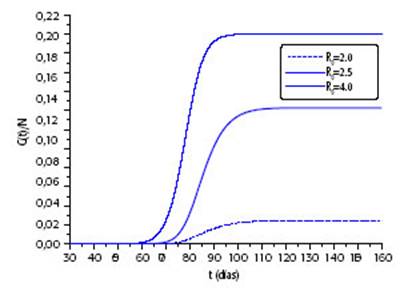
GRÁFICO 3A: Fracción de casos acumulados de coinfección. Evolución temporal de la fracción de casos acumulados de coinfectados para las curvas del Gráfico 2.
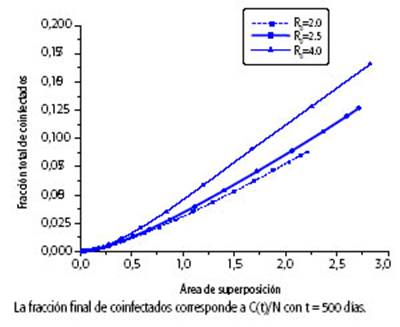
GRÁFICO 3B: Fracción de casos acumulados de coinfección. Fracción de casos acumulados de coinfectados para distintos grados de superposición entre epidemias.
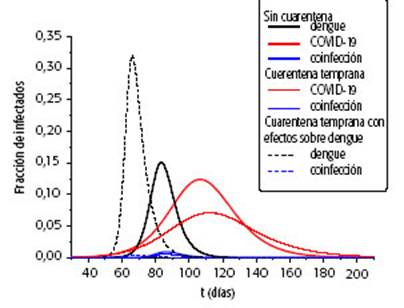
GRÁFICO 4A: Efecto de la cuarentena en la fracción de infectados con dengue, infectados con COVID-19 e infectados con ambas, para el caso R0 = 2,5. Escenario de cuarentena temprana.

GRÁFICO 4B: Efecto de la cuarentena en la fracción de infectados con dengue, infectados con COVID-19 e infectados con ambas, para el caso R0 = 2,5. Eescenario de cuarentena tardía.
RESULTADOS
El modelo de coinfección permite describir la evolución de cada una de las poblaciones. En el Gráfico 2 se mues tran la fracción de infectados de dengue, de COVID-19 y los coinfectados, para diferentes escenarios posibles de contagio de COVID-19. Como puede verse, la magnitud y posición del máximo de la curva de coinfectados depende de la magnitud y la posición del máximo de las curvas de ambas enfermedades.
En el Gráfico 3A se muestra la fracción de casos acumulados de coinfección, C(t)/N, para diferentes valores posibles del R0 de COVID-19 para la situación que se muestra en el Gráfico 2. En este caso, cuanto más alto es el R0 de COVID-19 mayor es la fracción de casos acumulados de coinfección que se tenga al final de la epidemia; sin embargo, esto no se cumple necesariamente en todas las situaciones, ya que también influye el grado de simultaneidad de las dos epidemias. Para explorar la dependencia de la fracción total de casos de coinfección con el grado de simultaneidad, se consideró como parámetro el área de superposición entre las curvas de infectados con dengue y con COVID-19 (es decir, el área comprendida entre la curva de color negro y una de las de color rojo del Gráfico 2). En el Gráfico 3B se observa que, cuando la superposición es muy baja, la fracción final de coinfectados cambia poco con el R0. Para valores más altos, como resulta esperable, se observa que, para un valor de área de superposición fija, la fracción final de casos de coinfección crece con el R0 considerado, y que para un R0 fijo, será mayor cuanto mayor sea la superposición entre las epidemias. La fracción final de coinfectados crece de manera lineal con el área de superposición entre las curvas en casi todo el rango.
EFECTOS DE LA INTERVENCIÓN SANITARIA (AISLAMIENTO SOCIAL DOMICILIARIO O CUARENTENA)
El efecto de la reducción en el contagio se traduce en la disminución y el retraso del pico epidemiológico del brote de COVID-19 y, por lo tanto, afecta la dinámica de la coinfección. Dado el papel que cumple el grado de su perposición de las epidemias, para un mismo brote de dengue se consideran dos escenarios para COVID-19: el de cuarentena temprana, en el que se inicia a T1= 40 días desde el comienzo de la epidemia de COVID-19, y uno menos favorable en que la medida se demora hasta T1= 70 días. El efecto de los dos escenarios de cuaren tena en la fracción de infectados para R0= 2,5 se muestra en las curvas continuas de los Gráficos 4A y 4B. En ambos escenarios, el pico de COVID-19 se reduce, y se aprecia, además, el efecto del retraso cuando la cuaren tena se implementa de modo temprano (Gráfico 4A).
En el escenario de cuarentena temprana, la fracción de casos acumulados de COVID-19 al final de la epidemia se reducirá en un 23%, mientras que, si la cuarentena es tardía, la reducción será del 9% (Ver Gráfico 5).
Respecto del efecto del aislamiento social sobre la dinámica del dengue, tanto el incremento en la fuerza de infección como el aumento en el tiempo de contagio, causan un aumento del brote y su adelantamiento. Las modificaciones sobre la dinámica de dengue y sus efec tos en la dinámica de la coinfección se muestran en las curvas a trazos del gráfico 4 para los escenarios de cuarentena temprana (Gráfico 4A) y cuarentena demorada (Gráfico 4B).
Para facilitar la comparación del efecto de los distintos escenarios de cuarentena sobre la población de coinfec tados, en el Gráfico 5 se muestra la fracción de casos acumulados, C(t)/N, para el caso R0= 2,5. Como se ob serva, el escenario de cuarentena temprana es el que arroja una menor fracción final de casos de coinfección cuando no se consideran efectos adicionales sobre el dengue. Como es de esperar, la cuarentena reduce los casos de coinfección en mayor medida cuando su inicio es temprano (40%) que cuando es tardío (7%).
Aunque los efectos de la cuarentena en la dinámica de dengue son negativos, y tienen como consecuencia un adelanto en la aparición de casos de coinfección, un re sultado interesante es que su inclusión en el modelo no aumenta la fracción final de coinfectados. En el escenario de cuarentena temprana, la inclusión de efectos adiciona les sobre dengue adelanta de manera marcada el desarrollo de la epidemia, reduce la superposición y disminuye la fracción final de coinfectados, mientras que para la cua rentena tardía la reducción es poco apreciable (Gráfico 5).
DISCUSIÓN
Como se esperaba, el efecto de una cuarentena que disminuya los casos de COVID-19 también reducirá los casos de coinfección, con una reducción mayor cuanto más temprana sea la cuarentena.
En el caso de que la cuarentena incluya efectos negativos sobre la dinámica del dengue, el modelo predice un incremento de los casos de dengue pero también un adelantamiento del pico, por lo cual, al modificar la dinámica de superposición, este empeoramiento del dengue no tiene necesariamente un efecto negativo sobre la curva de coinfectados.
El modelo de coinfección presentado fue utilizado para mostrar tendencias relativas a las posibles interacciones entre las dos epidemias, y no con objeto de una com paración directa con datos epidemiológicos. Uno de los factores que dificultan la comparación directa es la subnotificación. Por ejemplo, en el caso de Brasil, mientras a comienzos de 2020 los casos de dengue notificados superaron a los de años anteriores, se observó un descenso abrupto a partir de la semana epidemiológica 11, cuando se esperaba un aumento estacional29. Esta sema na coincide con el inicio de la implementación de medidas contra la COVID-19, por lo que los datos se han interpretado como posible subnotificación30.
El modelo de coinfección entre dengue y COVID-19 presentado se basa en dos modelos muy simplificados y, por lo tanto, hereda las limitaciones de los modelos originales. En el caso del dengue, no se consideran factores relevantes como la modulación temporal de la abundancia del vector, ni el tiempo de latencia de la enfermedad, ni la existencia de más de un serotipo circulante. Tampoco se considera la edad en el modelo, lo que constituye un aspecto importante, sobre todo para la COVID-19. Tanto el dengue como la COVID-19 tienen una alta proporción de individuos asintomáticos, que no se tuvieron en cuenta aquí de modo explícito, dado que no está claro que presenten diferencias en la transmisibilidad respecto de los sintomáticos.
En los escenarios presentados, se considera que la epidemia de dengue ocurre primero que la de COVID-19. Si bien esta situación epidemiológica resultará compatible con la de algunas regiones (como Santa Cruz, Bolivia), otras relaciones entre las magnitudes y el despliegue temporal de ambas epidemias pueden ser simuladas modificando los parámetros del modelo. Es evidente que el peso que tienen las magnitudes de los brotes y el grado de sincronía entre ambos sugiere que cualquier estudio realista de la coinfección debe tener una fuerte impronta local.
A pesar de estas consideraciones, las autoras entienden que el modelo propuesto para la interacción entre den gue y COVID-19 ofrece un primer abordaje de la dinámica de coinfección que puede ser de utilidad al sistema de salud, para dar visibilidad a esta problemática y compren der los mecanismos que podrían afectar su dinámica.
AGRADECIMIENTOS: A Erika Bartel, por su lectura crítica del manuscrito.