INTRODUCCIÓN
El 31 de diciembre de 2019, en la ciudad de Wuhan (China), se notificaron casos de neumonía causada por un virus nuevo, que luego recibiría el nombre de coronavirus de tipo 2 del síndrome respiratorio agudo grave (COVID-19)1. El nuevo coronavirus se diseminó de manera muy rápida a todo el mundo. Ante esta situación, el 11 de marzo de 2020 la Organización Mundial de la Salud (OMS) declaró a la enfermedad por el coronavirus de 2019 (COVID-19, por sus siglas en inglés) como una pandemia2.
En Argentina, el 22 de enero de 2020 se emitió una alerta epidemiológica y se inició la vigilancia de COVID-19 a través del Sistema Nacional de Vigilancia en Salud (SNVS 2.0). El 3 de marzo de ese mismo año se registró el primer caso confirmado de coronavirus, correspondiente a un residente de la Ciudad Autónoma de Buenos Aires (CABA), y el 7 de marzo se notificó el primer fallecimiento por COVID-19, en un residente de CABA con antecedente de viaje a Europa. En la provincia de Buenos Aires (PBA), el primer caso confirmado de COVID-19 fue un paciente con antecedente de viaje al extranjero, que comenzó con síntomas a fines de febrero de 2020. Se decretó un confinamiento estricto desde el 20 hasta el 31 de marzo a fin de proteger la salud pública (Aislamiento Social Preventivo y Obligatorio [ASPO]), y luego el plazo se prorrogó hasta el 26 de abril inclusive. Tras esta fecha, resultó imprescindible realizar una diferenciación entre zonas con transmisión comunitaria extendida del virus, zonas con conglomerados y casos esporádicos sin nexo, y aquellas con brotes o conglomerados pequeños controlados. Así se estableció un nuevo marco normativo, el Distanciamiento Social Preventivo y Obligatorio (DISPO), con el objetivo de recuperar el funcionamiento económico y social donde la situación epidemiológica lo permitiera, conservando dos referencias para limitar los desplazamientos de las personas: por un lado, la razón de tasas (cuando el cociente entre el número de casos confirmados acumulados en los últimos 14 días y el número de casos confirmados acumulados en los 14 días previos era superior a 1,20); por el otro, la tasa de incidencia (cuando el número de casos confirmados acumulados de los últimos 14 días por 100 mil habitantes era superior a 150)3.
Desde el comienzo de la pandemia hasta el 31 de marzo de 2022, en PBA se llegó a los 3 542 289 casos, de los cuales fallecieron 59 746, mientras que en Argentina el número de infectados alcanzó para esa misma fecha los 9 037 911 casos, de los cuales murieron 128 019. Las medidas de salud pública adoptadas por el país para contener la pandemia de COVID-19 persiguieron distintos objetivos, que incluyeron acciones de prevención, investigaciones y tratamientos experimentales, creación de infraestructura y abastecimiento de recursos médicos, protocolos sanitarios y una campaña de vacunación iniciada el 29 de diciembre de 2020. En febrero de 2020, siguiendo las recomendaciones de los organismos internacionales, el Ministerio de Salud de la Nación elaboró el Plan Nacional de Preparación, que recomendaba poner en marcha medidas de Salud Pública farmacológicas y no farmacológicas.
Una de las mediciones que se incorporaron rápidamente a la vigilancia del COVID-19 fue la estimación del número reproductivo básico (R0). R0 se define como el número promedio de individuos que pueden llegar a infectarse (casos secundarios) a partir del primer individuo infectado (caso primario) en una población completamente susceptible. Se trata de un parámetro teórico, que proporciona cierta información acerca de la velocidad con que una enfermedad puede propagarse en una población determinada. Puede interpretarse como el número esperado de contactos que un individuo infeccioso tiene durante su período completo de infección. Si R0>1, los individuos infecciosos al inicio de la enfermedad incrementarán el número de nuevas infecciones, es decir, se producirá un brote epidémico; por el contrario, si R0<1, los individuos enfermos serán, como población, transmisores poco eficientes, y la enfermedad acabará por desaparecer. Si R0=1, cada individuo simplemente se reemplazará a sí mismo y no se producirá un brote epidémico4,5.
Los modelos epidemiológicos estándar parten del supuesto de que los individuos se encuentran en uno de varios estados posibles. En función de dichos estados, la población puede incluirse en la categoría de individuos susceptibles (S), infectados (I) o recuperados (R). Los modelos más importantes son SI, SIS y SIR, que pueden modelarse en forma determinista o estocástica, y en todos ellos se asume que la interacción es aleatoria. Los individuos empiezan como susceptibles a un agente patógeno determinado y, si se infectan, van pasando a los otros dos compartimentos. El modelo se define por un sistema de tres ecuaciones diferenciales ordinarias:
(1)
(2)
(3)
donde beta es la tasa de transmisión, gamma es la tasa de recuperación (o la inversa del período infeccioso) y N es el tamaño total de la población, de manera que N=S+I+R. En el modelo ordinario de la ecuación se da por sentado que no hay nacimientos ni muertes. Al comienzo del brote o epidemia (t=0), se supone que la población está constituida totalmente por individuos susceptibles y un solo individuo infeccioso. Con este modelo, si la tasa de transmisión excede a la de recuperación (es decir beta/ gamma>1), la enfermedad se propagará (dI/dt>0). Por otro lado, beta/gamma es el número de infecciones nuevas por unidad de tiempo multiplicado por el tiempo que dura la infecciosidad y describe el número de infecciones nuevas que se originaron del individuo infectado inicialmente. En este modelo SIR sencillo, el número reproductivo básico (o la razón reproductiva básica) es igual a beta/gamma. Los modelos SIS se usan para enfermedades en las que no hay Inmunidad, pues, una vez que las personas Infectadas se recuperan, pasan a ser de nuevo susceptibles. Por lo tanto, la progresión de la enfermedad desde el punto de vista de un individuo es susceptible-infectado-susceptible. El verdadero R0 es desconocido; si bien existe una amplia gama de cifras reportadas para COVID-19, se supone que es 3,7. En definitiva, constituye más bien un estimador teórico, previo al desarrollo de la pandemia. Empíricamente entonces se trabaja con un estimador real, que considere los diferentes componentes, en términos de los modelos SIR y sus variantes, como lo es el número reproductivo efectivo para medir la transmisibilidad (Rt), es decir, el número promedio de casos secundarios causados por un individuo infectado en una población compuesta por individuos susceptibles y no susceptibles (por ejemplo, aquellos que ya son inmunes o se encuentran aislados)6. Rt es un parámetro esencial para cualquier proyección relacionada con COVID-19. Se basa en los casos diarios informados por el sistema nacional y el intervalo de serie esperado, y es un parámetro conocido. El objetivo del presente trabajo fue estimar la dinámica de la pandemia de COVID-19 con sus tres ondas a lo largo de dos años (desde marzo de 2020 hasta fines de marzo de 2022) en PBA, empleando para ello la estimación de la variación en el Rt.
MÉTODOS
Se realizó un estudio de cohorte retrospectivo. La información se obtuvo del SNVS 2.0. Se incluyeron todos los casos confirmados de COVID-19 con diagnóstico por laboratorio o criterio clínico-epidemiológico que hubieran iniciado síntomas desde marzo de 2020 hasta el 31 de marzo de 2022. En la evolución de la pandemia en Argentina se señalan en este informe tres períodos o fases epidémicas (que implican un número creciente de personas enfermas, un pico definido y luego una disminución). El primer período fue desde el inicio de la pandemia hasta el 1 de diciembre de 2020, con rebrote del 2 de diciembre de 2020 al 16 de febrero de 2021. El segundo abarcó desde el 17 de febrero de 2021 hasta el 10 de octubre de 2021 (punto de inflexión de la incidencia acumulada [IA] a 14 días de casos de COVID-19, entre el segundo y el tercer período epidémico). Finalmente tuvo lugar el tercer período desde el 30 de noviembre de 2021 hasta el 31 de marzo de 2022 (punto de inflexión de la IA a 14 días de casos de COVID-19, entre el tercer y el cuarto período epidémico).
Para determinar la dinámica del período pandémico se calcularon los Rt, los tiempos de duplicación de casos (Td) y las tasas de contagio (Tc) por cada período anual (que incluyó una onda específica). Se finalizó con el primer trimestre de 2022, cuando se produjo la última onda al momento del análisis. Rt se calculó utilizando el paquete de proyecto R EpiEstim, a través del comando Estimación R7 en función de los casos diarios informados por el SNVS y el intervalo de serie esperado (adoptado por la Organización Mundial de la Salud para su aplicativo en línea)8. La incidencia se calculó como casos diarios, en este caso la fecha de inicio de síntomas. Rt se estimó en ventanas semanales deslizantes, con una media de intervalo en serie paramétrica de 4,8 días y una desviación estándar de 2,37. Los parámetros allí incluidos fueron Rt estimado, que calcula, para cada unidad de tiempo, el número de reproducción dadas la serie temporal de incidencia y la distribución del intervalo de serie, considerando la fecha de inicio de síntomas; I, vector de enteros no negativos que contiene la serie temporal de incidencia; T1 y T2, vectores de enteros positivos que indican, respectivamente, los tiempos de inicio y final de cada intervalo con los que se procede a estimar el número de reproducción Rt, en este caso plazos cada 7 días. Dichos intervalos deben ser introducidos en orden ascendente, iniciando únicamente después del primer día con incidencia no nula. Los estadísticos producidos son la media y el desvío estándar de Rt. El Td estima cuántos días se tarda en doblar la cantidad de infectados en función del ritmo de crecimiento. Se trata de una variable relacionada con la velocidad de circulación del virus. Sin embargo, es importante vincularla con los parámetros que se utilizan para establecer una idea de la dinámica del brote. Para estimarla, se aplicó la siguiente fórmula:
Td = ln(2)/Tc
Se aplicó la función logaritmo (ln), ya que se asumió que el crecimiento del número de casos seguía una distribución exponencial. Este algoritmo se hace sobre el número 2, dado que se quiere estimar el tiempo que lleva duplicar los casos. Tc se estima a partir de una regresión lineal de los logaritmos de los casos acumulados en los últimos 7 días. Td es una medida que permite conocer qué tan rápido crece y se detecta la enfermedad en la población, y ayuda a considerar la intensidad de las medidas de mitigación que se deberían adoptar para contener el COVID-19. Una disminución en el Td del número de casos confirmados indica que la velocidad a la cual se confirman los casos de COVID-19 está aumentando porque el tiempo en el que los casos confirmados se duplican es menor. Un aumento de Td implica que el número de casos confirmados está disminuyendo, porque estos tardan más tiempo en duplicarse. El indicador permite obtener la pendiente de la curva para cada fecha y sobre la base de esa pendiente (Tc), el Td. La serie se dividió en períodos anuales completos (2020 y 2021) y un trimestre de 2022. Estos tres períodos completan el total de la serie de análisis. Se calcularon los Rt para cada período, así como Tc y Td.
No se requirió aval de un comité de ética, dado que se trató de un estudio descriptivo donde los datos fueron anonimizados y finalmente agrupados. Se mantuvo la confidencialidad de los datos por la Ley del Sistema Estadístico Nacional, y el personal de la Oficina de Estadísticas desarrolló su labor bajo la Ley de Secreto Estadístico 14998 de la Provincia de Buenos Aires.
RESULTADOS
A lo largo del período de análisis se estudiaron 713 855 casos confirmados en 2020, 1 540 773 en 2021 y 1 240 710 en 2022, es decir, un total de 3 495 338. Las Figuras 1 a 3 muestran la variación media y los intervalos de confianza que el Rt mantuvo a lo largo de la pandemia durante las tres ondas sucesivas en PBA. Para la selección de las ondas epidémicas, se recopiló información respecto de las curvas de COVID-19, reportadas y reconocidas como tales por el Ministerio de Salud de la Provincia de Buenos Aires. La información mínima requerida para la consideración fue el contexto (población, inicio y evolución de la pandemia) y la base de datos con cifras diarias de número de casos confirmados de COVID-19 con diagnóstico por laboratorio o criterio clínico-epidemiológico, con fecha de inicio de síntomas entre marzo de 2020 y el 31 de marzo de 2022 inclusive. (Figuras 1 a 3)

FIGURA 1 Evolución del número reproductivo efectivo (Rt) y de la incidencia absoluta de casos confirmados de COVID-19 en la Provincia de Buenos Aires, 2020.

FIGURA 2 Evolución del número reproductivo efectivo (Rt) y de la incidencia absoluta de casos confirmados de COVID-19 en la Provincia de Buenos Aires, 2021.

FIGURA 3 Evolución del número reproductivo efectivo (Rt) y de la incidencia absoluta de casos confirmados de COVID-19 en la Provincia de Buenos Aires (95%), enero-marzo 2022.
Los datos disponibles indican que los picos epidémicos ocurrieron de octubre de 2020 a enero de 2022, y cada período anual incluyó una onda específica.
Primera onda: 27 de febrero de 2020 al 1 de diciembre de 2020, con rebrote de verano, del 2 de diciembre de 2020 al 16 de febrero de 2021; pico: 21 de octubre de 2020; semana epidemiológica (SE) 43 de 2020.
Segunda onda: 17 de febrero de 2021 al 10 de octubre de 2021; pico: 27 de mayo de 2021; SE 21 de 2021.
Tercera onda: 14 de diciembre de 2021 al 31 de marzo de 2022; pico: 18 de enero de 2022; SE 3 de 2022.
Las Figuras 4 y 5 grafican las Te y el Td medio de casos para los dos años completos de pandemia, lo que incluye sendas ondas. (Figuras 4 y 5)

FIGURA 4 Casos confirmados de COVID-19 en la Provincia de Buenos Aires, tasa de contagio y tiempo de duplicación, 2020.
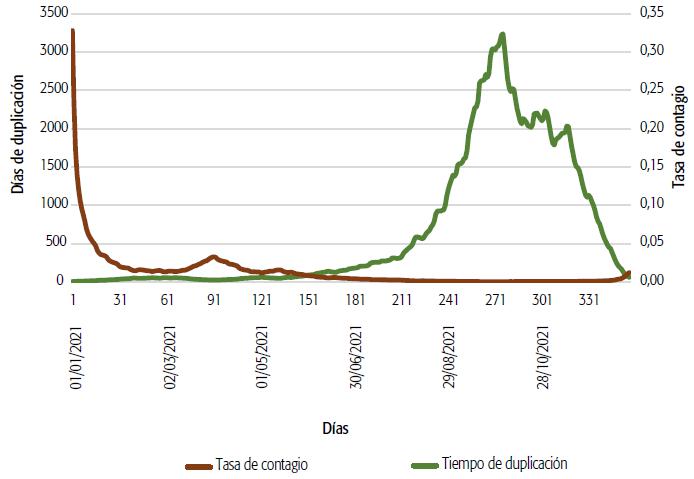
FIGURA 5 Casos confirmados de COVID-19 en la Provincia de Buenos Aires, tasa de contagio y tiempo de duplicación, 2021.
Las ondas epidémicas reflejan un Rt>l hasta inicios de setiembre de 2020, alrededor de la medición 190, cuando se llevaban acumulados unos 44 000 casos. El Rt baja de la unidad a partir de esa fecha. En cuanto a la incidencia semanal, hacia el 27 de julio de 2020, a partir de la medición 150, supera los 3000 casos hasta el 17 de octubre, y a partir de la medición 230 vuelve a disminuir. El Rt vuelve a ser >1 para el 6 de diciembre del mismo año, en la medición 283, y permanece así hasta finalizar el año. En 2021, el 1 de enero Rt supera el valor 3 (con una incidencia semanal que había comenzado a subir en diciembre de 2020) y permanece así hasta el 8 de enero, cuando cae a Rt<1 hasta el 15 de febrero, en la medición 45 de ese año. Recién el 10 de abril de 2021 Rt<1, mes en que semanalmente se superan los 10 000 casos. Sin embargo, Rt vuelve a crecer (con valores que nunca superan 1,5) entre el 4 y el 15 de mayo, período seguido por una baja hasta el mes de octubre. Luego se llega a Rt>2 en diciembre de 2021. A partir del 9 de diciembre, la incidencia semanal supera los 2000 casos. A comienzos de 2022, Rt permanece >1 hasta fines de enero y de la evaluación presentada aquí. La gran incidencia del verano muestra valores de medición semanales que superan los 5000 casos.
DISCUSIÓN
Una de las principales medidas no químicas para el control de enfermedades infecciosas a nivel poblacional incluye el aislamiento de casos y el seguimiento de contactos a través del rastreo. Un ejemplo antes de la era COVID fue la experiencia de la lucha contra otra enfermedad respiratoria: el síndrome respiratorio agudo grave (SARS). Se demostró que el uso de estas dos intervenciones podría prevenir la propagación de la infección. Aun así, hay evidencia de que el aislamiento y el rastreo son efectivos si la infecciosidad solo se presenta después de la aparición de los síntomas, como en el caso del SARS. Si la infección aparece antes del inicio de los síntomas (presintomáticamente), como en el caso del COVID-19, estas medidas comienzan a perder eficacia y aumenta la transmisión antes de la aparición de los síntomas. La transmisión del virus a partir de casos asintomáticos también juega un papel muy importante en la propagación epidémica, pero aún no se cuenta con datos que permitan hacer una estimación real de su proporción e infectividad. Los datos disponibles estiman que las personas asintomáticas podrían estar entre el 40-50% de todos los casos confirmados de COVID-19 o alrededor del 15%. Los casos asintomáticos pueden propagar la enfermedad durante mucho más tiempo (más de 14 días) que los casos sintomáticos9-12.
El interés de los gobiernos por controlar el brote a través de medidas de aislamiento de casos y el uso de mascarillas tuvo como contrapartida el desconocimiento de la fracción de la transmisión de presintomáticos sobre la fracción de sintomáticos, de su infecciosidad y del retraso de tiempo entre la aparición de síntomas y el momento del aislamiento13.
La difusión de la Tc y de su complemento —el Td de casos— representó una forma habitual de observar la curva epidémica14. A ello se adicionó el monitoreo del Rt, considerando que reflejaba el éxito parcial de las medidas tomadas para el control del brote. En PBA, así como en el resto del país, hubo tres ondas que constituyeron sendas alarmas para el sistema de vigilancia, habida cuenta de que una de las preocupaciones era la posible sobrecarga del sistema hospitalario, en particular de las terapias intensivas. Se ha demostrado que su capacidad operativa guardó relación con la sobrevida y la tasa de letalidad15.
El uso de mascarillas, iniciado durante el primer período de aislamiento, apuntó entre otras cosas a reducir la Tc y el Rt. Todo indica que la utilización de mascarillas médicas (cuando supera el 70% o más) permite controlar la situación porque disminuye la probabilidad de contacto directo, mientras que se registra una baja considerable con las no médicas (por debajo del 40%)16. El empleo de mascarillas (especialmente médicas) puede constituir una medida de control adicional a las Intervenciones básicas (aislamiento de casos y rastreo de contactos) para reducir la propagación de COVID-19 y prevenir la infección durante un período más largo. Sin embargo, para lograr una alta probabilidad de control del brote, las tres intervenciones deben ser implementadas en conjunto.
Recientemente17 se propuso un modelo matemático para COVID-19 que incorpora múltiples vías de transmisión, incluidas las rutas de humano a humano y de medio ambiente a humano. Los autores emplearon una tasa de incidencia bilineal basada en la ley de acción de masas y ajustaron el modelo con los datos de la ciudad china de Wuhan, estimando R. Encontraron que la contribución del reservorio ambiental es importante en la configuración del riesgo general de enfermedad. Sus resultados también indican que la infección por COVID-19 sigue siendo endémica, lo que requiere programas de intervención y políticas de prevención de enfermedades a largo plazo. Proponen un modelo matemático donde la población se divide en siete compartimentos (entre ellos, los asintomáticos juegan un rol esencial). En definitiva, tanto las medidas de aislamiento como el seguimiento de contactos resultan fundamentales, y la dinámica del sistema depende completamente de R0 y su derivado Rt. A medida que avanza la epidemia, cuando la población comienza a ser inmune y se ponen en marcha intervenciones, la eficacia de Rt se puede estimar en tiempo real. Esto es lo que el sistema de vigilancia fue haciendo diariamente.
En síntesis, el presente trabajo muestra cómo fue evolucionando Rt a lo largo de los dos años de pandemia en consonancia con las ondas u olas (que aparecieron en tres oportunidades durante la ventana histórica analizada) y como parámetro anticipatorio de la incidencia acumulada en los períodos posteriores. Respecto de la vacunación, que formó parte relevante en la ventana de tiempo estudiada, la clave de la inmunidad colectiva radica en que, incluso si una persona se infecta, hay muy pocos huéspedes susceptibles para mantener la transmisión: aquellos que han sido vacunados o que ya han tenido la infección no pueden contraer y propagar el virus. Las vacunas contra el COVID-19 desarrolladas por Moderna y Pfizer-BioNTech, por ejemplo, son extremadamente efectivas para prevenir enfermedades sintomáticas, pero aún no está claro si evitan que las personas se infecten o que propaguen el virus. Esto plantea un problema para la inmunidad colectiva, que solo es relevante si existe una vacuna capaz de bloquear la transmisión. En caso contrario, la única forma de obtener inmunidad colectiva en la población es vacunar al total. Aunque esto no es tan sombrío como podría parecer. Incluso sin inmunidad colectiva, la capacidad de vacunar a las personas vulnerables parece estar reduciendo las hospitalizaciones y muertes por COVID-19. Es probable que la enfermedad no desaparezca pronto, pero que su prominencia disminuya.
RELEVANCIA PARA POLÍTICAS E INTERVENCIONES SANITARIAS
El estudio ayudó a identificar y aplicar un estimador sencillo de la dinámica de la pandemia, obtenido a partir de la vigilancia habitual del sistema de salud. Esto contribuyó a monitorear no solo la evolución temporal, sino también los efectos que la propia campaña de vacunación reflejaba a lo largo de las semanas epidemiológicas.
DECLARACIÓN DE CONFLICTO DE INTERESES:
No hubo conflicto de Intereses durante la realización del estudio.
CONTRIBUCIÓN DE LOS AUTORES:
Todos los autores han efectuado una contribución sustancial a la concepción o el diseño del estudio o a la recolección, análisis o interpretación de los datos; han participado en la redacción del artículo o en la revisión crítica de su contenido intelectual; han aprobado la versión final del manuscrito; y son capaces de responder respecto de todos los aspectos del manuscrito de cara a asegurar que las cuestiones relacionadas con la veracidad o integridad de todos sus contenidos han sido adecuadamente investigadas y resueltas.














