INTRODUCCIÓN
El dengue es una enfermedad humana aguda causada por un virus (DENV) y transmitida por un vector, principalmente el mosquito Aedes aegypti, el cual se desarrolla y se reproduce en zonas urbanas de países de climas cálidos y templados 1 . Constituye un problema emergente de salud y provoca una alta morbilidad durante los períodos epidémicos, dado que no se dispone de tratamientos específicos ni de herramientas para generar inmunidad previa a la exposición. La vacuna en Argentina aún no se encuentra disponible al momento de redactar este trabajo. Empero, en otros países se está implementando para personas previamente expuestas 2 . La identificación temprana y el tratamiento oportuno de asistencia clínica pueden disminuir de manera significativa la carga de morbilidad y mortalidad, además del aislamiento del paciente virémico para limitar la dispersión del virus 3 .
En Argentina se produjeron brotes de dengue en 2009, 2016 y 2020 por los serotipos DEN-1 y DEN-4 principalmente. Cada brote superó al anterior en su magnitud. En la provincia de Buenos Aires, durante los primeros cuatro meses de 2016, los registros de incidencia sobrepasaron lo históricamente conocido hasta ese momento para el evento. En ese brote se pudieron localizar los casos confirmados y establecer “zonas calientes” para priorizar acciones en las regiones sanitarias (RS) VI, VII, XI y XII2 (cabe resaltar que las RS son los 12 grupos de municipios en los que el territorio provincial es dividido). El 15 de agosto de 2019, luego de dos años de baja incidencia de la enfermedad, la Organización Panamericana de la Salud (OPS) alertó acerca de un nuevo ciclo epidémico en la Región de las Américas, con un incremento de casos de dengue y dengue grave en varios territorios 4 . Los cuatro serotipos conocidos para el virus DENV circularon simultáneamente en Brasil, Guatemala y México, mientras que otros cinco países reportaron la circulación de tres serotipos: Colombia, Venezuela y Panamá (DEN-1, DEN-2 y DEN-3); Paraguay y Perú (DEN-1, DEN-2 y DEN-4). En 2020 la provincia de Buenos Aires nuevamente se vio afectada por el dengue, ahora con un 82% más de casos notificados que en 2016, que se extendieron en las 12 RS e incluyeron municipios sin antecedentes de casos previos. En esta epidemia se identificaron los serotipos DEN-4, DEN-1 y DEN-2.
El objetivo del presente trabajo fue caracterizar y comparar la dinámica de los brotes ocurridos en la provincia de Buenos Aires en 2016 y 2020 desde la semana epidemiológica (SE) 1 hasta la SE 25 de esos años.
MÉTODOS
Se realizó un estudio descriptivo, retrospectivo y transversal. Ambos brotes (2016 y 2020) se describieron según la onda epidémica y sus parámetros. Se consideraron los casos de dengue de residentes de la provincia de Buenos Aires, incluyendo las 12 RS según los datos registrados en el Sistema Nacional de Vigilancia de la Salud (SNVS). Los casos fueron agrupados en las siguientes categorías: notificados (todos los registrados en el SNVS que cumplían la definición de caso en cada brote), positivos (todos los que tenían al menos una muestra positiva de laboratorio, y los confirmados por nexo epidemiológico) y descartados (aquellos que tenían muestras de laboratorio que descartaban el diagnóstico). Se consideraron los casos con fecha de inicio de síntomas entre la SE 1 y la SE 25 de 2016 (SE 1: 3/1/2016 al 9/1/2016; SE 25: 19/6/2016 al 25/6/2016) y de 2020 (SE 1: 29/12/2019 al 4/1/2020; SE 25: 14/6/2020 al 20/6/2020). Se calcularon las distribuciones de frecuencia de los casos notificados, positivos y negativos. Asimismo, se determinó el origen de los casos positivos de dengue: si el contagio se había producido fuera del lugar de residencia de la persona (importado) o en su lugar de residencia habitual (autóctono). Las tasas de incidencia correspondientes y las razones de origen de contagio se calcularon por RS y por el total de la provincia. Para analizar el comportamiento de la dinámica de los brotes, se construyeron las curvas epidémicas y se estudiaron los parámetros de difusión de la onda 1 . La onda epidémica se construyó a partir de los datos de incidencia proporcionados por el sistema de vigilancia. Se obtuvieron entonces los respectivos parámetros estadísticos de distribución (tiempo medio, curtosis y asimetría) y de dinámica (coeficiente de difusión y tasa de propagación).
La velocidad con que aparecen los casos se expresa a través de un modelo, que relaciona la proporción acumulada de casos (Pt) en un momento determinado (t) y cuyo descriptor del cambio es el coeficiente de difusión (b), que —expresado por la pendiente— es la tasa de cambio por unidad de tiempo. Esto puede expresarse a través de la siguiente fórmula:
Pt = 1 / 1+ e a-bt
La deriva de la variable Pt es la velocidad de difusión de la onda, con los parámetros e y a constantes. El valor del coeficiente de difusión está determinado por la cercanía en unidad de tiempo de los casos a medida que se van produciendo (incidencia) y no por la cantidad de casos en un momento dado (prevalencia) 6 , 7 . El segundo parámetro calculado es la tasa de propagación, es decir, la razón entre los casos primarios y secundarios, presuponiendo que los casos notificados en un segundo momento t(2) son secundarios a los notificados en t(1). Así, para cada período t se estima a través del cociente entre dos medias móviles que incluye el período medio de incubación. Se asume, por tanto, que los casos notificados en un instante son secundarios a los notificados en el instante precedente, siendo el intervalo de tiempo el equivalente al período de incubación. Las medias móviles permiten construir la serie temporal estimando tendencia del brote a partir de valores puntuales observados. Se categorizaron en series de tiempo progresivas cuatrisemanales hasta completar el período desde la SE 1 a la 25. Los paquetes estadísticos empleados fueron SPSS (Statistical Package for Social Sciences) y Epi Dat 3.1 (Servicio Gallego de Salud/Organización Mundial de la Salud).
RESULTADOS
La Tabla 1 muestra las cifras de casos en ambos brotes. En 2020 el número de casos notificados superó a los registrados en 2016 en un 150% y en un 99% en los casos positivos. Ambos brotes se dieron de manera heterogénea en el territorio: las RS ubicadas hacia el sur (I, VIII y IX) y hacia el oeste (II y III) de la provincia tuvieron la menor cantidad de casos, tanto notificados como positivos, con tasas <5/100 000 en cada uno de los brotes.
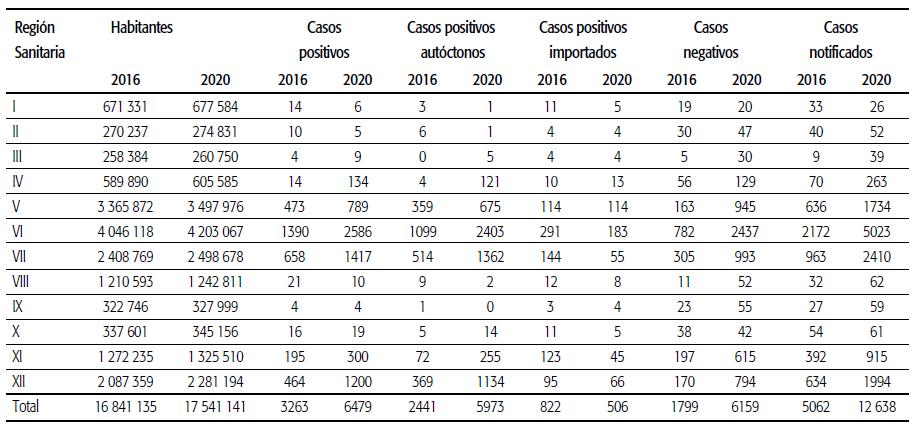
TABLA 1 Distribución de casos notificados, positivos y negativos de dengue según Reglón Sanitaria, brotes de 2016 y 2020, acumulados de las semanas epidemiológicas 1-25, Provincia de Buenos Aires, Argentina.
La RS X, en el centro de la provincia, también tuvo un bajo número de casos en ambos brotes, con tasas similares a las de las regiones del sur y oeste. Para estas RS, no hubo cambios llamativos en el número de casos entre ambos brotes. Por otro lado, la RS IV (ubicada al norte de la provincia) y las RS V, VI, VII, XI y XII (que forman parte del conurbano bonaerense) tuvieron el mayor número de casos notificados y positivos: concentraron más del 95% de los casos notificados y más del 97% de los positivos tanto en 2016 como en 2020 (ver Gráfico 1).
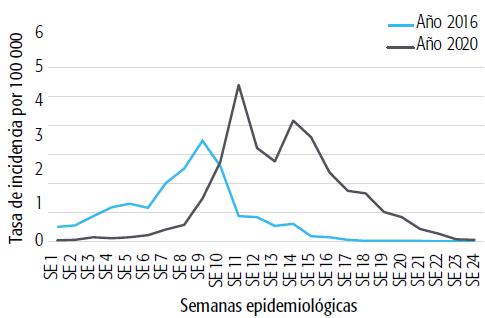
GRÁFICO 1 Tasas de incidencia de dengue, brotes 2016 y 2020 según semanas epidemiológicas (SE), Provincia de Buenos Aires, Argentina.
En cuanto al origen de los casos, las RS I, II, III y VIII aumentaron la razón de casos importados a autóctonos entre el brote de 2016 y el de 2020, y en las RS I, II y VIII se vio, a la vez, una disminución de las tasas de incidencia cada 100 000 habitantes (ver Tabla 2).

TABLA 2 Tasas de incidencia, de notificación por 100 000 habitantes y razón entre casos positivos de dengue importados y autóctonos por Región Sanitaria, brotes de 2016 y 2020, Provincia de Buenos Aires, Argentina.
Por su parte, el conurbano disminuyó la razón de casos importados a autóctonos, a la vez que en 2020 tuvo tasas de incidencia mayores a las de 2016. Observando los datos de la Tabla 3 y el Gráfico 2, se pueden comparar tanto los estadísticos como las curvas en ambos brotes. En los dos eventos las ondas epidémicas mostraron una tasa de propagación y coeficientes de difusión elevados (0,19 en 2016 y 0,27 en 2020 en las primeras cuatro semanas), para luego —a medida que se fueron produciendo los contagios— elevar la incidencia pero disminuyendo la velocidad de difusión (con una caída del coeficiente de difusión a 0,08 en 2016 y 0,07 en 2020 al final del brote). Asimismo, hubo valores pico de incidencia diferentes en cuanto a tiempo calendario entre ambos brotes, siendo anterior en 2020 (SE 9: 28 de febrero al 5 de marzo) comparativamente al brote de 2016 (SE 11: 13 al 19 de marzo). La segunda onda epidémica mostró mayor tasa de incidencia, mayor tasa inicial de propagación y una velocidad de difusión superior al inicio del brote, tal como se refleja en el Gráfico 1 y en la Tabla 3.

TABLA 3 Ondas epidémicas de los brotes de dengue de 2016 y 2020, dimensiones métricas por períodos cumulatlvos por cuatrlsemanas, semanas epidemiológicas 1 a 25, Provincia de Buenos Aires, Argentina.
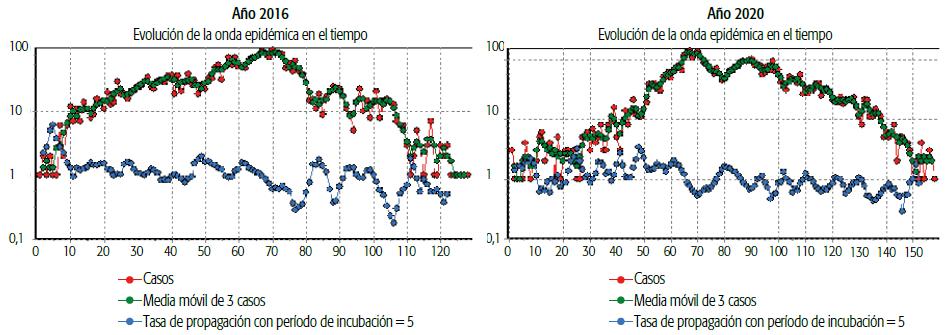
GRÁFICO 2 Ondas epidémicas de brotes de dengue en los años 2016 y 2020, ventana temporal entre las semanas epidemiológicas 1 a 25, escala logarítmica, Provincia de Buenos Aires, Argentina.
Finalmente, el retardo medio de infección también resultó más elevado hacia el final del brote de 2020.
En lo que respecta a las consideraciones éticas, el proyecto de investigación no requirió aprobación de comité de ética de investigación debido a que fueron utilizados datos de fuente estadística secundaria y anónima. Tampoco fue necesario obtener consentimiento informado de los participantes del estudio o pacientes debido a que se parte de una fuente anónima estadística de registro. Los datos personales de los pacientes quedaron a resguardo en cumplimiento del secreto estadístico. Se trabajó con datos agrupados.
DISCUSIÓN
El estudio mostró el comportamiento de los dos brotes de dengue ocurridos en la provincia de Buenos Aires: el primero en 2016 y el segundo en 2020. Si bien la distribución de los casos en 2020 no cambió sustancialmente respecto de 2016 en el global de la provincia, hubo una RS que incluyó por primera vez casos positivos sin registro de antecedente de viaje (municipios de Chacabuco y Junín). Además, otras RS registraron municipios con casos autóctonos por primera vez (en total, 14 municipios distribuidos en 4 RS con esta característica). En forma inversa, la RS IX no tuvo casos autóctonos en el brote de 2020, pero sí en el de 2016. Estos eventos reflejan los cambios que se produjeron entre ambos brotes a nivel regional.
La razón entre casos importados y autóctonos en cada RS guarda relación con la tasa de incidencia total alcanzada en cada brote, dado que el comportamiento habitual de los brotes se inicia a partir de casos importados que introducen la presencia del agente patógeno en el territorio y, al combinarse con la presencia del vector, generan las condiciones para la transmisión vectorial autóctona, favorecida a su vez por el aumento en la capacidad de reproducción del vector en las épocas más cálidas del año. De esta manera, a mayor desarrollo del brote en el territorio, la razón entre los casos importados respecto de los casos autóctonos se hace cada vez más pequeña, como se observa para las RS del conurbano bonaerense. Por el contrario, las RS del sur, oeste y sureste de la provincia (I, II y VIII) tuvieron razones altas entre casos importados y autóctonos, dado que los brotes no mostraron gran desarrollo en términos de incidencia, originando un número final de confirmados y de tasas bajos.
La modelización de la dinámica de brotes es un clásico de la epidemiología desde los conceptos de McKendrick en 1926 8 , 9 . La modificación de b (coeficiente de difusión) a lo largo del brote y aún más, comparativamente entre brotes, expresa entonces en cierto modo su dinámica. Aun cuando el caso del dengue resulta complejo por los factores intervinientes, ninguno de estos modelos podría ser construido sin las bases de los modelos simplificados, que a partir de parámetros básicos permiten describir su comportamiento general. La estimación de la tasa de propagación, como medida de intensidad del brote, parte del concepto de que los casos secundarios son consecuencia de uno anterior primario. Si bien es cierto que esta aplicación es correcta para las enfermedades de transmisión persona a persona, para el caso del dengue se adiciona el elemento vectorial. Por lo tanto, modelar una enfermedad trasmitida por un vector, como el dengue, implica considerar tanto las poblaciones de los vectores como la de los huéspedes en distintos compartimientos correspondientes a cada situación respecto a la enfermedad 10 .
Para el cálculo de la tasa de propagación, se consideraron sendas medias móviles donde el período de incubación es la variable tiempo y sin conocer si la consecuencia de la enfermedad se debió por tanto a mosquitos infectados por picar a humanos con dengue o por ser mosquitos con transmisión vertical, ya que ambos eventos son a priorivariables desconocidas. En tanto, el efecto, que se traduce en los casos que van siendo confirmados a lo largo de las SE, sí es medible y se presenta como la onda epidémica con una fecha de inicio y otra de final. La fuerza de infección se considera como un parámetro que depende del tiempo y representa la razón en que los susceptibles pasan a ser infectados. No hay un único modelo definido para estimar o calcular la fuerza de infección; por ende, se encuentran relaciones sencillas y complejas para representarla. Algunos de esos modelos se pueden hallar en artículos como el de Fernández 11 .
Actualmente se sabe que la dinámica del dengue está influenciada por el comportamiento humano, ya que tanto la estructura espacial como social de la población humana inciden en la evolución de la epidemia. Se ha probado que las características geográficas de los barrios o pueblos, la conservación del ambiente peridomiciliario, las separaciones a lo largo de las líneas de interacción social, el nivel socioeconómico y la segregación social afectan fuertemente la dinámica de la enfermedad 12 . El intervalo interepidémico (entre ambos brotes) de cinco años fue similar al reportado en estudios de simulación y ajustado según los datos de la vigilancia anterior 13 . Si bien el presente estudio no involucró estas variables, el hecho de que las grandes urbes y los cordones del área metropolitana hayan sido los más afectados muestra en cierta forma que efectivamente hubo un comportamiento socioestructural relacionado con la dinámica de ambos brotes.
Según una reciente modelización proyectiva sobre población y riesgo de dengue para Sudamérica, que incluyó un conjunto de variables ambientales y de caracterización de idoneidad ambiental para A. aegypti y A. albopictus,se prevé que el riesgo de brote, en el caso de Argentina, se extienda a zonas del norte del país 14 . Este modelo, tal como afirman los autores, muestra tendencias promedio pero no puede estimar predicciones anuales específicas. Sin embargo, la provincia de Buenos Aires ya ha quedado incorporada a la vigilancia del dengue y, en todo caso, la isoterma de los 15 °C como límite sur parece haber quedado obsoleta como estimador de distribución geográfica del vector.
La manipulación humana, demográfica, estructural, migratoria y de condiciones ecoclimáticas puede modificar sustancialmente los cálculos iniciales. Eso implica que las estimaciones sean relativas y no absolutas 15 . Dado que A. aegypti tiene un rango de vuelo restricto, los movimientos de población humana constituyen el verdadero rol crítico para la dispersión del dengue. Como se ha demostrado en la historia reciente y ya comentada previamente, las posibilidades de vuelos entre continentes y países producen hoy día una migración del dengue en términos de tiempo que sorprende a los sistemas de vigilancia. La dispersión del dengue a través de viajeros, que en el presente estudio se identifica con los casos importados, ha sido ampliamente reportada. Lugares que previamente no tenían antecedentes de dengue inician la serie autóctona de transmisión 16 . La formulación de modelos matemáticos y las simulaciones de las dinámicas de transmisión pueden ser herramientas sostenibles que sirvan de apoyo para la toma de decisiones.
Entre las limitaciones del análisis llevado a cabo, hay que resaltar su carácter descriptivo y no inferencial, que no ahonda en cuestiones de testeo ni incluye covariantes con probable influencia en la caracterización de ambos brotes.
RELEVANCIA PARA POLÍTICAS E INTERVENCIONES SANITARIAS
La distribución de frecuencia de casos positivos en las distintas RS y sus tasas de incidencia permiten identificar zonas con mayor circulación viral y así dirigir acciones territoriales para reducir las probabilidades de aumento de incidencia en la temporada de reproducción del vector. Las correspondientes actividades de prevención, centradas en lugares de gran circulación, deben estar enmarcadas en una planificación estratégica que incluya vigilancia vectorial, además de epidemiológica viral.
RELEVANCIA PARA LA INVESTIGACIÓN EN SALUD
La investigación realizada aportó datos sobre el fenómeno reemergente de la infección por arbovirus dengue (principalmente DEN-1 circulante) en la provincia de Buenos Aires durante los brotes de 2016 y 2020, con cifras de incidencia que superaron lo conocido en la historia de la enfermedad en Argentina. Es patente la necesidad de mejorar los sistemas de alerta y la consistencia de la información consolidada, es decir, del SNVS y sus componentes C2 (alerta clínica) y Sistema de Vigilancia por Laboratorios [SIVILA] (alerta de laboratorio). La arbovirosis ha evidenciado que el control vectorial es clave para poder disminuir las tasas de incidencia locales y, además, vigilar los casos alóctonos, sobre todo los provenientes de zonas endémicas.














