Introducción
La mandioca (Manihot esculentaCrantz, Euphorbiaceae) es uno de los principales cultivos a nivel mundial y constituye una de las fuentes de hidratos de carbono más utilizadas en la alimentación y en la industria. En Argentina, el más austral entre los países productores de Latinoamérica, se la cultiva en el nordeste argentino (NEA) principalmente por pequeños productores familiares (Burgos, 2018), constituyendo una fuente segura de alimentos y con un potencial de renta poco explotado.
En el NEA, la investigación relacionada con la propagación y la conservaciónin vitrode mandioca se remonta a la década del 70 (Rey et Mroginski, 1978); sin embargo, recién en el año 1982 se conforma un banco activo de germoplasma de mandioca en condicionesin vitro(Mroginski,com. pers.).En dicho banco participaron investigadores y técnicos del Laboratorio de Cultivo de Tejidos Vegetales de la Facultad de Ciencias Agrarias de la Universidad Nacional del Nordeste (FCA-UNNE) y del Instituto de Botánica del Nordeste (IBONE, CONICET-UNNE). Desde entonces se ha mantenido e incrementado merced a la gestión de diferentes profesionales que dirigían o dirigen proyectos de investigación afines a la temática. Desde el inicio del presente banco de germoplasma, el manejo habitual consistió en el empleo de metodologías de conservación a corto plazo mediante subcultivos secuencialesin vitrosiguiendo los lineamientos de Roca et al. (1991), cuyo orden y renovación de los cultivos (i.e. número de subcultivos por año) fueron aleatorios y establecidos únicamente mediante evaluaciones cualitativas del estado general de los cultivos hasta el año 2005, a partir del cual se implementaron censos periódicos con el objetivo principal de definir el orden de los subcultivos.
A nivel mundial, la pandemia por coronavirus de 2019 (COVID-19) ha afectado el desarrollo normal de las actividades, perturbando sin excepción, el funcionamiento de laboratorios dedicados a la conservación de especies vegetales. En marzo del año 2020, la Organización Mundial de la Salud (OMS) declaró que el avance del COVID-19 alcanzó elstatusde pandemia (OMS, 2020). La enfermedad causada por COVID-19, es una patología infecciosa ocasionada por el virus SARS-CoV-2 (coronavirus del síndrome respiratorio agudo grave tipo 2) (Gorbalenya et al., 2020), la cual fue informada por primera vez en diciembre de 2019 en la ciudad de Wuhan en la República Popular China (Huang et al., 2020), tras reportarse casos de personas enfermas con un tipo de neumonía desconocida. En Argentina, el primer caso de COVID-19 fue confirmado el 3 de marzo de 2020. Al 10 de noviembre de 2021, se notificaron 5.299.418 casos de personas infectadas con COVID-19 y 116.165 muertes en total (Ministerio de Salud de la República Argentina, 2021).
A partir del 20 de marzo de 2020, el Poder Ejecutivo Nacional dispuso el Aislamiento Social, Preventivo y Obligatorio (ASPO) en todo el territorio nacional (Boletín Oficial de la República Argentina, 2020), con el fin de proteger la salud pública frente a la propagación del COVID-19. Así se dispuso que todas las personas que habitan, o se encuentren temporalmente, en las jurisdicciones donde rige esta normativa deberán permanecer en sus domicilios habituales. Con el objetivo de no interrumpir el suministro de productos y servicios esenciales e incorporar gradualmente la realización de diversas actividades económicas y sociales en los lugares donde la evolución de la situación epidemiológica lo permitiera, se establecieron excepciones al ASPO y a la prohibición de circular para las personas afectadas a diferentes actividades y servicios. Entre las excepciones al ASPO se encontraron las actividades vinculadas con la producción agropecuaria. En septiembre del mismo año, el CONICET y la UNNE autorizaron el regreso gradual y controlado a las instituciones, para realizar tareas de carácter experimental, bajo estrictos protocolos de higiene y seguridad.
El objetivo de esta comunicación es realizar una reseña de la evolución del banco de germoplasmain vitrode mandioca existente en la FCA-UNNE e IBONE (CONICET-UNNE) y dar a conocer las prácticas de manejo habituales y los procedimientos realizados para preservar con vida el material vegetal protegiendo la salud del personal involucrado, destacando las actividades realizadas en tiempos prepandémicos y cómo debieron ser reestructuradas durante el período de limitaciones por la pandemia por COVID-19.
Materiales y Métodos
Material Vegetal
En la actualidad se cuenta con 56 cultivares de mandioca (Manihot esculenta) conservados mediante cultivoin vitro. Esta colección de plantas conforma el Banco de germoplasmain vitrode mandioca del Laboratorio de Cultivo de Tejidos Vegetales de la FCA-UNNE y del IBONE (CONICET-UNNE), situado en el Campus Sargento Cabral de la UNNE, Corrientes, Argentina.
En la Tabla 1 se detallan la procedencia, la denominación y el número de los materiales conservados.
Tabla 1. Procedencia, denominación (nombres de fantasía o derivados de códigos institucionales) y número de los cultivares de mandioca conservados in vitro.
| Procedencia | Denominación | Número de cultivares |
|---|---|---|
| Estación Experimental Agropecuaria INTA El Colorado (EC), Formosa, Argentina. | 6, 9, 60, 70, 90, 140, 1468, EC 1, EC 3, EC 5, EC 9, EC 11, EC 22, EC 24, EC 24-10, EC 27, EC 35, EC 41, EC 55, EC 64, EC 74, EC 78, EC 118, EC 121, EC 161, EC 163, EC 170, CM, CM 2600-2, CM 3306-4, Cuba Señorita y MPar 75 | 32 |
| Campo Didáctico-Experimental de la FCA-UNNE, Corrientes, Argentina. | 76, 256, Amarilla FCA-UNNE, Blanca de Santa Catarina, Campeona, Palomita FCA-UNNE, Ramada Paso y Rocha | 8 |
| Escuela Regional de Agricultura, Ganadería e Industrias Afines de la FCA-UNNE. | Amarilla ERAGIA, Carapé ERAGIA y Palomita ERAGIA | 3 |
| Centro Internacional de Agricultura Tropical, Cali, Colombia. | MCol 1505 | 1 |
| Empresa Brasileira de Pesquisa Agropecuária, Centro Nacional de Pesquisa de Recursos Genéticos e Biotecnologia, EMBRAPA-CENARGEN, Brasilia, Brasil. | Surubim-41 e IAC 12.829 | 2 |
| Estación Experimental Agropecuaria INTA Corrientes, El Sombrero, Corrientes, Argentina. | Amarilla Montecarlo, IAC 9, Manantiales, Palomita INTA, Pomberí, Rama Seda y Verde Santa Ana | 7 |
| Centro de Validación de Tecnologías Agropecuarias -CEDEVA, Misión Taccaglé, Formosa. | CA 145 | 1 |
| Colecciones privadas realizadas en Itatí, Corrientes. | Catiguá | 1 |
| Colecciones privadas realizadas en Corrientes - Capital, Corrientes. | Variegada | 1 |
Desde su recepción, durante su introducciónin vitroy su multiplicación para su conservación, los materiales fueron identificados individualmente por tubo y grupalmente con un rótulo de cartulina.
Manejo del banco de germoplasma in vitro
Aspectos de orden científico-tecnológico:
Etapa 1: preparación del medio basal y reguladores de crecimiento
Dos veces al año se prepara el medio basal sugerido por Murashige et Skoog (1962) -MS- (Tabla 2), concentrado 10 veces, se lo fracciona en botellas plásticas y se lo conserva a -20 °C.
Tabla 2. Composición química del medio basal de acuerdo con Murashige et Skoog (1962).
| Composición química | ||
|---|---|---|
| Macronutrientes | Concentración en mg/L | |
| NH4NO3 | 1650 | |
| KNO3 | 1900 | |
| KH2PO4 | 170 | |
| MgSO4.7H2O | 370 | |
| CaCL2.2H2O | 440 | |
| Micronutrientes | Concentración en mg/L | |
| FeSO4.7 H2O | 27,8 | |
| Na2.EDTA | 37,3 | |
| H3BO3 | 6,2 | |
| MnSO4.4H2O | 22,3 | |
| ZnSO4.7H2O | 8,6 | |
| NaMoO4.2H2O | 0,25 | |
| CuSO4.5H2O | 0,025 | |
| CoCl2.6H2O | 0,025 | |
| KI | 0,83 | |
| Vitaminas y Aminoácido | Concentración en mg/L | |
| Myo-Inositol | 100 | |
| Tiamina HCl | 0,1 | |
| Ácido Nicotínico | 0,5 | |
| Piridoxina HCl | 0,5 | |
| Glicina | 2 | |
| Otros | Concentración en g/L | |
| Sacarosa | 30 | |
| Agar SIGMA 1296 | 7,5 | |
De la misma manera, se preparan las soluciones stock de los reguladores de crecimiento ácido 1-naftalenacético (ANA), 6-bencilaminopurina (BAP) y ácido giberélico (AG3), necesarios para la elaboración del medio de cultivo empleado para el establecimiento y/o multiplicaciónin vitrode segmentos uninodales de mandioca (Medina et al., 2017a) a una concentración de 100 mg/L. Las mismas se fraccionan en botellas plásticas y se conservan a -20 °C.
Etapa 2: introducción de material vegetal
El establecimientoin vitrodel material vegetal de cultivares nuevos se llevó a cabo introduciendo segmentos uninodales de plantas crecidas en maceta. Para ello, estacas caulinares (con aproximadamente seis yemas) derivadas de las plantas madres se cultivaron en macetas con una mezcla de tierra negra y arena fina, en relación 1:1, para propiciar fertilidad al sustrato y favorecer el drenaje. Las estacas plantadas fueron mantenidas en el invernadero del Laboratorio de Cultivo de Tejidos Vegetales. Al cabo de 20 a 30 días, las yemas brotaron y diferenciaron vástagos foliosos conformando el lote de plantas madres (Fig. 1A). Los vástagos regenerados en maceta sirvieron como fuente de explantes uninodales para el establecimientoin vitro, previa desinfección en etanol al 70% durante 1 min, sumersión en hipoclorito de sodio al 1,1% más Tritón X-100® al 0,05% (v/v) durante 20 min y enjuague final por triplicado con agua destilada estéril (Fig. 1B). Finalizada la desinfección de los vástagos se depositan en cajas de Petri flameadas para ser seccionados en segmentos uninodales (Fig. 1C). Posteriormente los segmentos uninodales, de aproximadamente 1 cm de longitud, se cultivaron asépticamente (Fig. 1D) en el medio basal MS, suplementado con 0,01 mg.L-1de ANA, 0,01 mg.L-1de BAP y 0,1 mg.L-1de AG3(Medina et al., 2017a). El pH del medio de cultivo se ajustó a 5,8 con soluciones de KOH y/o HCl y se solidificó con 0,75% de agar (Agar Sigma® A1296). Se fraccionó el medio de cultivo a razón de 10 mL por tubo de ensayo de 50 mL, los que fueron obturados con papel de aluminio y esterilizados en autoclave a 1 atmósfera de presión (120°C) durante 20 minutos. Se cultivó un segmento uninodal por tubo. Los vástagos regeneradosin vitrocon este procedimiento, constituyeron la fuente de explantes para los sucesivos subcultivos.

Fig. 1. Introducción, regeneración, multiplicación y conservación de plantas de mandioca (Manihot esculenta) por cultivoin vitrode segmentos uninodales. A: Plantas madres crecidas en maceta. B: Desinfección de vástagos regenerados en maceta. C: Vástagos desinfectados. D: Segmento uninodal cultivadoin vitro. E: Explante con vástago regenerado libre de contaminación. F: Explante contaminado con hongos. G: Explante contaminado con bacterias. H: Segmentos uninodales de plantas regeneradasin vitroderivadas de explantes desinfectados. I: Plantas regeneradasin vitroa partir de distintos materiales genéticos. J: Plantas conservadasin vitrodurante 4 meses de cultivo en promedio. Barras: A: 10 cm; B-J: 1 cm.
Etapa 3: multiplicación y conservación
Al momento de un nuevo subcultivo, los cultivares se multiplicaron a partir de las plantas regeneradasin vitrosiguiendo los procedimientos recomendados por Medina et al. (2017a). Durante todos los años de conservación, se contempló el cultivo de 10 tubos por cultivar y por cada uno de los subcultivos realizados anualmente como mínimo. Para que el cultivo se conserve por más tiempo sin necesidad de repique, el medio de cultivo fraccionado por tubo fue de 15 mL.
Etapa 4: incubación
Los cultivos provenientes de las etapas de introducción y de multiplicaciónin vitrose incubaron en un cuarto climatizado a 27±2ºC, con un fotoperíodo de 14 h controlado mediante un interruptor horario e iluminado con lámparas Philips TL-D Reflex Blanco Frío (irradiancia fotosintéticamente activa de 116 μmol m-2s-1). Para asegurar que el suministro eléctrico de este cuarto climatizado sea continuo, toda la instalación estuvo conectada a un grupo electrógeno con encendido automático en caso de corte del servicio.
Etapa 5: inspección del estado de los cultivos
Desde 1982 hasta 2004, no se registraron datos del estado de los materiales conservados en forma sistemática. Si bien se controló el material preservado, no se tiene referencia de cómo se los inspeccionaba para determinar la necesidad de un nuevo subcultivo.
Desde el 2005, se planificaron censos periódicos del estado de los cultivos como una herramienta de control y decisión, considerando cualitativamente la cantidad de tubos con plantas vivas y en crecimiento y de tubos con plantas muertas, ya sea por infección, oxidación o deshidratación. Adicionalmente, en el año 2019, para evaluar la viabilidad de los materiales se determinó la tasa de multiplicación (i.e. número promedio de nudos regenerados por explante por mes), la longitud de los vástagos a los 90 días de conservación y la longitud de entrenudos promedio del plantel de cultivares completo. Integrando estas 3 variables, se analizaron las relaciones fenotípicas entre los cultivares y se representaron gráficamente mediante un análisis de conglomerados utilizando el promedio aritmético de grupos de pares no ponderados (UPGMA) y la distancia euclidiana promedio. El ajuste entre ambas matrices se realizó mediante el coeficiente de correlación cofenética. El análisis de conglomerados se realizó mediante el programa PAST V 1.50 (Hammer et al., 2001).
Considerando estos aspectos fue posible agrupar los materiales de acuerdo a la necesidad de subcultivo y ordenar su multiplicación. Asimismo, el plantel completo de cultivares se cultivóin vitrocada vez que se realizó un nuevo subcultivo.
Aspectos de orden legal e institucional:
Medidas sanitarias adoptadas durante la pandemia por COVID-19
Decretado el ASPO y posteriormente el Distanciamiento Social, Preventivo y Obligatorio (DISPO) en el territorio argentino por la pandemia por COVID-19, para dar continuidad a las actividades relacionadas con el mantenimiento del Banco de Germoplasmain vitrode mandioca, el personal involucrado se organizó en base a las indicaciones de los protocolos de seguridad e higiene del CONICET para reiniciar actividades esenciales experimentales en el ámbito del IBONE (CONICET, 2020a; 2020b; 2020c; IBONE, 2020) y de la FCA-UNNE (UNNE, 2020a; 2020b). El personal esencial autorizado para prestar servicios críticos e indispensables, siguiendo las indicaciones de los protocolos vigentes, se encargó del mantenimiento y rescate de los materiales del Banco de germoplasmain vitrode mandioca en custodia. De esta manera, se alternó la preparación de los medios nutritivos y el cultivo en cámara de flujo laminar de aire estéril. En forma resumida, la concurrencia al laboratorio se realizó en vehículo particular en días y horarios pre-acordados con todo el personal del área y respetando el aforo de personas permitidas por m2y el distanciamiento físico exigido. Al ingreso se procedía a la sanitización de manos con alcohol 70° y de plantillas del calzado en bandejas con solución desinfectante, uso permanente de tapabocas y uso de ropa de trabajo para la estadía en el laboratorio, sanitización o lavado frecuente de manos, limpieza de zonas y equipos con las soluciones admitidas antes y después de su ocupación. Además, se presentaban las Declaraciones Juradas correspondientes a ambas instituciones.
Resultados y Discusión
En el NEA, las investigaciones relacionadas con el desarrollo de metodologías de multiplicación, saneamiento y conservación de germoplasma de mandioca se remontan a la década de los setenta (Rey et Mroginski, 1978). Recién en 1982, los materiales genéticos introducidos o entradas de mandioca en estudio se concibieron como banco de germoplasma en condicionesin vitro(Mroginski,com. pers.) y desde entonces ofició de banco activo y colección de trabajo. El Banco de germoplasmain vitrode mandioca de la FCA-UNNE y del IBONE es una colección de cultivares bajo custodia, que se ha mantenido y acrecentado gracias a la gestión de diferentes investigadores que llevaban o llevan a cabo proyectos propios relacionados a la temática o en interacción con otras instituciones. Esta forma de administración del banco aseguró la supervivencia del material vegetal y el crecimiento en número de las entradas preservadas, cuya evolución entre 2005-2020, se representa en la Fig. 2. Además, esta manera de trabajar hizo y sigue haciendo propicia la ejecución de proyectos de investigación y la formación de recursos humanos calificados mediante el desarrollo de estadías, pasantías, tesinas de grado o tesis de posgrado (Mroginski et Scocchi, 1992; Scocchi et al., 1996; Medina et al., 2007a; Cavallero, 2010; Medina, 2010; Bertollo et al., 2015; Galeano, 2016; Schaller, 2016; Medina et al., 2017b; Bertollo, 2019; Zahner, 2021). Estas herramientas académicas o de interacción inter-institucionales, favorecieron el aumento del número de las entradas, haciendo posible la preservación de un patrimonio natural invaluable, útil para el progreso productivo y económico de la región y para el desarrollo de estudios científicos relacionados con aspectos morfogénicos, sanitarios, genéticos, agronómicos y tecnológicos (Medina et al., 2003; Medina et al., 2007b; Cavallero et al., 2012; Zanini et al., 2018; Collavino et al., 2022).
En general, las referencias de la evolución temporal del número total de entradas preservadas o de las entradas por año en cada banco de germoplasma son muy escasas. En los pocos casos en que se hace mención de dicha evolución la curva es ascendente, aunque el número de entradas o introducciones por año es irregular (Ebert, 2008; González Pérez et Cabrera García, 2019). Dicho comportamiento también se observó en la evolución del Banco de germoplasmain vitrode mandioca de la FCA-UNNE y del IBONE (CONICET-UNNE) (Fig. 2). Cuando el banco de germoplasma es de semillas, si no se evaluara periódicamente la viabilidad de las mismas, esa curva podría estar representando algo incierto. En el caso particular del Banco de germoplasmain vitrode mandioca aquí analizado, todos los materiales preservados se encuentran en activo crecimiento (regenerando plantas completas), garantizando la fidelidad de la curva de la Fig. 2.
Desde el 20 de marzo del año 2020, el inicio del ASPO afectó las actividades laborales. Desde septiembre de dicho año, el cambio de status epidemiológico de la Provincia de Corrientes a fase IV de administración del asilamiento y las gestiones por parte de las autoridades de la FCA-UNNE e IBONE hicieron posible el retorno al laboratorio. Sumado a esto, la organización del trabajo en etapas que se venía implementando desde 2005 para el mantenimiento del Banco de germoplasmain vitrode mandioca, tal y como fuera estandarizado y sugerido por instituciones de referencia (Mafla et al., 2010), facilitó el rescate del material en forma ordenada, eficaz y eficiente. La preparación diferida de las soluciones madres del medio basal y los reguladores de crecimiento en el año 2020 cobró capital importancia. La conservación a -20 °C de dichas soluciones, permitió que, desde el primer día hábil del reinicio de actividades, fuera posible preparar los medios nutritivos, sin destinar tiempo al formulado de las mismas, ya que el mismo era escaso y los cultivos presentaban signos de necesidad inminente de subcultivo. La gran mayoría de los cultivares, habiéndose transferido a medio fresco por última vez en diciembre de 2019, permanecieron en los mismos tubos alrededor de 7 meses, por lo que elaborados los medios nutritivos inmediatamente se pudieron iniciar las tareas de multiplicación priorizando los cultivares en estado más crítico.
Si bien los bancos de germoplasma tienen misiones, recursos y sistemas de gestión diferentes, comparten objetivos básicos. En relación a estos objetivos, los principios fundamentales de la conservación según la FAO (2014) son velar por la identidad de las entradas, mantener la viabilidad, la integridad genética y la sanidad de los materiales preservados, proveer de instalaciones seguras que eviten la acción de factores externos perjudiciales y arbitrar el acceso a los recursos fitogenéticos.
En el caso del Banco de germoplasmain vitrode mandioca de la FCA-UNNE y del IBONE se ha subcultivado 3 veces en promedio por año entre el 2005 y el 2020 (Fig. 2). En los primeros momentos del reinicio de actividades en el año 2020, el personal esencial autorizado era escaso y podía asistir al laboratorio sólo una vez a la semana hasta que fue ampliada la lista de personas habilitadas y los horarios permitidos para concurrir al laboratorio. De esta manera, alternando y dividiendo tareas fue posible el subcultivo de todos los materiales hasta 2 veces en el año 2020 desde la reanudación de las actividades esenciales experimentales (Fig. 3), habiéndose recuperado 55 de los 56 cultivares acumulados a la fecha. El único cultivar que no sobrevivió al primer repique del año fue Campeona, luego de transcurrir 7 meses de su último subcultivo. Habiéndose puesto a punto la metodología para la introducción a condiciones asépticas (Cavallero et al., 2012), y siendo Campeona integrante del plantel cultivado en el Campo Didáctico-Experimental de la FCA-UNNE, se pudo reintroducirin vitroy se sumó nuevamente al banco de germoplasma de referencia a fines de 2020 (Fig. 1). A un mes de cultivo post-reintroducción, se observaron explantes con vástagos regenerados sin signos de contaminación por microrganismos (Fig. 1E), explantes contaminados con hongos (Fig. 1F) o bacterias (Fig. 1G). A partir de los vástagos regenerados libres de contaminación se obtuvieron plantas, que al cabo de 4 meses en promedio, se seccionaron en segmentos uninodales (Fig. 1H), los que fueron subcultivados por primera vez (primera multiplicación) para conformar el lote a conservar. Dichos segmentos uninodales derivados de plantasin vitroregeneraron plantas, las cuales presentaron una capacidad de crecimiento variable según el material genético (Fig.1I). A los 4 meses de cultivo en promedio, las plantas conservadasin vitropresentaban un crecimiento excesivo con enrollamiento del vástago en la parte superior del tubo, multitud de raíces adventicias en nudos y entrenudos del tallo, senescencia y abscisión foliar y una drástica disminución del medio nutritivo (Fig. 1H), signos que fueron considerados al momento de decidir nuevos subcultivos. El cuidado de los cultivos del banco de germoplasma involucró además el control del correcto funcionamiento de la cámara de incubación, su climatización e iluminación.

Fig. 2. Evolución del banco de germoplasmain vitrode mandioca de FCA-UNNE e IBONE (CONICET-UNNE) entre 2005-2020.

Fig. 3. Número de subcultivos promedio del banco de germoplasmain vitrode mandioca de FCA-UNNE e IBONE (CONICET-UNNE) entre 2005-2020. Línea de trazo discontinuo indica el promedio aritmético.

Fig. 4. Tasa de multiplicación promedio de plantasin vitrodel banco de germoplasma de mandioca de FCA-UNNE e IBONE (CONICET-UNNE) en 2019. Línea de trazo discontinuo indica el promedio aritmético.
El análisis de los datos derivados de la inspección del estado de los cultivos permite afirmar que a pesar de la cantidad de años de conservación del plantel de cultivares y de la cantidad de subcultivos a la que fueron sometidos, hasta el momento, manifiestan una tasa de multiplicación activa con un promedio de 3,45 nudos por mes (Fig. 4) compatible con las citadas para la especie (Pedroso de Oliveira, 2000) y que no difiere de la registrada años atrás en algunos cultivares integrantes del mencionado banco (Medina et al., 2012). Por otra parte, si bien la longitud de los vástagos alcanzada luego de 90 días de conservación muestra una gran variabilidad entre genotipos (Fig. 5), en todos los casos, las yemas axilares de los explantes brotaron y crecieron regenerando vástagos foliosos de una altura promedio de 16,39 cm, corroborando la viabilidad del material preservado. La longitud de entrenudos también fue muy variable, con un valor promedio de 1,57 y de al menos 1 cm en 53 cultivares de los 56 conservados (Fig. 6), tal elongación facilitó el seccionamiento de los explantes y optimizó el aprovechamiento de los mismos al momento de realizar los subcultivos.
Para el manejo de los subcultivos, la evaluación cualitativa del estado general de los cultivos a través de censos (i.e. tubos con plantas vivas o muertas), la determinación de la tasa de multiplicación, la longitud de los vástagos alcanzada luego de 90 días de conservación y la longitud promedio de entrenudos fueron fundamentales. La consideración de estos aspectos, en forma conjunta, permitió decidir el momento adecuado para organizar la preparación de los medios nutritivos y la realización de los cultivos por grupos de prioridad de acuerdo a los signos de necesidad de un nuevo subcultivo que presentaban los materiales.
En general, el porcentaje de tubos con plantas muertas nunca superó el 20% del total cultivado para cada material (datos no mostrados), por lo que se tuvo principalmente en consideración la vigorosidad de las plantas vivas, en correspondencia con los conglomerados o grupos resultantes de un análisis multivariado. El fenograma resultante (Fig. 7) presentó un coeficiente de correlación cofenética igual a 0,815, lo que demostró un buen ajuste con respecto a la matriz de distancia utilizada de acuerdo a lo indicado por Rohlf et Sokal (1981). De acuerdo al fenograma de distancia fue posible identificar variabilidad fenotípica y distinguir 4 grupos bien definidos con una línea de corte de 4,8 (Fig. 6). De abajo hacia arriba, se pueden observar 4 grupos, dos de los cuales comprendieron los cultivares con mayor tasa de multiplicación, longitud de vástagos a los 90 días de conservación y longitud promedio de entrenudos (desde Surubím-41 a EC 3). En el extremo opuesto, el conglomerado más distante a estos últimos fue el grupo de cultivares que presentó los valores más bajos en todas las variables evaluadas (desde Palomita FCA-UNNE a EC 24). Ubicado entre los grupos extremos, se pudo evidenciar un grupo de comportamiento intermedio en donde se agruparon la mayoría de los cultivares analizados (23 de 56). Cabe destacar que transcurridos los 90-100 días de conservación, fue posible visualizar el consumo total del medio de cultivo en el caso de los cultivares más vigorosos y el consumo parcial del mismo en el grupo de cultivares menos vigorosos. De esta manera, los cultivares vigorosos de elevada tasa de multiplicación, vástagos más altos y entrenudos más largos encabezaron los subcultivos a medio nutritivo fresco y así sucesivamente hasta llegar al grupo de los menos vigorosos, caracterizados por presentar baja tasa de multiplicación y longitud de vástagos y entrenudos más cortos. Se observaron coincidencias en la conformación de grupos de cultivares de mandioca con el trabajo de Medina et al. (2017a), quienes evaluaron atributos cuantitativos relacionados con la propagación.
En relación al mantenimiento de la integridad genética de los materiales preservados, la misma fue garantizada propiciando la vía de regeneración de plantas por organogénesis directa durante la conservación, tal como se señalara para mandioca y otras especies (Medina et al., 2004; Ghimire et al., 2012; Basu et Jha, 2014; Medina et al., 2017). Además, se ha citado que las técnicas de propagaciónin vitrobasadas en la regeneración de vástagos vía brotación de ápices caulinares en forma directa son los más deseables para la conservación de germoplasma, ya que tienden a preservar la estabilidad genética durante el proceso morfogénico (Scocchi et al., 2004).
Respecto al arbitrio para el acceso a los recursos conservados, se realizaron acciones de intercambio a través de convenios de cooperación científica para la consecución de proyectos o formación de recursos humanos (Cavallero, 2010; Cavallero et al., 2012; Bertollo et al., 2015; Zanini et al., 2018; Bertollo, 2019).
En la actualidad, el germoplasma de mandioca a nivel mundial se conserva principalmente en colecciones en condiciones de campo oin vitro(González-Arnao et Engelmann, 2013; CIAT, 2021). Según la plataforma Genesys, en la que se encuentra informaciónon linesobre recursos fitogenéticos para la alimentación y la agricultura disponibles en bancos genéticos de todo el mundo, las entradas registradas deManihotson unas 13113, de las cuales 12438 se conservan a campo (31%),in vitro(68,6%) y por crioconservación (0,4%) (Genesys, 2021).
En relación a las estrategias basadas en el cultivo de tejidos que se emplean para la conservación de germoplasma vegetal, particularmente en mandioca, se utilizan metodologías de conservación a corto plazo mediante subcultivos secuencialesin vitrosin restricción del crecimiento (micropropagación), conservación a mediano plazo mediante cultivos a los que se les impone una cierta restricción del crecimiento (cultivo en medios subóptimos o de crecimiento mínimo) o conservación a largo plazo mediante cultivos a los que se les suprime totalmente el crecimiento sometiendo a los explantes a temperatura ultrabajas (i.e. crioconservación) (San José et al., 2014; Mafla et al., 2010; Danso et Ford-Lloyd, 2011; Bonilla Morales et al., 2015). En nuestro laboratorio, el tipo de conservación empleado es el de subcultivos secuencialesin vitrosin restricción del crecimiento, por lo que requiere varios subcultivos anuales. Decretado el ASPO en Argentina por la pandemia por COVID-19, si bien se pudieron llevar a cabo las tareas de multiplicación con cierta normalidad, las mismas se vieron seriamente dificultadas, por lo que en adelante debería considerarse la instauración de un plantel de cultivares homólogo cultivado en medios de crecimiento mínimo (Mafla et al., 2000).

Fig. 5. Longitud de vástagos promedio de plantasin vitrodel banco de germoplasma de mandioca de FCA-UNNE e IBONE (CONICET-UNNE) en 2019. Línea de trazo discontinuo indica el promedio aritmético.
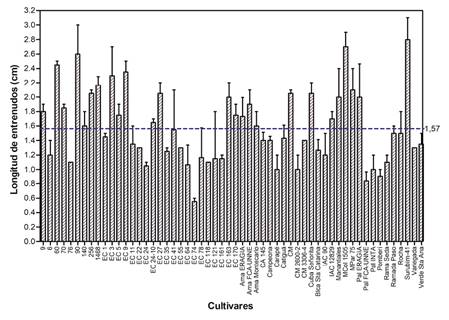
Fig. 6 Longitud de entrenudos promedio de plantasin vitrodel banco de germoplasma de mandioca de FCA-UNNE e IBONE (CONICET-UNNE) en 2019. Línea de trazo discontinuo indica el promedio aritmético.

Fig. 7. Fenograma de 56 cultivares de mandioca empleando el método del promedio aritmético de grupos de pares no ponderados (UPGMA) y la distancia Euclidiana promedio de 3 variables cuantitativas (i.e. número promedio de nudos regenerados por explante por mes, longitud de los vástagos a los 90 días de conservación y longitud de entrenudos promedio). Coeficiente Correlación Cofenética = 0,815.
Conclusiones
En el Laboratorio de Cultivo de Tejidos Vegetales de la Facultad de Ciencias Agrarias de la Universidad Nacional del Nordeste (FCA-UNNE) y el Instituto de Botánica del Nordeste (IBONE, CONICET-UNNE), se conservanin vitrocultivares de mandioca dando lugar a un Banco de germoplasma, el cual fue creciendo en número y diversidad de procedencias por casi 40 años, totalizando unas 56 entradas hasta la fecha. Dichos materiales, por la modalidad de conservación empleada sin restricción del crecimiento y por la vía de regeneración promovida, se puede decir que son plenamente viables y estables.
Las instituciones públicas, en este caso particular, la FCA-UNNE y el IBONE desempeñan un rol insoslayable y fundamental para la preservación de materiales genéticos vegetales en el NEA, cumpliendo con su misión de calidad, excelencia y pertinencia, comprometidas con la región y con el país. Para el desarrollo de estas actividades, no sólo fue importante el soporte económico y financiero brindado por sendas instituciones, sino también el apoyo institucional mediante la adopción oportuna y factible de medidas que facilitaron la reanudación de las tareas de conservación del germoplasma de forma segura durante la pandemia por COVID-19.
El apoyo institucional integral y sostenido a los docentes-investigadores involucrados en este tipo de actividades, garantizará no sólo la preservación del patrimonio vegetal en custodia, sino también la realización de nuevas líneas de investigación científica y tecnológica, proyectos de extensión y/o divulgación de la Ciencia y Tecnología, así como la formación de recursos humanos.
Para poder afrontar los nuevos escenarios impuestos por la situación sanitaria actual, se deberán considerar la puesta a punto de metodologías de conservación alternativas que acompañen a las ya empleadas, que sean eficaces para mantener la viabilidad del material y capaces de prolongar el tiempo de conservación.















