Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
On-line version ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.44 no.2 Mendoza Jul./Dec. 2012
ARTÍCULOS ORIGINALES
Extracto de semillas de vid (Vitis vinifera L.) con actividad antioxidante: concentración, deshidratación y comparación con antioxidantes de uso comercial
Antioxidant grape seed extract (Vitis vinifera L.): concentration, drying and comparison with commercial antioxidants
Silvia C. Paladino 1, Carlos A. Zuritz 2
1 Cát. de Enología I. Facultad de Ciencias Agrarias. UNCUYO. Alte. Brown 500. Chacras de Coria. Mendoza. Argentina. M5528AHB. spaladino@fca.uncu.edu.ar
2 Investigador, Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina. Facultad de Ciencias Agrarias. UNCUYO.
Originales: Recepción: 29/04/2011 - Aceptación: 05/09/2012
RESUMEN
Los objetivos de este trabajo fueron: 1) Evaluar un proceso de concentración y deshidratación de un extracto polifenólico de semillas de vid (Vitis vinifera L.). El proceso debía conservar el poder reductor del extracto. 2) Valorar la eficiencia del antioxidante obtenido por comparación con antioxidantes de uso habitual en un producto vegetal susceptible de ser oxidado, tal como el jugo de manzanas. El extracto de semillas de vid fue concentrado a 60°C en un concentrador rotativo al vacío de laboratorio. La concentración de los compuestos fenólicos fue determinada por el método de Folin-Ciocalteu modificado. La actividad antioxidante se determinó midiendo el poder reductor, por el método de Oyaizu. La oxidación del jugo de manzanas se determinó por el método de Özoglu. El extracto concentrado obtenido fue deshidratado por dos métodos: liofilización y secado en lecho de espuma. A igual concentración fenólica, el extracto concentrado mostró mayor capacidad antioxidante que el extracto simple. El extracto secado en lecho de espuma conservó la misma capacidad antioxidante que el extracto concentrado. El extracto liofilizado experimentó una pérdida significativa de la actividad antioxidante. El extracto concentrado de semillas de vid inhibió la oxidación del jugo de manzanas en un 31,51%, el ácido ascórbico en un 2,60% y el dióxido de azufre en un 97,40%.
Palabras clave: Polifenoles; Extracto de semillas de vid; Antioxidantes; Concentración; Secado; Jugo de manzanas
SUMMARY
The objectives of this work were: 1) to evaluate the processes of concentration and drying of a polyphenolic grape seed extract (Vitis vinifera L.). The processes should be able to preserve the reducing power of the extract; 2) to evaluate the efficiency of the antioxidant obtained by comparison with frequently used commercial antioxidants in a vegetable product susceptible to oxidation, such as apple juice. The single strength aqueous grape seed extract was concentrated at 60°C in a laboratory scale rotary evaporator under vacuum. The phenolic compounds concentration was determined using a modified Folin-Ciocalteu method. The antioxidant activity was evaluated measuring the reducing power by the method of Oyaizu. Apple juice oxidation was determined by the Özoglu method. The concentrated extract obtained was dehydrated by two methods: freeze-drying and foam-mat drying. At the same phenolic concentration, concentrated extracts exhibited greater antioxidant capacity than single strength extracts. Foam-mat dried extracts maintained the same antioxidant capacity than the concentrated extracts. Freeze dried extracts experienced a significant loss of antioxidant activity. The concentrated grape seed extract inhibited the oxidation of apple juice in 31.51%, ascorbic acid in 2.60% and sulfur dioxide in 97.40%.
Keywords: Polyphenols; Grape seed extracts; Antioxidants; Concentration; Drying; Apple juice
INTRODUCCIÓN
Los procesos de oxidación que sufren los alimentos deterioran la calidad de los mismos, originando cambios en el aroma, el color y el sabor. Por ello, el uso de antioxidantes sintéticos es una práctica difundida en la elaboración de productos alimenticios. Existe un creciente interés por la búsqueda de antioxidantes naturales capaces de sustituir los antioxidantes sintéticos, cuestionados por su toxicidad (24).
Las semillas de vid (Vitis vinifera L.) contienen compuestos fenólicos flavonoides tales como (+) catequina, (-) epicatequina, epicatequin-3-galato, polímeros de catequina de 2 a 16 unidades (procianidinas poliméricas), así como ácidos fenólicos (5, 34). Los compuestos fenólicos contenidos en las semillas de la vid presentan una variedad de efectos biológicos: antioxidantes, captores de radicales libres, antinflamatorios, antihipertensivos, antimutagénicos, antineoplásicos, antivirales, antibacterianos, antiúlcera estomacal, antitumorales, cicatrizantes, antihiperglucémicos, cardioprotectores, antihepatóxicos, anticataratas oculares y actúan como filtros solares. Estas propiedades están relacionadas con la reactividad del grupo fenol y han sido comprobadas in vitro, in vivo, en animales y en seres humanos (4, 5, 10, 11, 16, 22, 26, 29, 33, 36).
Existen antecedentes sobre el empleo de extractos de semillas de vid como antioxidante en distintos alimentos, tales como carne de vaca (1), carne de pavo (14,19), pescado azul (18) y aceites de algas (20). Si bien hay antecedentes de la acción antioxidante de los ácidos cinámicos sobre el pardeamiento enzimático del jugo de manzanas (23), no se conocen antecedentes sobre la actividad antioxidante de un extracto de semillas de vid aplicado a alimentos de origen vegetal, tales como jugos de frutas.
En un trabajo previo se obtuvo un extracto acuoso de semillas de vid, cuyas características reductoras fueron comprobadas sobre ferricianuro de potasio (24). Para facilitar el uso y la preservación del extracto se desea deshidratarlo y transformarlo en un polvo, pero los tratamientos térmicos aplicados al extracto acuoso pueden ejercer distintas acciones sobre los compuestos antioxidantes. Pueden causar un incremento en el coeficiente de difusión y en la solubilidad del soluto, pero también pueden degradar las sustancias fenólicas (9, 25). La liofilización y el secado en lecho de espuma son alternativas para deshidratar un líquido, minimizando el deterioro de sus cualidades reductoras.
La liofilización es un proceso muy oneroso, debido al elevado consumo de energía, pero se obtiene un producto seco de alta calidad (3).
El secado en lecho de espuma es un método adecuado para deshidratar productos en estado líquido. Los tiempos de secado son breves, debido al transporte acelerado de agua líquida al frente de evaporación, causado por el aumento de la superficie de evaporación de los materiales convertidos en espuma. Esta situación crea un producto que se rehidrata fácilmente y retiene compuestos volátiles (13, 27, 35).
Los compuestos que posean características antioxidantes deben ser ensayados en un sistema real sujeto a oxidación, para verificar su acción. Para calificar la intensidad de su poder reductor deben ser comparados con antioxidantes de comportamiento conocido, aplicados al mismo sistema (32).
El dióxido de azufre, el bisulfito de sodio y potasio, el sulfito de sodio y el metabisulfito se han agregado desde la antigüedad a los alimentos para prevenir la oxidación de los mismos, pero pueden provocar reacciones alérgicas en individuos sensibles. Los sulfitos inhiben la polifenoloxidasa y reaccionan con los grupos carbonilos, impidiendo la formación de pigmentos (17). Otro antioxidante ampliamente utilizado en alimentos es el ácido ascórbico. Este producto minimiza el pardeamiento enzimático, reduciendo las quinonas a fenoles, antes de formar pigmentos oscuros. Es un producto seguro (GRAS: generally recognized as safe). La acción antioxidante se debe al secuestro del cobre del grupo prostético de la polifenoloxidasa (8). El Código Alimentario Argentino (7) en sus artículos N° 996 y 1398 permite utilizar ambos antioxidantes: SO2 (dosis máxima 0,004 g/100 ml) y el ácido ascórbico (sin especificar una dosis máxima). Estos antioxidantes son útiles para comparar la actividad del antioxidante en estudio.
Los propósitos de este trabajo fueron: 1) Evaluar un proceso de concentración y deshidratación de un extracto polifenólico de semillas de vid (Vitis vinifera L.). El proceso debía conservar el poder reductor del extracto. 2) Valorar la eficiencia del antioxidante obtenido por comparación con antioxidantes de uso habitual en un producto vegetal susceptible de ser oxidado, tal como el jugo de manzanas.
MATERIALES Y MÉTODOS
Concentración del extracto y deshidratación de un extracto polifenólico de semillas de vid
Concentración
El extracto a concentrar fue obtenido por medio de una extracción acuosa a 90°C, durante 3 horas, a partir de semillas de vid cv Cabernet Sauvignon, provenientes de vinificaciones realizadas en la Bodega de la Facultad de Ciencias Agrarias, Universidad Nacional de Cuyo, Mendoza, Argentina. La relación sólido-líquido fue 1 g de semillas y 10 ml de solvente. Las semillas fueron obtenidas al momento de realizar el descube de los vinos tintos, por lo tanto, fueron sometidas a los procesos de maceración y fermentación alcohólica, previa a su utilización. La concentración se llevó a cabo en un evaporador rotativo al vacío marca Decalab, trabajando a una temperatura de 60°C. En los extractos concentrados y sin concentrar se determinaron fenoles totales por método de Folin Ciocalteu modificado (31) y el poder reductor por el método de Oyaizu (24). El ensayo se realizó con dos tratamientos (extracto simple y extracto concentrado) y cuatro repeticiones.
Verificación del poder reductor: Se utilizó jugo de manzanas, debido a su tendencia a la oxidación. El nivel de oxidación del jugo de manzanas fue determinado por lectura de la absorbancia a 420 nm sobre muestras centrifugadas (3000 rpm, durante 10 minutos) y diluidas 1:5. Se calculó el porcentaje de inhibición de la oxidación (23) de acuerdo con la siguiente fórmula:

El jugo de manzanas se obtuvo de manzanas frescas, cv Red delicious. Las manzanas fueron peladas y luego ralladas con una multiprocesadora de uso culinario. Las manzanas ralladas se colocaron en un lienzo y se prensaron en forma manual para obtener el jugo. Se determinó la absorbancia a 420 nm en forma inmediata a la obtención del jugo, antes del desarrollo de la oxidación. Se realizó un experimento con tres tratamientos y cuatro repeticiones. Los tratamientos efectuados fueron testigo (jugo de manzanas sin agregados), extracto simple (ES) y extracto concentrado (EC).
Las dosis de fenoles totales contenidas en el extracto a emplear se seleccionaron en base a ensayos previos. El extracto simple contenía 1143,2 mg de fenoles totales por litro. Se emplearon 20 ml de ES por cada 80 ml de jugo de manzanas (equivalente a 22,86 mg de fenoles totales). El extracto concentrado presentó una concentración de 36370,7 mg de fenoles totales por litro. Se emplearon 629 µl de EC por cada 80 ml de jugo de manzanas (equivalente a 22,86 mg de fenoles totales). El extracto concentrado fue reconstituido con agua destilada al volumen empleado de extracto simple (20 ml). El testigo (tratamiento sin antioxidante) se formó con 80 ml de jugo de manzanas + 20 ml de agua.
Deshidratación
Para realizar este ensayo se realizó una concentración más intensa del extracto de modo de obtener 186254,6 mg/l de fenoles totales.
Deshidratación en lecho de espuma
Se preparó una mezcla con 25 g de agua destilada, 2,5 g de ovoalbúmina, 0,5 g de carboximetilcelulosa y 0,5 g de (PO4)2 Ca3. La mezcla fue realizada con una batidora doméstica, hasta lograr una espuma consistente. Posteriormente se agregó a dicha espuma 10 ml (10,59 g) de extracto concentrado (186254,6 mg/l de fenoles totales y densidad = 1,059 g/ml). Este preparado fue colocado sobre bandejas de madera con tela de malla inoxidable 2 mm x 2 mm, y fue secado por medio de flujo de aire a 65°C, durante 90 minutos (35). Se partió de 39,09 g de mezcla total, donde 10,59 g correspondían al extracto fenólico, equivalente a 1862,546 mg de fenoles totales. Luego del secado, se obtuvieron 4,709 g de polvo.
Verificación del poder reductor: Al sustrato oxidable, 80 ml de jugo de manzanas, se le aplicaron los siguientes tratamientos, cada uno con cuatro repeticiones: testigo 20 ml de agua destilada, extracto concentrado (EC) 20 ml de agua destilada + 123 µl de EC (22,86 mg de fenoles totales) y extracto secado en lecho de espuma (ECSLE) 20 ml de agua destilada + 58 mg de ECSLE (22,86 mg de fenoles totales). El nivel de oxidación del jugo de manzanas fue determinado de acuerdo con lo indicado anteriormente. El tiempo de tratamiento fue 24 horas, a 20°C de temperatura.
Deshidratación por liofilización
El extracto concentrado fue liofilizado en liofilizador Thermovac, a -50°C, en ampollas de vidrio conteniendo 123 µl de extracto (22,86 mg de fenoles totales).
Verificación del poder reductor: Al sustrato oxidable, 80 ml de jugo de manzanas, se le aplicaron los siguientes tratamientos, cada uno con cuatro repeticiones: testigo 20 ml de agua destilada, extracto concentrado (EC) 20 ml de agua destilada + 123 µl de EC (22,86 mg de fenoles totales) y extracto secado liofilizado (ELI) 20 ml de agua destilada + una ampolla de ELI (123 µl de EC = 22,86 mg de fenoles totales). El nivel de oxidación del jugo de manzanas fue determinado de acuerdo con lo indicado anteriormente.f
Eficiencia del antioxidante en estudio: comparación con otros antioxidantes
Se diseñó un experimento con cuatro tratamientos y cuatro repeticiones. El sustrato oxidable fue jugo de manzanas. Los tratamientos fueron: testigo, extracto líquido concentrado de semillas de vid (EC = 186254,6 mg/l de fenoles totales), ácido ascórbico en polvo (AA) y dióxido de azufre en solución acuosa 58,88g/l (SO2). Las dosis aplicadas a 100 ml de jugo de manzanas recién obtenido fueron: 22,86 mg (123 µl) de fenoles totales EC (24); 0,18 mM (32 mg) de AA (23) y 4 mg (68 µl) de SO2 (7). El nivel de oxidación del jugo de manzanas fue determinado de acuerdo con lo indicado anteriormente.
Los datos obtenidos en todos los ensayos fueron procesados con el programa Statgraphics plus 4.0®. Cuando las varianzas fueron homogéneas, se aplicó el análisis de la varianza; cuando las varianzas no fueron homogéneas, se empleó el test de Kruskal-Wallis.
RESULTADOS Y DISCUSIÓN
Concentración del extracto y deshidratación de un extracto polifenólico de semillas de vid
Concentración
Los fenoles totales se concentraron aproximadamente 31,8 veces (36370,7 / 1143,2), pero el poder reductor del extracto concentrado aumentó unas 38,8 veces (68,200 / 1,756) respecto del extracto simple.
En la tabla 1 (pág. 136) se presentan los resultados obtenidos en el ensayo de concentración.
Tabla 1. Fenoles totales y poder reductor en los extractos simple (ES) y concentrado (EC) de semillas de vid (Vitis vinifera L.).
Table 1. Total phenols and reducing power of the single strength (ES) and concentrated grape seed (Vitis vinifera L.) extracts (EC).

Se realizó el análisis estadístico de la relación de concentración EC/ES para fenoles totales y la relación de concentración EC/ES para poder reductor, con el objeto de verificar si existen diferencias entre ambas (test de Kruskal-Wallis). Se comprobó que existen diferencias significativas entre la relación de concentración EC/ES para fenoles totales y la relación de concentración EC/ES para poder reductor. En la tabla 2 se presentan los resultados de este análisis.
Tabla 2. Medianas de las relaciones entre extracto concentrado y extracto sin concentrar de semillas de vid (Vitis vinifera L.).
Table 2. Medians of the ratios of total phenols and reducing power between concentrated and single strength grape seed (Vitis vinifera L.) extracts.

La concentración del extracto causó un aumento del poder reductor del mismo, superior al aumento debido a la estricta concentración del producto. Una explicación para este fenómeno puede encontrarse en los trabajos de Arnous et al. (2), Yamaguchi et al. (33), Saito et al. (29) y Rice-Evans et al. (28). Según Arnous et al. (2), la actividad antioxidante (reductora) de las proantocianidinas depende del largo de la cadena de oligómeros; los monómeros y los dímeros inhiben la oxidación de las LDL (lipoproteínas de baja densidad) de forma más eficiente que los hexámeros, mientras que la inhibición del anión superóxido tiende a incrementarse a medida que el grado de polimerización aumenta.
De acuerdo con Yamaguchi et al. (33), la capacidad de capturar anión superóxido es mayor a medida que el grado de polimerización de los flavanoles aumenta.
Saito et al. (29) verificaron que el monómero (+) catequina no inhibe la formación de úlceras gástricas en ratas, pero los oligómeros de más de tres unidades de (+) catequina presentan una fuerte actividad de protección ante la agresión a la mucosa estomacal.
Rice-Evans et al. (28) sostienen que el aumento de temperatura favorece la extracción, porque incrementa la solubilidad del soluto y también el coeficiente de difusión. Por otra parte, las muestras que fueron sujetas a destilación lograron concentraciones mayores de fenoles, así como mayor efecto antirradical que aquellas muestras que sólo fueron prensadas. Estas diferencias pueden explicarse por la tendencia que tienen los fenoles de combinarse entre sí a través de reacciones de polimerización, los oligómeros tienen mayor actividad antirradical que los monómeros.
En base a todo lo expuesto, puede hipotetizarse que la temperatura a la que fue sometido el extracto durante el proceso de concentración favoreció la polimerización, explicando de este modo el aumento relativo del poder reductor del extracto concentrado.
Verificación del poder reductor: Existen diferencias significativas entre los tres tratamientos. El tratamiento realizado con el extracto concentrado es el más eficiente, produciendo mayor inhibición de la oxidación en el jugo. (Análisis de la varianza, prueba de Tukey, 95% de confianza). La lectura inicial de densidad óptica del jugo de manzanas fue 1,659. En la tabla 3 se presentan los resultados obtenidos en este ensayo.
Tabla 3. Actividad antioxidante del extracto de semillas de vid (Vitis vinifera L.) en jugo de manzanas.
Table 3. Antioxidant activity of grape seed (Vitis vinifera L.) extracts on apple juice.

Cuando se agrega el extracto de semillas de vid al jugo de manzanas recién obtenido, se verifica una inhibición de la oxidación. Pero, a igualdad de concentración de fenoles agregada, los fenoles provenientes del extracto concentrado poseen una actividad inhibidora de la oxidación superior a la de los fenoles del extracto sin concentrar. Esto coincide con lo observado durante la concentración del extracto. Al medir el poder reductor del extracto concentrado se comprueba que el aumento del poder reductor es superior al esperado, como consecuencia de la concentración del mismo. Esto sugiere la posibilidad de un aumento de la polimerización, debido a la temperatura a la cual ha sido sometido el extracto durante la concentración.
Le Bourvellec et al. (15) observaron un hecho similar. Estos autores demostraron que la polifeniloxidasa (PPO) del jugo de manzanas es inhibida por las procianidinas naturales del mismo jugo, así como por los productos de la oxidación del ácido cafeoilquínico y de la (-) epicatequina. Esta inhibición es mayor a medida que el polímero de catequina es más grande. Por lo tanto, al agregar el extracto concentrado de semillas de vid se están agregando más procianidinas (si bien son de distinto origen vegetal), que actúan sobre la PPO.
Deshidratación
Deshidratación en lecho de espuma
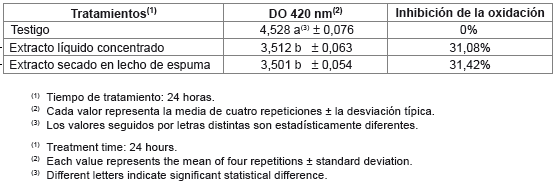
A igualdad de concentraciones fenólicas empleadas, no existen diferencias entre la inhibición de la oxidación del jugo de manzanas causada por el extracto líquido concentrado (EC) y la causada por el extracto concentrado secado en lecho de espuma (ECSLE), empleando el análisis de la varianza, prueba de Tukey, 95% de confianza. Pero existen diferencias entre el testigo y el extracto líquido concentrado (EC), así como entre el testigo y el extracto concentrado seco en lecho de espuma (ECSLE). La lectura inicial de densidad óptica a 420 nm del jugo de manzanas fue 1,26. En la tabla 4 se presentan los datos obtenidos en este ensayo.
Para un mismo contenido de fenoles totales agregado al jugo de manzanas, ambos extractos producen una inhibición de la oxidación de 31% respecto del testigo.
Tabla 4. Inhibición de la oxidación del jugo de manzanas. Efecto del extracto de semillas de vid (Vitis vinifera L.) concentrado líquido y secado en lecho de espuma.
Table 4. Antioxidant activity of concentrated and foam-mat dried grape seed extracts (Vitis vinifera L.) on apple juice.
Deshidratación por liofilización
A igualdad de concentraciones fenólicas empleadas, existen diferencias entre la inhibición de la oxidación del jugo de manzanas causada por el extracto líquido concentrado (EC) y la causada por extracto liofilizado (ELI), empleando análisis de la varianza, prueba de Tukey, para un nivel de confianza del 95%. El extracto líquido concentrado (EC) presenta una mayor inhibición de la oxidación del jugo de manzanas que el extracto liofilizado (ELI). Por lo tanto, existe una pérdida del poder antioxidante del extracto concentrado durante el proceso de liofilización. El color inicial del jugo de manzanas recién obtenido fue 1,587. En la tabla 5 (pág. 139) se presentan los datos obtenidos en este ensayo.
Tabla 5. Inhibición de la oxidación del jugo de manzanas. Efecto del extracto concentrado líquido y del extracto liofilizado de semillas de vid (Vitis vinifera L.).
Table 5. Antioxidant activity of concentrated and freeze dried grape seed extracts (Vitis vinifera L.) on apple juice.

Para un mismo contenido de fenoles totales agregado al jugo de manzanas, el extracto líquido concentrado produce inhibición de la oxidación mayor (aproximadamente el doble) que la causada por el uso del extracto secado liofilizado. Analizando el efecto de los extractos deshidratados sobre la inhibición de la oxidación, se observa que no existen diferencias entre el extracto concentrado secado en lecho de espuma y el extracto líquido concentrado, pero existen diferencias entre el extracto concentrado liofilizado y el extracto líquido concentrado.
El proceso de secado del extracto en lecho de espuma (que requiere el agregado de ovoalbúmina, (PO4)2 Ca3 y carboximetilcelulosa), no modifica la actividad antioxidante del extracto concentrado original, pero el proceso de secado del extracto por liofilización deteriora las propiedades antioxidantes de este producto. Esta pérdida de poder antioxidante puede explicarse considerando los trabajos de King et al. (12) y Chang et al. (6). En ellos se evalúan dos efectos: la creación de una mayor superficie expuesta al oxígeno y la acción de la temperatura sobre la inactivación de enzimas que degradan fenoles. King et al. (12) sostienen que la porosidad y la superficie de los productos sometidos a liofilizado son mayores que en el mismo producto deshidratado por otros métodos de secado. Esto conduce a un incremento en la oxidación del producto liofilizado debido a una mayor superficie expuesta que permite mayor contacto con el oxígeno.
Por otra parte, Chang et al. (6) trabajaron comparando las propiedades antioxidantes de tomates frescos (Solanum lycopersicum), deshidratados por aire caliente y liofilizados. Los compuestos fenólicos totales y los flavonoides totales se incrementaron en los dos tratamientos de secado respecto del testigo.
El aumento fue mayor en los tomates secados por aire caliente que en los liofilizados. Esto ocurriría porque a la temperatura de tratamiento, se inactivarían las enzimas oxidativas e hidrolíticas. Si las enzimas conservaran su actividad, se provocaría una pérdida de compuestos fenólicos. Esta situación se explicaría porque el extracto secado en lecho de espuma conserva sus características antioxidantes.
Eficiencia del antioxidante en estudio: comparación con otros antioxidantes
Existen diferencias entre la inhibición de la oxidación del jugo de manzanas causada por el extracto concentrado de semillas de vid y el dióxido de azufre. No hay diferencias entre la inhibición de la oxidación medida en el testigo y la causada por el ácido ascórbico (prueba de Kruskal-Wallis, 95% de confianza). El antioxidante que presentó mayor inhibición de la oxidación fue el dióxido de azufre, seguido por el extracto concentrado de semillas de vid. El ácido ascórbico se comportó de igual modo que el testigo, considerando 24 horas de tratamiento, a 20°C de temperatura. El color inicial del jugo de manzanas recién obtenido fue 1,587 (Abs a 420 nm). En la tabla 6 se presentan los resultados obtenidos en este ensayo.
Tabla 6. Inhibición de la oxidación del jugo de manzanas. Comparación entre el extracto de semillas de vid (Vitis vinifera L.) y otros antioxidantes comerciales.
Table 6. Antioxidant activity on apple juice. Comparison between grape seed extract (Vitis vinifera L.) and commercial antioxidants.

En las condiciones experimentales, el dióxido de azufre inhibió la oxidación en un 97,40%, resultando el antioxidante más eficiente de los comparados. Debe considerarse que la dosis de dióxido de azufre empleada es la máxima permitida por la reglamentación vigente en Argentina para jugos de frutas (7). Este producto no sólo inhibió la oxidación, sino que además produjo una disminución inicial del color en el jugo tratado, con respecto al jugo testigo. Dado que la incidencia de la oxidación se mide por el aumento de color, este efecto favorece especialmente el tratamiento con dióxido de azufre. Esta actividad decolorante del producto agregado como antioxidante ha sido observada también por Özoglu & Bayindirli (23), empleando L- Cisteína. Pero debe señalarse que, si bien el dióxido de azufre y sus derivados son compuestos altamente efectivos para prevenir el pardeamiento, pueden ser negativos para la salud humana, especialmente en las personas con problemas respiratorios (21).
El extracto concentrado de semillas de vid presentó un desempeño intermedio, inhibiendo la oxidación del jugo de manzanas en un 31,51%, superando la actividad antioxidante del ácido ascórbico, que fue de un 2,6%. El ácido ascórbico produjo una inhibición de la oxidación muy leve, no presentó diferencias con el testigo. Elácido ascórbico fue superado por el extracto de semillas de vid en cuanto a su comportamiento antioxidante. Esto coincide con los trabajos de Siddhuraju et al. (30), quienes encontraron que el extracto fenólico de hojas de Moringa oleifera Lam inhibió la peroxidación en un sistema de ácido linoleico de forma más eficaz que el ácido ascórbico. Esto puede deberse a que, dependiendo de las condiciones, el ácido ascórbico puede actuar como antioxidante o prooxidante. También puede ocurrir que el efecto del ácido ascórbico es temporario, ya que en dosis de 1,8 mM el efecto dura alrededor de 4 horas, según Özoglu & Bayindirli (23). En este ensayo, el tiempo de tratamiento fue de 24 horas. El ácido ascórbico previene el pardeamiento enzimático por reducción de las quinonas producidas por la oxidación a los difenoles originales. Una vez que el poder reductor del ácido ascórbico se ha consumido, debido a que se ha transformado (de modo irreversible) en ácido dehidroascórbico, el color pardo se desarrolla rápidamente en el producto oxidable (37).
CONCLUSIONES
El proceso de concentración del extracto de semillas de vid, por medio de evaporador rotativo al vacío, no deteriora las características reductoras del mismo. En las condiciones experimentales, este proceso incrementa la capacidad reductora del extracto. A igual concentración fenólica, el extracto concentrado de semillas presenta mayor capacidad para inhibir la oxidación del jugo de manzanas que el extracto sin concentrar. El proceso de deshidratación en lecho de espuma ha conservado las propiedades antioxidantes del extracto líquido concentrado, pero el extracto deshidratado por liofilización ha sufrido un deterioro de su capacidad antioxidante. Por lo tanto, el extracto de semillas de vid puede ser concentrado a 60°C y secado en lecho de espuma sin perder sus propiedades reductoras.
El extracto de semillas de vid actúa como un inhibidor de la oxidación del jugo de manzanas más eficiente que el ácido ascórbico, pero menos eficiente que el dióxido de azufre. En consecuencia, este extracto puede ser empleado en sustitución del ácido ascórbico, para inhibir la oxidación del jugo de manzanas.
1. Ahn, J.; Grün, L. U.; Fernando, L. N. 2002. Antioxidant properties of natural plant extracts containing polyphenolic compounds in cooked ground beef. Journal of Food Science. Vol. 67, N° 4, 1364-1369. [ Links ]
2. Arnous, A.; Makris, D.; Fekalas, P. 2001. Effect of principal polyphenolics components in relation to antioxidant characteristics of aged red wines. Journal of Agricultural and Food Chemistry. Vol.49, 5736-5742. [ Links ]
3. Arun Muthukumaran. 2007. Foam mat freeze drying of egg white and mathematical modeling. Department of Bioresource Engineering. Macdonald Campus of McGill University. Sainte-Annede- Bellevue (QC) H9X 3V9 Canadá. A thesis submitted to the Faculty of Graduate Studies and Research in partial fulfillment of the requirements for the degree of Master of Science. Consulta 8/5/2012. http://webpages.mcgill.ca/staff/deptshare/FAES/066-Bioresurce/Theses/ theses/352ArunMuthukumaran 2007/354 Arun Muthukumaran 2007.pdf. [ Links ]
4. Bagchi, D.; Bagchi, M.; Stohs, S.; Das, D.; Ray, S.; Kuszyinski, C; Joshi, S.; Pruess, H. 2000. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention. Toxicology. 148, 187-197. [ Links ]
5. Castillo, J.; Benavente-García, O.; Lorente, J.; Alcaraz, M.; Redondo, A.; Ortuño, A.; Del Río; J. A. 2000. Antioxidant activity and radioprotective effects against chromosomal damage induced in vivo by X-rays of Flavan-3-ols (Procyanidins) from grape seeds (Vitis vinifera): comparative study versus other phenolic and organic compounds. Journal of Agricultural and Food Chemistry. Vol. 48, 1738-1745. [ Links ]
6. Chang Chin-Hui; Hsing-Yu Lin; Chi-Yue Chang; Yung-Chuan Liu. 2006. Comparisons on the antioxidant properties of fresh, freeze dried and hot-air dried tomatoes. Journal of Food Engineering. Vol.77, 478-485. [ Links ]
7. Código Alimentario Argentino. 2010.www.anmat.gov.ar.2010 Capítulo XII, art.996 Bebidas analcóholicas, resolución GMC N° 141/96, incorporada por Res. MS y AS N° 587 /97. Fecha de consulta: 28 de marzo de 2011. [ Links ]
8. Cortez-Vega, W. R.; Becerra-Prado, A. M.; Marques Soares, J.; Graciano Fonseca, G. 2008. Effect of L-Ascorbic Acid and Sodium Metabisulfite in the Inhibition of the Enzymatic Browning of Minimally Processed Apple. International Journal of Agricultural Research, 3: 196-201. [ Links ]
9. Davidov-Pardo, G.; Arozarena, I.; Marín Arroyo, M. R. 2011. Kinetics of termal modifications in a grape seed extract. Journal of Agriculture and Food Chemistry. Vol. 59, 7211-7217. [ Links ]
10. Jayaprakasha, G. K.; Singh, R. P.; Sakariah, K. K. 2001. Antioxidant activity of grape seed (Vitis vinifera) extracts on peroxidation models in vitro. Food Chemistry. Vol. 73, 285-290. [ Links ]
11. Khanna, Savita, Venojarvi, M.; Roy, S.; Sharma, N.; Trikha, P.; Bagchi, D.; Bagchi, M.; Sen, C. 2002. Dermal wound properties of redox-active grape seed proanthocyanidins. Free Radical Biology & Medicine. Vol. 33, N° 8, 1089-1096. [ Links ]
12. King, V. An-Erl; Chia-Fang Liu; Yi-Jing Liu. 2001. Chlorophyll stability in spinach dehydrated by freeze drying and controlled low temperature vacuum dehydration. Food Research International. Vol. 34, 167-175. [ Links ]
13. Kudra, T.; Ratti, C. 2006. Foam-mat drying: Energy and cost analyses. Canadian Biosystems Engineering. Vol 48, 3.27 - 3.32. [ Links ]
14. Lau, D.; King, A. 2003. Pre and post-mortem use of grape seed extract in dark poultry meat to inhibit development of thiobarbituric acid reactive substances. Journal of Agricultural and Food Chemistry. Vol. 51, 1602-1607. [ Links ]
15. Le Bourvellec, C.; Le Quéré, J. M.; Sanoner, P.; Drilleau, J. F.; Guyot, S. 2004. Inhibition of apple polyphenol oxidase activity by procyanidins and polyphenol oxidation products. Journal of Agricultural and Food Chemistry. Vol. 52, 122-130. [ Links ]
16. Llópiz Niurka; Francesc Puiggrós; Ela Céspedes; Lluis Arola; Anna Ardévol, Cinta Bladé; M. Josepa Salvadó. 2004. Antigenotoxic effect of grape seed procyanidins extract in FAO cells submitted to oxidative stress. Journal of Agricultural and Food Chemistry. 52(5): 1083-1087. [ Links ]
17. Lozano de González, P. G.; Barret, D. M.; Wrolstad, R. E.; Durst, R. 1993. Enzymatic browning inhibited in fresh and dried Apple rings by pineapple juice. Journal of Food Science 58(2): 399-404. [ Links ]
18. Medina, I.; Lois, S.; Lizárraga, D.; Pazos, M.; Touriño, S.; Cascante, M.; Torres, J. L. 2006. Functional Fatty fish supplemented with grape procyanidins and proapoptotic properties on Colon cell Lines. Journal of Agricultural and Food Chemistry. Vol.54, 3598-3603. [ Links ]
19. Mielnik, M.; Olsen, E.; Vogt, G.; Adeline, D.; Skrede, G. 2006. Grape seed extract as antioxidant in cooked, cold stored turkey meat. LWT- Food science and technology. Vol. 39, n°3, 191-198. [ Links ]
20. Min Hu, D.; Mc Clements, J.; Decker, E. 2004. Antioxidant activity of a proanthocyanidin - rich extract from grape seed in Whey Protein isolate stabilized algae oil-in-water emulsions. Journal of Agricultural and Food Chemistry. Vol. 52, 5272-5276. [ Links ]
21. Mi Soon Jang; AiKo Sanada; Hideki Ushio; Munchiko Tanaka; Toshiaki Ohshima. 2002. Inhibitory effects of Enokitake mushroom Extracts on Polyphenol oxidase and prevention of apple browning. Lebensm. Wiss. U-technol. Vol. 35, 697-702. [ Links ]
22. Murga, R.; Ruiz, R.; Beltrán, S.; Cabezas, J. 2000. Extraction of natural complex phenols and tannins from grape seeds by using supercritical mixtures of carbon dioxide and alcohol. Journal of Agricultural and Food Chemistry. Vol. 48, 3408-3412. [ Links ]
23. Özoglu, H.; Bayindirli, A. 2002. Inhibition of enzymic browning in cloudy apple juice with selected antibrowning agents. Food Control. Vol. 13, 213-221. [ Links ]
24. Paladino, S. C.; Zuritz, C. A. 2011. Extracto de semillas de vid (Vitis vinifera L.) con actividad antioxidante: eficiencia de diferentes solventes en el proceso de extracción. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza, Argentina. 43(1): 187-199. [ Links ]
25. Palma, M.; Taylor, L. T.1999. Extraction of polyphenolic compounds from grape seeds with near critical carbon dioxide. Journal of Chromatography A, (849), 117-124 [ Links ]
26. Pinent, M.; Bladé, M.; Salvadó, M.; Arola, L.; Ardévol, A. 2005. Metabolic fate of glucose on 3T3-L1 adipocytes treated with grape seed derived procyanidin extract (GSPE). Comparison with the effects of insulin. Journal of Agricultural and Food Chemistry. Vol. 53, 5932-5935. [ Links ]
27. Rzepecka, M. A.; Brygidyr, A. M.; McConnell, M. B. 1976. Foam-mat dehydration of tomato paste using microwave energy. Agric. Eng. 18: 36-40. Canadian Agricultural Engineering, Vol.18, N° 1, 36-40. [ Links ]
28. Rice-Evans, C. A.; Miller, N. J.; Bolwell, P.G.; Bramley, P.; Pridham, J. B. 1995. The relative antioxidant activities of plant-derived polyphenolic flavonoids. Free Radical Research. Vol.22, 375-383. [ Links ]
29. Saito, M.; Hosoyama, H.; Ariga, T.; Kataoka, S.; Yamaji, N. 1998. Antiulcer activity of grape seed extract and procyanidins. Journal of Agricultural and Food Chemistry.Vol.46, 1460-1464. [ Links ]
30. Siddhuraju, Perumal; Becker, K. 2003. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree (Moringa oleifera Lam.) leaves. Journal of Agricultural and Food Chemistry. Vol. 51, 2144 -2156. [ Links ]
31. Singleton, V. L.; Rossi, J. A. 1965. Colorimetry of total phenolics with phosphomolibdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture. Vol.16, 144-158. [ Links ]
32. Verhagen, H.; Arouma, O. I.; van Delft, J. H. M.; Dragsted, L. O.; Ferguson, L. R.; Knasmüller, S.; Pool-Zobel, B. L.; Poulsen, H. E.; Williamson, G.; Yannai, S. 2003.The 10 basic requirements for a scientific paper reporting antioxidant, antimutagenic or anticarcinogenic potential of test substances in in vitro experiments and animal studies in vivo. Food and chemical toxicology 41, 603-610. [ Links ]
33. Yamaguchi, F.; Yoshimura,Y.; Nakazawa, H.; Ariga, T.1999. Free radical scavenging activity of grape seed extract and antioxidants by electron spin resonance spectrometry in an H2O2/Na OH/ DMSO system. Journal of Agricultural and Food Chemistry. Vol.47, 2544-2548. [ Links ]
34. Yen, G. H.; Chen, H. Y. 1995. Antioxidant activity of various tea extracts in relation to their antimutagenicity. Journal of Agricultural and Food Chemistry. Vol.43, 27-32. [ Links ]
35. Yerdeo, A. 2001. Deshidratación de pulpas de pera y membrillo por secado en lecho de espuma. Tesis de grado. Licenciatura en Bromatología. Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 66 p. [ Links ]
36. Yilmaz, Y.; Toledo, R. 2004. Health aspects of functional grape seed constituents. Trends in Food Science & Technology. Vol. 15, 422-433. [ Links ]
37. Zoecklein, B.; Fugelsang, K.; Gump, B.; Nury, F. 1995. Chapter 20: Laboratory Procedures. In: Wine analysis and production. First Edition, Chapman & Hall Ed., New York. United States of America. p. 455-458. [ Links ]














