Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versão On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.45 no.1 Mendoza jan./jun. 2013
Actividad biológica de Lonchocarpus guaricensis Pittier en el control de larvas de Tuta absoluta (Meyrick)
Biological activity of Lonchocarpus guaricensis Pittier in the control of larvae of Tuta absoluta (Meyrick)
Evelyn Cajias A. Héctor Vargas C. Francisca Estefane D. Dante Bobadilla G.
Dpto. de Recursos Ambientales. Facultad de Ciencias Agronómicas. Universidad de Tarapacá. Casilla 6 D. Arica, Chile. dereamb@uta.cl
Originales: Recepción: 16/05/2011 - Aceptación: 07/01/2013
Resumen
La actividad biológica de Lonchocarpus guaricensis Pittier fue evaluada utilizando dos dosis de Tecnona® en el control de larvas de Tuta absoluta (Meyrick), Valle de Azapa, Chile, mediante una pulverización sobre plantas de tomate cv. Naomi en macetas, ubicadas aleatoriamente en un invernáculo dentro de un vivero. Semanas previas a la pulverización, las macetas se infestaron artificialmente con adultos del fitófago para obtener larvas en los foliolos. Los tratamientos evaluados fueron los siguientes: T1 (0,21 g de IA de L. guaricensis·L-1), T2 (0,43 g de IA de L. guaricensis·L-1), T3 (control positivo a base de spinosad 0,048 g de IA·L-1) y T0 (control negativo a base de agua de pozo). De acuerdo con el porcentaje de mortalidad acumulada de larvas contabilizadas a las 24, 48, 120 horas y 9no día post aplicación, no hay diferencias estadísticas entre los tratamientos T0 y T1, a su vez, T2 alcanza una media de 53,05% de mortalidad, no diferenciándose de T3 que logra un 73,9%. Se concluye que la dosis experimental L. guaricensis de 0,43 g de IA∙ L-1 puede constituir una alternativa interesante de utilizar en el Manejo Integrado de Plagas del cultivo de tomate en el Valle de Azapa.
Palabras clave: Extracto botánico; Rotenona; Spinosad; Solanum lycopersicum
Abstract
Biological activity of Lonchocarpus guaricensis Pittier was evaluated using two doses of Tecnona® in the control of larvae of Tuta absoluta (Meyrick), Azapa Valley, Chile, by a spray on potted tomato plants cv. Naomi, randomly placed in a greenhouse within a nursery. Weeks prior to spraying, the pots were artificially infested with adults of phytophagous to obtain larvae in the leaflets. The evaluated treatments were the following ones: T1 (0.21 g AI of L. guaricensis·L-1), T2 (0.43 g AI of L. guaricensis·L-1), T3 (positive control based on spinosad 0.048 g AI·L-1) and T0 (negative control based on well water). According to the cumulative mortality percentage of larvae counted at 24, 48, 120 hours and 9th day post application, there was no statistical differences between T0 and T1 treatments, in turn, T2 reaches an average of 53.05% mortality not differing from T3 that achieves 73.9%. We conclude that the experimental dose of L. guaricensis 0.43 g AI∙L- 1 can be an attractive alternative for use in Integrated Pest Management of the tomato crop in the Azapa Valley.
Keywords: Botanical extract; Rotenone Spinosad; Solanum lycopersicum
Introducción
El agroclima de la Región de Arica y Parinacota, caracterizado por la ausencia de heladas y presencia de altas medias anuales (19°C) (14), no solo permite el cultivo de frutales y hortalizas, sino también el desarrollo permanente de sus fitófagos durante todo el año, constituyéndose en un factor importante en el costo de producción.
El control químico con insecticidas sintéticos (e. g. organofosforados y piretroides) es la técnica actual más empleada para evitar una reducción drástica de la producción (2, 17), pero su uso repetido e inadecuada aplicación puede seleccionar gradualmente poblaciones de insectos resistentes (17), resurgimiento de plagas, riesgos en la salud de las personas y medio ambiente (15). Como opción a los insecticidas de síntesis química, surgen los productos biorracionales, en los que se incluyen los de origen vegetal, siendo piretro, rotenona, neem y aceites esenciales los principales productos botánicos utilizados contra fitófagos en la actualidad (9). Estos metabolitos secundarios, sintetizados por muchas plantas, actúan por contacto y debido a su baja persistencia presentan selectividad hacia organismos no blanco, entre ellos los benéficos (7), siendo potencialmente adecuados para su uso en programas de manejo integrado (15). Entre ellos, la rotenona es un isoflavonoide insoluble en el agua (20), producido en las raíces o rizomas de leguminosas tropicales de los géneros Derris, Lonchocarpus y Tephrosia (5, 9, 16), y cuyo empleo, como insecticida, se expandió hacia cultivos comestibles debido a su baja toxicidad para los animales de sangre caliente, ser inocua para las plantas (13) y sumamente tóxica para ciertos insectos como áfidos, cochinillas, mosquitas blancas, orugas, pequeños escarabajos, y algunos ácaros (5), aunque la literatura muestra resultados variables en relación con el efecto de la rotenona sobre distintas plagas de interés agrícola y médico (12).
En la actualidad, el uso de la rotenona juega un papel vital en la producción de alimentos orgánicos (9, 15), utilizándose solo en California 200 kg de rotenona anualmente en cultivos de lechuga y tomate (9).
El modo de acción, de este veneno estomacal, implica la inhibición de la enzima NADH ubiquinona oxidoreductasa deshidrogenada del Complejo I de la cadena del transporte de electrones a nivel de mitocondrias, bloqueando la fosforilación del ADP a ATP a partir de la oxidación del NADH, por lo tanto corresponde a un inhibidor metabólico de la cadena respiratoria del insecto (3, 15, 16), cuyos efectos son la disminución del consumo de oxígeno, ataxia, convulsiones, parálisis y muerte del insecto por paro respiratorio (11).
La mayoría de la rotenona utilizada en la actualidad proviene de Lonchocarpus, género conocido como cubé y que cuenta con 67 especies descritas (10), cultivadas en Venezuela y Perú (9). Las raíces contienen un 8-13% de rotenona o rotenoides (4) y, entre ellos, Lonchocarpus guaricensis Pittier, 1928 se comercializa como Tecnona®, siendo un producto certificado por Ecocert-Sch para uso en agricultura orgánica conforme al anexo II del Reglamento (CEE) n° 2092/91 (18). La composición (p/p) de este producto es la siguiente: 6,6% de extracto de L. guaricensis; 4,4% de nitrógeno total y 74% de materia orgánica total.
El presente estudio tuvo como objetivo evaluar la actividad biológica de dos dosis de L. guaricensis (Tecnona®) en el control de larvas de la polilla del tomate, Tuta absoluta (Meyrick, 1917) (Lepidoptera: Gelechiidae) en plantas de tomate en macetas, infestadas artificialmente con adultos del fitófago. El uso de bioinsecticidas se muestra como una alternativa interesante de utilizar en el Manejo Integrado de Plagas y se espera que la aplicación de los resultados contribuya a mejorar la sustentabilidad de la agricultura en el Valle de Azapa. Por esta razón, es importante cuantificar la actividad biológica de bioinsecticidas, en el tiempo, frente a opciones de control utilizadas comercialmente, además de contrastarla respecto de un control negativo (sin aplicación de insecticidas).
Materiales y métodos
El ensayo en larvas de T. absoluta se realizó en los laboratorios de la Facultad de Ciencias Agronómicas de la Universidad de Tarapacá, ubicada en el km 12 del Valle de Azapa a 250 m s. n. m., coordenadas 18°31'14,26"S, 70°10'42,79"W, en la provincia de Arica, Región de Arica y Parinacota, Chile, mayo y octubre del 2006, bajo condiciones climáticas normales para una zona subtropical (tabla 1).
Tabla 1. Temperatura (máxima y mínima) y humedad relativa, registradas durante el período del ensayo.
Table 1. Temperature (maxim and minim) and relative humidity registered during the period of the assay.

Como material experimental se utilizaron veinte plantas de tomate cv. Naomi en macetas con turba y perlita, que fueron ubicadas y entutoradas sobre una estructura de metal de dimensiones 1,4 m de ancho, 1,10 m de alto y 3,3 m de largo, habilitada como invernadero tipo túnel, cubierto con tela tull y cinta velcro en sus costados para hermetizar. Esta estructura se ubicó dentro de un vivero, posteriormente las plantas fueron infestadas artificialmente con polillas de T. absoluta, obtenidas de una colecta de larvas, realizado entre el 31 de agosto y 04 de septiembre del 2006, en un cultivo de tomate sin aplicación de plaguicidas. La liberación de adultos se efectuó la primera semana de octubre, dejando en libertad aproximadamente veinticinco parejas de polillas.
El diseño experimental fue completamente aleatorizado con cuatro tratamientos (tabla 2) y cinco repeticiones: cada tamaño muestreal estuvo compuesto por un número variable de foliolos con larvas vivas (entre 7 y 19).
Tabla 2. Características de los tratamientos en la evaluación.
Table 2. Characteristics of the treatments in the evaluation.

Para la variable de L. guaricensis se evaluaron dos dosis: una recomendada por el fabricante (3 cc∙L-1: 0,21 g de IA·L-1) y una experimental (6 cc∙L-1: 0,43 g de IA·L-1).
La pulverización de los tratamientos se realizó transcurridos 21 días después de la liberación de los adultos de T. absoluta, al observarse un promedio de 15 galerías por repetición. Para la aplicación se utilizó un pulverizador de plástico manual Eva® de 1,8 L, con boquilla estándar y palanca de presión, asperjando completamente tanto el haz como el envés de la hoja, ocupando un volumen de 1,5 L por tratamiento mediante gota fina.
Previo a la aplicación curativa, el pH del agua (valor 6,97) se corrigió, antes de añadir cada tratamiento a excepción del control negativo, mediante la adición de Indicate®, un buffer y surfactante con indicador de pH, compuesto por ácido ortofosfórico (25%) y alquilfenoletoxilato (35%), el cual se utiliza para acidificar aguas alcalinas (1). Una vez obtenida la coloración rosa del agua (pH 4,5-5,5 adecuado para la mayoría de los insecticidas) se extrajo con una pipeta la dosis según cada tratamiento y se agregó al agua con su pH corregido, la formulación comercial se mezcló y se aplicó sobre las plantas tratando de asperjar completamente cada repetición. Las aplicaciones se realizaron fuera del invernadero tipo túnel ubicando las macetas dentro de esta, transcurrida la pulverización. A las 24 horas de aplicados los tratamientos, se colectaron entre 7-19 muestras de foliolos dañados por unidad experimental, siendo colocadas en placas Petri para sus posteriores evaluaciones. El parámetro medido correspondió al porcentaje de mortalidad acumulada, evaluándose el número de larvas muertas de cada unidad experimental a las 24, 48, 120 horas y al noveno día post aplicación de los tratamientos insecticidas.
Para el estudio estadístico se realizó el análisis de medidas repetidas (α = 0,05) con un factor entre sujetos (tratamientos) y un factor intra sujetos (tiempo), siendo el porcentaje de mortalidad acumulado la variable de respuesta. Para determinar diferencias estadísticas entre tratamientos se realizó la Prueba de Rango Múltiple de Duncan con un nivel de confianza del 95%.
Resultados y discusión
Los resultados de mortalidad acumulada de larvas de T. absoluta a las 24, 48, 120 horas y 9no día, por tratamiento y repetición, se presentan en la tabla 3.
Tabla 3. Mortalidad acumulada de larvas de T. absoluta en el ensayo.
Table 3. Cumulative mortality of T. absoluta larvae in the assay.
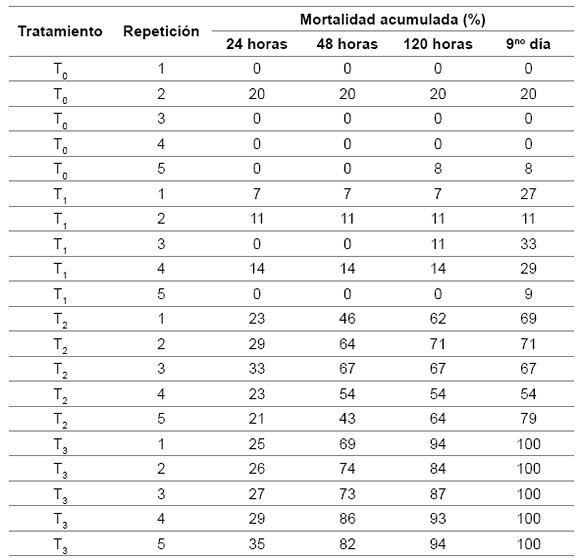
Al realizar la prueba de contrastes intrasujetos (α = 0,05), se aprecian diferencias altamente significativas a nivel de porcentaje de mortalidad acumulada de larvas de T. absoluta y tiempo (F = 155,438; P = 0,000). Para efectos de la interacción tratamientos∙tiempo (F = 41,282; P = 0,000) puede afirmarse que la influencia de los diferentes tiempos no es homogénea en los tratamientos. Respecto de la homogeneidad de varianzas, la Prueba de Levene arrojó heterogeneidad significativa (P < 0,05) solo en el recuento del 9no día, pero dado que los tamaños de los grupos no son desproporcionados, pueden considerarse relativamente iguales.
Para efectos de tipo entre sujetos (α = 0,05), existen diferencias significativas en el porcentaje de mortalidad acumulada en función de los tratamientos (F = 152,228; P = 0,000). Asimismo, las medias marginales estimadas para la interacción tratamientos∙tiempo se detallan en la tabla 4.
Tabla 4. Medias marginales estimadas de medidas para tratamientos de T. absoluta en el ensayo.
Table 4. Estimated marginal means of treatment measures of T. absoluta in the assay.

Realizada la Prueba de Rangos Múltiples de Duncan (P < 0,05), se observa que el mayor promedio de mortalidad acumulada de larvas de T. absoluta se obtiene con el tratamiento T3 (control positivo a base de spinosad 0,048 g de IA·L-1) con 73,9%, seguido de T2 (L. guaricencis 0,43 g de IA·L-1) con 53,05%. Los tratamientos T1 (L. guaricencis 0,21 g de IA·L-1) y T0 (control negativo) no difieren estadísticamente con promedios de 10,80 y 4,80% respectivamente (tabla 5).
Tabla 5. Prueba de Rango Múltiple de Duncan de medidas repetidas para mortalidad acumulada de larvas de T. absoluta.
Table 5. Multiple Range Test Duncan repeated measures for cumulative mortality of larvae of T. absolute.

Si bien no hay referencias sobre estudios que evalúan la actividad biológica del género Lonchocarpus en T. absoluta, existen evaluaciones realizadas por Mariños et al. (12) de la eficacia de polvo de raíz de Lonchocarpus utilis (Smith, 1930) para controlar larvas de tercer y cuarto estado de Anopheles benarrochi (Gabaldón, 1941) (Diptera: Culicidae), vector primario de la malaria, quienes obtuvieron que a las 12 horas postratamiento, las dosis de 6,25 y 3,1 g∙L-1 mostraran 98 y 89% de eficacia, mientras que a las 24 horas la mortalidad alcanzó el 99 y 94% respectivamente. Estos resultados evidencian que uno de los mejores roles del uso de botánicos se relaciona con la salud pública y uso doméstico (9).
Para T. absoluta y otras especies del orden Lepidoptera, mayores estudios se han realizado evaluando la eficacia de la rotenona, principal ingrediente activo de Lonchocarpus. Iannacone y Murrugarra (6) determinaron que los extractos botánicos de neem (16 mg/L y 28 mg/L), rotenona (640 mg/L y 960 mg/L) y químicos convencionales no presentaron diferencias estadísticas en el número de huevos y larvas de T. absoluta en un cultivo de tomate cv. Heinz 3302 en el Valle de Ica, Perú. Estos resultados no concuerdan con los obtenidos en el presente estudio, a excepción de la dosis empírica (T2) que logró diferenciarse del control negativo y puede constituir una alternativa de control frente a insecticidas convencionales de amplio espectro; o un potencial uso en agricultura orgánica, cuyo crecimiento se estima en un 8 a 15% anual en Europa y Norteamérica; o como un insecticida botánico que se puede incluir en programas de rotaciones de productos en un cultivo, especialmente en fitófagos que documentan presentar resistencias, e. g. Polilla del dorso de diamante, Plutella xylostella (L., 1758) (Lepidoptera: Plutellidae), debido al uso excesivo de Bacillus thuringiensis y spinosad (9)
Evaluaciones realizadas por Iannacone y Lamas (7) en otra especie de Gelechiidae, señalaron que la mortalidad de larvas de primer estado de la Polilla de la Papa, Phthorimaea operculella (Zeller, 1873) (Lepidoptera: Gelechiidae), se expresó en un 92,5 y 97,5% para las concentraciones de 400 mg (IA) L-1 y 800 mg (IA) L-1 de rotenona respectivamente, sin diferenciarse de la azadirachtina desde 8 mg (IA) L-1, por el cartap a 1250 mg (IA) L-1 y por tres extractos de lantana, Lantana camara L. (Verbenaceae) y de molle, Schinus molle L. (Anacardiaceae).
Por otra parte, la eficacia de extractos botánicos sobre otras especies de lepidópteros no presenta efectos similares. Valles & Capinera (19) obtuvieron que diferentes concentraciones de rotenona y un control positivo a base de jabón tuvieran pocos efectos en la mortalidad de larvas de Spodoptera eridania (Cramer, 1782) (Lepidoptera: Noctuidae) en bioensayos de laboratorio, diferenciándose de otros insecticidas botánicos como ryania, sabadilla y piretrina; esta última presentó la mayor eficacia en evaluaciones en campo. Sin embargo, Iannacone y Alvariño (8) no encontraron diferencias estadísticas en la eficacia de extractos botánicos de rotenona, azadirachtina e insecticidas convencionales sobre larvas de S. eridania en nueve evaluaciones que abarcaron desarrollo vegetativo, floración y fructificación en cultivo de tomate en Ica, Perú.
Conclusiones
Para efecto del presente ensayo, la actividad biológica de L. guaricensis (Tecnona®) sobre larvas de T. absoluta varía de acuerdo con la dosis de aplicación. La dosis experimental (T2) presentó mayor porcentaje de mortalidad acumulada de larvas en la evaluación, diferenciándose estadísticamente del control negativo (T0) y la dosis recomendada (T1). Esta última no es efectiva en controlar larvas de T. absoluta.
El control positivo, a base de spinosad, demostró ser muy eficaz en el control de larvas de T. absoluta, diferenciándose del resto de los tratamientos.
Se concluye que, bajo las condiciones experimentales del ensayo, la dosis experimental L. guaricensis de 0,43 g de IA∙L-1 puede constituir una alternativa interesante de utilizar en el Manejo Integrado de Plagas del cultivo de tomate en el Valle de Azapa, e inclusive en programas de agricultura orgánica.
Agradecimientos
A los Sres. Jorge Acevedo y Ricardo Mendoza M., funcionarios de la Universidad de Tarapacá, por su colaboración en las actividades de terreno.
Al Sr. Avelino García L., Ing. Agrónomo de la Universidad Nacional de Jorge Basadre Grohmann de Tacna, Perú, por su colaboración en el análisis estadístico.
1. AFIPA. 2006. Manual fitosanitario 2006-2007. Asociación Nacional de Fabricantes e Importadores de Productos Fitosanitarios Agrícolas (AFIPA), Santiago, Chile. 1160 p. [ Links ]
2. Apablaza, J.; Urra, F. 2010. Introducción a la Entomología General y Agrícola. 4ta ed. Ediciones Universidad Católica de Chile. 401 p. [ Links ]
3. Casida, J. E.; Quistad, G. B. 1998. Golden Age of Insecticide Research: Past, present, or future? Ann. Rev. Entomol. 43: 1-16.
4. Cisneros, F. 1995. Control de plagas agrícolas. http://www.avocadosource.com/books/ CisnerosFausto1995/CPA_2_PG_11-62.pdf. Fecha de consulta: 24 de octubre de 2007.
5. Gomero, L. 1991. Agroquímicos: Problema Nacional, Políticas y Alternativas. Instituto de Desarrollo y Medioambiente (IDMA). J. R. Ediciones. 367 p.
6. Iannacone, J.; Murrugarra, Y. 2002. Efecto del neem y rotenona en las poblaciones de Tuta absoluta (Meyrick) (Lepidoptera: Gelechiidae) y en dos especies de áfidos (Homoptera: Aphididae) en el cultivo de tomate en Ica, Perú. Folia Entomol. Mex. 41: 119-128.
7. Iannacone, J.; Lamas, G. 2003. Efecto insecticida de cuatro extractos botánicos y del cartap sobre la polilla de la papa Phthorimaea operculella (Zeller) (Lepidoptera: Gelechiidae), en el Perú. Entomotrópica. 18(2): 95-105.
8. Iannacone, J.; Alvariño, L. 2003. Efecto de la azadiractina y rotenona en las poblaciones del gusano ejército, Spodoptera eridania (Cramer) (Lepidoptera, Noctuidae), en el cultivo de tomate en Ica, Perú. Rev. Per. Ent. 43: 113-119.
9. Isman, M. 2006. Botanical insecticides, deterrents, and repellents inmodern agriculture and an increasingly regulated world. Annu. Rev. Entomol. 51: 45-66.
10. León, J. 1987. Botánica de los cultivos tropicales. San José, Costa Rica. Editorial IICA. 445 p.
11. Maggi, M. E. 2004. Insecticidas Naturales. http://www.monografias.com/trabajos18/insecticidasnaturales/ insecticidas-naturales.shtml. Fecha de consulta: 20 de julio de 2006.
12. Mariños, C.; Castro, J.; Nongrados, D. 2004. Efecto biocida del "barbasco" Lonchocarpus utilis (Smith,1930) como regulador de larvas de mosquitos. Rev. Per. Biol. 11(1-2): 87-94.
13. Metcalf, C.; Flint, W. 1962. Destructive and Useful Insects: Their Habits and Control. New York. Ed. Mc Graw-Hill. 1087 p.
14. Novoa, R.; Villaseca, S. 1989. Mapa Agroclimático de Chile. Instituto de Investigaciones Agropecuarias (INIA). Santiago, Chile. Ministerio de Agricultura. 54 p.
15. Rattan, R. 2010. Mechanism of action of insecticidal secondary metabolites of plant origin. Crop Protection 29: 913-920.
16. Romoser, W.; Stoffolano J. 1998. 4th Edition. The Science of Entomology. University of Massachusetts. 624 p.
17. Salazar, E.; Araya, J. 2001. Respuesta de la Polilla del Tomate, Tuta absoluta (Meyrick), a insecticidas en Arica, Chile. Agricultura Técnica (Chile). 61(4): 429-435.
18. Terralia. 2012. Tecnona®. http://www.terralia.com/agroquimicos_de_mexico/index.php?proceso=regi stro&numero=6417&id_marca=2013&base=2012. Fecha de consulta: 27 de Julio, 2012.
19. Valles, S.; Capinera, J. 1993. Response of larvae of the southern armyworm, Spodoptera eridania (Cramer) (Lepidoptera: Noctuidae), to select botanical insecticides and soap. J. Agric. Entomol., 10: 145-153.
20. Wiswesser, W. 1976. Pesticide Index. 5th Edition. Editorial Advisors. 328 p.














