Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versión On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.45 no.1 Mendoza ene./jun. 2013
Caracterización de tres suelos en Hidalgo y Querétaro, México: disponibilidad y daño tóxico por arsénico en garbanzo (Cicer arietinum L.)
Characterization of three soils in Hidalgo and Queretaro, Mexico: availability and toxic damage by arsenic in chickpea (Cicer arietinum L.)
Miguel Ángel Rico-Rodríguez 1 Elena María Otazo-Sánchez 2 Francisco Prieto-García 2 Otilio Arturo Acevedo-Sandoval 3 Alma Delia Román-Gutiérrez 2
1 Centro de Estudios Académicos sobre Contaminación Ambiental. Universidad Autónoma de Querétaro. Cerro de las Campanas s/n, Querétaro, Qro. México.
2 Área Académica de Química. Universidad Autónoma del Estado de Hidalgo. Carretera Pachuca- Tulancingo km 4,5. C. P. 42076. Pachuca, Hidalgo. México. prietog@uaeh.edu.mx
3 Instituto de Ciencias Agropecuarias. Universidad Autónoma del Estado de Hidalgo. Rancho Universitario. Ex-Hda. de Aquetzalpa AP 32. C. P. 43600. Tulancingo, Hidalgo, México.
Originales: Recepción: 10/03/2012 - Aceptación: 10/05/2013
Resumen
La presencia de arsénico (As) en suelos permite su migración hacia cultivos como el garbanzo (Cicer arietinum L.). En este trabajo se comparan contenidos de As en tres suelos de dos estados de la República Mexicana, y su acumulación en C. arietinum L. Los suelos resultaron moderadamente alcalinos, no salinos, reductores intermedios y con potenciales zeta (pZ) que indican suspensiones coloidales moderadamente estables. Con moderados contenidos de humedad y texturas franco- arcillosas, densidad aparente, capacidad de campo, agregados estables y capacidad de intercambio catiónico, significativamente diferentes y semejantes en velocidad de infiltración y espesor del horizonte A. En materia orgánica, carbono y nitrógeno son significativamente diferentes y con bajos contenidos. Existen diferencias importantes entre semillas de C. arietinum L. certificadas o no en su capacidad de germinación y desarrollo de raíces. El efecto genotóxico del As en raíces de C. arietinum L. se apreció por inducción de micronúcleos, reducción de 2,8 veces la división celular de muestras tratadas con agua con As, respecto de muestras control. Se apreció incremento de As de 9,5 veces en plántulas germinadas en suelo de El Salitre, que en suelo de Bella Vista, indicativo de migración del As. La suma de efectos de concentración de As en suelos y agua se incrementa 15,3 veces. Entre suelos de Bella Vista y Querétaro la correlación fue 2,9 veces mayor. En controles positivos los IBAs resultan 3 veces mayores que en las pruebas experimentales.
Palabras clave: Bioacumulación; Suelo; Arsénico; Citotoxicidad; Micronúcleo
Abstract
The presence of arsenic (As) in soils allows migration to crops like chickpea (Cicer arietinum L.). In this paper we compare contents of As in three soils of two states of the Mexican Republic, and its accumulation in C. arietinum L. The soils were moderately alkaline, non-saline, intermediate gearboxes and zeta potential (pZ) indicating moderately stable colloidal suspensions. With moderate moisture content and clay-loam textures, bulk density, field capacity, stable aggregates and cation exchange capacity, significantly different and similar infiltration rate and thickness of horizon A. Organic matter, carbon and nitrogen are significantly different and low content. There are important differences between seeds of C. arietinum L. certified or not in their ability to germinate and root development. The genotoxic effects of As in roots of C. arietinum L. appreciated by induction of micronucleus, 2.8- fold reduction of cell division in water samples treated with As, regarding control samples. As was observed increase of 9.5 times in seedlings germinated in soil El Salitre, that in Bella Vista soil, indicative of migration As. The sum effect of concentration of As in soil and water is increased 15.3 times. Among soils Bella Vista and Querétaro, the correlation was 2.9 times greater. In positive controls the IBAs are three times higher than in the experimental tests.
Keywords: Bioaccumulation; Soil; Arsenic; Cytotoxicity; Micronucleus
Introducción
México cuenta con una amplia riqueza de minerales en todo el territorio nacional, tanto minerales metálicos como no metálicos, presentándose una gran problemática por las actividades mineras, esto debido al desinterés de las compañías en ofrecer un confinamiento adecuado de sus residuos (jales de minería) los cuales son generados durante los procesos de recuperación de metales. Algunos estudios mencionan que los jales mineros pueden contener zinc, cobre, plomo, cadmio, selenio y arsénico (18, 22) en cantidades importantes. Este material particulado puede ser dispersado con facilidad por el viento y escorrentías pluviales, permitiendo la contaminación de los mantos acuíferos; así mismo las plantas cultivadas de la región llegan a acumular en sus tejidos algunos metales (2, 15). La necesidad de estudiar la presencia de metales pesados en el suelo radica en su impacto como indicador de contaminación ambiental; sus resultados permiten reflejar el potencial indicativo del suelo en la evaluación de la calidad ambiental (3).
Es así que estos metales pueden entrar a la cadena alimentaria; por ello, es necesaria su determinación en los niveles de biodisponibilidad como contaminantes
en los que se encuentren. La acción tóxica de estos contaminantes se manifiesta de forma diversa. En general, participan en procesos metabólicos vitales, provocando daños en cualquier eslabón de la cadena alimenticia (20). El arsénico (As) es un metaloide con propiedades tóxicas, que se encuentra en el ambiente (10). En forma natural se presenta como arseniuros de cobre, hierro y níquel, entre otros. El As en el suelo, cuando prevalecen condiciones aerobias, se encuentra como ion arsenato As(V) y es la especie más estable, mientras que el arsenito As(III) -que es la forma más tóxica-, predomina en condiciones anaerobias (25). Puede aparecer en forma orgánica e inorgánica en sus diferentes estados de oxidación -3, 0; +3 y +5 (24). El As, tanto orgánico como inorgánico, es tóxico para la salud humana y persiste en el ambiente como resultado de contaminación natural y antrópica (21, 36). Los contenidos de As natural en los suelos pueden provocar problemas de migración de este hacia cultivos como el garbanzo (Cicer arietinum L.) y su entrada en la cadena trófica.
En este trabajo, el objetivo fue caracterizar suelos de tres sitios de dos estados de la República Mexicana, comparar la presencia de As en los mismos y su acumulación en raíces de garbanzo (Cicer arietinum L.); así mismo, realizar estimaciones de los índices de Bioacumulación (IBAs) en órganos de las plantas cultivadas en los tres suelos en estudio. De los tres suelos, uno presenta antecedentes de presencia As (localidad El Salitre, municipio Zimapán, estado de Hidalgo) y los otros dos, sin estudios previos (municipios Bella Vista del Río, y Querétaro, ambos del estado de Querétaro) (figura 1, pág. 228). El suelo, de la comunidad de El Salitre, se encuentra afectado por presencia de As de manera natural y también el agua de consumo (28, 30).
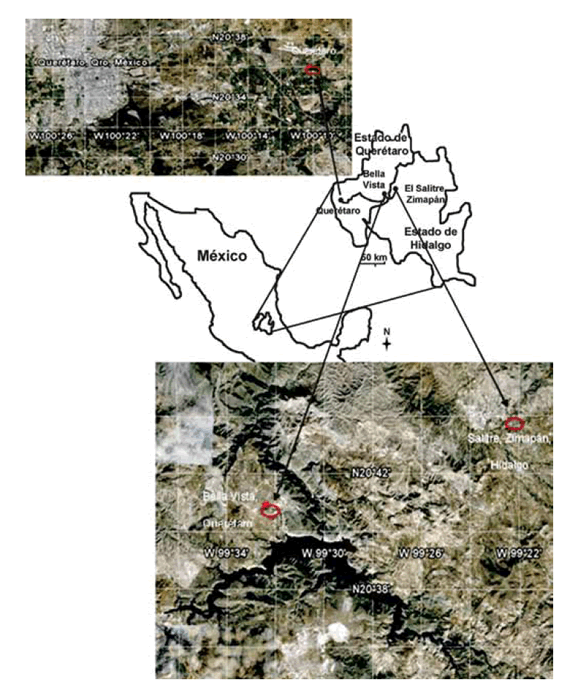
Figura 1. Localización de los puntos de muestreo. Bella Vista 20°40'35" N y 99°32'16" O; El Salitre 20°44'51" N y 99°22'15" O y Querétaro 20°35'52" N y 100°10'33" O.
Figure 1. Location of the sampling points. Bella Vista 20°40' 35" N and 99°32'16" W; El Salitre 20°44'51" N and 99°22'15" W and Queretaro 20°35'52" N and 100°10'33" W.
Los valores rebasan, para esta agua de pozo, los límites máximos establecidos por la NOM-127-SSA (24) (0,01mgL-1). Los contenidos de As natural en sus suelos resultan evidentes, debido a la presencia de minerales tales como arsenopirita, FeAsS o FeS2. FeAs2; Rejalgar, As2S2; Oropimento, As2S3; Loellingita, FeAs2 y Tennantita, Cu12As4S13, entre otros (26). El segundo sitio, Bella Vista (Querétaro), a una distancia de Zimapán de 20 km, no tiene antecedentes de As pero es de suma importancia debido a la cercanía a manantiales que abastecerán de agua la ciudad de Querétaro. El tercer sitio se encuentra a una distancia de 100 km de Zimapán y posee un suelo con características propicias para la agricultura con riego extensivo.
Materiales y métodos
Se tomaron muestras de suelo en las parcelas de los tres sitios, ubicados en zonas áridas de los estados de Querétaro e Hidalgo: El Salitre, ubicado dentro del distrito minero de Zimapán, a una altitud de 1.780 m s. n. m. en 20°44' N y 99°23' O; Bella Vista del Río, que se localiza a 20 km de El Salitre, entre el límite de los Estados de Hidalgo y Querétaro, a una altitud de 1.890 m s. n. m. en 20°68' N y 99°57' O, con un clima semidesértico, una precipitación pluvial de 390 mm anual y temperatura promedio de 20°C. Como sitio control negativo, suelo de una parcela con actividad agrícola cercano al municipio de Querétaro (figura 1, pág. 228), a unos 100 km al oeste de Bella Vista, a una altitud de 1.800 m s. n. m. en 20°35' N y 100°10' O y una precipitación pluvial de 555 mm anual y temperatura promedio de 20,5°C.
Los muestreos se realizaron en cada parcela (dos por cada sitio) en forma de zig-zag en cada uno de los tres lugares de estudio y a una profundidad de 30 cm (figura 2, pág. 229); se mezclaron, homogenizaron y se utilizó el método de cuarteo (22) por parcela. El tamaño de la muestra de suelo "n" de cada sitio se calculó a partir de la expresión (17):

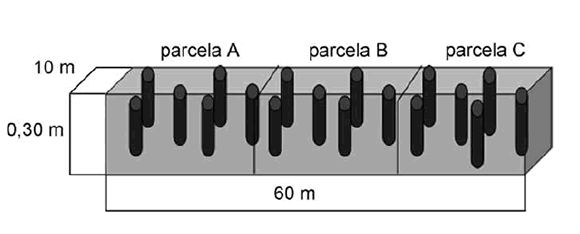
Figura 2. Representación esquemática del sitio de muestreo de suelos de Zimapán y Bella Vista del Río, con sus respectivos puntos de recolección de los mismos.
Figure 2. Schematic representation of site soil sampling Zimapán and Bella Vista Zimapán River with their respective collection points thereof.
Considerando una superficie total de 60 m de largo, 10 m de ancho (600 m2) de tres parcelas de cada zona y a 0,30 m de profundidad, la muestra a tomar en cada sitio fue aleatoria y de una población N de 180 m3.
Se consideró una densidad del suelo de 1,23 g.cm-3 (1.23 T.m-3), de esta manera se obtuvo una masa de población de suelo de 221,4 kg.
En las muestras de suelo se determinó pH, conductividad eléctrica (CE), potencial redox (Eh) y potencial Zeta (pZ), a partir del extracto acuoso, según indica la Norma Oficial Mexicana (21).
Así mismo, contenidos de humedad, textura, materia orgánica (MO, por el método K2Cr2O7 en medio de H2SO4), nitrógeno total (método Kjeldahl) y contenido de arsénico según técnicas reportadas (7, 22, 23).
También fueron caracterizados en cuanto a densidad real y aparente, porcentajes de humedad a capacidad de campo (CC), agregados estables, saturación de bases, velocidad de infiltración y de espesor del horizonte A (5, 6, 17, 30).
Posteriormente, muestras de suelos de los tres sitios de estudios se colocaron en macetas (1,5 kg en cada maceta), se realizaron cinco réplicas y un control positivo (suelo intencionalmente contaminado con solución de iones arseniatos).
En cada maceta se sembraron cinco semillas de garbanzo var. Kabuli Noroeste (semillas certificadas y suministradas por el Instituto Nacional de Investigaciones Forestales y Agropecuarias, INIFAP-Celaya, Guanajuato) y fueron irrigadas con agua de cada sitio, tres riegos de 500 ml por mes durante todo el ciclo (figura 3, pág. 230).
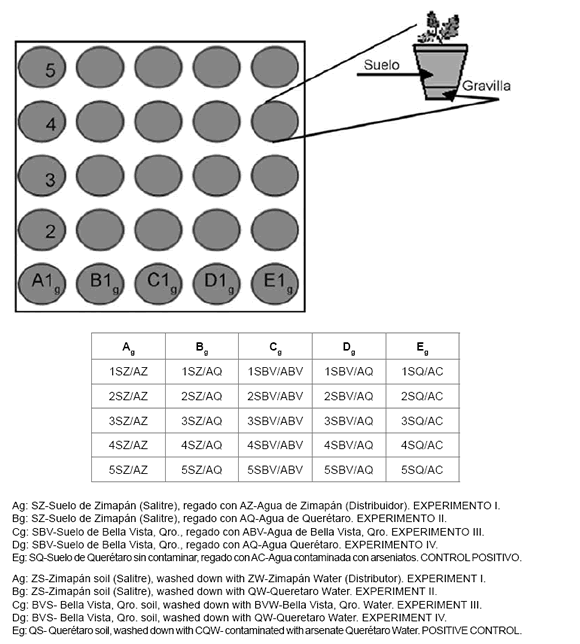
Figura 3. Esquema representativo del estudio de bioacumulación de arsénico en macetas para cultivos de garbanzo.
Figure 3. Scheme representing the study of bioaccumulation of arsenic in pots for chickpea crops.
Las aguas se analizaron según la NOM-127-SSA1 (24) para determinar la concentración de As, y mediciones de pH, conductividad eléctrica (CE) y potencial redox (Eh).
Para cada experimento se obtuvo un lixiviado adicionándole 5 ml de ácido nítrico concentrado grado reactivo (Baker) para conservar la muestra y medir el contenido de As. Se colectó la primera etapa de crecimiento y desarrollo del garbanzo a los 21 días, que consistió en la plúmula y primeras raíces, lavándose con abundante agua. Se colocaron sobre un papel dentro de un horno Felisa para el secado durante 72 horas a 65-75°C. Se realizó una digestión en un equipo de microondas Mars-X, las muestras fueron filtradas y aforadas a 50 mL con agua desionizada. Para la lectura de As se utilizó un espectrofotómetro de Absorción Atómica Perkin Elmer con la técnica de generador de Hidruros (8, 27).
Con la finalidad de evaluar la potencialidad de las semillas de garbanzo (Cicer arietinum L.), para los efectos de siembra se estudió la capacidad de germinación de semillas de garbanzo suministradas por el INIFAP de Celaya, Guanajuato, consideradas como certificadas, y semillas no certificadas y de grado comercial con un promedio de n = 20 semillas. Para ello se pusieron a remojar semillas por 24 horas, colocadas sobre una cama de algodón humedecida con agua destilada, sobre una charola en condiciones de temperatura (25°C) y oscuridad. Se realizó el conteo de semillas germinadas cada día y la medición de la longitud de la radícula durante seis días. Se efectuaron cinco réplicas de esta experiencia.
Se realizó, además, una evaluación preliminar del probable daño genotóxico en células de la raíz meristemática de garbanzo por presencia de arsénico, utilizando la metodología empleada para Vicia faba (haba) (15). Se hicieron germinar en cama de algodón humedecido a 25°C como se indicó anteriormente y al décimo día, con un tamaño aproximado de 5-6 mm, se cortaron 2 mm del meristemo apical y se fijaron en una solución de etanol: ácido acético (3:1). Se procedió a la tinción, colocando los meristemos apicales en etanol 70% (v/v) durante 15 minutos para deshidratar las células de la raíz y facilitar que penetrara mejor el HCl durante la hidrólisis, la cual fue realizada con HCl 5M durante 30 minutos.
Para eliminar el exceso de HCl y poder teñir las células, se decantó el HCl y se lavó 3 veces con agua destilada. La tinción se realizó con aceto-orceína por 40 minutos y se agregó a los meristemos ácido acético al 45% (v/v) con la finalidad de eliminar el exceso de colorante. El aplastamiento en monocapa se realizó luego de la tinción para lo cual se colocó un cubreobjetos y se presionó ligeramente; esto permite que quede una capa uniforme de células, lo que posibilita una mejor observación al microscopio (36).
Para discriminar entre un efecto genotóxico o citotóxico que encubre la capacidad mutagénica del As, se evaluó el índice mitótico, que se obtuvo dividiendo el número de células en división entre el total de células observadas y sacando una frecuencia por cada mil células observadas, evaluándose a través de la prueba de X2 (32, 37).
La cantidad de arsénico bioacumulado en la primera etapa del desarrollo del garbanzo (Cicer arietinum L.) sembrado en macetas, se realizó calculando el índice de bioacumulación de As (IBAs), según lo propuesto por Prieto-García et al. (32), utilizando la expresión:
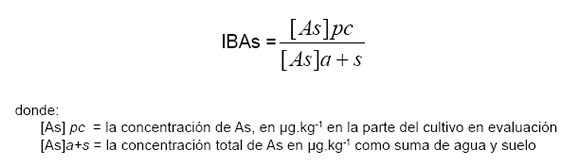
Los resultados fueron procesados estadísticamente sobre la base de cálculos de medias y desviaciones estándar (37). Así mismo se realizó prueba de Tukey, para medir diferencias de los valores de la medias de grupos, en términos de la varianza intragrupal. Se utilizó el programa estadístico SPSS, versión 11 (25). Se utilizó el test Chi-cuadrado para analizar las asociaciones entre variables. Se considero significación estadística para p < 0,05.
Resultados y discusión
Caracterización de los tres suelos
Las características como pH, potencial redox (Eh), conductividad eléctrica (CE) y potencial Zeta (pZ) de los suelos analizados mostraron algunas diferencias entre las tres regiones estudiadas. Los valores de pH de los suelos en estudio permiten clasificarlos como neutros (6, 22) para los suelos de Querétaro y como moderadamente alcalinos para los suelos de Bella Vista y de El Salitre. En la tabla 1 se muestran estos resultados.
Tabla 1. Resultados promedio de pH, CE, Eh, pZ y humedad en los suelos de las tres regiones en estudio. Entre paréntesis la desviación estándar.
Table 1. Average results of pH, EC, Eh, pZ and moisture in the soils of the three regions under study. In brackets the standard deviation.
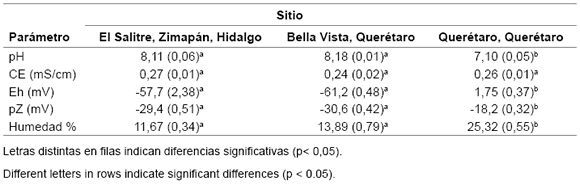
Estos valores de pH son característicos de zonas semiáridas. Valores extremos de pH alcalinos pueden provocar precipitación de ciertos nutrientes, los que permanecen en los suelos en forma no asimilable para las plantas.
También se puede modificar significativamente el pH del suelo mediante el riego, drenaje, uso de pesticidas y fertilizantes. El pH de 8,5 o mayores indica casi siempre 15% o más de sodio intercambiable y la presencia de carbonatos de metales alcalino- térreos (11).
Los valores de la CE señalan que los tres suelos presentan características similares (0,24-0,27 mS/cm) y clasifican como suelos con efectos despreciables de salinidad (6). Según los potenciales redox (Eh) clasifican como reductores intermedios; sin embargo, entre los suelos de Bella Vista, Querétaro y de El Salitre en Hidalgo, no hay diferencias significativas en este parámetro y sí con el suelo de Querétaro.
Los valores de potencial redox (Eh), que definen el carácter oxidante o reductor asociado a los suelos, indican que los suelos evaluados resultaron ser poco reductores. De forma similar los valores de potencial zeta (pZ) en los extractos de saturación los muestran como suelos que presentan suspensiones coloidales de partículas moderadamente estables (entre -15 y -30 mV) (19); estos resultados y criterios de clasificación se reportan por vez primera para estos suelos.
Los suelos de Querétaro son los que presentan suspensiones coloidales de menor estabilidad relativa. La estabilidad del suelo sirve también como un indicador cualitativo de la actividad biológica, flujo de energía, y desarrollo del ciclo de nutrientes.
La agregación de las partículas del suelo debe ser constantemente renovada por los procesos biológicos (37). Los suelos de Querétaro (pH = 7,10) mostraron el valor más bajo de pZ (-18,2 mV); es oportuno indicar que valores < 30 mV indican una elevada estabilidad en las fracciones coloidales en la fase líquida de los suelos (19). En relación con esto cabe señalar que el suelo de Bella Vista, Querétaro y el suelo de El Salitre en Zimapán, Hidalgo, son suelos de elevada estabilidad en sus fracciones coloidales formadas por micelas negativas de materia orgánica.
Los contenidos de humedad de todos los suelos resultaron ser de moderados (Bella Vista y El Salitre) a altos (Querétaro), lo cual se debe corresponder a suelos con contenidos en arcillas de alrededor de 60% por cuanto sus capacidades para retener el agua (CRA) son moderadas.
En la tabla 2 (pág. 234) se aprecian los resultados de texturas. No se observan diferencias significativas entre las texturas de los suelos de Querétaro y Bella Vista que resultan ser franco-arcillosos según NOM-021-SEMARNAT-2000 (23).
Tabla 2. Resultados promedio de las texturas de los suelos en estudio. Entre paréntesis la desviación estándar.
Table 2. Average results of the texture of the soil under study. In brackets the standard deviation.

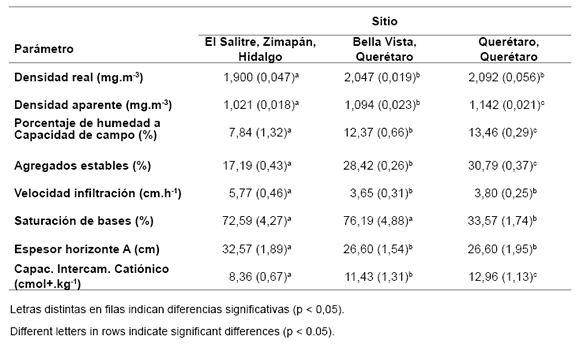
En la tabla 3 se muestran los resultados de densidad real y aparente, los porcentajes de humedad a capacidad de campo (CC), agregados estables y de saturación de bases; asimismo se muestra el resultado de velocidad de infiltración y de espesor del horizonte A. Se observa una semejanza entre los suelos de Querétaro y Bella Vista; el suelo de El Salitre es el que menor CC presentó, coincidiendo con el de menor porcentaje de humedad; igualmente fue el suelo de mayor velocidad de infiltración lo cual se corresponde con el suelo más rico en arena (más arenoso) y con menor capacidad para retener humedad.
Tabla 3. Resultados promedio de los parámetros físicos de los suelos en estudio en los suelos de las tres regiones. Entre paréntesis la desviación estándar.
Table 3. Average results of physical parameters of the soils under study in the soils of the three regions. In brackets the standard deviation.
La determinación de la materia orgánica (MO) resulta fundamental para el conocimiento de la productividad agrícola y forestal de los suelos (2, 4, 16). Los resultados de MO se muestran en la tabla 4. Se puede observar que clasifican según la normatividad mexicana (6, 22) como suelos con contenidos muy bajos de MO los suelos de El Salitre y Querétaro y como de bajos contenidos el suelo de Bella Vista.
Tabla 4. Resultados promedio de los contenidos de materia orgánica (%), análisis elemental de %C(orgánico) , arsénico (μg.kg-1) y % de N2O(total) en los suelos en estudio. Entre paréntesis la desviación estándar.
Table 4. Average results of the organic matter (%), elemental analysis of % C(organic), arsenic (μg.kg-1) and % N2O(total) in the soils under study. In brackets the standard deviation.
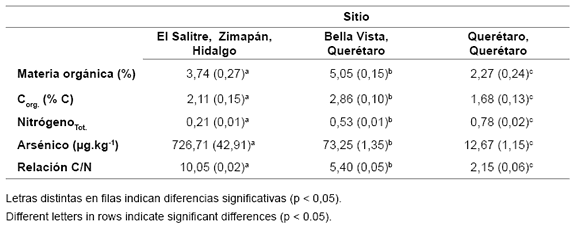
Se puede observar que existen diferencias significativas en cuanto a los %C y % de N. Por los contenidos de nitrógeno y según NOM-021-SEMARNAT-2000 (23), el suelo de Querétaro clasifica como de contenidos medios en tanto los suelos de Bella Vista y El Salitre como de contenidos bajos, sobre todo este último.
La relación C/N es un parámetro que evalúa la calidad de los restos orgánicos de los suelos, es decir, determina el grado de mineralización de la materia orgánica que existe en el suelo, así como el tipo de humus que se encuentra en él. Cuanto menor sea el valor de esta relación, mayor será el grado de mineralización de la materia orgánica y, por tanto, existe baja fertilidad; este es el caso de los suelos de Querétaro (relación C/N < 5). Cuando esta relación se encuentra entre 5-8 se pone de manifiesto una tendencia hacia la mineralización de la materia orgánica, la fertilidad es de baja a moderada. Relaciones > 8 señalan un equilibrio entre mineralización y humidificación (16).
Se han publicado trabajos que relacionan algunas funciones climáticas con los contenidos de C y N para algunas zonas tropicales (9) como la temperatura promedio, las precipitaciones pluviales y la altura de los sitios de estudio. En la mayor parte de las evaluaciones separan regiones con precipitaciones anuales entre 900 y 1500 mm y las mayores de 1500 y hasta 2000 mm anuales: encontraron una relación inversa entre los contenidos de materia orgánica, %N y temperatura; este es el caso de los suelos en estudio, en los que los contenidos de N son relativamente bajos, son zonas áridas (< 1000 mm anuales), con temperaturas medias entre 10-19°C y una altura promedio entre 1700-1900 m s. n. m. La edad o grado de evolución de los suelos juega un papel importante, ya que en sustratos recientes existen buenas reservas de elementos nutritivos, buenos desarrollos vegetales y altos contenidos de materia orgánica; con el avance de la edad usualmente se aprecian disminuciones en los contenidos de materia orgánica (1).
Los contenidos de As en los suelos de El Salitre en Zimapán (726,71 ± 42,91 μg/ kg-1 de As) fueron los más altos debido a su origen geomorfológico. Este resultado es dos veces más bajo que el mínimo que reportó Lechuga (17) en esta misma zona; sin embargo, cabe mencionar que en el citado estudio no se indican las coordenadas geográficas de la toma de muestra de suelo, por tanto, no pueden compararse con el mismo rigor. Le siguen en orden decreciente la contaminación natural (origen geomorfológico también) por As, el suelo de Bella Vista, con un nivel de concentración arsenical de 73,25 ± 1,35 μg/kg-1, que resulta ser diez veces menor que el suelo de El Salitre. En estos dos casos se puede señalar nuevamente la característica de proximidad geográfica, y finalmente, considerándose como un suelo no contaminado por As, (< 40 μg/kg-1) (6), el suelo de Querétaro que se tomó como referencia con solamente 12,67 ± 1,15 μg/kg-1 de As.
En otras zonas de México (Taxco, Estado de Guerrero) se han reportado valores de arsénico en suelos que oscilan entre 28,9 y 456,0 μg.kg-1 (33), es decir hasta 0,63 veces menor que el encontrado en El Salitre, Zimapán o los reportados en suelos de Ixtlán de Juárez, Oaxaca (14), con valores promedio de 409,6 μg.kg-1, igualmente inferiores a los de El Salitre, aunque mucho más elevados que los encontrados en Bella Vista, Querétaro. Por otro lado, también se reporta presencia de arsénico en regiones como Calpulalpan, estado de Tlaxcala (12) con valores similares a los de Guerrero y en la región centro norte de México, región biogeográfica conocida como Desierto Chihuahuense, en confluencia con los estados de Coahuila y Durango (35, 39).
Caracterización de las aguas utilizadas para riegos
Los resultados de caracterización de las aguas utilizadas para riegos se muestran en la tabla 5.
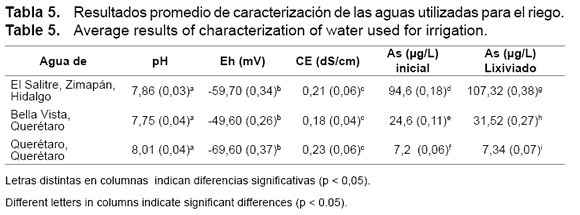
Se puede apreciar que no existen diferencias significativas en cuanto a los valores de pH, CE y Eh: las tres resultan ser aguas moderadamente alcalinas, moderadamente reductoras y no salinas. Solamente se determinó una diferencia importante en concentraciones de As (en todos los casos en forma de HAsO4 -2, de acuerdo con el diagrama de Pourbaix pH vs Eh).
Se observa en la tabla que la concentración inicial de As del agua utilizada para el riego de Zimapán excede 9,5 veces la NOM-127-SSA1 (24), por ello también es válida para control positivo; para el agua de Bella Vista supera en 2,5 veces la norma y el agua de Querétaro cumple con el contenido <10 μg/L. Las concentraciones de As determinadas en los lixiviados se hacen superiores a las iniciales, lo cual indica que existe un aporte del contenido de As presente en los suelos, en proporciones similares.
El arsénico contenido en las aguas de El Salitre se corresponde con los resultados reportados en otros estudios para esta región (29, 34), donde señalan para diferentes pozos y norias concentraciones que oscilaron entre 40 y 240 μg.L-1. Estos valores, aunque en forma As(V), se pueden considerar como tóxicos dado que concentraciones hasta 23 mg.L-1 se estiman seguras, al menos para peces (31); por encima de estas concentraciones ya son detectables efectos tóxicos, en este caso se tienen valores de 2 a 10 veces superiores. Con respecto a los contenidos en los lixiviados después de los riegos, se observa una ligera tendencia al incremento de las concentraciones de As, dada por su presencia en suelos, sobre todo en los suelos de El Salitre y Bella Vista.
Valoración de la capacidad de germinación de semillas de garbanzo (Cicer arietinum L.).
En la tabla 6 se muestran los resultados de las semillas de garbanzo (Cicer arietinum L.) que germinaron y la longitud alcanzada de la radícula por día.
Tabla 6. Análisis de germinación y crecimiento radicular de las semillas de garbanzo certificado. Cicer arietinum var. Kabuli (noralite) INIFAP-Celaya, Guanajuato y no certificado o de grado comercial. Entre paréntesis la desviación estándar.
Table 6. Analysis of germination and root growth of chickpea seed certificate Cicer arietinum var. Kabuli (noralite) INIFAP-Celaya, Guanajuato and not certificate. In brackets the standard deviation.
Como se puede apreciar existen diferencias importantes entre estas dos condiciones de semillas certificadas y no certificadas. Cuando se trata de semillas certificadas, 18 de 20 semillas (90%) germinan perfectamente y su raíz alcanza los 4 mm de longitud, aproximadamente a partir del sexto día. Para semillas comerciales solo 12 de 20 semillas germinaron (60%) y sus raíces alcanzaron tamaños entre 1,5 y 2,0 mm, es decir aproximadamente la mitad que en semillas certificadas.
A partir de 10°C el Cicer arietinum L. es capaz de germinar, aunque la temperatura óptima de germinación oscila entre 25-35°C. Si las temperaturas son más bajas se incrementa el tiempo de la germinación. Así mismo se reporta que la presencia de algunos microorganismos presentes en el suelo también puede inhibir el crecimiento radicular (24). Para este estudio la temperatura promedio durante los seis días fue de 25°C, obteniéndose buenos resultados para el caso de la variedad Kabuli (noralite), pues se observa que las semillas alcanzaron al cuarto día buena longitud en su raíz principal, para que con ellas se puedan realizar además estudios de genotoxicidad. Aunque algunas semillas lograron germinar tardíamente, al final del sexto día murieron.
Evaluación preliminar de daños genotóxicos en semillas de garbanzo (Cicer arietinum L.).
Los resultados mostraron que sí se puede utilizar la metodología señalada para estas evaluaciones en raíces de garbanzo, obteniéndose una buena observación de los núcleos, solo que los tiempos de hidrólisis deben ser diferentes, y se requieren alrededor de 45 minutos, mientras que para el mejor tiempo de tinción se obtuvo a los 55 minutos. En la figura 4 se observan núcleos bien teñidos de células apicales meristemáticas de garbanzo.
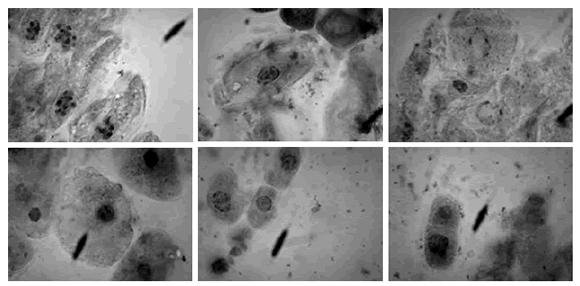
Figura 4. Microfotografía de células del meristemo apical del garbanzo Cicer arietinum L., germinadas en agua de Querétaro. Observados a aumento 40X.
Figure 4. Photomicrograph of apical meristem cells of chickpea Cicer arietinum L., germinated in water of Queretaro. 40X increase observed.
Las mitosis con cromosomas rotos son el origen de las células con micronúcleos (MNs) que aparecen en los meristemos. En la figura 5 se muestran microfotografías de células del meristemo apical del garbanzo (Cicer arietinum L.), que fueron germinadas con agua de Querétaro (figura a) y germinadas con agua de Querétaro contaminada con arsénico (figura b) y que fueron observados a aumento 40X. En el caso de la figura 3b se aprecian MNs inducidos, a diferencia de la figura 3a, lo cual es indicativo de un efecto aparentemente genotóxico por presencia de arsénico en el agua utilizada para riego, lo que corrobora que lo señalado por Prieto-García et al. (31), se cumple en tejidos meristemáticos de células apicales de garbanzo. Resultados similares fueron reportados en meristemos de Vicia faba y para células branquiales de pez cebra en agua de Zimapán (29).
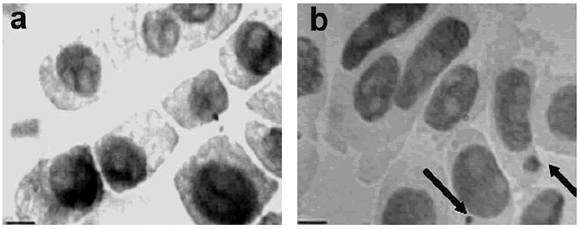
Figura 5. Microfotografía de células del meristemo apical del garbanzo Cicer arietinum L., a) germinadas en agua sin contaminar de Querétaro, b) germinadas en agua de Querétaro contaminada. Observados a aumento 40X.
Figure 5. Photomicrograph of apical meristem cells of chickpea Cicer arietinum L., a) germinated on uncontaminated water from Queretaro, b) germinated in contaminated water from Queretaro. 40X increase observed.
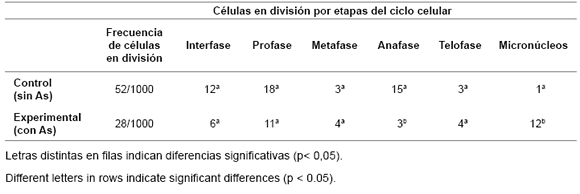
En la tabla 7 (pág. 240) se presenta la frecuencia de células en división, la distribución de éstas por etapas del ciclo celular y el número de MNs encontrados en las muestras control y experimentales. Se advierte que la frecuencia de MNs en los grupos experimentales difiere ligeramente con respecto al grupo control, presentando pequeñas diferencias significativas desde el punto vista estadístico y que aparentemente se producen en la etapa de anafase.
Tabla 7. Frecuencia de células en división y los micronúcleos encontrados en semillas de garbanzo certificado Cicer arietinum var. Kabuli (noralite) para el grupo control (sin presencia de As) y el grupo experimental (con presencia de As).
Table 7. Frequency of dividing cells and micronucleus found in seeds of certificate chickpea Cicer arietinum var. Kabuli (noralite) for the control group (without the presence of As) and the experimental group (with the presence of As).
El resultado anterior pudiera sugerir que no existe un daño genotóxico muy marcado, lo cual puede deberse a que el compuesto (As) sea más tóxico que mutágeno, en el cual el efecto mutagénico pudiera estar encubierto por el efecto tóxico.
El índice mitótico constituye un criterio para evaluar el daño fisiológico que provocan los diversos agentes xenobióticos. Se ha demostrado que algunas sustancias químicas pueden producir inhibición de la división celular, debido a un efecto citotóxico (29, 36).
De cinco preparaciones obtenidas por el grupo control se analizó el número de células en división en mil células por cada una y se promedió dicho resultado. Para el grupo experimental donde se utilizó el agua de Querétaro contaminada con As, se obtuvieron veintiún muestras, de las cuales también se analizaron mil células en cada una y se promedió igual que al grupo control el número de células en división entre el total de células observadas (tabla 8).
Tabla 8. Frecuencia de células meristemáticas de garbanzo certificado Cicer arietinum var. Kabuli (noralite) en división con y sin agua contaminada con arsénico.
Table 8. Frequency of meristematic cells of chickpea certificate Cicer arietinum var. Kabuli (noralite) dividing with and without arsenic-contaminated water.

Se observó una reducción de 2,8 veces en la división celular en las muestras tratadas con agua contaminada con As con respecto a las muestras del grupo control. Como se advierte dicha reducción es positiva estadísticamente y capaz de encubrir el efecto mutagénico.
Efectos de una sensible reducción en la división celular han sido reportados por Haber & Forrad (13), en estos casos evaluando la incidencia de radiaciones o el efecto de aplicaciones de insecticidas (36). Para determinar si existen diferencias en cuanto a las etapas del ciclo celular observadas en el grupo control y experimental, partiendo de la base de que se ha detectado un efecto citotóxico significativo, se desglosó la frecuencia de aparición de cada una de las sub-etapas de una división y se sacó la frecuencia por cada mil células para tener un índice de comparación.
Como se puede ver en la tabla 9 no hay diferencias significativas desde el punto de vista estadístico entre el grupo control y el experimental: inicialmente se puede observar que en ambos la mayoría de las células en división están en interfase y profase (64% y 67% sin As y con As, respectivamente), existiendo solo un segundo momento de expresión en anafase (23% y 20% sin As y con As, respectivamente), lo que sugiere un comportamiento similar entre los dos grupos y que dichas etapas del ciclo celular están coordinadas independientemente de la presencia de As o no. Por ello no se puede afirmar en qué lugar al ciclo celular está actuando el efecto citotóxico propiamente. Se realizó el análisis estadístico por medio de X2 y se encontró igual número de células en etapas de interfase, profase y anafase para ambos casos, de acuerdo con su proporción.
Tabla 9. Frecuencia observada de células meristemáticas de garbanzo certificado Cicer arietinum var. Kabuli (noralite) con respecto a cada una de las etapas del ciclo celular en los grupos tratados con agua contaminada con arsénico o sin contaminar.
Table 9. Observed frequency of meristematic cells chickpea certificate Cicer arietinum Kabuli var. (noralite) with respect to each of the stages of the cell cycle in the groups treated with water contaminated with arsenic or uncontaminated.

Bioacumulación de arsénico en semillas de garbanzo (Cicer arietinum L.) en la primera fase de crecimiento de la planta
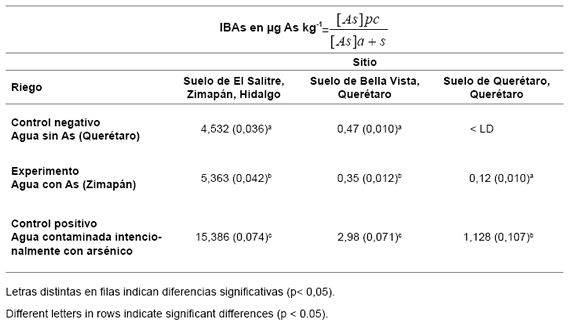
De las pruebas de siembra en macetas se colectaron a los 21 días las plántulas correspondientes a la primera etapa de crecimiento, conocida como etapa de germinación. La germinación es hipogea, lo que determina que los cotiledones permanezcan bajo la superficie del suelo una vez ocurrida la emergencia de las plántulas (figura 6, pág. 242). En la tabla 9 se muestran los resultados de los IBAs calculados. Como se aprecia existe una correlación dada por el nivel de As en plántula durante la etapa I de germinación de garbanzo, siendo unas 9,5 veces mayor en las plántulas germinadas en suelo de El Salitre, Zimapán, que en suelo de Bella Vista, Querétaro, utilizando agua para riego sin As (control negativo); esto pone de relieve la migración del As presente en suelos hacia el cultivo.

Figura 6. Pruebas de bioacumulación de As en siembra en macetas, plántulas colectadas a los 21 días correspondientes a la primera etapa de crecimiento, lavadas y en secado. a) Control negativo, agua sin As (agua y suelo de Querétaro); b) Experimento, agua con As (agua y suelo de El Salitre, Zimapán); c) Agua contaminada intencionalmente con arsénico, control positivo (agua contaminada con As y en suelo de El Salitre, Zimapán).
Figure 6. Evidence of bioaccumulation of As in potting, seedlings collected at 21 days for the first stage of growth, washed and dried. a) Negative control, water without As (water and soil of Queretaro); b) Experiment water with As (water and soil El Salitre, Zimapán); c) Arsenic contaminated water intentionally, positive control (As-contaminated water and soil El Salitre, Zimapán).
Cuando se suman efectos de concentración de As presente en suelos y agua (ver experimento en tabla 9, pág. 241) la correlación incrementa 15,3 veces. Entre suelos de Bella Vista y de Querétaro la correlación es 2,9 veces mayor. Es evidente que entre las evaluaciones de los experimentos (tabla 10) y los controles positivos, en estos últimos los IBAs resultan unas tres veces mayores.
Tabla 10. Índice de bioacumulación de arsénico (IBAs) en plántula durante la etapa I de germinación de garbanzo certificado Cicer arietinum var. Kabuli (noralite). Entre paréntesis la desviación estándar.
Table 10. Bioaccumulation of arsenic index (BAsI) in seedling during stage I of germination of certificate chickpea Cicer arietinum var. Kabuli (noralite). In brackets the standard deviation.
Conclusiones
La caracterización fisicoquímica de los suelos en estudio permite concluir que se trata de suelos neutros a moderadamente alcalinos, con efectos despreciables de salinidad, y de carácter reductores intermedios. Los valores de potencial zeta (pZ) en los extractos de saturación, muestran suelos con suspensiones coloidales de partículas, moderadamente estables. De acuerdo con estos criterios, los suelos de El Salitre, en Zimapán, Hidalgo y de Bella Vista en Querétaro, resultan muy similares con mínimas diferencias significativas. Los contenidos de humedad resultaron de moderados a altos con texturas que los clasifican entre franco-arcilloso a francoarcillo- arenoso. Por sus propiedades físicas (densidad aparente, capacidad de campo, agregados estables y capacidad de intercambio catiónico), son significativamente diferentes los tres suelos, aunque con semejanzas por la velocidad de infiltración y el espesor del horizonte A los suelos de Bella Vista y Querétaro, siendo los más enriquecidos en arcillas. Por sus contenidos de materia orgánica, carbono y nitrógeno los tres son significativamente diferentes aunque los suelos de Bella Vista y El Salitre
clasifican como de bajos contenidos. Finalmente resultan ser significativamente diferentes en sus contenidos de As, tanto el suelo de El Salitre (726,71 μg.kg-1) como el de Bella Vista (73,25 μg.kg-1), clasifican como suelos contaminados al presentar valores superiores a 40 μg.kg-1; el suelo de Querétaro (12,67μg.kg-1) se considera no contaminado y fue tomado como referencia.
Para la capacidad de germinación de las semillas de garbanzo, existen diferencias importantes entre las dos condiciones de semillas certificadas y no: de las primeras, el 90% germinan perfectamente y con buen desarrollo en su crecimiento, en tanto para las segundas, solo un 60% alcanza buena germinación pero sus dimensiones en tamaño de las raíces es aproximadamente la mitad que en las primeras. El efecto genotóxico del arsénico en las raíces de garbanzo (Cicer arietinum L.) se pudo apreciar desde el inicio al observarse el rompimiento de cromosomas anafásico y la aparición de micronúcleos inducidos por la presencia de As en las aguas; así también, se observaron pequeñas diferencias significativas desde el punto de vista estadístico. Se encontró, además, una reducción de 2,8 veces la división celular de las muestras tratadas con agua que contiene arsénico con respecto a las muestras del grupo control, resultando dicha reducción, positiva estadísticamente y capaz de encubrir al efecto mutagénico.
Se aprecia que existe correlación por el nivel de As en plántula siendo unas 9,5 veces mayor en las plántulas germinadas en suelo de El Salitre, Zimapán, que en suelo de Bella Vista, Querétaro, utilizando agua para riego sin As (control negativo); es indicativo de la migración del As presente en suelos hacia el cultivo. Cuando se suman efectos de concentración de As presente en suelos y agua, la correlación incrementa 15,3 veces. Entre suelos de Bella Vista y de Querétaro la correlación es 2,9 veces mayor. En los controles positivos los IBAs resultan 3 veces mayores que en las pruebas experimentales.
Agradecimientos
Miguel Ángel Rico expresa su agradecimiento al Consejo Nacional de Ciencia y Tecnología (CONACYT) de México por el apoyo brindado en el financiamiento del proyecto y beca otorgada (N° 251706) y al Centro de Estudios Académicos sobre Contaminación Ambiental (CEACA) de la Universidad Autónoma de Querétaro, México.
1. Acevedo, O. A.; Valera, M. A.; Prieto, F. 2010. Physical, chemical and mineralogical properties of forest soils in Acaxochitlan, state of Hidalgo, Mexico. Universidad y Ciencia. Trópico húmedo, 26(2): 137-149. [ Links ]
2. Aguilar, J.; Dorronsoro, C.; Fernández, E.; Fernández, J.; García, I.; Martín, F.; Sierra, M.; Simón, M. 2007. Arsenic Contamination in Soils Affected by a Pyrite-mine Spill (Aznalcóllar, SW Spain) Water Air Soil Pollut 180: 271-281. [ Links ]
3. Alcalá J.; Ávila, C.; Rodríguez, J. C.; Hernández, A.; Beltrán, A.; Rodríguez, H.; Loya, J. G. 2012. Metales pesados como indicador de impacto de un sistema ecológico fragmentado por usos de suelo, San Luis Potosí, México. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 44(2): 15-29.
4. Álvarez, R.; Steinbach, H. 2006. Valor agronómico de la matéria orgánica. En: Materia orgánica. Valor agronómico y dinámica en suelos pampeanos. Facultad de Agronomía, Universidad de Buenos Aires. Argentina. p. 13-29.
5. ASTM. Annual Book of Standards. 1993. ASTM D 3385-88. Section 4 Construction. Volume 04.08: Soil and Rock, Dimension Stone; Geosynthetics. p. 452-458.
6. Boulding, J. R. 1995. Description and sampling of contaminated soils. A field guide, 2nd ed. Chapter 3. Boca Raton, FL7 Lewis Publishers. USA. p. 12-16.
7. Certini, G.; Corti, G.; Fernández Sanjurjo, M. 2002. Comparison of two soil organic matter extractants and determination of the «Walkley-Black» correction factors for organic fractions from a volcanic soil. Commun. Soil Sci. Plant Anal. 33: 685-693.
8. Davidowski, L. 1993. A simple continuous flow hydride generator for ICP-OES. En Optima 3000. ICP Application Studies 67. Connecticut, USA. Perkin Elmer. p. 1-7.
9. Fassbender, H. W.; Bornemiza, E. 1987. Química de suelos con énfasis en suelos de América Latina. ISBN 92-9039-124-3. 2da Ed. Rev. Libros y Materiales Educativos 81. San José Costa Rica.
10. Fayiga, A. O.; Ma, L. Q. 2005. Arsenic uptake by two hyperaccumulator ferns four arsenic contaminated soils. Water, Air and Soil Pollution. 168: 71-89.
11. Ferreras, L.; Magra, G.; Besson, P.; Ovalevski, E.; García, F. 2007. Indicadores de calidad física en suelos de la región pampeana Norte de Argentina bajo siembra directa. Ci. Suel. 25(2): 159-172.
12. García, E.; Carrizales, L.; Juárez, L.; García, E. G.; Hernández, E.; Briones, E.; Vázquez, O. G. 2011. Plomo y arsénico en la subcuenca del Alto Atoyac en Tlaxcala, México. Rev. Chapingo. 17(1): 7-17.
13. Haber, A. H.; Forrad, D. E. 1964. Further studies of gamma-irradiated wheat and their relevance to use of mitotic inhibition for developmental studies. AMER J. But. 51: 151-159.
14. Hernández, A. 2011. Determinación de metales pesados en suelos Ixtlán de Juárez, Oaxaca. Tesis profesional. Universidad de la Sierra Juárez. México.
15. Jen-How, Huang; Kan-Nian, Hu; Berryinne Decker. 2011. Organic Arsenic in the Soil Environment: Speciation, Occurrence, Transformation, and Adsorption Behavior. Water Air Soil Pollut. 219: 401-415.
16. Jordán, A. 2006. Manual de Edafología. Departamento de Cristalografía, Mineralogía y Química Agrícola. Universidad de Sevilla. La Manna, L.; Alonso, V.; Buduba, C.; Davel, M.; Puentes, C.; Irisarri, J. 2007. Contenido de materia orgánica del suelo en la Región Andino Patagónica: comparación entre métodos analíticos. Actas del XX Congreso Argentino de la Ciencia del Suelo. Salta y Jujuy, Argentina.
17. Lechuga, M. A. 2002. Evaluación de los posibles daños genotóxicos en tejidos vegetales de alta sensibilidad, provocados por la bioacumulación de especies arsenicales. Tesis de Licenciatura. Universidad Autónoma del Estado de Hidalgo.
18. López-Domínguez, M. G. 2009. Distribución y fitobiodisponibilidad de metales pesados (Sb, Hg, As) en los jales de la mina de antimonio de Wadley, Estado de San Luis Potosí. Tesis de Maestría, Universidad Autónoma de San Luis Potosí.
19. Malvern Instrument, Inc. 2004. Potencial Zeta.Un curso completo en cinco minutos. Ed. Malver Inst. Catálogo Zeta-Meter. Westborough, MA 01581-1042, USA.
20. Martí, L.; Filippini, M. F.; Salcedo, C.; Drovandi, A.; Troilo, S.; Valdés, A. 2011. Evaluación de metales pesados en suelos de los oasis irrigados de la Provincia de Mendoza: I. Concentraciones totales de Zn, Pb, Cd y Cu. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 2011. 43(2): 203-221.
21. Mejías, F.; Valenzuela, J.; Aguaya, S.; Meza, D. 2009. Adsorción de arsénico en zeolita natural pretratada con óxidos de magnesio. Rev. Int. Contam. Ambient. 25(4): 217-227.
22. Mendoza-Amézquita, E.; Armienta-Hernández, M. A.; Ayora, C.; Soler, A.; Ramos-Ramírez, E. 2006. Potencial lixiviación de elementos traza en jales de las minas La Asunción y Las Torres, en el Distrito Minero de Guanajuato, México. Rev. Mex. de Cienc. Geol. 23(1): 75-83.
23. NOM-127-SSA1-1994. Norma Oficial Mexicana Salud ambiental, agua para uso y consumo humano- Límites permisibles de calidad y tratamiento a que debe someterse para su potabilización. Diario Oficial de la Federación del 18 de enero de 1996.
24. NOM 021-SEMARNAT-2000. Norma oficial mexicana que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. México.
25. Pardo, A.; Ruiz, M. A. 2002. SPSS 11. Guía para el análisis de datos. Madrid: McGraw-Hill.
26. Paredes, J. E.; Carrillo, J. A.; García, R. S.; Allende, A.; Sañudo, J. A.; Valdez, J. B. 2009. Microorganismos Antagonistas para el Control del Complejo de Hongos Causantes de la Rabia del Garbanzo (Cicer arietinum L.) en el Estado de Sinaloa, México. Rev. Mex. Fitopatol. 27(1): 27-35.
27. Patel, K. S.; Shrivas, K.; Brandt, R.; Jakubowski, N.; Corns, W.; Hoffmann, P. 2005. Arsenic contamination in water, soil, sediment and rice of central India. Environ Geochem and Health. 27: 131-145.
28. Pérez Moreno, F.; Prieto García, F.; Rojas Hernández, A.; Galán Vidal, C. A.; Marmolejo Santillán, Y.; Romo Gómez, C.; Castañeda, A.; Rodríguez Ávila, J. A.; Barrado Estaban, E. 2003. Caracterización química de aguas subterráneas en pozos y un distribuidor de agua de Zimapán, Estado de Hidalgo, México. Hidrobiológica. 13(2): 96-102.
29. Prieto-García, F.; Callejas, J.; Lechuga, M. A.; Gaytán, J. C.; Barrado, E. 2005. Acumulación en tejidos vegetales de arsénico proveniente de aguas y suelos de Zimapán, Hidalgo. Bioagro 17(3): 129-135.
30. Prieto-García, F.; Pérez, F.; Barrado, E. 2006. Lixiviación selectiva de arsénico y otros elementos de material sedimentario arrastrado por aguas subterráneas en Zimapán, Hidalgo, México. Interciencia. 31(1): 50-56.
31. Prieto-García, F.; Báez, O. A.; Scoot, W.; Gaytán, J. C.; Zúñiga, A. 2006. Acumulación, toxicidad y teratogénesis provocada por presencia de arsénico en aguas en el pez cebra (Danio rerio). Revista AquaTIC, Revista científica de la Sociedad Española de Acuicultura, N° 26: 72-85.
32. Prieto-García, F.; Callejas-Hernández, J.; Román-Gutiérrez, A. D.; Prieto-Méndez, J.; Gordillo Martínez, A. J.; Méndez Marzo, M. A. 2007. Acumulación de arsénico en el cultivo de habas (Vicia faba) Agronomía Costarricense. 31(2): 101-109.
33. Ruiz, E. A.; Armienta, M. A. 2012. Acumulación de arsénico y metales pesados en maíz en suelos cercanos a jales o residuos mineros. Rev. Int. Contam. Amb. 28(2): 103-117.
34. Smedley, P. L.; Kinniburgh, D. G. 2002. A review of the source, behaviour and distribution of arsenic in natural waters. Applied Geochemistry. 17: 517-568.
35. Solsona, F. 1986. Solución al problema del Hidroarsenicismo en la Región Lagunera (Coahuila y Durango) México. Organización Panamericana de la Salud (OPS), Organización Mundial de la Salud (OMS). México.
36. Söros C.; Bodó, E. T.; Fodor, P.; Morabito, R. 2003. The potential of arsenic speciation in mollusks for environmental monitoring. Anal. Bioanal. Chem. 377: 25-31.
37. Spiegel, M. R. 1970. Theory and problems of statistics, Schaum, New York, USA. p. 181-183.
38. USDA. 2000. Departamento de Agricultura de los Estados Unidos de Norteamérica. Guía para la Evaluación de la Calidad y Salud del Suelo. Traducción al Español del: "Soil Quality Test Kit Guide". Instituto de Suelos. CRN-CNIA-INTA. Argentina. p. 20-22.
39. Vega, S. 2001. Riesgo sanitario ambiental por la presencia de arsénico y fluoruros en los acuíferos de México. Comisión Nacional del Agua, Gerencia del Saneamiento y Calidad del Agua. México D. F.














