Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
On-line version ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.45 no.2 Mendoza Dec. 2013
ARTÍCULOS ORIGINALES
Morfología y anatomía floral de Schinopsis balansae (Anacardiaceae)
Floral morphology and anatomy of Schinopsis balansae (Anacardiaceae)
Ana Maria Gonzalez
Facultad de Ciencias Agrarias. Universidad Nacional del Nordeste (UNNE). Sgto. Cabral 2131. Corrientes. Argentina. W3402BKG. anitama39@gmail.com
Originales: Recepción: 21/12/2012 - Aceptación: 25/07/2013
Resumen
Se realizó el análisis morfo-anatómico de Schinopsis balansae Engl. con microscopía óptica y electrónica de barrido a fin de obtener datos de las flores de esta especie, definida como polígamo-dioica. Los resultados muestran que las flores estructuralmente perfectas son funcionalmente pistiladas, si bien presentan cinco estaminodios, los mismos carecen de tejido esporógeno; mientras que en las flores estaminadas la estructura denominada pistilo vestigial no es más que la excrecencia del ápice del receptáculo, cubierta por tejido nectarífero. De este modo, lo correcto es describir S. balansae como especie dioica. El estudio de la vascularización de las flores estaminadas muestra que el proceso de reducción es completo, ya que ni siquiera persisten los haces vasculares del pistilo. El gineceo de las flores pistiladas es pseudomonómero, con un carpelo funcional, un estilo/estigma dorsal y un óvulo; además posee dos carpelos vestigiales representados por sendos estilo/estigma laterales. Ambos tipos de flores presentan un disco nectarífero intraestaminal, con nectarostomatas para la salida del néctar. El análisis de la estructura anatómica de S. balansae brinda datos que concuerdan con los encontrados en otros géneros estudiados de la subfamila Anacardioideae de la familia Anacardiaceae.
Palabras clave: Dioecia; Estaminodios; Flores; Nectario; Schinopsis balansae; Vascularización
Abstract
A morphological and anatomical analysis of Schinopsis balansae Engl. was performed, using optical and scanning electron microscopy. The main objective was to obtain data from the flowers of this species, usually described as polygamous-dioecious. The results shows that the flowers described as functionally perfect are structurally pistillate; although have five staminoids, they are smaller and lack sporogenous tissue. In the staminate flowers, the structure described as vestigial pistil is the excrescence of the apex of the receptacle, covered by nectariferous tissue. Thus, it is right to describe S. balansae as dioecious species. The study of the vascularization of male flowers shows that the reduction process is complete, since not even the vascular traces for the pistil persists. The gynoecium of pistillate flowers is pseudomonomerous with one functional carpel, one ovule and one dorsal style and stigmata, and two vestigial carpels, represented only by individual lateral style/stigma. Both types of flowers present an intrastaminal nectary disc, with nectarostomatas for nectar release. The analysis of the anatomic structure of S. balansae provides data that are consistent with those found in other studied genus of Anacardioideae group in the Anacardiaceae family.
Keywords: Dioecy; Staminoids; Flowers; Nectary; Schinopsis balansae; Vascularization
Introducción
Schinopsis balansae Engl. denominado comúnmente quebracho colorado fue declarado "Árbol Forestal Nacional" por el Poder Ejecutivo Nacional (Decreto N° 15.190/1956). Desde el descubrimiento del poder curtiente de la madera en 1826 a la primera mitad del siglo XX, la sobreexplotación del quebracho colorado tuvo como objetivo la extracción de tanino y madera; en la actualidad continúa su extracción para dejar paso a tierras de cultivo (19, 40, 41).
Schinopsis balansae es un árbol polígamo-dioico con hojas simples, enteras y glabras; las flores se agrupan en panículas terminales (34, 35). Los frutos son sámaras semileñosas, de 3-3,4 x 0,8-1 cm, rojizas cuando jóvenes y castañas al madurar, tienen una porción seminífera subromboidal y un ala plana y oblonga (17, 34, 35). Además del tratamiento taxonómico, los estudios anatómicos se han enfocado al análisis de la madera, corteza y productos forestales derivados (15, 32), más recientemente a la ontogenia y estructura del fruto (17). El conocimiento de la estructura floral fue realizado en numerosos géneros de la familia (3, 44); sin embargo, ninguno de dichos estudios incluyó el género Schinopsis. A pesar de su importancia económica es notable la ausencia de datos acerca de sus características anatómicas especialmente reproductivas.
Objetivo
• Aportar información acerca de la estructura y anatomía floral a fin de contribuir al conocimiento de la especie y compararla con los restantes géneros ya estudiados de la familia.
Materiales y métodos
Se trabajó con flores de árboles cultivados en la ciudad de Corrientes y de poblaciones naturales del Chaco (ejemplares testigo depositados en el Herbario del Instituto de Botánica del Nordeste, Corrientes, Ana M. Gonzalez N° 200 y 306). Las flores fueron fijadas en FAA (formol, alcohol 70%, ácido Acético; 90:5:5), deshidratadas e incluidas en parafina (16, 23). Se realizaron cortes seriados longitudinales (CL) y transversales (CT) con micrótomo rotativo en espesores de 10-12 μm, se colorearon con safranina y azul de astra (39). Para observar los estomas en el nectario se diafanizaron las flores con solución de hipoclorito de sodio y se tiñeron con Lugol (23). Para la detección de taninos se utilizó FeSO4 (39) y IKI-H2SO4 (23). Se realizaron observaciones con microscopia óptica utilizando un microscopio estereoscópico Leica MZ6 y microscopio óptico Leica DM LB2, ambos equipados con tubo de dibujo y cámara fotográfica.
Para las observaciones con microscopía electrónica de Barrido (MEB) se utilizó material fijado en FAA, secado a punto crítico y metalizado con Oro-Paladio. Se utilizó un microscopio Jeol LV 5800 del Servicio de Microscopía Electrónica de la UNNE, Corrientes.
Resultados
Morfología floral
Schinopsis balansae posee flores imperfectas, pediceladas, actinomorfas, pentámeras, heteroclamídeas. Las flores pistiladas y estaminadas poseen las bases de sépalos, pétalos y filamentos estaminales soldados que forman un muy breve tubo floral. El cáliz es verde con cinco sépalos glabros, el margen de los lóbulos es membranoso. La corola está formada por 5 pétalos imbricados, glabros, blancos a amarillentos, reflexos durante la antesis (figuras 1A,1B: pág. 104).
Las flores pistiladas (figura 1A: pág. 104) poseen gineceo con ovario súpero, ovoide y aplanado lateralmente, unilocular. Cada una presenta tres estilos: uno dorsal y dos laterales, todos insertos en la zona media del ovario; cada estilo presenta una ranura ventral en toda su longitud y remata en un estigma capitado (figura 1C: pág. 104). Es usual la presencia de pistilos con 1 o 2 estilos. El ovario posee un solo óvulo, anátropo y de placentación sub-apical.
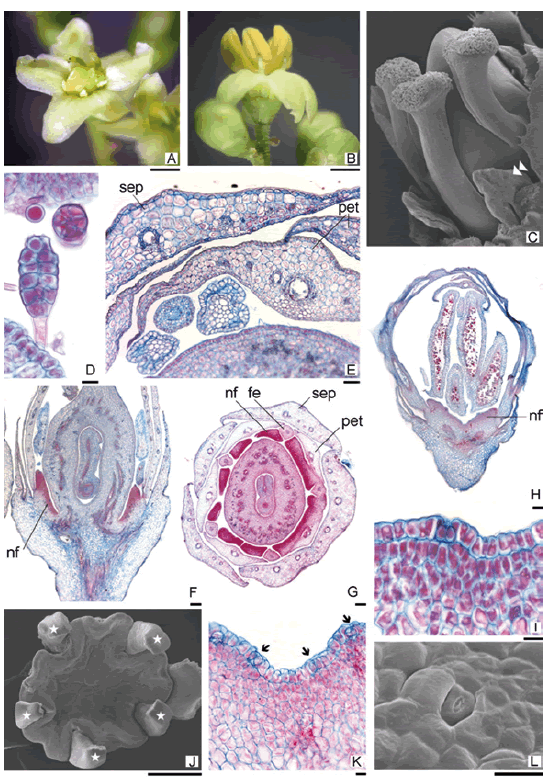
Figura 1. A. flor pistilada, B. flor estaminada, C. gineceo y estaminodios (punta de flecha) de flor pistilada (MEB), D. tricomas glandulares, E. sépalos (sep), pétalos (pet) y estaminodios en CT, F. CL flor pistilada (nf: nectario floral), G. CT flor pistilada (fe: filamento estaminal), H. CT de flor estaminada, I. detalle de tejido nectarífero, J. interior de flor estaminada, las anteras se removieron (*), K. CL de nf con nectarostomatas (flechas), L. nectarostomata (MEB).
Figure 1. A. female flower, B. male flower, C. gynoecium and staminodes (arrow point) of female flower (MEB), D. glandular trichomes, E. sepals (sep), petals (pet) and staminodes in CT, F. CL female flower (nf: floral nectary), G. CT female flower (fe: estaminal filament), H. CT of male flower, I. detail of nectariferous tissue, J. interior cup of male flower, anthers were removed (*), K. CL of nf with nectarostomatas (arrow), L. nectarostomata (MEB).
Estas flores tienen 4-5 estaminodios, de 0,8 - 1 mm de longitud, de filamentos engrosados y anteras bitecas, indehiscentes a pesar de tener línea de dehiscencia longitudinal demarcada. Tienen un disco nectarífero intraestaminal profundamente dividido en cinco lóbulos.
Las flores estaminadas (figura 1B: pág. 104) se caracterizan por tener 5 estambres fértiles, de 2,0 - 2,4 mm de longitud, con filamentos delgados y anteras dorsifijas, bitecas, con dehiscencia longitudinal y abundante producción de polen. El disco nectarífero es de color amarillo intenso, cubre la cavidad interior de la flor extendiéndose como disco intraestaminal, el borde está fraccionado (figura 1J: pág. 104). El gineceo está ausente o en algunas flores reducido a una masa vestigial carente por completo de la organización pistilar.
Anatomía
Pedúnculo y receptáculo
El pedúnculo floral está cubierto de pelos glandulares de pie uniseriado y cabezuela multicelular bi-triseriada (figura 1D: pág. 104). Estos tricomas le otorgan una consistencia pegajosa a las inflorescencias jóvenes, ya que recubren además las brácteas que acompañan las flores, las cuales caen antes de la antesis de las mismas. El resto de las piezas florales son glabras. Entre pedúnculo y receptáculo floral hay una línea de absición conspicua que, anatómicamente, sólo involucra el parénquima cortical.
El receptáculo está cubierto por epidermis uniestratificada, glabra, con estomas elevados y cutícula engrosada. El tejido parenquimático de la zona cortical tiene abundantes espacios intercelulares; el cilindro central está formado por una eustela compuesta por un anillo de haces vasculares acompañados por canales secretores floemáticos, caracterizados por la lisis de sus células (figura 1F: pág. 104).
Perianto
Los sépalos están constituidos por epidermis uniestratificada con abundantes estomas, la epidermis externa con cutícula engrosada. El mesófilo está formado por parénquima clorofiliano homogéneo con tres haces vasculares colaterales, el haz medio está acompañado por un canal resinífero floemático (figura 1E, sep, pág. 104). Los pétalos poseen epidermis uniestratificada, estomas más numerosos en la cara inferior. Mesófilo parenquimático con drusas ocasionales, está vascularizado por un haz dorsal y varios haces de menor diámetro que recorren la lámina del pétalo; los haces de mayor tamaño están acompañados por canales resiníferos (figura 1E, pág. 104).
Nectario floral (NF)
Presenta forma de disco, se encuentra soldado en su base a la cara interna del tubo floral, la porción apical del NF forma cinco lóbulos opositipétalos, con el margen superior ondulado (figuras 1F, 1G, 1H: pág. 104). Anatómicamente, el NF está compuesto por una epidermis uniestratificada con cutícula muy delgada y con numerosos nectarostomatas, formados solo por el par de células oclusivas (figuras 1I, 1L: pág. 104). La superficie libre del nectario presenta invaginaciones, ubicándose los nectarostomata tanto en las crestas como en las depresiones. El tejido subepidérmico está formado por 4-6 capas de parénquima glandular con citoplasma muy denso e intensamente coloreado. En las flores estaminadas el NF tiene las mismas características, solo que se continúa en toda la zona central de la flor, cubriendo el ápice del receptáculo (figuras 1J, 1K: pág. 104).
En la flor pistilada los estaminodios no superan en altura la porción media del ovario, los filamentos estaminales son cortos, gruesos y presentan una constricción en la zona de unión con las tecas (figura 1C-flecha: pág. 104). Las anteras son ditecas pero carecen de sacos polínicos (figuras 2B, 2C: pág. 106), están formadas por epidermis uniestratificada, un estrato subepidérmico de células rectangulares que en corte longitudinal se disponen en empalizada, pero carecen de los típicos engrosamientos del endotecio, en la zona del estomio este estrato tiene células de menor tamaño, lo cual conforma la línea de deshiscencia que se aprecia exteriormente, pero no se abren a la madurez. Internamente las tecas solo presentan tejido parenquimático compacto con drusas, no se forma tejido esporógeno. Anatómicamente los filamentos estaminales son similares a los de las flores estaminadas (figura 2C: pág. 106).

Figura 2. A: CT estambre, B-C: CT estaminodios, D: CL de estilo dorsal (sd), estigma (sg) y tejido de transmisión (tt), E: CL de ovario mostrando el óvulo, F: CL de estilo lateral (sl) y tejido de transmisión (tt), G: CT por estilo dorsal y lateral, H: CT estilo con 3 haces vasculares (hv), I-J: estigma papiloso, K: óvulo (MEB), la flecha indica la micrópila.
Figure 2. A. CT stamen, B-C: CT staminodes, D: CL dorsal style (sd), stigma (sg) and transmission tissue (tt), E: CL ovary showing the ovule, F: lateral style CL (sl) and transmission tissue (tt), G: CT of dorsal and lateral styles, H: CT of style with three vascular bundles (hv), I-J: papillose stigma, K: ovule (MEB), the arrow indicates the micropyle.
Gineceo
Solo está presente en la flor pistilada (figuras 1C, 1F: pág. 104). La pared carpelar está formada de afuera hacia adentro por: epidermis externa uniseriada de células en empalizada con estomas anomocíticos; mesófilo parenquimático con haces vasculares acompañados por canales resiníferos perifloemáticos; hipodermis biestratificada y epidermis interna también de dos capas de espesor (figura 2D: pág. 106).
Los estilos están formados por epidermis uniestratificada, sin estomas y parénquima vascularizado por dos o tres trazas vasculares (figuras 2D, 2H, pág. 106), poseen una ranura central hacia la cual se orienta el tejido de transmisión (figura 2H: pág. 106). El estilo dorsal posee tejido de transmisión que se extiende desde el lóculo del ovario, atraviesa la pared carpelar, recorre el estilo y llega hasta el estigma (figuras 2D, 2G: pág. 106). El tejido de transmisión es típicamente glandular: está formado por células alargadas de núcleo conspicuo y citoplasma denso, en la zona de la pared carpelar este tejido de transmisión presenta las células intercaladas demarcando la línea de sutura del carpelo. Los estilos laterales también presentan tejido de transmisión, que recorre el estilo hasta el estigma, pero en la zona del ovario forma un canal que termina ciego dentro del parénquima carpelar, sin alcanzar el lóculo (figuras 2F, 2G: pág. 106).
Los estigmas son capitados, están tapizados por pelos glandulares pluricelulares uniseriados, cubiertos por una secreción muy densa (figuras 2I, 2J: pág. 106), insoluble en alcohol o acetona.
El óvulo es anátropo, descendente, síntropo, el rafe es externo, dorsal y el micrópilo está orientado hacia la base del ovario (figuras 2E, 2K: pág. 106); el funículo se inserta en la porción subapical del ovario, tanto la inserción del funículo como la micrópila quedan opuestos al estilo dorsal (figura 2E: pág. 106). El funículo es muy largo y se curva un par de veces, presenta epidermis cuyas células tienen abundantes compuestos tánicos. La cara interna del funículo posee excrecencias (figuras 2E, 2K: pág. 106). El resto del funículo está formado por tejido parenquimático y tiene un conspicuo haz vascular que llega a la calaza sin ramificarse. El óvulo posee un solo tegumento de 4-5 células de espesor en la base engrosándose hacia la micrópila donde se fracciona. El óvulo es crasinucelado, el saco embrionario tipo Polygonum se encuentra cubierto por más de 10 capas de células en el ápice nucelar (figura 2E: pág. 106).
Vascularización floral
Flores pistiladas
El pedicelo está inervado por una sifonostela de la cual se desprenden 10 haces vasculares, cada uno de ellos está acompañado por un canal resinífero (figuras 3A, 3B: pág. 108). Esas trazas divergen hacia la periferia, quedando remanentes de la sifonostela central en el receptáculo de la flor (figuras 3C, 3D: pág. 108). Estas diez trazas son complejas y en el tubo floral se separan: hacia el interior quedan 10 haces que inervarán respectivamente 5 pétalos y 5 estaminodios alternipétalos (figuras 3E, 3F: pág. 108) y hacia el exterior se fraccionan en numerosos haces que inervan los 5 sépalos (figuras 3E, 3G: pág. 108).

Figura 3. Vascularización de la flor pistilada. A-Q: CT por niveles indicados en R (CL de flor). Abreviaturas: hpet: haz petalar, hsep: haz sepalar, hst: haz estaminal, nf: nectario floral, ov: ovario, ovu: óvulo, sd: estilo dorsal, sl: estilo lateral, stm: estaminodio.
Figure 3. Vascularization of the female flower. A-Q: CT of levels indicated in R (CL flower). Abbreviations: hpet: petalar trace, hsep: sepalar trace, hst: staminal trace, nf: floral nectary, ov: ovary, ovu: ovule, sd: dorsal style, sl: lateral style, stm: staminode.
Cuando los sépalos se separan del tubo floral ya están vascularizados por un haz medio y dos a varios haces laterales (figuras 3G, 3J). El haz petalar se divide en numerosos haces menores que vascularizan la lámina del pétalo. La sifonostela central remanente se fracciona en un anillo de hacecillos que se distribuyen de forma elíptica vascularizando el ovario (figuras 3F, 3H), no se diferencian haces dorsales ni marginales. En la zona media del ovario, dos haces ubicados en un vértice se separan para inervar el estilo dorsal (figura 3L: pág. 108). De los haces que recorren los laterales del ovario se desprenden dos trazas de cada lado (ocasionalmente tres) para inervar los estilos laterales (figuras 3L, 3M: pág. 108). En cada estilo, las dos trazas llegan hasta el estigma donde puede observarse alguna bifurcación ocasional. En el ápice del ovario, desde el vértice ventral, se desprende la traza que inerva el óvulo, recorriendo el largo funículo hasta la cálaza, sin ramificarse (figura 3R: pág. 108). Los restantes haces se curvan vascularizando el ápice y recorren la cresta del ovario llegando hasta la base del estilo dorsal donde finalizan sin ingresar al mismo.
Flor estaminada
El pedúnculo se encuentra vascularizado por una sifonostela (figuras 4A, 4B: pág. 110). En el receptáculo se liberan 10 trazas hacia la periferia (figuras 4C, 4D: pág. 110) y en un nivel superior los remanentes de la estela se resuelven en otros 10 haces (figuras 4E-4G: pág. 110). De las 10 trazas exteriores, 5 constituirán los haces dorsales de sépalos y los restantes se fraccionarán para constituir haces marginales de sépalos adyacentes (figuras 4J, 4K: pág. 110). De las 10 trazas internas: 5, acompañadas por canales secretores, vascularizan los pétalos; las 5 restantes inervan los filamentos estaminales (figuras 4G-4L: pág. 110). Cada estambre presenta un único haz que recorre todo el filamento y finaliza en el conectivo sin ramificarse, carece de canales secretores (figuras 4L-4N: pág. 110).

Figura 4. Vascularización de la flor estaminada. A-N: CT por niveles indicados en O (CL de flor). Abreviaturas: fs: filamento estaminal, hpet: haz petalar, hsep: haz sepalar, hst: haz estaminal, nf: nectario floral, pet: pétalo, sep: sépalo.
Figure 4. Vascularization of the male flower. A-N: CT or levels indicated in O (CL flower). Abbreviations: fs: staminal filament, hpet: petalar trace, hsep: sepalar trace, hst: staminal trace, nf: floral nectary, pet: petal, sep: sepal.
Discusión y conclusiones
En un esquema reproductivo polimórfico una especie presenta dioecia cuando tienen plantas "femeninas" y plantas "masculinas" (4), donde cada una produce gametas femeninas y masculinas y la alogamia es una condición obligada (20, 28). Esta situación, generalizada en el reino animal, solo se encuentra en un 6% de las Angiospermas, entre las cuales se encuentra la familia Anacardiaceae (1, 36, 37). La dioecia es una condición característica en la familia y bastante estudiada en especies comerciales como en el género Pistacia (12, 21).
Independientemente del proceso ontogenético o del momento en que se desarrollen o aborten las piezas florales, la apariencia final y externa de las flores de especies dioicas puede variar de hermafroditas (perfectas) a claramente unisexuales (26, 31). Limitándose a la presencia y apariencia externa de androceo y gineceo, las plantas de S. balansae fueron descriptas como polígamo-dioicas con flores perfectas y estaminadas en sendos individuos (34, 35, 36); solo Bachelier & Endress (3) reconocen que la mayoría de las flores de las Anacardiaceae descriptas morfológicamente como bisexuales son funcionalmente unisexuales. Los resultados del presente estudio confirman que las flores de S. balansae estructuralmente perfectas son funcionalmente pistiladas, ya que los estambres no producen tejido esporógeno y carecen por lo tanto de cualquier posibilidad de formar polen, mientras que en las flores estaminadas la estructura descripta como pistilo vestigial o rudimentario no es más que la excrecencia del ápice del receptáculo, cubiertas por tejido nectarífero. De este modo, lo correcto es describir S. balansae como especie dioica.
El presente análisis demuestra que si bien las flores pistiladas presentan el verticilo del sexo opuesto representado por cinco estaminodios, los mismos carecen de tejido esporógeno, pero tienen idéntica provisión vascular que los estambres funcionales de las flores estaminadas. El análisis de la vascularización de las flores pistiladas ayuda a comprender la presencia de los estaminodios, ya que el segundo anillo de 10 trazas que deriva de la sifonoestela central de la flor inerva tanto los pétalos como los estaminodios, de modo alterno. Evidentemente la presencia de estaminodios representa un proceso incompleto de supresión de la función masculina en las flores funcionalmente pistiladas, proceso frecuente en flores unisexuales (43). Estos estaminodios no parecen cumplir ninguna función en particular, ni siquiera producen polen estéril como recompensa para los polinizadores como ocurre en Anacardium (13).
La vascularización de las flores estaminadas, donde se ha perdido todo remanente de pistilo, muestra que el proceso de reducción es completo, ya que ni siquiera persisten sus haces vasculares. Estas observaciones anatómicas y morfológicas hacen de S. balansae una buena especie para el estudio de desarrollo floral y análisis de expresión de patrones de genes homeóticos o genes de identidad de órganos sexuales.
Wannan & Quinn (44) describen los géneros de la tribu Rhoeae de las Anacardiaceae (en la cual se ubica S. balansae) con gineceo tricarpelar y unilocular por aborto de dos carpelos, quedando dos estilos como remanentes. Según Bachelier & Endress (3) en Anacardiaceae la reducción del gineceo ocurre de dos maneras: (a) algunas especies con gineceo verdaderamente unicarpelar (monómero) o (b) por la reducción en el número de carpelos fértiles por desarrollo desigual, el gineceo posee menor número de lóculos que de carpelos; en este segundo caso el gineceo es pseudomonómero, con dos carpelos reducidos de los tres existentes. De acuerdo con numerosos estudios (2, 3, 14, 44) esta es una característica de la subfamilia Anacardioideae y encontrada en S. balansae en la presente investigación. De acuerdo con Endress (10, 11) en el core Eudicotyledoneae la reducción del gineceo a menudo conduce a la pseudomonomería, con un único carpelo funcional junto con los restos de carpelos adicionales estériles. Esta es la situación encontrada en S. balansae cuyo gineceo sería pseudomonómero con un carpelo funcional, con un óvulo y un estilo/estigma dorsal y dos carpelos vestigiales, solo representados por sendos estilo/estigma laterales.
Desde el análisis anatómico se comprueba la ausencia de cómpito interno: el tejido de transmisión recorre los tres estilos, pero solo el correspondiente al dorsal alcanza la cavidad ovárica; en los estilos laterales el tejido de transmisión termina ciego dentro de la pared carpelar y no se conecta con el lóculo, tampoco hay unión con los tejidos de transmisión del estilo dorsal. La ausencia de cómpito interno ya fue mencionada para algunas especies de la subfamilia Anacardioideae (ej.: Pistacia, Schinus y Semecarpus) por Bachelier & Endress (2, 3), subfamilia en la que se ubica a Schinopsis. Si bien en los tres estigmas se observó la presencia de polen, los laterales posiblemente no son funcionales, dato que debería verificarse con un análisis de recorrido de tubos polínicos, incluyendo el lugar de ingreso al óvulo, cuya micrópila se encuentra opuesta al lugar donde el tejido de transmisión del estilo dorsal alcanza el lóculo. Cabe considerar que existen antecedentes de calazogamia en la familia (5, 6, 7, 18, 29, 30, 38, 42), además de haberse registrado la existencia de frutos partenocárpicos (17).
El óvulo de S. balansae es crasinucelado y unitégmico, caracterizado por un largo funículo, similar a varias Anacardiaceae: Anacardium (6, 33); Mangifera (22, 45); Pistacia (5, 42); Mangifera (38); Lannea y Rhus (24, 25). Por la curvatura se considera síntropo [óvulo cuya dirección de curvatura es la misma que la de cierre del carpelo (9), término que se corresponde al de apótropo, posición característica de todas las especies de la familia (10).
Bachelier & Endress (3) mencionan que en Burseraceae y Anacardiaceae presentan un disco nectarífiero intraestaminal, glabro con nectarostomatas para la salida del néctar; estas características son las mismas que se encuentran en ambas flores de S. balansae. En las Burseraceae el tejido nectarífero acompaña y puede unirse en una estructura cónica con el gineceo reducido de las flores estaminadas, estructura denominada "ovariodisk" (3, 8, 27), la cual representa la descripta como ovario vestigial en S. balansae y confirmada en el presente estudio como el remanente de la estela central.
El análisis de la estructura anatómica de S. balansae brinda datos que concuerdan con los presentes en otros géneros estudiados del grupo Anacardioideae en la familia Anacardiaceae, y contribuye al conocimiento de la anatomía floral de una especie dioica de la flora argentina.
1. Al-Fredan, M. 2010. Sexual polymorphism in the dioecious plant species of eastern Saudi Arabia. The International Journal of Plant Reproductive Biology. 2(1): 85-91. [ Links ]
2. Bachelier, J.; Endress, P. 2007. Development of inflorescences, cupules and flowers in Amphipterygium and comparison with Pistacia (Anacardiaceae). International Journal of Plant Sciences. 168: 1237-1253. [ Links ]
3. Bachelier, J.; Endress, P. 2009. Comparative floral morphology and anatomy of Anacardiaceae and Burseraceae (Sapindales), with a special focus on gynoecium structure and evolution. Botanical Journal of the Linnean Society. 159(4): 499-571. [ Links ]
4. Barrett, S. 2002. The evolution of plant sexual diversity. Nature Reviews Genetics. 3: 274-284. [ Links ]
5. Copeland, H. 1955. The reproductive structures of Pistacia chinensis (Anacardiaceae). Phytomorphology. 5: 440-449. [ Links ]
6. Copeland, H. 1961. Observations on the reproductive structures of Anacardium occidentale. Phytomorphology. 11: 315-325. [ Links ]
7. Copeland, H.; Doyel, B. 1940. Some features of the structure of Toxicodendron diversiloba. American Journal of Botany. 27: 932-939. [ Links ]
8. Daly, D. 1989. Studies in Neotropical Burseraceae. II. Generic limits in New World Protieae and Canarieae. Brittonia. 41: 17-27. [ Links ]
9. Endress, P. 1994. Diversity and evolutionary biology of tropical flowers. Cambridge University Press. 511 p.
10. Endress, P. 2011. Angiosperm ovules: diversity, development, evolution. Annals of Botany 107: 1465-1489. [ Links ]
11. Endress, P.; Igersheim, A. 2000. Gynoecium structure and evolution in basal angiosperms. International Journal of Plant Sciences. 161(Suppl.): 211-223. [ Links ]
12. Esfandiyari, B.; Davarynejad, G.; Shahriari, F.; Kiani, M.; Mathe, A. 2011. Data to the sex determination in Pistacia species using molecular markers. Euphytica. 185(2): 227-231.
13. Freitas, B.; Paxton, R. 1996. The role of wind and insects in cashew (Anacardium occidentale) pollination in NE Brazil. Journal of Agricultural Science. 126: 319-326. [ Links ]
14. Gallant, J.; Kemp, J.; Lacroix, C. 1998. Floral development of dioecious staghorn sumac, Rhus hirta (Anacardiaceae). International Journal of Plant Sciences. 159(4): 539-549. [ Links ]
15. Giménez Bolzón, A.; Moglia Lugones, J. 1995. Estructura cortical de Anacardiáceas argentinas. Quebracho. 3: 24-36.
16. Gonzalez, A. M.; Cristóbal, C. 1997. Anatomía y ontogenia de semillas de Helicteres lhotzkyana (Sterculiaceae). Bonplandia. 9: 287-294. [ Links ]
17. Gonzalez, A. M.; Vesprini, J. 2010. Anatomy and fruit development in Schinopsis balansae (Anacardiaceae). Anales del Jardín Botánico de Madrid. 67(2): 103-112.
18. Grundwag, M.; Fahn, A. 1969. The relation of embryology to the low seed set in Pistacia vera (Anacardiaceae). Phytomorphology. 19: 225-235.
19. Guarnaschelli, A. 2010. Bosques Nativos de Argentina. CEABA. FAUBA. 47 p.
20. Heilbuth, J. 2000. Lower species richness in dioecious clades. The American Naturalist. 156(3): 221-241. [ Links ]
21. Hormaza, J.; Polito, V. 1996. Pistillate and staminate flower development in dioecious Pistacia vera (Anacardiaceae). American Journal of Botany. 83(6): 759-766. [ Links ]
22. Joel, D.; Eisenstein, D. 1980. A bridge between the ovule and ovary wall in Mangifera indica L. (Anacardiaceae). Acta Botanica Neerlandica. 29: 203-206. [ Links ]
23. Johansen, D. A. 1940. Plant Microtechnique. New York. McGraw-Hill. 523 p.
24. Kelkar, S. 1958. A contribution to the embryology of Lannea coromandelica (Houtt.) Merr. Journal of the University of Bombay. 26: 152-159.
25. Kelkar, S. 1958. Embryology of Rhus mysorensis, Heyne. Journal of the Indian Botanical Society. 37: 114-122. [ Links ]
26. Kemp, J.; Posluszny, U.; Gerrath, J.; Kevan, P. 1992. Floral development of Rosa setigera. Can. J. Bot. 71: 74-75.
27. Lam, H. 1932. The Burseraceae of the Malay Archipelago and Peninsula. Bulletin du Jardin Botanique Buitenzorg, Série III 12: 281-561.
28. Lazarte, J.; Palser, B. 1979. Morphology, vascular anatomy, and embryology of pistillate and staminate flowers of Asparagus officinalis. American Journal of Botany. 66: 753-764. [ Links ]
29. Martínez-Pallé, E.; Herrero M. 1995. The ponticulus: a structure bridging pollen tube access to the pollen tube in Pistacia vera. Sexual Plant Reproduction. 8: 217-222.
30. Martínez-Pallé, E.; Herrero, M. 1998. Pollen tube pathway in chalazogamous Pistacia vera L. International Journal of Plant Sciences. 1594: 566-574.
31. Mayers, A.; Lord, E. 1984. Comparative flower development in the cleistogamous species Viola obarata. A histological study. Botanical Gazzette. 145: 83-91.
32. Moglia, G.; Gimenez, A. 1998. Rasgos anatómicos característicos del hidrosistema de las principales especies arbóreas de la Región Chaqueña Argentina. Investigación Agraria: Sistemas y Recursos Forestales. 7(1-2): 53-71. [ Links ]
33. Moncur, M.; Wait, A. 1986. Floral ontogeny of the cashew, Anacardium occidentale L. (Anacardiaceae). Scientia Horticulturae. 30: 203-211.
34. Muñoz, J. de D. 1990. Anacardiaceae. En: Spichiger, R.; Ramella, L. (eds.). Flora del Paraguay. 14: 1-84. [ Links ]
35. Muñoz, J. de D. 2000. Anacardiaceae. En: Hunziker, A. T. (Ed.). Flora Fanerogámica Argentina. CONICET, Córdoba. Argentina. 65: 1-28.
36. Pell, S. 2009. Anacardiaceae. Cashew family. Avalaible in: http://tolweb.org/Anacardiaceae/21262/2009.01.03 (Accessed 0ctober 2012).
37. Renner, S.; Ricklefs, R. 1995. Dioecy and its correlates in the fowering plants. American Journal of Botany. 82: 596-606.
38. Robbertse, P.; von Teichman, I.; van Rensburg, H. 1986. A re-evaluation of the structure of the mango ovule in comparison with those of a few other Anacardiaceae species. South African Journal of Botany. 52: 17-24. [ Links ]
39. Ruzin, S. E. 1999. Plant microtechnique and microscopy. Oxford University Press. 334 p.
40. Secretaría de Ambiente y Desarrollo Sustentable. 2004. Atlas de Bosques Nativos Argentinos. 343 p.
41. Secretaría de Ambiente y Desarrollo Sustentable. 2008. Pérdida de Bosque Nativo en el norte de Argentina. Diciembre de 2007-Octubre de 2008. 12 p.
42. Shuraki, Y.; Sedgley, M. 1997. Pollen tube pathway and stimulation of embryo sac development in Pistacia vera (Anacardiaceae). Annals of Botany. 79: 361-369.
43. Walker-Larsen, J.; Harder, L. 2000. The evolution of staminodes in Angiosperms: patterns of stamen reduction, loss, and functional re-invention. American Journal of Botany. 87(10): 1367-1384.
44. Wannan, B.; Quinn, C. 1991. Floral structure and evolution in the Anacardiaceae. Botanical Journal of the Linnean Society. 107: 349-385. [ Links ]
45. Wet de, E.; Robbertse, P.; Coetzer, L. 1986. Pollination and ponticulus development in Mangifera indica L. cvs 'Haden' and 'Sensation'. South African Journal of Plant and Soil. 3: 76-79.
Agradecimientos
Al Dr. José Vesprini por la sugerencia del tema y a la Secretaría General de Ciencia y Técnica de la Universidad Nacional del Nordeste (UNNE) por el apoyo económico (PI N° 17/09A123).














