Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versión On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.46 no.1 Mendoza ene./jun. 2014
Evaluación de los efectos de la composición de la dieta artificial para la cría de Diatraea saccharalis (Lepidoptera: Crambidae) y Cotesia flavipes (Hymenoptera: Braconidae)
Assessment of artificial diet composition for laboratory rearing of Diatraea saccharalis (Lepidoptera: Crambidae) and Cotesia flavipes (Hymenoptera: Braconidae)
Carmen Reguilón 1, Pilar Medina Pereyra 2, Mariano Ordano 3, 4, Analía Salvatore 5, María Verónica Barros 6, Elitamara Morsoletto Santos 7, María Aparecida Vicente Cano 7
1 Instituto de Entomología, Fundación Miguel Lillo, Miguel Lillo 251, T4000JFE, San Miguel de Tucumán, Tucumán, Argentina. c_reguilon@yahoo.com.ar
2 Instituto de Fisiología Animal, Fundación Miguel Lillo.
3 Instituto de Ecología, Fundación Miguel Lillo.
4 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina.
5 EEAOC, Estación Experimental Agroindustrial Obispo Colombres. Av. William Cross 3150, T4101XAC, Las Talitas, Tucumán, Argentina.
6 Museo Miguel Lillo de Ciencias Naturales, Miguel Lillo 251, T4000JFE, San Miguel de Tucumán, Tucumán, Argentina.
7 Biocontrol, Rua das Orquideas 29, Chácara Recreio Planalto, CEP 14176-416, Sertaozhinho, Ribeirao Preto, San Pablo, Brasil.
Originales:
Recepción: 03/04/2013
Aceptación: 02/12/2013
Resumen
El control biológico aumentativo de Diatraea saccharalis Fabricius (Lepidoptera: Crambidae) requiere la cría masiva del parasitoide Cotesia flavipes Cameron (Braconidae: Microgastrinae) y por ello, es necesario el desarrollo de dietas artificiales eficientes. El objetivo fue examinar los efectos de distintos tipos de dieta sobre parámetros biológicos de D. saccharalis y su impacto en la producción de cocones de C. flavipes. Se sembraron 46136 huevos de D. saccharalis en once combinaciones de dietas artificiales, con dos tipos de harinas y tres tipos de antibióticos. Los resultados mostraron que la composición de la dieta afectó los parámetros biológicos de ambas especies. La mayor eficiencia en la cría se obtuvo con el empleo de combinaciones de harina de poroto y ampicilina. Sin embargo, si se considera la relación entre costos de producción y parámetros biológicos, la dieta con harina de poroto, oxitetraciclina y estreptomicina resulta más adecuada para la cría masiva.
Palabras clave: Barrenador de la caña de azúcar; Control biológico; Parasitoidismo; Manejo de plagas
Abstract
The augmentative biological control of Diatraea saccharlis Fabricius (Lepidoptera: Crambidae) requires the mass rearing of the parasitoid Cotesia flavipes Cameron (Braconidae: Microgastrinae), and for this, it's necessary the development of efficient artificial diets. The goal was to examine the effects of different diet types on biological parameters of D. saccharalis and their impact on coccon production of C. flavipes. 46136 eggs of D. saccharalis were sow on eleven combinations of artificial diets, with two types of flours and three types of antibiotics. The results showed that the diet composition affected biological parameters of both species. The larger efficiency in the rearing was obtained with the use of combinations of bean flour and ampicillin. However, if we consider the relationship between production costs and biological parameters, the diet with bean flour, oxytetracycline and streptomycin was the most adequate for mass rearing.
Keywords: Sugarcane stem borer; Biological; Control; Parositoidism; Pest management
Introducción
El gusano barrenador Diatraea saccharalis Fabricius (Lepidoptera: Crambidae) es uno de los insectos más importantes para la agricultura sudamericana, ya que es fuente de daños en caña de azúcar, maíz, arroz, avena, sorgo y trigo (17, 27, 36, 41, 47). Esta especie es una de las principales plagas que atacan al cultivo de la caña de azúcar (Saccharum officinarum, Poaceae), debido a su amplia distribución y a la alta incidencia (20, 43). En Argentina, el problema es mayormente relevante en la provincia de Tucumán, donde la producción de caña de azúcar representa 66% de la producción nacional (37).
La acción primaria de D. saccharalis es la formación de galerías en los tallos, lo cual reduce el peso y número de tallos producidos por hectárea. Las perforaciones funcionan como puerta de entrada de hongos y bacterias que son los responsables del deterioro de los tejidos que inciden negativamente en la calidad, pureza y contenido de sacarosa del jugo de caña extraíble. Existen otros daños que afectan la calidad vegetativa, como la aparición de brotes laterales, atrofia de entrenudos y muerte de la yema apical (2, 4, 15, 16, 53). En la provincia de Tucumán, los niveles de infestación de D. saccharalis en cultivos de caña de azúcar varían en promedio entre 5 y 8%, con picos de 60% (45). En términos de producción azucarera, la pérdida productiva se estima en 650 gramos de azúcar por tonelada de caña por punto porcentual de infestación (44).
Típicamente, tres estrategias son utilizadas para mitigar el problema de infestación por D. saccharalis: (1) cultivo de variedades resistentes, (2) aplicación de insecticidas, (3) control biológico. Como ejemplos para el primer caso, en Louisiana (USA) se cultivan las variedades resistentes CP70-321 y CP65-357 (6), sin embargo, las variedades comerciales más difundidas en Tucumán (Argentina), tales como LCP 85-384; TUC 77-42; CP 65-357; RA 87-3, L 75-33 y TUC 95-12, presentan escasa o nula resistencia a la plaga y la susceptibilidad al ataque es semejante entre ellas (14, 32, 45). Complementariamente, el uso de productos químicos (insecticidas) sólo puede hacerse efectivo en los primeros estadios larvales, antes de que la larva penetre los tallos (46). Como alternativa, el control biológico de D. saccharalis con el microhimenóptero parasitoide Cotesia flavipes Cameron (1891) (Braconidae: Microgastrinae) ha mostrado resultados positivos (3, 8, 33, 52).
Para la aplicación de técnicas de control biológico aumentativo se hace necesario el desarrollo de dietas artificiales eficientes para alimentar los estadios inmaduros de D. saccharalis, con el fin de ser utilizados para cría masiva como hospedadores del controlador biológico C. flavipes (11, 22, 24, 31, 39, 42). Esto es debido a que la composición de la dieta (natural o artificial) influye sobre parámetros del ciclo de vida (19), tales como fertilidad, tamaño de las larvas, proporción de sexos y supervivencia (1, 5, 6, 7, 21, 25, 28, 29, 35, 37).
Los componentes comúnmente adicionados a los formulados dietarios comprenden fuentes de nitrógeno (proteínas o aminoácidos), lípidos, carbohidratos y minerales (50). Además se adicionan vitaminas tipo B, como biotina y ácido fólico, que actúan como factores de crecimiento, y vitamina C (ácido ascórbico) como fagoestimulante y antioxidante. También se requieren estabilizantes que modifican el pH (ácido acético, ácido benzoico) y gelificantes como agar y caragenato que dan consistencia al alimento (12). Lo que se espera de una dieta artificial en condiciones de cría masiva, es que además de cubrir las necesidades nutricionales, sea capaz de atenuar los riesgos de enfermedades y contaminación por patógenos, cuyos efectos podrían disminuir drásticamente la población manejada en el laboratorio (48). Para prevenir la contaminación microbiana se emplean antifúngicos (por ejemplo, ácido sórbico, metil-parahidroxi-benzoato) y antibióticos. En consecuencia, se espera que la optimización de una dieta artificial contribuya al mantenimiento adecuado de la cría del hospedero D. saccharalis y a una mayor producción del parasitoide C. flavipes (4, 9, 22).
Estudios previos sobre la composición de la dieta de D. saccharalis han mostrado que ésta tiene efectos sobre el peso, la duración del ciclo de vida (en los estados de larva y pupa), la mortalidad de larvas, y la fecundidad de los adultos (7, 11, 38, 39, 50) además de un efecto en la producción de parasitoides (22). Este cúmulo de conocimiento es significativo aunque no suficiente para abordar las necesidades de la cría masiva. La presente investigación es la primera que considera once combinaciones de dieta y cinco parámetros biológicos y productivos de interés para la optimización de la cría masiva de D. saccharalis y C. flavipes.
Objetivo
• Examinar los efectos de distintas composiciones de dietas sobre parámetros del ciclo de vida de D. saccharalis y el impacto en la producción de cocones de C. flavipes.
Materiales y métodos
Preparación de la dieta base y combinaciones experimentales
La dieta se basó en Greene et al. (18), y en una dieta desarrollada en Biocontrol (10, 34), con modificaciones seguidamente descriptas. Para preparar la dieta básica se procedió de la siguiente manera. En 3 litros de agua calentada a 60°C, se licua harina de poroto grueso (380 g), harina de maíz (420 g), levadura inactiva (352 g) y germen de trigo (240 g, tratado en autoclave en bolsa de polipropileno 1 hora). Se agregan 70 ml de solución vitamínica, preparada en 2 fases. Una en la que se mezclan en seco: biotina (40 mg/l), niacinamida (2 g/l), pantotenato de calcio (2 g), riboflavina (1 g/l), clorhidrato de tiamina (500 mg), clorhidrato de piridoxina (500 mg), y ácido fólico (200 mg). Una fase líquida con: cloruro de colina (6 g), vitamina B12 (120 ml), Polivitamínico Mineral Tónico Plus (Induvet®; 9 ml), metil- parahidroxi- benzoato (95 g), ácido sórbico (18 g), ácido ascórbico (35,7 g) y antibiótico (16 g de oxitetraciclina más 1 g de estreptomicina). Luego se agrega caragenato (95 g licuado en 3 litros de agua hervida) y formol (12 ml al 35%). Esta dieta será referida como Dieta A. Se realizaron además otras diez combinaciones de dieta. En la tabla 1 (pág. 49) se describen las variaciones en los componentes y cantidades utilizadas para las once combinaciones de dieta, teniendo en cuenta que el procedimiento fue el mismo que el aquí descripto para la Dieta A. Se usó harina de poroto blanco (Phaseolus vulgaris; molienda fina y gruesa) y de soja (Glycine max).
Tabla 1. Variaciones de la dieta básica (Dieta A) para obtener once formulaciones de dieta artificial utilizadas en los ensayos de efecto de dieta. N indica el número de frascos sembrados con huevos de Diatraea saccharalis para cada combinación de dieta. Ver detalles en sección Materiales y Métodos.
Table 1. Variations of the basic diet (Diet A) to get eleven formulations of the artificial diet used in the essays on diet effects. N indicates the number of jars sowed with Diatraea saccharalis eggs for each diet combination. See details in Materials and Methods section.

Manejo del hospedero y del parasitoide en el laboratorio
El pie de cría de D. saccharalis se estableció en el Centro de Investigaciones sobre Regulación de Poblaciones de Organismos Nocivos, Tucumán, Argentina (CIRPON, autorización cuarentenaria de SENASA, Servicio Nacional de Sanidad y Calidad Agroalimentaria). Las larvas de D. saccharalis provenían de cultivos de caña de azúcar de las provincias de Tucumán y Salta, y material proveniente de Biocontrol. Cotesia flavipes fue introducido desde Biocontrol, Ribeirão Preto, Brasil. Los ensayos se realizaron con cohortes F1 de D. saccharalis y una línea de cría del parasitoide, para reducir potenciales efectos de variación genética entre líneas. Las líneas se sacrificaron al finalizar el trabajo.
Los ensayos se llevaron a cabo entre los meses de enero y abril de 2008. Se seleccionaron posturas (ubicadas en hojas de papel) con huevos de la misma fecha de oviposición. Las hojas se desinfectaron en sulfato cúprico (7 g/l de agua) por tres minutos. Luego un trozo de papel con postura se adhirió a la pared del frasco de dieta. Se contaron 46136 huevos de D. saccharalis (con lupa) y se sembraron 450 frascos de vidrio (esterilizados en autoclave a 120°C, 1 atm de presión, 50 minutos), cada uno con 120 ml de dieta artificial (tabla 1, pág. 49). Cada frasco tuvo en promedio 205 huevos (rango: 32 a 258; número total de huevos por tratamiento indicado en tabla 2, pág. 50). Las tapas fueron ahuecadas, cubiertas con algodón o malla de alambre con papel secante (esterilizadas en estufa a 200°C, 30 minutos). Luego de la siembra de huevos, los frascos se ubicaron en cámara de incubación (29 + 1°C, 65- 70% humedad relativa, fotoperíodo 12 L:12 O).
Una vez ocurrida la eclosión y el desarrollo de las larvas, los frascos de cada tratamiento se destinaron a dos líneas de desarrollo. Una submuestra de las larvas fue destinada para conocer los parámetros de D. saccharalis, mientras que otra submuestra fue destinada a la parasitoidización. El número de frascos para la medición de cada variable se indica en la tabla 2 (pág. 50) (indicado por "n"). El número final de frascos por tratamiento fue menor que el inicial, ya que sólo se usaron frascos en óptimas condiciones sanitarias.
Tabla 2. Tamaño de muestra (n, número de frascos sembrados), promedio (ŷ) y desvío estándar (s) de cada variable por tratamiento de dieta artificial. Las letras se refieren a las combinaciones de dieta descriptas en la tabla 1 (pág. 49).
Table 2. Sample size (n, number of sowed jars), mean (ŷ) and standard deviation (s) of each variable by artificial diet treatment. The letters refer to the diet combinations described in table 1 (page 49).

Para el destino de parasitoidización, a los 19 días de sembrados los huevos, se seleccionaron 6223 larvas de D. saccharalis en estado L4 (20-25 mm). Cada larva de D. saccharalis se ofreció manualmente a una hembra de C. flavipes. Luego, en cápsulas plásticas de Petri (desinfectadas con hipoclorito de sodio al 0,2%, 2 horas) se colocaron larvas parasitoidizadas (5 larvas por cápsula). Para conocer los parámetros de D. saccharalis, a los 21 días, se seleccionaron 6090 larvas en estado L5. En este caso se colocaron 6 larvas por cápsula. Las cápsulas con larvas parasitoidizadas (destino cocón) y no parasitoidizadas (destino D. saccharalis) se colocaron en cámaras separadas (27 + 1°C, 65-70% humedad relativa, fotoperiodo 12 L:12 O). Todas las cápsulas contenían 2-3 trozos de 2,5 cm2 cada uno de dieta de "realimentación". Esta segunda dieta se usó de manera constante para ambos destinos (línea D. saccharalis y línea C. flavipes).
La dieta para "realimentación" de larvas se preparó con harina de poroto (840 g), harina de maíz (840 g), germen de trigo (390 g esterilizado como fue indicado arriba), levadura inactiva (176 g), formol (36 ml), ácido acético (110 ml), Induvet® (12 ml), vitamina B12 (8 ml), solución vitamínica (100 ml), agar (336 g), oxitetraciclina (28 g) y 6 litros de agua.
Parámetros del ciclo de cría masiva
Los potenciales efectos de la dieta sobre parámetros de cría de D. saccharalis fueron evaluados sobre la proporción de huevos que llegaron a larva L4 (eficiencia huevo-larva), y sobre la proporción de larvas que llegaron a pupa (eficiencia larva-pupa). La eficiencia huevo-larva fue medida como número de larvas de D. saccharalis dividido por el número de huevos sembrados por frasco, independientemente del destino (cría de la plaga o parasitoidización). Los potenciales efectos de la dieta sobre la producción de C. flavipes fueron evaluados sobre la base de la producción de cocones (número de cocones dividido por el número de larvas parasitoidizadas) o producción de cocones. Dado que sería deseable una combinación que incremente la eficiencia de ambas líneas de cría (D. saccharalis y C. flavipes), se evaluó el efecto de la dieta sobre un estimador de eficiencia global. Esto se hizo multiplicando la eficiencia huevo-larva por la eficiencia larva-pupa para la línea de D. saccharalis, y multiplicando la eficiencia huevo-larva por la producción de cocones para la línea de C. flavipes. Para construir un índice de rentabilidad relativa, la eficiencia global fue dividida por el costo de la dieta correspondiente (calculado con base en los precios de los insumos durante el estudio).
Análisis de datos
De acuerdo con cada modelo estadístico, se realizaron pruebas de normalidad de Shapiro-Wilk. Cuando fue necesario, las variables originales fueron transformadas para alcanzar el supuesto de normalidad. El número de huevos por siembra fue transformado como la raíz cuadrada de X; la eficiencia huevo-larva, la eficiencia larva-pupa, y la producción de cocones (considerando una unidad como masa de cocón producida por larva parasitoidizada) fueron transformadas como el arcoseno de la raíz cuadrada de X. La eficiencia global y la eficiencia por unidad de costo (rentabilidad relativa) no fueron transformadas. Dado que el número de huevos por siembra varía y afecta la eficiencia huevo-larva por efectos de densidad, el número de huevos sembrados fue considerado una covariable. Esto asume que la variación en la proporción de eclosión fue despreciable. Para examinar el efecto de la composición de la dieta, se aplicó un modelo lineal general. El factor principal fue el tipo de dieta, el número de huevos sembrados fue una covariable, y las variables de respuesta fueron la eficiencia huevo-larva, la eficiencia larva-pupa, la producción de cocones, la eficiencia global y la rentabilidad. A los fines de este estudio se optó por aplicar modelos univariados. Siempre que fue posible se evaluaron interacciones entre factores. Cuando el factor principal fue significativo, se aplicaron pruebas a posteriori para determinar diferencias significativas entre tipos de dieta. Todos los análisis fueron llevados a cabo en STATISTICA 7.0 (49).
Resultados
En la tabla 2 (pág. 50) se muestra el resumen estadístico para cada uno de los parámetros de cría considerado. La composición de la dieta afectó significativamente todas las variables de respuesta. Las dietas difirieron significativamente entre sí (tabla 2, pág. 50; tabla 3).
Tabla 3. Sumario de resultados de los análisis con aplicación de modelos lineales generales. SC: suma de cuadrados; gl: grados de libertad; CM: cuadrados medios; F: valor del estadístico F; p: probabilidad asociada a la prueba estadística.
Table 3. Summary of results from analyses with the application of general linear models. SC: sum of squares; gl: degrees of freedom; CM: mean squares; F: value of the statistic F; p: associated probability to the statistical test.
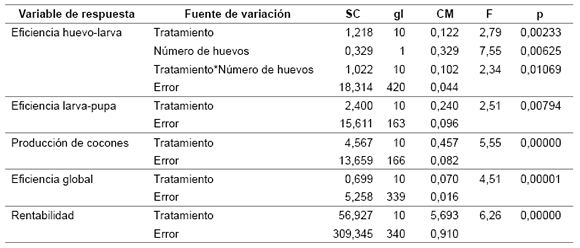
En el caso de la eficiencia huevo-larva, hubo un efecto significativo del número de huevos sembrados y de la interacción entre el número de huevos sembrados y el tipo de dieta (tabla 3). Esto indica que la covariación entre la eficiencia huevo-larva y el número de huevos sembrados dependió del tipo de dieta.
La menor eficiencia huevo-larva se observó en la dieta G, mientras que el valor promedio más alto se observó en la dieta I (tabla 2, pág. 50). Estas diferencias fueron significativas (p < 0,05; prueba de Tukey, muestras desiguales). Tanto la eficiencia larva-pupa de D. saccharalis como la producción de cocones de C. flavipes fueron significativamente mayores en la dieta E (tabla 2, pág. 50). Con la dieta E la producción de cocones fue significativamente mayor a otros cuatro tipos de dieta (p < 0,05).
La mejor eficiencia global fue obtenida con la dieta E, que fue significativamente superior a otros ocho tipos de dieta (p < 0,05, tabla 2, pág. 50). No ocurrió lo mismo con la rentabilidad, que evidenció que la dieta A fue más rentable respecto de otros seis tipos de dieta (p < 0,05, tabla 2, pág. 50).
Discusión
En general, los formulados con base en harina de poroto favorecieron los parámetros biológicos considerados. La dieta I (harina de poroto fino y grueso) favoreció la eficiencia huevo-larva. La dieta E (harina de poroto grueso) favoreció la eficiencia global. Estas observaciones contrastan con Lastra y Gómez (21), quienes compararon cuatro tipos de dietas (zanahoria, soja, caseína y poroto) sobre parámetros biológicos de D. saccharalis y señalan como menos adecuada la dieta a base de poroto por proporcionar un menor porcentaje de pupas, y un menor número de larvas aptas para parasitoidización. Los resultados de este estudio sugieren el empleo de harina de poroto como un componente más eficaz que la harina de soja. Este resultado sería contra-intuitivo si se considera que los productos de la soja son ampliamente difundidos como componentes de la dieta en insectos. La harina de soja tiene alto contenido proteico, vitamínico y mineral, y un perfil lipídico benéfico (12). Una explicación a este resultado podría darse por un efecto en la variación de la textura final de la dieta aquí utilizada. La harina de poroto confiere una textura más compacta o menos aireada y esto permite un mayor contenido de humedad que la harina de soja. Además, el contenido de humedad en dietas con harina de poroto se presume más estable, mientras que las dietas con harina de soja se secan más rápido. Una consistencia más estable jugaría un papel importante en la supervivencia de las larvas y en el aprovechamiento de los componentes nutritivos, ya que dietas secas dificultan la movilidad de las mismas. Otra posibilidad para explicar las diferencias observadas es la relación con el pH (23, 26), el cual no fue considerado en este estudio.
Por otra parte, los mejores resultados se obtuvieron con el empleo de ampicilina en diferentes dosis. La mayor eficiencia global se obtuvo con la dieta E (dosis doble de ampicilina) y en segundo lugar con la dieta I (ampicilina y estreptomicina). Sin embargo, una dosis doble de ampicilina aumenta el costo de la dieta, por lo que la dieta A (sin ampicilina) es la adecuada si se toma en cuenta la rentabilidad. Las recomendaciones del uso de bactericidas o bacteriostáticos son variables, lo cual depende del sistema de estudio y de características de la implementación de la cría masiva en laboratorio. En trabajos de cría de larvas de otros lepidópteros en laboratorio, como Hypsydia grandella (Zeller) (Lepidoptera: Pyralidae) resulta eficiente el uso de clorotetraciclina en dosis de 0,3 g/l de dieta (51). El uso de tetraciclina es recomendado para la cría de larvas de lepidópteros en general (18). Sin embargo, para controlar el crecimiento de bacterias en líneas de cría masiva de D. saccharalis, se utiliza sulfato de estreptomicina en dosis de 1 a 1,5 g/l (22, 23). Las grandes biofábricas de cría masiva de C. flavipes de Brasil usan con éxito una combinación de ácido nalidíxico (Wintomylon®; bacteriostático y bactericida) en dosis de 0,65 ml/l de dieta, mas ampicilina en dosis de 0,065 a 0,15g/l de dieta (13, 30, 51). Este último caso se podría comparar con los resultados de este trabajo ya que la dieta A combina un bactericida (estreptomicina) con un bacteriostático y bactericida (oxitetraciclina), con la ventaja de que los compuestos usados en la dieta A tienen menor costo que sus respectivos equivalentes usados por las biofábricas de Brasil.
Son varias las razones de variación en los parámetros biológicos que podrían devenir de los potenciales efectos de la dieta sobre la interacción hospedero-parasitoide. La interacción entre el polidnavirus (PVD) inyectado por C. flavipes durante la parasitoidización de la larva de D. saccharalis induce la supresión del sistema inmune de la larva hospedero, y en consecuencia las células de defensa (hemocitos) no pueden encapsular los huevos o larvas del parasitoide (40). Si el sistema inmune de las larvas parasitoidizadas se encuentra deprimido, las larvas se harían más susceptibles al ataque de microorganismos (bacterias) del sistema de cría y esto podría afectar la supervivencia, por lo cual debería considerarse este tema en futuros estudios.
Conclusiones
La dieta I (harinas de poroto grueso y fino, ampicilina y estreptomicina) es la dieta adecuada para mantener y/o incrementar el número de larvas de D. saccharalis, ya que con esta dieta se obtuvo el valor promedio más alto para la eficiencia huevo-larva. Como no es posible hacer una dieta óptima para cada situación, la dieta E (harina de poroto grueso con ampicilina en doble dosis) es la dieta adecuada para optimizar simultáneamente la producción en la línea de cría de D. saccharalis y la producción de cocones, ya que fue la dieta con mayor eficiencia global. Finalmente, para el desarrollo de la cría masiva con el objeto de su empleo en control biológico, se debe considerar además la relación costo-beneficio. En este caso, la dieta A (harina de poroto grueso, oxitetraciclina y estreptomicina) es la mejor opción.
1 Acatitla Trejo, C.; Bautista Martínez, N.; Vera Graziano, J.; Romero Nápoles, J.; Calyecac-Cortero, H. G. 2004. Ciclo biológico y tasas de supervivencia y reproducción de Copitarsia incommoda Walter (Lepidoptera: Noctuidae) en cinco dietas artificiales. Agrociencia-México. 38: 355-363. [ Links ]
2 Asdrúbal Aponte P.; Alfonso Ordosgoitti, F. 1991. Resultados de las investigaciones en enfermedades de la caña de azúcar en Venezuela en el período 1986-1989. Caña de Azúcar. 9(1): 53-65. [ Links ]
3 Badilla Fernández, F. 2002. Un programa exitoso de control biológico de insectos plaga de la caña de azúcar en Costa Rica. Manejo Integrado de Plagas y Agroecología. 64: 77-87. [ Links ]
4 Badilla Fernández, F.; Gómez, J. 2003. Pérdidas de azúcar causadas por Diatraea spp. en Nueva Concepción, Guatemala. Revista Manejo Integrado de Plagas y Agroecología (Costa Rica). 67: 18-22. [ Links ]
5 Bavaresco, A.; García, M. S.; Grützmacher, A. D.; Ringenberg, R.; Foresti, J. 2004. Adequação de uma dieta artificial para a criação de Spodoptera cosmioides (Walk.) (Lepidoptera: Noctuidae) em laboratorio. Ecology, behavior and bionomics. Neotropical Entomology. 33(2): 155-161. [ Links ]
6 Bessin, R. T., Moser, E. B.; Reagan, T. E. 1990. Integration of management tactics for Diatraea saccharalis (F.) (Lepidoptera: Pyralidae) populations in southern Louisiana. Journal of Economic Entomology. 83(4): 1563-1569.
7 Boiça Jr., A. L.; Lara, F. M.; Bellodi, M. P. 1997. Influência de variedades de cana-de-açúcar, incorporadas em dieta artificial, no desenvolvimento de Diatraea saccharalis (Fabr.) e no seu parasitismo por Cotesia flavipes (Cam.). Anais da Sociedade Entomológica do Brasil. 26(3): 537-542. [ Links ]
8 Botelho, P. S. M.; Macedo, N. 2002. Cotesia flavipes para o controle de Diatraea saccharalis. En: Parra, J. R.; Botelho, P. S. M.; Correa Ferreira, B. S.; Bento, J. M. S. (Eds.) Controle Biológico no Brasil. Parasitóides e Predadores. São Paulo. Brasil. Editora Manole Ltda. p. 409-426.
9 Botelho, P. S. M.; Parra, J. R.; Correa Ferreira, B. S.; Bento, J. M. S. (Eds.). 2002. Controle Biológico no Brasil; Parasitóides e Predadores. San Pablo. Brasil. Editora Manole Ltda. 609 p.
10 Cano, M. A. V.; dos Santos, E. M.; Pinto, A de E. 2006. Produção de Cotesia flavipes para o controle da broca da cana. En: S. Pinto, A. (Ed.). Controle de pragas da cana de açúcar. Boletín Técnico Biocontrol, Brasil. 1(3): 21-24. [ Links ]
11 Chan Wong, M. I. 1989. Comparación de cuatro dietas artificiales para la cría en laboratorio de Diatraea saccharalis (Lepidoptera: Pyralidae). Tesis de Licenciatura. Facultad de Agronomía. Escuela de Fitotecnia. San José, Costa Rica. 90 p.
12 Cohen, A. C. 2003. Insect diets: Science and technology. Arizona. USA. CRC Press. 324 p.
13 COPERSUCAR. 1987. Guia prático ilustrado para identificação e controle de contaminantes em insetários. Boletim técnico COPERSUCAR, Edição Especial. 5 p.
14 Costilla, M. A.; Chavanne, E. R.; García, M. B.; Delgado, N.; Cuenya, M. I. 2012. Descripción y registro de la nueva variedad de caña de azúcar TUC 95-10 producida en la Estación Experimental Agroindustrial Obispo Columbres. Avance Agroindustrial. 33(2): 13-16. [ Links ]
15 Ferrer, F.; Guédez, E. 1990. Estudio de los daños causados por Diatraea sp. (Lepidoptera: Pyralidae) en el área de influencia de la Azucarera Río Turbio en los años 1986-1987-1988. Caña de Azúcar. 8(1): 25-35. [ Links ]
16 Figueredo L.; Linares B.; Hernández L. 2004. Evaluación de daños y distribución de especies del complejo de taladradores de la caña de azúcar en los valles de los ríos Turbio y Yaracuy. Venezuela, 2003. Caña de Azúcar. 22(2): 38-55.
17 Gómez, L. A.; Lastra, L. A. 1995. Insectos asociados con la caña de azúcar en Colombia. En: Cassalett, C.; Torres, J.; Isaacs, C. (Eds.). El cultivo de la caña en la zona azucarera de Colombia. Cenicaña. Colombia. p. 237-263.
18 Greene, G. L.; Leppla, N. C.; Dickerson, W. A. 1976. Velvetbean caterpillar: a rearing procedure and artificial diet. Journal of Economic Entomology. 69(4): 487-488.
19 Hernández, O. 1994. Evaluación de dos ingredientes de la dieta para reproducción artificial del gusano barrenador de la caña de azúcar, Diatraea saccharalis (F.) y el parasitoide Cotesia flavipes (Cam.) en Escuintla. Tesis de grado en Ingeniería Agronómica. Guatemala. 67 p.
20 Kalnay, R. A. 1984. Diatraea spp. Lepidópteros minadores de la caña de azúcar. Publicación N° 1. Serie Didáctica. Ciencias Agrarias. Facultad de Ciencias Agrarias. Universidad Nacional de Jujuy.
21 Lastra, B. L. A.; Gómez, L. A. 1988. Evaluación del efecto de algunas dietas artificiales sobre la biología de Diatraea saccharalis F. (Lepidoptera: Pyralidae) y sus parásitos. Revista Colombiana de Entomología. 14(2): 9-14. [ Links ]
22 Lastra, B. L. A.; Gómez, L. A. 2006. La cría de Diatraea saccharalis (F.) para la producción masiva de sus enemigos naturales. Cenicaña. Colombia. 36: 30p.
23 Luna L. H.; Vega Trompeta S.; Núñez A.; Carranza O. 2004. Elaboración de una dieta para la cría artificial de Utetheisa ornatrix venusta (Dalm.) (Lepidoptera: Arctiidae). Centro Agrícola. 31(1-2): 9-12. [ Links ]
24 Macedo, N.; Botelho, P. S. M.; Degaspari, N.; Almeida, L. C.; Araújo, J. N.; Magrini, E. A. 1983. Controle biológico da broca da cana-de-açúcar: Manual de Instrução. Piracicaba, Brasil. IAA/ PLANALSUCAR. 22 p.
25 Magrini, E. A.; Parra, J. R. P.; Haddad, M. L.; Botelho, P. S. M. 1995. Comparação de dietas artificiais e tipos de milho, para criação de Anagasta kuehniella (Zeller, 1879) (Lepidoptera: Pyralidae). Scientia Agrícola. 52(1): 60-64. [ Links ]
26 Marín, M. S.; Sáez, C. C.; Caballero, A. E.; Quercetti, M. J. 2006. Grapholita molesta, evaluación de dietas larvarias artificiales. Revista de la Facultad de Ciencias Agrarias de la Universidad Nacional de Cuyo. 38(2): 1-7. [ Links ]
27 Mendonca, A. F. 1996. Distribuição de Diatraea (Lep.: Pyralidae) e de seus principais parasitoides larvais no continente Americano. En: Mendoca A. F. (Ed.). Pragas de cana-de açúcar. Brasil. p. 51-82.
28 Meneguim, A. M., Parra, J.; Haddad, M. 1997. Comparação de dietas artificiais, contendo diferentes fontes de ácidos graxos, para criação de Elasmopalpus lignosellus (Zeller) (Lepidoptera: Pyralidae). Anais da Socciedade Entomológica do Brasil. 26(1): 35-43. [ Links ]
29 Murúa, M. G.; Virla, E. G.; Defagó, V. 2003. Evaluación de cuatro dietas artificiales para la cría de Spodoptera frugiperda (Lep.: Noctuidae) destinada a mantener poblaciones experimentales de himenópteros parasitoides. Boletín de Sanidad Vegetal. Plagas. 29: 43-51.
30 Nardin, R. R. 2004. Protocolo de laboratório para a produção de Cotesia flavipes e Diatraea saccharalis. Itapira, Brasil. 19p.
31 Osores, V. M.; Willink, E.; Costilla, M. A. 1982. Cría de Diatraea saccharalis F. en laboratorio. Estación Experimental Agro-Industrial "Obispo Colombres". Boletín N° 139. Tucumán. Argentina. 10 p.
32 Ostengo, S.; García, M. B.; Díaz Romero, C.; Delgado, N.; Díaz, J. V.; Cuenya, M. I. 2011. Evaluación de la estabilidad de un cultivar de caña de azúcar (Saccharum spp.) en diferentes ambientes agroecológicos a través de una técnica no paramétrica en Tucumán, Argentina. Revista Industrial y Agrícola de Tucumán. 88(2): 21-26. [ Links ]
33 Parra, J. R. P. 1996. Técnicas de criação de insetos para programas de controle biológico. 3° ed. ESALQ/FEALQ. Piracicaba, Brasil. 137 p.
34 Parra, J. R. P. 2002. Criação massal de inimigos naturais. En: Parra, J. R.; Botelho, P. S. M.; Correa Ferreira, B. S.; Bento, J. M. S. (Eds.) Controle Biológico no Brasil. Parasitóides e Predadores. São Paulo. Brasil. Editora Manole Ltda. p. 143-161.
35 Parra, J. R. P., Mihsfeldt, L. H. 1992. Comparison of artificial diets for rearing the sugarcane borer. In: Anderson, T. E.; Leppla, N. C. (Eds.). Advances in insect rearing for research and pest management. Westview Press, Boulder, CO, USA. p. 195-209.
36 Peairs, F. B.; Saunders, J. L. 1980, Diatraea lineolata y D. saccharalis: Una revisión en relación con el maíz. Agronomía Costarricense. 4(1): 123-135. [ Links ]
37 Pérez, D.; Fandos, C.; Scandaliaris, J.; Mazzone, L.; Soria, F.; Scandaliaris, P. 2007. Estado actual y evolución de la productividad del cultivo de caña de azúcar en Tucumán y el noroeste argentino en el período 1990-2007. Publicación Especial N° 34. Estación Experimental Agroindustrial Obispo Colombres. Tucumán. Argentina.
38 Pompermayer, P.; Falco, M. C.; Parra, J. R. P.; Silva Filho, M. C. 2003. Coupling diet quality and Bowman-Birk and Kunitz-type soybean proteinase inhibitor effectiveness to Diatraea saccharalis development and mortality. Entomologia Experimentalis et Applicata. 109(3): 217-224.
39 Posso Gómez, C. E. 1984. Evaluación de cinco dietas artificiales comparadas con la natural para la cria masiva de Diatraea saccharalis Fabricius. Memorias Congreso de la Sociedad Colombiana de Técnicos de la Caña de Azúcar. TECNICAÑA. Cali, Colombia. p. 145-160.
40 Rodríguez Pérez, M. A.; Beckage, N. E. 2006. Estrategias co-evolutivas de la interacción entre parasitoides y polidnavirus. Revista Latinoamericana de Microbiología. 48(1): 31-43. [ Links ]
41 Romero Sueldo, G. M.; Virla, E. G. 2009. Datos biológicos de Doru luteipes (Dermaptera: Forficulidae) en plantaciones de caña de azúcar y consumo de huevos de Diatraea saccharalis (Lepidoptera: Crambidae) en condiciones de laboratorio. Revista de la Sociedad Entomológica Argentina, 68(3-4): 359-363. [ Links ]
42 Salvadori, J. R.; Parra, J. R. P. 1990. Seleção de dietas artificiais para Pseudaletia sequax (Lep.: Noctuidae). Pesquisa Agropecuaria Brasileira, 25(12): 1701-1713.
43 Salvatore, A.; Willink, E.; Acosta, M. E.; Saleme, J. J. 2004. Infestación y pérdidas causadas por Diatraea saccharalis en caña de azúcar en Tucumán, Argentina. Actas XX Congreso Brasileiro de Entomologia, Gramado, Brasil.
44 Salvatore, A. R.; G. López; E. Willink. 2009. Plagas en el cultivo de caña de azúcar. En: Romero, E.; Digonzelli, P. A.; Scandaliaris, J. (Eds.). Manual del cañero. Estación Experimental Agroindustrial Obispo Colombres. p. 117-122.
45 Salvatore, A. R.; López, G.; Willink, E.; Ahmed, M.; Varela, L. 2008. Ataque del gusano perforador de la caña de azúcar Diatraea saccharalis en Tucumán: análisis prezafra de las campañas 2003 a 2007. Avance Agroindustrial. 29(1): 12-13.
46 Schexnayder, H. P. Jr.; Reagan, T. E.; Ring, D. R. 2001. Sampling for the Sugarcane borer (Lepidoptera: Crambidae) on Sugarcane in Louisiana. Journal of Economic Entomology. 94(3): 766-771. [ Links ]
47 Serra, G.; Trumper, E. 2006. Estimación de incidencia de daños provocados por larvas de Diatraea saccharalis (Lepidoptera: Crambidae) en tallos de maíz mediante evaluación de signos externos de infestación. Agriscientia. 23(1): 1-7.
48 Singh, P. 1974. Artificial diets for insects: a compilation of references with abstracts (1970-72). Bulletin New Zealand Department of Scientific and Industrial Research. 214: 96.
49 StatSoft, Inc. 2004. STATISTICA (data analysis software system), version 7. http://www.statsoft.com.
50 Vacari, A. M.; Souza Genovez, G.; Laurentis, V. L.; De Bortoli, S. A. 2012. Fonte proteica na criação de Diatraea saccharalis e seu reflexo na produção e no controle de qualidade de Cotesia flavipes. Bragantia. 71(3): 355-361. [ Links ]
51 Vargas, C.; Shanonn, P. J.; Taveras, R.; Soto, F.; Hilje, L. 2001. Un nuevo método para la cría masiva de Hypsipyla grandella. Manejo Integrado de Plagas. 62: 1-4.
52 Wiedenmann, R. N.; Smith, J. W.; Darnell, P. O. 1992. Laboratory rearing and biology of the parasite Cotesia flavipes (Hymenoptera: Braconidae) using Diatraea saccharalis (Lepidoptera: Pyralidae) as a host. Enviromental Entomology. 21(5): 1160-1167. [ Links ]
53 Yasem de Romero, M. G.; Salvatore, A. R.; López, G.; WIillink, E. 2008. Presencia natural de hongos hyphomycetes en larvas invernantes de Diatraea saccharalis F. en caña de azúcar en Tucumán, Argentina. Revista Industrial y Agrícola de Tucumán. 85(2): 39-42. [ Links ]
Agradecimientos
Al financiamiento, apoyo técnico y logístico del Ingenio y Refinería San Martín de Tabacal S. R. L., como parte del Proyecto "Control biológico de Diatraea saccharalis con Cotesia flavipes en extensiones cañeras del NOA", mediante convenio 2007-2010 entre el Ingenio y Refinería y la Fundación Miguel Lillo.
A. G. Ibarra, F. Trindade, P. Juncosa, S. Ovruski, P. Albornoz Medina, P. Schliserman, J. C. Díaz Ricci y G. J. Torres Leal, por el asesoramiento y estímulo sobre el manejo en laboratorio.
Al menos 45 personas colaboraron con las tareas de laboratorio desarrolladas en el CIRPON.














