Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versión On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.46 no.1 Mendoza ene./jun. 2014
Concentración de benciladenina, tipo y dosis de carbohidratos en el medio de cultivo para proliferación de brotes de Agave americana
Benzyladenine concentration, type and dose of carbohydrates in the culture medium for shoot proliferation of Agave americana
Maura Elisama Miguel Luna, José Raymundo Enríquez del Valle, Vicente Arturo Velasco Velasco, Yuri Villegas Aparicio, José Cruz Carrillo Rodríguez
Instituto Tecnológico del Valle de Oaxaca. Xoxocotlán, C. P. 71230, Oaxaca, México. lunitastar.mar@hotmail.com
Originales:
Recepción: 09/09/2012
Aceptación: 17/03/2014
Resumen
Para evaluar la proliferación in vitro de brotes de Agave americana var. oaxacensis, piezas de callo con dos a tres brotes adventicios se establecieron en diversos medios de cultivo con pH 5,8 y consistencia de gel, con sales minerales MS, 100 mg L-1 myo-inositol, diversas concentraciones de benciladenina (BA) (0, 2, 4, 6, 8 y 10 mg L-1), tipo de carbohidrato (sacarosa o jarabe fructosado) y concentración de carbohidrato (20, 30, 40 g). Los cultivos se incubaron 60 días bajo luz fluorescente blanca en 16 h luz/8 h oscuridad, temperatura 20- 28°C. El experimento se estableció según un diseño completamente al azar con arreglo factorial 6x2x3. La sacarosa resultó mejor fuente de carbohidrato que el jarabe fructosado. Los explantos en el medio de cultivo sin BA y 20 g L-1 de sacarosa formaron cuatro brotes de 10,8 cm, con raíces adventicias. Al aumentar la concentración de BA y sacarosa los explantos formaron más brotes, pero en el medio con 6 mg L-1 BA y 40 g L-1 sacarosa los explantos formaron hasta 21 brotes de 6,5 cm de tamaño. La citocinina inhibió la formación de raíces.
Palabras clave: Agave americana; Citocinina; Jarabe fructosado; Propagación in vitro; Sacarosa
Abstract
To evaluate the in vitro shoot proliferation of Agave americana var. oaxacensis, calli fragments with two or three adventitious shoots were put in different culture media with pH 5.8 and consistency of gel, containing the MS mineral salts, 100 mg L-1 myo-inositol; benzyladenine (BA) in different concentration (0, 2, 4, 6, 8 and 10 mg L-1), type of carbohydrate (sucrose or fructose syrup) and carbohydrate concentration (20, 30, 40 g L-1). Cultures were incubated for 60 days under white fluorescent light in 16 h light/8 h darkness, temperature 20-28°C. The experiment was established according to a completely randomized design with a factorial arrangement 6x2x3. The sucrose was better carbohydrate than fructose syrup. The explants in media without BA and 20 g L-1 sucrose formed four shoots with 10.8 cm tall, and formed adventitious roots. When the BA and sucrose concentration were increased the explants formed more adventitious shoots, but in the media with 6 mg L-1 BA and 40 g L-1 sucrose the esplants formed up to 21adventitious shoots which had 6.5 cm size. The cytokinin prevented the root formation.
Keywords: Agave americana; Cytokinin; Fructose Syrup; In vitro propagation; Sucrose
Introducción
En México las poblaciones rurales aprovechan diversas especies de agaves para obtener edulcorantes, elaboración de bebidas fermentadas, productos a base de fibra, usadas como combustible, materiales de construcción, ornato, papel, otros usos productivos y medicinales (14). En los Valles Centrales y Sierra Sur del estado de Oaxaca, el Agave americana var. oaxacensis, se encuentra silvestre y en pequeñas plantaciones. La cantidad de individuos que se plantan no compensa la cantidad de plantas adultas que se cosechan para su uso, como materia prima, para elaborar la bebida destilada llamada mezcal, por lo que su población ha disminuido (2, 5). Esta especie se reproduce mediante semillas, pero las plantas tardan de 18-20 años en llegar a su etapa reproductiva y los campesinos que cosechan las plantas, impiden el desarrollo de las inflorescencias, para promover la acumulación de azúcares en el tallo. La especie también se reproduce asexualmente, mediante vástagos de rizoma, y bulbilos en la inflorescencia (11).
Algunos agricultores muestran interés en propagar gran cantidad de plantas (8). El cultivo in vitro es un método eficiente para propagar especies de importancia económica (22) y para conservación de germoplasma
Las células que asumen procesos de organogénesis incrementan su actividad metabólica, su intensidad de respiración y consumo de carbohidratos (18) que se deben proporcionar en cantidades suficientes, además de los elementos minerales esenciales y otros compuestos orgánicos (28). Los agaves acumulan reservas de carbohidratos en forma de fructanos, que son cadenas de 25 a 35 unidades de fructosa unidas por enlaces glucosidicos de fructosa β (2→1) y al final de la cadena una molécula de glucosa unida a la fructosa por (1-2) como sacarosa. Cuando el tallo de una planta adulta de agave es sometida a cocción, ocurre la hidrólisis de los fructanos, quedando unidades de monosacáridos donde al menos el 96% corresponde a fructosa y 4% glucosa (3, 7). Por lo que interesa conocer si usar jarabes fructosados de agave en el medio de cultivo es apropiado para la proliferación de brotes adventicios de A. americana. Por lo anterior, el objetivo del presente trabajo fue: evaluar en la etapa de multiplicación de propágulos de Agave americana var. oaxacensis los niveles de respuesta e identificar la óptima de proliferación de brotes de calidad en función de las dosis crecientes de benciladenina, tipo y concentración de carbohidrato.
Materiales y métodos
La investigación se realizó en el laboratorio de cultivos de tejidos vegetales del Instituto Tecnológico del Valle de Oaxaca, México, en 17°04' N, 96°46' O y 1550 m s. n. m. (19), con material vegetal colectado en la zona de Ocotlán, del Estado de Oaxaca.
Racimos de 6 a 10 brotes adventicios obtenidos in vitro a partir de tejido de tallo, se mantenían en la etapa de multiplicación de propágulos en frascos de vidrio de 145 cm3 con 20 mL de medio de cultivo con consistencia de gel preparado con las sales minerales de Murashige y Skoog (23) (MS); 0,4 mg L-1 de Tiamina, 100 mg L-1 de myo-inositol, 30 g L-1 de sacarosa y 1.0 mg L-1 de benciladenina (BA). El pH se ajustó a 5,8 antes de agregar 5,4 g L-1 de agar.
Los cultivos se incubaron durante 60 días bajo luz fluorescente blanca, a 100 μmol m-2 s-1, en fotoperiodos de 16 h y 8 h de oscuridad, la temperatura en el rango de 20 a 28°C. En condiciones asépticas, los racimos de 6 a 10 brotes se separaron en racimos de 2 a 3 brotes para establecerlos en frascos de 145 cm3 con 25 ml de medio de cultivo preparado con una mezcla de sustancias en cantidad similar a todos los tratamientos, las sales minerales de MS (23), 0,4 mg L-1 de tiamina-HCl, 100 mg L-1 de myo-inosiltol; 1) diversas concentraciones de benciladenina (BA) (0, 2, 4, 6, 8, y 10 mg L-1); 2) dos tipos de carbohidrato (sacarosa o jarabe fructosado obtenido de piñas de agave sometidas a cocción a 70-90°C durante 72 h para hidrolizar los fructanos) y 3) concentraciones de cada carbohidrato (20, 30 y 40 g L-1).
El experimento se estableció según el diseño completamente al azar y arreglo factorial 6x2x3 (dosis de BA, tipo de carbohidrato, concentración de carbohidrato) resultando 36 tratamientos. La unidad experimental fue un fragmento de callo compacto del que surgían de dos a tres brotes, establecido en un frasco de cultivo y se tuvieron 10 repeticiones por tratamiento. Cuando transcurrieron los 60 días se cuantificó el número de brotes que se formaron a partir del callo, número de hojas y tamaño del brote mayor, el peso fresco y seco de callo+ brotes, de las raíces y total (callo+ brotes + raíces). Las raíces se separaron de los brotes y para cuantificar su volumen se sumergieron en un volumen conocido de agua en una probeta de 5 mL con graduaciones de 0,1mL. Para determinar el peso seco del callo + brotes y peso seco de raíces, se colocaron por separado en bolsas de papel y durante 72 h en estufa de convección a 70°C. Transcurrido este tiempo, se pesaron en balanza analítica con precisión de 0,1 mg. Los datos se sometieron a análisis de varianza y comparación de medias (Tukey, α = 0,05).
Resultados y discusión
Al iniciar el experimento los explantos tenían de dos a tres brotes en una base común de callo compacto y el brote más grande tenía 2,5 cm de altura. Durante los 60 días ocurrió la proliferación de brotes y raíces, pero se observaron efectos de las distintas dosis de BA, el tipo y concentración de carbohidratos, sobre la cantidad de brotes, tamaño del brote mayor y formación de raíces adventicias.
Los análisis de varianza mostraron que la dosis de benciladenina tuvo efectos altamente significativos (P ≤ 0,01) en la cantidad de nuevos brotes que se formaron, tamaño del brote mayor, número de hojas, peso fresco de las raíces, volumen de raíz, peso seco de la raíz y peso seco total; también tuvo efectos significativos (P ≤ 0,05) en el peso fresco de callo + brotes y peso fresco total (tabla 1).
Tabla 1. Análisis de varianza de la formación de brotes en explantos de Agave americana var. oaxacensis cultivados in vitro en medios de cultivos con cantidades diferentes de la citocinina benciladenina (BA), dosis y tipo de carbohidrato.
Table 1. Analysis of variance of shoot formation in explants of Agave americana var. oaxacensis cultured in vitro in culture media containing different amounts of the cytokinin benzyladenine (BA), dose and type of carbohydrate.

Se debe establecer el nivel hormonal exógeno adecuado para una especie particular que influya positivamente en la formación de brotes (13, 17, 20).
Los resultados confirman los efectos descritos para las citocininas pero muestran que la dosis para la respuesta óptima depende de la especie, que en el caso de la propagación in vitro de Agave cocuy, se determinó que al incrementar la dosis de BA de 0 a 1,0 mg L-1 en el medio de cultivo, se formó mayor cantidad de brotes y la BA inhibió la formación de raíces (29). Para la propagación in vitro de A. karwinskii, se obtuvo que la mayor cantidad de brotes se formó en los explantos establecidos en medios de cultivo con 1,0 mg L-1 de BA (9), mientras que la mayor cantidad de nuevos brotes de Agave inaequidens ocurrió en explantos establecidos en medio de cultivo con 10 mg L-1 de BA (1). En el presente trabajo, al incrementar la dosis de BA a cantidades mayores que 6 mg L-1 no ocurrió la formación de cantidades adicionales de brotes, pero los brotes obtenidos fueron cada vez más pequeños. Al final del periodo de incubación los explantos establecidos en medios de cultivo con 0, 2, 4, 6 y 8 mg L-1 BA formaron en promedio 6,4; 8,4; 10,4; 11,8 y 11,7 nuevos brotes, respectivamente (tabla 2).
Tabla 2. Características de propágulos en función de niveles de factores principales.
Table 2. Propagule characteristics depending on levels of major factors.

La sacarosa en el medio de cultivo es necesaria para que los propágulos aumenten tanto su peso fresco y materia seca (21). Pero cantidades de 20 g (60 mM), 30 g (87,7 mM) y 40 g (116,9 mM) de sacarosa en el medio de cultivo, el potencial osmótico del medio es -0,31; -0,45 y -0,60 MPa y si la cantidad de macronutrimentos de MS (23) crea un potencial osmótico de -0,23 MPa, los potenciales osmóticos combinados de los medios con cantidades diferentes de sacarosa serian -0,54 ; -0,68 y -0,83 MPa, respectivamente, que limita la absorción de agua, pero se favorece el ingreso de sacarosa y con ello el aumento de materia seca (4). En medios de cultivo con potencial osmótico más negativo que -0,3 MPa, los cultivos in vitro cesan el crecimiento y organogénesis (26). Lo cual no ocurrió en el presente trabajo.
Las dosis de carbohidratos en los medios de cultivo mostraron diferencias de efecto altamente significativas (P ≤ 0,01) para la mayoría de las variables a excepción del volumen de raíz. El tipo de carbohidrato tuvo efectos altamente significativos (P ≤ 0,01) en número de brotes, tamaño del brote mayor, número de hojas, peso fresco de callo + brotes, peso fresco total, volumen de raíz, peso seco de callo + brotes, peso seco de raíz y peso seco total. La interacción de benciladenina y dosis de carbohidrato mostró efectos altamente significativos (P ≤ 0,01) en el número de brotes, número de hojas, peso fresco de callo + brotes, peso fresco de raíz, peso fresco total, peso seco de raíz y el peso seco total. La interacción benciladenina y tipo de carbohidrato tuvo efecto altamente significativo (P ≤ 0,01) en la cantidad de brotes adventicios que se formaron, tamaño del brote mayor, número de hojas, volumen de raíz y el peso seco de raíz (tabla 1, pág. 100). La interacción dosis de carbohidrato y tipo de carbohidrato fue altamente significativo (P ≤ 0,01) para la mayoría de las variables excepto para el peso fresco de raíz. La triple interacción mostró efectos altamente significativos (P ≤ 0,01) para número de brotes, tamaño del brote mayor, número de hojas, volumen de raíz, y peso seco de raíz (tabla 1, pág. 100).
En los explantos ocurrió la formación de cada vez mayor cantidad de brotes y hojas, pero de menor tamaño conforme se incrementó la concentración de BA hasta 6 mg L-1, de tal manera que los explantos establecidos en los medios de cultivo sin BA y en los que se agregó 6 mg L-1 de BA se formaron en promedio 6,4 y 11,8 brotes adventicios, de 9,3 y 7,0 cm, que tuvieron 20 y 23 hojas, cantidades significativamente (Tukey, α = 0,05) diferentes.
Los propágulos en medios de cultivo con sacarosa formaron más brotes adventicios y hojas, los brotes fueron más grandes, y el peso fresco y seco del callo + brotes fueron superiores, en comparación con los propágulos establecidos en los medios de cultivo con jarabe fructosado (tabla 2, pág. 101). También, conforme se incrementó desde 20 a 40 g L-1 la concentración de carbohidrato en el medio de cultivo ocurrió la formación de cada vez mayor cantidad de brotes adventicios y más hojas pero de menor tamaño. De tal manera que en los explantos establecidos en el medio con 20 g L-1 y los explantos en el medio de cultivo de 40 g L-1 de carbohidrato, ocurrió la formación de 7,1 y 12,3 brotes adventicios, de 8,2 y 6,6 cm de tamaño, respectivamente, que en cada caso fueron valores significativamente diferentes (Tukey, α = 0,05) (tabla 2, pág. 101).
El efecto de las interacciones sobre la formación de brotes podría deberse a que, si bien la citocinina desempeña un papel importante para inducir la formación de nuevos brotes, el proceso de organogénesis consume energía proporcionado por los carbohidratos. De tal manera que 6 mg L-1 de BA y 40 g L-1 de sacarosa en el medio de cultivo fue una condición apropiada para la formación de mayor cantidad de brotes adventicios de Agave americana var. oaxacensis en la etapa de multiplicación de propágulos (tabla 3, pág. 103).
Tabla 3. Características de los propágulos de Agave americana variedad oaxacensis obtenidos in vitro después de 60 días de incubación en medios de cultivo con diferentes dosis de benciladenina, diferentes tipos y concentraciones de carbohidratos.
Table 3. Characteristics of the Agave americana var. oaxacencis propagule obtained in vitro after 60 days of incubate them in culture media with different doses of benzyladenine, different types and concentrations of carbohydrate.
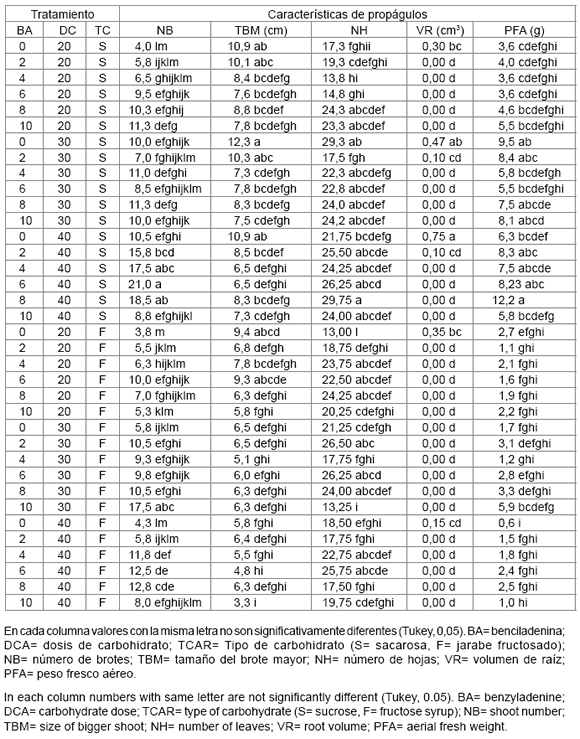
En los explantos establecidos en los medios de cultivo sin citocinina y con 20 a 40 g L-1 de sacarosa se formó la menor cantidad de brotes adventicios, pero estos brotes fueron los más grandes y eventualmente formaron raíces adventicias (tabla 3, pág. 103), por lo que transcurridos 60 días de incubación en esta condición se tuvieron plantas que pudieron ser trasplantadas a condiciones ex vitro.
Conforme se aumentó la concentración de sacarosa en el medio de cultivo sin citocinina el tamaño de las raíces fue mayor, de tal manera que los brotes en los medios de cultivo sin BA y 20 g de sacarosa y los brotes en el medio sin BA y con 40 g L-1 de sacarosa, sus raíces fueron de 0,30 y 0,75 cm3, respectivamente (tabla 3, pág. 103). Por lo anterior esta condición de medios de cultivo se podría usar para preparar a los propágulos para su trasplante a suelo.
Para el enraizado in vitro de brotes de Agave angustifolia, Enríquez del Valle et al., (10) encontraron que los brotes mejoraron su respuesta de formación de raíces adventicias cuando se establecieron en medios de cultivo con las sales minerales disminuidas hasta 50% y con 1 mg L-1 de ácido indolbutírico. Los resultados obtenidos en los trabajos citados y la presente investigación sugieren la posibilidad de evaluar el efecto combinado de dos o más factores del ambiente de cultivo en una respuesta determinada de desarrollo vegetal.
Posterior a la presente investigación, brotes que se obtuvieron en medios de cultivo con benciladenina y 40 g L-1 de sacarosa, se transfirieron durante 25 días a un medio de cultivo sin benciladenina pero con la auxina ácido indilbutírico (AIB) para inducir la formación de raíces adventicias. Las plantas que se obtuvieron se transfirieron a macetas con sustrato y condiciones de invernadero donde se adaptaron y mostraron desarrollo normal (foto, pág. 105).

Foto. Propagación de Agave americana var. oaxacensis: a) incubación de cultivos in vitro en etapa de multiplicación de propágulos; b) brotes múltiples que surgen a partir de una base de callo; c) planta obtenida in vitro; d) plantas microropagadas durante su aclimatización en invernadero.
Photo. Propagation of Agave americana var. oaxacensis: a) incubation of in vitro cultures in propagule multiplication stage; b) multiple shoots formed from a calli base; c) plant obtained in vitro; d) acclimatization in greenhouse of micropropagated plants.
Conclusiones
En todos los explantos que se establecieron durante 60 días en las diferentes condiciones de medio de cultivo, durante este período se formaron nuevos brotes adventicios. La dosis de BA desempeñó un papel importante para inducir la formación de nuevos brotes, pero el tipo y dosis de carbohidratos fue complementaria a la BA para obtener la máxima cantidad de brotes. El medio de cultivo con 6 mg L-1 de benciladenina y 40 g L-1 de sacarosa, fue la mejor condición para que se formaran nuevos brotes de Agave americana var. oaxacensis, en cantidad cinco veces la cantidad de brotes con que se inició el cultivo de multiplicación de propágulos. En el medio de cultivo sin BA y con 20 a 30 g L-1 de sacarosa ocurrió la menor formación de brotes pero estos fueron más grandes y eventualmente formaron raíces adventicias, por lo que ésta podría ser una condición de preparación de los propágulos para su trasplante a suelo.
1 Aureoles-Rodríguez, F.; Rodríguez de la O., J. L.; Legaria-Solano, J. P.; Sahagún-Castellanos, J.; Peña- Ortega, M. G. 2008. Propagación in vitro del maguey bruto (Agave inaequidens Koch), una especie amenazada de interés económico. Revista Chapingo. Serie Horticultura. 14(3): 263- 269. [ Links ]
2 Barraza-Morales, A.; Sánchez-Teyer, F. L.; Robert, M.; Esqueda, M.; Gardea, A. 2006. Variabilidad genética en Agave angustifolia Haw. de la Sierra Sonorense, México, determinada con marcadores AFLP. Rev. Fitotec. Mex. Vol 29(1): 1-8. [ Links ]
3 Bautista-Justo, M.; García-Oropeza, L.; Salcedo-Hernández, R.; Parra-Negrete, L. A. 2001. Azúcares en agaves (Agave tequilana weber) cultivados en el Estado de Guanajuato. Acta Universitaria. 11(1): 33-38. [ Links ]
4 Cárdenas, L. A.; Villegas, M. A. 2002. Potencial osmótico del medio de cultivo con diferentes componentes para la propagación in vitro. Rev. Fitotec. Mex. 25: 213-217. [ Links ]
5 Cervera, F.; Fagoaga, M.; Duran-Vila, C.; Peña, N. L. 2004. Applications of biotechnology to citrus improvement in Spain. Acta Horticulturae. 632: 221-234. [ Links ]
6 Chee, R.; Pool, R. M.; Bucher, D. 1984. A method for large scale in vitro propagation of vitis. New York's Food and Life Sciences Bulletin. 109: 1- 9. [ Links ]
7 Coronado-González, R. I.; Pelayo-Ortiz, C.; González-Álvarez, V.; Zuñiga-Partida, V. 2005. Optimización de la producción de inulinasas por saccharomyce ssp. a partir de Agave tequilana Weber variedad azul. e-Gnosis. 3(8): 1-10.
8 Domínguez, R. M. S.; González, J. M. L.; Rosales, G. C.; Quilloñes, V. C.; Delgadillo, D. L. S.; Mireles, O. J.; Pérez, M. B. E. 2008 (a). El cultivo in vitro como herramienta para el aprovechamiento, mejoramiento y conservación de especies del género Agave. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes. Aguascalientes, México. 16(41): 53- 62.
9 Domínguez, R. M. S.; Alpuche, S. A. G.; Vasco, M. N. L.; Molphe, B. E. P. 2008 (b). Efecto de citocininas en la propagación in vitro de Agaves Mexicanos. Revista Fitotecnia Mexicana. 31(4): 317- 322. [ Links ]
10 Enríquez del Valle, J. R.; Carrillo-Castañeda, G.; Rodríguez de la O., J. 2005. Sales inorgánicas y ácido indolbutírico en el enraizamiento in vitro de brotes de Agave angustifolia. Revista Fitotecnia Mexicana. 28: 175-178.
11 Enríquez del Valle, J. R. 2008. La propagación y crecimiento de agaves. Fundación Produce Oaxaca A.C. Instituto Tecnológico del Valle de Oaxaca. México. 46 p.
12 Enríquez del Valle, J. R.; Estrada Silias, A.; Rodríguez Ortíz, G.; Velasco Velasco, V. A.; Campos Ángeles, G. V. 2013. Sustrato y dosis de fertirriego en la aclimatización de vitroplantas de Agave americana var. oaxacencis. Revista de la Facultad de Ciencias Agrarias de la Universidad Nacional de Cuyo. Mendoza. Argentina. 45(2): 341-348
13 Fehér, A.; Pasternak, T. P.; Dudits, D. 2003. Transition of somatic plant cells to an embryogenic state. Plant Cell, Tissue and Organ Culture. 74(3): 201-228. [ Links ]
14 García, M. A. J. 2007. Los Agaves de México. Jardín Botánico. Instituto de Biología. Universidad Autónoma de México. México. Revista Ciencias. 87: 14- 23.
15 Garriga-Caraballo, M.; González-Oramas, G.; Alemán-García, S.; Abreu-Cruz, E.; Quiroz-Bravo, K.; Caligari, P. D. S.; García-González, R. 2010. Management of auxin-cytokinin interactions to improve micropropagation protocol of henequén (Agave fourcroydes Lem). Chilean Journal of Agricultural Research. 70(4): 545-551.
16 Gonzáles, G.; Alemán, S.; Barredo, F.; Robert, M. L. 2001. Embriogénesis Somática en Agave fourcroydes Lem. Biotecnología Vegetal. 2(1): 3-8
17 Haberer, G.; Kieber, J. J. 2002. Cytokinins. New Insights into a Classic Phytohormone. Revista. American Society of Plant Biologists. Department of Biology, University of North Carolina, Chapel Hill, North Carolina. Vol. 128. p. 354-362.
18 Harrar, Y.; Bellec, Y.; Bellini, C.; Faure, J. D. 2003. Hormonal Control of Cell Proliferation Requires Pasticcino Genes. Physiol Plant. 132: 1217-1227. [ Links ]
19 INEGI. 2005. Principales resultados por localidad. II conteo de población y vivienda. World Wide Web electrónica publicación. http://www.inegi.gob.mx/est/contenidos/esmand/conteo2005/iter2005/ selentcampo.aspx.
20 Jankiewicz, L. S. 2003. Reguladores de crecimiento, desarrollo y resistencia en plantas. Propiedades y acción. Ed. Mundi-Prensa. México, D. F. 487 p.
21 Kubota, C.; Ezawa, M.; Kozai, T.; Wilson, S. B. 2002. In situ estimation of carbon balance of in vitro sweet potato and tomato plantlets cultured with varying initial sucrose concentrations in the medium. J. Am. Soc. Hort. Sci. 127: 963-970. [ Links ]
22 Martínez-Palacios, A.; Ortega, L. M. P.; Chávez, V. M.; Bye, R. 2003. Somatic embryogenesis and organogenesis of Agave victoriae-reginae: Considerations for its conservation. Plant Cell Tiss. Organ Cult. 74: 135-142.
23 Murashige, T.; Skoog, F. 1962. A revised médium for rapid growth and bioassays with Tobacco Tissue cultures. Physiol. Plant. 15: 473- 497.
24 Nikam, T. D.; Bansude, G. M.; Aneesh-Kumar, K. C. 2003. Somatic embryogenesis in sisal (Agave sisalana Perr. ex Engelm). Plant Cell Rep. 22: 188-194. [ Links ]
25 Pedrosa-Manrique, A.; Tupaz-Villacorte, J.; Wiliam, A. 2008. Micropropagación de llexkunthiana Triana y Planchon (Aquifoliacea), una especie de gran importancia en programas de revegetación. Revista Colombiana de Biotecnológica. 10(2): 72-84. Colombia.
26 Pierik, R. L. M.; Steegmans, H. H. M. 1975. Analysis of adventitious root formation in isolated stem explants of Rhododendron. Scientia Hort. 3: 1-20. [ Links ]
27 Ramírez, B. I. I. 1999. Biología Celular. Grupo Editorial Éxodo. 253 p.
28 Ruzéicå, D.; Saricå, M.; Cerovicå, R.; Cåulaficå, L. 2000. Relationship between the concentration of macroelements, their uptake and multiplication of cherry rootstock Gisela 5 in vitro. Plant Cell, Tiss. Organ Cult. 63: 9-14.
29 Salazar, E.; González, P.; Hernández, C. 2009. Multiplicación in vitro de Agave cocui Trelease a través de yemas axilares. Agronomía tropical. 59(2): 1-12.
30 Valenzuela-Sánchez, K. K.; Juárez-Hernández, R. E.; Cruz-Hernández, A.; Olalde-Portugal, V.; Valverde, M. E.; Paredes-López, O. 2006. Plant regeneration of Agave tequilana by indirect organogenesis. In vitro cell. Dev. Biol. Plant. 42: 336-340. [ Links ]














