Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versión On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.46 no.2 Mendoza dic. 2014
ARTICULO ORIGINAL
Control biológico de Fusarium graminearum: utilización de Trichoderma spp. y biofumigación con parte aérea de Brassica juncea
Biological control of Fusarium graminearum: use of Trichoderma spp. and biofumigation with aerial part of Brassica juncea
Omar Salvador Perniola 1, Sebastián Staltari 1, Silvia Elena Chorzempa 2, Marta Mónica Astiz Gassó 1, María del Carmen Molina 1, 3
1 Instituto Fitotécnico de Santa Catalina, Facultad de Ciencias Agrarias y Forestales, Universidad Nacional de la Plata. Garibaldi 3400, Llavallol, C. P. 1836, Buenos Aires, Argentina. omarperniola@yahoo.com.ar
2 Facultad de Ciencias Agrarias, Universidad Nacional de Lomas de Zamora. Ruta N° 4, Km 2, Llavallol, C. P. 1836, Buenos Aires, Argentina.
3 CONICET
Originales: Recepción: 16/08/2013 - Aceptación: 27/06/2014
RESUMEN
Los objetivos de este trabajo fueron: determinar la factibilidad de la utilización combinada de dos métodos de control biológico: la aplicación del hongo antagonista Trichoderma spp. y la biofumigación con la parte aérea de Brassica juncea en el estadio de fin de fructificación; evaluar su efecto sobre el crecimiento del patógeno Fusarium graminearum. Se trituraron plantas de B. juncea y se colocaron en recipientes de plástico en dosis de 5 y 10 g. Sobre el material triturado se apoyó una caja de Petri con agar papa glucosado al 2%, que contenía un disco con micelio de F. graminearum o Trichoderma spp. o ambos hongos. Los recipientes de plástico se cerraron e incubaron a 25±2°C en oscuridad durante 7 días. Finalizado este período, se midió el diámetro de las colonias. Se obtuvieron los siguientes resultados: i) cuando se biofumigaron por separado, no se observó efecto fungistático de B. juncea sobre Trichoderma spp. ni sobre F. graminearum; ii) en ausencia del biofumigante, Trichoderma spp. inhibió significativamente el crecimiento de las colonias de F. graminearum, iii) la combinación de Trichoderma spp. y la biofumigación con B. juncea mostró un efecto sinérgico sobre el control del crecimiento miceliar de F. graminearum. Los resultados in vitro sugieren que el crecimiento de Trichoderma spp. y su potencial efecto de biocontrol sobre F. graminearum, no son afectados por la biofumigación con B. juncea. La utilización combinada de Trichoderma spp. y la biofumigación con B. juncea, tendría un efecto sinérgico sobre el control del crecimiento de F. graminearum.
Palabras clave: In vitro; Cultivo dual; Antagonismo; Biocontrol; Biofumigación; Brassicáceas
ABSTRACT
The aims of this work were: to determine feasibility of the combination of two biological control methods: application of antagonistic fungus Trichoderma spp. and biofumigation with the aerial part of Brassica juncea in the end of fruiting stage; to evaluate their effect on the growth of the pathogen Fusarium graminearum. Two doses (5 and 10 g) of triturated plant material from B. juncea were placed in plastic recipients. Petri dishes with potato glucose agar medium 2% and a disc inoculated with F. graminearum, or Trichoderma spp. or both fungi, were placed on top of the plant material. Plastic recipients were then closed and incubated at 25±2°C in darkness for 7 days. After that, the diameter of the colonies was measured. The results indicated that: i) when Trichoderma spp. and F. graminearum were biofumigated separately, fungistatic effect was not observed, ii) without biofumigant, Trichoderma spp. significantly inhibited growth of F. graminearum colonies, iii) the combination of Trichoderma spp. and the biofumigation with B. juncea showed synergic effect on growth control of F. graminearum. These in vitro results suggest that the growth of Trichoderma spp. And its potential biocontrol effect of F. graminearum, are not affected by biofumigation with B. juncea. Also, the combination of Trichoderma spp. and biofumigation with B. juncea, would have synergic effect on growth control of F. graminearum.
Keywords: In vitro; Dual culture; Antagonism; Biocontrol; Biofumigation; Brassicaceae
INTRODUCCIÓN
La mayoría de las plantas cultivadas sufren enfermedades causadas por hongos de distintas especies del género Fusarium (30). Particularmente, Fusarium graminearum Schwabe [Teleomorfo Gibberella zeae (Schw.) Petch.] es un patógeno vegetal de significativa importancia económica. Entre las enfermedades que provoca en trigo y otros cereales de invierno se destacan: la fusariosis de la espiga, el pietín y el tizón de plántulas; en maíz causa la podredumbre de la espiga y del tallo (24, 26). En el cultivo de trigo este patógeno adquiere características particularmente deletéreas porque afecta tanto el rendimiento como la calidad de los granos (poder germinativo, vigor, contenido de proteínas, aptitud panadera de la harina y otros parámetros tecnológicos). Al margen de estas deficiencias, la consecuencia más seria de la fusariosis de la espiga de trigo es la contaminación de los granos y sus derivados, con micotoxinas (30).
Fusarium graminearum sobrevive en el suelo en tejidos vivos y muertos, y sus ascosporas, macroconidios, clamidosporas y fragmentos de micelio sirven como inóculo, siendo el rastrojo la fuente de propágulos más significativa (6). En el caso particular de la fusariosis de la espiga de trigo, se emplean diferentes estrategias para su control, que incluyen la utilización de semillas sanas, la rotación de cultivos, la aplicación de fungicidas, el empleo de cultivares resistentes y diferentes prácticas de labranza; no obstante ninguna de estas estrategias aplicadas en forma independiente es capaz de reducir considerablemente el impacto de esta enfermedad (24).
Los métodos de control biológico, integrados a las prácticas culturales, podrían colaborar en la prevención y en la disminución de la incidencia y severidad de las enfermedades provocadas por este patógeno. En este aspecto, se presentan como métodos promisorios la biofumigación y la aplicación del hongo antagonista Trichoderma spp. (24, 31, 40).
La biofumigación puede definirse como el control de plagas y patógenos edáficos por medio de la liberación en el suelo de compuestos, en su mayoría volátiles, originados por la descomposición de residuos orgánicos (15). Como biofumigantes se pueden emplear estiércoles, residuos agroindustriales y de cosechas, incorporación de plantas de Brassicáceas, sorgo, maíz, etc. Durante el proceso de biofumigación, como resultado de la descomposición del material orgánico, se generan en el suelo sustancias con actividad biocida como amonio, ácido acético, compuestos azufrados, etc. Además, si se incorporan al suelo plantas de Brassicáceas, los glucosinolatos presentes en sus tejidos (21), se hidrolizan por la acción de la enzima mirosinasa y se producen diferentes tipos de isotiocianatos, con variable grado de toxicidad frente a hongos patógenos u otros organismos (16, 18, 28, 42). Entre las especies de Brassicáceas más estudiadas como biofumigantes se encuentra Brassica juncea L. Czerniak (mostaza parda), que ha demostrado tener efecto fungistático sobre diversos hongos fitopatógenos: Fusarium sambucinum Fuckel (23, 25), Pythium ultimum Trow (8, 23), Rhizoctonia solani Kühn (8, 23, 38), Phytophthora spp. (13, 23, 43), Verticillium dahliae Kleb. (11, 27), Fusarium oxysporum Schlechtend.: Fr. f. sp. lycopersici (Sacc.) W. C. Snyder & H. N. Hansen (11), Sclerotinia sclerotiorum (Lib.) de Bary (23), Sclerotinia minor Jagger (10), F. graminearum (31), etc.
Gran variedad de especies fúngicas han sido evaluadas como agentes biocontroladores, no obstante Trichoderma spp. se destaca claramente en este tipo de estudios por su facilidad de cultivo y el amplio rango de patógenos que controla (40). Los hongos del género Trichoderma son frecuentes en todo el mundo y pueden aislarse fácilmente desde el suelo, de troncos caídos y de otros restos vegetales en descomposición. Clasificados dentro de los hogos imperfectos, poseen una elevada tasa de crecimiento y producen un gran número de esporas asexuales (conidios) de color verde o blanco a partir de células conidiógenas situadas en el extremo de conidióforos ampliamente ramificados (17, 19). Varias especies de este género son de importancia económica dado que sintetizan enzimas industriales (como celulasas y hemicelulasas) y antibióticos. Además poseen acción biocontroladora (22), como consecuencia de la elevada tasa de crecimiento, la producción de metabolitos con actividad antibiótica y la manifestación de micoparasitismo ante diversos patógenos (17). La actividad lítica sobre las paredes celulares de los hongos, debida a la acción de las enzimas 1,3-β-glucanasa y quitinasa, es uno de los principales mecanismos responsables de la actividad antagonista sobre patógenos de suelo (36). Adicionalmente, en algunas especies del género Trichoderma se reportó la capacidad de inducir resistencia en plantas como otro mecanismo de biocontrol (7, 41).
Diversos autores determinaron la capacidad biocontroladora de distintas especies del género sobre un amplio rango de patógenos. Trichoderma harzianum Rifai, posiblemente la especie más estudiada, manifestó efecto antagonista sobre R. solani, Sclerotium rolfsii Sacc., Phytium aphanidermatum (Edson) Fitz (36), Aphanomyces cochlioides Drechsler, Phoma betae (A. B. Frank), Acremonium cucurbitacearum Alfaro-García, W. Gams et J. García-Jiménez, F. oxysporum f. sp. radicis lycopersici Jarvis & Shoemaker (17), F. oxysporum f. sp. asparagi S.I. Cohen & Heald (2), F. oxysporum f. sp. cumini (Foc), Alternaria burnsii Uppal, Patel & Kamat (12), Phytophtora capsici Leonian, Pyrenophora tritici- repentis (Died.) Drechsler, P. ultimum, S. sclerotiorum (40), Phytophtora nicotianae Breda de Haan (37) y Colletotrichum dematium (Pers. ex Fr.) Grove (35). Asimismo, Trichoderma hamatum (Bonord.) Bain. exhibió efecto biocontrolador sobre R. solani; Trichoderma longibrachiatum Rifai sobre P. ultimum; Trichoderma viride Pers. ex Fr. sobre R. solani; Trichoderma virens (Miller, Giddens & Foster) v. Arx sobre Pythium arrhenomanes Drechsler, P. ultimum, R. solani, F. graminearum (40), F. o. cumini y A. burnsii (12); Trichoderma gamsii Samuels & Druzhinina y Trichoderma velutinum Bissett, C.P. Kubicek & Szakacs manifestaron biocontrol sobre Fusarium culmorum (W. G. Sm.) Sacc. y F. graminearum (24).
Los conocimientos actuales sobre la técnica de biofumigación refieren principalmente al biocontrol de organismos perjudiciales para los cultivos, pero es limitada la información relativa a su efecto sobre la flora y fauna benéfica. En este aspecto, los antecedentes del efecto de la biofumigación sobre hongos del género Trichoderma son escasos. Kirkegaard & Matthiessen (2004) argumentaron que son necesarias bajas concentraciones de isotiocianatos para detener el crecimiento de ciertos patógenos como Sclerotinia spp. o Pythium spp., pero para afectar a Trichoderma spp. se requieren dosis treinta veces superiores. En pruebas in vitro, Sanchi et al. (2005) observaron que S. sclerotiorum y S. minor fueron más sensibles que la cepa T39 de T. harzianum a los isotiocianatos liberados por Brassica carinata Braun. Por otro lado, Dandurand et al. (2000) reportaron que la biofumigación con Brassica napus L. puede ser incompatible en combinación directa con T. harzianum.
Objetivos
• Determinar la factibilidad de la utilización combinada de dos métodos de control biológico: la aplicación del hongo antagonista Trichoderma spp. y la biofumigación con B. juncea.
• Evaluar su efecto sobre el crecimiento del patógeno F. graminearum.
MATERIALES Y MÉTODOS
Material vegetal y fúngico
El material vegetal utilizado para la biofumigación fue la parte aérea de plantas de B. juncea (mostaza parda), cultivadas en el campo experimental del Instituto Fitotécnico de Santa Catalina (IFSC), Llavallol, Argentina. El cultivo se sembró en mayo de 2012; cuando alcanzó el estadio de fin de fructificación (en octubre del mismo año), se cosechó la parte aérea.
La cepa de F. graminearum utilizada fue la LM2010, identificada por el Instituto Fitotécnico de Santa Catalina y el Centro de Referencia de Micología, Universidad Nacional de Rosario (CEREMIC - UNR).
El hongo Trichoderma spp. se obtuvo del producto comercial Biagro TL® (5 x 108 conidios de Trichoderma spp. x ml-1), formulado biológico generado a través de un convenio de vinculación tecnológica entre el IFSC y el laboratorio Biagro S. A., a base de cepas nativas aisladas del campo experimental del IFSC (3, 4, 5).
Procedimientos in vitro
Evaluación del efecto biofumigador de B. juncea sobre Trichoderma spp. y F. graminearum.
El ensayo realizado para determinar el efecto biofumigador de B. juncea sobre el crecimiento de Trichoderma spp. y de F. graminearum se basó en la metodología llevada a cabo por otros autores para probar la eficacia de fungicidas volátiles sintéticos y biofumigantes (8, 13, 25, 33, 43). Los dos tercios superiores de la parte aérea de las plantas de B. juncea se segaron y llevaron al laboratorio. El material cosechado se lavó con agua destilada estéril, se cortó en trozos pequeños y se trituró en una procesadora durante aproximadamente un minuto. El material triturado se colocó en recipientes de plástico de 900 ml, en dos dosis de 5 y 10 g.
Previamente, las cepas de Trichoderma spp. y F. graminearum se multiplicaron por separado en medio agar papa glucosado (APG) al 2%, durante siete días a 25±2°C y oscuridad. Se extrajeron discos del cultivo de 5 mm de diámetro de la parte más externa de las colonias y de activo crecimiento micelial, y se transfirieron de a uno a cajas de Petri con medio APG al 2%. Las cajas de Petri con un disco de F. graminearum o de Trichoderma spp. se colocaron de a una dentro de los recipientes que contenían el biofumigante, apoyadas sobre soportes de plástico, quedando elevadas 2 a 3 cm por encima del material vegetal triturado. Los recipientes se cerraron con tapas plásticas. Para el tratamiento control se siguió la misma técnica pero no se utilizó material vegetal biofumigante.
Determinación del biocontrol de Trichoderma spp. sobre F. graminearum
Para analizar el potencial antagónico de Trichoderma spp. sobre F. graminearum se utilizó la técnica de cultivo dual (29). Se colocaron en cajas de Petri con medio de cultivo APG al 2%, un disco de 5 mm de diámetro de F. graminearum y otro de Trichoderma spp., ubicados a una distancia de 4 cm uno del otro. Las cajas de Petri se colocaron dentro de recipientes de plástico de 900 ml y éstos se cerraron con tapas.
Estudio de la combinación de Trichoderma spp. y la biofumigación con B. juncea para el control de F. graminearum
Para evaluar el efecto conjunto de Trichoderma spp. y la biofumigación con B. juncea sobre el crecimiento de F. graminearum, se utilizó el cultivo dual combinado con la técnica de biofumigación, anteriormente descriptos. Incubación En todos los ensayos, los recipientes de plástico con sus respectivos contenidos fueron incubados en cámara de crecimiento durante siete días, a 25±2°C y oscuridad.
Evaluaciones
Finalizado el período de incubación, se midieron y analizaron los diámetros de las colonias de ambos microorganismos. En el cultivo dual se realizaron observaciones microscópicas en la zona de interacción de ambos microorganismos para identificar mecanismos antagónicos. A fin de evaluar el efecto combinado de Trichoderma spp.
-
mediante la siguiente fórmula (32, 39):
I=[(C-T)/C]x100
donde:
C = diámetro de la colonia del patógeno en el control
T = diámetro de la colonia del patógeno tratada con Trichoderma spp. y el biofumigante B. juncea
Diseño experimental y análisis estadístico
Se utilizó un diseño completamente aleatorizado con cinco repeticiones por tratamiento. El tratamiento de los datos se realizó mediante un ANOVA simple y la comparación de medias con la prueba de Tukey. Cuando los datos no cumplieron los supuestos de normalidad, homocedasticidad y aleatoriedad, se aplicó estadística no paramétrica mediante la prueba de Kruskal-Wallis. Los datos se analizaron con el programa Statistica 7.
RESULTADOS Y DISCUSIÓN
Efecto de la biofumigación con B. juncea sobre Trichoderma spp.
En todos los tratamientos, el hongo Trichoderma spp. colonizó íntegramente las cajas de Petri y sus colonias presentaron el mismo diámetro que el control sin biofumigante (p value = 1; H = 0) (tabla 1 y figura 1C; 1F; 1I, pág. 51).
Tabla 1. Efecto de la biofumigación con B. juncea sobre el crecimiento de las colonias de Trichoderma spp.
Table 1. Effect of biofumigation with B. juncea on the growth of colonies of Trichoderma spp.

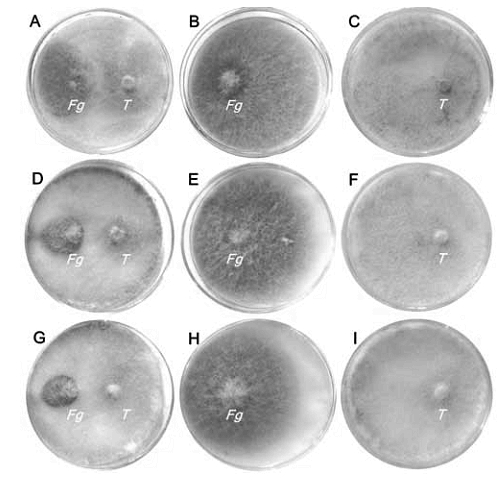
Figura 1. Crecimiento de las colonias de F. graminearum y Trichoderma spp. tratadas con B. juncea. A, B, C: sin biofumigante; D, E, F: con 5 g de B. juncea; G, H, I: con 10 g de B. juncea; Fg: F. graminearum; T: Trichoderma spp.
Figure 1. Colony growth of F. graminearum and Trichoderma spp. treated with B. juncea. A, B, C: without biofumigant; D, E, F: with 5 g of B. juncea; G, H, I: with 10 g of B. juncea; Fg: F. graminearum; T: Trichoderma spp.
La biofumigación con B. juncea no inhibió el crecimiento de las colonias de Trichoderma spp. en ninguna de las dosis evaluadas.
Los resultados de este trabajo concuerdan parcialmente con aquellos obtenidos por otros investigadores que analizaron el efecto de la biofumigación de otras Brassicáceas sobre Trichoderma spp. Por ejemplo Sanchi et al. (2005) demostraron en pruebas in vitro que la cepa T39 de T. harzianum fue menos sensible a los gases biofumigantes de B. carinata que S. sclerotiorum y S. minor; Galletti et al. (2008) analizaron in vitro el efecto de la biofumigación con harina de semilla de B. carinata sobre 40 aislados de Trichoderma spp., y hallaron que fueron menos sensibles a los gases que todos los patógenos ensayados (P. ultimum, R. solani, F. oxysporum), aunque observaron un efecto fungistático sobre Trichoderma spp. a la dosis más alta del biofumigante. Por lo tanto, la biofumigación con Brassicáceas afectaría en diferente medida el crecimiento de Trichoderma spp., en función de la dosis, especie botánica y órgano utilizado del biofumigante.
Efecto de la biofumigación con B. juncea sobre F. graminearum
Las colonias de F. graminearum resultaron de diámetro similar a la del tratamiento control en las dos dosis utilizadas (p value = 0,3832) (tabla 2, pág. 52 y figura 1B; 1E; 1H). La biofumigación con B. juncea no inhibió el crecimiento de F. graminearum.
Tabla 2. Efecto de la biofumigación con B. juncea sobre el crecimiento de las colonias de F. graminearum.
Table 2. Effect of biofumigation with B. juncea on the growth of colonies of F. graminearum.

En un trabajo previo donde se evaluó in vitro el efecto fungistático de la biofumigación con B. juncea sobre F. graminearum (31), se observó inhibición del crecimiento del hongo con dosis de 10 g de B. juncea. Sin embargo, a diferencia del presente ensayo, el estadio fenológico de la mostaza parda fue el de plena fructificación y la temperatura de incubación fue 20°C. Posiblemente una o ambas disimilitudes en la metodología explicarían las diferencias halladas en los resultados. Por un lado, la concentración de glucosinolatos varía según el estadío fenológico de las Brassicáceas (25, 43). En cuanto a la temperatura de incubación, F. graminearum presenta una tasa de crecimiento mayor a 25°C que a 20°C (1). Todo lo anteriormente expuesto indicaría que la biofumigación con B. juncea, tendría un efecto variable sobre la supresión del crecimiento de F. graminearum, dependiendo del estadio fenológico de la mostaza y/o de la temperatura de incubación.
Acción de Trichoderma spp. sobre el crecimiento de F. graminearum
En el cultivo dual, las colonias de F. graminearum resultaron de diámetro significativamente menor que las del tratamiento control, en cambio las colonias de Trichoderma spp. presentaron el mismo diámetro que en el control (p value = 0,0003; H = 18,53) (tabla 3 y figura 1A; 1B; 1C, pág. 51).
Tabla 3. Acción antagonista de Trichoderma spp. sobre F. graminearum.
Table 3. Antagonistic action of Trichoderma spp. on F. graminearum.

El hongo biocontrolador Trichoderma spp. inhibió significativamente el crecimiento de las colonias de F. graminearum. En observaciones microscópicas realizadas en la zona de interacción de ambos microorganismos se identificaron dos mecanismos antagónicos de Trichoderma spp. sobre F. graminearum: micelio envolvente (coiling) y vacuolización.
Estos resultados coinciden con los obtenidos por otros autores quienes observaron biocontrol de F. graminearum por acción antagónica de T. virens (40), T. gamsii y T. velutinum (24).
Efecto de la combinación de Trichoderma spp. y la biofumigación con
B. juncea sobre el crecimiento de F. graminearum
La combinación del antagonista Trichoderma spp. y la biofumigación con B. juncea tuvo un efecto sinérgico en el control del crecimiento de F. graminearum: el porcentaje de inhibición miceliar en los tratamientos que combinaban las dos técnicas fue significativamente mayor que el del tratamiento en el que solo se utilizó Trichoderma spp. No se observaron diferencias significativas entre las distintas dosis de B. juncea (p value = 0,0035) (tabla 4 y figura 1A; 1D; 1G, pág. 51).
Tabla 4. Efecto de la combinación de Trichoderma spp. y de la biofumigación con B. juncea sobre el crecimiento de F. graminearum, expresado a través del porcentaje de inhibición miceliar.
Table 4. Combinated effect of Trichoderma spp. and biofumigation with B. juncea on growth of F. graminearum, expressed as the percentage of mycelial inhibition.

Este es el primer reporte sobre biocontrol in vitro de F. graminearum empleando en forma conjunta al hongo antagonista Trichoderma spp. y la biofumigación con B. juncea.
Otras investigaciones relacionadas con este tema han reportado resultados similares. Sanchi et al. (2005) observaron que la combinación de T. harzianum - T39 con la biofumigación con B. carinata no suprimió la actividad antagonista del hongo biocontrolador frente a S. sclerotiorum y S. minor, pero los metabolitos volátiles de Trichoderma redujeron la eficiencia de los isotiocianatos para inhibir el crecimiento miceliar de esos patógenos; no obstante, concluyen que la biofumigación con B. carinata puede ser considerada compatible con la aplicación de T. harzianum - T39. Galletti et al. (2008) encontraron un efecto sinérgico de los dos métodos del control biológico, en un ensayo realizado en suelo bajo condiciones controladas, aplicando en forma separada y conjunta, Trichoderma spp. y la biofumigación con harina de semilla de B. carinata. Ellos midieron luego la incidencia de la mortalidad de plántulas de remolacha azucarera provocada por P. ultimum y observaron que el mayor control de la enfermedad se logró cuando la biofumigación se aplicó en combinación con Trichoderma spp.
CONCLUSIONES
Los resultados obtenidos in vitro sugieren que la técnica de biocontrol con el hongo antagonista Trichoderma spp. puede ser considerada compatible con la biofumigación con B. juncea.
El crecimiento de Trichoderma spp. y su potencial efecto de biocontrol sobre F. graminearum, no serían afectados por la biofumigación con B. juncea.
Además, la utilización combinada de Trichoderma spp. y la biofumigación con B. juncea, tendría un efecto sinérgico sobre el control del crecimiento de F. graminearum. Esta combinación de prácticas de control biológico representaría una herramienta alternativa para el manejo integrado de las enfermedades causadas por F. graminearum.
1. Andersen, A. L. 1948. The development of Gibberella zeae headbligh of wheat. Phytopathology. 38: 595-611. [ Links ]
2. Arriola, L. L.; Hausbeck, M. K.; Rogers, J.; Safir, G. R. 2000. The Effect of Trichoderma harzianum and Arbuscular Mycorrhizae on Fusarium Root Rot in Asparagus. Hortechnology. 10(1): 141-144. [ Links ]
3. Astiz Gassó, M. M.; Pagliocca, R.; Varaschin, C. 2009. Comportamiento del formulado biológico Biagro TL en el manejo integrado de Ustilago bullata (Ustilaginales) en Bromus catharticus. Actas VII Simposio Nacional de Biotecnología Redbio. Rosario, Argentina. p. 151. [ Links ]
4. Astiz Gassó, M. M.; Pagliocca, R.; Varaschin, C. 2009. Comportamiento del formulado biológico Biagro TL en el manejo integrado del carbón hediondo (Tilletia laveis) en trigo.Actas XIII Jornadas Fitosanitarias Argentinas. Termas de Río Hondo, Argentina. PV05. [ Links ]
5. Astiz Gassó, M. M.; Pagliocca, R.; Varaschin, C. 2011. Comportamiento del formulado biológico Biagro TL en el manejo integrado de enfermedades. Actas 2° Congreso Argentino de Fitopatología. Mar del Plata, Argentina. p. 373. [ Links ]
6. Bai, G.; Shaner, G. 1994. Scab of wheat: Prospects for Control. Plant Disease. 78(8): 760-766. [ Links ]
7. Brunner, K.; Zeilinger, S.; Ciliento, R.; Woo, S. L.; Lorito, M.; Kubicek, C.; Mach, R. L. 2005. Improvement of the Fungal Biocontrol Agent Trichoderma atroviride to Enhance both Antagonism and Induction of Plant Systemic Disease Resistance. Applied And Environmental Microbiology. 71(7): 3959-3965. [ Links ]
8. Charron, C. S.; Sams, C. E. 1999. Inhibition of Pythium ultimum and Rhizoctonia solani by Shredded Leaves of Brassica Species. J. Amer. Soc. Hort. Sci. 124(5): 462-467. [ Links ]
9. Dandurand, L. M.; Mosher, R. D.; Knudsen, G. R. 2000. Combined effects of Brassica napus seed meal and Trichoderma harzianum on two soilborne plant pathogens. Canadian Journal of Microbiology. 46(11): 1051-1057. [ Links ]
10. Daugovish, O.; Downer, J.; Becker, O.; Browne, G. 2004. Mustard-derived biofumigation research in Southern California. In Proceedings of the First International Biofumigation Symposium. Florence, Italy. 38-39. [ Links ]
11. Debiase, G.; Rotolo, C.; Miazzi, M.; Pollastro, S.; Verdini, L.; De Mastro, G.; Faretra, F. 2008. Biofumigant activity of Brassicaceae against soil-borne fungi. In Proceedings of the Third International Biofumigation Symposium. Canberra, Australia. p. 59. [ Links ]
12. Deepak, P.; Saran, L.; Lal, G. 2008. Control of Wilt and Blight Diseases of Cumin through Antagonistic Fungi under in vitro and Field Conditions. Not. Bot. Hort. Agrobot. Cluj. 36(2): 91-96. [ Links ]
13. Dunne, C. P.; Dell, B.; Hardy, G. E. S. 2003. The effect of biofumigants on the vegetative growth of five Phytophthora species in vitro. Acta Hortic. 602: 45-51. [ Links ]
14. Galletti, S.; Sala, E.; Leoni, O.; Burzi, P. L.; Cerato, C. 2008. Trichoderma spp. tolerance to Brassica carinata seed meal for a combined use in biofumigation. Biological Control. 45(3): 319-327. [ Links ]
15. Gimsing, A. L.; Kirkegaard, J. A. 2006. Glucosinolate and isothiocyanate concentration in soil following incorporation of Brassica biofumigants. Soil Biology and Biochemistry. 38: 2255-2264. [ Links ]
16. Gowers, S. 2008. Selection of B. napus and B. rapa lines for biofumigation potential. In proceedings of the Third International Biofumigation Symposium. Canberra, Australia. p. 79. [ Links ]
17. Grondona, I.; Hermosa, R.; Tejada, M.; Gomis, M. D.; Mateos, P. F.; Bridge, P. D.; Monte, E.; Garcia-Acha, I. 1997. Physiological and Biochemical Characterization of Trichoderma harzianum, a Biological Control Agent against Soilborne Fungal. Applied And Environmental Microbiology. 63(8): 3189-3198. [ Links ]
18. Harding, R. B.; Wicks, T. J. 2001. Effects of incorporating Brassica and cereal cover crop residues on soil populations of Verticillium dahliae. In proceedings of the Second Soilborne Diseases Conference. Lorne, Australia. 148-149. [ Links ]
19. Howell, C. R. 2003. Mechanisms Employed by Trichoderma Species in the Biological Control of Plant Diseases: The History and Evolution of Current Concepts. Plant Disease. 87(1): 4-10. [ Links ]
20. Kirkegaard, J. A.; Matthiessen, J. N. 2004. Developing and refining the biofumigation concept. Agroindustria 3: 233-239. [ Links ]
21. Kjaer, A. 1976. Glucosinolates in cruciferae. In: The Biology and Chemistry of the Cruciferae. London, Academic Press. 207-219. [ Links ]
22. Kullnig-Gradinger, C. M.; Szakacs, G.; Kubicek, C. P. 2002. Phylogeny and evolution of the genus Trichoderma: a multigene approach. Mycol. Res. 106(7): 757-767. [ Links ]
23. Larkin, R. P.; Griffin, T. S. 2007. Control of soilborne potato diseases using Brassica green manures. Crop Protection. 26(7): 1067-1077. [ Links ]
24. Matarese, F.; Sarrocco, S.; Gruber, S.; Seidl-Seiboth, V.; Vannacci, G. 2012. Biocontrol of Fusarium head blight: interactions between Trichoderma and mycotoxigenic Fusarium. Microbiology. 158: 98-106. [ Links ]
25. Mayton, H. S.; Olivier, C.; Vaughn, S. F.; Loria, R. 1996. Correlation of fungicidal activity of Brassica especies with allyl-isotiocyanate production in macerated leaf tissue. Phytopathology. 86: 267-271. [ Links ]
26. McMullen, M.; Jones, R.; Gallenberg, D. 1997. Scab of Wheat and Barley: A Re-emerging Disease of Devastating Impact. Plant Disease. 81: 1340-1348. [ Links ]
27. Michel, V. V.; Lazzeri, L. 2008. Biofumigation to control Verticillium wilt influenced by plant species and soil types. In Proceedings of the Third International Biofumigation Symposium. Canberra, Australia. p. 62. [ Links ]
28. Molina-Vargas, L. F.; Bentura-Castellanos, J. U. 2009. Efecto inhibitorio in vitro de cinco isotiocianatos sobre Rhizoctonia solani Kühn AG-3. Revista de Investigación Agraria y Ambiental. 37-40. [ Links ]
29. Morton, D. T.; Stroube, N. H. 1955. Antagonistic and stimulatory effects of microorganism upon Sclerotium rolfsii. Phytopathology. 45: 419-420. [ Links ]
30. Parry, D. W.; Jenkinson, P.; McLeod, L. 1995. Fusarium ear blight (scab) in small grain cereals - a review. Plant Pathology. 44(2): 207-238. [ Links ]
31. Perniola, O. S.; Staltari, S.; Chorzempa, S. E.; Molina, M. del C. 2012. Biofumigación con Brassicáceas: actividad supresora sobre Fusarium graminearum. Rev. Fac. Agron. 111(1): 48-53. [ Links ]
32. Rekha, D.; Patil, M. B.; Shridhar Shetty, P.; Swamy, K. M.; Rajini, B. Gamanagatti. 2012. Invitro screening of native Trichoderma isolates against Sclerotium rolfsii causing collar rot of ground nut. International Journal of Science and Nature. 3(1): 117-120. [ Links ]
33. Richardson, L. T.; Munnecke, D. E. 1964. A bioassay for volatile toxicants from fungicides in soil. Phytopathology. 54: 836-839. [ Links ]
34. Sanchi, S.; Odorizzi, S.; Lazzeri, L.; Marciano, P. 2005. Effect of Brassica carinata Seed Meal Treatment on the Trichoderma harzianum T39-Sclerotinia Species Interaction. Acta Hort. (ISHS). 698: 287-292. [ Links ]
35. Shovan, L. R.; Bhuiyan, K. A.; Begum, J. A.; Pervez, Z. 2008. In vitro control of Colletotrichum dematium causing anthracnose of soybean by fungicides, plant extracts and Trichoderma harzianum. Int. J. Sustain. Crop Prod. 3(3): 10-17. [ Links ]
36. Sivan, A.; Chet, I. 1989. Degradation of Fungal Cell Walls by Lytic Enzymes of Trichoderma harzianum. Journal of General Microbiology. 135: 675-682. [ Links ]
37. Stefanova, M.; Sandoval, I.; Martínez, M. L.; Heredia, I.; Ariosa, M. D.; Arévalo, R. 2004. Control de hongos fitopatógenos del suelo en semilleros de tabaco con Trichoderma harzianum. Fitosanidad. 8(2): 35-38. [ Links ]
38. van Os, G. J.; Bijman, V.; de Boer, M.; Breeuwsma, S.; van der Bent, J.; Lazzeri, L. 2004. Biofumigation against soilborne fungal diseases in flower bulbs. In Proceedings of the First International Biofumigation Symposium. Florence, Italy. 21-22. [ Links ]
39. Vincent, J. M. 1947. The esters of 4-hydroxybenzoic acid and related compounds. Part I. Methods for the study of their fungistatic properties. J. Soc. Chem. Ind. 66: 149-155. [ Links ]
40. Whipps, J. M. 2001. Microbial interactions and biocontrol in the rhizosphere. J. Expt. Bot. 52: 487-511. [ Links ]
41. Yedidia, I.; Benhamou, N.; Chet, I. 1999. Induction of Defense Responses in Cucumber Plants (Cucumis sativus L.) by the Biocontrol Agent Trichoderma harzianum. Applied and Environmental Microbiology. 65(3): 1061-1070. [ Links ]
42. Yulianti, T.; Sivasithamparam, K.; Turner, D. W. 2008. Incorporation of Brassica nigra and Diplotaxis tenuifolia residues and incubation under different soil conditions affects the survival of Rhizoctonia solani AG2-1 (ZG5), the causal agent of damping off of canola differently. In Proceedings of the Third International Biofumigation Symposium. Canberra, Australia. p. 70. [ Links ]
43. Zurera, C.; Romero, E.; Porras, M.; Barrau, C.; Romero, F. 2007. Efecto biofumigante de especies de Brassica en el crecimiento de Phytophthora spp. in vitro. XI Congreso Sociedad Española de Ciencias Hortícolas. Albacete, España. Actas de Horticultura. 48: 306-309. [ Links ]














