Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versão On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.46 no.2 Mendoza dez. 2014
ARTICULO ORIGINAL
Estudio preliminar de los efectos letales y sub- l etal es de extractos etanólicos de cuatro especies xerófitas del altiplano chileno contra Tetranychus cinnabarinus (Acarina: Tetranychidae)
Preliminary studies of lethal and sub-lethal effects of ethanolic extracts of four xerophytic species of high Andes of Chilean against Tetranychus cinnabarinus(Acarina: Tetranychidae)
Víctor Tello Mercado1, Maximiliano Derosas Arriagada1
1 Facultad de Recursos Naturales Renovables, Universidad Arturo Prat, Avenida Arturo Prat 2120, Casilla 121, Iquique, Chile. victor.tello@unap.cl
Originales: Recepción: 21/02/2014 - Aceptación: 22/08/2014
RESUMEN
Se evaluaron los efectos letales y subletales de extractos etanólicos de cuatro plantas originarias de la zona alto andina del desierto chileno (Baccharis tola Phil., Fabiana densa J. Remy, Lampayo medicinalis F. Phil. y Azorella compacta Phil.) sobre adultos y huevos de Tetranychus cinnabarinus (Boisduval) (Acari: Tetranychidae), en condiciones de laboratorio (26 ± 2°C, 70 ± 10% HR y fotoperíodo de 16:8 luz: oscuridad). Los mayores niveles de mortalidad por contacto directo sobre adultos fueron obtenidos por A. compacta al 10% (p/v), L. medicinalis 10% (p/v) y A. compacta 7,5% (p/v), los cuales no presentaron diferencias significativas (p<0,05) con respecto al tratamiento control (spirodiclofen). Las CL 50 más bajas fueron obtenida por F. densacon 0,71% (p/v) y L. medicinalis con 0,98% (p/v). A. compacta presentó la CL 90 más baja con 5,10% (p/v) y la mayor eficacia por obtener un coeficiente de 3,21 (CL 90 /CL 50 ). Lampayo medicinalis al 10% (p/v) presentó el mayor porcentaje de huevos no eclosionados con un 73,15%. Baccharis tola al 7% (p/v) expuso la mayor toxicidad por efecto residual con una mortalidad de 57,8% sobre adultos de T. cinnabarinus. Fabiana densa mantuvo efecto repelente hasta las 72 horas. Lampayo medicinalis, B. tola y A. compacta perdieron levemente su actividad repelente en el tiempo.
Palabras clave: Acaricidas; Concentración letal media; Plantas andinas; Repelencia; Susceptibilidad; Toxicidad
ABSTRACT
Lethal and sublethal effects of ethanolic extracts of four original plants of the high Andes of Chilean desert (Baccharis tola Phil., Fabiana densa J. Remy, Lampayo medicinalis F. Phil. and Azorella compacta Phil.) were studied at 26 ± 2°C and 70 ± 10% of RH with a photoperiod of 16:8 h (L:D) on adults and eggs of Tetranychus cinnabarinus (Boisduval) (Acari: Tetranychidae). The highest mortalities of adults by contact were obtained with A. compacta (10% w/v), L. medicinalis (10% (w/v) and A. compacta (7.5% w/v) which no showed significant differences (p< 0.05) compared with the control treatment (spirodiclofen). The lowest LC 50 was obtained by F. densa (0.71% w/v), followed by L. medicinalis (0.98% w/v). Azorella compacta (5.10% w/v) showed the lowest LC 90 and the highest efficiency with a coefficient of 3.21 (CL 90 / CL50 ). Lampayo medicinalis (10% w/v) produced the highest percentage of unhatched eggs with 73.15%. Bacharis tola (7% w/v) exhibited the highest toxicity by residual effect with a mortality of 57.8% of T. cinnabarinus adults. Fabiana densa maintained its repellent effect for 72 hours. Lampayo medicinalis, B. tola and A. compact slightly lost their repellent activity over time.
Keyword: Acaricides; Median lethal concentration; Andean plants; Repellency; Susceptibility; Toxicity
INTRODUCCIÓN
Tetranychus cinnabarinus (Boisduval 1867) está asociado a más de 120 especies hospederas de importancia económica en todo el mundo, incluido el algodón, fresa, plantas ornamentales, frutales de hoja caduca, tomate, berenjena y otras hortalizas, con una amplia distribución en diferentes partes del mundo (25). En Chile, los hospederos principales de este ácaro son alfalfa, clavel, frijol, fresa y melón (21). Se distribuye desde la Región de Arica y Parinacota hasta la Región del Maule. En la Región de Tarapacá, se asocia principalmente con el melón y el clavel, y por lo general se controla químicamente (20).
El uso excesivo de pesticidas ha llevado a un rápido desarrollo de resistencia en este ácaro. Por ejemplo, T. cinnabarinus ha desarrollado resistencia a dicofol hasta 100 veces dentro de 6 a 16 generaciones (6) y para paratión más de 460 veces durante la década de 1980 (26). En China, se ha documentado la resistencia de este ácaro para siete plaguicidas comerciales, incluyendo diclorvos, foxim, metomilo, piridaben, propargite, abamectina y clorfenapir (12).
Además, el uso de acaricidas de amplio espectro, es de alto costo y acarrea secuelas colaterales secundarias que pueden ser más graves que el problema inicial. Estas consecuencias, son el desarrollo de resistencias en las plagas, la contaminación ambiental, brotes de nuevas plagas, eliminación de especies benéficas, la acumulación ascendente de residuos en la cadena trófica e intoxicación humana tanto de las personas que participan en la producción y aplicación de los productos como de los consumidores de alimentos contaminados por sus residuos (15). Los plaguicidas con base en extractos o aceites vegetales poseen una mezcla de sustancias activas, lo que puede retrasar o prevenir el desarrollo de resistencia (24).
Muchos extractos vegetales han mostrado actividad biológica contra insectos y ácaros fitófagos incluyendo repelencia, disuasión de la alimentación y oviposición, toxicidad y actividad reguladora del crecimiento. Sin embargo, solo unas pocas familias botánicas han demostrado tener actividad acaricida (5).
El altiplano del norte de Chile tiene una flora rica en especies de plantas aromáticas y medicinales nativas (1), entre las que destacan: Baccharis tola Phil. (Asteraceae), Fabiana densa J. Remy (Solanaceae), Lampayo medicinalis F. Phil. (Verbenacea) y Azorella compacta Phil. (Apiaceae), las cuales crecen entre los 3.000 y 5.500 metros sobre el nivel mar.
Debido a la importante problemática que representa el control de plagas en la agricultura a nivel mundial, y al interés renovado en la utilización de productos naturales como fuente para su control, este trabajo de investigación se ha enfocado en el área del estudio de potenciales biopesticidas, específicamente con el efecto acaricida, que podrían tener los extractos provenientes de plantas de la cordillera andina de Iquique, permitiendo disponer de una mayor información, la cual es de gran utilidad desde el punto de vista agronómico y económico.
Objetivo
• Evaluar los efectos letales y subletales de cuatro extractos etanólicos obtenidos a partir de B. tola, F. densa, L. medicinalis y A. compacta contra T. cinnabarinus en condiciones de laboratorio.
MATERIALES Y MÉTODOS
Material vegetal
Las especies vegetales: B. tola., F. densa, L. medicinalis y A. compacta, fueron colectadas en las localidades de Colchane y Cariquima, Región de Tarapacá, Chile (19°16' Latitud Sur y 68°38' Longitud Oeste, 3.715 m s. n. m.). El material vegetal fue identificado y autenticado por el profesor Dr. Roberto Rodríguez en la Universidad de Concepción (2). Especímenes voucher están depositados en el Herbario de la Universidad de Concepción y en el Laboratorio de Productos Naturales de la Universidad Arturo Prat.
Material acarológico
La crianza de T. cinnabarinus se realizó en el laboratorio de Fitosanidad de la Universidad Arturo Prat en la Estación Experimental de Canchones, comuna de Pozo Almonte, Provincia del Tamarugal, Región de Tarapacá, Chile.
Los ácaros fueron obtenidos desde cultivos de clavel (Dianthus caryophyllus Linneo var. Celta) en la localidad de Pica, Región de Tarapacá, Chile (20°29' S; 69°19' O) y criados en el laboratorio por varias generaciones antes de ser usados en los bioensayos.
Las plantas de Phaseolus vulgaris Linneo var. Apolo, infestadas con ácaros, se mantuvieron en una sala de crianza a 27±2°C, 60-80% de HR y fotoperíodo de 16:8 L:O (luz:oscuridad), siendo regadas cada dos días aproximadamente; las plantas senescentes fueron remplazadas por plantas nuevas agregadas a la colonia.
La identificación taxonómica se realizó usando las claves taxonómicas de Gutiérrez (1985), confirmándose la identificación por comparación con especímenes voucher de la Universidad Arturo Prat.
Obtención de los extractos etanólicos
La obtención de extractos etanólicos se realizó en el Laboratorio de Productos Naturales de la Facultad de Ciencias de la Salud, perteneciente a la Universidad Arturo Prat, Campus Playa Brava, Iquique, Chile.
Se utilizaron las partes aéreas de las plantas (ramas y hojas), ya que las sustancias activas se encuentran mayormente a nivel foliar (19).
El secado se realizó bajo sombra en un lugar fresco y aireado, luego se pulverizaron en un molino multiuso (Sindelen, L-2001, Chile), pesando entre 150-200 g.
La extracción se realizó con 600 mL de etanol utilizando un equipo Soxhlet (manto calefactor marca Fisatom, Class 650 modelo 23, Brasil), por 12 horas, aproximadamente.
Una vez finalizada la extracción, se filtró y se eliminó el solvente en un rotavapor (marca Heidolph, modelo Laborota 4001, Alemania), a 150-200 rpm y entre 45 y 50°C de temperatura. Estos fueron almacenados en frascos de color ámbar, sin la presencia de luz y a 4°C.
Ensayo de toxicidad por contacto directo en adultos
Se cortaron discos de hojas de frijol de 2 cm de diámetro con un sacabocado y se dispusieron en una placa Petri de 10 cm de diámetro.
Se transfirieron 10 adultos de T. cinnabarinus a cada disco de hoja.
El escape de las arañitas fue prevenido rodeando cada disco de hoja con pegamento (Point StickyGlue®, Point Chile, SA) (23).
La unidad experimental correspondió a un disco de hoja con 10 hembras adultas, repitiéndose cada tratamiento 10 veces.
Para la aplicación directa de cada extracto etanólico sobre adultos se utilizaron las siguientes concentraciones: 0,5%, 1,0%, 2,5%, 5,0%, 7,5% y 10% p/v. También se evaluaron tres controles, uno correspondiente a etanol (99,8%), acaricida sintético aplicando la dosis recomendada de 60 mL en 100 L (0,0012 mL de Envidor® 240 SC en 2 mL de agua, lo que equivale a 0,288 mg de spirodiclofen por aplicación) y por último un control absoluto para descartar mortalidad por manipulación.
Cada tratamiento fue rociado con 2 mL de cada concentración con una torre Potter (Makers Burkards Manufacturing Co Ltd., Rickmans Worth, Inglaterra) con una presión de trabajo de 55 KPa y un tiempo de rociado de 5 segundos.
Posteriormente, cada placa Petri fue puesta en cámara de crianza a 26 ± 2°C, 70 ± 10% HR y un fotoperiodo de 16:8 L:O (23).
La mortalidad fue evaluada a las 72 horas, considerándose como muerto al ácaro que no mostraba actividad motora al ser tocado con una aguja de disección (13).
Las observaciones fueron realizadas con una lupa estereoscópica Carl ZeissStemi SV6.
Ensayo de toxicidad por contacto directo en huevos
Se transfirieron 10 hembras adultas a discos de hojas de frijol de 2 cm de diámetro y éstos se depositaron en una placa Petri de 10 cm de diámetro. Se permitió la postura de huevos a las hembras por un período de 4 horas, siempre acompañadas por un macho, para tener fertilización de huevos y evitar la pseudoarrenotoquia.
Los ácaros fueron removidos cuando se obtuvo, al menos, 20 huevos por disco. Para este ensayo se aplicaron las siguientes concentraciones de cada extracto: 0,5%, 1,0%, 2,5%, 5,0%, 7,5% y 10% p/v.
Se utilizaron los mismos controles que en el ensayo de toxicidad por contacto directo en adultos.
Se realizó un conteo de los huevos no eclosionados cuando los controles (a excepción del acaricida) presentaron el 90% de los huevos eclosionados, aproximadamente al sexto día de la postura y aplicación de los extractos.
La unidad experimental correspondió a un grupo de 10 huevos, repitiéndose cada tratamiento 10 veces.
Ensayo de toxicidad por contacto residual en adultos
Se cortaron discos de hojas de frijol de 8 cm de diámetro y se sumergieron en 2 mL de solución.
Para cada extracto se evaluaron tres concentraciones 5%, 7% y 10% p/v. Como control se utilizó sólo solvente, etanol (99,8%).
Luego de ser secados por 5 minutos a temperatura ambiente se colocó pegamento en los bordes de cada disco para evitar escape de ácaros.
Los discos de hoja fueron, posteriormente, trasladados a una placa Petri, y se depositaron en ellos 10 arañitas.
Por último se evaluó la mortalidad como se describió anteriormente.
La unidad experimental correspondió a un grupo de 10 hembras adultas, repitiéndose cada tratamiento 10 veces.
Ensayo de repelencia
Se cortaron cinco discos de hojas de frijol de 4 cm de diámetro, procurando dejar la nervadura principal en el centro del disco foliar, se dispusieron en una placa Petri de 10 cm de diámetro.
Se cubrió la mitad de cada disco con una lámina de papel aluminio (Alusa®).
Se aplicaron 2 mL de cada extracto mediante una torre Potter. La concentración que se evaluó fue la de 7% p/v, la que fue determinada mediante un ensayo preliminar.
Se evaluó un control correspondiente a etanol (99,8%).
Una vez retirada la lámina de papel aluminio, los discos de hoja fueron secados por 5 minutos. Se aplicó pegamento para evitar el escape de los ácaros después del secado.
Se dispusieron 10 arañitas adultas en la nervadura media del disco foliar.
El efecto repelente fue calculado mediante el porcentaje de adultos que se mantuvieron fuera de la mitad aplicada, en tres períodos de evaluación 24, 48 y 72 horas.
Cada tratamiento fue repetido 10 veces.
Análisis estadístico
El diseño experimental a utilizar en todos los ensayos fue completamente al azar.
La eficacia de los tratamientos se evaluó a través de un análisis de varianza, con un nivel de significancia del 5%, previa normalización de los datos mediante la transformación angular raíz cuadrada del arcoseno del porcentaje(√x % -1 ), posteriormente se realizó la prueba de Tukey (α=0,05) para la separación de las medias de los tratamientos.
Para calcular las CL 50 y CL 90 se realizó un análisis probit utilizando el procedimiento PROC PROBIT disponible en el programa computacional SAS (SAS Institute Inc., Cary NC, USA, 2000).
Se calculó la eficacia de acuerdo con la relación CL50 /CL 90 que indica la mayor eficacia del extracto evaluado mientras menor sea el coeficiente (10).
En el ensayo de repelencia se realizaron pruebas t- Student de medias pareadas (α=0,05) para evaluar las diferencias entre ácaros encontrados en el lado aplicado y no aplicado (9) y análisis de varianza (ANOVA), para la comparación entre tratamientos. La separación de medias se realizó a través de la prueba de Tukey (α =0,05).
RESULTADOS Y DISCUSIÓN
Mortalidad por aplicación directa sobre adultos de Tetranychus cinnabarinus Los datos consignados en la tabla 1 corresponden a mortalidades mayores al 50%, obtenidas con las diferentes concentraciones de los extractos evaluados.
Tabla 1. Porcentaje de mortalidad de adultos de Tetranychus cinnabarinus expuestos a distintas concentraciones de los extractos evaluados mediante aplicación directa, observaciones realizadas a las 72 horas.
Table 1. Percentage mortality of Tetranychus cinnabarinus adults exposed to different concentrations of the extracts evaluated by direct application, observations at 72 hours.
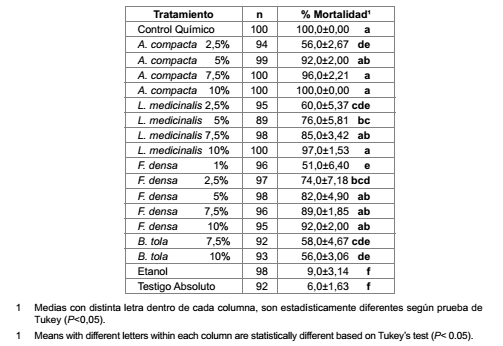
Un valor sobre el 50% de mortalidad es considerado promisorio en estudios de la actividad insecticida en extractos de plantas (4).
Se detectaron diferencias significativas entre tratamientos (F (17, 162) = 55,97; P<0,001).
El efecto del spirodiclofen (control químico) alcanzó mortalidades mayores al 90% a las 72 horas post aplicación. Los tratamientos que presentaron porcentajes de mortalidad estadísticamente similares al spirodiclofen fueron A. compacta 5%, 7,5 y 10% p/v, L. medicinalis 17,5% y 10% p/v y F. densa 5%, 7,5% y 10% p/v. Azorella compacta presenta en su composición química seis diterpenos (3), F. densa presenta dos diterpenos (7) y B. tola cinco diterpenos (17, 18). Por otra parte L. medicinalis presenta cuatro flavonoides y un diterpeno (14).
Liu et al. (2004) aplicaron extractos etanólicos de Eupatorium adenophorum Spreng. (Asteraceae), ricos en monoterpenos y sesquiterpenos derivados del labdano (1, 16, 28), a una concentración de 0,1% (p/v), sobre Panonychus citri Koch obteniendo mortalidades de 71,10% y 73,53% a las 12 y 24 horas, respectivamente.
En este estudio, el extracto etanólico de B. tola,con diterpenos derivados del kaureno (17, 18), al 7,5% (p/v) sobre T. cinnabarinus, obtuvo una mortalidad menor al 50% a las 24 horas. Estas diferencias pueden deberse, entre otros múltiples factores, a que ambos tetraníquidos pertenecen a diferentes géneros y a la naturaleza química de los terpenos presentes en B. tola y E. adenophorum.
Concentraciones letales y eficacia para cada extracto evaluado
De acuerdo con el análisis de las CL50 , la toxicidad de los extractos para T. cinnabarinus ordenados en forma decreciente, fueron: F. densa>L. medicinalis>A. compacta>B. tola. El orden de toxicidad de acuerdo con la CL90 fue: A. compacta>L. medicinalis>F. densa>B. tola. Esto puede ser explicado al analizar las pendientes de las regresiones (tabla 2), indicando una susceptibilidad decreciente de T. cinnabarinus a los extractos (A. compacta>L. medicinales>F. densa>B. tola) las cuales coinciden con el ordenamiento de la CL 90 .
Tabla 2. Concentraciones letales (CL50, 90 en % p/v) y eficacia (CL 90 /CL 50 ) para cada uno de los extractos evaluados a través de aplicación directa estimado por análisis probit sobre adultos de Tetranychus cinnabarinus.
Table 2. Lethal concentrations (LC 50, 90 at % w/v) and efficacy (CL 90 /CL 50 ) for each of the extracts evaluated through direct application estimated by probit analysis on Tetranychus cinnabarinus adults.

La mayor eficacia la obtuvo el extracto de A. compacta entregando el menor coeficiente, y la menor eficacia la presentó el extracto de B. tola (tabla 2).
Tello et al. (2014) determinaron el efecto acaricida contra T. urticae de extractos metanólicos de A. compacta, F. densa, L. medicinalis y B. tola obteniendo CL 50 , en hembras adultas, con 0,32; 0,40; 0,52 y 0,61% p/v, respectivamente. Las leves diferencias registradas pudieron deberse al solvente y la especie de tetraníquido utilizados.
Mortalidad por aplicación directa sobre huevos de Tetranychus cinnabarinus
El análisis de varianzas arrojó diferencias significativas entre los tratamientos aplicados (tabla 3: F (11,108) = 93,04; P<0,001).
Tabla 3. Porcentaje de mortalidad de huevos de Tetranychus cinnabarinus expuestos a distintas concentraciones de los extractos evaluados mediante aplicación directa, observaciones realizadas a las 72 horas.
Table 3. Percentage mortality of Tetranychus cinnabarinus eggs exposed to different concentrations of the extracts evaluated by direct application, observations at 72 hours.

El extracto con mayor efecto ovicida fue el de L. medicinalis al 10% p/v, siendo estadísticamente diferente a los demás tratamientos. También destaca el extracto de F. densa al 10% p/v el cual no presentó diferencias significativas con el extracto de L. medicinalis al 7,5% (p/v), ambos generando mortalidades mayores al 55%. El control acaricida presentó un 100% de mortalidad. Los controles etanol y testigo absoluto fueron estadísticamente diferentes a todos los demás tratamientos.
Tello et al. (2014), encontró una alta mortalidad de huevos de T. urticae con extractos metanólicos de A. compacta al 5% (p/v) (94% de mortalidad) y con B. tola 5% (p/v) (67% de mortalidad). Estas diferencias pueden deberse a la calidad del solvente utilizado en la extracción y la diferencia entre las especies. De la misma manera, Yanar et al. (2011) evaluaron el efecto acaricida de extractos de Solanum nigrum L. (Solanaceae) y Anthemis vulgaris L. (Asteraceae) sobre huevos de T. urticae obteniendo mortalidades de 51,57 y 46,80%, respectivamente.
Mortalidad por aplicación residual sobre adultos de Tetranychus cinnabarinus
Hubo diferencias significativas entre los tratamientos (tabla 4: F (12,147) = 11,43; P<0,001) a las 72 horas después de la aplicación.
Tabla 4. Porcentaje de mortalidad de adultos de Tetranychus cinnabarinus expuestos a distintas concentraciones de los extractos evaluados mediante efecto residual, observaciones realizadas a las 72 horas.
Table 4. Percentage mortality of Tetranychus cinnabarinus adults exposed to different concentrations of the extracts evaluated by residual effect, observations at 72 hours.

El extracto de A. compacta causó la mayor mortalidad por efecto residual, pero no logró superar el 50%. En cambio en el ensayo por contacto directo este extracto (al 10%) causó una mortalidad del 100%. Al respecto, Vargas et al.(2002), en estudios realizados sobre adultos de T. urticae, indican que la aplicación por contacto directo causa mayor mortalidad que por contacto residual.
Tello et al. (2014) obtuvieron las mayores mortalidades contra T. urticae con la concentración más alta evaluada (10% p/v) a las 72 horas por contacto residual (A. compacta: 68%, B. tola: 23%, L. medicinalis: 23% y F. densa: 20%). La mayores mortalidades alcanzadas por estos extractos pudo deberse a las diferentes susceptibilidades en las especies de ácaros evaluadas.
Ensayos de repelencia
Todos los tratamientos presentaron diferencias significativas (p<0,05) en todos los períodos de evaluación (tabla 5, pág. 145), ubicándose el mayor número de individuos en la zona no tratada, excepto en el caso del control (etanol), donde la mayoría de los ácaros se ubicaron en la zona tratada, descartando así el efecto de éste en la repelencia.
Tabla 5. Actividad repelente de los extractos evaluados sobre adultos de Tetranychus cinnabarinus.
Table 5. Repellent activity of the extracts on Tetranychus cinnabarinus adults.

En la evaluación a las 24 horas (F (4; 45) = 44,38; P<0,0001) los extractos de F. densa y L. medicinalis fueron los que presentaron los menores porcentajes de presencia de ácaros en el área tratada. Al cabo de 48 horas (F (4; 45) = 33,97; P<0,0001) el extracto de F. densa continuó ejerciendo el mayor efecto repelente. Similares resultados fueron obtenidos por Tello et al.(2014), donde los extractos metanólicos de B. tola y L. medicinalis presentaron los mayores porcentajes de individuos en el lado no tratado, con tan sólo un 6% de presencia en el lado tratado de la hoja, lo que indica que tienen un efecto repelente sobre T. urticae.
CONCLUSIONES
El mayor efecto letal por contacto directo en adultos de T. cinnabarinus lo logró con A. compacta a una concentración al 10% p/v con una mortalidad del 100%, además el extracto de esta especie presentó la mayor eficacia (CL 50 /CL 90 ) producto de poseer la mayor pendiente de la rectas de regresión. En el caso del efecto letal por contacto directo en huevos, el mayor porcentaje de mortalidad lo logró el extracto de L. medicinalis al 10% p/v con un 73,15%.
La mayor toxicidad fue alcanzada por F. densa con una CL 50 a 0,71% p/v, seguida por L. medicinalis con una CL 50 de 0,98% p/v. De acuerdo con el análisis de las CL 50 se concluye que la toxicidad de los extractos evaluados, de forma decreciente, es: F. densa>L. medicinalis>A. compacta>B. tola. El análisis de las pendientes de las regresiones permiten concluir que la susceptibilidad de T. cinnabarinus a los extractos evaluados, en forma decreciente, es: A. compacta>L. medicinalis>F. densa>B. tola.
Ningún extracto logró superar el 50% de mortalidad por efecto residual. Los mejores resultados fueron obtenidos por A. compacta con un rango de mortalidad entre el 25% y 40%.
En el caso del ensayo de repelencia los extractos de B. tola y F. densa presentaron altos porcentajes de individuos en zonas no aplicadas a las 72 horas después del tratamiento, considerándose a estos extractos con mayor efecto repelente.
Los resultados obtenidos en el presente trabajo indican el alto valor acaricida de los extractos evaluados bajo condiciones de laboratorio, y su potencial uso para el control de T. cinnabarinus a nivel campo.
Se recomienda realizar la evaluación de estas plantas con distintos solventes en su extracción, al igual que un estudio estacional y determinar la composición de los principios activos involucrados.
1. Ahluwalia, V.; Sisodia, R.; Walia, S.; Sati, O.; Kumar, J.; Kundu, A. 2014. Chemical analysis of essential oils of Eupatorium adenophorum and their antimicrobial, antioxidant and phytotoxic properties. Journal of Pest Science. 87: 341-349. [ Links ]
2. Benites, J.; Bustos, L.; Rios, D.; Bravo, F.; López, J.; Gajardo, S.; Rojo, L.; Buc P. 2013. Antidepressant and anxiolytic-like effects of essential oil from Acantholippia deserticola Phil. in female rats. Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas. Chile. 12(4): 413-419. [ Links ]
3. Bórquez, J.; Loyola, L.; Morales, G.; Zúñiga, E.; Soto, R.; San Martín, A. 1996. Diterpenoides de Azorella compacta. Actas III Simposio Internacional de Química, Productos Naturales y sus Aplicaciones, Punta de Tralca, Chile. [ Links ]
4. Broussalis, A.; Ferraro, G.; Martino, V.; Pinzón, R.; Coussio, J.; Calle, J. 1999. Argentine plants as potential source of insecticidal compounds. Journal of Ethnopharmacology. 67: 219-223. [ Links ]
5. Choi, W.; Lee, S.; Park, H.; Ahn, Y. 2004. Toxicity of plant Essentials oils to Tetranychus urticae (Acari: Tetranychidae) and Phytoseiulus permisilis(Acari: Phitoseiidae). Journal of Economic Entomology. 97(2): 553-558. [ Links ]
6. Dagli, F.; Tunc, I. 2001. Dicofol resistance in Tetranychus cinnabarinus: Resistance and stability of resistance in populations from Antalya, Turkey. Pest Management Science. 57(7): 609-614. [ Links ]
7. Erazo, S.; Zaldivar, M.; Delporte, C.; Backhouse, N.; Tapia, P.; Elmonte, E.; Franco, D. F.; Negrete, R. 2002. Antibacterial diterpenoids from Fabiana densa var. ramulosa. Planta Medica. 8(4): 361-363. [ Links ]
8. Gutierrez, J. 1985. Systematics. In Helle W, Sabelis M (eds) Spider mites: their biology, natural enemies and control. Vol 1A. p.75-90. Amsterdam, Elsevier Science Publishers B. V., 405 p. [ Links ]
9. Lancey, L.; Singer, S. 1982. Larvicidal activity of new isolates of Bacillus sphaericus and Bacillus thuringiensis (H-14) against anopheline and culicine mosquitoes. Mosquito News. 42(4): 537-543. [ Links ]
10. Lahlou, M. 2004. Methods to study the phytochemistry and bioactivity of essential oils. Phytotherapy Research.18(6): 435-448. [ Links ]
11. Liu, Y.P.; Gao, P.; Pan, W. G.; Xu, F.Y.; Liu, S.G. 2004. Effect of several plant extracts on Tetranychus urticae and Panoychus citri. Journal of Sichuan University. 41: 212-215. [ Links ]
12. Luo, YJ, Ni, J., Liu, YG., Jiang, XJ., Chai, JP., Xie, DY., Da, AS., Huang, P., Li, SX.; Ding, W. 2013. Acaricide resistance of Tetranychus cinnabarinus (Acari: Tetraychidae) from mulberry plantations in southwest China. International Journal Of Acarology. 39(7): 522-525. [ Links ]
13. Miresmailli, S.; Bradbury, R.; Isman, M.B. 2006. Comparative toxicity of Rosemarinus officinalis L. essential oil and blends of its mayor constituents against Tetranychus urticae Koch. (Acari: Tetranychidae) on two different host plants. Pest Management Science. 62(4): 366-371. [ Links ]
14. Montes, M.; Wilkomirsky, T.; Valenzuela, L. 1992. Plantas Medicinales. Chile. Ediciones Universidad de Concepción. 207 p. [ Links ]
15. Pérez, D.; Iannacone, J. 2006. Efectividad de extractos botánicos de diez plantas sobre la mortalidad y repelencia de larvas de Rhynchophorus palmarum L., insecto plaga del Pijuayo Bactris gasipaes Kunth en la amazonía del Perú. Agricultura Técnica (Chile). 66(1): 21-30. [ Links ]
16. Roque, M. 2008. Diterpenos del género Eupatorium. Tesis para optar al título de químico fármacobiólogo. Universidad Michoacana de San Nicolás de Hidalgo, Michoacán, México. 55 p. [ Links ]
17. San Martin, A.; Rovirosa, J.; Becker, R.; Castillo, M. 1980. Diterpenoids from Baccharis tola. Phytochemistry. 19: 1985-1987. [ Links ]
18. San Martín, A.; Rovirosa, J.; Castillo, M. 1983. Diterpenoids from Bacharis tola. Phytochemistry. 22(6): 1461-1463. [ Links ]
19. Sharma, S.; Sharma, O.; Singh, B.; Bhat, T. 2000. Biotransformation of the landadenes, the pentacyclictriterpenoid hepatoxins of lantana plants, in guinea pig. Toxicon. 38: 1191-1202. [ Links ]
20. Tello, V.; Vargas, R.; Araya, J. 2009a. Parámetros de vida de Tetranychus cinnabarinus (Acari: Tetranychidae) sobre hojas de clavel, Dianthus caryophyllus. Revista Colombiana de Entomología. 35(1): 47-51. [ Links ]
21. Tello, V.; Vargas, R.; Araya, J.; Cardemil, A. 2009b. Biological parameters of Cydnodromus picanus and Phytoseiulus persimilis raised on the carmine spider mite, Tetranychus cinnabarinus (Acari: Phytoseiidae, Tetranychidae). Ciencia e Investigación Agraria. 36(2): 277-290. [ Links ]
22. Tello, V.; Jacob, S.; Vargas, R. 2014. Estudio preliminar del efecto acaricida de seis extractos metanólicos sobre la arañita bimaculada, Tetranychus urticae Koch. IDESIA. 32(2): 37-45. [ Links ]
23. Vargas, R.; Chapman, B.; Penman, D. 2002. Factors influencing the responses of Tetranychus urticae Koch (Acari: Tetranychidae) to thuringiensin. AgriculturaTécnica. 62(1): 3-14. [ Links ]
24. Wang, Y.N.; Shi, G.L.; Zhao, L.L.; Liu, S.Q.; Yu, T.Q.; Clarke, S.R.;Sun, J.H.2007. Acaricidal activity of Juglans regia leaf extracts on Tetranychus viennensis and Tetranychus cinnabarinus (Acari: Tetranychidae). Journal of Economic Entomology. 100: 1298-1303. [ Links ]
25. Wei, L.; Ding, W.; Zhao, Y.; Vanichpakorn, P. 2011. Acaridical activity of Aloe vera L. leaf extracts against Tetranychus cinnabarinus (Boisduval) (Acarina: Tetranychidae). Journal of Asia-Pacific Entomology. 14: 353-356. [ Links ]
26. Wu, K. M.; Liu, X. C.; Qin, X. Q.; Luo, G. Q. 1990. Investigation of carmine spider mite (Tetranychus cinnabarinus) resistance to insecticides. Acta Agricultura Boreali-Sinica. 5: 117-123. [ Links ]
27. Yanar, D.; Kadıoğlu, D.; Gökçe, A. 2011. Ovicidal activity of different plant extracts on two spotted spider mite (Tetranychus urticae Koch) (Acari: Tetranychidae). Scientific Research and Essays. 6(14): 3041-3044. [ Links ]
28. Zhao, X.; Zheng, G.-W.; Niu, X. M.; Li, W. Q.; Wang, F.-S.; Li, S. H. 2009. Terpenes from Eupatorium adenophorum and their allelopathic effects on Arabidopsis seeds germination. Journal of Agricultural and Food Chemistry. 57: 478-482. [ Links ]
Agradecimientos
A la Universidad Arturo Prat por el financiamiento de este estudio.














