Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versão On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.46 no.2 Mendoza dez. 2014
NOTA CIENTIFICA
Biofertilización de Azospirillum spp. y rendimiento de grano de maíz, sorgo y trigo
Azospirillum spp. biofertilization and corn, sorghum and wheat grain yield
José Antonio Rangel Lucio 1, Rosa María Ramírez Gama 2, Francisco Cervantes Ortíz 3, Mariano Mendoza Elos 3, Edmundo García Moya 4, J. Guadalupe Rivera Reyes 2
1 Instituto Tecnológico de Ciudad Victoria. Boulevard Emilio Portes Gil #1301 Poniente. Ciudad Victoria, Tamaulipas, México. C. P. 87,010. anrangel@itroque.edu.mx
2 Facultad de Química. Universidad Nacional Autónoma de México. Ciudad Universitaria. Coyoacán, México. D. F. México. C. P. 04510
3 Instituto Tecnológico de Roque. Kilómetro 8 carretera Celaya-Juventino Rosas, Sin Número. Celaya, Guanajuato, México. C. P. 38,110.
4 Colegio de Postgraduados. Kilómetro 36.5 carretera México-Texcoco. Montecillo, Texcoco, estado de México, México. C. P. 56,264.
Originales: Recepción: 15/04/2013 - Aceptación: 10/07/2014
RESUMEN
El escrito muestra evidencias del uso de Azospirillum spp. en la producción de grano de maíz, sorgo y trigo en México. Los ensayos en campo se desarrollaron en dos sitios geográfica y tecnológicamente distintos con semillas inoculadas y sembradas con cepas de A. lipoferum o A. brasilense. Los resultados permiten apreciar una respuesta benéfica de la inoculación sólo para sorgo con cepas de A. brasilense VS-7 o VS-9, debido a que el rendimiento de grano fue significativamente mayor (55 y 49%), que el testigo fertilizado. Este resultado prueba la afinidad existente entre sorgo y A. lipoferum VS-7 ó VS-9 y el uso potencial de la biofertilización en una región con nivel tecnológico-productivo medio.
Palabras clave: Fijación de nitrógeno; Cepas; Rendimiento de grano; Afinidad
ABSTRACT
This manuscript argues about the Azospirillum spp. biofertilization profit, through grain yield of corn, sorghum and wheat tilled in Mexico. The assays were development in two different places. The seeds were inoculated with A. lipoferum or A. brasilense strains and later sowed. The results demonstrated a beneficial response to inoculation only for sorghum because of A. lipoferum VS-7 or VS-9 strains effect: the grain yield was significantly greater (55% and 49%) than nitrogen fertilizer effect. This result shown the affinity between sorghum plants and A. lipoferum VS-7 or VS-9 strains and the biofertilization potential use in a Mexico region where the agriculture production development a middle technology.
Keywords: Nitrogen fixation; Strain; Grain yield; Affinity
INTRODUCCIÓN
La mayor proporción de nitrógeno (N) en ecosistemas terrestres y acuáticos proviene de la fijación biológica (FBN), (23). La integración de FBN a cultivos mejoraría la sustentabilidad de sistemas agrícolas como maíz, sorgo y trigo, demandantes de N o de leguminosas (7).
A la relación entre organismos fijadores de N y cultivos se le conoce como simbiosis y, de acuerdo con el sitio de colonización, la bacteria puede ser rizosférica o endofítica (19).
Azospirillum se desarrolla y nutre en la raíz (15) y suministra N a la planta (4), se desarrolla en diversos ambientes edáficos (3) asociado a cereales (21) y otras especies. Además, sintetiza fitohormonas que promueven el crecimiento y cambios morfológicos y fisiológicos de la raíz y ejercen micro-biocontrol (8), mejora el aprovechamiento de agua y nutrimentos e incrementa rendimiento y productividad (12). Cuando Azospirillum exhibe quimiotaxia con algún genotipo particular se le refiere como afinidad (14), estudiada en maíz (20) y comprobada entre cepas de Azospirillum aisladas y reinoculadas en maíces liberados recientemente (22).
Existe afinidad entre Azospirillum y maíz (9), pero entre esta bacteria y cultivares de maíz es escasa (27). Efecto que también se ha reportado en trigo (1) y Pennisetum americanum (L.) K. Shum (25), aunque el éxito de Azospirillum es mayor entre la cepa y la especie vegetal apropiada. Algunos estudios destacan la afinidad entre Azospirillum y maíz, pero el grado de respuesta varía con el genotipo (17). Estos buscan aumentar rendimiento de cereales (5), sin embargo, la aceptación de Azospirillum como inoculante en México se fundamenta en resultados de investigación desarrollados en laboratorio e invernadero, pero se sugiere su comercialización sin pruebas consistentes en campo, donde la cepa inoculada pierde eficacia ante cepas nativas. En tal sentido, este trabajo tiene como objetivo corroborar el efecto de la biofertilización de cepas de Azospirillum inoculadas a campo, analizando la producción de grano de maíz, sorgo y trigo, bajo la hipótesis que la biofertilización de este tipo de rhizobacterias estimula la producción de grano de los tres cereales.
MATERIALES Y MÉTODOS
El ensayo de maíz se desarrolló en un suelo Molisol con 6 % de pendiente, 15 a 20 cm de profundidad, 30% de rocas calcimórficas (3,308 mg kg-1 de Ca) en el perfil y superficie, materia orgánica 2,8%, 0,5% de N, CE de 1,1 cmolckg-1, pH=7,8 y Franco Arcilloso, en Miacatlán, Morelos, México: 18°45'31,07" N y 99°22'16,72" O; 1,013 m de altura.
El clima es cálido subhúmedo, el más seco de los subhúmedos, con lluvias en verano y, a mediados de éste, presencia de canícula; llueven 800 mm y tiene temperatura de 22 a 26°C (16).
El maíz se fertiliza con la fórmula 80-40-00 (6). Los niveles 0, 40 y 80 kg de N/ha se combinaron con: A. lipoferum cepa MT (aislada de maíz por la UNAM), A. brasilense cepas VS-7 (sorgo, UNAM) y SP-7 (Digitaria decumbens Stent) y CD [Cynodon dactylon (L.) Pers.)] como testigos internacionales; más testigo absoluto (T-) y fertilizado con 80 kg de N/ha (T+). Se formaron 15 tratamientos.
La carga bacteriana fue 109ufc/g. Trazo de surcos y escardas se practicaron con yunta de bueyes.
La semilla de maíz nativo "Costeño" se impregnó con la turba-cepa y depositó cada 0,5 m el 1° de julio de 2012; enseguida se aplicó mitad de N (urea) y todo el fósforo (superfosfato de Ca triple) y, la segunda parte de N, 20 días después de la emergencia (dde).
La población se ajustó a 50 mil plantas/ha.
La parcela útil tuvo 5,4 m2 y los tratamientos se repitieron cinco veces. El diseño experimental fue bloques completos al azar con arreglo en parcelas divididas: a) fertilización química nitrogenada, en parcelas grandes y; b) cepas de Azospirillum, en parcelas chicas.
Las malezas se controlaron manualmente y Spodoptera frugiperda Smith con 150 mL ha-1 de Decis® FORTE (i.a.: Deltametrina, 100 g L-1), 40 días después de la siembra (dds). Después de la cosecha (122 dds) se obtuvo producción de grano maíz.
El experimento con sorgo se realizó en el sitio indicado para maíz pero pendiente arriba. El análisis de suelo mostró 1,77% de materia orgánica, 0,08 % de nitrógeno total, pH de 7,8 y Migajón Arcilloso. La ubicación es 18°45'32,25" N y 99°22'16,72" O y 1,014 m de altura.
Los tratamientos fueron la mitad de la sugerencia (6), 120 kg ha-1 de N (T+), cinco cepas: A. lipoferum VS-1 (aislada de sorgo) y A. brasilense [VS- 7 y VS-9 (sorgo), VT-1 (maíz) y SP-7], donadas por la UNAM, y testigo absoluto (T-).
La carga de cepas inoculadas fue 10g/kg de semilla de sorgo (Sorghum bicolor Moench. cv. Master Gold). Trazo de surcos y escardas se practicaron con yunta de bueyes, y la siembra se hizo el 28 de junio de 2012, en "banda" (14 kg ha- 1); antes se aplicó mitad de N (sulfato de amonio) y todo el fósforo (100 kg de P2O5, superfosfato de Ca simple), y 30 dds la segunda parte de N.
La parcela útil se formó en 4,2 m2 centrales de la unidad experimental.
El diseño experimental consistió en bloques completos al azar, con cuatro repeticiones.
Las malezas se controlaron manualmente.
La producción de grano se estimó de10 plantas en antesis (cosecha, 105 dds).
El trabajo con trigo se hizo en Celaya, Guanajuato, México, en un suelo Vertisol Pélico, primera calidad por su uso, pH=7,6, bajo en materia orgánica y N de 0,098 a 0,154%. Localizado en 20°35'53,76" N y 100°48'51,13" O y 1,770 m de altura; el clima es semicálido, subhúmedo, estación seca en invierno, 670 mm de lluvia anual y 18 a 20°C (16).
La parcela útil fue de 5,40 m2 y el diseño experimental en bloques completos al azar con arreglo en parcelas divididas: a) variedad de trigo, en parcelas grandes y; b) biofertilizantes y testigo absoluto (T-, 0 kg de N/ha) y nitrogenado (T+, 240 kg ha-1), en parcelas chicas.
Las variedades de trigo Salamanca, Saturno, Temporalera, Marte, Romuma y Verano, tienen ciclo de 115 a 155 d y producción de grano de 5 a 7 t ha-1.
Las cepas fueron A. lipoferum VS-1 y A. brasilense VS-7, C4 (aislada de trigo, UNAM) y CD, inoculadas con una carga de 1,4 g de biofertilizante/1% de semilla (109ufc/g de bacterias). Se formaron 36 tratamientos.
La mitad de N (urea) y todo el fósforo (80 kg/ha de P2O5 en superfosfato de Ca triple) se distribuyeron en la siembra (19 de diciembre de 2011); la segunda parte de N, 20 dds. La densidad de siembra fue 120 kg ha-1 de semilla, impregnada con las cepas. Se dio riego de siembra y seis adicionales en el ciclo, cada 25 ó 30 d, con agua de pozo profundo. El control de malezas fue manual y Schizaphis graminum (Rondani) con 600 cc de Dimetoato EC 37,6%. La producción de trigo se estimó en10 espigas, cosechadas entre 17 de abril y 27 de mayo de 2012.
Los resultados de rendimiento de grano de maíz, sorgo y trigo se sometieron a ANOVA con el paquete SAS v.9 (24) y los valores medios se compararon con Tukey, α = 0,05.
RESULTADOS Y DISCUSIÓN
El rendimiento de grano de maíz no fue significativamente afectado por efectos simples o combinados de los factores. Este resultado, aunque es contrario a la eficacia generalizada de Azospirillum (17), podría mostrar su lado positivo al emplear sólo la cepa A. brasilense MT que produjo 6,131 kg ha-1 de grano de maíz, valor ligeramente inferior al testigo absoluto, 6,149 kg ha-1. Una explicación posible de ello podría ser la falta de adaptación de las cepas inoculadas y a la fuerte competencia que desarrollan las cepas nativas encontradas en 20% de muestras de raíz de maíz de 20 días de edad, sin fertilizar con nitrógeno (datos no mostrados).
Las cepas nativas también estuvieron en 53 y 20% de raíces de maíz tratadas con nivel medio (40 kg de N/ha) o alto de N (80 kg de N/ha), sin embargo, el incremento de fertilizante nitrogenado redujo el efecto promotor de las cepas de Azospirillum spp. en el rendimiento de grano de maíz. Esto demuestra el daño que causa el fertilizante nitrogenado en la microbiota del suelo. Sin embargo, el concepto afinidad (13) podría tener respaldo en la biofertilización de A. brasilense MT en maíz. Además, la disminución de área fotosintética de maíz "Costeño" por el ataque de S. frugiperda, pudo haber interrumpido momentáneamente el flujo de fotoasimilados hacia la raíz en la relación biológica planta y hospedero y, por lo tanto, la respuesta óptima en el rendimiento de grano. El maíz tradicional es afectado con mayor severidad por gusano cogollero conforme a la región y fecha de siembra, además de condiciones climáticas (2). El maíz nativo "Costeño" se adapta, además de Morelos, a la zona limítrofe formada por los estados mexicanos de Puebla, Guerrero y Oaxaca, conocida como la Mixteca (11).
Por otro lado, el estímulo de cepas de A. brasilense VS-7 y VS-9 incrementó significativamente la producción de grano de sorgo (tabla).
Tabla. Producción de grano de sorgo biofertilizado con Azospirillum. Miacatlán, Morelos, México. 2012.
Table. Grain production of sorghum biofertilized with Azospirillum strains. Miacatlán, Morelos, México. 2012.
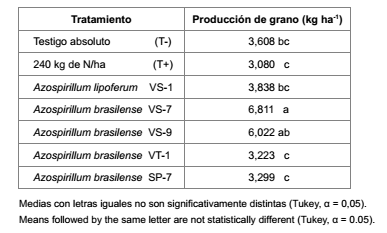
Así, un aumento de 47 y 55 % de la producción fue debida a la biofertilización de A. brasilense VS-7, y de 38 y 49% con A. brasilense VS-9, respecto a testigos absoluto y fertilizado con 240 kg de N/ha.
Resultados que son consistentes con el aislamiento de Azospirillum de la raíz de un hospedero; es decir, se tiene mayor eficacia en la producción al inocularse en hospedero afín (5). Además, existen estudios que demuestran que A. brasilense incrementó entre 5 y 23% la producción de grano de sorgo en semiaridez (18); mientras (10), también señalan buena producción de grano de sorgo al inocular A. brasilense, además de micorrizas. Estos resultados equivaldrían a aplicar 240 kg de N/ha sugeridos para producir sorgo en la región de estudio (tabla).
En cambio, hubo ausencia de diferencias significativas en la producción de grano de trigo por efecto de Azospirillum, variedad de trigo o su interacción (figura 1, pág. 236): el uso de 240 kg de N/ha, fue significativo al aumentar la producción ca. 8 t ha-1, mientras que con A. brasilense C4 y testigo absoluto, la producción fue ligeramente superior a 6 t ha-1, un resultado favorable ante el costo del fertilizante nitrogenado.

Figura 1. Producción de grano de trigo biofertilizado con cepas de Azospirillum. Celaya, Guanajuato, México. 2011-2012.
Figure 1. Grain production of wheat biofertilized with Azospirillum strains. Celaya, Guanajuato, Mexico. 2011-2012.
Esto pudo haber sido porque el trigo mejorado exige la fertilización química, como N alto, para la buena nutrición, formación de follaje y mejor producción de grano.
La incorporación de N se asocia a un nivel tecnológico alto, como ocurre en Celaya, Guanajuato, donde se usa intensamente. Por el contrario, autores (26) afirman que, la inoculación de Azospirillum permitió incrementar la producción de trigo y sugieren el uso de variedades aptas ante la biofertilización. Además, evidencias positivas de la biofertilización y nivel medio de nitrógeno se tienen al incrementar el rendimiento de 10 a 40% sobre el testigo (22).
CONCLUSIONES
La biofertilización de Azospirillum spp. demostró beneficios potenciales únicamente en la producción de grano de sorgo, en particular las cepas de A. brasilense VS-7 y VS-9 al tener un efecto 55 y 49% superior que el testigo fertilizado con nitrógeno. Estos resultados también demostraron la afinidad existente entre cepa y genotipo vegetal, una relación que merecer mayor atención en trabajos de investigación por desarrollar.
1. Alamri, S. A.; Mostafa, Y.S. 2009. Effect of nitrogen supply and Azospirillum brasilense Sp-248 on the response of wheat to seawater irrigation. Saudi Journal of Biological Science. 16(2): 101-107. [ Links ]
2. Ayala, O. R.; Navarro, F.; Virla, E. G. 2013. Evaluation of the attack rates and level of damages by the fall armyworm, Spodoptera frugiperda (Lepidoptera: Noctuidae), affecting corn-crops in the northeast of Argentina. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 45(2): 1-12. [ Links ]
3. Bashan, Y.; Holguin G.; de-Bashan, L. E. 2004. Azospirillum-plant relationships: physiological, molecular, agricultural and environmental advances (1997-2003). Canadian Journal of Microbiology. 50(8): 521-557. [ Links ]
4. Bashan, Y.; de-Bashan, L. E. 2010. How the Plant Growth-Promoting Bacterium Azospirillum Promotes Plant Growth. Chapter II. A Critical Assessment Advances of Agronomy. 108: 77-136. [ Links ]
5. Boddey, R. M.; Döbereiner, J. 1988. Nitrogen fixation associated with grasses and cereals: recent results and perspectives for future research. Plant and Soil. 108: 53-65. [ Links ]
6. CAEZACA (Centro Agrícola Experimental Zacatepec). 1981. Guía para la Asistencia Técnica Agrícola. Área de Influencia del CAEZACA-INIA-SARH. Zacatepec, Morelos, México. 32 p. [ Links ]
7. Córdova-Sánchez, S.; Cárdenas-Navarro, R.; Peña-Cabriales, J. J.; Salgado-García, S.; Castelán- Estrada, M.; Lobbit-Phellipe, C.; Vera-Núñez, J. A. 2013. Fijación biológica de nitrógeno por cuatro fabáceas en suelos ácidos de Tabasco, México. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 44(1): 1-9. [ Links ]
8. Correa, O. S.; Romero, A. M.; Montecchia, M. S.; Soria, M. A. 2007. Tomato genotype and Azospirillum inoculation modulate the changes in bacterial communities associated with roots and leaves. Journal of Applied Microbiology. 102: 781-786. [ Links ]
9. De-Bashan, L. E.; Holguin, G.; Glick, B. R.; Bashan, Y. 2007. Bacterias promotoras de crecimiento en plantas para propósito agrícolas y ambientales. In: Microbiología Agrícola. Hongos, bacterias, micro y macrofauna, control biológico y planta micro-organismo. Ferrera-Cerrato, R.; Alarcón, R. (Editores). Editorial Trillas. México, D. F. p. 170-224. [ Links ]
10. Díaz-Franco, A.; Jacques-Hernández, C.; Peña del Río, M. A. 2008. Productividad de sorgo en campo asociada con micorriza arbuscular y Azospirillum brasilense. Universidad y Ciencia. 24(3): 229-237. [ Links ]
11. Diego-Flores, P.; Carrillo-Rodríguez, J. C.; Chávez-Servia, J. L.; Castillo-González, F. 2012. Variabilidad en poblaciones de maíz nativo de la Mixteca Baja Oaxaqueña, México. Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo. Mendoza. Argentina. 44(1): 157-171. [ Links ]
12. Dobbelaere, S.; Croonenborghs, A.; Thys, A.; Ptacek, D.; Vanderleyden, J.; Dutto P.; Labandera-Gonzalez, C.; Caballero-Mellado, J. J.; Aguirre, J. F.; Kapulnik, Y; Berner, S.; Burdman, S.; Kadouri, D.; Sarig, S.; Okon, Y. 2001. Responses of agronomically important crops to inoculation with Azospirillum. Australian Journal of Plant Physiology, 28: 871-879. [ Links ]
13. Dobbelaere, S.; Croonenborghs, A.; Thys, A.; Ptacek, D.; Okon, Y.; Vanderleyden, J. 2002. Effect of inoculation with wild type Azospirillum brasilense and A. irakense strains on development and nitrogen uptake of spring wheat and grain maize. Biology and Fertility of Soils, 36(4): 284-297. [ Links ]
14. dos Santos, A.M.; dos Santos, T.K.T.; Kirchhof, G.; Hartmann, A.; Baldani, JI. 2005. Influence of soil and host plant crop on the genetic diversity of Azospirillum amazonense isolates. Pedobiologia, 49(6): 565-576. [ Links ]
15. El-Tarabily, K. A.; Nassar, A. H.; Hardy, G. E. S. J.; Sivasithamparam, K. 2009. Plant growth promotion and biological control of Pythiumaphani dermatum, a pathogen of cucumber, by endophytic actinomycetes. Journal of Applied Microbiology, 106:13-26 [ Links ]
16. García, E. 1988. Modificaciones al Sistema de Clasificación Climática de Köppen para la República Mexicana. 5ª. Edición. Talleres de Offset Larios, S. A. México, D. F. 220 p. [ Links ]
17. García de Salamone, I. E. 2009. Ecophysiology of the response to Azospirillum inoculation of cereal crops in Argentina. Progress in the use of PGPR. 8th. IPGPR Workshop. Mayo 17-22, 2009. Portland, Oregon, USA. p. 48. [ Links ]
18. Mendoza-Herrera, A.; Cruz-Hernández, A.; Jacques-Hernández, C. 2008. Aislamiento, selección y evaluación de un inoculante basado en cepas nativas de Azospirillum en el norte de Tamaulipas. In: Díaz-Franco, A. y N. Mayek-Pérez (Editores). La Biofertilización como Tecnología Sostenible. Plaza y Valdés-CONACYT. Distrito Federal, México. 257 p. [ Links ]
19. Montañez, A.; Abreu, C.; Paul, R.; Gill, P.R.; Hardarson, G.; Sicardi, M. 2008. Biological nitrogen fixation in maize (Zea mays L.) by 15N isotope-dilution and identification of associated culturable diazotrophs. Biology and Fertility of Soils, 45(3): 253-263. [ Links ]
20. Pecina-Quintero, V.; Díaz-Franco, A.; Williams-Alanís, H.; Rosales-Robles, E.; Garza-Cano, I. 2005. Influencia de fecha de siembra y biofertilizantes en sorgo. Revista Fitotecnia Mexicana, 28(4): 389-392. [ Links ]
21. Pereyra, C. M.; Ramella, N. A.; Pereyra, M. A.; Barassi, C. A.; Creus, C. M. 2010. Changes in cucumber hypocotyl cell wall dynamics caused by Azospirillum brasilense inoculation. Plant Physiology and Biochemistry, 48(1): 62-69. [ Links ]
22. Rangel-Lucio, J. A.; Rodríguez-Mendoza, M. N.; Ferrera-Cerrato, R.; Castellanos-Ramos, J. Z.; Ramírez-Gama, R. M.; Alvarado-Bárcenas, E. 2011. Afinidad y efecto de Azospirillum spp. en maíz. Agronomía Mesoamericana, 22(2): 269-279. [ Links ]
23. Roesch, L. F. W.; Camargo, F. A. O.; Bento, F. M.; Triplett, E. W. 2008. Biodiversity of diazotrophic bacteria within the soil, root and stem of field-grown maize. Plant and Soil, 302(1-2): 91-104. [ Links ]
24. SAS (Statistical Analysis System). 2002. The SAS System for Windows 9.0. User’s Electronic Guide: Statistics. SAS Institute, Inc. Cary, N. C. USA.
25. Tien, T. M.; Gaskins, M. H.; Hubbell, D. H. 1979. Plant growth substances produced by Azospirillum brasilense and their effect on the growth of Pearl Millet (Pennisetum americanum L.). Applied and Environmental Microbiology, 37: 1016-1024. [ Links ]
26. Villarreal, R. M.; Ferrera-Cerrato, R.; Volke, H. V.; Hernández, S. A. 1990. Aislamiento y evaluación de Azospirillum sp. por afinidad con trigo (Triticum aestivum L.). Agrociencia, 1(3): 183-198. [ Links ]
27. Warenbourg, F. R.; Dressen, R.; Vlassak, K.; Lafont, F. 1987. Pecculiar effect of Azospirillum inoculation on growth and nitrogen balance of winter wheat (Triticum aestivum L.). Biology and Fertility of Soils. 4: 55-59. [ Links ]














