Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de la Facultad de Ciencias Agrarias. Universidad Nacional de Cuyo
versão On-line ISSN 1853-8665
Rev. Fac. Cienc. Agrar., Univ. Nac. Cuyo vol.47 no.1 Mendoza jun. 2015
ARTICULO ORIGINAL
Efecto de la fertilización fosfatada con cachaza sobre la actividad microbiana del suelo y la absorción de fósforo en caña de azúcar (Saccharum spp.)
Effect of the phosphate fertilizer with filter cake on soil microbial activity and phosphorous uptake in sugar cane
Orlando Saucedo Castillo 1, Renato de Mello Prado 2, Leónides Castellanos González 3, Nahas Ely 2, Cid Naudi Silva Campos 2, Gilmara Pereira Da Silva 2, Luis Carlos Assis 2
1 Facultad Ciencias Agropecuarias. Universidad Central "Marta Abreu" de Las Villas (UCLV). Santa Clara, Villa Clara, C. P. 50.100, Cuba. saucedo@uclv.edu.cu
2 Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista "Júlio de Mesquita Filho", (UNESP). Jaboticabal, São Paulo, C. P. 1009, Brasil.
3 Centro de Estudios para la Transformación Agraria Sostenible. Facultad de Ciencias Agrarias. Universidad de Cienfuegos, Cienfuegos, C. P. 55100, Cuba. lcastellanos@ ucf.edu.cu, lclcastell@gmail.com
Originales: Recepción: 08/02/2014 - Aceptación: 09/04/2015
RESUMEN
El objetivo del trabajo fue evaluar el efecto de diferentes dosis de fertilizante fosfatado con la adición de cachaza sobre la actividad microbiana del suelo, y el contenido de fósforo en el suelo y en plantas de caña de azúcar. El experimento se condujo en condiciones de invernadero en Jaboticabal Brasil en 2013, usándose plántulas de caña de azúcar (variedad "CTC 05"). Las unidades experimentales estuvieron constituidas por macetas cargadas con un Hapludox. Se empleó un diseño completamente aleatorizado, con el arreglo factorial de 5x2 y tres repeticiones. Los tratamientos fueron cinco dosis de fósforo: 0, 50, 100, 200 y 400 mg dm-3 y dos niveles de cachaza (ausencia y presencia). Se evaluaron la actividad respiratoria, la fosfatasa ácida y la deshidrogenasa, el carbono soluble, el pH y el tenor de P en el suelo, así como el P acumulado en las plántulas. Se encontró interacción entre las dosis de P y la cachaza para todas las variables, excepto para el pH y el carbono soluble. El fosfato con la adición de cachaza aumentó la actividad microbiana y el fósforo disponible en el suelo, reflejándose en una mayor acumulación de P en las plantas.
Palabras clave: Saccharum spp; Compuesto orgánico; Deshidrogenasa; Fosfatasa; Enzimas
ABSTRACT
The objective of the work was to evaluate the effect of different doses of phosphate fertilizer with the addition of sugar cane industry filter cake on the soil microbial activity and soil and plant P concentration in sugar cane. The experiment was carried out in vegetation house at Jaboticabal, Brazil, in 2013, and the sugar cane seedlings variety "CTC 05"was used as tests plant. The experimental units were pots containing Hapludox. A completely randomized design was used, with factorial arrangement of 5x2 and three repetitions. The treatments were five phosphorus doses: 0, 50, 100, 200 and 400 mg dm-3 and two levels of filter cake (absence and presence). Soil respiration, acid phosphatase and dehydrogenase activity, soluble carbon, pH value, soil and plant P concentrations. There was interaction among doses of P and filter cake application for all the variables, except for the pH. The phosphate with the addition of filter cake increased the microbial activity, the value of the pH and the P concentration in the soil, being reflected in a higher accumulation of P in the seedling.
Keywords: Saccharum spp; Organic compound; Dehydrogenase; Phosphatase; Enzymes
INTRODUCTION
En el cultivo de la caña de azúcar el fósforo (P) es fundamental en la síntesis y almacenamiento de azúcares, aumentando el número de entrenudos y el rendimiento agrícola (12, 14). Sin embargo en la mayoría de los suelos tropicales, donde se presentan considerables cantidades de óxido de hierro y de aluminio, hay una alta absorción de P por estos minerales, siendo menos disponible para las plantas. Por lo tanto, la baja disponibilidad de P se convierte en un factor limitante para el desarrollo de los vegetales (22).
Diferentes investigaciones internacionalmente se refieren al aumento de la eficiencia de la fertilización fosfatada utilizando la cachaza, contribuyendo en la caña de azúcar a mejorar la calidad del suelo y la acumulación de P en las plantas reduciéndose los costos de la fertilización, maximizándose el efecto sobre la productividad del cultivo (1).
El uso de la cachaza puede reducir las dosis de fertilizante mineral hasta un 25% y aún así obtener buenos rendimientos en el cultivo de caña de azúcar (5), aumentándose la disponibilidad de P en el suelo, siendo una importante fuente alternativa de fósforo (30, 31).
La cachaza (subproducto obtenido en el proceso industrial de elaboración del azúcar de caña) está constituida de materia orgánica y contiene especialmente P, también, N, Ca, K, Mg (22). Los beneficios obtenidos por el uso de este compuesto se pueden atribuir al aumento de la actividad de los microorganismos y enzimas que facilitan del proceso de solubilización de P en el suelo, contribuyendo así a una mayor disponibilidad del nutriente para las plantas (34).
Los microorganismos contenidos en el suelo se consideran como un reservorio de P lábil y juegan un papel importante en el ciclo y la disponibilidad de este nutriente (24). Sin embargo, de acuerdo con Nahas (2002), la población de los microorganismos del suelo, especialmente los productores de fosfatasas han sido poco estudiados.
Teniendo en cuenta los limitados estudios que vinculan los niveles de P y la cachaza con los procesos microbiológicos y enzimáticos en el suelo y la absorción de P por las plantas de caña de azúcar, el objetivo del trabajo fue evaluar el efecto de diferentes dosis de fertilizante fosfatado con la adición de cachaza sobre la actividad microbiológica y enzimática del suelo, el contenido de P en el suelo y su acumulación en las plántulas de caña de azúcar en condiciones de invernadero.
MATERIALES Y METODOS
El experimento se llevó a cabo en la casa de vegetación en la Facultad de Ciencias Agrarias y Veterinarias de la Universidad Estadual Paulista (Unesp-FCAV), Jaboticabal - SP, Brasil, entre agosto y noviembre de 2013, utilizándose plántulas de caña de azúcar.
Se utilizó un suelo Hapludox típico, procedente de la Estación Experimental de la Unesp-FCAV, Jaboticabal, el cual de acuerdo con los análisis realizados por la metodología de Raij et al. (2001) presentaba las siguientes características: pH = 5,5; materia orgánica = 8 g dm-3; P disponible = 6 mg dm-3 ; K = 1,4 mmolc dm-3; Ca = 16 mmolc dm-3; Mg = 9 mmolc dm-3; Al = 15 mmolc dm-3; suma de bases = 26,4 mmolc dm-3; capacidad de intercambio catiónico = 41,4 mmolc dm-3; saturación por bases = 63,5 %, B = 0,20 mg dm-3; Cu = 0,2 mg dm-3; Fe = 4,0 mg dm-3; Mn = 4,2 mg dm-3 y Zn = 0,3 mg dm-3.
Treinta días antes de la plantación, se realizó un encalado del suelo para corregir la acidez y elevar la saturación de bases al 70%, lo cual está recomendado en Brasil para el cultivo de la caña de azúcar (25).
Se utilizó un diseño completamente al azar con arreglo factorial 5 x 2 y tres repeticiones. Los tratamientos consistieron en cinco niveles de P: 0, 50, 100, 200 y 400 mg dm-3 en forma de superfosfato triple (P2O5 total de 46% y 42% de P2O5 soluble en ácido cítrico al 2%) y dos niveles de cachaza (ausencia y presencia). La cachaza fue obtenida de una Central azucarera, ubicado en el municipio de Catanduva, perteneciente al estado de Sao Paulo, Brasil, presentando un proceso de descomposición de seis meses. Las características químicas de la cachaza de acuerdo con la metodología propuesta por Bataglia et al. (1983), fueron las siguientes: para los macronutrientes (g kg-1): N= 17,1; P = 2,3; K = 0,7; Ca = 3,6; Mg = 0,7; S = 2,7 y para los micronutrientes (mg kg-1) B y Cu = 27; Fe = 20 600; Mn = 217; Zn = 43.
La cachaza fue mezclada uniformemente con el suelo a razón de 15 g dm-3, correspondiente a 30 Mg ha-1 de peso seco. En todos los tratamientos, se aplicó nitrógeno (200 mg dm-3) en la forma de sulfato de amonio (20% N) y potasio (150 mg dm-3) en forma de cloruro de potasio (60% de K2O).
Las plántulas de caña de azúcar se obtuvieron a partir de secciones de tallos de 8 cm conteniendo una yema, los cuales se colocaron para su brotación en vasos de polipropileno de 0,5 dm3 con arena lavada. Cuando las plántulas alcanzaron una altura de 15 cm se trasplantaron a macetas de 20 dm3 (dos plántulas por maceta). Se realizaron riegos diarios manteniendo la humedad del suelo entre 60% y 70% de su capacidad de campo.
A los 90 días después de iniciado el experimento se colectaron las plántulas y se realizó un muestreo de suelo para determinar el contenido de P disponible (CP) y el pH, de acuerdo con la metodología descrita por Raij et al. (2001), y las variables microbiológicas. Para éstas, las muestras se almacenaron en bolsas plásticas y protegidas de la luz, permaneciendo en refrigerador hasta su procesamiento posterior. En los restantes análisis realizados las muestras fueron secadas en una estufa a 45°C y posteriormente tamizadas (2 mm).
Para determinar la actividad respiratoria (AR) se tomaron 100 g de suelo que se colocaron en incubación tapados herméticamente a 100% de capacidad de campo durante 4 días a 30°C. En el interior de cada frasco se colocó un beaker con 20 mL de hidróxido de sodio, al cual se le añadió al final de la etapa 2 mL de cloruro de bario al 30% y tres gotas de fenoftaleina al 1%, realizándose la titulación con HCl hasta el cambio de coloración de rojo a blanco lechoso (28), expresándose en mg CO2100 g suelo.
El carbono soluble (CS) se determinó a partir de 1,0 g de suelo, al cual se le adicionó agua desionizada, se llevó a baño de María, se filtró, se le añadió antrona, (10-ceto-9,10- dihidroantraceno) para la reacción de color y se puso de nuevo en baño de María. Se hizo la lectura de la absorbancia en un espectrofotómetro a 607 nm. La concentración de C se calculó sobre la base de la ecuación de la recta o curva de calibración obtenida a partir de una solución patrón de glucosa (11), determinándose en µg C ml-1g-1ss
La actividad de la fosfatasa ácida (FA) se determinó pesando 0,2 g de suelo al cual se le añadió una solución tampón y se colocó a baño de María para estabilizar la temperatura. Se añadió p-nitrofenol (p-NPP), se midió el tiempo de reacción con un cronómetro y se puso de nuevo en baño de María. Posteriormente se agitó y se añadió cloruro de calcio e hidróxido de sodio. Finalmente se midió la absorbancia en el espectrofotómetro y se estimó la actividad en función del tiempo de reacción, el peso de la muestra y la ecuación de la curva patrón de p-PPN (8) siendo determinada en µg p-NF g-1ss h-1.
La actividad de la deshidrogenasa (DH) se determinó a partir de una muestra de 3,0 g de suelo a la cual se le adicionó CaCO3 y posteriormente una solución acuosa de Triphenyl Tetrazolium Cloride de Sodio (TCT) al 3%, se puso a incubar a 30°C durante 24 horas y se extrajo el TCT con etanol y se filtró. Se leyó la absorbancia en el espectrofotómetro. Se estableció una curva patrón de TFF (Triphenilformazan) donde se determina el valor (µg TFF/ mL) para cada muestra. Se calculó la actividad en dependencia del volumen de la muestra, la concentración obtenida en la curva patrón, la dilución de la enzima y el peso de la muestra (33) expresada en µg TFF ml-1g-1 ss.
Se determinó la materia seca y el contenido de P de la parte aérea de las plántulas de caña de azúcar. Para esto, el material recogido se colocó en bolsas de papel y se secó en un horno con circulación de aire forzado a 65°C durante 96 horas, tiempo suficiente para que alcanzaran un peso constante. Después de secar, se pesaron las muestras y se obtuvo el peso seco por maceta. A continuación, las muestras se molieron en un molino Willey, determinándose el contenido de P, de acuerdo con la metodología descrita por Bataglia et al. (1983). Sobre la base de la masa seca y el contenido de P, se calculó la acumulación de P por maceta (AP).
Los datos fueron sometidos a análisis de varianza. Las medias se compararon mediante la prueba de Tukey (P <0,05). Se utilizó el programa estadístico SPSS (Statistical Package for the Social Sciences).
RESULTADOS
Se establecieron diferencias significativas entre los tratamientos en todas las variables analizadas, siendo en general siempre mayores los que tienen aplicación de cachaza, mientras que los tratamientos con diferentes dosis de P no variaron entre sí en AR, FA y pH (tabla 1).
Tabla 1. Valores de probabilidad para los tratamientos en estudio en las variables: actividad respiratoria (AR), fosfatasa ácida (FA), carbono soluble (CS), deshidrogenasa (DH), pH, contenido de P en el suelo (CP), acumulación de fósforo (AP) en la parte aérea de la planta de caña de azúcar.
Table 1. Probability values for the studied treatments in the variables: soil respiration (AR), acid phosphatase (FA), soluble carbon (CS), dehydrogenase (DH), pH, soil P concentration (CP), and P accumulation in aerial parts of sugarcane plants (AP).
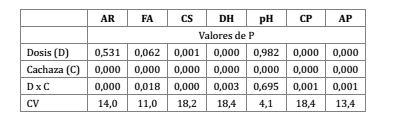
Se detectaron interacciones significativas entre dosis de P y presencia de cachaza en todos los parámetros, excepto en pH (tabla 1).
La AR fue más elevada en los tratamientos con aplicación de cachaza, presentando el valor más bajo con dosis P0 sin cachaza (sin diferir de dosis P50, P100 y P200) y el más elevado con dosis P100 con cachaza (sin diferir de dosis P0, P50 y P200).
Es de destacar que sin cachaza la actividad respiratoria mostró una tendencia a ser mayor con dosis más altas de P, mientras que con cachaza la dosis más alta de P (400 mg dm-3) presentó valores más bajos que con dosis P100 (tabla 2, pág. 38).
Tabla 2. Efecto de dosis de P en combinación con cachaza sobre la actividad respiratoria (AR), la fosfatasa ácida (FA), el carbono soluble (CS), la deshidrogenasa (DH), la concentración de P en el suelo (CP), y la acumulación de P (AP) en la parte aérea de la planta de caña de azúcar.
Table 2. Effect of P dose and filter pie, on soil respiration (AR), acid phosphatase (FA), soluble carbon (CS), dehydrogenase (DH) soil P concentration (CP) and P accumulation in aerial parts of sugarcane plants (AP).
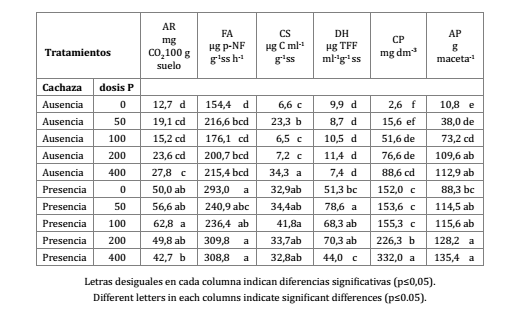
Contrariamente, en FA no visualizó esa tendencia siendo muy clara solo la separación entre presencia y ausencia de cachaza (tabla 2, pág. 38). El CS presentó un comportamiento muy errático, ya que si bien en general fue más alto en todos los tratamientos con presencia de cachaza, las dosis P50 y P400 sin cachaza no difirieron de los aplicados con cachaza (tabla 2, pág. 38). Este resultado indicaría que en ausencia del fertilizante orgánico, la dosis de P no tiene una influencia directa sobre esta variable.
La DH fue mayor en el tratamiento con cachaza con dosis P50 pero sin diferir de P100 y P200, y claramente menores en todos los tratamientos sin cachaza.
Un comportamiento similar se detectó para CP excepto que el tratamiento con cachaza P400 fue el único que presentó los valores más elevados (tabla 2, pág. 38).
El caso del AP fue más atípico, ya que si bien fue mayor en los tratamientos con cachaza, las dosis P200 y P400 sin cachaza presentaron valores semejantes a los aplicados con cachaza (tabla 2, pág. 38).
El contenido de P en el suelo fue mayor cuando se aplicó cachaza y en ambos casos mostró una clara tendencia a aumentar en relación con la dosis de P, siendo siempre menores con dosis P0 y mayores con dosis P400 (tabla 2).
Sin embargo, el P acumulado en la parte aérea de las plantas no siguió el mismo patrón, ya que si bien en general, fue mayor en presencia de cachaza, las dosis P200 y P400 sin cachaza no difirieron de los con cachaza (tabla 2). Este resultado estaría indicando una mayor eficiencia en la absorción del P, cuando el fertilizante fosfatado se combina con la cachaza.
DISCUSION
Se verificó un aumento de la actividad respiratoria a medida que aumentó la dosis de P sin presencia de cachaza, hecho similar fue observado por Bezerra (2008), quien evaluó los efectos de la aplicación de tres niveles de fertilización de P y encontró un aumento de la respiración, incluso en la dosis más alta utilizada. Un aumento de la actividad respiratoria fue observado por otros investigadores en China con un aumento de la población de los microorganismos del suelo, como consecuencia de la utilización de la cachaza (34), lo cual es corroborado con los presentes resultados.
Otros autores como Yang et al. (2013), evaluaron los efectos de la cachaza e informaron un aumento de las bacterias, los hongos y la actividad de las enzimas que facilitan el proceso de la solubilización del fósforo en relación con la no aplicación de ésta.
El aumento de la fosfatasa ácida en el suelo ante la presencia de la cachaza, se atribuye a que la cachaza contiene altas cantidades de materia orgánica, P orgánico y microorganismos (31, 34) ya que el P orgánico contenido en este compuesto, pasa a P orgánico (soluble) debido a un proceso de transformación realizado por la acción de la enzima fosfatasa (10, 20).
Los incrementos de la actividad de la fosfatasa ácida en función de los niveles de fósforo y la presencia de la cachaza, puede estar relacionado con la disponibilidad de P, ya que en los suelos tropicales, la mayor parte de este elemento queda absorbido con los óxidos e hidróxidos de aluminio y hierro (15), induciendo incrementos de los tenores de P adsorbido u orgánico, lo que hace necesario un aumento de la actividad de las fosfatasas con el fin de hacer que este sea soluble (20).
Resultados similares a los presentes con relación al aumento de carbono soluble frente a la aplicación creciente de dosis de P fueron informados por Bezerra (2008), en el cultivo de la caña de azúcar. También en un estudio reciente realizado por Ryals et al. (2014), encontraron un aumento en el contenido de carbono soluble del suelo después de la aplicación de abono orgánico.
Los resultados obtenidos en relación con el carbono soluble con la presencia de cachaza en este estudio pueden estar relacionados con la mayor cantidad de materia orgánica y de P en el suelo, ya que se conoce que las concentraciones de carbono soluble se asocian con el contenido de materia orgánica, la disponibilidad de nutrientes y la presencia de microorganismos en el suelo (23).
El hecho de que la deshidrogenasa tuviera mayor actividad en presencia de la cachaza, se atribuye al aumento de la actividad microbiana propiciada por la adición de la cachaza al suelo, confirmando la relación positiva de ésta y la actividad biológica del suelo (18), esta enzima está exclusivamente asociada con células vivas (32).
Resultados similares a este estudio fueron obtenidos por Marinari et al. (2000) y Greggio y Nahas (2007), que verificaron una alta actividad de la deshidrogenasa con el uso de abonos orgánicos y también Yang et al. (2013), que observaron una mayor actividad de esta enzima con la aplicación de fertilizantes químicos asociados con orgánicos en comparación con la mera aplicación de fertilizantes químicos.
Las variaciones en el pH del suelo con la aplicación de la cachaza pueden ser atribuidas al proceso de mineralización del compuesto orgánico, que induce un ambiente reductor responsable de la disminución de la acidez, o también en relación con la composición química del propio material orgánico (27), ya que en los centrales azucareros se añade hidróxido de calcio durante el proceso de producción de este residual (2). El aumento del valor del pH debido a la utilización de la cachaza, también fue encontrado por Almeida Júnior et al. (2011) en el cultivo de caña de azúcar.
La mayor disponibilidad de P en el suelo en la combinación de dosis de P con la presencia de cachaza se atribuye al P que aporta ésta y además al hecho de que la cachaza puede aumentar la población microbiana del suelo, ya que en una caracterización microbiológica realizada por Castellanos et al. (2013), informaron niveles de 105 ufc g-1 de bacterias totales, 102 ufc g-1 de bacterias solubilizadoras de fósforo y 103 ufc g-1 de los hongos en ese compuesto orgánico. Estos microorganismos pueden favorecer la solubilización de P (13, 17), lo que explicaría el aumento de la concentración de P en el suelo con la aplicación de la cachaza.
Los resultados obtenidos de mayor disponibilidad de P en los suelos con aplicación de cachaza ratifican los obtenidos por Santos et al. (2010), Caione et al. (2011), Santos et al. (2011), Caione (2013), que informaron de una mayor disponibilidad de P en suelos cultivados con caña de azúcar, cuando se adicionó este compuesto orgánico
También han sido observado beneficios de la cachaza al adicionarse a la fertilización mineral con P sobre la absorción de P por las plantas en otros estudios, como el de Almeida Júnior et al. (2011), quienes verificaron que la aplicación de cachaza produjo incrementos significativos en las concentraciones de P de retoños de caña de azúcar y el de Castellanos et al. (2013), en la evaluación de los efectos de la fertilización combinada de la cachaza y roca fosfórica en el maíz, que también encontraron aumentos en la acumulación de P con la adición de este compuesto orgánico.
CONCLUSIONES
La aplicación de cachaza modificó el efecto de las dosis de P en todas las variables analizadas, particularmente en la actividad enzimática y el contenido de P disponible en el suelo, reflejándose en una diferencial acumulación de P en las plantas.
1. Almeida, Jr. A. B.; Clistenes, W. A.; Nascimento, C. W. A.; Sobral, M. F.; Da Silva, M. V.; Gomes V. W. A. 2011. Qualidade tecnológica da cana-de-açúcar sob adubação com torta de filtro enriquecida com fosfato solúvel. Revista Brasileira de Engenharia Agrícola e Ambiental. 15(5): 443-449. [ Links ]
2. Amaral, A. S.; Spader, V.; Annghinoni, I.; Neurer, E. J. 2000. Resíduos vegetais na superfície do solo afetam a acidez do solo e eficiência do herbicida flumetsulam. Ciência Rural. 30: 789-794. [ Links ]
3. Bataglia, O.C.; Furlani, A.M.C.; Teixeira, J. P. F.; Furlani, P. R., Gallo, J. R. 1983. Métodos para el análisis químico de las plantas. Instituto Agronómico de Campinas (Boletín Técnico 78). 48p. [ Links ]
4. Bezerra, R. G. D. 2008. Atividade microbiana em solo cultivado com cana-de-açúcar submetido a doses de fósforo. Revista Verde, Mossoró. 3(4): 64-69. [ Links ]
5. Bokhtiar, S. M.; Paul, G. C.; Alam, K. M. 2008. Effects of organic and inorganic fertilizer on growth, yield, and juice quality and residual effects on ratoon crops of sugarcane. Journal of Plant Nutrition, New York. 31(10): 1832-1843. [ Links ]
6. Caione, G. 2013. Nutrição e produção da cana planta emargissolo e latossolo fertilizado comfontes de fósforo e torta de filtro. Tesis Doctoral. Universidade Estadual Paulista, UNESP. Campus de Jaboticabal. 67p. [ Links ]
7. Caione, G.; Lange A.;Benettv C. G. S.;Fernandes F. M. 2011. Fontes de fósforo para adubação de cana-de-Açúcarforrageira no cerrado. Pesquisa Agropecuaria Tropical. 41(1): 66-73. [ Links ]
8. Casida Jr, L. E.; Klein, D. A.; Santoro, T. 1964. Soil de hydrogenase activity. 371-376. [ Links ]
9. Castellanos, L.; De Mello, R., Reyes A.; Assis, L.; Caione,G.; Rosatto, L.; Parets, E. 2013. Efeito da torta de filtro enriquecida com fosfato natural e microorganismos sobre o suelo e cultura em um Latossolo Vermelho-Distrófico. Centro Agrícola. 40(2): 31-38. [ Links ]
10. Conte, E.; Anghinoni, I; Rheinheimer, D.S. 2002. Fósforo da biomassa microbiana e atividade de fosfatase ácida apósaplicação de fosfato em solo no sistema plantiodireto. R. Bras. Ci. Solo. 26: 925-930. [ Links ]
11. Davidson, E. A.; Galloway, L. F.; Strand, M. K. 1987. Assessing available carbon: Comparison techniques across selected forest soils. Commun. In Soil Sci. Plant Anal. 18(1): 45-64. [ Links ]
12. Devi, T. C.; Bharathalakshmi, M.; Kumari, M. B. G. S.; Naidu, N. V. 2012. Effect of sources and levels of phosphorus with zinc on yield and quality of sugarcane. Sugar Tech, Heidelberg. 14(2): 195-198. [ Links ]
13. Di Ciocco, C. A.; Sandler, R. V.; Falco, L. B.; Coviella, C. E. 2014. Actividad microbiológica de un suelo sometido a distintos usos y su relación con variables físico- químicas. Revista de la Facultad de Ciencias Agrarias de la Universidad Nacional de Cuyo. Mendoza. Argentina. 46(1): 73-85. [ Links ]
14. El-Tilib, M. A.; Elnasikh, M. H.; Elamin, E. A. 2004. Phosphorus and potassium fertilization effects on growth attributes and yield of two sugarcane varieties grown on three soil series. Journal of Plant Nutrition, New York. 27(4): 663-699. [ Links ]
15. Gichangi, E. M.; Mnkeni, P. N. S.; Brookes, P. C. 2009. Effects of goat manure and inorganic phosphate addition on soil inorganic and microbial biomass phosphorus fractions under laboratory incubation conditions. Soil Science and Plant Nutrition,Tokyo. 55(6): 764-771. [ Links ]
16. Greggio T. C.; Najas, E. 2007. Atividade enzimática do solo sobdois fragmentos forestais. Cientifica. 35: 179-187. [ Links ]
17. Jilani, G.; Akram, A.; Ali, R. M.; Hafeez, F. Y.; Shamsi, I. H.; Chaudhry, A. N.; Chaudhry, A. G. 2007. Enhancing crop growth, nutrients availability, economics and beneficial rhizospheremicroflora through organic and biofertilizers. Annals of Microbiology. 57: 177-184. [ Links ]
18. Longo, Regina M.; Ribeiro A. I.; Melo W. J. 2011. Recuperação de solos degradados naexploração mineral de cassiterita: biomassa microbiana e atividade da desidrogenase. Bragantia, Campinas. 70(1): 132-138. [ Links ]
19. Marinari, S.; Masciandaro, G.; Ceccanti, B.; Grego, S. 2000. Influence of organic and mineral fertilizers on soil biological and physical properties.Biores. Technol. 72: 9-7. [ Links ]
20. Nahas, E.; Centurion, J. F.; Assis, L. C.1994. Microrganismos solubilizadores de fosfato e produtores de fosfatasse de vários solos. Revista Brasileira de Ciencia do Solo. 18: 43-48. [ Links ]
21. Nahas, E. 2002. Microrganismos do solo produtores de fosfatas seem diferentes sistemas agrícolas. Bragantia. 61(3): 267-275. [ Links ]
22. Nunes Júnior, D. 2008. Torta de filtro: de resíduo a produtonobre. Idea News, Ribeirão Preto. 8(92): 22-30. [ Links ]
23. Oliveira Júnior, A.; Prochnow, L. I; Klepker, D. 2008. Eficiência agronômica de fosfato natural reativo na cultura da soja. Pesquisa Agropecuária Brasileira. 43(5): 623-631. [ Links ]
24. Oliveira Júnior, A.; Prochnow, L. I; Klepker, D. 2011. Soybean yield in response to application of phosphate rock associated with triple superphosphate. Scientia Agrícola. 68: 376-385. [ Links ]
25. Raij, B. Vav; Cantarella, H.; Quaggio, J. A.; Furlani, A. M. C. 1997. Recomendaciones de encalado y fertilización para el estado de São Paulo. 2. ed. Instituto Agronómico de Campinas Boletín Técnico. 100: 223-239. [ Links ]
26. Raij, B. Van; Andrade, J. C.; Cantarella, H.; Quaggio, J. A. 2001. Análise química para avaliação da fertilidade de solos tropicais. Campinas: Instituto Agronômico. 285 p. [ Links ]
27. Reis T. C.; Rodella A. A. 2002. Cinética de degradação da matéria orgânica e variação do pH do solo sob diferentes temperaturas Revista Brasileña de Ciencia de Suelo. 26: 619-626. [ Links ]
28. Rezende, L. A.; Assis, L. C.; Nahas, E. 2004. Carbon, nitrogen and phosphorus mineralization in two soils amended with distillery yeast. Bioresource Technol. 94(2): 159-167. [ Links ]
29. Ryals, Rebecca; Kaiser, M.; Torn, Margaret S.; Berhe, Asmeret Asefaw; Silver; Whendee L. 2014. Impacts of organic matter amendments on carbon and nitrogen dynamics in grassland soils, Soil Biology & Biochemistry. 68: 52-61. [ Links ]
30. Santos, D. H.; Silva, M. A.; Tiritan, C. S.; Foloni, J. S. S.; Fabris, L. B. 2010. Produtividade de canade- açúcar sob adubação com torta de filtro enriquecida com fosfato solúvel. Pesquisa Agropecuária Tropical. 40(4): 454-461. [ Links ]
31. Santos, D. H.; Silva, M. A.; Tiritan, C. S.; Foloni, J. S. S.; Echer, F. R. 2011. La calidad tecnológica de la caña de azúcar en el marco de fertilización con torta de filtro enriquecida con fosfato soluble. Revista Brasileña de Ingeniería Agrícola y Ambiental, Campina Grande. 15(5): 443-449. [ Links ]
32. Skujins, J. 1976. Extracellular enzymes in soil. Crit. Rev.Microbiol. 4: 383-421. [ Links ]
33. Tabatabai, M. A., Bremner, J. M. 1969. Use of p-Nitrophenyl phosphate for assay of soil phosphatase activity. Soil Biol. Biochem. 1: 301-307. [ Links ]
34. Yang, S. D.; Liu, J. X.; Wu, J.; Tan, H. W.; LI, Y. R. 2013. Effects of Vinasse and Press Mud Application on the Biological Properties of Soils and Productivity of Sugarcane. Sugar Tech. 15: 152-158. [ Links ]
AGRADECIMIENTOS
A CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil). Al MES (Ministerio de Educación Superior - Cuba).














