Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de cirugía
versão impressa ISSN 2250-639Xversão On-line ISSN 2250-639X
Rev. argent. cir. vol.103 no.4-6 Cap. Fed. dez. 2012
ARTÍCULO ORIGINAL
Riesgo de Recidiva local en la cirugía conservadora mamaria: El problema de los márgenes
Héctor D. Vuoto** MAAC, Gabriela B. Candas** MAAC, Juan Luis Uriburu** MAAC, Juan A.M. Isetta**, Lucas Cogorno**, Ana S. Freijido*, Alejandra M. García** y Osear L. Bernabé*** MAAC
del Servicio de Patología Mamaria, Hospital Británico de Buenos Aires
* Becario del Servicio de Patología Mamaria. hospital Británico de Buenos Aires.
** Médico de Planta del Servicio de Patología Mamaria. hospital Británico de Buenos Aires.
*** Jefe del Servicio de Patología Mamaria. hospital Británico de Buenos Aires.
Recibido el 17 de Mayo de 2012
Aceptado el 07 de Agosto de 2012
Resumen
Introducción: El tratamiento conservador, seguido de radioterapia en pacientes con cáncer de mama en estadios iniciales es la terapéutica estándar en la actualidad. La incidencia de recidiva local (RL) varía entre 4.1 y 18%.
Objetivo: Evaluar los márgenes quirúrgicos como factor de riesgo de RL luego del tratamiento conservador en las pacientes operadas en el Servicio de Patología Mamaria del ospital Británico de Buenos Aires, y analizar el impacto en la supervivencia global.
Material y Métodos: Se analizaron retrospectivamente 830 pacientes operadas, entre enero de 1988 y diciembre de 2005, de las cuales recidivaron 87 (10.5%), con un tiempo medio de aparición de 71.9 meses y seguimiento promedio de 71.9 meses.
Resultados: El riesgo anual de RL fue 1.29%. Presentaron RL el 15.7% de las pacientes con márgenes resección s 5mm y el 7.4% de las pacientes con márgenes a 6mm. La supervivencia global a cinco años de las pacientes con RL fue 95.2%, a diez años 86.1 % y a quince años 78.4%.
Conclusiones: Los márgenes quirúrgicos de resección s 5mm resultaron un factor de riesgo independiente para recidiva local. Las pacientes con RL presentaron menor sobrevida y mayor riesgo de desarrollar metástasis a distancia.
Palabras clave: Recidiva local; Tratamiento conservador; Factores de riesgo
ABSTRACT
Introduction: Breast conserving surgery followed by radiation therapy in early stage breast cáncer are trie standard therapeutics at present. Trie incidence of local recurrence (LR) varíes between 4,1 and 18 %.
Objective: To evalúate trie resection margins as LR risk factor following breast conserving treatment in patients undergoing surgery at trie Breast Diseases División of the British ospital and to analyze trie impact on overall survival.
Material and Methods: 830 patients operated on between January 1988 and December 2005; 87 developing recurrences after a median time of 71,9 months were analyzed retrospectively
Results: The LR annual risk was 1,29 %. We observed LR in 15,7% in patients which resection margins were £ 5mm and 7,4% when resection margins were a 6mm. The five year overall survival rate in LR patients was 95,2%, at ten years 86,1 % and at fifteen years 78,4%.
Conclusions: Margins s 5mm are an independent risk factor for local recurrence. LR patients presented less survival chances and higher risk of developing distant metástasis.
Key words: Local relapse; Conservative treatment; Risk factors
Introdución
El tratamiento conservador, seguido de radioterapia en pacientes con estadios iniciales de cáncer de mama es la terapéutica estándar en la actualidad1 7.
La incidencia de recidiva local (RL) luego de cirugía conservadora en las distintas series publicadas, tanto nacionales como internacionales varía entre un 4.1 y 18%814.
Distintos parámetros han sido analizados, por diferentes autores, para establecer los factores relacionados con RL, porej.: edad, tamaño tumoral, tipo histológico, grado nuclear e histológico, estado ganglionar, receptores hormonales, márgenes, invasión linfovascular, etc.
Actualmente el tratamiento estándar de la RL luego de cirugía conservadora es la mastectomía, la cual provee un control locorregional en el 90% de las pacientes15. Sin embargo, en pacientes seleccionadas, algunos autores consideran factible la retumorectomía16.
La RL luego de cirugía conservadora es considerada como factor predictivo de metástasis a distancia en numerosas publicaciones131719.
El impacto en la supervivencia es objeto de discusión; si bien la mayoría de los autores encuentran que las pacientes con RL luego de cirugía conservadora tendrían peor pronóstico, otros no hallan diferencias estadísticamente significativas20 22.
Objetivo
El objetivo del presente trabajo es evaluar los márgenes quirúrgicos como factor relacionado con el aumento del riesgo de recidiva local, luego del tratamiento conservador, en las pacientes con cáncer de mama y evaluar el impacto en la supervivencia global.
Material y Métodos
Entre enero de 1988 y diciembre de 2005, fueron tratadas 2374 pacientes con diagnóstico de cáncer de mama, en las cuales se efectuó cirugía conservadora en 1353 pacientes (57%).
Se excluyeron 523 pacientes por los siguientes motivos: haber sido operadas en otra institución, aquellas que no completaron el tratamiento radiante, pacientes perdidas durante
el seguimiento, pacientes con tumores mayores de 5 cm y pacientes con metástasis a distancia de inicio. Quedaron para el análisis retrospectivo 830 casos, de acuerdo a la base de datos que el servicio posee para el registro de las pacientes.
Las cirugías fueron realizadas por el mismo equipo quirúrgico y consistieron en la cuadrantectomía con evaluación del estado axilar en los carcinomas infiltrantes, ya sea mediante vaciamiento axilar o biopsia de ganglio centinela de acuerdo a la época en que se realizó el tratamiento, seguido de radioterapia sobre el volumen total de la mama preservada (promedio 5040 cGy) y boost (1620 cGy).
El seguimiento promedio fue de 105.2 meses con un rango de 21-325 meses.
Definimos como recidiva local, de acuerdo a Bernardello8, a cualquier forma de nueva manifestación de la enfermedad en la mama homolateral sea cual fuere el intervalo libre, el lugar propiamente dicho o el tejido afectado (piel o glándula mamaria).
El tratamiento adyuvante se realizó de acuerdo a las características de presentación de los tumores, acorde con la época en que se efectuaron los diagnósticos.
El seguimiento clínico se realizó en forma trimestral, los dos primeros años, y luego en forma semestral, con mamografía y ecografia anual.
Para el análisis se dividió a las pacientes en dos grupos, con y sin recidiva local. Se diagnosticó RL en 87 pacientes (10.5%). En la Tabla 1 se describen las características de las mismas.
TABLA 1
Descripción de los grupos analizados
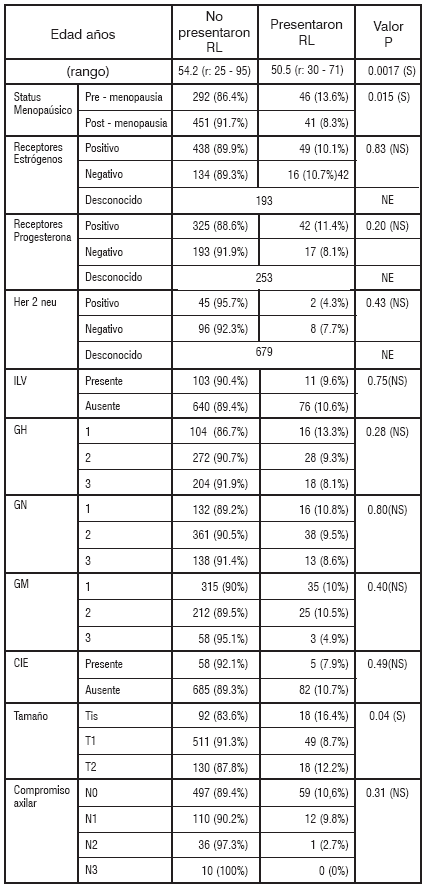
ILV: invasión linfo-vascular, GH: grado histológico, GN: grado nuclear, GM: grado mitótico, IÉ: componente ¡ntraductal extenso, S: significativo, NS: no significativo, NE: no evaluado.
El diagnóstico de la RL fue, en 47 pacientes (54%) por presentar un nodulo palpable mientras que en 40 pacientes (46%) las lesiones fueron no palpables.
Los carcinomas ductales in situ que recidivaron (18 pacientes), lo hicieron como tumores in situ en 4 pacientes (22.2%) y como infiltrantes en 14 (77.8%). Los carcinomas infiltrantes que recidivaron (69 pacientes), lo hicieron como tumores insitu en 7 casos (10.1%) y como carcinomas infiltrantes en 62 (89.9%).
Las 87 pacientes con RL recibieron tratamientos diversos: 79 fueron intervenidas quirúrgicamente: 92.4% (73 pacientes) mastectomía y 7.6% (6 pacientes) retumorectomía, por deseo de la paciente. El resto de las 8 pacientes: 4 no fueron operadas y recibieron tratamiento sistémico (quimio u hormonoterapia); no se cuenta con los datos de 4 pacientes. De las pacientes con RL 20.7% (18 pacientes) recibió tratamiento quimioterápico y el 6.9% (6 pacientes) recibió radioterapia.
Se evaluó específicamente: edad, estatus menopáusico, tipo histológico, grado histológico, nuclear y mitótico, compromiso axilar, invasión linfovascular (ILV), componente intraductal extenso (IÉ), márgenes de resección, pTNM, receptores hormonales, Her2 Neu, aparición de metástasis y supervivencia global.
La estadificacion tumoral se realizó de acuerdo a la clasificación TNM de la AJ/ UI 6g versión año 2003.
Los márgenes de resección fueron evaluados en milímetros (mm) y se los dividió en cinco grupos para su análisis: menores o iguales a 1 milímetro, entre 2 y 5 mm, entre 6 y 9 mm, mayores o iguales a 10 mm y desconocidos (grupo de pacientes en las cuales se informan márgenes libres, pero no se especifica en mm).
Se calculó supervivencia global a los 5, 10 y 15 años en pacientes con y sin recidiva local luego del tratamiento conservador de cáncer de mama, considerando el tiempo desde la cirugía hasta la muerte o hasta el último control disponible.
Para el análisis estadístico se utilizó el programa Intercooled Stata 8.0. Para comparar variables cuantitativas se utilizó el test de Student o la prueba de los rangos de Wilcoxon, según correspondía. Para comparar proporciones se utilizó el test de chi cuadrado (Pearson). Se graficaron tiempos de supervivencia y se calcularon probabilidades con la técnica de Kaplan-Meier. Se informan intervalos de confianza (I) para el 95%. Para comparar curvas se utilizó la prueba de Logrank. Para identificar variables relacionadas con mortalidad o recidiva se utilizó Análisis Proporcional de Cox. En todos los casos se consideró una p < 0.05 como estadísticamente significativa.
Resultados
En la serie de 830 pacientes con cáncer de mama en las que se realizó tratamiento conservador, recidivaron 87 pacientes (10.5%), con un tiempo medio de aparición de 71.9 meses (rango: 12 -251 meses). La incidencia anual de RL fue de 1.29% y el riesgo acumulado a 15 años de 18.9% (I 95% 15.1-26.1), Gráfico 1.

GRÁFICO 1 Riesgo de recidiva local por año
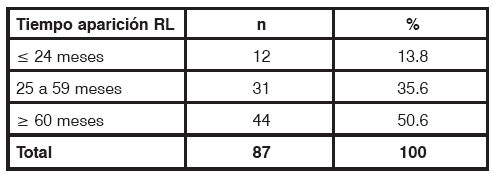
El tiempo de aparición de la RL (Tabla 2), evidenció que el 13.8% (12 pacientes) recidivó antes de los 24 meses. El 35.6% (31 pacientes) entre 25 y 59 meses y el 50.6% (44 pacientes) después de los 60 meses.
TABLA 2 Tiempo de aparición de la recidiva local N: Número de pacientes
El 75.9% (66 casos) de las recidivas locales fue en el mismo cuadrante que el tumor original.
Analizando la edad como factor de riesgo de RL (Tabla 3), encontramos que el punto de corte fue de 55 años, presentando dos veces más riesgo las pacientes menores de esta edad (OR= 2.08).
TABLA 3 Edad como factor de riesgo de recidiva local S: Significativo, N: Número de pacientes
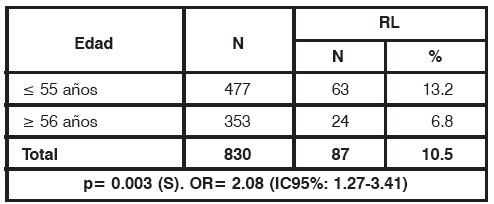
Entre las pacientes menores de 55 años recidivó el 13.2%; mientras que de las pacientes mayores de 56 años recidivó el 6.8% (p= 0.003).
La edad promedio de las pacientes en el grupo que recidivó fue 50.2 años (rango: 30-71 años) versus 54.2 años (rango: 25-95 años) en el grupo sin recidiva, siendo esta diferencia estadísticamente significativa (p= 0.0017).
El status menopáusico de la paciente al momento del diagnóstico, resultó un factor de riesgo para RL. Recidivaron 13.6% de las pacientes premenopáusicas y 8.3% de las pacientes postmenopáusicas, siendo esta diferencia estadísticamente significativa (p= 0.015), Tabla 1.
Al evaluar el carcinoma in situ (Tis) encontramos que un 16.4% recidivaron, contra un 8.7% de los carcinomas infiltrantes T1 y el 12.2% de los T2, siendo esta diferencia estadísticamente significativa (p= 0.04). Al analizar de manera independiente los carcinomas infiltrantes de acuerdo al tamaño tumoral T1 y T2, la diferencia no llega a ser estadísticamente significativa (p= 0.26).
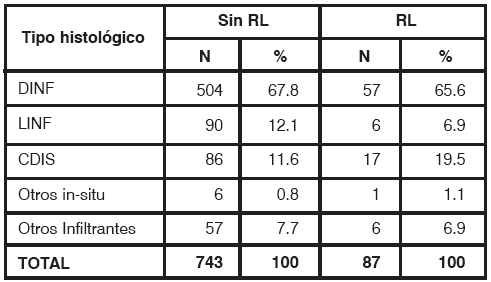
No se encontró una diferencia estadísticamente significativa en el riesgo de RL de acuerdo al subtipo histológico (Tabla 4), grado histológico, mitótico ni nuclear, CIÉ, ILV, Receptores hormonales, Her2neu ni compromiso axilar (Tabla 1).
TABLA 4
Recidiva local de acuerdo al subtipo histológico DINFxarcinoma ductal infiltrante, LINFxarcinoma lobulillar infiltrante, DIS: carcinoma ductal in situ
Para la evaluación de los márgenes de resección quirúrgica (Tabla 5) se excluyeron las 209 pacientes con márgenes
TABLA 5 Márgenes de resección en pacientes con y sin recidiva local S: significativo, n: número de pacientesdesconocidos (25.2%).
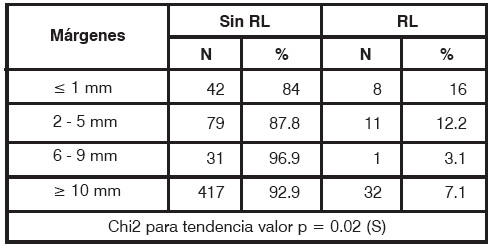
Entre las pacientes con márgenes < a 1mm recidivaron 8 (16%), entre 2 y 5 mm recidivaron 11 pacientes (12.2%), entre 6 y 9 mm recidivó una paciente (3.1%) y por último, en el grupo con márgenes > a 10 mm recidivaron 32 pacientes (7.1%). Estas diferencias resultaron estadísticamente significativas (p= 0.02), siendo el punto de corte para mayor riesgo de RL de 5 mm.
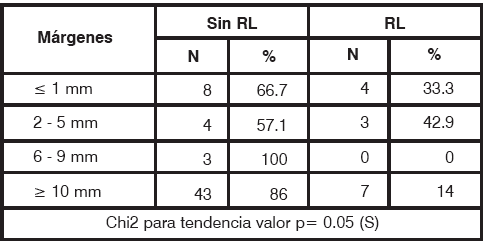
Al analizar independientemente los carcinomas infiltrantes, los márgenes de resección no resultaron estadísticamente significativos (p= 0.19; tabla 6). Entre las pacientes con márgenes <6mm recidivaron 12 (9.9%); en aquellas con márgenes de 6 mm o más, recidivaron 26 pacientes (6.1%). En el grupo de carcinomas insitu (Tabla 7), entre las pacientes con márgenes <5mm recidivaron 7 (36.8%); en aquellas con márgenes > 6mm, recidivaron 7 pacientes (13.2%), siendo esta diferencia estadísticamente significativa (p= 0.05).
TABLA 6 Carcinomas Infiltrantes. Márgenes de resección en pacientes con y sin RL NS: no significativo, N: número de pacientes.
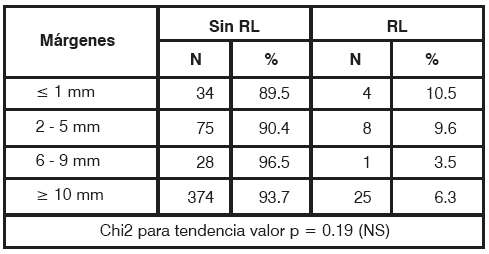
TABLA 7 Carcinomas in-situ. Márgenes de resección en pacientes con y sin recidiva local S: significativo, N: número de pacientes.
Al analizar independientemente a los carcinomas infiltrantes que presentaron RL, 18 casos (26.1%) desarrollaron metástasis a distancia, mientras que en aquellas que no recidivaron, sólo un 7.5% (49 pacientes) metastatizó; siendo esta diferencia estadísticamente significativa, p<0.001 (Tabla 9).
TABLA 8 Metástasis a distancia. S: significativo, N: número de pacientes.
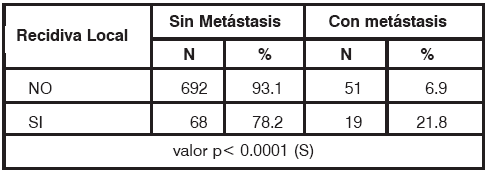
TABLA 9 Metástasis a distancia en carcinomas infiltrantes. S: significativo, n: número de pacientes.
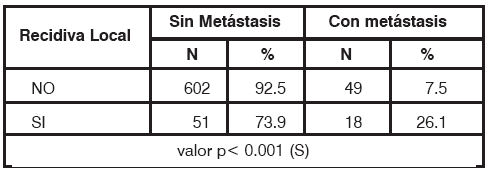
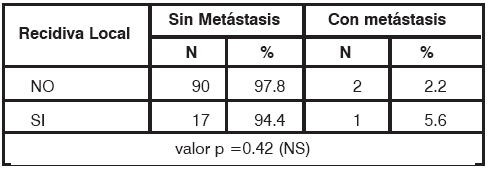
Sin embargo, en el grupo de pacientes con carcinomas in-situ no se evidenció una diferencia estadísticamente significativa, siendo el riesgo de 5.6% vs. 2.2% en el grupo con y sin RL respectivamente (p= 0.42), Tabla 10.
TABLA 10 Metástasis a distancia en carcinomas in-situ NS: no significativo, N: número de pacientes.
En el grupo de pacientes con RL, 19 casos (21.8%) desarrollaron metástasis a distancia mientras que en el grupo que no recidivó sólo un 6.9% (51 pacientes) metastatizó, siendo esta diferencia estadísticamente significativa, p<0.0001 (Tabla 8).
El tiempo promedio de aparición de las metástasis fue de 67.3 meses (rango: 11-210 meses).
Se evaluaron las curvas de Kaplan Meier para supervivencia global (Gráfico 2), encontrando que aquellas pacientes con RL tuvieron menor sobrevida (p=0.0046). La supervivencia global de las pacientes con RL, a 5 años fue de 95.2%, a diez años de 86.1% y a quince años de 78.4%,
Curvas de Kaplan-Meier. Sobrevidad global.
Pacientes con RL
Tiempo (meses)
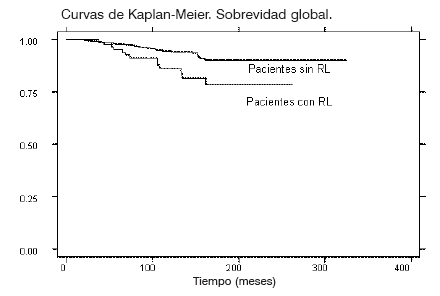
GRÁFICO 2 Supervivencia global de pacientes con y sin recidiva local
Se analizó la supervivencia global en aquellas pacientes que recidivaron antes y después de los dos años, presentando menor supervivencia aquellas que recidivaron antes de dicho periodo. Esta diferencia resultó estadísticamente significativa de acuerdo al método de Logrank Test con una p<0.0001 (Gráfico 3).
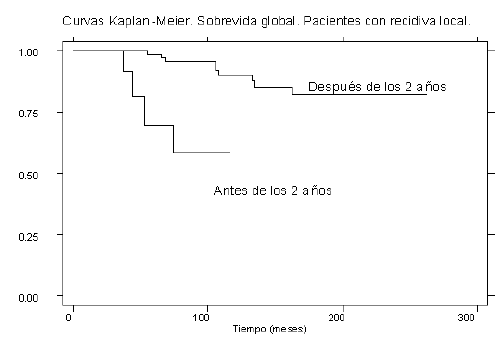
GRÁFICO 3 Supervivencia global de pacientes con RL antes y después de los dos años
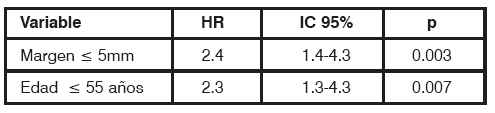
Se realizó el análisis multivariado de ox procurando establecer algunos de los factores analizados como variable de riesgo independiente de RL, Tabla 11.
TABLA 11 Análisis multivariado de Cox
Discusión
La cirugía conservadora (entendida por cuadrantectomía con intervención axilar más radioterapia) es el tratamiento estándar en la actualidad, desde las primeras publicaciones del grupo de Veronesi en Milán y Fisher en Estados Unidos, para el carcinoma invasor de mama457.
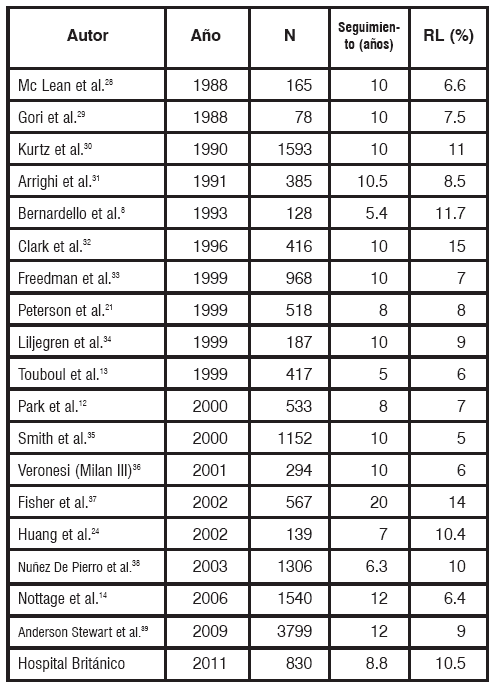
La incidencia de RL de acuerdo a las distintas series (Tabla 12) oscila entre un 4.1 a 18%8142324, loque representa un 1 a2%anual1925, en concordancia con nuestros hallazgos.
TABLA 12 Incidencia de recidiva local de acuerdo a las distintas series publicadas. N: número de pacientes. Modificado de Kunos40.
El tiempo medio de aparición de la recidiva, según los diferentes autores, se encuentra dentro de los dos primeros años de seguimiento, en el 80-90% de los casos26 27. En nuestra serie las RLse presentaron en 12 pacientes (13.8%) antes de los dos años; entre los dos y los cinco años en 31 casos (35.6%) y después de los 5 años en 44 pacientes (50.6 %).
Los factores de riesgo para RL resultan motivo de controversia aún en la actualidad. Han sido publicadas numerosas series analizando diversas variables relacionadas con las características de la paciente, biología tumoral y técnica quirúrgica. Sin embargo, no se ha logrado establecer un consenso sobre los mismos, por lo que sigue siendo tema de discusión.
Las variables analizadas como posibles causas de aumento de RL por la mayoría de los autores son: edad al momento del diagnóstico, estatus menopáusico, tamaño tumoral, componente intraductal extenso (IÉ), invasión linfo-vascular (ILV), estado de los márgenes, entre otras15'4144.
Los márgenes inadecuados pueden aumentar el riesgo de RL y una resección excesiva puede condicionar el resultado estético. Sin embargo, no existe un consenso que determine cuáles deben ser los márgenes de resección adecuados. Esto se ve reflejado en los numerosos trabajos de cirugía conservadora donde los criterios no son uniformes para definir márgenes libres, cercanos o negativos.
Varios autores aceptan como márgenes libres, aquella lesión que no contacta con la tinta china4546. Otros autores como Freedman, Kunos y Smitt33 40 47 afirman que las pacientes con márgenes mayores a 2 mm tienen menos RL. Morrow2 48 49 y Peterson21 discriminan los márgenes de los carcinomas infiltrantes y de los in situ, encontrando que para los primeros el tumor no debe estar en contacto y para los in situ el margen debe ser de 2 mm. En nuestra serie encontramos que el punto de corte (para riesgo de recidiva) para los carcinomas in situ es de 5 mm y para los carcinomas infiltrantes las diferencias no son estadísticamente significativas.
En concordancia con los hallazgos del estudio publicado por el grupo del Hospital Fernández de Buenos Aires38, encontramos que las pacientes con márgenes de resección menores de 5 mm presentaron mayor tasa de RL, cuando no se discriminan los carcinomas in situ de los infiltrantes.
Nuestros hallazgos en concordancia con Komoike18, Fisher46 y numerosos autores13 19 50 mostraron que el riesgo de metástasis a distancia en las pacientes con RL es mayor, comparado con aquellas pacientes que no recidivaron.
El NSABP B-04 y B-0646 concluye que aquellas pacientes con RL tienen un riesgo 3.41 veces mayor de desarrollar metástasis a distancia; y que el factor pronóstico más importante es el tiempo de aparición de la recidiva.
Varios estudios evaluaron el efecto en la supervivencia de las pacientes con recidiva local luego de tratamiento conservador.
En concordancia con Nottage14, Courdi51, Anderson39y Nuñez de Pierro38, mostraron que la recurrencia temprana, antes de los dos años, está asociada a una menor tasa de supervivencia.
En conclusión el riesgo anual de recidiva local fue de 1.29%. Son factores de riesgo independiente para RL: los márgenes de resección < a 5 mm y la edad < a 55 años. Las pacientes con RL presentaron menor supervivencia y mayor riesgo de desarrollar metástasis a distancia, especialmente aquellas que recidivaron antes de los dos años.
Agradecimiento
A la Dra. Marina Khoury por la realización del análisis estadístico del presente trabajo.
1. National Institutes of Health (NIH).Consensus development conference statementtreatment of early stage breast cáncer. JAMA 1991; 265:391-394. [ Links ]
2. Morrow M, Strom EA, Bassett LW, et al. Standard for the management of ductalcarcinoma in situ of the breast (DCIS). CA Cáncer J Clin 2002; 52:258-276.
3. Whinchester DR Cox JD: Standards for diagnosis and management of invasive breastcarcinoma. CA Cáncer J Clin 1998; 48: 83- 107.
4. Fisher B, Dignam J, Wolmark N, et al. umpectomy and radiation therapy for thetreatment of intraductal breast cáncer: findings from National Surgical Adjuvant Breastand Bowel Project B-17. J Clin Oncol 1998; 16:441-52.
5. Veronesi U, Banfi A, Del Vecchio M et al. Comparision of Halsted mastectomy withquadrantectomy axillary dissection, and radiotherapy in early breast cáncer: ong-termresults. Eur J Cáncer Clin Oncol 1986; 22: 1085-1089. [ Links ]
6. Veronesi U, Salvadori B, Luini A, et al. Conservative treatment of early breast cáncer. ong-term results of 1232 cases treated with quadrantectomy axillary dissection, andradiother-apy Ann Surg 1990; 211: 250-259. [ Links ]
7. Veronesi U, Cascinelli N, Mariani L, Greco M, et al. Twenty-years follow-up of arandomized study comparing breast-conserving surgery with radical mastectomy forearly breast cáncer. N Engl J Med 2002; 347:1227-32.
8. Bernardello E., Margossian J., Müller Perrier G. y col. Recidivas locorregionales deltratamiento conservador del cáncer de mama. Rev. Argent. Cirug.1993; 64:150-154.
9. Mamounas E, Ipsilateral breast tumor recurrence after lumpectomy: fe it time to take thebull by the horns? J Clin Oncol 2001; 19:3798-3800.
10. Solin L, Fowble B, Martz K, et al. Definitive irradiaron for early stage breast cancer.The University of Pennsylvania experience. Int J Radiat Oncol Biol Phys 1988; 14: 235- 242. [ Links ]
11. Amalric R, Santamaria F, Robert F, et al. Conservaron therapy of operable breastcancer. Results at 5, 10, and 15 years in 2216 consecutive cases. In: Harris JR,Hellmans S, Silen W, eds. Conservative management of breast cáncer. J B Lippin-cottyCo. Philadelphia 1983; pp.15-21.
12. Park C, Mitsumori M, Nixon A, et al. Outcome at 8 years after breast-conservingsurgery and radiaron therapy on local recurrence. J Clin Oncol 2000; 18:1668-1675. [ Links ]
13. Touboul E, Buffat K, Belkacemi Y et al. ocal recurrences and distant metastasesafter a breast-conserving surgery and radiation therapy for early breast cáncer. Int J.Radiat Oncol Biol. Phys 1999; 43: 25-38.
14. Nottage MK, Kopciuk KA, Tzontcheva A, et al. Analysis oí incidence and prognosticfactors for ipsilateral breast tumor recurrence and its impact on disease specificsurvival oí women with node-negative breast cáncer a prospective cohort study Breast Cáncer Research 2006; 8(4): R44.
15. Freedmann GM, Fawle B. ocal recurrence after mastectomy or breast -conserving surgery and radiation. Oncology 2000; 14:1561-1581.
16. Salvación B, Marubini E, Miceri R, Andreola S, et al. Reoperation for locally recurrentbreast cáncer in patients previously treated with conservative surgery. Br J Surg 1999;86: 84-87. [ Links ]
17. Fisher ER, Anderson S, Tan-Chiu, et al. Fifteen-year prognostic discriminants forinvasive breast carcinoma. National Surgical Adjuvant Breast and Bowel Project Protocol-06. Cáncer. 2001; 91: 1979 -1987.
18. Komoike Yoshifumi, Futoshi Akiyama, Yuichi lino, Tadashi Ikeda, Sadako Akashi-Tanaka, Shozo Ohsumi, Mikihiro Kusama, Muneaki Sano, et al. Ipsilateral Breast tumorRecurrence (IBTR) after breast Conserving treatment for early breast cáncer. Cancer2006; 106: 35-41.
19. Veronesi U, Marubini E, et al. ocal recurrences and distant metastasesafter conservative breast cáncer treatments:Partly independent events. J Nati Cancerlnst 1995; 87:19-27.
20. Meric F, Mirza NQ, Vlastos G, et al. Positive surgical margins and ipsilateral breasttumor recurrence predict disease-specific survival after breast-conserving therapy. Cáncer 2003; 97: 926-933. [ Links ]
21. Peterson ME, Schultz DJ, Reynolds C, Solin LJ. Outcomes in breast cáncer patientsrelative to margin status after treatment with breast conserving surgery and radiationtherapy: the University of Pennsylvania experience. Int J Radiat Oncol Biol Physl 999;43:1029-35.
22. Yoshida T, Takei H., Korosumi M. et al. True recurrences and new primary tumorshave different clinical features in invasive breast cáncer patients with ipsilateral breasttumor relapse after breast-conserving treatment. The Breast Journal, 2010; 16(2): 127-133. [ Links ]
23. Kurtz J, Jacquemier J, et al. Conservation Therapy for Breast Cancers Other Thanlnfiltrating Ductal Carcinoma. Cáncer 1989;63: 1630- 1635.
24. Huang Eugene, Thomas A. Buchholz, et al. Classifying local desease recurrences afterbreast conservation therapy based on location and histology Cáncer 2002; 95:2059-67. [ Links ]
25. Fowble BL, Solin LJ, Schultz DJ, Goodman RL. Ten-year results of conservativesurgery and irradiaron for stage I and II breast cáncer. Int J Radiat Oncol Biol Physl 991; 21:269-277.
26. Sarria J. A, I rico G, Franco G.F Propuesta terapéutica conservadora de la recidivalocal por carcinoma mamario. Revista Argentina de Mastolo-gía 2007; 26(91): 130-142. [ Links ]
27. Vicini FA, Sestin L, Huang R, et al. Does local recurrence affect the rate of distantmetastasis and survival in patients with earlly-stage breast conserving therapy? Cancer2003; 97: 910-19.
28. Me Lean L, Santillán F. Cirugía limitada en cáncer de mama. Rev Argent Cirug, 198854: 167.
29. Gori J,Castaño R, Dominguez J, Puga A, Medici R. Resultados a 10 años deltratameinto conservador del cáncer de mama. Rev Argent Mast, 1991; 10: 286-298.
30. Kurtz JM, Spitalier JM, Amalric R, et al. The prognostic significance of late localrecurrence after breast-conserving therapy. Int J Radiat Oncol Biol Phys 1990; 18:87-93. [ Links ]
31. Arrighi A, Lamatina J. C, Guixa H.G, Lorusso C, Orti R. Tatamiento conservador encancer de mama estadio I y II. Experiencia de 10 años de trabajo. Rev. Argent Mast.1991 ;10: 75-80.
32. Clark RM, Whelan T, Levine M,et al. Randomized clinical trial of breast irradiationfollowing lumpec-tomy and axillary dissection for nodenegative breast cáncer: anupdate. Ontario Clinical Oncology Group. J Nati Cáncer Inst 1996; 88:1659-64.
33. Freedmann G, et al. Patients with early stage invasive can with cióse or positivemargins treated with conservative surgery and radiation have an increased rísk of breast recurrence that ¡s delayed by adjuvant systemic therapy. Int J Radiat Oncol BiolPhys 1999; 44(5): 1005-1015.
34. Liljegren G, Holmberg L, Bergh J,et al. 10-year results after sector resection with orwithout post-operative radiotherapy for stage I breast cáncer: a randomized trial. J Clin Oncol 1999;17:2326-33. [ Links ]
35. Smith TE, Lee D, Turner BC, Cárter D, Haffty BG. True recurrence es. New primaryipsilateral breast tumor relapse: an analysis of clinical and patho-logic differences andtheir implications in natural history prognoses, and therapeutic management. Int J Radiat Oncol Biol Phys 2000; 48: 1281-89.
36. Veronesi U, Marubini E, Mariani L, et al. Radiotherapy after Breast -conserving surgeryin small breast carcinoma: long-term results ofa randomized trial. Ann Oncol 2001; 12:997-1003.
37. Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trialcomparing total mastectomy, lumpectomy and lumpectomy plus irradiation for thetreatment of invasive breast cáncer. N Engl J Med 2002; 12:997-1003. [ Links ]
38. Núñez De Pierro A., Allemand D., Agejas G. Tratamiento conservador del cáncer demama. Evaluación de los resultados en 1306 casos. Experiencia del grupo de trabajodel Hospital Juan A. Fernández de Buenos Aires. Rev Arg Mastol 2004;23(78):69-93.
39. Anderson S, Wapnir I, et al. Prognosis After Ipsila-teral Breast Tumor Recurrence and ocorregional Recurrences in PatientsTreated by Breast-Conserving Therapy in Five National Surgical Adjuvant Breast andBowel Project Protocols of Node-Negative Breast Cáncer. J Clin Oncol 2009; 27:2466-2473.
40. Kunos C, Latson L, Overmoyer B, et al. Breast Conservaron Surgery Achieving >2mm Tumor-Free Margins Results in Decreased ocal-Regional Recurrence Rates. The Breast Journal. 2006;12(1): 28-36.
41. Solin LJ, Fouble BL, Schultz DJ, Goodman RL. The significance of the pathologymargins of the tumor excisión on the outcome of patients treated with definitiveirradiation for early stage breast cáncer. Int J Radiat Oncol Biol Phys 1991 ;21: 279-87. [ Links ]
42. Borger J, Kemperman H, Hart A, Perterse H, Van Dongen J, Bartelink H. Rlskfactors in breast conserving therapy. J Clin Oncol 1994;12: 653-60.
43. Holland R, Connolly JL, et al. Thepresence of an extensiv intraductal component following a limited excisión correlateswith prominent residual disease in the remainder of the breast. J Clin Oncol 1990; 8:113-8.
44. Botteri E, Bagnard V, Veronis U, et al. Analysis of local and regional recurrences in breast cáncer after conservative surgery. Annal Oncol 2010 21: 723-728.
45. Park C, Mitsumori M, Nixon A, et al. Outcome at 8 years after breast-conservingsurgery and radiation therapy on local recurrence. J Clin Oncol 2000; 18:1668-1675.
46. Fisher B, Anderson, Fisher ER, et al. National Surgical Adjuvant Breast and Bowel Project (NSABP) B-06.Significance of ipsilateral breast tumor recurrence afterlumpectomy. Lancet 1991; 338:327-331.
47. Smitt M, Nowels K, arlson R, Jeffrey S. Predictors of reexcision findings and recurrence after breast conservation. I. J. Radiation Oncology 2003; 57(4): 979-985. [ Links ]
48. Morrow M. os márgenes adecuados en la cua-drantectomía. Rev Arg Mastol 2009;28 (100): 240-250.
49. Dune C, Barke J, Morrow M, Kell M. Effect of Margin Status on ocal Recurrence After Breast Conservation and Radiation Therapy for Ductal Carcinoma in situ. J Clin Oncol2009;27: 1615-1620.
50. Haffty GC, Fischer D, Beinfield M, Me khann C. Prognosis following local recurrence in the conservatievely treated breast cáncer patient. Int J Radiat Oncol Biol Phys.1991;21:293-298. [ Links ]
51. Courdi A, Larguiller R, Fero J, et al. Early vs late local recurrence after conservative treatment of breast carcinoma. Oncology 2006, 71:361-8.














