Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cirugía
versión impresa ISSN 2250-639Xversión On-line ISSN 2250-639X
Rev. argent. cir. vol.105 no.1 Cap. Fed. set. 2013
ARTÍCULOS ORIGINALES
Ingeniería de tejidos y cirugía de la pared abdominal: prototipo de bioprótesis
Claudio Brandi* MAAC, Mariana Ambrosis**, Carlos Barraud***, Pablo Argibay**** MAAC
de la Sección Paredes Abdominales y Microcirugía Reconstructiva, Servicio de Cirugía General y del Instituto de Ciencias Básicas y Medicina Experimental del Hospital Italiano de Buenos Aires
*Jefe del Sector de Paredes Abdominales y Microcirugía Reconstructiva del Servicio de Cirugía General del Hospital Italiano de Buenos Aires.
** Becaria del Instituto de Ciencias Básicas y Medicina Experimental del Hospital Italiano de Buenos Aires.
*** Fellow del Sector de Paredes Abdominales y Microcirugía del Servicio de Cirugía General del Hospital Italiano de Buenos Aires.
**** Director del Instituto de Ciencias Básicas y Medicina Experimental del Hospital Italiano de Buenos Aires. (ICBME)
Dirección de correspondencia: Dr Claudio Brandi, Hospital Italiano de Buenos Aires Juan D. Perón 4190 (C1181ACH) Buenos Aires, Argentina. E-mail: claudio.brandi@hospitalitaliano.org.ar
Recibido el 14/09/12.
Aceptado el 12/08/13.
RESUMEN
Antecedentes: La tendencia actual es reparar los defectos de la pared abdominal con mallas de polipropileno (PP) Este polímero tiene buena resistencia a las presiones intraabdominales, sin embargo puede presentar adherencias intestinales e infección. Con la idea de evitar estas complicaciones surge el desarrollo de mallas biológicas. Éstas están compuestas de colágeno descelularizado obtenido de tejido conectivo porcino, bovino o humano. Una posibilidad actual es cultivar células madres mesenquimales autólogas sobre las mallas biológicas para que estas últimas sirvan de andamio para el desarrollo de las células madre. Así se podría crear una malla híbrida bioartificial compuesta por una malla de polipropileno y una malla biológica cultivada con células madres autólogas del propio paciente. De esta forma el componente de polipropileno aportaría resistencia y la malla biológica cultivada con células madres podría aportar capacidad antiinflamatoria, inmunomoduladora y regeneradora de tejido, así como disminuir las adherencias intestinales, fístulas enterocutáneas e infecciones. La hipótesis de trabajo es que un componente biológico mixto compuesto de una matriz biológica extracelular xenogeneica asociada a células madre mesenquimales autólogas podría disminuir las reacciones inflamatorias tisulares y adherencias intestinales que generan las mallas de polipropileno.
Objetivos de la primer etapa: Obtener un prototipo de matriz xenogeneica de cerdo combinada con la recelularización con células madre humanas derivadas de tejido adiposo humano. Describir los resultados preliminares obtenidos con este prototipo.
Materiales y métodos: Etapa I: Obtención de la malla biológica: submucosa de intestino delgado de cerdo (SIS - small intestine submucosa-) descelularizada. Se utilizan cerdos machos de 15 kg. Resección intestino delgado del cerdo, preparación del SIS, proceso de descelularización del SIS. Etapa II: Proceso de recelularicación (cultivo celular sobre el SIS). Siembra con células madre: A) Línea celular 3T3 (fibroblastos de origen embrionario de ratón), B) Células mesenquimales de tejido adiposo humano.
Resultados: Se logró con éxito el proceso de obtención del SIS, su descelularización y posterior recelularización con células mesenquimales de tejido adiposo humano.
Discusión: El componente de polipropileno aporta la resistencia necesaria para reparar los grandes defectos de la pared abdominal, el SIS un andamio o medio para el desarrollo de las células madre mesenquimales de tejido adiposo humano con capacidad de diferenciación, inhibir procesos inflamatorios, fuente de factores tróficos y regeneración de tejidos. Pensamos que la asociación de los materiales sintéticos con la ingeniería de tejidos puede ayudar a reparar los defectos graves de la pared abdominal.
Conclusión: Nuestros resultados preliminares indican que es factible recelularizar con células madre mesenquimales de tejido adiposo humano una malla heteróloga acelular derivada de submucosa de intestino delgado de cerdo.
ABSTRACT
Background: The current trend is to repair large abdominal wall defects with polypropylene mesh (PP). This polymer has good resistance to intra-abdominal pressure but may produce bowel adhesion and infection. Biological meshes were developed with the aim of avoiding these complications. They are composed of collagen connective tissue derived from decellularized porcine, bovine or human origin. One possibility is to culture current autologous mesenchymal stem cells on biological meshes for the latter to serve as a scaffold for the development of stem cells. Thus, a bioartificial hybrid mesh could be created, composed of a polypropylene mesh and a biological mesh cultured with autologous stem cells. The polypropylene component provides resistance and the biological mesh (cultured with stem cells), may provide anti-inflammatory and immunomodulatory properties favoring tissue regeneration, reducing intestinal adhesion, enterocutaneous fistula, and infection. The hypothesis is that a mixed biological component (SIS-cells) reduce the inflammatory reaction and the adhesions to the intestinal tissue generated by polypropylene meshes.
Objectives: To describe the technique of obtaining pig xenogenic matrix combined with recellularization of human stem cell derived from human adipose tissue.
Materials and methods: Stage I: To obtain decellularized small intestine submucosa (SIS), 15 Kg male pigs were used. Small intestine was resected, the SIS prepared and decellularized. Stage II (recellularization by cell culture on SIS). Stem cell seeding: A) 3T3 cell line (embryonic mouse fibroblasts) B) Mesenchymal cells from human adipose tissue.
Results: All the stages of obtaining SIS cells, decellularization and culture with mesenchymal cell from human adipose tissue were successfully achieved.
Discussion: The polypropylene component provides the strength needed to repair large abdominal wall defects. The SIS may provide a scaffold for the development of mesenchymal cells from human adipose tissue with the ability for differentiation, inhibition of inflammatory processes, as a source of trophic factors and regeneration of tissues. We believe that the association of synthetic materials with engineered tissue can help to repair serious defects of the abdominal wall.
Conclusion: Our preliminary results indicate the feasibility of culturing small intestine submucosa (SIS) with human mesenchymal adipose cells.
Introducción
La reparación de los defectos de la pared abdominal continúa siendo un desafío frecuente para el cirujano general.
Las eventraciones constituyen la complicación alejada más común de la cirugía abdominal con una incidencia entre el 2% y 16% de las incisiones abdominales 1, 14, 17, 19, 20.
La tendencia actual es reparar estos defectos con mallas sintéticas siendo varios los autores que avalan esta conducta 1, 3, 4, 5, 6, 13, 14, 16, 17, 19, 20, 22, 23, 26.
Dentro de las mallas sintéticas las compuestas por polipropileno (PP) son las más empleadas y se usan desde 1959 a partir de los trabajos de Usher 30, 31, 32, 33, 34, 35. Este polímero ha demostrado tener buena tolerancia e integración a los tejidos, así como adecuada resistencia a las presiones intraabdominales.
Sin embargo, este material puede producir complicaciones como: infección de malla, adherencias intestinales y fístulas enterocutáneas.
Con la intención de disminuir estas complicaciones, en los últimos años han surgido las mallas denominadas "biológicas" 4, 6, 8, 11,15.
Éstas están compuestas por tejido colágeno descelularizado de origen animal (xenogénico, heterogénico) o humano (alogénico, homogénico, isogénico) 4, 6, 7, 8, 11, 15.
Si bien la idea de utilizar una malla biológica resulta atractiva, no está claro su reabsorción temprana y/o tardía, su resistencia a largo plazo, la formación de adherencias intestinales, su comportamiento inflamatorio debido a su origen xenogénico y su capacidad de evitar procesos inflamatorios crónicos 11.
Con la idea de mejorar las propiedades de las mallas biológicas, hoy podemos recurrir a la ingeniería de tejidos, esta es una nueva disciplina que se nutre de los conocimientos de la biología, medicina y ciencia de los materiales, cuyo objetivo es el manejo de células y materiales biocompatibles para lograr sustitutos capaces de restaurar una función tisular perdida 2, 8, 9, 24.
Bajo la hipótesis de que las mallas biológicas junto con el cultivo de células madres mesenquimales podrían disminuir la reacción inflamatoria tisular y las adherencias intestinales, el objetivo del trabajo es, en esta primer etapa desarrollar, con la ayuda de la ingeniería de tejidos, una matriz mixta compuesta por una malla biológica de origen animal (cerdo) combinada con la recelularización de células madres mesenquimales obtenidas de tejido adiposo humano.
Material y métodos
Describiremos en el trabajo dos etapas:
1. Obtención de la matriz biológica descelularizada.
2. Obtención, procesamiento y cultivo de la línea celular seleccionada para este estudio y posterior siembra sobre la matriz biológica.
Etapa 1: Obtención de la matriz biológica descelularizada.
- Proceso de obtención de la submucosa de intestino delgado de cerdo (SIS). Animal de experimentación: cerdos machos de 15 kg.
Técnica quirúrgica
Bajo los efectos de la anestesia general y en condiciones de asepsia se realiza incisión mediana supra-infra umbilical, se penetra en cavidad peritoneal y se realiza la resección total del intestino delgado. A continuación se ligan los vasos de la arcada mesentérica a nivel del borde intestinal. Se deja así el intestino delgado sin su mesenterio conformando un segmento tubular (Fig. 1).

Los animales fueron sacrificados por veterinarios siguiendo los protocolos éticos estandarizados de experimentación animal.
El primer paso que se realiza en el laboratorio (ICBME) es lavar el contenido intestinal con solución fisiológica, luego se abre el tubo intestinal por su borde mesentérico, se quita la capa externa seromuscular con maniobras de tracción y con la acción mecánica de gasas húmedas se remueve la capa interior mucosa. Así resta, solamente la capa media, denominada submucosa de intestino delgado, SIS (por sus siglas en ingles, small intes tinal submucosa). Ésta es una matriz de aproximadamente 0.4 mm de espesor compuesta por fibras colágenas y células conectivas (fibroblastos y fibrocitos). Finalmente se corta en rectangulos según necesidad para iniciar la descelularización. (Figura 2 y 3).
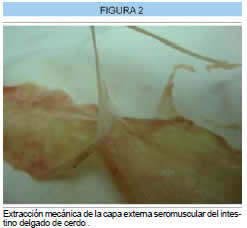

- Proceso de descelularización de la submucosa de intestino delgado de cerdo (SIS)
Este proceso se inicia con el secado del SIS, luego se coloca en agua destilada y agita durante 24 horas para destruir las células de la matriz, a continuación se agrega Triton X- 100 y agita por otras 72 horas para remover los restos de las células nativas, por último se procede a un nuevo secado y se controlan muestras teñidas con hematoxilina & eosina bajo microscopía para comprobar la trama de fibras colágenas y la ausencia de células conectivas (Figura 4).

Finalmente las piezas de SIS se secan y esterilizan en óxido de etileno. De este modo la matriz extracelular de submucosa de intestino delgado de cerdo (ECM- SIS por sus siglas en inglés) está terminada y lista para iniciar el proceso de recelularización.
Etapa 2: Obtención, procesamiento y cultivo de la línea celular seleccionada para este estudio y posterior siembra sobre la matriz biológica.
- Proceso de obtención y cultivo de células madres del tejido adiposo humano.
La línea célular seleccionada para este trabajo son las células madres mesenquimales (CMM) (mesenchymal stem cells) obtenidas de tejido adiposo humano.
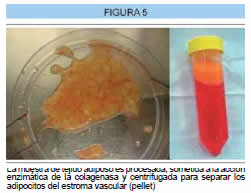
Se toma una biopsia de tejido adiposo humano y se envía al laboratorio, a continuación la muestra se corta en pequeños trozos (digestión mecánica) y lava varias veces con un medio apropiado (Hank's Balanced Salt Solution HBSS + ATB) para remover restos de sangre. Luego la muestra se somete a la acción de la colagenasa tipo I, (digestión enzimática), mientras se incuba a 37º C y agita durante 60 minutos, terminado esto la acción enzimática es inhibida con suero fetal bovino, luego la muestra se centrifuga para separar los adipositos de la fracción vásculo-estromal (pellet) (Figura 5).
Las células madres mesenquimales contenidas en el pellet son cultivadas en medio de cultivo (D-MEM 20% SFB) a 37ºC y con 5% de CO2 en el aire para su desarrollo y reproducción. Una vez obtenido el pasaje 4 se fija el cultivo celular con paraformaldheído (PAF) 4% durante 20 minutos, luego se realiza una inmunohistoquímica con fluorescencia (FIT C) para la detección de las proteínas CD90 membrana, CD29 membrana, STRO1 citoplasmática
Los marcadores biológicos utilizados para caracterizar las células madres mesenquimales son el CD90, CD29 y el STRO1.
- Proceso de siembra de la matriz biológica (SIS) con CMM Las células madres mesenquimales (CMM) cultivadas en el paso anterior son sembradas sobre piezas de matriz biológica (SIS) de 2.5 x 2.5 cm.
En una placa de Petri conteniendo medio de cultivo se coloca una muestra del SIS, sobre este se siembran las células mesenquimales con una densidad de 1 x 105 células/cm2 de matriz y se incuban a 37ºC y 5% de CO2 . El medio de cultivo se cambia cada tres días.
El proceso de siembra de células madre mesenquimales de tejido adiposo humano se realiza en 6 muestras de SIS de 2.5 x 2.5 cm, más una muestra de SIS control sin sembrar. Al cabo de 10 días todas las muestras se fijan para obtener cortes histológicos y cuantificar por microscopia óptica (40X) la cantidad de células adheridas al SIS usando el programa Image J.
Como control se usa el cultivo de la línea celular 3T3 (fibroblastos de embriones de ratón) que se siembra sobre una muestra de SIS. Se sabe que estas células se adhieren fácilmente a distintas superficies. La finalidad de esta muestra es comparar el desarrollo celular sobre el SIS de las células 3T3 con las céluas madre mesenquimales de tejido adiposo humano.
Resultados
1. Eficiencia de la descelularización: el proceso fue efectivo no observándose presencia de núcleos celulares en cortes histológicos del SIS teñidos con hematoxilina y eosina y vistos por microscopía óptica convencional.
2. Cuantificación de los diferentes marcadores para células madre (CD90, CD29 y el STRO1): el 58.53% de las células presentaban marcación positiva para CD90, el 53.30% de las células presentaban marcación positiva para CD29 y el 44.4% de las células presentaban marcación positiva para STRO1.
3. Cuantificación de la recelularización: se cuantificó por microscopía óptica a 40X la cantidad de células adheridas al SIS en la totalidad de la malla y se obtuvo un promedio de 0.23 células/ 10-6 cm2, mediante el programa Image J.
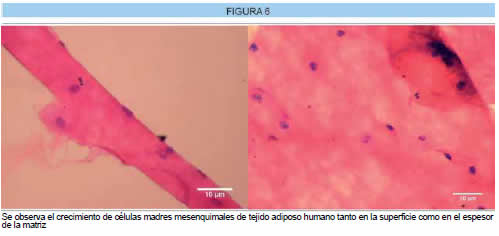
En la Figura 6 se muestra el desarrollo de células madre mesenquimales de tejido adiposo humano sobre la superficie del SIS y en su espesor.
Discusión
Los defectos de la pared abdominal se pueden reparar por medio de plásticas con malla o sin ella.
La indicación de reparar con malla depende de varios factores: diámetro del anillo (el más importante), calidad de los tejidos vecinos y ubicación del defecto.
Hasta fines de los años 80 se indicaba reparar con malla los defectos que superaban los 10 cm de diámetro, pero en la actualidad algunos autores ya recomiendan utilizar éstas cuando el diámetro supera los 3 cm 3, 6, 9, 13, 14, 16, 19, 20.
Así, la malla sintética se ha convertido en un estándar de cuidado para la reparación de los defectos de la pared abdominal 3, 5, 6, 13, 14, 16, 17, 19, 20, 27, 28.
Existen muchas mallas protésicas pero básicamente se las puede clasificar en 1, 3, 5, 6, 14, 16, 17, 19, 20, 21, 25:
Sintéticas irreabsorbibles: Polipropileno (PP), poliéster (POL), politetrafluoroetileno (PTFE)
Sintéticas reabsorbibles: Poliglactina, ácido poliglicólico.
Biológicas: Submucosa de intestino delgado de cerdo (SIS) (surgisis®), dermis de cerdo (permacol ®) y dermis humana cadavérica (alloderm®) entre otras 4, 6, 7, 11, 15.
De todos estos materiales el polipropileno es el más utilizado. Sus principales ventajas son: adecuada resistencia, buena integración a los tejidos y el ser inerte. Hasta el momento es el material que mejores resultados ofrece.
Sin embargo puede presentar algunas complicaciones como, infección de malla, adherencias intestinales y fístulas enterocutáneas 13.
Las mallas biológicas han surgido como una nueva alternativa para resolver estas complicaciones 4, 7, 11, 15.
Están compuestas por una matriz de fibras colágenas de origen animal o humano, que actúan como soporte para la infiltración de células conectivas del paciente 4, 7, 11, 12, 15.
Sin embargo, no hay suficiente experiencia con estas matrices biológicas y existen dudas sobre: grado de reabsorción, resistencia a largo plazo, comportamiento ante la infección y formación de adherencias intestinales 4, 7, 11, 15.
En la actualidad persiste la necesidad de crear una malla que pueda ser: a) colocada intraperitoneal en contacto con las vísceras, b) que no produzca adherencias intestinales ni fístulas enterocutáneas, c) resistente a la infección, pudiendo ser utilizada asociada a cirugías sucias, d) prolongada resistencia a la acción mecánica, e) capaz de regenerar tejido, f) inmunomoduladora (capaz de regular la respuesta inflamatoria para evitar procesos crónicos).
¿Cómo nos puede ayudar la ingeniería de tejidos?
Esta disciplina nos posibilita generar órganos y tejidos por fuera del ser humano haciendo uso de dos elementos básicos, una matriz o andamio y un componente celular 2, 8, 9, 18, 24, 29.
En la actualidad la ingeniería de tejidos podría permitir la elaboración de una matriz de tejido conectivo descelularizado (SIS) con el agregado de células madres mesenquimales autólogas obtenidas en el laboratorio e integrarla con una malla de polipropileno para formar una bioprótesis que evite las adherencias intestinales.
Por lo tanto nos hemos planteado el estudio de una prótesis que combine las ventajas de la malla de polipropileno (aportando resistencia) y la biológica con siembra de células madres mesenquimales autólogas (aportando biointegración) 1, 4, 9, 24, 29 (Figura 7).

En esta primera etapa nos hemos propuesto crear la matriz biológica con el agregado de células madre mesenquimales y en una posterior, integrar ésta con el polipropileno. Las células usadas en ingeniería de tejidos pueden ser obtenidas de una variedad de fuentes. Las células pueden ser allogénicas, xenogénicas o autólogas. Pero las células ideales deberían ser: de fácil obtención, multipotentes con capacidad de diferenciarse en células con funciones específicas, altamente proliferativas en vitro y aceptadas por el sistema inmunológico del receptor para no emplear terapia inmunosupresora8, 9, 10, 18, 24, 29.
¿Qué son las células madre?
La identificación de células madre (CM) o troncales ha progresado sustancialmente desde finales del siglo XX y se han descripto en casi todos los tejidos adultos. Han sido descriptas células madre somáticas de la piel, el sistema nervioso central, la médula ósea, el hígado, el intestino, el músculo esquelético y el corazón 2, 9, 10, 18, 29.
Es importante destacar que hoy en día, el término célula madre es utilizado para describir distintas poblaciones celulares que se caracterizan por sus atributos funcionales y no morfológicos. Las células madre se definen por sus características funcionales y no por su morfología 2, 9, 29.
Las características que definen a las células madre son: a) Indiferenciación: son células que no expresan marcadores específicos de un tejido, por lo cual no son las células funcionales de dicho tejido. b) Capacidad de proliferación: las células madre mantienen su capacidad de proliferación a lo largo de toda la vida del individuo. Sin embargo estas células permanecen en estado quiescente y solo proliferan cuando son estimuladas. c) Capacidad de automantener la población: las células madres son capaces de dividirse dando origen a dos células hijas iguales. Pueden autorrenovarse indefinidamente al mismo tiempo que pueden producir una progenie más madura, especializada y específica de órgano/tejido. d) Capacidad de participar en la regeneración de tejidos: las células madre pueden dar origen a células altamente proliferativas e indiferenciadas que van adquiriendo marcadores de diferenciación y originan las células funcionales de órganos y tejidos. Estas células pueden ser activadas luego de un daño, participando en el proceso de reparación 2, 9, 29.
Para que una célula sea considerada CM debería cumplir con todos estos criterios; sin embargo, en la práctica, existen limitaciones experimentales que conducen a categorizar a una CM cuando cumple sólo con alguno de estos, si bien no todos tienen el mismo peso 2, 29.
De todas estas propiedades se desprende que las CM no son una entidad autónoma dependientes de presentar o no esta cualidad, sino que su principal atributo se refiere a su comportamiento potencial y este es un estado dinámico de activación/ represión modulado por factores intrínsecos en estrecha relación con señales extrínsecas locales 2, 8, 9, 18, 29.
Sin embargo, aún es una incógnita cómo conseguir un tejido a partir de dichas células, cuales son las señales que determinan el destino de las CM y que tejido pueden originar.
Existen distintos tipos de CM que se clasifican en base a su potencial de diferenciación o plasticidad.
CM totipotentes: Capaces de generar los más de 200 tipos celulares de un individuo. Pueden desarrollar los componentes embrionarios (las tres capas embrionarias, el linaje germinal y los tejidos que darán lugar al saco vitelino), como los extraembrionarios (la placenta). Por ejemplo, las células madre embrionarias.
CM pluripotentes: Pueden generar cualquier tipo de célula proveniente de los tres linajes embrionarios (endodermo, ectodermo y mesodermo), así como el germinal y el saco vitelino. Por ejemplo, las células derivadas de los blastocitos.
CM multipotentes: Capaces de generar un número variado pero más limitado de células diferenciadas que las generadas por las pluripotentes. Por ejemplo, las células madre de médula ósea.
CM unipotentes: Solo son capaces de generar un linaje celular. Por ejemplo, el condroblasto, que da origen al condrocito.
Por otra parte, con cada nuevo descubrimiento, los investigadores han creado diferencias terminológicas para estas células. Así, células del estroma de médula ósea, células estromales multipotentes, células estromales mesenquimales, unidad formadoras de colonias fibroblásticas (CFUFs), células precursoras estromales y células progenitoras adultas multipotentes, son algunos de los términos que se utilizan para estas células 9, 10, 18.
Los cultivos de células madre mesenquimales se caracterizan (identifican) usando un panel de anticuerpos y se definen células CD45-, CD34- , CD105+, CD73+. Otras marcas que se utilizan para identificar estos cultivos incluyen CD90 +, CD144+, CD29+ Stro1, CD166 y otros, sin embargo las células madre mesenquimales no poseen una marca única que sea confiable para el aislamiento y purificación, por lo tanto su caracterización todavía se debate 9,10, 29.
No obstante estas ambigüedades generales, hoy en día está bien establecido que dichas células se pueden aislar de la médula ósea y de otros tejidos y sirven como fuente para la ingeniería de tejidos 9, 10, 29.
¿Por qué seleccionamos las células madres mesenquimales?
Las células madre mesenquimales representan un homogéneo grupo celular similar a los fibroblastos. Las ventajas de usar estas células derivan de la capacidad que tienen de diferenciarse en varias líneas celulares como: células mesoteliales, fibroblastos, adipoblastos, mioblastos, osteoblastos y condroblastos 9, 10, 18, 29. También contarían con capacidad inmunomoduladora, capacidad de disminuir la respuesta inflamatoria tisular, son tolerogénicas, son fuente de factores tróficos y pueden secretar factores de crecimiento.
¿Por qué obtener las células madre mesenquimales del tejido adiposo?
Es importante resaltar que la fuente habitual de este tipo de células es la médula ósea, y por lo tanto la toma de una muestra de tejido adiposo presenta ventajas quirúrgicas sobre la toma de médula ósea 9, 10, 18, 29.
¿Por qué usar matrices biológicas?
La malla biológica o matriz extracelular (ECM) es el estroma o estructura proteica sobre el cual se organizan las células de un órgano o tejido. Es producida por las mismas células que la componen en función de un delicado estado dinámico de interacción con su microambiente 4, 8, 12. Por lo tanto preservar su composición y estructura específica durante el proceso de descelularización es indispensable para el ulterior desarrollo de las células 7, 12.
La elección de los agentes de descelularización depende de muchos factores, incluyendo la celularidad del tejido, su densidad, contenido lipídico, espesor, etc. Se debe entender que cada agente empleado para descelularizar la ECM causará algún grado de alteración en la composición o microestructura de la misma 8, 12. Una actualización de las técnicas de descelularización y sus posibles efectos deletéreos sobre las ECM fue publicado por Crapo y cols. en 20117.
Estas matrices tienen la propiedad de: a) conservar el colágeno tipo I, II, III, IV y V, glucosaminoglicanos y otras proteínas como fibronectina, laminina y citoquinas 29; b) presentar alto grado de tolerancia debido a su homogéneo componente de colágeno; c) servir como (scaffold) estructura, andamio o encofrado para el crecimiento, desarrollo y diferenciación de las líneas celulares y d) contendrían sustancias estimulantes de la angiogénesis 4, 8, 10, 26.
Por lo tanto nos resultó un material interesante para investigar la siembra y crecimiento de las células madre de tejido adiposo 2.
Como desventaja se resalta su baja resistencia mecánica debido a su rápida degradación. En nuestro trabajo hemos logrado obtener mallas biológicas de intestino de cerdo descelularizadas, esto fue comprobado por la ausencia de núcleos celulares así como de ADN en la microscopia óptica luego de teñidos con hematoxilina eosina.
Paralelamente se logró el aislamiento, desarrollo y cultivo in vitro de células madres mesenquimales de origen adiposo. La comprobación de que las células corresponden a esta estirpe se realizó por inmunohistoquímica con fluorescencia para la detección de las proteínas de membrana CD90 y CD29 y la proteína STRO 1 citoplasmática.
Si bien existen otros marcadores para caracterizar estas células usamos el CD90, CD29 y el STRO1 por ser con los que contamos en nuestro laboratorio. En la actualidad, con el uso de tres marcadores es suficiente para considerar positiva la caracterización.
Más del 50% de las células presentaron marcación positiva para CD90 y CD29 y 44% positivas para STRO1.
Si bien estos valores no son muy altos se consideran suficientes para determinar el desarrollo de las células. Se cuantificó por microscopía óptica la cantidad de células adheridas al SIS en la totalidad de cada una de las muestras y se obtuvo un promedio de 0.23 células/10-6 cm2. Si bien no es un promedio muy alto consideramos que se puede mejorar con el incremento de la densidad de siembra y la experiencia.
¿Cuáles son las posibilidades futuras?
En la actualidad el cultivo celular junto con la ingeniería de tejidos permitiría la integración de matrices biológicas con el polipropileno para desarrollar una bioprótesis que podría disminuir las adherencias intestinales.
El polipropileno aportaría resistencia mecánica mientras que la matriz biológica junto con el cultivo celular podría disminuir las adherencias intestinales.
Finalmente pensamos que los avances en la reparación de los defectos de la pared abdominal se deberán al desarrollo de nuevos biomateriales. Las técnicas quirúrgicas ya nos han entregado casi todo su potencial, tal es así que tanto en cirugía abierta como laparoscópica, la reducción de recidivas se debió al uso de mallas sintéticas.
En casos complejos se necesitarán bioprótesis especiales o incluso la producción de tejidos artificiales producto de la ingeniería de tejidos.
Conclusión
Nuestros resultados preliminares muestran la posibilidad de que la submucosa de intestino delgado de cerdo (SIS) sea recelularizada usando células madres mesenquimales obtenidas del tejido adiposo humano.
1. Aguayo-Albasini JS, Moreno-Egea A, Torralba-Martínez JA. El laberinto de las prótesis composite en las eventraciones. Cir Esp 2009; 86 (3): 139-146. [ Links ]
2. Argibay P y col. Medicina regenerativa. Delhospital ediciones. 2012. [ Links ]
3. Aufenacker TJ, koelemay MJW, Gouma DJ, Simons MP. Systematic review and meta-analylis of the effectiveness of antibiotic prophylaxis in prevention of wound infection after mesh repair of abdominal wall hernia. Br J Surg 2006; 93: 5-10. [ Links ]
4. Badylak SF. Xenogeneic extracellular matrix as a scaffold for tissue reconstruction. Transplant Immunology 2004, 12: 367- 377. [ Links ]
5. Bendavid R. Composite mesh (polypropylene-e-PTFE) in the intraperitoneal position. A report of 30 cases. Hernia 1997;1:5-8. [ Links ]
6. Brandi CD. Tratamiento de los defectos de la pared abdominal. Rev. Argent, Cir. 2009 Nº extraordinario. [ Links ]
7. Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011 April; 32(12): 3233-3243. [ Links ]
8. Daley WP, Peters SB, Larsen M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science 2008; 121: 255-264. [ Links ]
9. Deans TL, Elisseeff JH. Stem cells musculoskeletal engineered tissue. Current opinion in biotechnology 2009, 20:537-544. [ Links ]
10. Deans TL, Elisseeff JH. The Life of a Cell: Probing the Complex Relationships with the World. Cell Stem Cell 2010; 6 (4): 499-501. [ Links ]
11. Gaertner W.B, Bonsack M.E, Delaney J.P. Experimental evaluation of four biologic prostheses for ventral hernia repair. J. Gastrointest Surg 2007; 11: 1275-1285. [ Links ]
12. Gilbert TW, Sellaro TL, Badylak SF. Decellularization of tissues and organs. Biomaterials. 2006; 27(19):3675-3683. [ Links ]
13. Granat M. Reduction of peritoneal adhesions formation by colchicines: a compatative study in the rat. Fertl Steril. 1998; 40 (3): 369-372. [ Links ]
14. Hesselink VJ, Luijendijk RW, de Wilt JHW, Heide R, Jeekel J. An evaluation of risk factors in incisional hernia recurrence. Surg Gynecol Obstet 1993;176:228-234. [ Links ]
15. Hoganson DM, Owens GE, O´Doherty EM, et al. Preserved extracellular matrix components and retained biological activity in decellularized porcine mesothelium. Biomaterials. 2010; 31: 6934-6940. [ Links ]
16. Israelsson LA, Smedberg S, Montgomery A, Nordin P; Spangen L: Incisional hernia repair en Sweden 2002. Hernia 2006; 10: 259-261. [ Links ]
17. Jenkins J T, O´Dowyer P J. Inguinal hernias. BMJ 2008; 336: 269-272. [ Links ]
18. Kern S, Eichker H, Stoeve J, Klüter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem cell 2006; 24: 1294-1301. [ Links ]
19. Kingsnorth A, LeBlanc K. Hernias: inguinal and incisional. Lancet 2003; 362:1561-1571. [ Links ]
20. Kingsnorth A. Treating inguinal hernias. BMJ 2004, 328: 59-60. [ Links ]
21. Klinge U, Conze J. Krones CJ, Schumpelick V. Incisional hernia: Open techniques. World J. Surg 2005; 29: 1066- 1072. [ Links ]
22. Millikan K W, Cummings B, Doolas A. The Millikan modified mesh-plug hernioplasty. Arch Surg 2003; 138:525-530. [ Links ]
23. Millikan K W, Doolas A. A long-term evaluation of the modified mesh-plug hernioplasty in over 2000 patients. Hernia 2008; 12: 257-260. [ Links ]
24. Nasseri B.A. Ogawa K. Vacanti J.P. Tissue engineering: An evolving 21st-century science to provide biologic replacement for reconstruction and transplantation. Surgery 2001; 130: 781- 784. [ Links ]
25. Penttinen R, Grönroos. Mesh repair of common abdominal hernias: a review on experimental and clinical studies. Hernia 2008; 12: 337-344. [ Links ]
26. Primatesta P, Goldacre M J. Inguinal hernia repair: incidence of elective and emergency surgery, readmission and mortality. Inter J Epidem 1996; 25: 835-839. [ Links ]
27. Rutkow I M. Demographic and socioeconomic aspect of hernia repair in the United State in 2003. Surg Clin N Am 2003; 83: 1045-1051. [ Links ]
28. Sanjay P, Woodward A. A survey of inguinal hernia repair in Wales with special emphasis on laparoscopic repair. Hernia 2007; 11: 403-407. [ Links ]
29. Tuan R S, Boland G, Tuli R. Adult mesenchymal stem cells and cell-based tissue engineering. Arthritis Res Ther 2003, 5: 32-45. [ Links ]
30. Usher F. A new plastic prosthesis for repairing tissue defects of chest and abdominal wall. Am J. Surg 1959; 97: 629-633. [ Links ]
31. Usher F. Hernia repair with knitted plolypropylene mesh. Surg. Gynecol Obst. August 1963; 239-240. [ Links ]
32. Usher F. Hernia repair with Marlex Mesh: an analysis of 451 cases. Arch Surg. 1962; 84:73-76. [ Links ]
33. Usher FC, Cogan IE, Lowry TI. A new technique for the repair of inguinal and incisional hernias. Arch Surg. 1960; 81: 847-854. [ Links ]
34. Usher FC, Hill J, Ochsner J. Hernia repair with Marlex mesh. Surgery 1959; 46: 718. [ Links ]
35. Usher FC. New technique for repairing incisional hernias with marlex mesh. Am J Surg 1979; 138: 740-741. [ Links ]














