Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cirugía
versión impresa ISSN 2250-639Xversión On-line ISSN 2250-639X
Rev. argent. cir. vol.111 no.4 Cap. Fed. dic. 2019
ARTÍCULO ORIGINAL | ORIGINAL ARTICLE
Abordaje laparoscópico simultáneo del cáncer de colon con metástasis hepáticas
Simultaneous laparoscopic approach for colon cancer and liver metastases
Rafael J. Maurette1, Marcos D. García Ejarque, Hernán Ruíz2, Mariano L. Bregante1, Diego J. Bogetti2, Mariano Cillo2, Diego Estefanía2, Fernando G. Bugallo2, Juan C. Patrón Uriburu2, Carlos R. Tyrrell2, Mario C. Salomón2, Daniel E. Pirchi1
1 Servicio de Cirugía General, Sector de Cirugía Hepatobilio-Pancreática.
2 Servicio de Coloproctología. Hospital Británico de Buenos Aires. Argentina
Correspondencia Correspondence: Rafael J. Maurette e-mail: rmaurette@hbritanico.com.ar
Los autores declaran no tener conflictos de interés.
Conflicts of interest None declared.
http://dx.doi.org/10.25132/raac.v111.n4.1403.es
Presentado en la Academia Argentina de Cirugía, sesión del 16 de mayo de 2018
Recibido | Received 15-03-19
Aceptado | Accepted 22-07-19
RESUMEN
Antecedentes: la hemicolectomía derecha laparoscópica con abordaje suprapúbico (HDLS) y empleo de tecnología. En los pacientes con cáncer de colon con metástasis hepáticas sincrónicas (CCMHS), la resección completa del tumor primario con las metástasis es la única opción de tratamiento con intención curativa. Se conocen varios informes de series de casos en el mundo; sin embargo, no existe ningún estudio aleatorizado controlado.
Objetivo: el objetivo es evaluar la factibilidad y seguridad del abordaje laparoscópico simultáneo de la resección del tumor primario de colon y de la metástasis hepática.
Material y métodos: es un estudio retrospectivo; a tal fin se recolectaron todos los pacientes con sospecha de CCMHS abordados por laparoscopia con intención de resección simultánea del tumor primario de colon con las metástasis hepáticas. Se analizaron variables preoperatorias, operatorias, resultados a corto y largo plazo, y anatomopatológicas.
Resultados: en el período de estudio se realizaron 89 resecciones hepáticas laparoscópicas (RHL). En 28 pacientes se realizó âen forma simultánea con la RHLâ otro procedimiento, en 21 de los cuales fue una colectomía laparoscópica. El tiempo quirúrgico promedio total de los dos procedimientos llegó a 407 minutos. El promedio de días de estadía hospitalaria fue de 8 días. No hubo mortalidad en la serie, y la morbilidad global fue del 71%, pero un solo caso con morbilidad mayor. La sobrevida global y la sobrevida libre de recurrencia a los 3 años fue de 55,2% y 16,3%, respectivamente.
Conclusión: Esta es la primera publicación acerca del tema en nuestro país. Podemos decir que, en casos bien seleccionados, el abordaje laparoscópico simultáneo es factible de realizar, con aceptable morbimortalidad y sin comprometer los resultados oncológicos.
Palabras clave: Cáncer de colon; Metástasis hepática; Abordaje simultáneo; Laparoscopia; Colectomía laparoscópica; Resecciones hepáticas laparoscópicas.
ABSTRACT
Background: In patients with colorectal cancer with synchronous liver metastases (CLM), complete resection of the primary tumor with the metastases is the only option for curative treatment. Several case series have been reported but no randomized controlled trials have been published.
Objective: The aim was to evaluate if the simultaneous laparoscopic resection of the primary colon tumor and liver metastases is feasible and safe.
Material and methods: A retrospective study was conducted with patients with suspected CLM scheduled for simultaneous laparoscopic resection of the primary tumor of the colon and liver metastases. The preoperative and operative variables, short- and long-term outcomes and pathological variables were analyzed.
Results: A total of 89 laparoscopic liver resections (LLR) were performed during the study period. In 28 patients, LLR was simultaneous with other procedures, 21 of which corresponded to laparoscopic colon resection. Mean surgical time for both procedures was 407 minutes. Mean hospital length of stay was 8 days. None of the patients died and overall morbidity rate was 71% with only one major complication. Overall survival and relapse-free survival at three years was 55.2% and 16.3%, respectively.
Conclusion: This is the first publication analyzing this approach in our country. In well selected cases, the simultaneous laparoscopic approach is feasible, with low morbidity and mortality and acceptable oncological results.
Keywords: Colon cancer; Liver metastasis; Simultaneous approach; Laparoscopy; Laparoscopic colectomy; Laparoscopic liver resection.
Introducción
Según estudios poblacionales, la incidencia de cáncer de colon con metástasis hepáticas sincrónicas (CCMHS) ocurre en el 15 al 30% de los pacientes al momento de su diagnóstico1,2. Para estos pacientes, la resección completa del tumor primario con las metástasis hepáticas sincrónicas es la única opción de sobrevida a largo plazo. Existen tres opciones quirúrgicas diferentes de abordaje de los pacientes con diagnóstico de CCMHS: el abordaje secuencial, el reverso y el simultáneo. El abordaje secuencial consiste en la resección en primer lugar del tumor primario del colon y luego de las metástasis hepáticas. El abordaje reverso es la resección en primer lugar de la metástasis y luego del tumor primario. Finalmente, el abordaje simultáneo implica la resección de ambos en la misma intervención, independientemente de su orden. Se han publicado varios resultados de estudios observacionales, revisiones sistemáticas y metanálisis, donde no se encontró que la resección simultánea haya aumentado la morbimortalidad, incluso cuando se asocia a hepatectomías mayores3. Esto ha sido corroborado por el estudio multicéntrico de Mayo y col., entre otros, que comparó el abordaje simultáneo con el secuencial, sin encontrar diferencias4.
Tanto la cirugía laparoscópica del colon como algunas indicaciones de las resecciones hepáticas laparoscópicas (RHL) se encuentran aceptadas como prácticas habituales. Sin embargo, el abordaje simultáneo por laparoscopia del tumor de colon y las metástasis hepáticas se halla aún en investigación5. Si bien existen numerosos estudios de series de casos, multicéntricos, revisiones sistemáticas del abordaje laparoscópico simultáneo del tumor primario de colon y sus metástasis hepáticas12-21, hasta la fecha no se han realizado estudios aleatorizados controlados así como ningún tipo de publicación proveniente de nuestro medio.
El objetivo primario del presente trabajo es evaluar la factibilidad y seguridad del abordaje laparoscópico simultáneo de la resección del tumor primario de colon y de la metástasis hepática. El objetivo secundario es conocer los resultados a largo plazo.
Material y métodos
En el sector de Cirugía Hepatobilio-Pancreática, junto con el Servicio de Coloproctología del Hospital Británico de Buenos Aires, se realizó un estudio retrospectivo sobre una base de datos prospectiva donde se recolectaron todos los pacientes con sospecha de CCMHS abordados por laparoscopia con intención de resección simultánea del tumor primario de colon con las metástasis hepáticas. Se incluyeron todos los pacientes operados consecutivamente entre agosto del año 2008 hasta mayo de 2018.
El criterio de selección de pacientes para abordaje laparoscópico fue decidido por el grupo médico tratante, ya que hasta la fecha no existen criterios establecidos para ese fin.
Se definió como âcaso laparoscópicoâ cuando se haya realizado al menos una parte relevante del procedimiento; en el caso de la RHL: movilización hepática completa, ligadura de pedículos, o si se hizo parte de la transección. Tanto para los abordajes del colon como del hígado, no se registraron como casos laparoscópicos cuando después de una laparoscopia exploradora, o por hallazgos de la ecografía translaparoscópica, se decide convertir el procedimiento a cirugía abierta sin haber realizado las maniobras previamente mencionadas.
Criterios de exclusión del abordaje laparoscópico: tumor primario de colon complicado o adherido a órganos vecinos; lesiones hepáticas: nódulos mayores de 10 cm, cercanos a la vena cava, o con compromiso del pedículo hepático principal o del confluente de las venas suprahepáticas.
Se analizaron:
1. Variables preoperatorias: datos demográficos; diagnóstico; localización, número y tamaño de la lesión más grande en el hígado según los estudios por imágenes; localización del tumor primario de colon, CEA y CA 19-9, quimioterapia neoadyuvante.
2. Variables operatorias y resultados a corto plazo: procedimientos realizados sobre el hígado; procedimiento realizado en el tumor primario de colon; eventos intraoperatorios según la clasificación de Oslo; clampeo pedicular; número de pacientes transfundidos; tiempo quirúrgico total, de la hepatectomía y el de la colectomía; conversión del procedimiento a mano asistido o a cirugía convencional. Asimismo se tuvieron en cuenta tiempo de internación, morbilidad global según la clasificación de Dindo-Clavien, morbilidad específica del hígado o de la cirugía colónica, morbilidad mayor definida como complicaciones grado 3b o mayor y mortalidad a los 90 días22,23.
3. Variables anatomopatológicas: TNM del tumor primario, grado de diferenciación, márgenes, tamaño y número de las lesiones resecadas, márgenes de la colectomía y de la lesión hepática definida como R0 o R1.
4. Resultados a largo plazo: quimioterapia adyuvante, sitio de la recaída, sobrevida libre de recurrencia y sobrevida global.
Análisis estadístico
Los datos continuos están expresados en media con desvío estándar (DS) o mediana con el correspondiente rango entre paréntesis. Para analizar las curvas de sobrevida se utilizó el test de Kaplan-Meier. Todos los análisis estadísticos fueron realizados utilizando el programa estadístico IBM SPSS Satistic 20.0®.
Resultados
En el período de estudio se realizaron 89 RHL. En 28 pacientes se efectuó, en forma simultánea con la RHL otro procedimiento, en 21 de los cuales fue una resección colónica o rectal. Estos últimos se incluyeron para el presente análisis (Fig. 1). En la tabla 1 se listan las variables clínicas y demográficas, destacándose que hubo principalmente pacientes de bajo riesgo (solo tres fueron ASA 3), con pocas lesiones (62%: 1 lesión y 24%: 2 lesiones), con un diámetro con una mediana de 20 mm (7- 88) y en su mayoría con lesiones hepáticas unilobares (71,4%). Las variables intraoperatorias se resumen en las tablas 2 y 3. Se realizaron 3 resecciones laparoscópicas de recto; la mayoría de las resecciones hepáticas fueron no anatómicas (71%). De las RHL anatómicas, 3 fueron seccionectomías laterales izquierdas, y 3 segmentectomías (todas S6). También, junto con la colectomía laparoscópica, en tres casos se realizó el primer tiempo de una hepatectomía de remodelación hepática: en uno, ligadura de vena porta derecha más metastasectomías en los S2-3 y S4a, y en los otros dos se realizó en el primer tiempo una seccionectomía lateral izquierda + metstasectomías. También se realizó el primer tiempo de un mini-ALPPS (ligadura de vena porta izquierda, más metastasectomía en los S6, S4b, ablación por radiofrecuencia -ARF- de la lesión del S4A, más transección parcial sobre la línea de Cantlie). De los tres casos de cirugía de remodelado hepático, en el primer caso no se completó la segunda cirugía por falta de hipertrofia del futuro remanente hepático; en el segundo se completó la resección por vía convencional a los 120 días de la primera cirugía (recibió tratamiento con quimioterapia en el intervalo), y al último se le realizó una seccionectomía posterior derecha laparoscópica al mes. En el paciente del mini-ALPPS se completó la hepatectomía izquierda laparoscópica a los 16 días de la primera cirugía. Solo en dos casos se empezó mediante abordaje mano asistido, y en el 62% de los casos se comenzó el procedimiento con la colectomía. Se convirtieron a cirugía abierta 9 casos (Fig. 2); 5 (23,8%) de estas conversiones tuvieron lugar durante la resección hepática laparoscópica y 4 (19%) durante la resección colónica. Las causas de la conversión en la fase de la resección hepática laparoscópica fueron: 2 por sangrado, 2 para asegurar una resección R0, 1 por no encontrar la lesión. Las causas de conversión durante la colectomía laparoscópica fueron: 2 tamaño tumoral, 1 perforación colónica, 1 por no encontrar el tumor. Las 5 conversiones durante la hepatectomía laparoscópica se presentaron en la primera etapa de la experiencia; no existieron conversiones en la segunda mitad de la serie. La única conversión que fue de urgencia se debió al sangrado durante la resección hepática. Esta se clasifica como incidente intraoperatorio grado 1 de la clasificación de Oslo, ya que el sangrado no superó los 1000 mililitros.

Figura 1
Tabla 1

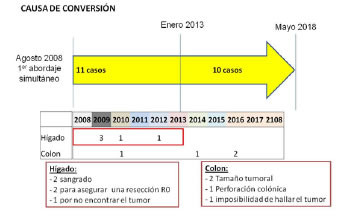
Figura 2
En más de la mitad de los pacientes (66%) se utilizó maniobra de Pringle. El tiempo quirúrgico promedio total de los dos procedimientos fue de 407 minutos (240-845). Nueve pacientes se transfundieron en el perioperatorio (Fig. 3), 8 de estos en la primera mitad de la experiencia. Dos de estos requirieron más de 2UGR: uno, debido a la perforación del dudodeno, y otro por un sangrado que motivó la conversión.

Figura 3
Tabla 2

Tabla 3

El promedio de días de estadía hospitalaria fue de 8 días (rango 3-49). No hubo mortalidad en la serie y la morbilidad global fue del 71%, pero hubo un solo caso con morbilidad mayor (grado 4), una perforación duodenal. En las tablas 4 y 5 se detallan las morbilidades. En cuanto a las morbilidades específicas, hubo 3 dehiscencias de anastomosis, de las cuales 2 necesitaron drenaje percutáneo y una resolvió con conducta expectante. En la morbilidad específica del procedimiento hepático hubo 3 colecciones perihepáticas que necesitaron drenaje percutáneo y una bilirragia tipo A. De las 5 complicaciones grado 3a que se resolvieron colocando un drenaje abdominal con anestesia local, 3 fueron colecciones perihepáticas y dos, colecciones por dehiscencia de la anastomosis. La morbilidad grado 4 fue un paciente al que se le realizó metastasectomía más ARF de una lesión del S5 posicionando la aguja de radiofrecuencia por la cara anterior del hígado, e inadvertidamente por contigͼidad quemó la segunda porción duodenal que provocó la perforación en el posoperatorio, y las múltiples reoperaciones.
Tabla 4

Tabla 5

De acuerdo con la estadificación anatomopatológica, el 88% de los tumores eran T3/4 y el 70% N positivo (Tabla 6). La mayoría de los pacientes recibió quimioterapia adyuvante (88%). Hubo un total de 12 (70%) recaídas: 7 en el hígado, 2 en el pulmón, 2 recaídas locales en adenopatías y 1 recayó en más de un sitio. Las recaídas en el hígado se presentaron con una media de 11,5 meses (rango 1,5 a 22,5 meses). El caso que recayó al mes y medio fue el paciente que se convirtió en la fase de la hepatectomía para lograr una resección R0. Probablemente debió existir en este caso una lesión pequeña no vista en las imágenes preoperatorias así como tampoco durante la cirugía. Se logró la resección R0 de la lesión conocida, pero el paciente tenía una enfermedad biológicamente agresiva, ya que a los 5 meses de su recaída hepática presentó recaída pulmonar (36 años con un estadio patológico pT4N2M1, y sin neoadyuvancia). En los 7 pacientes que recayeron solo en el hígado, la recaída fue en un sitio distinto del de la primera resección, y de estos, en 3 ocurrió en los pacientes a los que se les realizó una cirugía hepática en dos tiempos (2 casos de remodelado hepático y el mini-ALPPS). La sobrevida global y la sobrevida libre de recurrencia al año y a los 3 años fue de 74,5%-55,2% y 68%-16,3%, respectivamente (Fig. 4).
Tabla 6


Figura 4
Discusión
Todavía hoy sigue vigente la controversia acerca de si es mejor un abordaje simultáneo o secuencial en el tratamiento del CCMHS. A partir de los años 90 aparecieron publicaciones que informaban una alta mortalidad para las resecciones simultáneas, desde un 7- 12% hasta un 24% si se asociaba a resecciones hepáticas mayores5. Se ha planteado si el abordaje simultáneo podría incrementar la dehiscencia de la anastomosis del colon por el edema intestinal que provoca la maniobra de Pringle, o por el aumento de la presión venosa mesentérica en una hepatectomía mayor. También se ha sugerido una posible morbilidad mayor por la contaminación y/o translocación bacteriana al lecho cruento de la hepatectomía, que predispone a la formación de colecciones intrabdominales6,7. Es por esto que se ha limitado la indicación del abordaje simultáneo en el CCMHS, aunque es ideal en pacientes ⤠65 años, en buena condición clínica (ASA ⤠3), con un tumor de colon con biología favorable (N1 y CEA ⤠200 ng/dL), que implique resecciones hepáticas limitadas (seccionectomía lateral izquierda, lesiones únicas periféricas), y preferentemente que no suponga una resección de recto o una resección de tumor primario complicado. En resumen, el abordaje simultáneo es actualmente recomendado para pacientes de bajo riesgo, fácilmente resecables8.
Sin embargo, existen claras ventajas del abordaje simultáneo; entre otras, evita dos procedimientos: reduce la masa tumoral mejorando de esta forma la respuesta de la quimioterapia, y disminuye las complicaciones y la estadía hospitalaria que conllevan duplicar intervenciones mediante laparotomías grandes o laparoscopias8. Uno de los inconvenientes de las publicaciones que analizan este tema es que no todas emplean la misma definición de âsincrónicoâ, y muchos de esos estudios comprenden un largo período de tiempo. Es sabido que, con el advenimiento de los nuevos esquemas quimioterápicos, ha cambiado la forma de abordar a estos pacientes. Estos dos limitantes, más la falta de estudios aleatorizados controlados, hacen que no tengamos evidencia respecto de cuál abordaje es el más conveniente. Una de las revisiones sistemáticas mejor realizadas es la de Baltatzis y col., que encontraron diferencias en morbimortalidad y sobrevida a 5 años en una serie de 1203 pacientes, donde 748 se trataron en forma secuencial operando primero el tumor de colon, 75 recibieron abordaje reverso y 380 se operaron en forma simultánea9. Tampoco el estudio de Kelly col. encontró diferencias en resultados a corto plazo y sobrevida revisando 18 publicaciones con un total de 3605 pacientes10.
La colectomía laparoscópica ha mostrado beneficios y equivalentes resultados a corto y largo plazo en el MRC CLASICC trial, COLOR trial, comparada con la del trial de Leung y col.11-13. A su vez, con respecto a las RHL en metástasis de cáncer colorrectal, el ensayo aleatorizado controlado Oslo-CoMet, así como el último Consenso de Marioka (Japón) en el año 2014, mostraron que las RHL en casos seleccionados son seguras, con iguales sobrevida libre de recurrencia y sobrevida global que el abordaje abierto14,15. A pesar de esto, hay pocas publicaciones sobre el abordaje laparoscópico simultáneo del CCMHS. Esta serie es la primera publicada en nuestro medio y tiene un número similar de casos operados en forma simultánea por laparoscopia realizados en otras publicaciones europeas unicéntricas16-19.
Nuestro estudio tiene el sesgo de abarcar un largo período, de casi 10 años, por lo que se incluyeron diferentes esquemas de tratamiento quimioterápicos. Solo 19% de la serie recibió neoadyuvancia, situación que en estos últimos años ha cambiado. También al ser incluidos pocos casos por año en un período largo, esto implicó una lenta curva de aprendizaje para el tipo de abordaje simultáneo. Como se puede ver en la figura 2, todas las conversiones a cirugía abierta de las RHL ocurrieron en la primera mitad de la experiencia, y en la segunda parte de la experiencia casi no se transfundió ningún paciente. Existen varias causas posibles que expliquen la lenta adopción de este abordaje durante 10 años. En la primera parte de la experiencia se fue muy selectivo para decidir el abordaje laparoscópico simultáneo, dado que se requería superar la curva de aprendizaje de las RHL antes de indicarlas en abordaje simultáneo. Sin embargo, el aumento de complejidad que implica combinar procedimientos en el abordaje simultáneo impone per se el inicio de una nueva curva de aprendizaje.
Por otro lado, en un centro con amplia experiencia en colectomías laparoscópicas, que ya ha superado ampliamente su curva de aprendizaje, surge la pregunta de si el abordaje simultáneo aumenta la incidencia de fugas anastomóticas y de colecciones intraabdominales. En nuestra serie tuvimos 3 dehiscencias de la anastomosis colónica (14%), para un Servicio de Coloproctología con una incidencia histórica de 7,79%. Pareciera ser más alta de lo habitual pero, al analizar series comparativas como la de Jung y col. (2014), se observa que hallaron 8,2% de dehiscencias tanto en abordajes simultáneos abiertos como en los laparoscópicos. Debe señalarse que, en ese estudio, todas las fugas anastomóticas requirieron reoperación, a diferencia de nuestra serie en la cual no fue necesaria excepto drenaje percutáneo o solo expectación. Creemos muy importante estratificar la gravedad de esta complicación para poder realizar comparaciones válidas. Del mismo modo, otros estudios como el de Tranchart y col. (2016) señalaron 5,5% de dehiscencias pero sin detallar su gravedad.
En lo referente a colecciones perihepáticas, fueron de 3 casos (14%), en el trabajo de Tranchart y col. de 4,5% y en el de Jung y col. 2 de 24 (8,3%). Esto se debe a que en la serie son pocos los casos, y una sola complicación de este tipo que se suma o resta cambia en forma significativa la incidencia.
Cuando comparamos esta serie con lo publicado en abordaje laparoscópico simultáneo en cáncer de colon y metástasis hepáticas, vemos que en nuestros casos hay pocas resecciones de recto y que muchos se operaron sin quimioterapia neoadyuvante (solo el 19%), a diferencia de otras series que en el 80 a 88% sí la recibieron. En casi todas las publicaciones se puede ver que fueron casos bien seleccionados: pocas lesiones, unilobares y chicas16-18, 20-22 (Tabla 7). En este estudio se incluyeron todos los pacientes con intención de tratamiento, lo que se refleja en la tasa de conversión. Si se compara con lo publicado, la series de Hatwell y col. y la de Huh y col. son procedimientos híbridos, por lo que no se puede saber cuál es el índice de conversión en esas series20, 22 (Tabla 8). Al constatar que todas las conversiones ocurrieron en la primera mitad de la serie, se postula que la elección de casos y superada la curva de aprendizaje esta técnica es factible, y se logra una disminución de las conversiones cuando se avanza con la experiencia.
Tabla 7

Tabla 8

En la serie de Berti y col. también se realizó el primer tiempo de una cirugía de remodelado hepático en simultáneo con la colectomía laparoscópica en 4 casos de 35 (11%). En nuestra serie tuvimos 4 casos (19%); si bien son pocos, pareciera factible realizar el primer tiempo laparoscópico, lo que tendría ventajas para el segundo procedimiento en cuanto a las adherencias y al menor traumatismo quirúrgico provocado por la laparoscopia en la primera cirugía.
Analizando los resultados oncológicos se puede ver que los estudios de Ferretti y col. y el de Berti y col. tienen un alto porcentaje de resecciones hepáticas R1 (7% y 17,14%), pero no es el caso de esta serie17, 18 (Tabla 9). Creemos que no se deben perjudicar los resultados oncológicos por el tipo de abordaje. En esta serie se convirtieron dos casos durante la fase de la resección hepática para lograr una resección R0, y dos por tamaño del tumor primario de colon por el riesgo de ruptura por manipular un tumor grande por laparoscopia.
Tabla 9

Si se analizan la morbilidad general y la morbilidad mayor, al igual que el promedio de estadía hospitalaria, no hubo diferencias con el resto de las series publicadas (Tabla 10).
Tabla 10

Conclusiones
- En casos bien seleccionados, el abordaje laparoscópico simultáneo es factible de realizar, y con bajo índice de conversiones a cirugía abierta una vez superada la curva de aprendizaje.
- En estos casos, tal abordaje presenta baja morbimortalidad, sin comprometer los resultados oncológicos.
- Si bien se evidencian algunas ventajas del abordaje simultáneo laparoscópico, se necesitan ensayos aleatorizados controlados, estratificando variables preoperatorias que permitan determinar cuáles son las indicaciones del abordaje simultáneo laparoscópico para el cáncer de colon con metástasis hepáticas.
Discusión en la Academia Argentina de Cirugía
Eduardo de Santibañes: Felicito al doctor Rafael Maurette y al equipo del Hospital Británico que han presentado este trabajo innovador indudablemente, ya que hace bastantes años que vienen trabajando en él y, bueno, cuando uno es innovador tiene que estar dispuesto a la resistencia y al fracaso, a veces, hasta que le encuentra bien el punto a la técnica que ha hecho. Nosotros, con el doctor Bonadeo, hace muchos años que comenzamos, en cirugía abierta, a utilizar la resección simultánea y en la primera serie de 71 casos que publicamos en el Journal of the American College of Surgeons tuvimos una sola dehiscencia de colon y ninguna muerte, y en la segunda serie que publicamos en el Word Journal of Surgery tuvimos tres muertes en hepatectomía mayor en las tres y más de 70 años los enfermos, o más de 65, y tuvimos dos dehiscencias solamente en 170 enfermos de la colectomía. Algo que me llama la atención, digamos, cuando en la serie el doctor Bonadeo comparó la dehiscencia de fístulas anastomóticas colónicas de la serie simultánea con la serie metacrónica: era menor la serie simultánea, con lo cual muy poquito pensamos que era un tema de números solamente.
Yo tengo algunas preguntas para hacerle, cuatro preguntas. Voy a empezar por la última porque me parece que hay un error en una diapositiva: usted dijo que no había tenido R0 en hígado y después dijo que no había tenido R1; me llamó la atención porque indudablemente lo que usted dijo está equivocado. El primer tema, la primera pregunta, se refiere a la quimioterapia: hoy en día el abordaje de un enfermo con enfermedad sincrónica se hace siempre luego de quimioterapia porque la enfermedad sincrónica es uno de los criterios de alta agresividad biológica del cáncer de colon. Quiero saber cuál es la conducta de ustedes y qué esquema de quimioterapia y durante cuánto tiempo, y cuál es la ventana en la cual ustedes deciden la cirugía. La segunda pregunta se refiere a los tumores de recto, medio y bajo: ¿Qué conducta adoptan y qué esquema de nueva adyuvancia usan? La tercera pregunta sería: ¿Qué procedimientos ustedes hacen antes? He escuchado esto y he discutido con algunos compañeros que empiezan por el hígado porque quieren terminar antes. Nosotros, con Bonadeo, siempre teníamos una regla y con Benati y con Ojea que hacemos siempre y ahora con Rossi y Vaccaro, hacíamos siempre primero el colon y se hacia el hígado si la cirugía de colon era R0; si no, no se seguía con la metástasis. Todo esto después lo fuimos cambiando, pero esa conducta la teníamos fundamentalmente porque si después teníamos que usar maniobra de Pringle y empezamos por el hígado y nosotros hacemos simultáneo prácticamente de rutina siempre, es excepcional que no hagamos abordaje simultáneo desde hace más de 20 años, no nos importa que esté en recto, que sea cirugía mayor, siempre va simultáneo, o sea se prepara el enfermo para que lo aborde el grupo de colon, de coloproctología y el grupo de hígado. Nosotros empezamos por colon y hacemos la anastomosis de colon porque el clampeo de Pringle edematiza, y hacer una anastomosis si uno empieza por hígado y tiene que clampear el pedículo sobre un intestino edematizado siempre pensamos que es un problema. La cuarta pregunta ây discúlpeme que le haga tantas preguntas al señor Presidenteâ está relacionada con la cirugía ahorradora de parénquima. Hoy en día, en el tratamiento de la metástasis, el 90% del abordaje en el hígado es cirugía ahorradora de parénquima. Yo estoy totalmente convencido de que en pocos años más el abordaje abierto va a ser algo inusual, va a ser para algunos casos excepcionales, pero todavía veo que hay dificultades en la metodología, a veces en la aparatología, y veo que los cirujanos laparocopistas prefieren hacer resecciones anatómicas en lugar de cirugía ahorradora de parénquima. Por ejemplo, hoy en día se sabe que el margen vascular despegar una metástasis de cualquier vaso suprahepático o pedículo portal tiene exactamente la misma supervivencia; no es así en el R0 y la misma recidiva que en el R0 en la era de la moderna quimioterapia, eso ya está demostrado. Entonces, si ustedes hacen cirugías ahorradoras de parénquima, porque veo que la mayoría de las lesiones que hicieron era una serie muy bien hecha, seleccionada, etcétera, o sea, ¿cómo hacen? Porque la gran dificultad, la gran desventaja, la única desventaja de la laparoscopia es que no tiene la palpación y la palpación en enfermos que han recibido quimioterapia muchas veces es más importante que la ecografía, porque hay metástasis que desaparecen en la ecografía pero que el cirujano las palpa. Y la cuarta cirugía, cuando ustedes hacen la resección quirúrgica, mandan el espécimen hepático para hacer una congelación para informar el margen por si tienen que ampliar el margen, y, si es así, en una lesión que ven que es muy muy cercana al pedículo vascular, ¿cómo hacen para ampliar el margen? Muchas gracias, doctor, y lo felicito por su trabajo.
Rafael J. Maurette: Muchas gracias, doctor De Santibañes. Es verdad: hay un error en la diapositiva, es que no tuvimos resecciones R1, todas las resecciones hepáticas fueron R0, perdón que no fue claro. En cuanto a la quimioterapia es un sesgo de este estudio; en un período de 10 años ante lesiones sincrónicas con una metástasis accesible íbamos directamente a cirugía; esto ha cambiado, en el medio pasamos también por el stent. Los stents se han abandonado y, si hoy en día en estos últimos 2-3 años, como usted dijo, es una enfermedad agresiva lo primero que se hace es quimioterapia y acá hacemos una quimioterapia corta, no más de 3 meses; revaluamos y entonces vemos; pero ese es el sesgo, no se pueden comparar las [resecciones] hechas en el año 2008 con las de 2018. En cuanto al recto y la neoadyuvancia, nosotros tuvimos tres rectos, los tres tuvieron neoadyuvancia; de hecho, no es el 100% de adyuvancia sino creo que es un 80 y pico por ciento, eran porque los rectos eran neoadyuvancia.
En cuanto a con qué procedimiento empezar, esto también lo fuimos variando. Al principio hacíamos lo mismo que usted: empezaba primero proctología y después nosotros; después nos dimos cuenta de que, a medida que aprendíamos y sobre todo aprendía el equipo de anestesia, como son procedimientos muy largos el miedo mío era que se llenara mucho de líquidos; entonces rotamos y empezamos nosotros (âno me dejes el hígado con mucho edemaâ, âdéjame empezar a míâ) y después empezaban ustedes la colectomía. Ahora volvimos para atrás o sea, hacer primero el colon y después el hígado, un poco por lo que usted manifestó, y eso se debió a los anestesiólogos pues ellos tienen un excelente manejo anestésico y los tiene muy secos, inotrópicos, con una resección hepática que no hay diferencia hacerla al principio de la cirugía o 7 horas después; por eso hemos variado. Contesto la última y después voy a la anterior. Con respecto al tema de la cirugía ahorradora de parénquima, creo que la hepatectomía laparoscópica tiene una limitante, que es el número. Uno no puede estar haciendo varias metastasectomías por laparoscopia por el simple hecho de que no puede andar poniendo más trocares o accediendo a lesiones difíciles. Hay una limitante, no hay duda. Sí vemos una clara ventaja en hacer un primer tiempo; nosotros tuvimos cuatro casos y un primer tiempo por ejemplo una seccionectomía lateral izquierda y una colectomía y después una seccionectomía posterior derecha; la verdad es que es muy beneficioso, pero la multiplicidad creo que es una limitante para el abordaje laparoscópico. El tema de no encontrar las lesiones: nosotros tenemos causas por conversión por no encontrar si lo ven ahí, y lo que nos ha ayudado a veces es poder hacerlo mano asistida de hecho convertimos a mano asistida también, pero fue de la mano con el crecimiento de la experiencia del uso del transductor laparoscópico. El transductor laparoscópico tiene una desventaja: es como una especie de limpiaparabrisas con el que uno va de derecha a izquierda barriendo en un sentido que no es el anatómico; entonces uno se marea con las estructuras e hicimos una curva de aprendizaje muy larga, entonces muchas veces hemos puesto la mano. En cuanto a los márgenes, nosotros cortamos el margen ni bien sacamos la pieza y hacemos los dos chequeos. Y respecto de la hepatectomía anatómica eso nos dijo el segundo Consenso, advirtió sobre eso, no ampliar las indicaciones de hepatectomías anatómicas por querer hacerlo por laparoscopia. No ha sido nuestro caso. Nosotros seleccionamos muy bien; si ustedes se fijan, eran una o dos lesiones casi al 80% de las lesiones de hígado, por eso tardamos tanto tiempo y también la curva de aprendizaje fue muy larga, porque âsi bien no hemos tenido muchos casosâ por ahí hubiéramos reducido, por ejemplo, la cantidad de transfusiones al principio. Muchas gracias.
Oscar C. Andriani: Quiero unirme a las felicitaciones por este trabajo. Realmente es un número de cirugías laparoscópicas de avanzada en hígado interesante, 80 casos de los cuales 21 fueron los que se presentaron en esta serie. La selección demuestra que debe ser restringida a casos muy especiales y cubre una parte de todo el espectro de cirugías para las metástasis hepáticas, un poco como mencionó el doctor De Santibañes; la cirugía ahorradora de parénquima que implica múltiples resecciones en distintas localizaciones está âpor lo menos en el momento actualâ limitada a la cirugía abierta, pero de todos modos quiero resaltar que es una muy buena experiencia y me alegro de que la hayan traído a la Academia. Mi pregunta es técnica: quería saber cómo se manejaban con la anastomosis del colon, si hacían una anastomosis intracorpórea o extracorpórea, si extraían en forma simultánea el hígado y el colon, o hacían la extracción del colon, cerraban la pared y volvían a hacer el neumoperitoneo. Y, por último, quería saber sobre la utilización de la maniobra de Pringle, si la usaban en forma sistemática para las resecciones no anatómicas, un poco más profundas. Gracias.
Rafael J. Maurette:Muchas gracias, doctor Andreani. Insisto en que creo que una de las limitantes de la hepatectomía laparoscópica es el número. Cuando aumenta el número, como mucho podemos hacer una cirugía secuencial, un primer tiempo y un segundo tiempo. Hemos sumado ablación por radiofrecuencia, no es lo ideal, pero para la multiplicidad de nódulos no hay como tener el lío en la mano e ir sacando nódulo por nódulo, o sea, tiene su limitante. En cuanto a la parte técnica de sacar la pieza, esto fue variando. Al principio empezaba la cirugía de la colectomía laparoscópica y después íbamos nosotros; entonces, lo que hacíamos era aprovechar la incisión, que es una incisión umbilical; por ahí a veces meter la mano; de hecho, el primer caso fue mano asistido y la pieza la íbamos sacandoâ¦, como ya lo teníamos abierto, sacábamos colectomía y la pieza de hepatectomía por el mismo sitio. Después eso fue variando; entonces, como empezábamos nosotros con el hígado, un poco nos poníamos de acuerdo con los proctólogos a ver dónde hacer la incisión y, de toda la serie no tuvimos ningún caso de sutura intracorpórea de la anastomosis colónica; todas fueron o usando las suturas a través del ano, o suturas mecánicas, pero en ninguna de las que se hacían extracorpóreas se sacaba la pieza afuera y se hacía la anastomosis. Y con respecto a Pringle, también al principio le teníamos mucho miedo; en esa época no se usaba mucho el Pringle en cirugía abierta, nosotros no queríamos violar esa premisa, y la verdad es que últimamente estamos usando Pringle casi en el 100% hasta incluso en una resección chiquita. Esto lo aprendimos en el Congreso que hubo el año pasado en París, donde casi todos los cirujanos hepáticos que hacen laparoscopia usan Pringle, así que eso es lo que ha cambiado en nuestra conducta al principio y al final. Muchas gracias.
Javier C. Lendoire: Es muy oportuno y de interés el estudio que el doctor Maurette y colaboradores traen al seno de esta Academia. Quiero agradecer al doctor Maurette por haberme facilitado el manuscrito, lo cual claramente beneficia la discusión y el análisis de algunos de sus puntos. Se analizan 21 pacientes tratados mediante resección sincrónica de tumor primario en metástasis hepáticas presuntivas y ahora voy a referir por qué presuntivas:, porque analizándolo detalladamente desde el punto de vista metodológico, uno debe considerar que no se deberían haber excluido, es decir, se deberían haber excluido del estudio, pero no solo del análisis de supervivencia sino de todas sus tablas en forma completa, los tres pacientes que resultaron ser portadores de hemangiomas y que, cuando analizamos y comparamos las distintas series, el número final es 21 pero en realidad, si vamos a la anatomía patológica, el número final es 18 incluyendo la anatomía patológica de la metástasis que no presentaba células viables; eso es solo metodológico. Por otro lado, el estudio demuestra claramente que los criterios de selección fueron claramente los apropiados y lo más importante es que muestra el valor de la curva de aprendizaje que los autores confirman y que con ella confirman el objetivo primario del estudio, que es la factibilidad y la seguridad con una morbilidad adecuada, si bien destacable en el primer período, no solo la morbilidad sino también los episodios de sangrado y el requerimiento de hemoderivados.
Mis preguntas (las preguntas iniciales fueron contestadas) fueron la del abordaje(¿cuál usan primero?) y la táctica de Pringle. Ahora merece un comentario especial el tema de la táctica de modulación que presentan. Doctor Maurette, quería preguntarle por qué los tres casos que presentó no son casos de modulación convencional. Hoy por hoy, la preservación del segmento 2/3 y uno podría decir que la piedra angular muchas veces para el cirujano de hígado en metástasis colorrectal termina siendo la preservación del segmento 2/3 porque es el que después nos va a salvar en la posibilidad de una cirugía en dos tiempos o una cirugía bien ampliada. La pregunta, también referida un poco a lo que manifestó el doctor De Santibañes, apunta a la necesidad de haber hecho una seccionectomía lateral izquierda: ¿No había factibilidad de hacer una resección no anatómica para preservar el segmento 2/3? Por otro lado, el segundo tiempo quirúrgico no fue una hepatectomía derecha sino una seccionectomía posterior derecha o una septectomía posterior, ante lo cual uno se pregunta si una resección 2/3 más una septectomía posterior no se pueden hacer en un tiempo. Entiendo que por vía laparoscópica no; ustedes hicieron dos tiempos quirúrgicos porque era necesario para poder hacer un primer tiempo durante la laparoscopia. Esta es solo una consideración para tener en cuenta y para que usted lo pueda aclarar. El tercer punto se refiere al mini- ALPPS que realizaron. Realizaron mini-ALPPS en un paciente al que primero le hicieron una resección del segmento 6, una resección del segmento 4B y una radiofrecuencia del segmento 4A. Cortaron la línea de Cantlie y posteriormente extirparon el lóbulo izquierdo en un segundo tiempo; entonces, no es un mini-ALPPS convencional, no es una técnica convencional en este caso porque al final lo que terminaron extirpando era el segmento 6 y el lóbulo izquierdo. La pregunta es, pues, cuál fue la causa de ello. Nada más que para aclararlo. Por último, referido a la supervivencia, su supervivencia global fue de alrededor del 55% y una supervivencia libre de enfermedad del 16% a los tres años. Considerando, pues, que son metástasis únicas, lógicamente la cirugía sincrónica influye mucho, le quería preguntar si analizaron los indicios por los cuales la supervivencia libre de enfermedad fue del 16%, que uno diría un poco baja comparativamente por ahí con otras series. Lo felicito por el estudio y le agradezco nuevamente. Y algo que quiero destacar son los centros como esos en los cuales usted trabaja, multidisciplinarios, y la relación que usted mantiene entre el equipo de cirugía de HPB y el equipo de colon con los cuales claramente se pueden implementar estas técnicas innovadoras, como se refirió previamente. Lo felicito.
Rafael J. Maurette: Muchas gracias, doctor Lendoire. Primero le voy a responder en lo referente a los 21 versus 17. En realidad, con 21 lo que queríamos ver âporque al fin y al cabo fueron dos procedimientosâ fue colectomía y metastasectomía independientemente de que haya sido un hemangioma, si eso le agrego por haberlo hecho a la vez más morbilidad o sea analizamos resultados a corto plazo en los 21. Y en los 17, si bien uno tuvo respuesta completa porque hay fibrosis pero yo creo que ahí sí se puede hacer análisis a largo plazo, eso fue lo que nosotros consideramos. Con respecto a la segunda pregunta, si me permite, puedo pasar; este es un paciente de 40 años con esas dos grandes metástasis que ustedes pueden ver. Íl recibió 8 meses de tratamiento quimioterápico y las lesiones se achicaron y lo que nosotros hicimos fue, en un primer tiempo, la seccionectomía lateral izquierda por laparoscopia más la colectomía laparoscópica y, en un segundo tiempo, por laparoscopia completamos la seccionectomía posterior derecha. Hizo una complicación que es esta colección, pero âfíjeseâ pudimos dejar el hígado residual sin enfermedad. Entonces tuvimos otro caso parecido que está en el trabajo, que era una seccionectomía lateral izquierda de una lesión grande que tenía dos metástasis. Lo que pasa es que, en el intervalo, hizo quimioterapia y tardó 6 meses el segundo tiempo, que fue por cirugía convencional. En cuanto al mini-ALPPS, es verdad; después aprendimos que no fue un verdadero mini-ALPPS, primero porque la transección no la hicimos completa, o sea, está descripta que tiene que llegar hasta la suprahepática media y nosotros no profundizamos tanto, de hecho, no hipertrofió tanto. Es verdad que se podría haber hecho una resección tal vez simultánea, pero nosotros somos muy cautelosos ante las hepatectomías mayores con colectomías y lo seguro en nuestro protocolo es no hepatectomías mayores con resección de recto; la cirugía de recto tiene morbilidad y creemos que no es una buena indicación como está publicado también en la literatura, y creo que respondí.
Rodrigo Sánchez Claria: Felicitar a los autores también por el trabajo y al doctor Maurette. La verdad es que es una serie importante y, si uno busca en la literatura, no hay muchas series publicadas con resecciones simultáneas laparoscópicas de colon y de hígado, por lo cual cabe felicitar realmente por el trabajo. Las preguntas giran un poco alrededor de los temas que ya se hablaron. La primera pregunta se refiere a la cirugía preservadora de parénquima. El doctor Maurette comentó acerca de la limitación con respecto a la multiplicidad de las lesiones y muchas veces para nosotros en el hospital, aparte de la multiplicidad de las lesiones, es la ubicación de las lesiones; con respecto a las lesiones superiores y posteriores, muchas veces es más fácil hacer cirugía anatómica que hacer cirugía no anatómica y claramente esta cirugía anatómica que vamos a hacer va en contramano de la cirugía preservadora de parénquima, eso con respecto a los segmentos posteriores y superiores derechos. Con respecto al segmento lateral, como comentó el doctor Lendoire, muchas veces uno se tienta porque âdesde el punto de vista técnicoâ es muy sencillo, muy accesible, hacer una seccionectomía lateral izquierda y de esa manera sacrificamos todo el segmento lateral izquierdo que posiblemente, a ese paciente que tiene altas chances de recurrir, ese segmento le puede llegar a cambiar el devenir oncológico; con lo cual la pregunta mía no se refiere solo la multiplicidad sino a si encontraron algún tipo de limitante con respecto a la ubicación de las lesiones, teniendo en cuenta esto de cirugía anatómica versus no anatómica y la dificultad de hacerla. La segunda pregunta es con respecto a la quimioterapia: la mayoría de estos pacientes son pacientes con cáncer de colon y metástasis, o sea, pacientes en estadio 4. En nuestro hospital, la gran mayoría de estos pacientes âel 100% de estos pacientesâ van a recibir quimio perioperatoria, y muchas veces en cirugía laparoscópica la transección es el factor más condicionante de sangrado. Y ya sabemos que los hígados con quimioterapia, en general, tienden a sangrar más, así que ¿cuál fue la experiencia de ustedes con respecto a la transección y el sangrado en aquellos pacientes que recibieron quimio perioperatoria? La tercera pregunta se relaciona con la ecografía intraopetaroria. Me llamó la atención que no se mencionara en el trabajo su utilidad. Uno, en cirugía laparoscópica, no tiene tacto razón por la cual acá la ecografía es fundamental para ubicar las lesiones y para saber si uno va a salir con un buen margen de resección. Eso es todo.
Rafael J. Maurette: Muchas gracias, doctor Sánchez Claria. Respondo la última: no lo dije antes porque se presupone, o sea, no se puede hacer hepatectomía laparoscópica sin transductor laparoscópico en la mano adentro. Lo que nos costó fue aprender pero lo usamos desde el principio; creo que alguien que quiera hacer hepactetomía laparoscópica lo que tiene que hacer es comprarse el transductor y después hacerla, pero no hacerla sin transductor, eso seguro. En cuanto a la ubicación y la multiplicidad, nosotros tenemos criterios de exclusión bien claros, o sea, si están cabalgando sobre el pedículo portal, si están cerca de las desembocaduras de las suprahepáticas o muy cerca de la vena cava con temor de que esté invadida; esos son criterios que nosotros ni siquiera cuando son metacrónicos los abordamos por laparoscopia. Sí hemos abordado lesiones altas; beneficia un montón el decúbito lateral, como se ve en el video, y la ventaja mayor que tiene la laparoscopia es una sumatoria de cosas: un buen manejo anestésico con poco líquido, una posición con una retención de líquido que hace que no sangre supra hepática; después el neumoperitoneo, por el hecho de tener neumoperitoneo ya sangran menos y esto está demostrado en los trabajos, pero no quiere decir que se le pueda hacer a todo el mundo; yo coincido en que hay lesiones que no se pueden hacer. El año pasado trajimos a la Academia una segmentectomía D7 y D8, donde sacamos la suprahepática media con parte de la media; creo que era que salió muy bien por laparoscopia pero en casos metacrónicos. Nunca se nos ocurriría hacerlo en simultáneo; simultáneo es una cirugía muy larga que tiene morbilidad y no nos pareció una buena indicación. Y en cuanto a la quimioterapia varió al principio, insisto, solamente un 13% creo que tuvieron neoadyuvancia, que fueron principalmente los rectos, o sea, que en casi todos a los casos que operamos fue sin quimioterapia. Pero ahora, como en este caso que mostré, están con mucha quimioterapia encima, y este caso que mostré creo que es un buen ejemplo de cómo en la seccionectomía lateral izquierda âcuando es grande el tumorâ no se puede preservar ese segmento lateral izquierdo; entonces, una resección para que quede después un segundo paso de alguna otra cosa del lado derecho no nos parece buena. De hecho, en los dos casos que tuvimos, fueron factibles preservando parénquima. Si ves que la lesión es grande no hay forma de preservar parénquima en ese segmento lateral izquierdo.
Pablo J. Sisco: Bueno, realmente felicito al doctor Maurette. En primer lugar por la honestidad de presentar todo y no esconder nada y, después, por los progresos que va haciendo y va demostrando en esta Academia. Dos preguntas muy simples para hacerle: en primer lugar si a aquellos enfermos a los que les hicieron tratamiento oncológico y en quienes progresó la enfermedad los incluyeron para cirugía, y, en segundo lugar, si no crees que este (todo el mundo acá, Eduardo De Santibañes y alguien más comentó la falta de la palpación) es el problema que nos impide muchas veces detectar lesiones y el manejo a veces complejo de la ecografía intraoperatoria. ¿No te parece que los estudios de realidad virtual que se imponen ahora, que están viniendo con la fusión de imágenes de ecografías, tomografía y visualización de todos los vasos a través de sistemas dinámicos angiográficos, van a hacer que esta cirugía se imponga definitivamente, como dijo antes De Santibañes que está totalmente de lado de la cirugía abierta?
Rafael J. Maurette: Muchas gracias, doctor Sisco. Con respecto a la primera pregunta sobre progresión, vuelvo a repetir: la mayoría de estos enfermos fueron a cirugía sin quimioterapia, o sea, por eso fue una selección tan estricta. Uno o dos nódulos simultáneos. Pero sí contestando la pregunta del doctor Lendoire, no nos fue bien en cuanto a la zona libre de recurrencia si uno mira al no haber seleccionado con quimioterapia a qué pacientes les iba a ir bien; incluimos pacientes de alto riesgo oncológico, muchos T3, muchos T4, N1 y esos son los pacientes que anduvieron mal. Por eso el 16% un poco responde a por qué la recurrencia no fue alta. Y en cuanto a la falta de palpación manual, una de las cosas que hacemos es revisar bien las imágenes, no solamente la tomografía sino también la resonancia con difusión, y tratamos de hacer un esquema y marcar bien dónde están, dónde estaban y dónde están, dónde estaban antes de la quimio (en este caso no) y dónde están para ir a buscarlas. Eso facilita mucho la ecografía dirigida porque cambiamos de posición el transductor, lo ponemos en una incidencia que nos favorezca y la buscamos y se ven lesiones muy chicas; paso rápido pero hay un esquema de un quiste con una lesión que mide 1 centímetro y usamos reparos, la suprahepática, los quistes y vamos buscándola hasta encontrarla. Pero sí, a veces no la encontramos y tenemos que poner la mano; la mano yo creo que sí hay que usarla, hay que usarla y, si hay que convertir, hay que convertir. Nosotros siempre les decimos a los pacientes que, si no es un procedimiento seguro para la vida del paciente y si no es un procedimiento seguro oncológicamente, no se va hacer por laparoscopia; se puede empezar y, al momento en que esa premisa no se cumple, se convierte a cirugía abierta. Pero sí, la mano se puede poner.
Oscar M. Mazza: Primero, me sumo a las felicitaciones por el trabajo, por traerlo a la Academia. Yo le voy a preguntar sobre la estrategia de manejo porque creo que es algo que compartimos en esta institución. El abordaje, en lo posible simultáneo y en lo posible laparoscópico. Pero yo quería ir un poquito más a la concepción del trabajo y de ahí algunas preguntas que me quedaron pendientes. Usted empieza diciendo que no ha sido posible, hasta ahora, encontrar un ensayo prospectivo aleatorizado que avale alguna postura; yo creo que ese ensayo prospectivo nunca va a existir; va a ser muy difícil hoy en día, con centros experimentados en cirugía colónica y hepática, por lo menos hacer este tipo de resecciones menores en forma abierta. Sería muy difícil de justificar en la práctica cotidiana y ante el paciente mismo que voy a hacer abierto algo que yo sé que técnicamente es viable. Pero usted parte de una premisa bastante ambiciosa que es la hipótesis nula del trabajo que dice tratar de demostrar: que el abordaje simultáneo laparoscópico y hepático es peor que el abordaje abierto. Uno busca descartar esa hipótesis nula y son muy difíciles de contestar contra el trabajo que es una serie de pacientes; entonces, la primera pregunta es cuántos pacientes similares a los que operaron en la institución durante este período laparoscópico fueron operados a cielo abierto quizá por selección natural del grupo tratante y por una elección del tratamiento porque quizás esa población puede servir para hacer un estudio o caso control. En nuestra institución, el abordaje laparoscópico es similar al abordaje abierto y es igual de seguro; de ahí que podemos descartar la hipótesis nula porque llama la atención que, entre sus conclusiones, usted dice que el abordaje es seguro pero muestra un 14,5-15% de dehiscencia anastomótica contra un 7,9% histórico. Ese 7,9% histórico ¿es en cirugía colónica sola o es en cirugía colónica simultánea con recto a cielo abierto? Y la tercera pregunta ya prácticamente existencial es, si luego de ese 14% de dehiscencias, ustedes han cambiado en la práctica asistencial a la conducta ejemplo en estos casos de proteger las anastomosis.Rafael J. Maurette: Muchas gracias, doctor Mazza. Nos hubiera gustado, y de hecho vamos a llevar al Congreso Argentino de Cirugía un trabajo que sea sincrónico, abordarlo simultáneo por laparoscopia versus sincrónico abordado en forma secuencial. Tenemos algunos casos abordados por laparoscopia, la decisión de hacerlo por laparoscopia. Las colectomías en general es un servicio con mucha experiencia en colectomía laparoscópica, por lo cual casi siempre empiezan por vía laparoscópica. En lo que respecta al hígado, sí es una resección difícil que implica una hepatectomía mayor; por ahí empiezan ellos y después nosotros nos ponemos cómodos con la incisión subcostal y nos ha pasado también abordar directamente abierto, por ejemplo, en todo lo que es lado derecho que es muy simple con una misma incisión de colectomía derecha más hepatectomía, pero no es el número exacto; de abiertas no lo sé, de secuencial laparoscópico âsi Dios quiereâ en el Congreso lo vamos a presentar, que tampoco son muchos. Coincido un 100%; es muy difícil hacer un trabajo prospectivo randomizado. En este momento hay dos finalizados con resultados publicados que son el ORANGE y el OSLO-COMET. En los dos no encontraron diferencias entre ambos tipos de abordaje; pero todos sabemos que las biologías son muy distintas en cada paciente. Hay pacientes que por ahí tienen un tumor más agresivo, más diferenciado, N1, o tienen algún K-RAS mutado o no mutado. Va un poco más allá de lo anatómico, de una lesión sola o de un tumor no complicado; entonces creo que es muy difícil hacer un estudio aleatorizado o bien hecho, pero bueno se tendría que intentar. Y con respecto a las dehiscencias de las anastomosis, este trabajo, como lo dije, tiene un sesgo que es bajo número y mucho tiempo. Un caso que se saca y ya el porcentaje cambia; de las tres dehiscencias que tuvimos, una sola se resolvió con conducta expectante y dos requirieron drenaje percutáneo. De esas tres, dos fueron rectos; por eso somos tan temerosos con el recto, pero si sacamos una ya el porcentaje baja a casi al 7%; entonces es muy difícil. Sí, nos lo preguntamos, sí nos preguntamos si solo aumenta la dehiscencia o también aumentan las colecciones perihepáticas. En esas dos reconstrucciones de tránsito también tuvimos una colección; entonces no estamos preguntando si realmente. Así que no tenemos respuesta para eso.
Emilio G. Quiñonez: Felicito en primer lugar al doctor Maurette por la presentación del trabajo y además agradezco la referencia en el envío del material para su lectura previa. Creo que, más allá de la vía de abordaje, uno debe estar convencido de que el tratamiento simultáneo es de elección, si bien hace 15 años que en el trabajo publicado por el Hospital Italiano en el American Journal of College en el año 2002 hay una parte no menor de los coloproctólogos y los cirujanos hepáticos. Por supuesto, en nuestro caso, todavía duda de este tipo de procedimientos; por un problema de formación absolutamente estamos convencidos de que esta es una muy buena forma de abordaje; por eso âperdón por el procedimientoâ veo que el abordaje es una cosa muy interesante para discutir y me parece muy saludable que lo hayan traído a esta Academia, pero creo que lo que hay que pensar primero es la estrategia antes que la simultaneidad. Desafortunadamente después, más allá de lo que uno crea, creo que uno tiene que adaptarse al medio donde trabaja; el nuestro es un hospital de alta complejidad pero de derivación, por lo cual probablemente no lleguen más pacientes donde el primario ya fue tratado y no podemos hacer âcomo nos gustaríaâ la simultaneidad de este tipo de patología. Dos preguntas básicamente, la primera: de la lectura del trabajo surge que la media de internación es de 8 días, cosa que es bastante similar cuando uno compara, por ejemplo, con un grupo como los nuestros donde la cirugía abierta tiene tiempos de internación similares. Quiero preguntarle si ustedes pudieron, si bien no son grupos comparables en su experiencia, si estos tiempos son prolongados, si ustedes creen que se puede mejorar o están en relación con algún aspecto que por supuesto no surge del trabajo. El segundo punto se lo dejo como tema de reflexión: en un momento en el que todos estamos discutiendo la costo-efectividad, los costos tanto en la salud pública como privada, quiero preguntarle si usted notó o tiene la sensación de que, independientemente de las ventajas desde el punto de vista médico y médico-asistencial, en el abordaje laparoscópico los costos van a ser mayores, y uno deberá discutir en un tiempo no muy lejano si esos costos justifican este tipo de abordaje. Por supuesto desde lo personal y desde la unidad donde yo trabajo, claramente tiene ventajas, pero quiero preguntarle si ustedes ya lo han notado. Muchas gracias.
Rafael J. Maurette: Muchas gracias, doctor Quiñonez. Yo coincido un poco con lo que dijo el doctor De Santibañes al principio: esto está cambiando y va a seguir cambiando. Ya, hoy en día, la oncóloga nos pide: No lo operes, déjame hacer tres ciclos de quimio, ver cómo respondeâ. Incluso en lesiones que son accesibles, porque eso selecciona la agresividad del tumor, la biología, y no va a pasar lo que nos pasó, que tenemos 16% de recurrencia y hoy en día casi todos los pacientes hacen tres meses de quimioterapia, salvo que sea una lesión muy muy chica. Si en el medio se complica el tumor, no ponemos stent, se reseca; eso también cambió. Hace dos años se ponían stents a todos; es evolutivo y yo no sé si la indicación del abordaje simultáneo va a ser el mismo de acá a 3-4 años; por ahí cambia con estos tratamientos dirigidos, pero si se puede y es seguro es lo que dije al principio de la discusión: es preferible una cirugía y no dos, disminuye las morbilidades, la estadía hospitalaria, reduce la masa tumoral. Pero no sé si va a ser así en el futuro. En los 8 días de internación tuvimos una perforación duodenal, fue en uno de los primeros casos y fue por continuidad de la aguja radiofrecuencia que lesionó el duodeno y el paciente estuvo como 42 días internado. En 21 pacientes, 42 días tira todo hacia la izquierda, hacia prolongar las estadías, pero es verdad que tampoco son 2 días; el promedio, sacando ese caso, deben ser 5 días. Yo insisto en que es una cirugía larga y compleja y que tiene su morbilidad tanto la abierta como la laparoscópica, incluso si las comparamos con las series ya publicadas en Europa, así que no se puede reducir esa cantidad de días. Y en lo referente a los costos, como todo lo que es laparoscopia, tiene más costos, pero en algún momento se beneficia con la disminución de la estadía, que en nuestro caso todavía no; en algunos pacientes sí y en otros no.
ENGLISH VERSION
Introduction
According to population-based studies, colorectal cancer with synchronous liver metastases (CLM) occurs in 15-30% of patients at the time of diagnosis1,2. Complete resection of the primary tumor with the synchronous liver metastases is the only option for long-term survival. There are three different surgical approaches for the management of patients with CLM: sequential surgery, reverse surgery and simultaneous surgery. Sequential surgery consists in the resection of the primary tumor of the colon followed by the liver metastases. In the reverse strategy, resection of the CLM is performed first, followed by resection of the primary tumor. Finally, the simultaneous approach implies resection of the primary tumor and the CLM in the same intervention. The results of many observational studies, systematic reviews and meta-analyses previously published demonstrated that simultaneous resection was not realated with greater morbidity and mortality, even when associated with major liver resections3. This has been corroborated by the multicenter study by Mayo et al., among others, who found no differences between the simultaneous and sequential approach4.
Laparoscopic surgery of the colon and some indications of laparoscopic liver resections (LLR) are accepted as current practices. However, the simultaneous surgery of the colon tumor and liver metastases by laparoscopy is still under investigation5. The simultaneous approach has been evaluated in many case series, multicenter trials and systematic reviews12-21; yet, so far, this strategy has not been analyzed in randomized controlled trials or in any type of study in our country.
The primary outcome of the present study is to evaluate if the simultaneous laparoscopic resection of the primary colon tumor and liver metastases is feasible and safe. The secondary outcome is to report the long-term results.
Material and methods
The Hepato-Pancreato-Biliary Surgery and Colon and Rectal Surgery sections of the Hospital Británico of Buenos Aires conducted a retrospective study using the information retrieved from a prospective database of patients with suspected CLM who were scheduled for laparoscopic resection of the primary tumor of the colon and liver metastases. All the patients consecutively operated on between August 2008 and May 2018 were included.
The selection of patients for the laparoscopic approach was decided by the attending physicians, as no criteria have been established yet.
When at least a relevant part of the procedure had been performed through laparoscopy, the case was defined as âlaparoscopicâ. Laparoscopic liver resection was considered when complete liver mobilization, pedicle ligation or part of the transection were performed with this approach. In case of conversion to open surgery after exploratory laparoscopy or due to the findings of translaparoscopic intraoperative ultrasonography, and before performing the steps previously mentioned, the cases were not considered laparoscopic.
Complicated primary tumors of the colon, those with adhesions to adjacent structures, or liver nodules > 10 cm, close to the vena cava or involving the main hepatic pedicle or the confluence of the hepatic veins were excluded from the laparoscopic approach.
The following variables were analyzed:
1) Preoperative variables: demographic data; diagnosis; location, number and size of the largest liver lesion according to imaging tests; location of primary tumor of the colon, CEA and CA 19-9, and neoadjuvant chemotherapy.
2) Intraoperative variables and short-term outcomes: procedures performed on the liver; procedure performed on the primary tumor of the colon; intraoperative adverse events according to the Oslo classification; hepatic pedicle clamping; number of patients with requirement of transfusion; total operative time, and duration of liver resection and colon resection; and conversion to hand-assisted laparoscopy or to conventional surgery. Other outcomes were also considered: hospital length of stay, overall morbidity rate according to the Dindo-Clavien classification, specific complications from liver or colon resection, major complications defined as ⥠grade 3b and 90-day mortality22,23.
3) Pathological variables: TNM classification of the primary tumor, tumor grade, surgical margins, size and number of the lesions resected, resection margins after resection of the colon and liver lesions defined as R0 and R1.
4) Long-term outcomes: adjuvant chemotherapy, site of recurrence, relapse-free survival and overall survival.
Statistical analysis
Continuous variables are expressed as mean ± standard deviation (SD) or median and range. Survival curves were estimated using the Kaplan- Meier method. All the calculations were performed using IBM SPSS Statistics 20.0 software package.
Figure 3 Figure 4
Results
A total of 89 LLRs were performed during the study period. In 28 patients LLR was simultaneous with other procedures, 21 of which corresponded to colorectal cancer and were included in the present analysis (Fig. 1). Table 1 shows the clinical and demographic variables. Most patients had low surgical risk (only three patients with an ASA grade 3) and few lesions (62%: one lesion, and 24%: two lesions), with a median diameter of 20 mm (7-88). Most liver lesions were located in a single lobe (71.4%). Intraoperative variables are summarized in Tables 2 and 3. Three laparoscopic rectal resections were performed; most of the liver surgeries were non-anatomic resections (71%). Of the anatomic LLRs, three left lateral hepatic sectionectomies and three segmentectomies (segment VI) were performed. Three patients underwent the first stage of a hepatectomy for hepatic remodeling in the simultaneous surgical procedure. This first stage consisted of right portal vein ligation plus metastasectomy of the tumor in the segments II, III and IVa in one patient and left lateral sectionectomy + metastasectomies in the other two. The first stage of a mini-ALPPS (left portal vein ligation, plus metastasectomy in segment VI, segment IVb, radiofrequency ablation (RFA) of the lesion in segment IVa, plus partial transection along the Cantlieâs line) was also performed. Of the three cases of staged hepatectomy for hepatic remodeling, the second stage was not performed in one patient due to failure of hypertrophy of the future liver remnant. The second patient received chemotherapy and the resection was completed by conventional surgery 120 days after the first surgery. Finally, the third patient underwent laparoscopic right posterior sectionectomy one month after the first procedure. In the patient who underwent mini-ALPPS, the left hepatectomy was completed by laparoscopy 16 days after the first surgery. Only in two cases the procedure was hand-assisted and colon resection was the first procedure in 62% of the patients. Nine cases required conversion to open surgery (Fig. 2); five (23.8%) of these conversions occurred during LLR and four (19%) during colon resection. The reasons for conversions during LLR were bleeding (n = 2), to ensure R0 resection (n = 2) and failure to find the lesion (n = 1). Conversion to open surgery during laparoscopic colon resection were tumor size (n = 2), colon perforation (n = 1) and failure to find the tumor (n = 1). The five conversions during LLR occurred during the initial stage of the experience, while there were no conversions during the second half of the series. Only one conversion was an emergency due to bleeding during liver resection. This complication corresponded to a grade 1 intraoperative adverse event of the Oslo classification as the hemorrhage was < 1000 mL.

Figure 1
Table 1

Table 2

Table 3


Figure 2
The Pringle maneuver was used in 66% of the patients. Mean surgical time for both procedures was 407 minutes (240-845). Nine patients required transfusion in the perioperative period (Fig. 3), eight of them during the first half of the experience. Two of these patients required > two units of packed red blood cells, one due to perforation of the duodenum and another due to bleeding that was the reason for conversion.

Figure 3
Mean hospital length of stay was 8 days (range: 3-49). None of the patients died and overall morbidity rate was 71% with only one major complication (grade 4, perforation of the duodenum). The complications are detailed in Tables 4 and 5. Three patients presented anastomotic dehiscence, two of which required percutaneous drainage and one resolved after expectant management. The specific complications associated with liver resection included three perihepatic fluid collections requiring percutaneous drainage and one Type A bile leakage. Five complications grade 3a occurred: three perihepatic fluid collections and two fluid collections due to anastomotic dehiscence; all the cases were solved after placing an abdominal drain under local anesthesia. One patient developed a complication grade 4 during metastasectomy plus RFA of a lesion in segment V, when the radiofrequency needle was placed against the anterior surface of the liver and inadvertently burnt the second part of the duodenum, provoking duodenal perforation in the postoperative period which required multiple reoperations.
Table 4
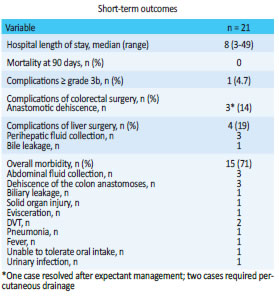
Table 5

According to the TNM classification, 88% of the tumors corresponded to T3 and T4 categories and 70% had positive lymph nodes (Table 6). Most patients received adjuvant chemotherapy (88%). Twelve patients (70%) relapsed with metastases in the liver (seven patients), lung (two patients), local lymph nodes (two patients) and one patient relapsed with metastases in more than one site. Liver recurrences occurred after a mean interval of 11.5 months (range: 1.5-22.5 months). The patient who relapsed after a month and a half was the one who was converted during liver resection to ensure an R0 resection. Probably, there was a small lesion that was not detected by preoperative imaging tests and during surgery. It was possible to perform an R0 resection of the known lesion, but this 36 year-old male patient with a pT4N2M1 tumor without neoadjuvant therapy had a biologically aggressive disease, and presented pulmonary metastases five months after the liver relapse. In the seven patients with liver relapse, the site of liver metastases was different from that of the first resection, and three of these patients had undergone two-stage hepatectomy (two cases of liver remodeling and one mini-ALPPS). Overall survival and relapse-free survival at one and three years was 74.5% and 55.2%, respectively, and 68% and 16.3%, respectively (Fig. 4).
Table 6


Figure 4
Discussion
The management of patients with CLM using a simultaneous or sequential approach remains controversial. Since the â90s, many publications have reported high mortality rates for simultaneous resections, ranging from 7-12% to 24% in case of with major liver resections5. The simultaneous approach has been associated with higher risk of anastomotic dehiscence due to bowel congestion produced by the Pringle maneuver or to elevated mesenteric venous pressure during major liver resection. Contamination or bacterial translocation in liver resection has been reported as a risk factor for intrabdominal fluid collections6,7. Therefore, the indication for simultaneous approach in the CLM has been restricted to patients ⤠65 years, in good clinical condition (ASA grade ⤠3), with a colon tumor with favorable biology (N1 node status and CEA ⤠200 ng/dL), limited liver resections (left lateral sectionectomy or single peripheral lesions), and uncomplicated primary colon cancer rather than rectal cancer. In summary, the simultaneous approach is currently recommended for low risk patients with easily resectable tumors8.
However, the simultaneous approach has clear advantages; avoidance of an additional surgical procedure, reduction in tumor mass, better response to chemotherapy, lower rate of complications and shorter hospital length of stay, with no need of additional major surgical interventions or laparoscopies8. One of the drawbacks of the publications analyzing this matter is that the definition of âsynchronousâ is not the same for all the studies, and many of them cover a long period of time. It is well known that the advent of the new chemotherapy treatment schemes has changed the management of these patients. These two limiting factors plus the lack of randomized controlled trials, result in the lack of evidence to determine the most appropriate approach. Baltatzis et al. published One of the most accurate systematic reviews and found no differences in morbidity and mortality and 5-year survival in a series of 1203 patients, of which 748 patients received colon-first surgery, 75 liver-first surgery and 380 simultaneous surgery9. Kelly et al. performed a review of 18 publications including 3605 patients and did not find differences in short-term outcomes and survival10.
Laparoscopic colectomy has shown similar benefits and short- and long-term results in the MRC CLASICC trial and in the COLOR trial, compared to those reported by Leung et al11-13. As for LHR in colorectal cancer metastases, the randomized controlled trial Oslo- CoMet and the consensus conference held in Morioka, Japan, in 2014 showed that LHR in selected cases is a safe approach, with relapse-free survival and overall survival similar to the open approach14,15. Nevertheless, there are few publications about the simultaneous laparoscopic approach for CLM. This is the first series published in our country and the number of cases operated on by laparoscopy using the simultaneous approach is similar to that of other single-center reports from Europe16-19.
Our study is biased as it covers a long period of almost 10 years and, thus, different chemotherapy treatment schemes have been included. Only 19% of the patients received neoadjuvant therapy, a situation that has changed over the past years. Also, the fact that few cases were included per year over a long period implied a slow learning curve for the simultaneous approach. All the conversions of LHR to open surgery occurred during the first half of the experience and almost none of the patients required transfusion during the second half (Fig. 2). Several possible causes explain the slow implementation of this approach over a 10-year period. In the first half of the experience, we were very exigent at the moment of deciding when to use the simultaneous laparoscopic approach, since it was necessary to complete the learning curve for LLR before indicating the simultaneous approach. However, the higher complexity of combining procedures in the simultaneous approach requires a new learning curve per se.
At the same time, the question is if the simultaneous approach increases the incidence of anastomotic leaks and intra-abdominal fluid collections in an experienced center that has already completed its learning curve in laparoscopic colon resections. In our series, three patients (14%) presented dehiscence of the colorectal anastomoses when the historical rate in our team of colon and rectal surgery is 7.79%. This percentage seems to be higher than usual, but when we analyze the comparative series like the one by Jung et al. (2014), we observe that 8.2% of the dehiscences occurred when the simultaneous approach was used both in open surgery and laparoscopic surgery. In that study, all the anastomotic leaks required reoperation. In our series, this complication required only percutaneous drainage or expectant management. We believe that the severity of this complication should be stratified to make valid comparisons. In the same way, other studies, such as that of Tranchart et al. (2016), reported 5.5% of dehiscences but without specifying their severity.
Three (14%) perihepatic fluid collections occurred, compared with 4.5% in the study by Tranchart et al. and 8.3% (2/24) in the publication by Jung et al. This is due to the low number of cases in the series, and the occurrence of only one complication can significantly change the result.
When we compare this series with previous publications on the simultaneous laparoscopic approach for colon cancer and hepatic metastases, we find few rectal resections in our cases, and only 19% of the cases underwent surgery and neoadjuvant chemotherapy, in contrast to the 80-88% reported by other series. Almost all the publications included well selected cases: few, unilobar and small lesions16-18, 20-22 (Table 7). All the patients allocated to treatment were included in this study, which is reflected in the conversion rate. Compared to previous publications, the series by Hatwell et al. and by Huh et al. are hybrid procedures so the real rate of conversion cannot be estimated20, 22 (Table 8). Since all the conversions occurred in the first half of the experience, and once the learning curve was completed the rate of conversions decreased, this technique may be considered a feasible approach.
Table 7

Table 8

Berti et al. also performed simultaneous laparoscopic colon resection and the first stage of staged hepatectomy for hepatic remodeling in four of 35 cases (11%). In our series, this strategy was used in only four cases (19%), and performing the first stage by laparoscopy has the advantage of reducing adhesions and surgical trauma for the second surgery.
In the oncologic analysis, Ferretti et al. and Berti et al. reported a high percentage of R1 liver resections (7% and 17.14%, respectively), compared to this series17,18 (Table 9). We believe that the oncologic results should not be affected by the approach. In this series, conversion was necessary in two cases during liver resection to achieve R0 resection and to avoid rupture of a large primary tumor of the colon in another two cases.
Table 9

Overall morbidity, major complications and mean hospital length of stay was similar to other series (Table 10).
Table 10

Conclusions
In well selected cases, simultaneous laparoscopic approach is feasible, with low rates of conversion to open surgery once the learning curve has been completed, with low morbidity and mortality and acceptable oncological results.
Although the simultaneous laparoscopic approach offers some advantages, randomized controlled trials are needed with stratification of preoperative variables to determine the indications of the simultaneous laparoscopic approach for colon cancer with liver metastases.
Discussion at the Argentine Academy of Surgery
Eduardo de Santibañes: I congratulate Dr. Rafael Maurette and the team of the Hospital Británico who have presented this undoubtedly innovative work, since they have been working on it for many years. When you are an innovator, you have to be willing to resist and sometimes fail until you optimize the technique you have developed. Many years ago, Dr. Bonadeo and I began using the simultaneous resection in open surgery and in the first series of 71 cases that we published in the Journal of the American College of Surgeons we had only one colon dehiscence and no mortality. In the second series that we published in the Word Journal of Surgery, the three patients who underwent major hepatectomy died (they were 65-70 years old) and only two of the 170 patients undergoing colon resection presented dehiscences. I was struck when Dr. Bonadeo compared the anastomotic dehiscences of colonic fistulas of the simultaneous series with the metachronous series: there were fewer dehiscences in the simultaneous series, so we hardly thought it was a matter of numbers only.
I will ask you four questions. I will star with the last question because I think there is a mistake is one slide: you said you had not achieved R0 liver resections and then said that there were no R1 resections, which called my attention because, undoubtedly, what you have said is wrong. The first question refers to chemotherapy: nowadays, patients with synchronous metastases are operated on after chemotherapy because synchronous disease is a criterion of biological aggressive colorectal carcinoma. My question is: how do you manage these patients, which chemotherapy regimen do you use and for how long, and when do you decide on surgery? The second question is about upper, mid and lower rectal tumors. How do you manage these patients and which neoadjuvant chemotherapy regimens do you use? The third question would be: with which procedure do you start? I have heard some colleagues saying that they start with the liver because they want to finish soon and I have argued with them. With Bonadeo, Benati and Ojea, and nowadays with Rossi and Vaccaro, we had a rule: we firstly resected the colon, and only continued with the liver if we achieved R0 colon resection. We changed this afterwards, but we used this approach if we had to use the Pringle maneuver after having started with the liver. We have been performing the simultaneous approach in our daily practice over the past 20 years, even for rectal tumors or major surgery. The patient is prepared to be treated by the colon team, the coloproctology group and liver team. We start by the colon and complete the colon anastomosis to avoid the development edema in case of performing the Pringle maneuver as we think that pedicle ligation is a problem in the presence of bowel edema. The forth question -and I apologize for asking Mr. President so many questions- is associated with parenchymal-sparing liver surgery. Nowadays, a parenchymal-sparing approach is used in 90% of the cases to treat liver metastases. I am completely convinced that open surgery will become unusual in a few more years; it will be an approach for exceptional cases, but I still notice some difficulties associated with the procedure, and the use of the devices. Many laparoscopic surgeons prefer to perform anatomic resections instead of parenchymal-sparing surgery. For example, we now know that the vascular margin to resect a metastasis from any suprahepatic vessel or portal pedicle has exactly the same survival; this is for R0 resections and the same recurrence rate in R0 resections in the era of modern chemotherapy has already been demonstrated. So, how did you perform parenchymal-sparing liver surgeries in most lesions of this well-selected series? Because the main disadvantage, the only drawback of laparoscopy is that the surgeon cannot palpate the liver, and palpation in patients who have received chemotherapy is sometimes more important than ultrasound, because some metastases that are not detected by ultrasound are detected by palpation. So, after the surgical resection, the liver specimen is sent for intraoperative frozen section biopsy to decide the need for extending the surgical margin. How do you extend the margin if the lesion is close to the vascular pedicle? Thank you very much and I congratulate you for your work.
Rafael J. Maurette: Thank you very much, Dr. De Santibañes. You are right, the slide is wrong, we did not have R1 resections, all liver resections were R0, I apologize for not being clear. Chemotherapy is biased in our study. Over a period of 10 years, patients with synchronous lesions with accessible metastasis were operated on without previous chemotherapy; this has changed over the time, and in the meantime, we also used stents. Stents are no longer used, and, as you said, as it is an aggressive disease, over the past two or three years we have been indicating chemotherapy for three months and then we reevaluate. But the bias exists because we cannot compare the resections performed in 2008 with those performed in 2018. Our three cases of rectal cancer underwent neoadjuvant therapy, corresponding to more than 80% of all the series.
We also changed the first procedure. At the beginning, the proctologists started and then we continued, as you do. Then, as we and the anesthesiologists gained experience, I was afraid of liver edema and decided to star with the liver and then continue with the colectomy. Now we went back to perform colon surgery first and then liver surgery, partly because of what you said and because the anesthesiologists have excellent management of fluids and of the inotropic status, and there is no difference in performing a liver resection at the beginning of surgery or 7 hours later. I will answer the last question now and then return with the previous question. The number is a limiting factor for parenchymal-sparing surgery by laparoscopy. It is not possible to resect many metastatic lesions by laparoscopy because of the number of trocars necessary. In the same sense, remote lesions are not accessible. Undoubtedly, there is a limitation. But we do think that a first stage approach has a clear advantage; we had four cases and performed a left lateral hepatic sectionectomy and colectomy as a first stage, followed by a right posterior sectionectomy. This approach is in fact useful, but the number of lesions is a limitation for laparoscopy. In case of not finding the lesions, we have some cases that we converted to open surgery or hand-assisted surgery, and the experience gained with the use of the laparoscopic transducer was helpful. The laparoscopic transducer has a disadvantage: it is a king of windscreen wiper that moves from right to left in a non-anatomic direction; then, one gets dizzy with the structures and our learning curve was long, that is why we sometimes converted to hand-assisted surgery. Speaking of margins, we resect the margin when we remove the specimen and check both sides. And with respect to anatomic hepatectomy, the second consensus recommends not to extend the indications of anatomic liver resections to perform them by laparoscopy. This has not been our case. We made a very careful selection; you can notice that they were one or two lesions covering almost 80% of the liver, that is why it took us so long and the learning curve was also long. Perhaps, could have reduced the number of transfusions at the beginning. Thank you very much.
Oscar C. Andriani: I want to join in the congratulations on this work. In fact, it is an interesting number of sophisticated laparoscopic liver surgeries, 80 cases of which 21 were presented in this series. The cases selected demonstrate that this approach should be restricted to very special cases and covers part of the entire spectrum of surgeries for liver metastases, as Dr. De Santibañes has mentioned; parenchymal-sparing surgery involving multiple resections in different locations is, for the time being, limited to open surgery. Anyway, I want to emphasize that it is a very good experience and I am glad that it has been brought to the Academia. My question relates to technical aspects: I would like to know how you managed with colon anastomosis. Were the anastomoses intracorporeal or extracorporeal? Did you remove the liver and the colon simultaneously, or was the colon removed first, then the wall was sutured and you then created pneumoperitoneum again? And, finally, I would like to know if you used the Pringle maneuver in all deeper, non-anatomic resections. Thank you.
Rafael J. Maurette:Thank you, Dr. Andreani. I insist that one of the limitations of laparoscopic hepatectomy is the number of lesions. When the number increases, the best we can do is sequential surgery in two stages. We have added radiofrequency ablation, which is not the ideal method, but in case of multiple nodules there is nothing like having them on hand so as to remove each node. Thus, it has its limitations. We have been changing the way of removing the specimen. In the beginning, laparoscopic colectomy started first and then we continued with liver surgery through the same umbilical incision. We sometimes introduced our hands through this incision; in fact, the first case was a hand-assisted surgery and both the colon and liver specimens were removed through the same site because it was already open. Later, we started with the liver, and we agreed with the proctologists on where to make the incision. All the colon anastomoses were extracorporeal, with sutures introduced through the anum or mechanical stapler. As for the Pringle maneuver, at the beginning we were afraid of performing it because it was not used in open surgery and we definitely didnât want to break that rule. The truth is that we are using the Pringle maneuver in almost 100% of the cases, even in small resections. We learned this at last yearâs Congress in Paris, where almost all laparoscopic liver surgeons use it, so thatâs what changed our behavior from the beginning to the end. Thank you very much.
Javier C. Lendoire: The study that Dr. Maurette and his colleagues have brought to the Academia is pertinent and interesting. I would like to thank Dr. Maurette for sending me the manuscript which clearly facilitates the discussion and analysis of some of its points. Twenty-one patients treated by synchronous resection of the primary tumor and suspected liver metastases are analyzed. And I use the term âsuspectedâ because from a methodological viewpoint, the three patients with hemangiomas should have been excluded from the study, they should have been removed not only from the survival analysis but also from all the tables. Actually, the final number should have been 18 patients and not 21 based on the pathology report, including the metastasis without viable cells. On the other hand, the study clearly demonstrates that the selection criteria were clearly appropriate and what is most important, the study shows the value of the learning curve, confirmed by the authors, which confirms the primary goal of the study: the procedure is feasible and safe, with adequate morbidity, bleeding events and requirement for blood products.
My initial questions about which approach you do first and the use the Pringle maneuver have already been answered. Now, the modulation strategies presented deserve a special comment. Dr. Maurette, I would like to ask you why the three cases you presented are not cases of conventional modulation strategies. Nowadays, preserving the liver segments II/III in colorectal metastases is the cornerstone for liver surgeons to avoid two-stage surgery or a well expanded surgery. The question, also referred to what Dr. De Santibañes said, is about the need for a left lateral sectionectomy: Was it not feasible to perform a non-anatomic resection to preserve the segments II/III? On the other hand, as the second surgical stage was not a right hepatectomy but a right posterior sectionectomy or a posterior septectomy, I ask myself if a left lateral liver resection plus a posterior septectomy can be done in one stage. I understand that this is not possible by laparoscopy; you used a two-stage approach so that the first stage could be through laparoscopy. This is just a consideration to take into account so that you can explain. The third point refers to the mini-ALPPS you performed on a patient who first had a resection of segment VI, a resection of segment IVb and a radiofrequency ablation of segment IVa. You made a transection along the Cantlie line and then removed the left lobe in a second stage; therefore, it is not a conventional mini-ALPPS, it is not a conventional technique in this case because you finally removed segment VI and the left lobe. Then, the question is: why did you do so? Just to clarify. Finally, your overall survival was around 55% with disease-free survival of 16% at three years. Considering, then, that only the liver has metastases, undoubtedly synchronous surgery has significant influence, I want to ask you if you analyzed the reasons why disease-free survival was 16%, which is somewhat lower compared with other series. I congratulate you on the study and thank you again. I would also like to emphasize the importance of multidisciplinary centers like the one you where you work, and the relationship you have with the BPH surgery team and the colorectal surgery team, with which you could clearly implement these innovative techniques, as mentioned earlier. Congratulations.
Rafael J. Maurette: Thank you, Dr. Lendoire. Firstly, I will explain the matter of 21 versus 17. In fact, we wanted to analyze the outcomes of both procedures, colectomy and metastasectomy in 21 cases, regardless of the case of the hemangioma, because the fact that the procedures were simultaneous adds more morbidity; that is why we analyzed the short-term results of 21 cases. And I think that we can analyze the long-term outcomes in 17 cases, although one patient had a complete response because we found fibrosis. With regard to the second question, the case was a 40-year-old patient with those two large metastases that you can observe. He was treated with chemotherapy for 8 months (the question I did not answer from Dr. De Santibañes was firinox), the lesions became smaller and we performed the left lateral sectionectomy by laparoscopy plus the laparoscopic colectomy in a first stage and, we completed the right posterior sectionectomy by laparoscopy in a second stage. He developed a collection as complication, but we were able to leave the residual liver free of disease. Then we had another similar case, a left lateral sectionectomy of a large lesion with two metastases. In the meantime, the patient received chemotherapy and underwent the second stage by conventional surgery six months later. You are right about the mini-ALPPS; later, we learned that it was not a true mini-ALPPS, firstly because the transection was not complete, that is, it has to reach the middle suprahepatic vein and we did not do so; in fact, the liver did not develop significant hypertrophy. We could have actually performed a simultaneous resection, but we are extremely cautious about major hepatectomies with colectomies, and in our protocol safety means no major hepatectomies with rectal resection; rectal surgery has complications and, in coincidence with the literature, we believe it is not a good indication. I think I have answered.
Rodrigo Sánchez Claria: Congratulations to the authors for their work and to Dr. Maurette. This is actually an important series and, if one searches the literature, there are not many published series with simultaneous laparoscopic resections of the colon and liver, so the work deserves congratulations. The questions focus on the topics that have already been discussed. The first question refers to parenchymal-sparing surgery. Dr. Maurette commented about the limitation associated with multiple lesions, and with the site of lesions; anatomic resections are easier than non-anatomic resections in case of upper and posterior lesions, and clearly anatomic resections are not the best for parenchymal-sparing surgery in the case of the right posterior and superior segments. With respect to the lateral segment, left lateral sectionectomy, as Dr. Lendoire commented, is accessible and can be easily performed from a technical viewpoint, and in this way we sacrifice the entire left lateral segment to change the oncologic outcome as this patient has high chances of recurrence. Therefore, my question does not only refer to multiple lesions; I would like to ask if you found any kind of limitation with respect to the location of the lesions, taking into account this aspect of anatomic versus non-anatomic surgery and the difficulty of doing so. The second question is about chemotherapy: most of these patients with colon cancer and metastases are in stage IV. In our hospital, 100% of these patients will receive perioperative chemotherapy, and in laparoscopic surgery transection is often the most determining factor for bleeding. And we already know that livers with chemotherapy are more likely to bleed, so what was your experience with transection and bleeding in those patients who received perioperative chemotherapy? The third question has to do with intraoperative ultrasound. I was struck by the fact that the usefulness of ultrasound was not mentioned in the paper. As palpation is not possible during laparoscopic surgery, ultrasound is essential to locate the lesions and to know if good resection margins are possible. That is all.
Rafael J. Maurette: Thank you very much, Dr. Sanchez Claria. I start with the last question: I didnât mention it before because we are assuming that laparoscopic hepatectomy is not possible without a laparoscopic ultrasound probe. It was hard for us to learn how to use it but we used it from the beginning; I think that someone who wants to perform laparoscopic hepactetomy should first buy a transducer and then do the procedure, but not do it without a transducer, thatâs for sure. With regard to lesion location and number, we have very clear exclusion criteria; we do not resect liver metastases by laparoscopy, even in case of metachronous disease, when they are close to the portal pedicle, confluence of the suprahepatic veins or vena cava. We have approached upper lesions; the lateral position is of great help, as shown in the video, and the greatest advantages of laparoscopy are that it offers adequate anesthesia with appropriate fluid management, a position that involves less blood loss which is also favored by pneumoperitoneum as has been demonstrated in other publications, but this does not mean that it can be done to everyone; I agree that some lesions that cannot be resected by laparoscopy. Last year we brought to the Academia a segmentectomy VII and VIII, with resection of the middle suprahepatic vein; I think this procedure is appropriate by laparoscopy in metachronous metastases. I would never thought of a simultaneous approach as the procedure is long, has complications and we thought it was not a good indication. With respect to chemotherapy, it varied over the time. At the beginning, I think only 13% of the patients received neoadjuvant therapy, and they were patients with rectal cancer; so most patients did not receive chemotherapy. But now, as in this case that I have showed, many patients are treated with chemotherapy, and this case that I have showed is a good example of how in the left lateral sectionectomy -when the tumor is large- that left lateral segment cannot be preserved; so, we did not want to do a resection and leave the right segments for a second stage. In fact, in the two cases we had, parenchymal-sparing surgery was feasible. If you see that the lesion is large, there is no way to preserve parenchyma in that left lateral segment.
Pablo J. Sisco: I really congratulate Dr. Maurette. First of all, for the honesty of presenting everything and hiding nothing, and then for the progress he has been making and demonstrating in this Academia. I have two very simple questions to ask: firstly, if those patients who received oncologic treatment and in whom the disease progressed were included for surgery, and secondly, if you donât believe that the lack of palpation previously commented by Eduardo De Santibañes and other colleague is the problem that often hinders us the detection of lesions and the sometimes complex management of intraoperative ultrasound. Donât you think that the virtual reality tests that have been recently introduced with fusion of ultrasound images, tomography scans and visualization of all the vessels through dynamic angiography systems will make this approach definitely prevail, as De Santibañes, who prefers open surgery, has mentioned before?
Rafael J. Maurette:Thank you very much, Dr. Sisco. With regard to the first question about disease progression, I will repeat once again: the selection was so strict because most of these patients underwent surgery without chemotherapy. They had one or two simultaneous nodules. But answering Dr. Lendoireâs question, the results were not favorable in terms of the recurrence-free zone because we did not select patients with chemotherapy that would have had a better outcome; we included high risk patients, many with T3, T4, N1 disease and those are the patients with poor outcomes. Thatâs why a recurrence-free survival of 16% was not high. And as for the lack of manual palpation, one of the things we do is check the images thoroughly, not only the tomography scan but also the diffusion weighted magnetic resonance imaging, and we try to make a diagram and mark well where the lesions are, where they were and where they are, where they were before chemotherapy (not in this case) and where they are in order to look for them. This is helpful for laparoscopic ultrasound because we change the position of the transducer in a convenient incidence to look for the lesions and we see very small lesions. There is a diagram of a cyst with a lesion that measures 1 centimeter and we use the suprahepatic veins and the cysts as reference, until we find the lesion. But sometimes we donât find it and we have to introduce our hand; if we have to convert, we do so. We always tell the patients that if it is the procedure is not safe for their lives, if it is not an oncologically safe procedure, we will not use the laparoscopic approach. We can start with laparoscopy and, if necessary, we convert to open surgery. But yes, we can use the hand.
Oscar M. Mazza: Firstly, I want to join in the congratulations on this work and for bringing it to the Academia. I will ask you about the management strategy because I believe it is something we share in this institution, a simultaneous and laparoscopic approach if possible. But I wanted to go a little further into the design of the study and ask some pending questions. You started saying that you could not find any randomized prospective trial supporting any strategy; I believe that this prospective trial will never exist; it will be very difficult nowadays to find experienced centers in colon and liver surgery, performing minor resections by open surgery. It would be very difficult to justify an open procedure in everyday practice when another strategy is technically feasible. But you start from a rather ambitious premise of trying to demonstrate a null hypothesis: the simultaneous laparoscopic colon and liver approach is worse than the open approach. One tries to ignore this null hypothesis which is difficult to answer in a series of patients; therefore, the first question is: how many patients similar to those you operated on at the institution during the study period underwent open surgery, perhaps by natural selection of the treating team or by the surgeonsâ preference? Because that population could be used as controls in another study. In our institution, the laparoscopic approach is similar to the open approach and is just as safe; therefore, we can rule out the null hypothesis because, among your conclusions, you say that the approach is safe but you show an incidence of anastomotic leaks of 14.5-15% versus a historical incidence of 7.9%. Does that historic 7.9% correspond to colon surgery alone or to simultaneous colon surgery with open rectal surgery? And the third and almost existential question is that, in view of that 14% of anastomotic leaks, have you taken any measure in your daily practice to protect the anastomosis?
Rafael J. Maurette: Thank you very much, Dr. Mazza. We would have liked so, and in fact we will present a study at the Argentine Congress of Surgery comparing simultaneous laparoscopic approach with sequential approach in synchronous metastases. We have some cases approached by laparoscopy and our colorectal surgeons have great experience with laparoscopic colectomy, so they usually start with laparoscopy. Liver resection is quite difficult and implies a major hepatectomy, so colorectal surgeons start and then we continue via a comfortable subcostal incision. Sometimes, in cases of open surgery, a right-sided incision is used for both right hemicolectomy and hepatectomy but I do not have the exact number of open surgeries, but the number of laparoscopic sequential surgeries will be presented at the Congress, God willing. Anyway, the number is small. And I completely agree: prospective studies are very difficult to carry out; there are two prospective studies with results in ORANGE and COMET-OSLO. In both, no differences were observed with regards to both types of approaches; but we all know that the biologies are very different in each patient. Tumors can be more aggressive, more differentiated or N1, with K-RAS or without mutations. It is not just about tumor anatomy, of a single lesion or an uncomplicated tumor, so I think it is very difficult to perform a well conducted randomized study, but it is worth trying. And with respect to anastomotic leaks, this work, as I have said, is biased due to the low number of patients and the long period of time involved. Only one of the three anastomotic leaks resolved spontaneously and two required percutaneous drainage. Two of them occurred in the rectum; that is why we are so cautious with the rectum, but if we consider only two dehiscences, the percentage falls to almost 7%; then it is very difficult. We ask ourselves if the approach only increases the development of dehiscences or also of perihepatic collections. In those two bowel reconstructions we also had a fluid collection. We donât have an answer for that.
Emilio G. Quiñonez: First of all, I congratulate Dr. Maurette for the presentation of the work and I also thank him for sending me the manuscript for reading. I believe that, besides the approach used, one must be convinced that the simultaneous surgery is the treatment of choice. Since the study published 15 years ago by the Hospital Italiano in the Journal of the American College of Surgeons in 2002, many coloproctologists and liver surgeons still doubt about this type of procedure due to training issues, but we are absolutely convinced that this is a very good approach. I think that the approach is very interesting to discuss in the Academia, but we should first think which strategy to use rather than focus on the simultaneous approach. Unfortunately, one has to adapt to the environment where one works beyond oneâs beliefs; our hospital is a high-complexity healthcare center and receives patients referred from other institutions, so probably many of our patients have undergone resection of the primary tumor before arriving at our hospital and we cannot perform the simultaneous approach as we would like. I have two questions to ask. First question: the average hospital length of stay was 8 days, which is quite similar to our results in open surgery. Although these groups are not comparable, in your experience, if these time intervals are prolonged, do you think you can improve the length of stay or is it related with other aspects that do not emerge from work? The second question is left for reflection: at a time when cost-effectiveness is discussed, both in public and private healthcare systems, I would like to ask you if you feel that, independently of the advantages from the medical-care point of view, costs will be higher with the laparoscopic approach, and one should discuss in a not too distant future whether these costs justify this type of approach. Of course, in my opinion, and in the opinion of the unit where I work, it clearly has advantages, but I would like to know your appreciation. Thank you very much.
Rafael J. Maurette: Thank you very much, Dr. Quiñonez. I agree with what Dr. De Santibañes said at the beginning: this is changing and itâs going to keep on changing. Nowadays, the oncologist requests: âDo not operate, let me do three cycles of chemotherapy, and see how the patient respondsâ. Even for accessible lesions, because that selects tumor aggressiveness and biology, and the incidence of recurrence will no longer be of 16% because nowadays most patients undergo three months of chemotherapy, unless the lesion is very small. In the meantime, if complications develop, we do not use stents, we resect the tumor. Two years ago, we implanted stents to all the patients; things have evolved and I donât know if the indication of the simultaneous approach will be the same in 3-4 years. Maybe the indication changes with these targeted treatments, but this approach is possible and safe. And as I said at the beginning of the discussion: one surgery is better than two surgeries; there are fewer complications, shorter hospital length of stay and the tumor mass is reduced. But I donât know if this will be the case in the future. During the eight days of hospitalization, we had one duodenal perforation; it was in one of the first cases and it was caused by the radiofrequency needle that injured the duodenum. This patient was hospitalized for about 42 days. In 21 patients, 42 days shifts hospital length of stay to the left, prolonging the average length of stay. Anyway, the average was not of two days, but if this patient is not included, it would be of 5 days. I insist that it is a long and complex surgery, with the complications of open and laparoscopic surgery which are higher to those reported by European series, so hospital length of stay cannot be reduced. And with regard to costs, they are higher, as with all laparoscopic surgeries, but then benefits are seen when length of stay is shorter, which is not our case yet.
Referencias bibliográficas | References
1. Choti MA. Trends in long-term survival following liver resection for hepatic colorectal metastases. Ann Surg. 2002; 235(6):759- 66. [ Links ]
2. Brouquet A, Mortenson MM, Vauthey J-N, Rodríguez-Bigas MA, Overman MJ, Chang GJ, et al. Surgical Strategies for Synchronous Colorectal Liver Metastases in 156 Consecutive Patients: Classic, Combined or Reverse Strategy? J Am Coll of Surg. 2010; 210(6):934-41. [ Links ]
3. Capussotti L, Ferrero A, ViganͲ L, Ribero D, Tesoriere RL, Polastri R. Major Liver Resections Synchronous with Colorectal Surgery. Ann Surg Oncol. 2007; 14(1):195-201. [ Links ]
4. Mayo SC, Pulitano C, Marques H, Lamelas J, Wolfgang CL, de Saussure W, et al. Surgical Management of Patients with Synchronous Colorectal Liver Metastasis: A Multicenter International Analysis. J Am Coll Surg. 2013; 216(4):707-16. [ Links ]
5. Martin R, Paty P, Fong YM, Grace A, Cohen A, DeMatteo R, et al. Simultaneous liver and colorectal resections are safe for synchronous colorectal liver metastasis. J Am Coll Surg. 2003; 197(2):233- 41. [ Links ]
6. Thelen A, Jonas S, Benckert C, Spinelli A, Lopez-Hanninen E, RuÂdolph B, et al. Simultaneous versus staged liver resection of synchronous liver metastases from colorectal cancer. IntJ Colorectal Dis. 2007; 22(10):1269-76. [ Links ]
7. Ferri M, Gabriel S, Gavelli A, Franconeri P, Huguet C. Bacterial translocation during portal clamping for liver resection - A clinical study. Archives of Surgery. 1997;132(2):162-5. [ Links ]
8. de Santibañes E. Short-term and long-term outcomes after simultaneous resection of colorectal malignancies and synchronous liver metastases. World J Surg. 2010;34(9):2133-40. [ Links ]
9. Baltatzis M, Chan AKC, Jegatheeswaran S, Mason JM, Siriwardena AK. Colorectal cancer with synchronous hepatic metastases: Systematic review of reports comparing synchronous surgery with sequential bowel-first or liver-first approaches. European Journal of Surgical Oncology (EJSO). 2016; 42(2):159-65. [ Links ]
10. Kelly ME, Spolverato G, Le GN, Mavros MN, Doyle F, Pawlik TM, et al. Synchronous Colorectal Liver Metastasis: A Network Meta- Analysis Review Comparing Classical, Combined, and Liver-First Surgical Strategies. J Surg Oncol. 2015; 111(3):341-51. [ Links ]
11. Bonjer HJ, Haglind E, Jeekel I, Kazemier G, Pahlman L, Hop WCJ, et al. Laparoscopic surgery versus open surgery for colon cancer: short-term outcomes of a randomised trial. Lancet Oncol. 2005; 6(7):477-84. [ Links ]
12. Jayne DG, Guillou PJ, Thorpe H, Quirke P, Copeland J, Smith AMH, et al. Randomized trial of laparoscopic-assisted resection of colorectal carcinoma: 3-year results of the UK MRC CLASICC trial group. J Clinl Oncoly. 2007; 25(21):3061-8. [ Links ]
13. Leung KL, Kwok SPY, Lam SCW, Lee JFY, Yiu RYC, Ng SSM, et al. Laparoscopic resection of rectosigmoid carcinoma: prospective randomised trial. Lancet. 2004; 363(9416):1187-92. [ Links ]
14. Fretland AA, Kazaryan AM, Bjornbeth BA, Flatmark K, Andersen MH, Tonnessen TI, et al. Open versus laparoscopic liver resection for colorectal liver metastases (the Oslo-CoMet study): study protocol for a randomized controlled trial. Trials. 2015; [ Links ] 16.
15. Wakabayashi G, Cherqui D, Geller DA, Buell JE, Kaneko H, Han HS, et al. Recommendations for Laparoscopic Liver Resection A ReÂport From the Second International Consensus Conference Held in Morioka. Ann Surg. 2015; 261(4):619-29. [ Links ]
16. Ratti F, Catena M, Di Palo S, Staudacher C, Aldrighetti L. Impact of totally laparoscopic combined management of colorectal canÂcer with synchronous hepatic metastases on severity of complications: a propensity-score-based analysis. Surg Endosc. 2016; 30(11):4934-45. [ Links ]
17. Berti S, Francone E, Minuto M, Bonfante P, Sagnelli C, Bianchi C, et al. Synchronous totally laparoscopic management of colorectal cancer and resectable liver metastases: a single center experience. Langenbecks Arch Surg. 2015; 400(4):495-503. [ Links ]
18. Ferretti S, Tranchart H, Buell JF, Eretta C, Patriti A, Spampinato MG, et al. Laparoscopic Simultaneous Resection of Colorectal PriÂmary Tumor and Liver Metastases: Results of a Multicenter InterÂnational Study. World J Surg. 2015; 39(8):2052-60. [ Links ]
19. Tranchart H, Fuks D, Vigano L, Ferretti S, Paye F, Wakabayashi G, et al. Laparoscopic simultaneous resection of colorectal primary tumor and liver metastases: a propensity score matching analysis. Surgical Endoscopy. 2016; 30(5):1853-62. [ Links ]
20. Hatwell C, Bretagnol F, Farges O, Belghiti J, Panis Y. Laparoscopic resection of colorectal cancer facilitates simultaneous surgery of synchronous liver metastases. Colorectal Dis. 2013; 15(1):E21- E8. [ Links ]
21. Polignano FM, Quyn AJ, Sanjay P, Henderson NA, Tait IS. Totally laparoscopic strategies for the management of colorectal cancer with synchronous liver metastasis. Surg Endosc. 2012; 26(9):2571- 8. [ Links ]
22. Huh JW, Koh YS, Kim HR, Cho CK, Kim YJ. Comparison of laparoscopic and open colorectal resections for patients undergoing simultaneous R0 resection for liver metastases. Surg Endoscs. 2011; 25(1):193-8. [ Links ]














