Introducción
El cáncer de esófago afecta a más de 450 000 personas en todo el mundo y su incidencia está aumen tando rápidamente1. En pacientes con cáncer de esó fago no metastásico resecable, la quimiorradioterapia neoadyuvante seguida de cirugía es el procedimiento de referencia (gold standard) como tratamiento están dar con intención curativa.2,3El cáncer gástrico también sigue siendo un importante problema de salud mundial pues representa la quinta enfermedad más común y la tercera causa más frecuente de muerte por cáncer en todo el mundo, ya que causa 723 000 muertes/año, lo cual equivale al 8,8% de todas las muertes relacionadas con el cáncer4.
En la última década se ha observado un cam bio en el abordaje de estas patologías, primero debido al impacto positivo del tratamiento neoadyuvante, y, segundo, al advenimiento de diferentes herramientas para lograr una mejor estadificación preoperatoria5. Actualmente, la ecoendoscopia por ultrasonido (EUS) se considera el procedimiento de referencia para la estadificación locorregional preoperatoria en cáncer gástrico y esofágico6,9. Muchos estudios han evaluado la precisión de la EUS, informando que es útil para de terminar la profundidad de invasión en la pared (T), con una precisión superior al 90%. Si bien la evaluación de las metástasis ganglionares (N) parece ser menos efi caz, hay estudios previos que han demostrado excelen te resultados 7,8. La EUS facilita la selección de pacientes que se beneficiarían con el tratamiento neoadyuvante seguido de la cirugía con intención curativa, así como también en la selección de los pacientes candidatos a realizarles resección local.
Lamentablemente, la Argentina es uno de los países con mayor incidencia de cáncer de esófago (7,5 y 2,5 cada 100 000 habitantes en hombres y mujeres, respectivamente) y estómago (7,5 y 3 cada 100 000 ha bitantes en hombres y mujeres, respectivamente) en América del Sur9; muchos de estos pacientes no tienen acceso a la EUS como estudio preoperatorio. En este trabajo se propuso como objetivo evaluar la utilidad de la EUS en la estadificación de ACG y ACE para seleccio nar los pacientes candidatos a neoadyuvancia, compa rándola con la etapa previa a la implementación de la EUS en un centro quirúrgico de la Argentina.
Material y métodos
Se realizó un estudio observacional, retrospec tivo, sobre una base de datos cargada de manera pros pectiva, en el período comprendido desde enero del año 2013 hasta enero de 2019, en el Hospital Alemán de Buenos Aires. Se incluyeron todos los pacientes con adenocarcinoma de esófago y estómago que fueron sometidos a cirugía con intención curativa, excluyéndo se aquellos con criterios de irresecabilidad (metástasis a distancia, invasión de aorta o columna vertebral) y operados de urgencia.
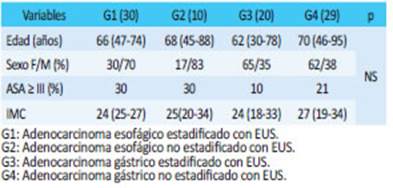
Para el análisis se dividió la muestra en cuatro grupos, teniendo en cuenta el órgano y la realización o no de EUS estadificadora preoperatoria: G1, los pacien tes con cáncer esofágico estadificado con EUS; G2, los pacientes con cáncer de esófago no estadificados con EUS; G3, los pacientes con cáncer gástrico estadificados con EUS y G4, los pacientes con cáncer gástrico no esta dificados con EUS. Todos los pacientes de los 4 grupos fueron estadificados también con tomografía compu tarizada (TC) o tomografía por emisión de positrones (PET-TC) o con ambas técnicas. Se definieron como cri terios para realizar quimiorradioterapia neoadyuvante aquellos > T2 o ≥ N1 en G1 y G2, y criterios para qui mioterapia perioperatoria aquellos > T2 o ≥ N1 en G3 y G4.
Los pacientes que se realizaron EUS estadifica dora cumplieron un ayuno de ocho horas y esta se rea lizó en todos los casos con un ecoendoscopio radial de 360° (Olympus GF-UE160AL®) con frecuencias de 7,5 y 12 MHz. Los pacientes fueron sedados y monitorizados previa entrevista con el anestesiólogo; a aquellos que por factores de riesgo lo requerían se les realizó anes tesia general. Se colocaron en decúbito lateral izquier do, y todos los procedimientos fueron realizados por el mismo endoscopista.
Se incluyeron en el análisis: edad, sexo, indica ción de neoadyuvancia, metástasis ganglionares en la pieza de anatomía patológica, supervivencia y tiempo de recurrencia.
Se compararon todas las variables entre los grupos de estudio.
Análisis estadístico
Para la caracterización de los datos se utilizó el programa Microsoft Excel® versión 2019.
Se realizó estadística descriptiva de las varia bles demográficas y clínico-quirúrgicas. El análisis es tadístico se realizó con la prueba de chi cuadrado para las variables categóricas y el T-test para variables conti nuas. La evaluación de la supervivencia global y super vivencia libre de recurrencia se analizó mediante curvas de Kaplan-Meier, y la comparación de las curvas me diante la prueba de log-rank. El análisis estadístico se realizó con el programa R versión 4.0.2®. Se consideró una p < 0,05 como estadísticamente significativa.
Resultados
Se realizaron un total de 89 cirugías por adeno carcinoma de esófago y estómago en el período anali zado, de las cuales 50 se estadificaron con EUS y 39 sin EUS.
Predominó el sexo masculino en ACE (70% y 83%) en G1 y G2, respectivamente, mientras que en ACG observamos mayoría de sexo femenino (65% y 62% ) en G3 y G4. Los pacientes con ACE tuvieron ma yor porcentaje de ASA ≥ III con respecto a los ACG. Las características generales de los pacientes se muestran en la tabla 1.
En los ACE, el síntoma predomínate fue la dis fagia en 21 (53%); en el caso de los ACG, la pérdida de peso fue el signo más frecuente en 20 (49%) de la muestra.
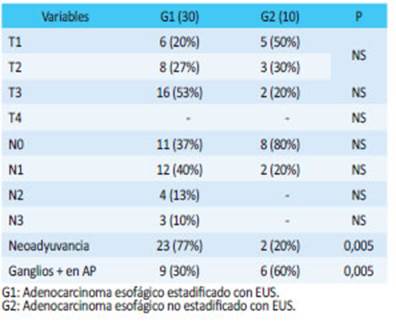
En G1, 23 (75%) de los pacientes realizaron neoadyuvancia, mientras que solo 2 (20%) en el G2 (p: ≤ 0,005). En cuanto a la estadificación preoperatoria, en G1 el 76% de los pacientes fueron estadificados como ≥ estadio IIB, mientras que en G2 solo el 40%. Cuando comparamos las pieza de anatomía patológica, obtuvi mos 9 (30%) de metástasis ganglionares en G1 y (60%) en G2 (p: ≤ 0,005) (tabla 2).
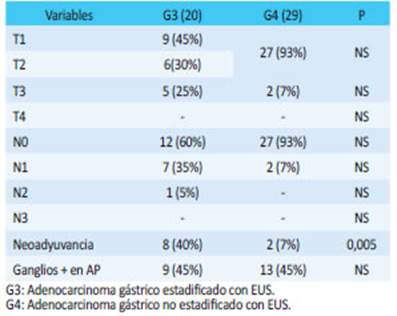
En G3 realizó quimioterapia perioperatoria el 40% de los pacientes, mientras que solo 2 (7% ) en G4 (p: ≤ 0,005). Se estadificaron como ≥ estadio IIA el 70 % de los pacientes en G3, y solo el 31% en G4. En la ana tomía patológica observamos metástasis ganglionares en 9 (45%) en G3 y en 13 (45%) en G4 (Tabla 3).
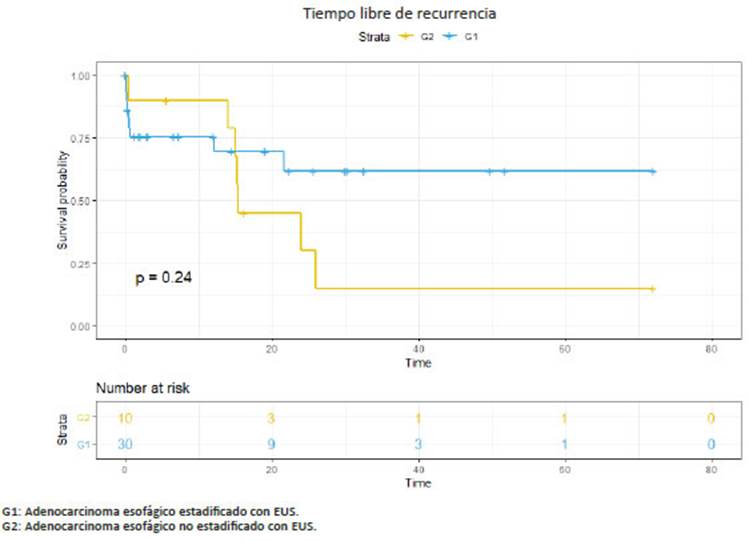
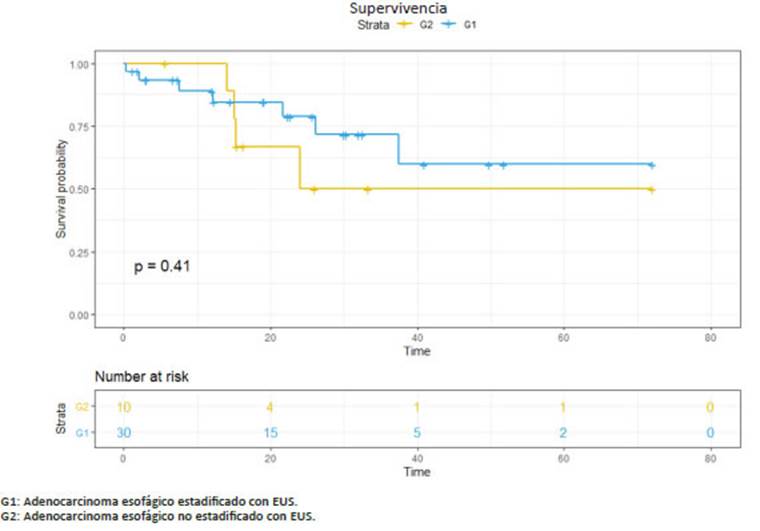
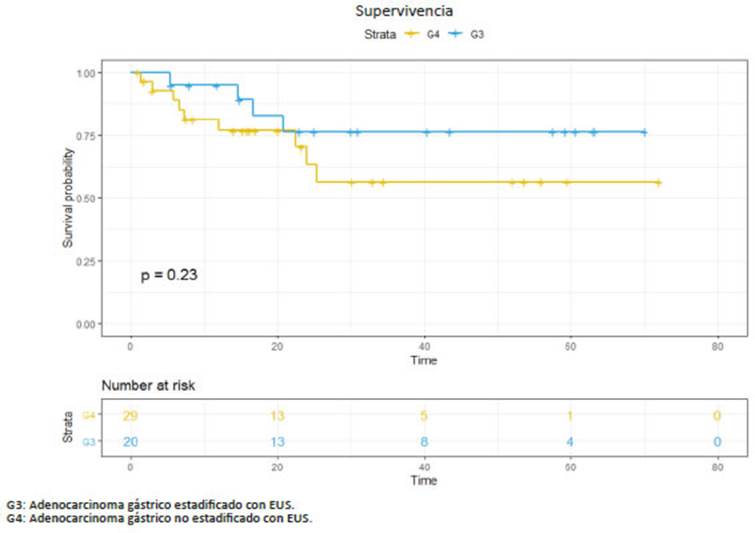
La supervivencia libre de enfermedad prome dio en G1 fue de 20 (6-72) meses, en G2 de 25 (6-72) meses, en G3 de 32 (6-72) meses y en G4 de 26 (6-56) meses. La supervivencia global en G1 fue de 32 (6-72) meses, en G2 36 (6-72) meses, en G3 de 40 (6-70) me ses y en G4 de 37 (6-72) meses (Figs. 1,2,3,4).
Discusión
El tratamiento neoadyuvante está ampliamen te recomendado en los canceres localmente avanzados tanto de esófago como de estómago; es por esto que la EUS se convirtió en una herramienta de gran utilidad en la estadificación preoperatoria locorregional, para se leccionar correctamente los pacientes que se beneficia rían de este tratamiento seguido de la cirugía, así como también los pacientes candidatos a resecciones locales.
Una gran cantidad de literatura apoya a la EUS como la modalidad más precisa para la estadificación local del cáncer de esófago en comparación con la TC y la tomografía por emisión de positrones (PET-TC). Una revisión que incluyó 21 estudios encontró que la EUS tuvo una precisión del 84% para la predicción de la invasión en la pared10. Otros estudios han encontrado que la precisión de la EUS para la estadificación (T) con la mayoría de los transductores de exploración radial de 7,5-12 MHz oscila entre 75 y 92% en comparación con la TC, que tiene una precisión del 42-60%11. Sin em bargo, la precisión de la EUS para la estadificación del cáncer de esófago varía según la invasión en la pared (T) 12. La EUS es más fiable para clasificar T3 y T4, con precisiones de 89-94% y 88-100%; en cambio para los tumores T1 y T2, con precisiones de 75-84% y 64-85%, respectivamente10. En particular, las lesiones T2 pare cen ser las más desafiantes porque están sujetas a una sobreestadificación13. Para Rice y col. 14, la EUS puede diferenciar las lesiones T1 y T2 de las lesiones T3 o T4 con 87% de precisión, 82% de sensibilidad y 91% de es pecificidad.
Cuando analizamos las metástasis ganglionares encontramos en la literatura que la EUS es una de las modalidades más precisas disponibles para examinar los ganglios linfáticos regionales. Hay varias caracterís ticas que pueden ayudar a predecir malignidad, como por ejemplo: tamaño mayor de 1 cm, forma redonda, bordes claramente delimitados y la ecoestructura hi poecoica. Cuando las cuatro características están pre sentes, la precisión de estos predictores es del 80%; sin embargo, solo la minoría de los ganglios linfáticos ten drá las cuatro características presentes a la vez15. La pre cisión general de la EUS para la estadificación de N es del 75-80% en comparación con la tomografía compu tarizada, que tiene una precisión general del 51-74%10. La EUS también es superior a la valoración por PET-TC, que tiene una precisión de 37-90%16. Lowe y col.17 mos traron, en un estudio prospectivo de 75 pacientes con diagnóstico reciente de cáncer de esófago, la sensibili dad y especificidad para la afectación ganglionar por es tas modalidades, las cuales fueron 86 y 67% para EUS, 84 y 67% para TC y 82 y 60% para PET-TC17.
En nuestra serie observamos cómo la utiliza ción de la EUS preoperatoria nos permitió aumentar el número de pacientes con adenocarcinoma de esófago que realizaron neoadyuvancia (G1: 75% vs. G2: 20%), con una esperable disminución de pacientes con me tástasis ganglionares en la anatomía patológica y una prolongación en la supervivencia.
La estadificación del cáncer gástrico a través de la EUS comienza con la evaluación del tumor primario con especial atención a la profundidad de la lesión, lo cual cambia el pronóstico y el tratamiento de la pato logía. Los estudios que evalúan la estadificación son la EUS, la TC y resonancia magnética nuclear (RMN); es tos han registrado en general que la EUS es más precisa para la estadificación tanto del T como del N 18. Kuntz y col19 evaluaron la estadificación en las tres modalida des, observando que la EUS tenía la mayor precisión para la estadificación T (73%) y N (87%). La resonancia magnética tuvo la precisión más baja (48%) para definir el T, mientras que para metástasis ganglionares tanto la RMN como la TC fueron comparables (69 y 65%, respec tivamente). Para Kwee y col.20 ‒si bien la utilización de TC y resonancia magnética multidetector han demos trado una mejora en la precisión de la estadificación en T, la EUS sigue siendo la modalidad de imagen más pre cisa para la estadificación locorregional. No obstante, la TC y/o la RMN son los mejores estudios para la evalua ción de enfermedad a distancia; por lo tanto, el papel complementario de la imagen transversal y la EUS en la estadificación tanto del cáncer esofágico como gástrico es primordial.
Sin bien entendemos las limitaciones de nues tro trabajo por ser un análisis retrospectivo, en nuestra serie de pacientes con adenocarcinoma gástrico tam bién notamos el aumento de indicación de quimiote rapia perioperatoria en los pacientes estadificados con EUS (G3: 40% vs. G4: 7%), hecho que no se ve refleja do en los números absolutos de metástasis gangliona res, tal vez debido a la diferencia en el tamaño de las muestras. En cuanto a supervivencia y tiempo libre de enfermedad, según lo esperado las curvas favorecen a los pacientes que alcanzaron la quimioterapia periope ratoria a pesar de no ser estadísticamente significativo.
Actualmente en la Argentina son pocos los cen tros que implementan rutinariamente la EUS para la es tadificación del adenocarcinoma de esófago y estóma go. Creemos que, en parte, se debe a la dificultad en la formación del joven endoscopista en el manejo de esta compleja herramienta. El costo de los equipos, los ma teriales y su adecuado mantenimiento es otra limitante debido a la delicada situación económica de nuestro país. En la bibliografía no encontramos evidencia del uso actual de la EUS para esta patología en la Argentina, pero seguramente ‒si quisiéramos aumentar su em pleo‒ deberíamos empezar por entrenar a nuestros en doscopistas en diferentes centros de referencias del país y así aumentar el acceso de la población a este estudio.
Conclusión
La utilidad de la EUS como herramienta para la estadificación locorregional en pacientes seleccio nados con adenocarcinoma de esófago y estómago desempeña un papel muy importante para la selección de pacientes que realizarán tratamiento neoadyuvante previo a la cirugía con intención curativa.











 texto en
texto en