Introducción
La neoplasia papilar mucinosa intraductal de páncreas (NPMI) se considera un grupo de tumores con proliferación adenomatosa del epitelio ductal pancreá tico, que puede afectar el conducto pancreático princi pal (tipo I), sus ramas secundarias (tipo II) o ambos (tipo III)1. Inicialmente fue descripto en 1982 por Ohhashi y col.2 como una entidad diferente dentro del grupo de los tumores quísticos del páncreas y, en 1996, aceptada como lesiones con potencial maligno3 por la Organiza ción Mundial de la Salud. Son las características ima genológicas las que, teniendo en cuenta las diferentes guías publicadas, nos van a guiar en el tratamiento para seguir4.
Debido a la mejoría de los métodos diagnósti cos, su incidencia ha aumentado en los últimos años, estimándose actualmente en 2/100 000/habitantes por año5, con una frecuencia diagnóstica que alcanza el 50% de las lesiones quísticas detectadas en estudios por imágenes; se las ha encontrado en el 24% de las autopsias en adultos, y en un 25% de las neoplasias pancreáticas operadas4,6,7. La frecuencia diagnóstica por tipo descripta es del 37% para las tipo I, 27% para las tipo II y 36% para las tipo III4,8.
La NPMI se ha constituido en la lesión quísti ca precursora del adenocarcinoma ductal de páncreas más frecuentemente diagnosticada, por lo que la dis cusión acerca de ella, como de las guías actuales de manejo, debe ser parte de la formación médica del pre grado y posgrado, dado el aumento en su prevalencia diagnóstica.
El propósito de este trabajo fue comunicar nuestra experiencia concerniente al diagnóstico, mane jo estandarizado multidisciplinario y seguimiento aleja do de pacientes con NPMI en un centro de referencia.
Material y métodos
Análisis retrospectivo, descriptivo, de una base de datos prospectiva de pacientes que consultaron al Servicio de Cirugía General y HPB del Hospital Univer sitario Fundación Favaloro, Ciudad Autónoma de Bue nos Aires (CABA), Argentina, por patología pancreática tumoral entre enero de 2010 y diciembre de 2019. Se incluyeron los pacientes que concurrieron a consulto rios externos y se consultaron datos disponibles en la historia clínica informatizada, excluyendo a aquellos pacientes que no regresaron a la consulta luego del diagnóstico y/o se perdieron en el seguimiento. Se con templaron como variables: edad, sexo, antecedentes personales, cuadro clínico, estudios por imágenes, lo calización del tumor, laboratorio, tratamiento, compli caciones, estadía hospitalaria, seguimiento, morbilidad y mortalidad y clasificación ductal e histopatológica.
A partir de los datos obtenidos se dividieron los pacientes en 2 grupos:
A. NPMI diagnosticados en consultorio
B. NPMI diagnosticadas en la anatomía patológica de una pancreatectomía por otra causa
La indicación quirúrgica se decidió en ateneo multidisciplinario sobre la base de las guías de mane jo internacional. En el grupo A, a los pacientes a quie nes se les indicó cirugía se los subcategorizó como AC, mientras que a los que continuaron en seguimiento como AS9-11. Las complicaciones se informaron utilizan do la clasificación de Dindo-Clavien (considerando las complicaciones clínicamente relevantes, DC > 3)12 y la del Grupo Internacional de Estudio de la Cirugía Pan creática (GIECP)13-15.
Las variables continuas están expresadas en media con desvío estándar (DS) o mediana y rango. Las variables categóricas se expresan como N y/o porcenta jes. El valor “p” se consideró significativo cuando fue < 0,05; la supervivencia actuarial se analizó utilizando la prueba de Kaplan-Meier. El análisis estadístico se reali zó con el programa IBM SPSS Satistic versión 25.0®.
Resultados
En el Hospital Universitario Fundación Favalo ro, 101 pacientes fueron diagnosticados con NPMI. Si guiendo los criterios de exclusión, 86 pacientes fueron incluidos en el estudio; a 79 (90%) se les diagnosticó NPMI en consultorio y 7 tuvieron hallazgo en la anato mía patológica; 53 fueron mujeres (62%) con una me dia de 65 ± 14 años de edad.
Treinta y tres pacientes (38%) consultaron debido a dolores abdominales inespecíficos, 10 (12%) habían cursado internación por cuadro de pancreatitis aguda y en 43 casos (50%) fue un hallazgo incidental en estudios por imágenes.
En cuanto a los estudios por imágenes utiliza dos para el diagnóstico del tipo y características de las lesiones, 66 pacientes se hicieron tomografía computa rizada (TC), 79 una resonancia magnética nuclear con colangiorresonancia (cRMN) y en 30 fue necesario rea lizar una ecoendoscopia por duda diagnóstica (35%).
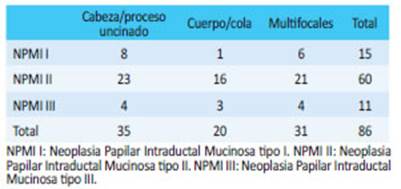
Del total, 15 pacientes (17%) tenían NPMI I (2 asociadas a adenoarcinoma); 60 (70%) una NPMI II (1 asociada a un ampuloma y otra a un adenocarcinoma) y 11 (13%) una NPMI III (1 asociada a TNE y 1 a ade nocarcinoma). Con respecto a la ubicación de la lesión: 35 (41%) se localizaban en cabeza/proceso uncinado, 20 (23%) en cuerpo/cola y 31 (36%) eran multifocales (Tabla 1).
De los 79 pacientes del grupo A, en 57 casos (66%) se decidió conducta expectante y seguimiento (AS) de acuerdo con las guías mencionadas. Esto se de bió a que:
▪▪En 53 casos (93%), los pacientes presentaban NPMI II sin ningún signo de malignidad.
▪▪2 pacientes (3,5%) con NPMI III y 2 pacientes (3,5%) con NPMI II optaron por continuar con el seguimiento clínico a pesar de la sugerencia médica.
La mediana de seguimiento fue de 12 meses (Rango 1-83).
De los 22 pacientes restantes:
▪▪18 (29%) fueron operados (AC) por presentar:
◦◦9 NPMI I
◦◦3 NPMI II: 1 con estigmas de alto riesgo, 1 debido al tamaño de la lesión y
◦◦6 NPMI III
▪▪4 tienen la cirugía pendiente: 2 NPMI 2 con elevación del Ca19.9 intraquístico y 2 NPMI III con característi cas preocupantes.
La mediana en seguimiento hasta indicación de cirugía fue 5 meses (Rango 3-106).
De un total de 221 pancreatectomías realiza das en el período analizado, 142 se debieron a patolo gías malignas y en 7 de ellas se encontraron NPMI en la anatomía patológica (grupo B). De ellas, 5 fueron neo plasias primarias de páncreas y 2 ampulomas (Tabla 2).
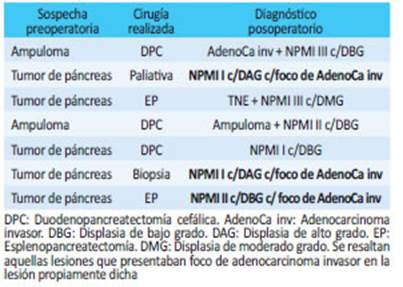
Tabla 2 Pacientes del Grupo B: relación entre la sospecha preoperatoria, la cirugía realizada y la anato mía patológica en pacientes con resección pancreática por otra causa.
En caso del grupo AC, se realizaron 6 DPC, 5 pancreatectomías distales, 5 pancreatectomías totales y 2 cirugías derivativas debido al hallazgo intraopera torio de infiltración de vena mesentérica superior en un paciente de 83 años y metástasis hepática en otro (Tabla 3). El 20% de las pancreatectomías totales reali zadas comenzaron como pancretectomía parcial, pero debieron extenderse debido a la positividad reiterada del margen del conducto de Wirsung enviado a conge lación.

Tabla 3 Pacientes del Grupo AC: correlación entre el tipo de NPMI diagnosticada en el preoperatorio y el diagnóstico anatomopatológico posoperatorio de pacientes que fueron intervenidos luego del diagnóstico en consultorio de NPMI
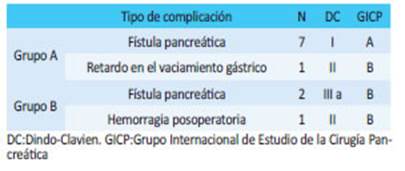
En total se registraron 8 complicaciones poso peratorias dentro del grupo AC y 3 dentro del grupo B (Tabla 4).
Ninguno de los pacientes del grupo AC o B tu vieron recidiva en el páncreas remanente. Una paciente del grupo B, a la que se le realizó una esplenopancrea tectomía por TNE con hallazgo de NIPM III con displasia moderada, presentaba además una NIPM II en cabeza de páncreas, que se decidió seguir.
Para el grupo A, la supervivencia de los pacien tes en quienes se adoptó la conducta conservadora (AS) fue 96% y 89%, mientras que en aquellos que fueron sometidos a cirugía (AC) fue 95% y 86% a los 2 y 5 años, respectivamente. En cambio, en el grupo B, la supervi vencia a 2 y 5 años fue 43% (p = 0,001 grupo AS vs. AC, Fig. 1. A).
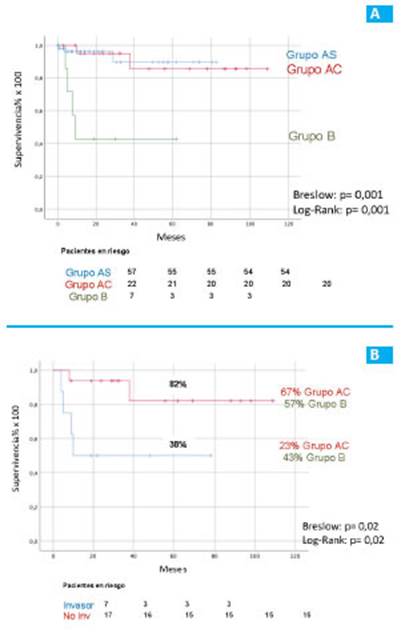
Figura 1 A: supervivencia de los pacientes que se encuentran en seguimiento (AS), aquellos que fueron operados con diagnóstico de NPMI (AC) y en los que fue un hallazgo en la anatomía patológica (B). B: supervivencia de los pacientes operados con neoplasia papilar mu cinosa intraductal del páncreas invasor y no invasor.
Del total de 17 NPMI no invasivas resecadas, 13 pertenecían al grupo AC (4 NPMI I, 2 NPMI II y 7 NPMI III) y 4 al grupo B (1 NPMI I, 1 NPMI II y 2 NPMI III). La supervivencia a 5 años para NPMI no invasivas reseca das quirúrgicamente fue 83%. Entre las NPMI invasivas, la supervivencia fue del 38% (p = 0,02. Fig. 1.B). Dentro de este último grupo 4 pertenecían al grupo AC (2 NPMI I y 2 NPMI III) y 3 al grupo B (2 NPMI I y 1 NPMI II).
Las causas de muerte fueron: progresión de la enfermedad en el subgrupo AC (los 2 operados con ci rugía derivativa); en el subgrupo AS, 2 pacientes: uno de ellos cirrótico (falleció en quirófano durante la in ducción anestésica para un trasplante hepático) y el segundo por un infarto agudo de miocardio (IAM). En el grupo B, 4 pacientes fallecieron; las causas de muer te fueron: shock séptico, IAM y 2 por progresión de la enfermedad.
Discusión
La NPMI se ha constituido en una patología pancreática de alta prevalencia dado el desarrollo de los métodos de estudios por imágenes. Entre los fac tores de riesgo para su desarrollo se consideran la dia betes (especialmente la forma insulino-requiriente), la pancreatitis crónica, la historia familiar de adenocarci noma pancreático ductal y el tabaquismo16,17. Las NPMI se diagnostican en pacientes con un promedio de edad de 64 años, más en hombres y mayoritariamente asin tomáticos. En cuanto a su localización, la más frecuen te suele ser a nivel de la cabeza pancreática y proceso uncinado, son multifocales en un 30-40%4,7. Contraria mente a lo referido en la literatura, informamos que un 70% de las lesiones eran NPMI II, un 17% NPMI I y NPMI III en 13%, pero sí hay consistencia en relación con la ubicación.
La mayor parte de las NPMI son asintomáticas e incidentales. En caso de que el paciente se encuen tre sintomático, los síntomas suelen ser inespecíficos (dolor abdominal, dolor lumbar, náuseas y/o vómitos, anorexia y pérdida de peso)18; puede presentarse con cuadros de pancreatitis aguda o de ictericia19,20.
En el caso de los estudios por imágenes, la re comendación es comenzar con una resonancia magné tica nuclear con contraste más cRMN, siendo la TC la alternativa. Mediante ellas se busca estudiar las carac terísticas del quiste, la presencia de nódulos murales y la relación con el conducto de Wirsung. Hoy en día, la ecoendoscopia con punción es el método más pre ciso para el diagnóstico de lesiones quísticas pancreá ticas. Debería solicitarse en caso de duda diagnóstica o sospecha de degeneración maligna. La citología en el líquido de punción presenta muy bajo rédito diagnós tico debido a la baja celularidad presente en el líqui do. El dosaje de antígeno carcinoma embrionario (CEA) mayor de 200 ng/mL podría orientar con alto grado de precisión hacia un quiste productor de mucina, pero no es predictor de malignidad21. En 2013, Park y col. informaron la medición de glucosa intraquística como método para diferenciar quistes mucinosos de los no mucinosos, y que es más alta en estos últimos22.
En 2006 y luego en 2017, Tanaka y col. publi caron guías donde sugieren algoritmos para el mane jo de las NPMI, conocidas como las guías de Sendai y Fukuoka. En las últimas se describen dos grupos de fac tores de riesgo de degeneración a cáncer detectados en los estudios por imágenes: “estigma de alto riesgo” (EAR) y “características preocupantes” (CP) (Tabla 5), las cuales se cree que contribuyen individualmente a la malignidad9,10. Izumo y col. presentaron un estudio retrospectivo en el cual encontraron que la presencia de un nódulo mural > 5 mm que realza con contraste, antecedente de pancreatitis o la presencia de engrosa miento/realce mural son factores de riesgo significati vos para displasia de alto grado. Asimismo, un conduc to pancreático > 10 mm, cambio abrupto en el calibre del conducto de Wirsung con atrofia del páncreas distal o la presencia de adenopatías fueron factores de riesgo para el carcinoma papilar mucinoso intraductal23.
Durante el seguimiento de una NPMI II, en caso de detectarse EAR, la indicación es la cirugía. Si en cam bio se detectan CP, debería confirmarse la sospecha con ecoendoscopia y punción: en el caso de ser positi vo debería orientarse para el tratamiento quirúrgico. En caso contrario, la conducta va a ser el seguimiento, con una frecuencia que dependerá en principio del tamaño del quiste. En aquellos que miden menos de 1 cm, hay que repetir las imágenes en 2-3 años, cuando el quiste mide entre 1-2 cm, la TC/RMN debería ser anual por 2 años y luego ir espaciando los controles. Para aquellas lesiones que miden entre 2 y 3 cm, la indicación es ir al ternando entre ecoendoscopia y RMN cada 3-6 meses, con una fuerte recomendación de considerar la cirugía en aquellos pacientes jóvenes con buen performance status9,10,24-26.
En una reciente publicación, Giuffrida y col. presentan su experiencia en pacientes con NPMI II con criterios de Sendai negativos al inicio del seguimiento y que, durante su transcurso, se positivizaron. En este trabajo, el 17% de los pacientes necesitaron un cambio de estrategia (cirugía) y se encontró cáncer en el 5,5% de los operados. Según los autores, los criterios de Sen dai presentan un alto (100%) valor predictivo negativo para cáncer pero un bajo (32%) valor predictivo positi vo. Por lo tanto, concluyen que la ausencia de criterios positivos de Sendai excluyen la posibilidad de cáncer en pacientes con NIPM II, pero su positividad no lo puede confirmar. En pacientes con criterios de Sendai positi vos, la cirugía debería definirse dependiendo de la ex pectativa de vida y los riesgos de los pacientes27.
Debido a que las NPMI I y III o mixtas tienen un riesgo de hasta el 61% de displasia de alto grado y ade nocarcinoma, está indicada la resección quirúrgica. Las NPMI II presentan un riesgo del 31% y 18% de displasia de alto grado y adenocarcinoma, respectivamente18. Además de los cambios apreciables en las imágenes, algunos signos clínicos de alarma que deben tenerse en cuenta son la progresión a diabetes y la elevación sérica de CA-19.9.
El tipo de cirugía para indicar va a depender de la localización del NPMI; hoy es de elección el aborda je videolaparoscópico. La cirugía más frecuentemen te realizada es la duodenopancreatectomía cefálica (70%), seguida por la pancreatectomía distal (25%)28. Estas cifras coinciden con lo informado en nuestra se rie. La ecografía intraoperatoria es indispensable para definir la conducta en muchos casos (sensibilidad del 95 al 100%), descartar otras lesiones y confirmar su re secabilidad 29. Una vez realizada la sección pancreática, y sobre todo en los casos de NPMI tipo I, se debe enviar el borde del conducto para biopsia por congelación. En caso de hallarse displasia de alto grado, se recomienda, de ser posible, realizar una retoma. De continuar sien do positivo, se sugiere completar la pancreatectomía total7. Si bien la enucleación ha sido propuesta, no hay resultados a largo plazo, como para poder recomendar la. En el caso de NPMI multifocal se recomienda rea lizar resecciones segmentarias de aquellas lesiones de mayor riesgo, y un seguimiento de las lesiones ubicadas en el remanente30.
La revisión de las piezas quirúrgicas lleva a tratar de identificar las características anatomopato lógicas de las NPMI, e informar los diferentes subti pos, entre los que se encuentran el intestinal (27%), el pancreático-biliar (45%), el oncocítico (4%) y el gástrico (13%). En algunas ocasiones puede encontrarse más de un subtipo dentro de la misma lesión4,8,31. En algu nos casos, las NPMI pueden progresar y convertirse en carcinoma invasor siguiendo la secuencia de displasia de bajo, moderado o alto grado y carcinoma invasor. Se estima que 20% de las NPMI halladas en autopsias, pre sentan displasia de alto grado y 30% carcinoma invasor. La progresión de adenoma a carcinoma sucede en un lapso entre 5-6 años y va a depender del subtipo de NPMI30. En nuestra experiencia, solo en el 25% de los casos pudieron identificarse formas puras de subtipos de NPMI: en 9 casos (64%) se halló el tipo gástrico, se guido en frecuencia por el intestinal (2 pacientes, 14%). En 3 casos, se encontró más de un subtipo dentro de la misma lesión: 2 gástrico + intestinal y 1 gástrico y bilio-pancreático.
Uehara y col. mostraron que el 8% (5/60) de los pacientes con NPMI II desarrollaron adenocarcino ma pancreático ductal durante el seguimiento31. La tasa de supervivencia a 5 años, para NPMI no invasivas re secadas quirúrgicamente, es del 90 a 100%, mientras que para NPMI invasivo es del 31 al 60%11. El Progra ma de mejoramiento de la calidad quirúrgica llevado a cabo por el Colegio Americano de Cirugía informó que de 478 pacientes con resecciones pancreáticas, el 10% fueron por NPMI, de los cuales el 23% tenía displasia de alto grado o cáncer7. Estos números son similares a los observados en nuestro estudio, donde el seguimiento tiene, como ha sido recomendado, una mayor aplicabi lidad que la indicación de cirugía.
Según la serie de Marchegiani y col, 65 de 381 (17%) presentaron recurrencia posresección, 2 de los cuales desarrollaron adenocarcinoma meta crónico y 9 requirieron reoperación32. En esta cohorte aún no se han observado recurrencias posresección.
En conclusión, el diagnóstico y manejo de este tipo de lesiones está hoy bien estandarizado, con guías que han evolucionado con los avances imagenológicos y terapéuticos. La historia natural de la enfermedad y los eventos que llevan a la progresión a adenocarcino ma comienzan a comprenderse y pueden sospecharse con los estudios por imágenes actuales. Cuando la ci rugía está indicada, la supervivencia a largo plazo debe ser similar a la del grupo en seguimiento.











 texto en
texto en