Introducción
La neoplasia mucinosa apendicular (NMA, o AMN por sus siglas en inglés) fue descripta por Roki tansky en 1842 como una dilatación de la luz del apén dice vermicular secundaria a la acumulación de moco1,2.
La neoplasia apendicular “no carcinoide” tiene una incidencia de 0,9 por 100 000 por año; de esta ma nera, la NMA representa en el 0,2- 0,7% de todas las apendicectomías1,3,4. El 25% son adenocarcinomas.
Es más prevalente en mujeres que en hombres (4:1), a una edad media de 55 años5.
La forma de presentación más común es el hallazgo incidental seguido del diagnóstico en pa cientes con molestias crónicas en fosa ilíaca derecha (FID) y, finalmente, por el hallazgo anatomopatoló gico en piezas ingresadas por apendicitis aguda3,5,6. Debe ser considerado como un diagnóstico diferen cial en casos de dolor crónico en fosa ilíaca derecha1,7.
Los tumores no carcinoides de apéndice son: adenoma (símil a adenoma rectocolónico), lesión ase rrada (pólipo), neoplasia mucinosa apendicular de bajo grado (LAMN), neoplasia mucinosa apendicular de alto grado (HAMN), adenocarcinoma mucinoso, adenocar cinoma apendicular (no mucinoso)4,8-10.
La característica principal de la LAMN es que no es invasiva de acuerdo con la clasificación de la Organización Mundial de la Salud (OMS)7. La HAMN comparte características histológicas con LAMN pero presenta atipia citológica más agresiva y es de poca prevalencia8,10. Tanto LAMN como HAMN se consideran patologías benignas que no producen “invasión infil trativa” como el adenocarcinoma mucinoso4. La razón del “potencial” comportamiento maligno se debe a las consecuencias que puede acarrear el vuelco de moco o células neoplásicas a la cavidad peritoneal; tanto es así que la complicación más temida es la perforación espontánea o iatrogénica que puede ser el origen de un pseudomixoma peritoneal (PMP), una neoplasia muci nosa que crece dentro de la cavidad peritoneal causan do ascitis mucinosa e implantes peritoneales2,4,6,9.
Las LAMN tienen generalmente el KRAS muta do y no es habitual la inestabilidad microsatelital o la mutación BRAF6,8,10,11.
El mucocele apendicular es un término descrip tivo utilizado para englobar entidades benignas o malig nas que puedan producir una degeneración quística del órgano3,6. Existe la posibilidad de que sea solo un quiste de retención (mucocele inflamatorio)3. Sin embargo, las lesiones mayores de 20 mm tienen mayor probabilidad de ser una neoplasia mucinosa, en especial si no hay cau sa obstructiva aparente5,6. Los mucoceles menores de 20 mm raramente son malignos pero, por contrapartida, los mayores de 60 mm tienen alta probabilidad de tener cé lulas neoplásicas y de perforación espontánea1,12.
El diagnóstico preoperatorio es difícil de rea lizar si no hay dilatación de la luz apendicular, pero es muy importante sospecharlo si la luz del apéndice es mayor de 13 mm o si existen calcificaciones a nivel de la pared o el contenido endoluminal3,14.
El diagnóstico apropiado de las neoplasias mu cinosas y el PMP es fundamental debido a que el ma nejo implica un seguimiento prolongado o tratamientos radicales como la cirugía citorreductiva con quimiotera pia intraperitoneal6,8.
Por lo antes expuesto, el tratamiento de las NMA es la apendicectomía con el objeto de respetar la integridad de la pieza quirúrgica. En caso de márge nes comprometidos por células neoplásicas o mucina, la opinión es controvertida. Algunos autores sugieren ampliar la resección y otros sostienen que es seguro el seguimiento médico incluso en caso de perforación15. La hemicolectomía derecha no ofrece ningún beneficio adicional sobre la apendicectomía sola para pacientes con LAMN8,10. Es mandatorio evitar una solución de continuidad de la totalidad de la pared del apéndice du rante el acto operatorio para impedir el vuelco de moco o células neoplasias a la cavidad peritoneal13,16.
Hay escasa evidencia acerca de cómo es el ma nejo posoperatorio y el seguimiento de las neoplasias confinadas al apéndice. Una estrategia razonable in cluye una tomografía de abdomen con contraste intra venoso, marcadores tumorales (CEA, CA 125, CA19.9) al año de la resección, disminuyendo la frecuencia en caso de controles normales4. En caso de seguimiento normal se discontinúa a los 5 años6,9,13,17,18.
La colonoscopia es recomendable para descar tar neoplasias sincrónicas4,6,20.
Objetivos
Presentar 4 casos clínicos de pacientes apen dicectomizados por el Servicio de Cirugía General ad mitidos en la Guardia del Sanatorio Parque (Centro de Emergencia Rosario) por cuadro de apendicitis aguda, durante el año 2019, con hallazgo de NMA en la anato mía patológica.
Presentación de casos
A continuación describiremos cuatro casos clí nicos. Detallamos en la tabla 1 los valores demográficos y de laboratorio.
En todos los casos se realizó tomografía com putarizada (TC) multicorte de abdomen y pelvis con contraste intravenoso para valorar diagnósticos dife renciales de abdomen agudo; en cada paciente se va loraron, antes de la administración de contraste, los an tecedentes de alergia a yodo intravenoso y la función renal; además, en el sexo femenino en edad fértil se protocolizó valorar por laboratorio la negatividad de subunidad beta, antes de la imagen con irradiación.
Caso N° 1
Paciente de 56 años, de sexo femenino, sin an tecedentes de jerarquía. Consulta por dolor abdominal de 5 días de evolución de comienzo periumbilical que luego se irradia a FID acompañado de registros febriles en las últimas 24 horas. Al examen físico presenta dolor en FID e hipogastrio con defensa. Se solicita tomografía computarizada (TC) de abdomen y pelvis (Fig. 1A).
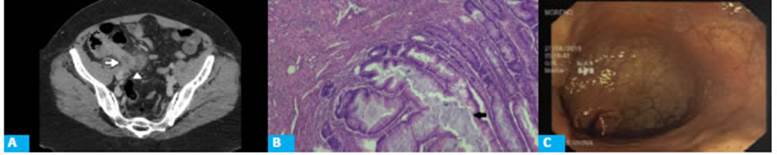
Figura 1 A: Plano axial de TC con contraste intravenoso en fase portal que muestra apéndice cecal con un diámetro máximo de 12 mm y área de dilata ción quística en su interior (flecha). En relación con la punta del apéndice se observa una colección de paredes definidas asociada a alteración de los planos grasos adyacentes (punta de flecha). B: Microscopia de pieza quirúrgica a ×10 con técnica de eosina y hematoxilina (E&H), que muestra lesión mucinosa de mucosa apendicular de bajo grado. Se aprecia margen tipo pushing, no infiltrativo (flecha). C: Fondo cecal sin particularidades mediante videocolonoscopia
Se realiza cirugía laparoscópica donde se evidencia plastrón apendicular. Se procede a la apendicectomía.
En la pieza quirúrgica se constata apendicitis aguda purulenta con periapendicitis y mesoapendicitis asociada a neoplasia mucinosa de la mucosa con displa sia de bajo grado y presencia de material mucinoso que compromete irregularmente la pared del órgano (Fig. 1.B). Margen quirúrgico con presencia focal de material mucinoso intraparietal.
En el día 30 de control posoperatorio, de forma ambulatoria, se realiza nueva tomografía de abdomen y laboratorio de control donde no se encuentran anor malidades. Se decide la realización de una videocolo noscopia (VCC). No se constatan anormalidades en el fondo cecal (Fig. 1.C). Se toman muestras de biopsia de ostium apendicular donde se constata mucosa dentro de parámetros normales.
Caso N° 2
Paciente de sexo masculino de 39 años, sin an tecedentes de jerarquía- Consulta por dolor abdominal de comienzo en epigastrio que luego se localiza en FID de 9 días de evolución, sin síntomas acompañantes. Se solicita TC de abdomen y pelvis (Fig. 2.A).

Figura 2 A: Plano coronal de TC con contraste in travenoso en fase portal que muestra apéndice cecal aumentado de calibre con un diámetro máximo de 10 mm (fle cha). Los planos grasos adyacentes se encuentran conservados. B: Microscopia de pieza quirúrgica a ×4 con técnica de E&H que muestra luz apendicular ocu pada por material mucinoso (flecha) y revestimiento de la mucosa por epitelio mucinoso de bajo grado de tipo velloso (punta de flecha).
Se decide laparoscopia donde se evidencia apéndice cecal aumentado de tamaño con tumor visi ble. Se realiza apendicectomía.
El diagnóstico patológico informa apéndice ce cal con lesión quística a nivel distal. NMA de bajo grado. Los márgenes de la pieza quirúrgica no presentan lesión aparente (Fig. 2.B).
Caso N°3
Paciente de 47 años de sexo masculino, sin an tecedentes médicos. Consulta por dolor abdominal difu so de 72 horas de evolución que se localiza en FID en las últimas 12 horas acompañado de hiporexia y registros febriles. Se solicita TC de abdomen y pelvis (Fig. 3.A).
Se procede a realizar videolaparoscopia. Se constata peritonitis apendicular localizada con plastrón en FID. En la anatomía patológica se observa NMA de bajo grado asociada a apendicitis aguda purulenta (Fig. 3.B).

Figura 3 A: Plano axial de TC con contraste intra venoso en fase portal que muestra apén dice cecal con un diámetro máximo de 11 mm (flecha). Se observa alteración de los planos grasos adyacentes y engrosa miento parietal del íleon distal (punta de flecha). B: Microscopía de pieza quirúrgi ca a x4 con técnica de E&H que muestra reemplazo de epitelio normal por epitelio mucinoso con signos de atipia de bajo grado (flecha). No se observa tejido lin foideo subyacente.).
Caso N°4
Un paciente de sexo masculino de 77 años con antecedente de hiperplasia prostática benigna e hiper tensión arterial ingresa en la Institución por presentar dolor en hemiabdomen inferior de 24 horas de evolu ción, de comienzo periumbilical, asociado a episodios febriles en las últimas horas. Se indica TC de abdomen y pelvis (Fig. 4.A).
Se indica laparoscopia donde, una vez ingre sado al abdomen, se observa plastrón apendicular con peritonitis localizada. En la anatomía patológica se diagnostica apendicitis aguda asociada a NMA de bajo grado con lagos de mucina en el espesor de la capa muscular a nivel del extremo distal (Fig. 4.B).

Figura 4 A: Plano coronal de TC con contraste in travenoso en fase portal que muestra apéndice cecal con un diámetro máximo de 11 mm (flecha), asociado a alteración de los planos grasos adyacentes y engro samiento parietal del íleon distal (pun ta de flecha). B: Microscopía de pieza quirúrgica a x4 con técnica de E&H que muestra lagos de mucina en el espesor de la pared apendicular (flecha)
Discusión
En nuestra Institución se realizó un total de 303 apendicectomías en el año 2019. En esta can tidad de cirugías se observó la presencia de neo plasia mucinosa apendicular en la anatomía pato lógica como hallazgo posquirúrgico en 4 pacientes.
Debido a la poca frecuencia que presenta esta patología, nos resultó llamativo ese número, y, por tal motivo, decidimos presentar este artículo.
En nuestra experiencia, todos los pacientes presentaron síntomas agudos compatibles con apendi citis aguda. El síntoma más común fue el dolor abdo minal localizado en fosa ilíaca derecha acompañado de defensa localizada sin peritonismo y con cronología de Murphy.
En ningún caso las imágenes tomográficas fueron complementarias de la sospecha de NMA; por este motivo, el diagnóstico siempre fue retros pectivo. Si bien la prevalencia es mayor en mujeres en relación 4:1, observamos que en nuestros pacien tes predominó el sexo masculino en el 75% de los casos; esto se explica dado que la presentación de casos se halla sesgada por una población con un nú mero bajo de pacientes para sacar una conclusión del comportamiento demográfico de la patología.
Conclusión
Ante presentaciones clínicas de dolor crónico a nivel de FID, y en cuadro de abdomen agudo por apen dicitis aguda que presente un diámetro de su luz ma yor de 13 mm o calcificaciones de pared valorado por imágenes complementarias, el diagnóstico de sospecha principal es la NMA2,3.
En estos casos hay que extremar los cuidados durante el acto operatorio para evitar la perforación de la pared apendicular y la consiguiente siembra perito neal de células neoplásicas o moco13,16.
Una de las complicaciones más temidas de la NMA es el desarrollo de PMP, por lo que el seguimiento posoperatorio adquiere una importancia vital en estos pacientes2.











 texto en
texto en 



