Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de nefrologia, dialisis y trasplante
versión On-line ISSN 2346-8548
Rev. nefrol. dial. traspl. vol.34 no.4 Ciudad Autónoma de Buenos Aires dic. 2014
CASUÍSTICA
MUJER EN HEMODIÁLISIS POR AMILOIDOSIS AA, DESNUTRIDA POR COMPROMISO DIGESTIVO
WOMAN ON HEMODIALYSIS BECAUSE OF AMILOIDOSIS AA, UNDERNOURISHED DUE TO DIGESTIVE COMPROMISE
Fernando Segovia, Hernán B. Sarzuri Marca, Liliana E. Olivieri, Pablo Barbero
Instituto de Nefrología del Oeste, Buenos Aires
e-mail: dr.fernandosegovia@gmail.com
Nefrología, Diálisis y Trasplante 2014; 34 (4) Pág. 199 - 207
Recibido: 2 de julio de 2014
Aceptación final: 1 de agosto de 2014
Paciente mujer, de 42 años de edad, con diagnóstico a los 19 años de Artritis Reumatoidea (AR), seropositiva y erosiva, con destrucción de articulaciones de la rodilla, y cambios radiológicos con pinzamientos y erosión en manos, pies y hombros.
Evoluciona de forma refractaria a diversos tratamientos no biológicos, con drogas antirreumáticas modificadoras de enfermedad (DMARDs: metotrexate, sulfasalazina, hidroxicloroquina, leflunomida); con progresión de la enfermedad y severa discapacidad funcional, que requirió reemplazo de la articulación de ambas rodillas (1998 y 2005).
En 2006 comenzó con edemas, principalmente en miembros inferiores; automedicada con diuréticos, sin controles clínicos durante todo ese año.
En 2007 consulta por edemas generalizados, anorexia, vómitos, astenia y adinamia. Se diagnostica Síndrome Nefrótico y Síndrome Urémico, por lo cual se inicia tratamiento sustitutivo de la función renal en la modalidad hemodiálisis, en marzo de 2007.
Ese mismo mes, se realiza punción biopsia renal (PBR). La muestra tenía 23 glomérulos, de los cuáles 22 estaban globalmente esclerosados, con depósitos nodulares de material amorfo, homogéneo, PAS negativo, Rojo Congo y Tioflavina T positivos. El glomérulo restante con nódulos, depósitos subendoteliales y escasos capilares conservados. Severo daño tubulointersticial (atrofia tubular, fibrosis intersticial > 50 %, y abundantes infiltrados mononucleares).
Inmunofluorescencia: Ig G ++, IgM++, c1q y c3 +. Diagnóstico histopatológico: amiloidosis renal.
Se confecciona acceso A-V definitivo, quedando en plan dialítico crónico.
Persistió con actividad de la artritis reumatoidea a nivel sistémico, con importante compromiso articular, especialmente en rodilla, que requirió punción de dicha articulación para diagnóstico diferencial (el material obtenido fue de tipo inflamatorio).
Durante el curso de estos años, realiza frecuentes trasgresiones alimentarias con sobrepesos importantes e hipertensión volumen dependiente, con buena función ventricular.
Episodios reiterados de diarreas, inicialmente ante trasgresiones alimentarias, progresando en frecuencia a través de los años de manera pertinaz. Se realizó Fibroendoscopía Digestiva Alta (FEDA) con biopsia de tubo digestivo, con hallazgos incaracterísticos en estómago y compromiso amiloide en duodeno.
Se inició terapia biológica con Anti-TNFα (Etanercept) 50 mg/sem en mayo de 2008, asociado a metotrexate 2,5 mg/sem.
En diciembre de 2008 (intratratamiento con Etanercept y Metotrexate) se evidencia una masa blanda, elástica, indolora, de crecimiento progresivo en región cervical, que llega a ser de grandes dimensiones, constatándose por ecografía que era glándula tiroidea de aproximadamente 120 gramos y de predominio de lóbulo derecho. Se realiza punción aspirativa con aguja fina (PAAF), siendo estudiada la muestra con técnica de Tioflavina T y Rojo Congo, dando ambas positivas. Se realiza diagnóstico de bocio amiloide gigante con función tiroidea normal.
En enero de 2009 se realiza nueva punción de rodilla, con liquido articular con hallazgos vinculables a sinovitis por enfermedad del colágeno, sin amiloide. Ante la falta de respuesta articular y sistémica favorable, dicho mes se suspende Etarnecept.
En mayo de 2009 se transfunde con 2 unidades de Glóbulos Rojos por presentar un Hto de 18%. No se detectaron signos evidentes de sangrado. La Sangre Oculta en Materia Fecal fue negativa. Recibía igual dosis de Eritropoyetina y de Hierro intravenoso que los meses anteriores. Se suspende en ese momento el Metotrexate.
En agosto de 2009, se realiza TAC de cuello, que muestra glándula tiroidea deformada y agrandada (bocio), especialmente lóbulo derecho (4,7 por 4,2 cm), más que el izquierdo (2,7 por 2,2cm); desplazando la laringe, sin disminución de la luz aérea; se extendía hasta el hueco supraesternal sin invadir mediastino, y presentaba un granuloma calcificado en lóbulo inferior derecho.
El Ecocardiograma realizado demostraba una función sistólica conservada.
Ante el fracaso del tratamiento recibido para el compromiso sistémico persistente (actividad inflamatoria poliarticular, amiloidosis tiroidea y duodenal), se decide iniciar en noviembre de 2009 Tocilizumab 8 mg/kg IV mensualmente. Se evidencia en pocas semanas buena respuesta articular y sistémica. Se interrumpe a los 7 meses dicho tratamiento por problemas en su suministro (mayo de 2010).
Se realiza Tiroidectomía total en enero de 2011, con diagnóstico anatomopatológico de bocio amiloide. Se transfunde 1 unidad de Glóbulos Rojos.
Durante 2011 se acentúan los episodios diarreicos, con frecuentes desconexiones durante las sesiones de hemodiálisis por dicho motivo.
En Noviembre de 2011 se detecta derrame pleural y ascitis, evidenciando descenso de peso seco. La paciente se negaba hasta entonces a mayores ultrafiltraciones y desciende consiguientemente de peso, durante las diálisis.
Desde comienzos de 2012, persiste con pérdida de peso progresiva en el contexto de diarreas crónicas incoercibles, con cuadro compatible con desnutrición calórico-proteica severa (masa muscular y grasa corporal subcutánea severamente deplecionada, extrema debilidad que la postraba, pérdida de cabello, etc.).
Se realiza en septiembre de 2012 videoendoscopia alta (gastropatía erosiva de techo gástrico con múltiples tomas de estómago y duodeno) y videocolonoscopía (hemorroides internas, preparación subóptima). Los estudios parasitológicos fueron negativos. Las biopsias informaban inflamación y abundantes depósitos de amiloide.
En octubre de 2012, se inicia alimentación parenteral intradiálisis. Se intentan medidas locales sobre tubo digestivo (dieta astringente, antidiarreicos, colestiramina, etc.) con resultados irregulares.Requirió nuevamente transfusiones en enero y abril de 2013. Habitualmente concurría asténica; en ocasiones en silla de ruedas, pese a las transfusiones.
Recibió irregularmente Alimentación Parenteral Intradialítica 1.000 ml por sesión (1200 calorías por sesión ), y suplementos orales,1 a 2 latas por día (475 calorías cada lata). Este apoyo dietético se intensificó en marzo de 2013, cuando llegó al nadir de la curva de peso (con 36,5 kg). Dichas medidas permitieron mejorar parcialmente el cuadro nutricional, aumentando a 38,5 kg, los meses siguientes.
En julio de 2013 se reinició la terapia con Tocilizumab en pulsos mensuales de 8 mg/kg de peso. Respondió favorablemente a partir de la segunda semana, con mejoría del estado general y del cuadro digestivo. Al mes, se suspendió el aporte dietético intradialítico, y al segundo mes ya toleraba adecuadamente la dieta.
La mejoría progresiva del estado nutricional se manifestó con aumento progresivo del peso seco, de 36,2 kg en julio de 2013, a 47 kg, a los 10 meses de tratamiento, a expensas del aumento y tolerancia de la ingesta calórico-proteica. (Figura 2 y 3).
En forma paralela a este fenómeno, se observó mejoría de los valores de laboratorio (albúmina de 2,14 a 3,5 g/l, Colesterol de 58 a 128 , Ureas pre-diálisis de menores de 80 a mayores de 100 mg/dl, Creatininas de menos de 3,8 mg/dl a 8,7 mg/dl).
Asimismo, comenzó a responder a la Eritropoyetina, con corrección de la anemia en paciente previamente resistente a la misma (el Hematocrito llegó a 36,2, para previos 10 meses antes de aproximadamente 25%, en parte logrado con transfusiones) (Figura 1).
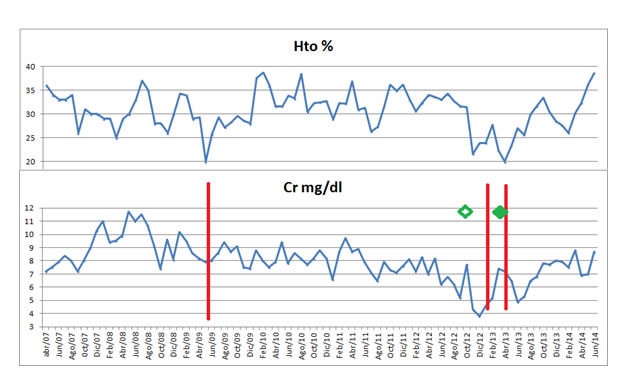
Figura 1.Comportamiento de los niveles de creatinina y el hematocrito a través de la evolución de la paciente. Las líneas marcan las transfusiones recibidas. En rombo hueco, inicio de tratamiento nutricional supletorio (oral e intravenoso intradiálisis), en rombo lleno, cuando se aumenta dicho aporte.
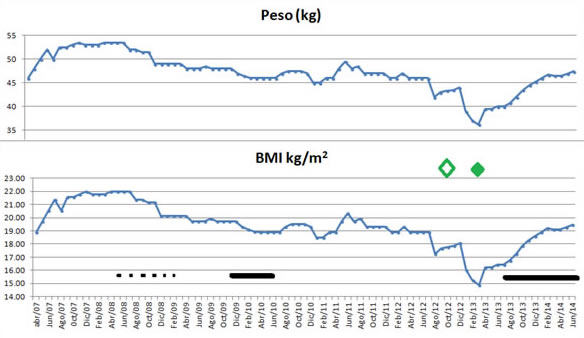
Figura 2. Comportamiento del peso seco y BMI. Línea punteada muestra el período que recibió Etarnecept. La línea llena el período de Tocilizumab. Los rombos muestran el aporte dietético al igual que en figura anterior
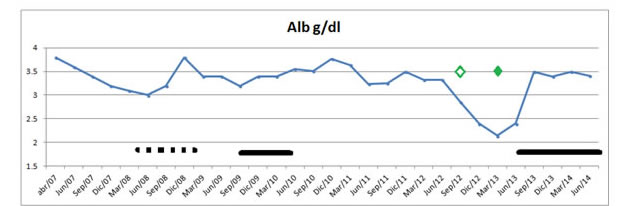
Figura 3. Se muestra el comportamiento de la Albúmina sérica, referidos a los mismos tratamientos que en figura 2
Como intercurrencia, durante el período de tratamiento con Tocilizumab, presentó en diciembre de 2013 episodio de palpitaciones en el contexto de extrasístoles ventriculares frecuentes, por lo que luego de ser valorada por Cardiología, se inicia tratamiento con dosis bajas de beta-bloqueantes.
Continua hemodializando sin haber presentado otras alteraciones, sin signos inflamatorios por su enfermedad de base, ni alteraciones digestivas derivadas de la amiloidosis.
Tratamiento actual: Levotiroxina 175 mcg/día, Nevibolol 2.5 mg/día, Omeprazol 40 mg/día, Deltisona 8 mg/día, Ácido fólico 10 mg/día, Complejo B1 B6 B12 1 comp/día, Carbonato de Calcio 3 x día, Alprazolam 0.25 mg/día, Eritropoyetina 12.000 U/semana, Fe Sacarosa IV, 400 mg mensuales y Tocilizumab 8 mg/kg IV mensual.
DISCUSIÓN
La artritis reumatoidea es una enfermedad autoinmunitaria, crónica e inflamatoria que afecta articulaciones y otros órganos. Es más común en mujeres de mediana edad.
El tejido renal puede ser afectado de distinta manera, tanto por la AR como por algunos tratamientos (antiinflamatorios, penicilamina, sales de oro). La persistencia del fenómeno inflamatorio, per se, puede desencadenar una de las complicaciones más temidas: la amiloidosis renal (habitualmente también con afectación sistémica), la cuál está asociada a mayor morbi-mortalidad.
El término Amiloidosis es usado para englobar distintas enfermedades que tienen en común el depósito extracelular de proteínas fibrilares insolubles de aspecto amorfo, en diferentes tejidos y órganos, condicionando alteraciones funcionales y estructurales según la localización e intensidad del depósito.
Se denominó «amiloide» en el siglo XIX, cuando fue descripta por Virchow, por la suposición en base a las características tintoriales, de que dichos depósitos contenían almidón.
Las proteínas depositadas son diversas, de bajo peso molecular, beta-plegadas y sin relación en su secuencia primaria de aminoácidos, haciendo que las enfermedades por amiloide se clasifiquen de acuerdo a si son sistémicas o localizadas, adquiridas o hereditarias, y por sus patrones clínicos conocidos.
La sustancia amiloide tiene dos componentes: el común y el específico. El componente común, presente en los depósitos de todas las amiloidosis, es una proteína denominada componente amiloide P (AP), que deriva del componente amiloide sérico (SAP), una proteína habitual del suero de las personas sanas. El componente común representa el 15-20 % del peso seco de la sustancia amiloide. El componente específico es una proteína que define el tipo de amiloidosis.
La llamada Amiloidosis Primaria (AL) presenta en los depósitos fibrillas compuestas por fragmentos de cadenas livianas kappa o lambda, frecuentemente asociada con Mieloma Múltiple o discrasias de células plasmáticas. En algunos casos es idiopática. Se denominan fibrillas de tipo AL.
En la Amiloidosis Secundaria (AA) las fibrillas están compuestas de fragmentos de amiloide sérico A (SAA), un reactante de fase aguda.
Complica una serie de enfermedades crónicas infecciosas (TBC, Bronquiectasias, Osteomielitis, Lepra) o inflamatorias (Artritis Reumatoide, Espondiloartritis, LES, Fiebre Mediterránea Familiar, etc.), en especial los pacientes con niveles persistentemente elevados de la proteína SAA.
Otros tipos de amiloidosis incluyen: la asociada a tratamiento prolongado en diálisis (que no es el caso presentado), en la cual el material amiloide es la beta2 microglobulina, las asociadas a distintos tipos de polineuroptías y miocardiopatías, muchas de ellas con nefropatía, hereditarias o esporádicas (donde las proteínas depositadas pueden ser Transtirretina o pre-albúmina, Apolipoproteína I y II, Lisozima, variantes del Fibrinógeno, Gelsolina, etc.), asociadas al Alzheimer y al síndrome de Down (proteína amiloide beta), asociada al compromiso auricular (factor natriurético atrial), al carcinoma medular de tiroides (calcitonina), etc. La Amiloidosis secundaria (AA) agrava las enfermedades de base con una morbimortalidad significativa debido a insuficiencia renal terminal, infección, insuficiencia cardíaca, perforación intestinal o hemorragia gastrointestinal.
En una revisión desde 1992 hasta el 2004, un grupo de Barcelona ha encontrado compromiso renal en el 75 % sobre 76 casos (filtrado glomerular menor de 60 ml/min en el 69 % y el 37 % con proteinuria masiva), el 28% evolucionó a insuficiencia renal grado V en un tiempo medio de 8,1 ± 9,8 meses, iniciando diálisis 14 pacientes (10 HD, 4 CAPD). En 7 casos (33 %) no recibieron tratamiento dialítico por la importante afectación del estado general y la mala calidad de vida. La supervivencia actuarial global desde el momento del diagnóstico fue de 55 % y 40 % a los 12 y 24 meses (AL 58 % y 19 %; AA 55 % y 44 %). La supervivencia actuarial desde el inicio de diálisis, fue de 30 % y 5 % a los 12 y 24 meses.
Otro grupo de la misma región, analizando amiloidosis secundaria desde enero de 1988 hasta noviembre de 2002, sobre 31 pacientes con edad media de 58,43 ± 15,7 años,
13 varones y 18 mujeres, encontró que el 61 % de los pacientes presentaban insuficiencia renal (IR) en el momento del diagnóstico (Creatinina mayor de 1,5 mg/dl), el 90 % proteinuria (media de 5 ± 3,9 g/dia), el 77 % edemas y el 45 % hematuria. (tabla 1)
Tabla 1. Muestra distintos tipos de amiloidosis, con las proteínas amiloides más características y los órganos más comprometidos
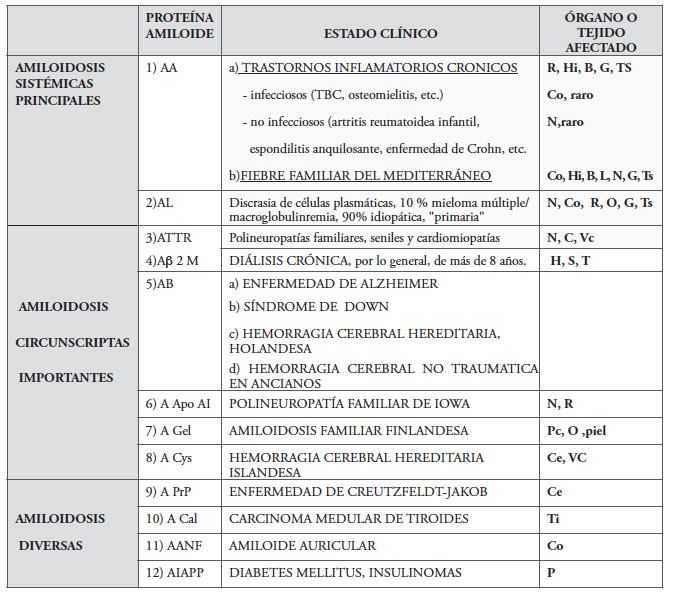
Referencias de proteínas amiloides: AA proteína A reactante de fase aguda, AL cadena liviana de inmunoglobulina, A β2 M β2 microglobulina, ATTR transtiretina o pre-albúmina, AB amiloide beta, A Apo AI Apolipoproteína A-I, GEL gelsolina, Cys cistatina C, APrP asociada a priones, A CAL amiloide calcitonina, AANF amiloide factor atrial natriurético, A1A PP amiloide insular.
Referencias de órganos más afectados: B bazo Ce cerebro Co corazón G gastrointenal Hi hígado Hu hueso L lengua N nervio O ojo P páncreas R riñón S sinovial T tenosinovitis Ti tiroides Ts tejido subcutáneo
La supervivencia libre de diálisis fue del 67% ( 90,9% en los que no tenían IR y 51,1% los que presentaban IR) a los 12 meses y 54% (77,9% no IR, 38,2% IR) a los 24 meses (p = 0,017). El 42% (n:13) de los pacientes entraron en programa de diálisis (10 hemodiálisis y 3 DPCA). La supervivencia de estos pacientes a partir de la entrada en diálisis fue del 68% a los 6 meses y del 43% a los 12 meses.
Las principales complicaciones fueron la infección (55%) y la hemorragia (25%). Las causas de muerte fueron infecciosas (46,6%), hemorragia (33,3%) y cardiovascular (6,6%).
Estos datos de escasa supervivencia, coinciden con nuestra experiencia en este tipo de pacientes en plan de diálisis, los cuáles presentaban históricamente inadecuada tolerancia al procedimiento y menor sobrevida (aún menor que la de los diabéticos).
El compromiso amiloide ocurre en los pacientes con actividad de la enfermedad sostenida en el tiempo, con niveles muy elevados de la proteína SAA como factor sine qua non, pero en solo un pequeño porcentaje de los mismos, desconociéndose la etiopatogenia y los factores de riesgo. La persistente inflamación incrementa la liberación de Factor de Necrosis Tumoral ( FNT), InterLeuquina 6 (IL-6) e InterLeuquina 1 (IL-1), las cuales estimulan en hígado la síntesis de SAA (aumenta 100 a 1.000 veces). Factores tales como proteasas, proteinglicanos y el componente amiloide sérico P (SAP), entre otros, intervendrían en la patogénesis y formación de las fibrillas AA, las cuáles son fundamentalmente fragmentos N-terminal de la SAA.
El compromiso gastrointestinal en la Amiloidosis reactiva o tipo AA llega al 60%, en especial en la Artritis Reumatoidea, siendo menos frecuente en la Amiloidosis AL y aparentemente no tan común en la asociada a beta2 microglobulina.
Se ve con infiltrado de la mucosa o a nivel del sector neuromuscular. Mayor compromiso se evidencia en duodeno, luego estómago y colo-recto. La afectación autonómica también puede dar sintomatología digestiva, con tránsito lento.
En el tipo AA el infiltrado fundamentalmente de la mucosa genera friabilidad de la misma con erosiones y presentando habitualmente diarrea y síndrome de malabsorción, a veces hemorragia digestiva. En la AL infiltra más profundamente produciendo engrosamiento y protrusiones de las válvulas de Kerckring en intestino delgado, expresándose frecuentemente con constipación, obstrucción mecánica o pseudoobstrucción intestinal crónica.
El compromiso digestivo puede mejorar con el tratamiento y control de la causa de la amiloidosis, tanto el control del proceso inflamatorio en la forma AA o el tratamiento del Mieloma en la forma AL.
La diarrea severa, según algunos reportes, puede responder a corticoides y análogos de la somatostatina.
Se ha visto muy buena respuesta en el tipo AA con el control de la enfermedad inflamatoria o infecciosa. Al suprimir o eliminar la inflamación o la infección también disminuye la proteína SAA.
Se cuenta actualmente con un gran arsenal terapéutico para controlar la actividad de la AR. Son los llamados DMARDs (Disease Modifying Anti-Rheumatic Drugs), los tradicionales, o no biológicos, y los biológicos.
Hay distintas estrategias en su uso, a fin de controlar las sinovitis, la progresión radiológica y otros compromisos, como la amiloidosis. El tratamiento inicial debe realizarse con los DMARDs tradicionales (metotrexate, hidroxicloroquina, sulfasalazina, leflunomida y menos usados, por menos eficaces y más tóxicos: la azatioprina, la ciclosporina, sales de oro, minociclina,etc.)
El uso de antiinflamatorios y corticoides debe ser solo como apoyo para controlar los síntomas, hasta que hagan efecto los DMARDs.
Se inicia con uno de ellos (el de mayor uso es el metotrexate) y si hay resistencia (falta de control total o parcial dentro de los 3 a 6 meses de la dosis máxima), se asocia con otro DMARDs no biológico en doble o triple terapia. De persistir el paciente resistente, habitualmente se recomienda seguir con metotrexate y un biológico (el anti-FNT etanercept). Si no responden a este esquema en 6 meses, debe cambiarse a otro biológico con otro mecanismo de acción, con o sin metotrexate.
Dentro de los biológicos, se usan los anti-FNT (anti-TNF en la nomenclatura inglesa), siempre como primer alternativa de este grupo (etarnecept en especial, el infliximab y otros más modernos, pero con menos experiencia: adalimumab, certolizumab y golimumab). Si estos fallan, se debe pasar a los anti InterLeuquina-6 (Tocilizumab). Parecería ser menos eficaz los antagonistas de Interleukina -1 (Anakinra)
El uso de productos biológicos con actividades contra las citoquinas proinflamatorias (TNF-alfa, IL-1 e IL-6) en AR, la artritis psoriásica y la espondilitis anquilosante, disminuiría el riesgo para desarrollar amiloidosis AA, y podría aún revertirla. De hecho, a partir de los 90, estos agentes han revolucionado el tratamiento de la AR en especial.
La eficacia de los antagonistas de TNF, parece estar directamente relacionada con su capacidad para reducir los niveles de amiloide A sérico (SAA), y sería más efectivo con pulsos de corticoides para la inducción. La regresión del tejido amiloide ocurriría tan pronto como en tres meses, con casos documentados por biopsias gastrointestinales.
El Tocilizumab (inhibidor de IL-6) es un anticuerpo humanizado contra el receptor humano de la IL-6 aprobado para la AR (tanto en EEUU como Europa y Japón). Ha demostrado ser más efectivo que el metotrexate solo, y sería más efectivo que los Anti- FNT. Puede producir dislipemia y leve aumento del riesgo de infecciones. No incrementó las tasas de malignidad, reactivación de tuberculosis ni hepatitis.
El grado de depósitos de amiloide podría chequearse, controlando la respuesta al tratamiento, con scintigrafía con I123- SAP. El inconveniente que la proteína SAP se obtiene de donantes e implica cierto riesgo infeccioso.
Medicamentos usados para prevenir la amiloidosis AA en las distintas etiologías han sido:
Colchicina: usada precozmente previene la amiloidosis secundaria en la fiebre mediterránea familiar (FMF). Hay reportes de éxito en enfermedad inflamatoria crónica y en enfermedad de Behçet.
Dimetilsulfóxido (DMSO): informes de casos de pacientes con amiloidosis AA secundario a AR o a la enfermedad de Crohn.
Citotóxicos y agentes inmunosupresores, entre ellos la ciclofosfamida en AR
Anticitoquinas o agentes biológicos: ya comentados en tratamiento de la AR.
La terapia con anticitoquinas también es una opción para los pacientes sometidos a trasplante renal, como profilaxis para prevenir la recurrencia de amiloidosis AA en el aloinjerto; además, el inhibidor de la calcineurina FK506 (tacrolimus), que se utiliza comúnmente para prevenir el rechazo del aloinjerto, también puede retardar la progresión de amiloidosis AA, con base en estudios en animales.
1. Elkayam O, Hawkins PN, Lachmann H, et al. Rapid and Complete Resolution of Proteinuria Due to Renal Amyloidosis in a Patient With Rheumatoid Arthritis Treated With Infliximab. Arthritis & Rheumatism 2002 46; 2571â73. [ Links ]
2. Esteve V, Almirall J, Ponz E, et al. Afectación renal en la amiloidosis. Características clínicas, evolución y supervivencia. Nefrología 2006; 26: 2. [ Links ]
3. Hattori Y, Ubara Y, Sumida K, et al. Tocilizumab improves cardiac disease in a hemodialysis patient with AA amyloidosis secondary to rheumatoid arthritis. Amyloid 2012; 19: 37-40. [ Links ]
4.- Herrera RN. Amiloidosis. Revista de la Facultad de Medicina UNT 2005; 6: 3-7. [ Links ]
5.- Inoue D, Arima H, Kawanami C, et al. Excellent therapeutic effect of tocilizumab on intestinal amyloid a deposition secondary to active rheumatoid arthritis. Clin Rheumatol 2010; 29: 1195-97. [ Links ]
6.- Kuroda T, Otaki Y, Sato H, et al. A case of AA amyloidosis associated with rheumatoid arthritis effectively treated with Infliximab. Rheumatol Int 2008; 28: 1155. [ Links ]
7. Kuroda T, Wada Y, Kobayashi D, et al. Effective anti-TNF-alpha therapy can induce rapid resolution and sustained decrease of gastroduodenal mucosal amyloid deposits in reactive amyloidosis associated with rheumatoid arthritis. J Rheumatol 2009; 36: 2409. [ Links ]
8. Lee CK, Park JY, Shim JJ, Jang JY. Successful treatment with anti-tumor necrosis factor alpha for reactive small-bowel amyloidosis. Endoscopy 2011; 43 Suppl 2 UCTN: E326. [ Links ]
9. Nakamura T, Higashi S, Tomoda K, Tsukano M, Baba S, Shono M. Significance of SAA1.3 allele genotype in Japanese patients with amyloidosis secondary to rheumatoid arthritis. Rheumatology (Oxford) 2006; 45: 43-49. [ Links ]
10. Nishida S, Hagihara K, Shima Y, et al. Rapid improvement of AA amyloidosis with humanized anti-interleukin 6 receptor antibody treatment. Ann Rheum Dis 2009; 68: 1235-6. [ Links ]
11. Okuda Y, Ohnishi M, Matoba K, et al. Comparison of the clinical utility of tocilizumab and anti-TNF therapy in AA amyloidosis complicating rheumatic diseases. Mod Rheumatol 2014; 24: 137. [ Links ]
12. Okuda Y, Takasugi K. Successful use of a humanized anti-interleukin-6 receptor antibody, tocilizumab, to treat amyloid A amyloidosis complicating juvenile idiopathic arthritis. Arthritis Rheum 2006; 54: 2997. [ Links ]
13. Park YK, Han DS, Eun CS. Systemic amyloidosis with Crohnâs disease treated with infliximab. Inflamm Bowel Dis 2008; 14: 431. [ Links ]
14. Sato H, Sakai T, Sugaya T, et al. Tocilizumab dramatically ameliorated life-threatening diarrhea due to secondary amyloidosis associated with rheumatoid arthritis. Clin Rheumatol 2009; 28: 1113-1116. [ Links ]
15. Shin JK, Jung YH, Bae MN, et al. Successful treatment of protein-losing enteropathy due to AA amyloidosis with octreotide in a patient with rheumatoid arthritis. Mod Rheumatol 2013; 23: 406. [ Links ]
16. Song SN, Tomosugi N, Kawabata H, et al. Down regulation of hepcidin resulting from long- term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010; 116: 3627-34. [ Links ]
17. Torregrosa E, Hernández-Jaras J, Calvo C, et al. Amiloidosis secundaria (AA) y afectación renal. Nefrología 2003; XXIII: 321-26. [ Links ]
18. Yasuaki Okuda, Kioshi Takasugi. Succesful use of a humanized anti-interleukin-6 receptor antibody, tocilizumab, to treat amuloid A amuloidosis complicating Juvenile Idiopathic Arthritis. Arthritis & Rheumatism 2006; 54: 2997-3000. [ Links ]














