Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Lilloa
versión impresa ISSN 0075-9481versión On-line ISSN 2346-9641
Lilloa vol.53 no.2 San Miguel de Tucumán dic. 2016
Estudio anatómico-histológico de las flores del endemismo Lamottea diania (Asteraceae) y de los efectos del ozono troposférico sobre su desarrollo
García-Breijo, Francisco J.1-2*; Vicente Calatayud3; José Reig-Armiñana2
1 Departamento de Ecosistemas Agroforestales. Universitat Politécnica de Valencia. Camino de Vera s/n, (46022) Valencia (España)
2 Laboratorio de Anatomía Vegetal «Julio Iranzo». Jardín Botánico de la Universitat de Valéncia. ICBIBE C/ Quart, 81. (46008) Valencia (España)
3 Fundación CEAM, c/ Charles R. Darwin 14, Parque Tecnológico, (46980) Paterna, Valencia, (España).
* Autor corresponsal: fjgarci@eaf.upv.es
Resumen
Plantas del endemismo Lamottea diania se expusieron en cámaras OTC (Open Top Chambers) a aire ambiente filtrado y a aire ambiente no filtrado más 30 ppb de ozono para observar el efecto de este contaminante sobre el desarrollo de sus flores, particularmente sobre su androceo. Hemos comprobado, mediante estudios de microscopía óptica y electrónica, que el ozono afecta el proceso de desarrollo y maduración de los estambres y del polen. Las anteras se ven afectadas, en unos casos al abortar algunos estambres en su desarrollo y, en otros, impidiéndose el desarrollo correcto de los sacos polínicos en el interior de las mismas. Asimismo, el ozono impide la formación correcta del polen encontrando numerosos granos de polen sin desarrollar o desarrollados y madurados de forma anómala en el interior de los sacos polínicos. Los resultados indican que el ozono es el responsable del desarrollo anormal del androceo y del polen en plantas de L. diania.
Palabras clave: Anatomía; Carthamus dianius; endemismo; esporogénesis; estrés abióti-co; histología floral; ozono; polen; ultraestructura.
Abstract
Plants of endemism Lamottea diania were exposed in cameras OTC (Open Top Chambers) to filtered ambient air and ambient air unfiltered over 30 ppb ozone to observe the effect of this pollutant on the development of its flowers, particularly on its androecium. We have found, through studies of optical and electron microscopy, that ozone affects the process of development and matura-tion of stamens and pollen. The anthers are affected, in some cases by aborting some sta-mens in their development and in other, prevented the proper development of the pollen sacs within them. In addition, ozone prevents proper formationand maturation of pollen found many undeveloped pollen grains or developed abnormally inside the pollen sacs. Results indicate that ozone was responsible for the abnormal development of androecium and pollen in L. diania.
Keywords: Abiotic stress; anatomy; Carthamus dianius; endemism; floral histology; ozone; pollen; sporogenesis; ultrastructure.
Recibido: 29/06/16 - Aceptado: 11/10/16
INTRODUCCIÓN
En la actualidad, el ozono (O3) troposférico se considera uno de los contaminantes atmosféricos más importantes del planeta y el más importante de los que actúan sobre las plantas (Ainsworth et al., 2012; Ashmo-re, 2005; IPCC, 2013; Karnosky et al., 2007; Matyssek et al., 2007, Paoletti, 2007, Wittig et al., 2009), causando graves pérdidas en cosechas (Asensi-Fabado, 2007; Asensi-Faba-do et al., 2010) e induciendo una serie de efectos perjudiciales en la vegetación nativa (Krupa et al., 2001). Durante las pasadas décadas, se ha observado un incremento global del O3 troposférico, especialmente en el Hemisferio Norte. Esto ha sido atribuido inicialmente al incremento en los precursores del O3 de origen antropogénico (Volz y Kley, 1988). El Mediterráneo es un área crítica para la formación de fotooxidantes (Millán et al., 1992; Sanz et al., 2007). Es una zona densamente poblada (abundan por lo tanto los precursores del O3) que se ha descrito como un gran reactor fotoquímico donde la intensa radiación solar, las altas temperaturas y los procesos de recirculación de las masas de aire contaminadas favorecen la formación de este contaminante (Lelieveld et al., 2002; Millán et al., 1996, 1997, 2002; Sanz y Millán, 1998). Como consecuencia, las concentraciones de O3 alcanzan niveles fitotóxicos especialmente en verano (Bussotti y Ferretti, 1998; Fumagalli et al., 2001; Reinert et al., 1992; Sanz y Millan, 1998, 2000; Velissariou et al., 1992).
Hasta ahora, muy pocos trabajos se han realizado sobre los efectos que los agentes contaminantes tienen sobre las especies vegetales endémicas o raras. Algunos trabajos no publicados han estudiado los efectos del ozono sobre las hojas de Lamotea diania (Webb.) G. López (Asteraceae) (Serna-Riddell, 2006) o sobre las flores de Centran-thus ruber (L.) DC. (Valerianaceae) (García-Sebastiá, 2006). Las especies con poblaciones relativamente pequeñas pueden ser más vulnerables a la contaminación y a otras amenazas no sólo debido a sus reducidas áreas de distribución o al bajo número de individuos, sino también a su más baja variabilidad genética, que puede limitar sus posibilidades de adaptación a los cambios en su hábitat. Desde un punto de vista botánico, la región mediterránea es el área más diversa de Europa, con muchas plantas que son bien endémicas o/y de distribución reducida. Como ejemplo, de las 9000 especies de la flora española, 1571 taxa se enumeran en la lista roja (Moreno, 2008), y más de 400 están en peligro.
Una de las maneras de identificar los impactos del O3 en una planta es la observación de lesiones en las hojas visibles en las especies sensibles (Feng et al, 2014; Schaub y Calatayud, 2013). Con el fin de identificar correctamente los síntomas de O3 de otros producidos por otros factores bióticos o abióticos, los estudios de microscopía han demostrado ser una herramienta muy útil (Günthardt-Goerg y Vollenweider, 2007; Vo-llenweider et al., 2003). A diferencia de otros contaminantes, el O3 no se acumula en los tejidos celulares, pero induce una serie de cambios anatómicos y ultraestructurales característicos que pueden variar en diferentes plantas (Bussotti et al., 2005; Calatayud et al., 2011; García-Breijo et al., 2008; Reig-Armiñana et al., 2004; Vollenweider et al, 2003). Las observaciones de campo, sin embargo, tienen que ser apoyadas por estudios de referencia en condiciones controladas o semi-controladas (en Open Top Cham-bers (OTC) o en otros sistemas de exposición), en el que las respuestas de las diferentes especies a O3 pueden reproducirse y caracterizarse.
El ozono puede afectar directamente a las estructuras reproductivas, a saber, superficies del estilo o del estigma, polen, anteras, frutos y semillas. Las concentraciones actuales de O3 disminuyen significativamente el número de semillas (-16%), el número de frutos (-9%) y el peso de los frutos (-22%) en comparación con el aire filtrado (Black et al., 2000). Además, la germinación del polen y el crecimiento del tubo polínico disminuyen con concentraciones elevadas de O3 en comparación con el aire filtrado (Leisner y Ainsworth, 2012).
Ya se han realizado estudios sobre la vulnerabilidad de L. diania a los niveles cada vez mayores de ozono troposférico (Calata-yud et al., 2011). Estos estudios han complementado unos preliminares donde se demostró que el ozono también producía efectos deletéreos en la reproducción de esta especie, incluyendo una reducción significativa en el número de flores producidas por la planta, y un aumento en la producción alterada del polen (García-Breijo et al., 2005).
El objetivo principal del trabajo es el estudio anatómico-histológico a nivel estructural y ultraestructural del efecto producido por el ozono troposférico sobre las anteras de L. diania y, especialmente, sobre su desarrollo ontogénico y sobre la producción de polen e intentar correlacionar estos efectos con las dificultades reproductoras de esta especie que puedan poner en peligro su continuidad.
Lamottea diania (Webb) G. López (sin. Carthamus dianius Webb) es un nanofaneró-fito, hierba de tronco leñoso que forma unos capítulos con flores de color blanco amarillento y brácteas espinescentes.Tiene hojas basales muy divididas en lóbulos lanceolados (Fig. 1). Florece en los meses de mayo y junio.
Las poblaciones más importantes (Fig. 2) y pujantes se sitúan en las zonas umbrías del Montgó pero no existe estimación precisa de sus efectivos. Stübing y Estévez (1990) en el estudio multidisciplinar sobre el Parque Natural del Montgó (38°482 303 N 0°072 003 E) estiman que este endemismo dianico-pi-tiúsico es una de las plantas más interesantes de este macizo montañoso. Hay otras poblaciones de menor entidad en acantilados litorales y en barrancos o zonas de matorral de algunas sierras colindantes. En Ibiza se presenta constituyendo pequeñas poblaciones (6) localizadas en la costa norte (cala NaXa-mena, Penyal de s'Aguila, cala Aubarca, Es Alls, Ses Torretes y cala d'En Sardina). También vive en el islote de s'Espartar, donde es abundante, tanto en los cinglos de tramontana como en la parte más alta.
L. diania es un endemismo (microareal) emblemático en España en gran riesgo de desaparición a medio plazo ya que en los últimos años se ha comprobado una gran desaparición de poblaciones.El interés del estudio de esta especie es evidente ya que el «Catálogo Nacional de Especies Amenazadas» y el «Listado de Especies Silvestres en Régimen de Protección Especial» la presenta dentro de la categoría de plantas «De interés especial» (Real Decreto 139/2011 de 4 de febrero de 2011 y en sus actualizaciones por las órdenes AAA/75/2012 de 12 de enero y AAA/1771/2015 de 31 de agosto) y la «IUCN» (International Unionfor Conservation of Nature) la cataloga como «VU» (vulnerable, en alto riesgo de extinción en estado silvestre a medio plazo) siendo los criterios y subcriterios para su catalogación: «C2a» (declinación continua en el número de individuos maduros estando todos ellos en una sola sub-población) y «D2» (área de ocupación menor de 100 km2 o en menos de 5 poblaciones).

Fig. 1. A Hábito de la planta mostrando el aspecto de las hojas, tallos y flores. B] Detalle del capítulo con brácteas epinescentes y flores actinomorfas blanquecinas.
Fig. 2. Mapa de distribución de L. diania.
MATERIAL Y MÉTODOS
1. Material vegetal
El material utilizado fue obtenido a partir de las semillas recolectadas durante la campaña 2007-2008 procedentes del Parque Natural del Macizo de «El Montgó» (Alicante, Comunidad Valenciana; España; 38°48' 30'' N; 0°07'00''E; UTM: 4299457 249632 31 S).
Las plántulas se colocaron en envases de 7L que fueron rellenados con una mezcla de 50% de turba de coco, 30% de turba, 10% de arena y 10% de vermiculita. El pH fue de
7,0. Se incorporó al medio un fertilizante de lenta liberación (Osmocote plus), y un aporte de NPK 20:10:20. Las plantas fueron irrigadas dos veces al día usando un sistema de goteo. Para las experiencias, doce plantas fueron mantenidas en aire filtrado, y otras 12 fueron expuestas al ozono.
2. CÁMARAS «OPEN-TOP» (OTC) Y EXPOSICIÓN AL OZONO
Las muestras procesadas se obtuvieron tras el tratamiento de las plantas de L. diania en cámaras OTCs bajo condiciones de fumigación controladas. Estos tratamientos con ozono fueron realizados en el campo experimental de la Fundación CEAM en la «LaPeira» (Benifaió, Comunidad Valenciana, España; 39°16'14.8"N, 00°26'59.6"W, 30 m snm). Las plantas fueron distribuidas en seis cámaras de techo abierto (OTC), con dos tratamientos (3 cámaras por el tratamiento): 1°) con aire filtrado a través filtros de carbono (CF), y 2°) con aire no filtrado más una concentración de ozono de 30 ppb (NF+30). Esta concentración era ligeramente superior a las concentraciones más altas medidas en áreas de montaña del este de España (Millán et al., 2002). El ozono fue generado a partir de oxígeno usando un generador de descarga eléctrica de alto voltaje (Sir sa), y la calidad del aire dentro y fuera de las cámaras fue supervisada continuamente (a intervalos regulares) con un monitor de ozono (Dasibi 1008-AH, Environmental Corp.). Los tratamientos comenzaron el 12 de mayo y terminaron el 8 de septiembre, tras lo que las plantas fueron cosechadas.
Las muestras de flores se recogieron los días 16 de junio, 23 de junio (2 y 3 semanas después del comienzo de la floración) y el 7 de julio (4 semanas después de la floración cuando el 50% de las flores había alcanzado la antesis). Se tomaron cada vez muestras de 3 plantas, 5 capítulos por planta. Las hojas de las plantas tratadas mostraron a simple vista síntomas de daños producidos por el ozono a diferencia de las muestras de flores donde no se apreciaron daños.
Durante los tratamientos, las plantas fueron expuestas al ozono 8 h al día, desde las 10:00 a las 18:00 CET, todas las semanas. Para los periodos de tratamientos, se calcularon las medias a 24, 12 y 8 h, así como el AOT40, es decir, la exposición acumulada sobre un umbral de 40ppb (80 mg m-3), basado en promedios cada hora, durante las horas de luz día desde las 8:00 a las 20:00 CET.
3. Control de síntomas visibles
Todas las plantas fueron examinadas diariamente por el personal del campo experimental para detectar los primeros síntomas. La intensidad de los síntomas visibles producidos por el ozono era anotada semanalmente y registrado tanto el porcentaje de hojas afectadas por planta (HA), como el porcentaje del área afectada (AA) en las hojas con síntomas en cada planta. Para evaluar el daño total en la planta, se calculó un Índice de Daño Total (IDT) combinando estos dos parámetros: IDT= (HAxAA) /100.
4. Senescencia y reparto
DE LA BIOMASA
Las hojas senescentes fueron recogidas regularmente durante el experimento y el peso seco acumulado por la planta fue calculado sobre una base de dos semanas. Al final de los experimentos (5-8 de septiembre), las 24 plantas fueron recogidas, y la biomasa aérea (hojas, vástagos y flores) y subterránea (raíces) fue calculada por separado después de secada en el horno en 60°C hasta peso estable.
5. Análisis estadísticos
Las diferencias entre los diferentes tipos de hojas considerados eran resueltas usando un análisis ANOVA seguido de un test LSD (Least Significant Difference). Un nivel de probabilidad de <0,05 se consideró estadísticamente significativo. Los datos fueron analizados usando el software SPSS® 10.0 para Windows (SPSS Inc., Chicago, EE.UU.).
6. Métodos microscópicos
Las muestras de las flores fueron fijadas in situ con una mezcla de formaldehido-áci-do acético-alcohol etílico (FAA) (para trabajar en microscopía óptica, MO) y luego almacenadas en nevera, o con Karnovsky modificado (2% de paraformaldehido y 2,5% de glutaraldehido; Karnovsky, 1965), (para trabajar en microscopía electrónica, TEM). Las muestras en Karnovsky se fijaron durante 12 horas, y luego se lavaron en tampón fosfato 0,1M y pH 7,4. Posteriormente, se postfijaron en OsO4 al 2% durante 2 horas, se lavaron en tampón fosfato 0,1M y pH 7,4 y, finalmente, se guardaron en refrigerador hasta su manipulación posterior.
6.1. Observación en microscopía óptica.- Las muestras fijadas con FAA se sometieron a los tratamientos siguientes:
Una parte de las muestras se incluyeron en parafina. Para ello primero se deshidrataron en series de etanol (50%, 70%, 80%, 96% y absoluto) durante 15 minutos en cada uno de ellos y luego fueron introducidas en acetato de isoamilo durante 1 h. A continuación, se introdujeron en una mezcla de xile-no-parafina a 55°C durante 1 h, luego en parafina líquida durante 1 h y, finalmente, se confeccionaron los bloques de parafina mediante el uso de casetes histológicos de inclusión (TissueTek®). Los bloques fueron cortados en secciones de 10 um con un mi-crótomo rotatorio AngliaScientific 500 y teñidos con safranina-verde rápido (Johansen, 1940).
Otra parte de las muestras se incluyeron en resina LR-White®Hard Grade (London Resin Company). Para ello primero se deshidrataron en series de etanol (50%, 70%, 80%, 96% y absoluto) durante 15 minutos en cada uno de ellos y luego fueron introducidas en Ependorf® conteniendo mezclas de etanol absoluto-resina (2:1) durante 1 h, etanol absoluto-resina (1:1) 1 h, y etanol absoluto-resina (1:2), durante toda la noche y destapado para permitir que el etanol se evaporara. Finalmente, las muestras fueron incluidas en resina pura contenida en cápsulas BEEM (8 mm I.D.) que se cerraron y guardaron en estufa a 60°C durante 24 horas para su polimerización. Las secciones semifinas (1,5 u-m) de estos bloques se llevaron a cabo en un ultramicrótomo Ultratome Nova LKB Bromma, con cuchillas de diamante DIATOME Histo 45° y se tiñeron con azul de toluidina al 0,1% (Feder y O'Brien, 1968). Finalmente, otras muestras se guardaron para su observación en LTSEM.
Todas las secciones fueron observadas con un microscopio óptico OLYMPUS Provis AX 70 equipado con un equipo de epifluores-cencia. En nuestro caso, las observaciones con fluorescencia y autofluorescencia se realizaron con un cubo de fluorescencia U-MWU (excitation filter: 330-385nm; barrier filter: 420nm; dichroic Mirror: 400 nm). Todas las imágenes fueron fotografiadas con una cámara digital Lumenera Infinity 2-3C digital CCD color camera (2080 x 1536 re-solution) y tratadas posteriormente con los programas Infinity Analyze® v. 4.6.0 y Photoshop CS5®.
6.2. Observación en TEM.- Las muestras fijadas con Karnovsky y post-fijadas con OsO4 se deshidrataron en series de etanol (50%, 70%, 80%, 96% y absoluto) durante 15 minutos en cada uno de ellos y luego se incluyeron en resina LR-White® Hard Grade (London Resin Company) siguiendo el mismo procedimiento que para los cortes semi-finos. Las secciones ultrafinas (80 nm) se cortaron en un ultramicrótomo Ultratome Nova LKB Bromma, con cuchillas de diamante DIATOME Ultra 45°, se recogieron sobre rejillas de cobre de 100 mesh con ayuda de asas PerfectLoop (EMS) para ultrami-crotomía, y se tiñeron con citrato de plomo al 2% durante 10 min (Reynolds, 1963) y con acetato de uranilo 2% durante 5 min (Watson, 1958).
Para la observación de las mismas se usó un microscopio electrónico de transmisión PHILIPS CM10 a 80kV dotado de una cámara digital MegaView III y un software de adquisición de imágenes «AnalySIS» del Servicio de Microscopía Electrónica de la Universidad Politécnica de Valencia.
6.3. Observación en LTSEM.- Algunas muestras fijadas en FAA se emplearon para su observación en un microscopio de barrido de baja temperatura (LTSEM). Para ello, las muestras hidratadas fueron depositadas en un portaobjetos especial y congeladas con nitrógeno líquido. Posteriormente, fueron sublimadas a -90°C durante 10 min. Una vez introducidas en la pre-cámara del microscopio se recubrieron con oro durante 60 s. Finalmente, se visualizaron bajo un voltaje de 10 kV en un microscopio electrónico Cryo-SEM (JSM-5410 LV Scanning Microscope, JEOL, Japón) interconectado con un sistema de crio-transferencia (Cryotrans CT1500, Oxford Instruments, Oxford, Reino Unido) y dotado con un sistema digital de adquisición de imágenes INCA-Point & ID (Oxford Ins-truments) del Servicio de Microscopía Electrónica de la Universidad Politécnica de Valencia.
RESULTADOS
1. Concentraciones de ozono
Las concentraciones de ozono ambiente en el sitio experimental durante el período entero de la exposición (del 12 de mayo al 8 de septiembre, un total de 120 días) fueron moderados (Tabla 1). En los tratamientos realizados en aire filtrado con carbono (CF, control), las concentraciones medias de ozono cada hora se situaron por debajo de 15 ppb, mientras que en los tratamientos NF + 30, las concentraciones medias cada hora estuvieron cercanas a 40 ppb. Otros medios descriptivos y exposiciones acumuladas se proporcionan en la Tabla 1.
2. Evolución de los síntomas
visibles
Después de 3 días de exposición al tratamiento NF + 30, se observaron los primeros síntomas en las hojas de L. diania: un amari-lleamiento que afecta solamente a la superficie intervenal superior de las hojas más viejas, mientras que las hojas más jóvenes no se mostraron afectadas. Después de 15 días, los 12 individuos del tratamiento NF+30 eran sintomáticos. Los síntomas nunca fueron observados en el tratamiento de los CF durante el curso del experimento. Los síntomas visibles fueron inicialmente muy evidentes, luego se estabilizaban hasta el día 57, y finalmente se producía de nuevo un aumento. El último aumento correspondió a un período en el cual más de la mitad de las flores
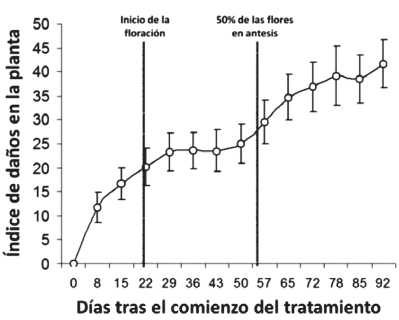
Fig. 3. Evolución del índice de daños en la planta Los datos se refieren únicamente a los tratamientos con ozono. Media ± d. e., n = 12 plantas.
habían alcanzado la antesis, las semillas estaban maduras (Fig. 3), y la senescencia de las hojas viejas muy acelerada.
3. Efectos sobre la anatomía
DE LAS FLORES
Las flores blanquecinas de L. diania están agrupadas en capítulo, técnicamente calati-dio, (Fig. 1B) y sentadas sobre un receptáculo o clinanto. Las brácteas medias del involucro pueden llevar o no apéndice cocleariforme. Las flores son pequeñas y hermafroditas, con simetría actinomorfa (Fig. 1B) e hipanto ausente.El cáliz tiene los sépalos profundamente modificados, formando un papus o vilano de tipo piloso. El vilano es doble, persis-
Tabla 1. Concentraciones medias de ozono para diversas ventanas diarias de tiempo, AOT40 y valor máximo por hora alcanzados para el período completo cubierto por este experimento (del 18 de mayo al 8 de septiembre de 2008). El periodo de 8 h, a partir del 10 a 18 h, cubrió las horas en las cuales las plantas del tratamiento NF+30 fueron expuestas a los niveles crecientes del ozono. CF = Filtro de carbono; NF+30 = aire no filtrado + 30 ppb ozono. El aire ambiente no es un tratamiento sino que se refiere a los niveles del ozono medidos en el lugar experimental fuera de las OTCs.
| Media 24 h | Media 12 h [8-20 CET] | Media 8 h [10-18 CET] | Valor máx/hora | AOT40 [8-20 CET] | |
| (ppb) | (ppb) | (ppb) | (ppb) | (ppb*h) | |
| CF | 10,8 | 10,3 | 12,3 | 30,8 | 0 |
| NF+30 | 39,8 | 64,8 | 72,2 | 110,3 | 35019 |
| Aire ambiente | 31,6 | 45,6 | 48,1 | 86,0 | 10866 |
tente, con cerdas lignificadas en la base, que a veces falta en los aquenios externos o en todos; vilano externo con cerdas lineares, de longitud desigual, ± planas, algo cortas y regularmente ciliadas; vilano interno con cerdas más cortas y conniventes, sentadas sobre una base claviforme esclerificada.
La corola es gamopétala, con 5 pétalos formando un tubo (corola tubulosa o flóscu-lo) con 5 lóbulos (Fig. 4C). Los pétalos presentan epidermis adaxial y abaxial monoes-tratificadas. Sus células son prismáticas con paredes celulares periclinales externas muy desarrolladas y con una gruesa cutícula, formada de capa cuticular y ceras (Fig. 5A, 5C y 5E). El parénquima consta de entre 3 y 6 células dependiendo de la parte del pétalo considerada. Las células son pequeñas y apenas dejan espacios intercelulares entre ellas (Fig. 5A, 5C y 5E). En la parte tubulosa de la flor, los pétalos se unen unos con otros a través de células epidérmicas modificadas (Fig. 5A y 5C). En los bordes de los mismos suelen aparecen dos conductos secretores junto a los haces vasculares (Fig. 5A y 5C).
El androceo presenta 5 estambres, los cuales alternan con los lóbulos de la corola (Fig. 4A y 4C). Las anteras son basifijas y se unen entre sí, formando un tubo alrededor del estilo (Fig. 4A y 4C). Las anteras presentan dehiscencia longitudinal e introrsa. Los granos de polen usualmente son tricolpora-dos (Fig. 4D y 4E). Cada antera contiene cuatro sacos polínicos (microsporangios) que se disponen por pares en dos lóbulos. Estos lóbulos se separan por una zona de tejido estéril que se denomina conectivo; a través de este tejido de unión atraviesa el hacecillo conductor (Fig. 4C).
El gineceo está formado por 2 carpelos connados, con ovario ínfero y unilocular. Presenta un solo óvulo anátropo, con 1 tegumento y un delgado megasporangio (Fig. 4B). La placentación es basal. El gineceo presenta un estilo que usualmente posee en su ápice un nectario. El estilo se halla dividido distalmente en dos ramas estilares, que presentan papilas estigmáticas en su cara adaxial dispuestas en dos líneas separadas (Fig. 4C).
Cuando la flor es muy joven, la antera no consta más que de protodermis y una masa de meristemo fundamental. El tejido esporó-geno (con 2 capas de células iniciales) se desarrolla solamente en las cuatro zonas de la esquina de la antera en desarrollo (figura suplementaria S1A y S1B).La capa interna forma las células esporógenas primarias, que por divisiones ulteriores forman las células madres de las micrósporas. La capa superior de las células iniciales citadas forma las células parietales primarias, de las que se forma la pared de los sacos polínicos y una gran parte del tapete, como resultado de divisiones periclinales y anticlinales.
Las células esporógenas primarias comienzan a dividirse mitóticamente en diferentes planos al tiempo que se desarrolla la pared del saco polínico (Fig. 7A). De estas divisiones derivan las células madres de las micróspo-ras, llamadas también microsporócitos (Fig. 6A y 7A). Estas células son ricas en citoplasma y presentan una pared muy delgada de pectocelulosa. No dejan apenas espacios intercelulares (Fig. 6C y 7A y suplementaria S1C). El citoplasma tiene una estructura muy simple, apareciendo sus constituyentes distribuidos al azar. Existe una gran comunicación intercelular mediante canales citoplásmicos y plasmodesmos (Figura suplementaria S1D). Los núcleos presentan numerosos poros nucleares (Figura suplementaria S1E). También son muy abundantes los ribosomas.
Más tarde, cada célula madre sufre una meiosis y forma una tétrada de granos de polen, que equivalen a cuatro micrósporas haploides (Fig. 6). Poco antes de la reducción meiótica la membrana primaria del microesporócito se sustituye por capas gruesas de calosa (Fig. 6F). Al finalizar el proceso meiótico las micrósporas haploides se aíslan en la tétrada rodeándose cada una de una pared de calosa y sin plasmodesmos que las conecten con sus células hermanas.
Al mismo tiempo que se constituye la té-trada, las células del tapete de cada antera crecen y comienzan a formar unos cuerpos esféricos específicos (los pro-orbículos; Fig. 6B). En el estado de tétrada avanzado aparecen entre la membrana plasmática y la pared celular del tapete, que desaparece paulatinamente. Al mismo tiempo que se deposita la esporopolenina en los báculos de la ectexina, también se recubren los pro-or-bículos formando orbículos o corpúsculos de Ubisch.
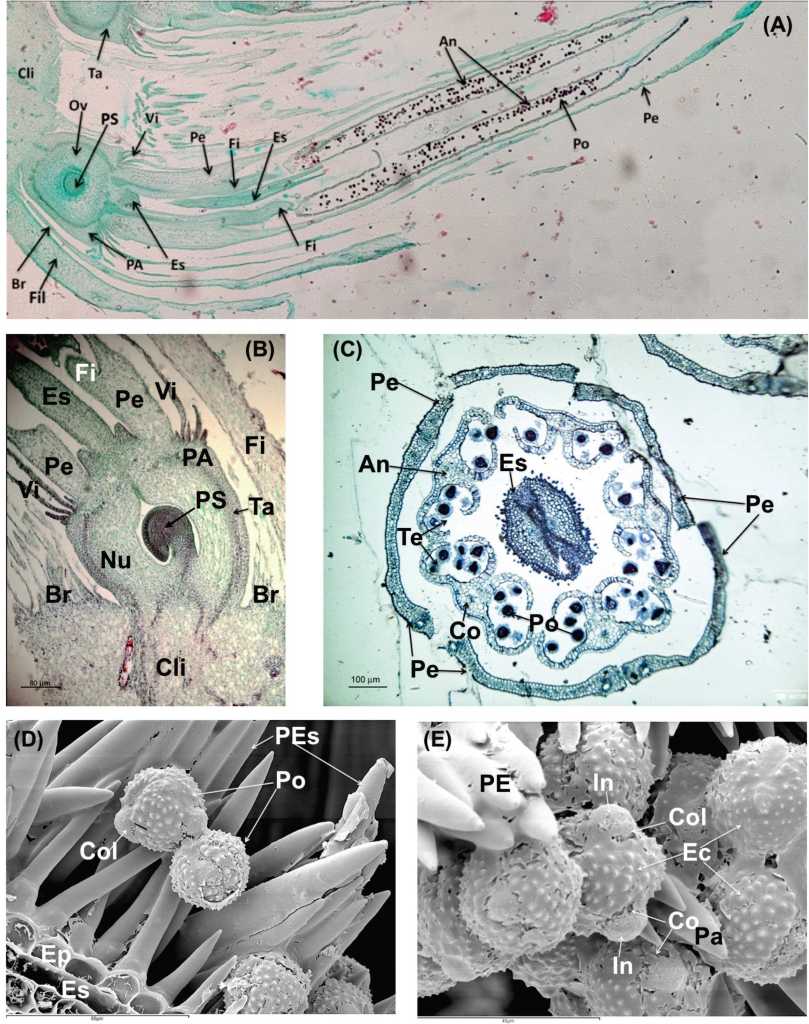
Fig. 4. A) Sección longitudinal de una flor muy madura filtrada con las anteras abiertas. 100x. B) Sección longitudinal de un detalle del tálamo y del ovario ínfero con un primordio seminal anátropo. 200x. C) Sección transversal de una flor muy madura filtrada con las anteras ya abiertas. 100x. D) Micrografía en LTSEM de un detalle del estilo y de las papilas estigmáticas. 750x. E) Micrografía en LTSEM de granos de polen en una flor madura filtrada. 1500x. Referencias: An: anteras; Br: brácteas de la flor; Cli: clinanto; Co: conectivo. Col: colpos; Ec: ectexina. Ep: epidermis; Es: estilo bífido; Fi: filarias ; In: Intina; Nu: nucela; Ov: ovario; PA: placa axial; PE: papilas estigmáticas; Pe: pétalos; PEs: Papilas estilares; Po: polen; PS: primordio seminal; Ta: tálamo o receptáculo; Te: tecas; Vi: vilano (cáliz).
Fig. 5. A) Sección transversal de dos pétalos de una flor madura filtrada (detalle). Sección semifina teñida con azul de toluidina. 2QQx. B) Sección transversal del pétalo de una flor fumigada (4 semanas) mostrando alteraciones producidas por el ozono: protrusiones pectiná-ceas (flechas discontinuas), zonas de degradación de la pared celular (asteriscos). 400x. C) Micrografía de LTSEM de un pétalo de una flor madura filtrada. 1000x. D) Micrografía de LTSEM de un pétalo de una flor fumigada (4 semanas) mostrando daños de la acción del ozono: alteración en la forma de las células del mesófilo y presencia de numerosos espacios intercelulares.1500x. E) Micrografía de LTSEM de un pétalo de una flor madura mostrando un conducto secretor.1000x.F) Micrografía de TEM de un pétalo afectado. Detalle de protrusiones pectináceas (flechas discontinuas) y zonas de degradación de la pared celular (asterisco). Referencias: CS: conducto secretor; Cu: cutícula; EI: espacio intercelular; EpAb: epidermis abaxial; EpAd: epidermis adaxial; F: floema; HV: haz vascular; M: mesófilo; PC: pared celular; T: tonoplasto; X: xilema.
Las células del tapete son notoriamente grandes, ricas en protoplasma y pueden ser multinucleadas o poliploides ya que en ellas ocurren varias mitosis irregulares y fusiones nucleares (Fig. 6, 7A y 7C). Poseen un citoplasma muy complejo, con abundantes ribosomas libres, mitocondrias, retículo endoplásmico y dictiosomas (Fig. 8E y 9A). El tapete es de tipo glandular o de secreción, ya que las células permanecen en su posición original para desintegrarse más tarde (Fig. 6 y 8E) y ser absorbido su contenido por las células madres de polen y por los mismos granos durante su desarrollo (Fig. 8).
Antes de la liberación de los granos polínicos las paredes celulares del endotecio se engrosan, a excepción de la pared tangencial externa que contacta con el exotecio. Cada engrosamiento tiene forma de «U» con la luz dirigida hacia el exotecio (Fig. 7E, 8A y 8B). Esta capa responde de la dehiscencia del saco polínico que en L. diania es longitudinal según una línea que se extiende entre los dos sacos polínicos de cada teca. Antes de la dehiscencia el tejido existente entre los dos sacos de la teca suele desintegrarse, quedando esta zona sólo recubierta por el exote-cio antes de la dehiscencia.
El grano de polen adulto se encuentra rodeado por una capa de celulosa, la intina. Por fuera de la intina hay otra capa llamada exina. El componente principal de la exina es un polímero de esporopolina (el pollen-kitt) suministrado a partir de las células del tapete (Fig. 8E, 9A y 9C). La exina en L. dia-nia consta de una parte externa esculpida, la ectexina, y una interna, la endexina. La en-dexina, que cubre completamente a la intina, forma generalmente una capa lisa. La endexina se deposita bajo la ectexina. Inicialmente el proceso comporta gran número de laminillas de baja densidad electrónica que parecen nacer del citoplasma (Figura suplementaria S1F) y forman las bases en torno a las cuales se deposita la esporopole-nina. Al depositarse la esporopolenina, las laminillas engrosan y se funden unas con otras para formar la endexina. En la endexi-na madura no se distinguen las laminillas. Las esculturas de la ectexina resultan de la disposición radial de los báculos, de extremidades engrosadas. Son de diferentes tamaños y pueden disponerse aislados o agrupados. En L. diania, los extremos de los báculos se sueldan formando un téctum, con lo que resulta tectado; este téctum presenta a su vez la superficie esculpida de modo característico (Fig. 10A y 10C).
El ozono produce efectos evidentes sobre el desarrollo de las flores de L. diania aunque menos evidentes a nivel macroscópico que los producidos en las hojas. Estos efectos, además, tardaron más en aparecer debido a que la floración comenzó tiempo después de comenzado el tratamiento (3 semanas más tarde) alcanzándose el 50% de la antesis casi dos meses después de comenzado el mismo. En cualquier caso, la recogida de muestras de flores se hizo a las 2, 3 y 4 semanas del inicio de la floración. Los daños anatómicos comenzaron a ponerse de manifiesto a partir de la 3-4 semanas. Los datos comentados a continuación, se corresponden con estas muestras.
Los primeros efectos que produce el ozono sobre las flores ocurren en los pétalos. Son efectos parecidos a los que se manifiestan en las hojas (Calatayud et al., 2011) pero mucho menos agresivos, ya que en ningún caso se apreciaron los colapsos celulares típicos de hojas tratadas durante mucho tiempo. En los pétalos, se observa una progresiva degradación de las paredes celulares parenquimáticas lo que se traduce en la aparición de protrusiones pectináceas, debilitamiento de las paredes con la consiguiente pérdida de forma de las células, aumento importante de los espacios intercelulares y zonas donde las láminas medias se deshacen de forma evidente (Fig. 5B, 5D y 5F). Asimismo, los haces vasculares sufren ligeros daños en su floema, que aparece con algunas de sus células taponadas con depósitos densos (Figura suplementaria S2A).
La parte de la flor estudiada con más intensidad ha sido el androceo. Debido a que las flores muy jóvenes se encuentran bastante protegidas, apenas se han notado daños en las mismas. Sólo en algunos casos se han detectado afectaciones en algunos sacos polínicos que se traducen en células del tapete y células madres de las micrósporas afectadas (Fig. 7B). También en casos particulares se vieron efectos más graves como el aborto
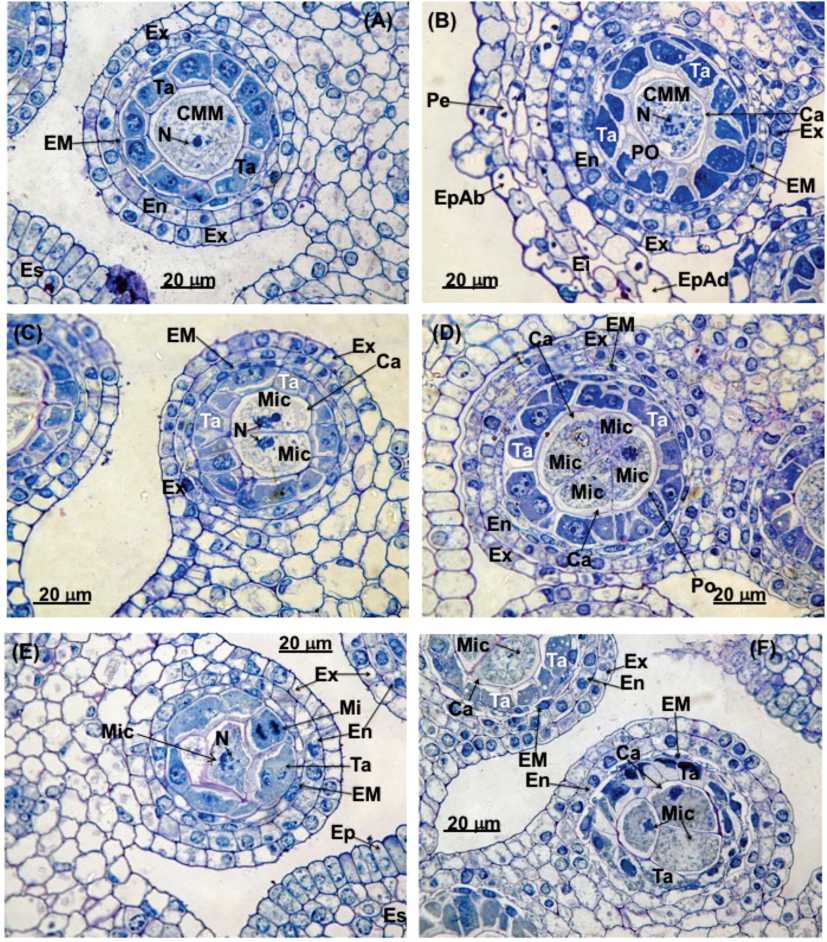
Fig. 6. Micrografías de secciones transversales de anteras de flores filtradas jóvenes en distintos estadios del proceso meiótico de las células madre de las micrósporas.. 1000x. A) Antes del inicio de la meiosis. B) Comienzo de la condensación cromosómica. C-F). Meiosis. Referencias: Ca: calosa; CMM: células madre de las micrósporas; EI: espacio intercelular; EM: estrato mecánico En: endotecio; Ep: epidermis; EpAb: epidermis abaxial; EpAd: epidermis adaxial; Ex: exotecio; N: núcleo; Pe: pétalo; Po: pro-orbículos; Mic: micróspora; Ta: tapete.
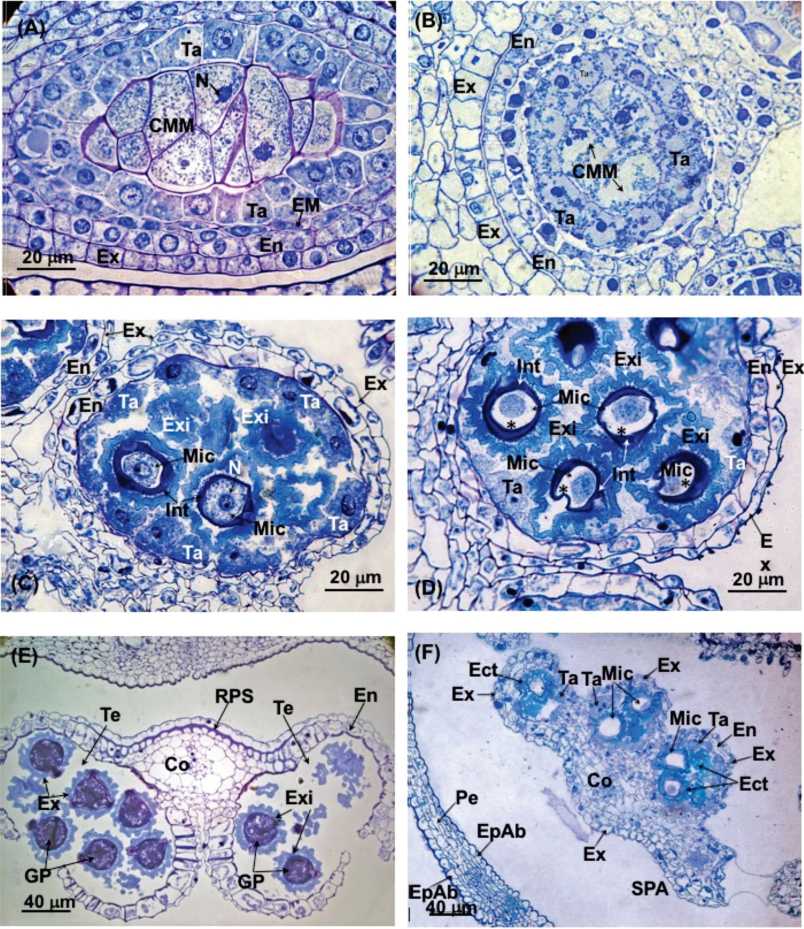
Fig. 7. A) Sección longitudinal de una antera filtrada joven. Se observan las células madres de las micrósporas rodeadas de las células del tapete. 1QQQx.B) Sección transversal de la antera de una flor muy joven fumigada (4 semanas) mostrando daños internos. Detalle de un saco polínico afectado. 1000x. C) Sección transversal de una antera de una flor filtrada intermedia. El estrato mecánico ha comenzado a desaparecer. 1000x. D) Sección transversal de la antera de una flor intermedia fumigada (4 semanas). Detalle de un saco polínico con varias micrósporas mostrando daños. (asterisco). 1000x. E) Sección transversal de una antera en dehiscencia de una flor filtrada muy madura. Se observan los granos de polen ya formados. 400x. F) Sección transversal de un antera de una flor intermedia fumigada (4 semanas) mostrando daños. Prácticamente todas las micrósporas están vacías. 400x. Referencias: Co: conectivo; Ect: ectexina; EM: estrato mecánico; En: endotecio; Es: estilo; Ex: exotecio; Exi: exina: Int: intina; Mic: micróspora; N: núcleo; Pe: pétalo; RPS: refuerzos de pared secundaria; SPA: saco polínico abortado; Ta: tapete.
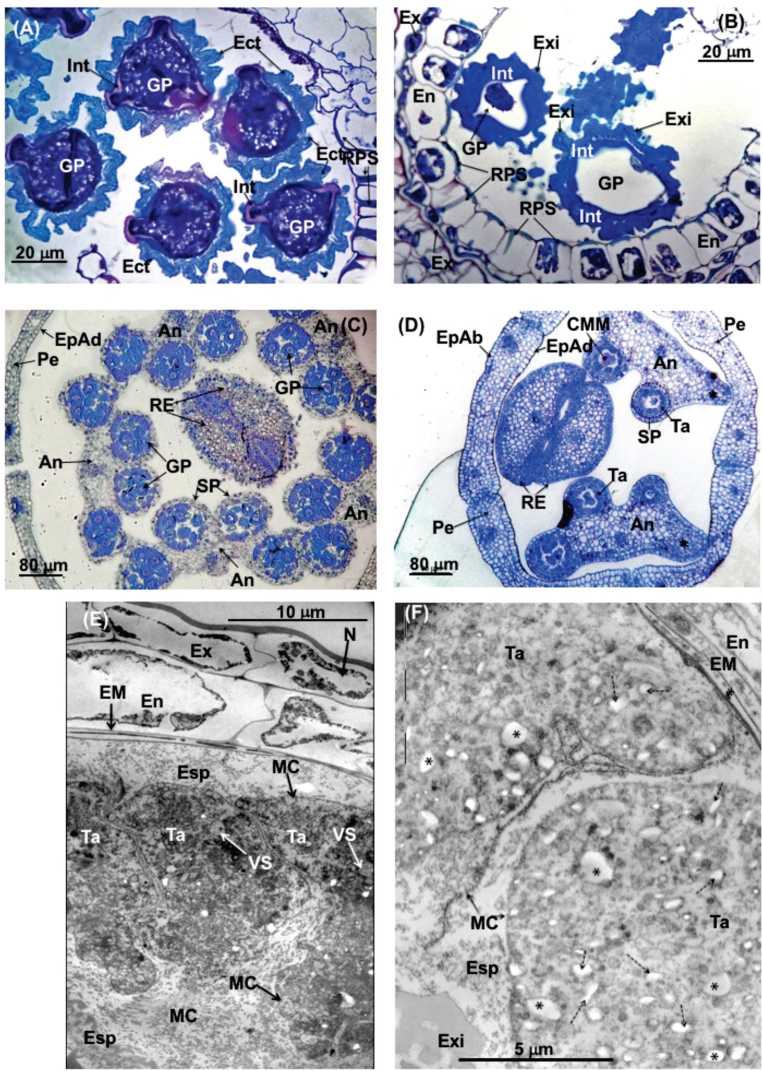
Fig. 8. A) Sección transversal de una antera en dehiscencia de una flor filtrada. Detalle de los granos de polen totalmente formados 1000x. B) Sección transversal de una flor madura fumigada (4 semanas). Detalle de un saco polínico en dehiscencia mostrando daños. 1000x. C) Sección transversal de una flor madura filtrada. Anteras con los sacos polínicos funcionales y llenos de numerosos granos de polen maduros. 200x. D) Sección transversal de una flor joven fumigada (4 semanas). Se observa como 3 de los 5 estambres han abortado. En cada antera uno de los sacos polínicos es afuncional (asterisco). 200x. E) Micrografía de de algunos estambres en sus estados iniciales de desarrollo (Fig. 8D).
Cuando las flores se encuentran en un estadio intermedio de desarrollo, es decir, cuando ya se ha producido la meiosis y se han liberado las micrósporas haploides, comienzan a verse síntomas claros del efecto del ozono. En muchas anteras se observan sacos polínicos con granos de polen en desarrollo que aparecen totalmente vacíos o con grandes deformaciones (Fig. 7D y 7F) cuando se observan con el microscopio óptico. En algunos casos se apreciaron aberraciones en algún saco polínico (Fig. 7F). Al microscopio electrónico los efectos también son evidentes. En este estadio, las células del tapete aparecen afectadas y presentan numerosas vacuolas anómalas (Fig. 8F, 9B y 9D).
En el último estadio de desarrollo, cuando las anteras están maduras y listas para la dehiscencia, se observan numerosos daños. Así, en muchos casos se apreciaron flores con estambres aberrantes que no han desarrollado sus sacos polínicos (Fig. 7D, 8D y Figura suplementaria S2B). Los granos de polen aparecen en muchos casos vacíos (Fig. 8B) o con su contenido celular afectado o en proceso de degradación (Fig. 10D). Las paredes de los granos de polen también se ven afectadas. En algunos casos se aprecian granos sin exina (Figura suplementaria S2C), o bien con exina alterada y muy porosa (Fig. 10B). También se aprecian al microscopio electrónico de transmisión y en LTSEM la aparición de grandes espacios o huecos entre sus capas componentes. Es normal observar granos donde el protoplasto celular está totalmente separado de la intina (Fig. 10D y 10F) o donde se produce una desestructuración de la endexina que se deshace en capas
(Fig. 9F) separándose de esta manera de la ectexina.
4. Senescencia y reparto
DE LA BIOMASA
En el curso de los primeros 43 días, existen diferencias significativas (o marginalmente significativas) entre los tratamientos, apareciendo más hojas senescentes en el tratamiento NF+30 (Fig. 11). Para el resto del período, el tratamiento NF+30 produjo, en promedio, una cantidad más alta de bioma-sa seca de las hojas senescentes, aunque la variabilidad relativamente grande existente entre las plantas previene diferencias significativas. Hacia el final del experimento, cuando la mayor parte de las flores habían alcanzado antesis, se aceleraron los procesos de senescencia de las hojas, como ocurre normalmente en esta especie en condiciones naturales hacia el verano.
El tratamiento con ozono no produjo ningún cambio en la biomasa total de las plantas, pero redujo perceptiblemente la biomasa de la raíz (Fig. 12). En plantas expuestas a ozono, esta reducción en biomasa subterránea se compensó por una tendencia (no significativa) a aumentar la biomasa sobre el suelo (aérea). Mientras que los procesos de senescencia se aceleraron en las hojas más viejas de las plantas expuestas al ozono, observamos un incremento en la producción de hojas nuevas en las partes más jóvenes de la planta, lo que puede explicar la tendencia a aumentar la biomasa aérea con este tratamiento. El tratamiento con ozono produjo un cambio claro en la división de la bioma-sa, según se indica por la relación biomasa subterránea/aérea: en plantas expuestas a ozono este cociente se redujo perceptiblemente (Fig. 12).
TEM de una antera perteneciente a una flor intermedia filtrada. 1200x. F) Micrografía de TEM de una antera perteneciente a una flor intermedia fumigada (3 semanas). Se observan numerosas vesículas (asteriscos y flechas discontinuas) de aspecto distinto al normal 1650x. Referencias: An: antera; CMM: células madre de las micrósporas; Ect: ectexina; EM: estrato mecánico; En: endotecio; EpAb: epidermis abaxial; EpAd: epidermis adaxial; Esp: esporo-polenina; Ex: exotecio; Exi: exina; GP: grano de polen; Int: Intina; MC: membrana celular; N: núcleo; Pe: pétalo; SP: saco polínico: RE: ramas estilares; RPS: refuerzos de pared secundaria; Ta: tapete; VS: vesícula de secreción.
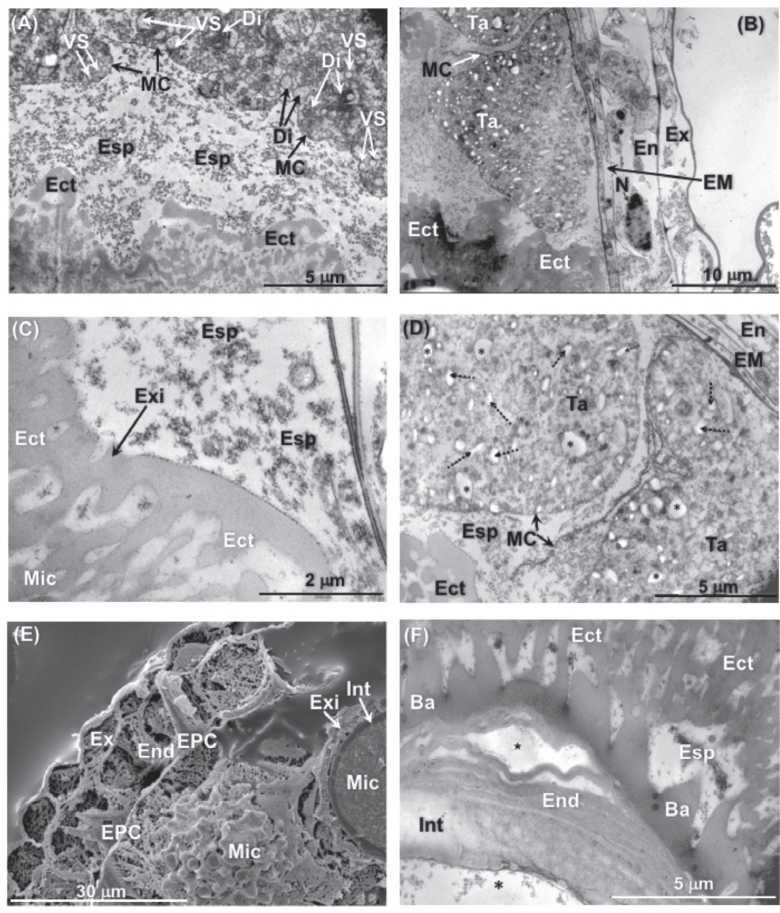
Fig. 9. A) Micrografía de TEM de una antera perteneciente a una flor filtrada intermedia. Células del tapete en proceso de desintegración y liberando esporopolenina. 1200x. B) Micrografía de TEM de una antera de una flor intermedia fumigada (3 semanas). Detalle de algunas alteraciones en las células del tapete: alta vacuolización. 1700x. C) Micrografía de TEM de una antera de una flor madura filtrada. Detalle de la deposición de la esporopolenina. 3900x. D) Micrografía de TEM de una antera de una flor intermedia fumigada (3 semanas). Se observan numerosas vesículas (asteriscos y flechas discontinuas) 1650x. E) Micrografía de LTSEM de una antera de una flor madura filtrada. Detalle del endotecio mostrando los engrosamientos de pared para la dehiscencia de la antera. 2000x. F) Micrografía de TEM de una antera de una flor intermedia fumigada (4 semanas). La endexina aparece muy desorganizada y separada en algunos puntos (estrella) de la ectexina. 2200x. Referencias: Ba: báculo; Di: dictiosoma; Ect: ectexina; EM: estrato mecánico; En: endotecio; Esp: esporopolenina; Ex: exotecio; Exi: exina; Int: Intina; MC: membrana celular; Mic: micróspora; N: núcleo; RPS: refuerzos de pared secundaria; Ta: tapete; VS: vesícula de secreción.
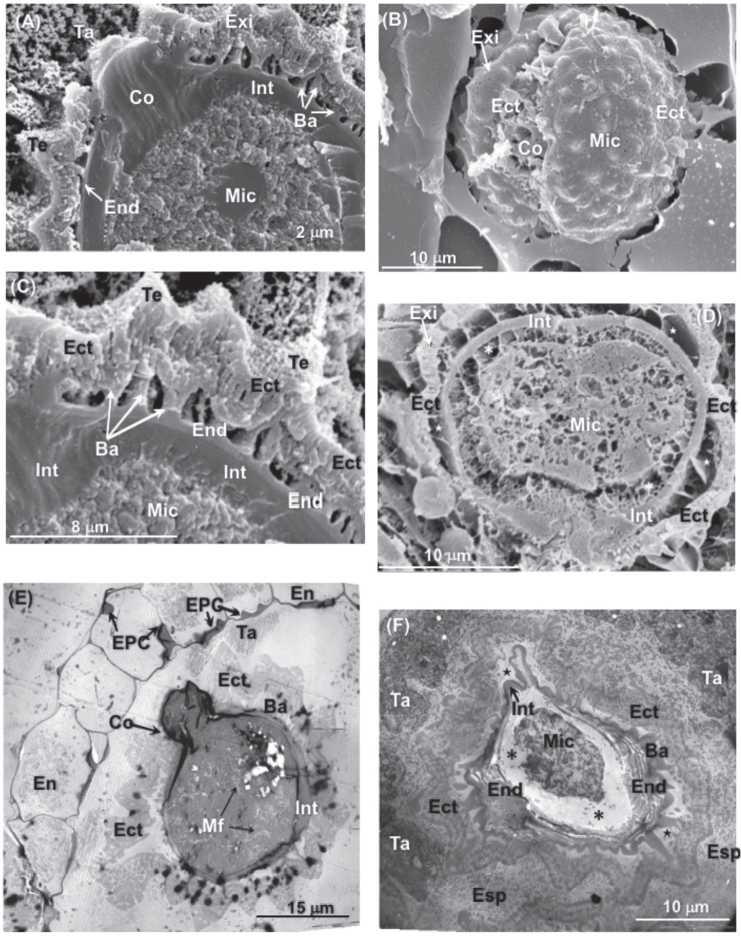
Fig. 10. A) Micrografía de LTSEM de una antera de flor filtrada madura. Detalle de la pared en formación de una micróspora y células en degradación del tapete. 5000x. B) Micrografía de LTSEM de una flor madura fumigada (3 semanas). La exina es más porosa de lo normal y en el colpo se aprecian daños externos. 5000x. C) Micrografía de LTSEM de una antera de flor madura filtrada. Se observa la endexina, los báculos de la ectexina y el tectum que une los báculos en la parte superior. 7500x. D) Micrografía de LTSEM de una flor madura fumigada (4 semanas). Se aprecia una notable separación entre el protoplasto y la intina y entre la endexina y la ectexina (estrella). 5000x. E) Micrografía de TEM de una antera a punto de dehiscencia de una flor filtrada. Detalle de un grano de polen maduro 3500x. F) Micrografía de TEM de la antera de una flor intermedia fumigada (4 semanas). Se aprecia un protoplasto muy alterado y separaciones (asteriscos) con la endexina muy desorganizada. 4000x. Referencias: Ba: báculo; Co: colpo; Ect: ectexina; End: endexina; EPC: engrosamiento de la pared secundaria; Exi: exina; Int: intina; Mf: microfibrilla; Mic: micróspora; Ta: tapete; Te: tectum.
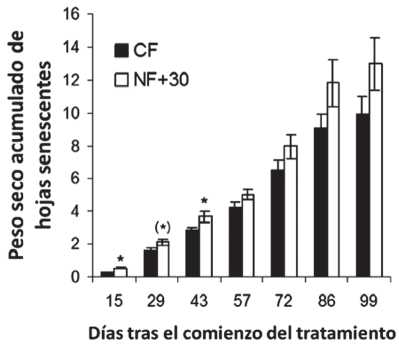
Fig. 11. Peso seco acumulado de hojas senescentes por planta en los dos tratamientos. (Media ± d.e., n = 12 plantas, test de Student, nivel de significación *p<=0.05, (*) p=0.06). CF= Aire filtrado en carbono; NF+30= aire no filtrado + 30 ppb de ozono.
DISCUSIÓN Y CONCLUSIONES
En este trabajo hemos estudiado las respuestas del endemismo Lamottea diania frente al ozono troposférico y los daños que este produce en su anatomía, histología y citología así como el modo en que afecta a la productividad de su biomasa.
Los resultados del estudio demuestran que el ozono altera el reparto de la biomasa reduciendo la biomasa subterránea (las raíces) mientras que produce un crecimiento compensatorio leve, no significativo de nuevas hojas. Una reducción en la biomasa de la raíz o en la relación biomasa aérea/subterránea se ha divulgado como efecto del ozono en diversas especies (Andersen, 2003), lo que refleja una disminución del reparto de los fotoasimilados desde los tejidos fuente (hojas) a los tejidos sumidero (raíces). Las consecuencias de la reducción de la biomasa radical en una planta hemicriptofítica tal como L. diania pueden ser relevantes para la supervivencia de esta especie. La mayoría de las partes aéreas de Lamottea se desecan hacia finales del verano, después de la producción de las flores y de las semillas. Una roseta basal y, más adelante, simplemente las yemas, pueden permanecer sobre la tierra, de modo que durante este período la planta solo dependa de las reservas de la raíz para su supervivencia. Estas reservas se

Fig. 12. A) Biomasa (peso seco) total, biomasa subterránea y biomasa aérea al final del experimento. B) Relación biomasa subterránea/aérea (peso seco). Media ± d.e., n = 12 plantas, test de Student, nivel de significancia: p<=0.05, las diferencias significativas entre ambos tratamientos se indican con letras diferentes. CF= aire filtrado en carbono; NF+30= aire no filtrado + 30 ppb de ozono.

Fig. S1. A) Sección transversal de una flor filtrada muy joven. Se observan las anteras en formación con el tejido esporógeno. 200x. B) Detalle ampliado de (A). Se observan las zonas de tejido esporógeno de las cuales se formarán las células madres de las micrósporas. 1000x. C) Micrografía de TEM de las células madres de las micrósporas de una antera muy joven de una flor filtrada. Se observan los grandes núcleos y las delgadas paredes celulares primarias. 900x. D) Micrografía de TEM de las células madres de las micrósporas de una antera muy joven de flor filtrada. Detalle de una zona de unión de dos CMM con numerosos plasmodesmos y ribosomas. 5200x. E) Micrografía de TEM de una célula madre de las micrósporas de una antera muy joven de flor filtrada. Detalle del núcleo, membrana nuclear con poros nucleares, el nucléolo y, en el citosol, numerosos ribosomas. 8900x. F) Micrografía de TEM de una antera a punto de la dehiscencia de una flor filtrada. 2200x. Referencias: An: antera; Ba: báculo; CEP: células esporógenas primarias; Ci: citosol; CPP: células parietales primarias; Cr: cromatina; CS: canal secretor; Ect: ectexina; End: endexina; Ep: epidermis; Es: estilo; Esp: esporopolenina; Exi: exina; Int: intina; LM: lámina media; Mi: mitocon-dria; MN: membrana nuclear; N: núcleo; Nu: nucléolo; PC: pared celular; Pe: pétalo; Pl: plasmodesmos; PN: poro nuclear; Pro: protodermis; RER: retículo endoplásmico rugoso; Ri: ribosomas; TE: tejido esporógeno; ZU: zona de unión de los pétalos.
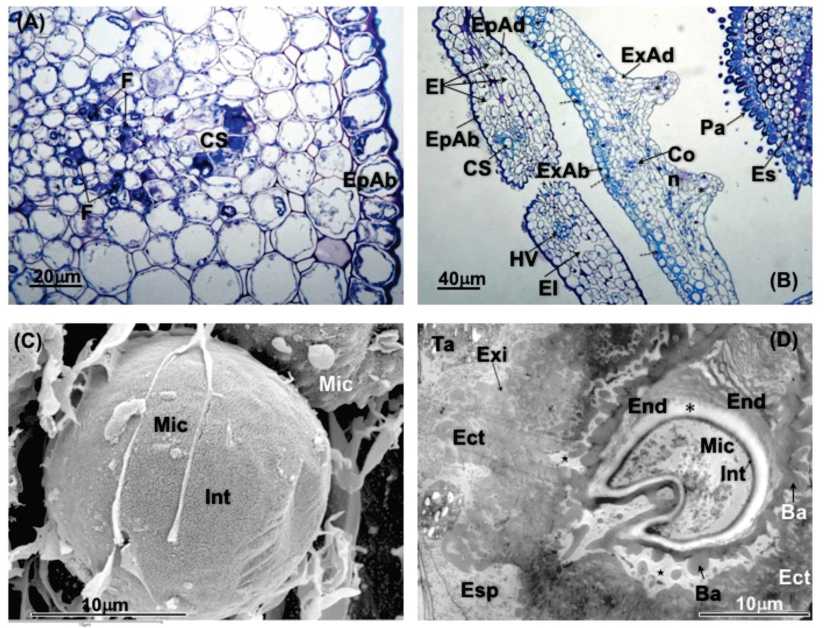
Fig. S2. A) Sección transversal de un pétale de flor fumigada (3 semanas) mostrando daños internos en la zona del haz vascular: vasos de floema taponados con calosa. 1000x. B) Sección transversal de una flor madura fumigada (4 semanas) mostrando daños internos que afectan a la formación de las anteras. Se observan como los 4 sacos polínicos (asteriscos) han abortado aunque se han desarrollado los refuerzos de la pared secundaria (flechas discontinuas). 400x. C) Micrografía de LTSEM de la antera de una flor madura fumigada (4 semanas). Detalle de una micróspora anormal sin exina. 5000x. D) Micrografía de TEM de la antera de una flor madura fumigada (4 semanas). Detalle del interior de una micróspora afectada: protoplasto degradado y separaciones (asteriscos) entre el protoplasto y la endexina y entre esta y la ectexina. Células del tapete alteradas y con vesículas anómalas. 4000x. Referencias: Ba: báculo; Con: conectivo; CS: canal secretor; Ect: ectexina: EI: espacio intercelular; End: endexina; EpAb: epidermis abaxial; EpAd: epidermis adaxial; Es: estilo; Esp: esporopolenina; ExAb: exotecio abaxial; ExAd: exotecio adaxial; Exi: exina; F: floema; HV: haz vascular; Int: intina; Mic: micróspora; Pe: pétalo; Ta: tapete.
movilizan para el nuevo crecimiento en otoño, hacia octubre. Reduciendo la biomasa radical, el ozono puede afectar a esta planta de dos modos diferentes. Primero, las reservas de la raíz son necesarias para la iniciación del crecimiento, en un período en el cual la fotosíntesis no es suficiente para sostener la respiración de la planta. En segundo lugar, un sistema menos desarrollado de la raíz puede representar un serio impedimento para la resistencia de la planta a las condiciones de estrés y para el éxito reproductivo, ya que el suelo es cada vez más seco duran-teel verano. Sin embargo, la extrapolación de estos resultados a las condiciones de campo es difícil, ya que en este experimento no fue simulado un período seco hacia finales del verano. Considerando la biología y los requisitos del hábitat de esta especie, es probable que los altos episodios de ozono que produzcan efectos nocivos sobre L. diania, son los que ocurren en la primavera, cuando el intercambio de gases en la planta no está limitado por las condiciones secas y las temperaturas altas que prevalecen en el verano.
Asimismo, los daños sobre la formación del polen han sido muy evidentes en la especie estudiada. Existen muy pocos trabajos que describan la acción del ozono sobre los sistemas reproductivos de los vegetales (Black et al., 2000; Chappelka, 2002; Gille-spie et al., 2015; Hernández-Tejeda et al., 2004; Naas et al., 2016; Pasqualini et al., 2011; Schoene, 2004), y muy escasos sobre la estructura y ultraestructura del proceso de formación del grano de polen (Schoene et al., 2004). Esto, probablemente se deba a que muchas especies tienen la floración en épocas en las que el ozono es poco abundante y los efectos son reducidos.
En el caso de L. diania los daños comienzan a apreciarse tras la meiosis de las células madre. En primer lugar se ve alterado el tapete, lo que tendrá efectos negativos sobre el polen, especialmente en su etapa final ya que los materiales de secreción que surgen de estas células nutricias están degradados por procesos oxidativos y no pueden nutrir a las células del polen ni formar convenientemente la exina de éstos.
El microscopio óptico permite diferenciar un número significativo de anteras abortadas, probablemente por el insuficiente aporte de sacarosa floemática proveniente de las hojas debido al taponamiento por calosa del floema de los filamentos estaminales, proceso que es muy corriente en los vasos floemá-ticos de hojas afectadas (Landolt et al., 1997; Rennenberg et al., 1996). Pero además, las anteras que aparentemente se encuentran en condiciones tienen los granos de polen alterados ya que, por una parte hay un porcentaje de ellos que carecen de contenido celular, y por otra, en los que tienen contenido, el citoplasma está muy dañado con una gran cantidad de vacuolas, reducido número de ribosomas, mitocondrias deformes, contenido poco denso y protoplasto celular separado de la intina.
Este conjunto de alteraciones provoca, por una parte, una disminución de las anteras y, por otra, una disminución de los granos de polen con capacidad de emitir tubo polínico en las anteras aparentemente normales. De todo ello se infiere que, independientemente de lo que pudiera suceder con el gineceo, la capacidad reproductiva de la planta se ve alterada por la baja tasa de producción de polen.
Podemos, por lo tanto, concluir que los niveles cada vez mayores de ozono en el Este de España pueden representar una amenaza grave para el endemismo L. diania. En la cuenca mediterránea, niveles relativamente altos del ozono pueden darse en primavera (Cristofanelli y Bonasoni, 2009; Sanz et al. , 2007) cuando las plantas no están hídri-camente estresadas. Si tales episodios de altas concentraciones de ozono afectan a la capacidad de la asimilación del CO2 por las hojas y reducen su eficiencia en el uso del agua (WUE) (datos suministrados por el CEAM), y quizás, también afectan el desarrollo del sistema radical, según ha mostrado este experimento, puede ser que también contribuyan a reducir la capacidad de estas plantas para soportar las condiciones de estrés hídrico que suelen darse en el verano. A esto hay que unir el hecho de los importantes efectos que produce el ozono sobre las flores de esta especie, especialmente sobre el desarrollo del polen. Las plantas endémicas son especies altamente valiosas y su protección y vigilancia deben ser una prioridad. En un marco donde los niveles de ozono van en aumento, el conocimiento de su sensibilidad y la caracterización de los efectos que produce representan una información muy importante para predecir los riesgos reales y futuros para estos componentes, altamente valiosos, de nuestros ecosistemas.
AGRADECIMIENTOS
Este estudio ha sido subvencionado por el Ministerio de Economía y Competitividad (MINECO CGL2012-40058-C02-01/02), FE-DER y la Generalitat Valenciana (PROMETE-OII2013/021, GVA y GVPRE/2008/140).
Damos las gracias a los técnicos del Servicio de Microscopía Electrónica de la Universidad Politécnica de Valencia por su disponibilidad y buen hacer a la hora de facilitarnos la observación de las muestras en TEM y en LTSEM.
BIBLIOGRAFÍA
Ainsworth E. A., Yendrek C. R., Sitch S., Collins W. J., Emberson L. D. 2012. The Effects of Troposphe-ric Ozone on Net Primary Productivity and Impli-cations for Climate Change. Annual Review of Plant Biology 63: 637-661.
Andersen C. P 2003. Source-sink balance and carbon allocation below ground in plants exposed to ozone. New Phytologist 157: 213-228. Asensi-Fabado A. 2007. Efecto del ozono troposférico sobre el cultivo de patata en Carcaixent (Valencia). Tesis doctoral. Universidad de Valencia. Asensi-Fabado A., García-Breijo F. J., Reig-Armiñana J. 2010. Ozone-induced reductions in below-ground biomass:an anatomical approach in potato. Plant Cell and Environment 33: 1070-1083.
Ashmore M. R. 2005. Assessing the future global impacts of ozone on vegetation. Plant cell and Environment 28 (8): 949-964.
Black V. J., Black C. R., Roberts J. A., Stewart C. A. 2000. Impact of ozone on the reproductive deve-lopment of plants. New Phytologist 147: 421447.
Bussotti F., Agati G., Desotgiu R., Matteini P, Tani C. 2005. Ozone foliar symptoms in woody plant species assessed with ultrastructural and fluo-rescence analysis. New Phytologist 166: 941955.
Bussotti F., Ferretti M. 1998. Air pollution, forest condition and forest decline in Southern Europe: an overview. Environmental Pollution 101 (1): 4965.
Calatayud V, Cerveró J., García-Breijo F. J., Reig-Armiñana J., Sanz M. J. 2011. Physiological, anatomical and biomass partitioning responses to ozone in the Mediterranean endemic plant Lamottea diania. Ecotoxicology and Environmental Safety 74 (5): 1131-1138.
Chappelka A. H. 2002. Reproductive development of blackberry (Rubus cuneifolius], as influenced by ozone. New Phytologist 155 (2): 249-255. Cristofanelli P, Bonasoni P 2009. Background ozone in the southern Europe and Mediterranean area: Influence of the transport processes. Environmental Pollution 157: 1399-1406.
Feder N., O'Brien T. P 1968. Plant microtechnique; some principles and new methods. American Journal of Botany 55: 133-142.
Feng Z. Z., Sun J. S., Wan W. X., Hu E. Z., Calatayud V. 2014. Evidence of wide spreado zone-induced visible injury on plants in Beijing, China. Environ-mental Pollution 193: 296-301.
Fumagalli I., Gimeno B. S., Velissariou D., De Temmer-man L., Mills G. 2001. Evidence of ozone-indu-ced adverse effects on crops in the Mediterra-nean region. Atmospheric Environment 35 (14): 2583-2587.
García-Breijo F. J., Calatayud V, Cerceró J., Reig-Armiñana J., Sanz M. J. 2005. Anatomical and Reproductive Effects of Ozone in the Endemic Mediterranean Plant Lamottea diania. International Society of Environmental Botanists & Natio-nal Botanical Research Institute. Third Internatio-nal Conference on Plants & Environmental Pollution. Lucknow (India) 28 nov-2 dec. Book of Abs-tracts, pp. 104-105.
García-Breijo F. J., Reig-Armiñana J., Bautista-Peris B., Calatayud V, Cerveró J.,
Sanz M. J. 2008. Effect anatomiques de l'ozone sur le térébinthe [Pistacia terebinthus). Foret Médi-terranéenne 29: 1 3-22.
García-Sebastiá C. 2006. Estudio anatómico e histológico de afecciones por ozono troposférico sobre el desarrollo floral de Centranthus ruber. Trabajo final de carrera. ETSMRE; Universidad Politécnica de Valencia.
Gillespie C., Stabler D., Tallentire E., Goumenaki E., Barnes J. 2015. Exposure to environmentally-relevant levels of ozone negatively influence pollen and fruit development. Environmental Pollution 206: 494-501.
Günthardt-Goerg M. S., Vollenweider P 2007. Linking stress with macroscopic and microscopic leaf response in trees: new diagnostic perspectives. Environmental Pollution 147: 467-488.
Hernández-Tejeda T., Roger M., Malcom J., De la Isla de Bauer M.L., Vargas J., Velánquez A., Alvarado D. 2004. Impacto del ozono sobre el polen de Pinus hartwegii Lindl. Revista Mexicana de Ciencias Forestales 26 (86): 5-18.
IPCC 2013. Intergovernmental Panel on Climate Chan-ge. Fifth Assessment Report.
Johansen D. A. 1940. Plant Microtechnique. New York, McGraw-Hill Book Company, Inc.
Karnosky D. F., Werner H., Holopainen T., Percy K., Oksanen T., Oksanen E., Heerdt C., Fabian P, Nagy J., Heilman W., Cox R., Nelson N., Matys-sek R. 2007. Free-Air ExposureSystems to Scale up Ozone Research to MatureTrees. Plant Biology 9 (2): 181-190.
Karnovsky M. J. 1965. A formaldehide-glutaraldehide fixative of high osmolarity for use in electron microscopy. Journal of Cell Biology 27: 137.
Krupa S., McGrath M. T., Andersen C. P, Booker F. L., Burkey K. O., Chappelka A. H., Chevone B. I., Pell E. J., Zilinskas B. A. 2001. Ambient ozone and plant health. Plant Disease 85: 4-12.
Landolt W., Gunthardt-Goerg M. S., Pfenninger I., Einig W., Hampp R., Maurer S., Matyssek R. 1997. Effect of fertilization on ozone-induced changes in the metabolism of birch [Betula péndula) leaves. New Phytologist 137: 389-397.
Leisner C. P, Ainsworth E. A. 2012. Quantifying the effects of ozone on plant reproductive growth and development. Global Change Biology 18: 606616.
Lelieveld J., Berresheim H., Borrmann S., Crutzen P J., Dentener F J., Fischer H., Feichter J., Flatau P J., Heland J., Holzinger R., Korrmann R., Lawrence M. G., Levin Z., Markowicz K. M., Mihalopoulos N., Minikin A., Ramanathan V., de Reus M., Roelofs G. J., Scheeren H. A., Sciare J., Schlager H., Schultz M., Siegmund P, Steil
B. , Stephanou E. G., Stier F!, Traub M., Warneke
C. , Williams J., Ziereis H. 2002. Global air po-llution crossroads over the Mediterranean. Science 298: 794-799.
Matyssek R., Bytnerowicz A., Karlsson P E., Paoletti E., Sanz M., Schaub M., Wieser G. 2007. Pro-motingthe O3 flux concept forEuropean forest trees. Environmental pollution 146 (3): 587-607.
Millán M. M., Artiñano B., Alonso L., Castro M., Fernández-Patier R., Goberna J. 1992. Meso-meteorological cycles of air pollution in the Ibe-rian Peninsula (MECAPIP), Air Pollution Research Report44, [EUR N (14834), Brussels, European Commission DG XII/E-1.
Millán M. M., Salvador R., Mantilla E., Artiñano B. 1996. Meteorology and photochemical air pollu-tion in southern Europe: experimental results from EC research projects. Atmospheric Environ-ment 30: 1 909-1 924.
Millán M. M., Salvador R., Mantilla E., Kallos G. 1997. Photooxidant dynamics in the Mediterranean basin in summer: results from European resear-ch projects. Journal of Geophysical Research 102: 8811-8823.
Millán M. M., Sanz M. J., Salvador R., Mantilla E. 2002. Atmospheric dynamics and ozone cycles related to nitrogen deposition in the western Mediterranean. Environmental Pollution 118: 167-186.
Moreno J. C., coord. 2008. Lista Roja 2008 de la flora vascular española. Dirección General de Medio Natural y PolíticaForestal (Ministerio de Medio Ambiente, y Medio Rural y Marino, y Sociedad Española de Biología de la Conservación de Plantas), Madrid, 86 pp.
Naas O., Mendez M., Quijada M., Gosselin S., Farah J., Choukri A., Visez N. 2016. Chemical modifi-cation of coating of Pinus halepensis pollen by ozone exposure. Environmental Pollution 214: 816-821.
Paoletti E. 2007. Ozone impactsonforests. CAB Re-views 2 (068).
Pasqualini S., Tedeschini E., Frenguelli G., Wopfner N., Ferreira F., D'Amato G., Ederli L. 2011. Ozone affects pollen viability and NAD (P) H oxidase release from Ambrosia artemisiifolia pollen. Environmental Pollution 159: 2823-2830.
Reig-Armiñana J., Calatayud V., Cerveró J., García-Breijo F. J., Ibars A., Sanz M. J. 2004. Effects of ozone on the foliar histology of the mastic plant [Pistacia lentiscus L.). Environmental Pollution 132: 321-331.
Reinert R., Gimeno B. S., Salleras J. M., Bermejo V., Ochoa M. J., Tarruel A. 1992. Ozone effects on watermelon plants at the Ebro delta (Spain). Symptomatology Agriculture Ecosystems and Environment 38: 41-49.
Rennenberg H., Herschbach C., Polle A. 1996. Con-sequences of air pollution on shoot-root interac-tions. Journal of Plant Physiology 148: 296-301.
Reynolds E. S. 1963. Use of lead citrate at high pH as an electronopaque stain in electron microsco-py. Journal of Cell Biology 17: 208-213.
Sanz M. J., Calatayud V., Sanchez G. 2007. Measu-res of ozone concentrations using passive sam-pling in forests of South Western Europe. Envi-ronmental Pollution 145: 620-628.
Sanz M. J., Millán M. M. 1998. The dynamics of polluted airmasses and ozone cycles in the western Mediterranean: relevance of forest ecosys-tems. Chemosphere 36: 1089-1094.
Sanz M. J., Millán M. M. 2000. Ozone in the Medite-rranean Region: evidence of injury to vegetation. In: Innes, J. L., Oleskyn, J. (Eds.). Forest Dynamics in Heavily Polluted Regions. CAB International, London, pp. 165-192.
Serna-Riddell J. M. 2006. Estudio histológico del efecto del ozono troposférico en el desarrollo foliar del endemismo «Carduncellus diannus». Trabajo final de carrera. ETSMRE; Universidad Politécnica de Valencia.
Schaub M., Calatayud V. 2013. Assessment of Visible Foliar Injury Induced by Ozone. En: Ferreti, M. and Fischer, R., (eds.). Forest Monitoring. Me-thods for terrestrial investigations in Europe with an overview of North America and Asia. 205221 . Amsterdam, The Netherlands.
Schoene K., Franz J.-Th., Masuch G. 2004. The effect of ozone on pollen development in Lolium perenne L. Environmental Pollution 131: 347-354.
Stübing G., Estévez A. (coord.).1990. Parque Natural del Montgó. Estudio multidisciplinar. Monografies 10. Agencia de Medi Ambient. Generalitat Valenciana.
Velissariou D., Davison A. W., Barnes J. D., Pfirr-mann T., Maclean D. C., Holevas C. D. 1992. Effects of air pollution on Pinus halepensis Mill.: pollution levels in Attica, Greece. Atmospheric Environment 26A (3): 373-380.
Vollenweider P, Ottiger M., Günthardt-Goerg M. S. 2003. Validation of leaf ozone symptoms in natural vegetation using microscopical methods. Environmental Pollution 124: 101-118.
Volz A., Kley D. 1988. Evaluation of the Montsouris series of ozone measurements made in the nine-teenth century. Nature 332: 240-242.
Watson M. L. 1958. Staining of tissue sections for electron microscopy with heavy metals. The Journal of Biophysical and Biochemical Cytology 4: 475-478
Wittig V. E., Ainsworth E. A., Shawna Naidu L., Kar-nosky D. F., Long S. P 2009. Quantifying the impact of current and future tropospheric ozone on tree biomass, growth, physiology and bioche-mistry: a quantitative meta-analysis. Global change biology 15 (2]: 396-424.














