Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Lilloa
versión impresa ISSN 0075-9481versión On-line ISSN 2346-9641
Lilloa vol.59 no.1 San Miguel de Tucumán jun. 2022
http://dx.doi.org/https://doi.org/10.30550/j.lil/2022.59.1/2022.06.03
Lilloa 59 (1): 94â111, 7 de junio de 2022
Artículo original
https://doi.org/10.30550/j.lil/2022.59.1/2022.06.03
Clorofitas, euglenofitas y cianobacterias de humedales de altura de tres provincias argentinas
Chlorophytes, euglenophytes and cyanobacteria of high wetlands from three provinces of Argentine
Mirande, Virginia1-2*  https://orcid.org/0000-0002-1780-7041
https://orcid.org/0000-0002-1780-7041
1Instituto Criptogámico - Laboratorio Ficológico, Fundación Miguel Lillo. Miguel Lillo 251, (4000) San Miguel de Tucumán, Argentina.
2Instituto de Limnología del Noroeste Argentino (ILINOA). Miguel Lillo 205, (4000) San Miguel de Tucumán, Argentina.
* Autor corresponsal: virginiamirande@yahoo.com.ar; vmirande@lillo.org.ar
Resumen
El objetivo del estudio fue contribuir al conocimiento de la composición y estructura de la taxocenosis conformada por cianobacterias, clorofitas y euglenofitas de estos ambientes extremos, en relación a variables abióticas (conductividad eléctrica, salinidad y pH del agua, altura sobre el nivel del mar y superficie lacustre). En 2005, se efectuó un muestreo interdisciplinario de veintiséis puntos de colecta en tres provincias del noroeste argentino (NOA). Los datos abióticos y bióticos registrados en campo y en laboratorio se hicieron según protocolos convencionales. De acuerdo a los resultados, la mayoría de los ejemplares identificados en Catamarca (coincidente con Jujuy y Salta) fueron cosmopolitas y afines con la salinidad, destacándose, en general, las cianobacterias y Chroococcus turgidus dentro de este grupo; en segundo lugar, estuvieron las algas verdes y, en el caso de las euglenofitas, no fueron registradas en dicha provincia. La taxocenosis estuvo constituida tanto por especies propias del fitoplancton como de otros hábitats. Los valores bajos a intermedios de diversidad (0,01-2,85) estarían vinculados al predominio de especies raras y de unas pocas dominantes. La biomasa mostró sensibilidad a las condiciones ambientales, en general disminuyó con el aumento de la salinidad, varió entre 24.007-60.396.324 mg/ml de C. La aplicación del Análisis de Componentes Principales, tanto para variables abióticas como bióticas, fueron de utilidad porque aportaron datos complementarios sobre la ocasionar floraciones y potencialÂmente tóxicas, como Chroococcus turgidus, Microcystis flos-aquae y Nodularia spumigena conducen a sugerir un control periódico de estos cuerpos de agua.
Palabras clave: Abundancia; Argentina; biomasa; diversidad; fitoplancton.
Abstract
The aim this study was to contribute to the knowledge of the composition and structure of taxocenosis formed by cyanobacteria, chlorophytes and euglenophytes of these extreme environments in relation to abiotic variables (water electrical conductivity, salinity, pH, height above sea level and lake surface). In 2005, an interdisciplinary sampling was carried out covering twenty-six collection sites in three provinces from Argentinean Northwest. Abiotic and biotic data were recorded in the field and in the laboratory following conventional protocols. According to the results, most of the specimens in the province of Catamarca (coinciding with Jujuy and Salta) were cosmopolitan and related to salinity, with Cyanobacteria and Chroococcus turgidus standing out in general within this group; green algae were in second place, while euglenophytes were not recorded in this province. Taxocenosis was made up of phytoplankton species and those coming from other habitats. The low to intermediate values ââof diversity (0.01-2.85) would be linked to the dominance of rare species and presence of a few taxa with high numbers of individuals. Biomass showed sensitivity to environmental conditions, highlighting in general a decrease of this variable with the increase in salinity, whose records varied between 24,007- 60,396,324 mg/ml of C. The application of the Principal Components Analysis for abiotic and biotic variables was a useful tool because it provided complementary information on the distribution of the selected sites. Finally, the quantification of cyanobacterial species potentially toxic and capable of producing blooms, such as Chroococcus turgidus, Microcystis flos-aquae and Nodularia spumigena lead to suggest a periodic control of these water bodies.
Keywords: Abundance; Argentine; biomass; diversity; phytoplankton.
Original recibido el 29 de abril 2022,
aceptado el 3 de junio 2022. Publicado en línea el 7 de junio 2022.
INTRODUCCIÃN
Los humedales son ecosistemas esenciales porque cumplen funciones ecológicas fundamentales para el hombre. Entre ellas, pueden nombrarse, la regulación de los regímenes hidrológicos y la provisión de recursos básicos (agua potable, peces, paja para techar, pastizales para el ganado, etc.) para su subsistencia (Canevari et al., 1999). Se reconocen en nuestro país veintiún humedales ramsar, es decir, protegidos por convenios internacionales (Vecinos del Humedal, 2013). La superficie del territorio nacional ocupada por estos ambientes se estima en 600.000 km 2 que representan el 21,5% (Kandus et al., 2008). El significado de la palabra âhumedalâ, en sentido estricto, hace referencia a marismas, pantanos, turberas y superficies de aguas estancadas o fluyentes; permanentes o temporales; naturales o artificiales; dulces, saladas o salobres; y extensiones de agua marina con profundidades en bajamar inferiores a los seis metros (Canevari et al., 1998; Kandus et al., 2011). La expresión âramsarâ es indicativa de la ciudad de Ramsar (Irán), donde se efectuó y firmó el Primer Conve- nio Internacional sobre Humedales en el año 1971. La finalidad de este encuentro fue proteger los ecosistemas elegidos como nidificaciones por las aves acuáticas (Coco- nier, 2005). Aparte de su importancia como reservorios avícolas, estos ambientes son (o deben ser) valorados, como reservas de agua, recarga de acuíferos, mitigadores de erosiones y para el funcionamiento de cuencas hidrográficas menores. Son útiles en las retenciones, transformaciones y remociones de la materia orgánica, sedimentos, nutrientes y contaminantes. Además de proporcionar refugios temporarios a aves migratorias (flamencos andinos, chilensis y de james, otras) y a diversos mamíferos (burros, llamas, vicuñas, guanacos, zorros, chinchillas, etc.), albergan ejemplares de plantas y animales endémicos. Sus condiciones de fragilidad y extremidad están asociadas a causas naturales como la presencia de varios meses de sequías, altas irradiaciones, vientos constantes de diferentes intensidades, amplitudes térmicas extremas y, también, a actividades antrópicas tales como la agricultura no sostenible, sobrepastoreo y la minería a cielo abierto (Caziani y Derlindati, 1999).
En verano de 2005, se participó del III Censo Simultáneo Internacional de flamencos andino (Phoenicoparrus andinus), de James (P. jamesi) y chilensis (Phoenicopterus chilensis), organizado por el equipo para la Conservación de Flamencos Altoandinos, encabezado por la Dra. Sandra Caziani, quienes nos invitaron para obtener información ficológica de estos ambientes. Se llevó a cabo en la puna norteña y sirvió como base a varias publicaciones. El objetivo fue contribuir al conocimiento de la estructura de la taxocenosis conformada por cianobacterias, clorofitas y euglenofitas de estos ambientes extremos en relación a variables abióticas (conductividad eléctrica, salinidad y pH del agua, altura sobre el nivel del mar y superficie lacustre). En Mirande y Tracanna (2009) se expusieron los cambios observados en las provincias de Jujuy y Salta, incorporándose en esta nueva contribución a la provincia de Catamarca. Se pudo constatar en las lagunas de salinidades intermedias las máximas densidades algales (7426 ind/ml en Catal), mienÂtras que en las de dimensiones pequeñas e hipersalinas se dieron los menores registros (24-43 ind/ml). Las entidades que sobresalieron dentro de los grupos considerados fueron Phormidium molle Gomont, P. tergestinum (Kütz.) Anagnostidis et Komárek, Chlamydomonas tremulans Rodhe et Skuja y Euglena proxima Dangeard. Respecto a las diatomeas, no consideradas a fin de valorar los aportes dados por los otros grupos taxonómicos, Seeligmann et al. (2008) reconocieron, dentro de los 208 taxones identificados en humedales de altura jujeños, una dominancia de especies bentónicas, capaces de vivir en ambientes someros expuestos a desecaciones (Van Dam et al., 1994), tales como Nitzschia palea (Kütz.) W. Smith y Pinnularia brebissonnii (Kütz.) Rabenhorst. Además, encontraron una correlaÂción positiva entre la riqueza específica con la altura, tanto para sitios ubicados en la Puna como en la Cordillera Oriental. Mayores detalles sobre los puntos seleccionados para esta publicación, por ejemplo, desde el punto de vista geomorfológico, climático, conservación y usos pueden consultarse en Mirande y Tracanna (2007, 2009, 2015, 2017).
Cabe destacarse que las recopilaciones sobre estos ambientes extremos son escasas, debido a la precariedad y peligrosidad de los caminos, muchas veces, no visibles ni siquiera como huellas. Existen otros antecedentes vinculados a estos cuerpos de agua, tanto a nivel limnológico (Halloy, 1978, 1982; Salusso et al., 1997b) como ornitológico (Caziani y Derlindati, 1999, 2000; Caziani et al., 2001), fitoplanctónico (Salusso et al., 1997a; Seeligmann y Maidana, 2003; Maidana y Seeligmann, 2006; Salusso y Moraña, 2015) y zooplanctónico (Paggi y Villagra de Gamundi, 1980; Locascio de Mitrovich, 1986; Villagra de Gamundi, 1994, 1998; Locascio de Mitrovich y Ceraolo, 1999; Locascio de Mitrovich et al., 2005).
MATERIALES Y MÃTODOS
En relación a los sitios seleccionados para este estudio, fueron coincidentes con Mirande y Tracanna (2015). Durante el verano de 2005 (enero-febrero), se efectuó un muestreo interdisciplinario de diez días a veintiséis puntos de colecta, el cual abarcó tres provincias del NOA (Fig. 1): Jujuy (complejo de Vilama, lagunas Pozuelos, Los Enamorados y Runtuyoc), Salta (laguna Pastos Grandes) y Catamarca (lagunas La Alumbrera, Purulla, Grande, Carachi Pampa, Diamante, Baya, del Salitre, Blanca y embalse Cortaderas). En la laguna Palar se consideraron dos muestras, una en cada cubeta de agua, nombradas como Palar Chica y Palar Grande.
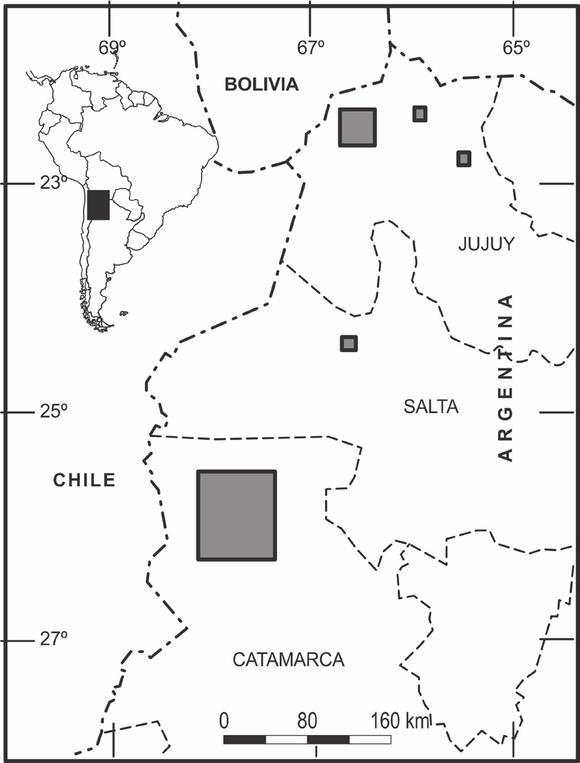
Fig. 1. Ubicación de las áreas de estudio en las provincias de Jujuy, Salta y Catamarca.
Fig. 1. Location of the study areas in the provinces of Jujuy, Salta and Catamarca.
La caracterización ambiental se realizó en base a datos de conductividad eléctrica (μS/cm), pH, altitud (m snm) y superficie del cuerpo de agua. Las dos primeras variables fueron medidas in situ con conductímetro Altronix (modelo CT-1) y peachímetro digital portátil Altronix (modelo TPA-1). La altitud y posición de los sitios de muestreo se registraron con un GPS 12 XL. También se emplearon datos de Caziani y Derlindati (1999) y Caziani et al. (2001). Caziani y Derlindati (2000) estimaron las profundidades de las lagunas en la zona central y las definieron, de acuerdo a la pendiente de las cubetas, como: somera (menor de 1%), intermedia (1%) y profunda (mayor de 2%).
En relación al fitoplancton se hizo una extracción directa de dos muestras subsuperficiales por sitio en envases plásticos de 250 cm 3 que, inmediatamente, fueron fijadas con formaldehído diluido al 4%. La poca profundidad de la mayoría de estos ambientes hizo que hubiese que introducirse a varios metros de las orillas para la extracción del material ficológico. Se consideró la abundancia absoluta de la ficoflora y su recuento se realizó con microscopio invertido Zeiss ID02, previa sedimentación en cámara de 10 ml. Se contó un número de campos elegidos al azar, con una confianza del 95% ( a = 0,05). Las algas unicelulares, coloniales y filamentosas fueron consideradas como unidad âindividuoâ. La bibliografía consultada para la identificación de los taxones es indicada en Mirande y Tracanna (2007, 2017).
La diversidad específica se calculó a partir de Shannon-Weaver, índice que fluctúa entre 0 (baja) y por encima de 4 (alta), interpretándose los valores por debajo de 1,5 como una diversidad específica baja y entre este valor y 4 una diversidad específica media (Hewitt, 1991).
La biomasa algal se obtuvo multiplicándose el biovolumen promedio de los individuos contados (μm 3 /ind) por sus respectivas abundancias absolutas (ind/ml). Los resultados son expresados en peso seco (mg/ml de carbono). Las fórmulas geomé- tricas se basaron principalmente en Lewis (1976) y Rott (1981).
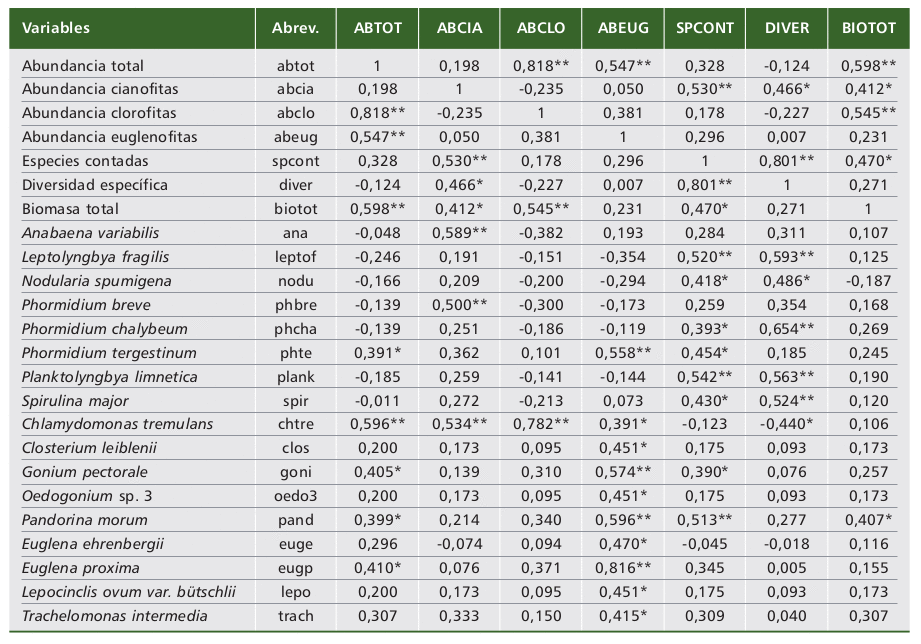
Se empleó el coeficiente de correlación de Spearman para estudiar las relaciones ( a = 0,05* significativa; 0,01** altamente significativa) entre las variables abióticas y bióticas seleccionadas, previa transformación logarítmica (log10), a excepción de diversidad y rangos de salinidad (valores bajos), con la finalidad de reducir los amplios márgenes de variabilidad de los datos. Los rangos de salinidad se estimaron a partir de la conductividad eléctrica: 1= salino (1150-8700 μS/cm), 2= salino-hipersalino (22.500-40.300 μS/cm) y 3= hipersalino (108.300-268.800 μS/cm).
Mediante el análisis de componentes principales (ACP) se compararon las muestras en relación con, por un lado, las variables abióticas (altura, superficie, conductividad eléctrica, pH y rangos de salinidad) y, por el otro, las bióticas. En la selección de estas últimas, se tuvo en cuenta el paso anterior, es decir, que hubiese correlaciones significativas entre los taxones estudiados con: especies contadas, biomasa, diversidad y abundancia absoluta (total y parciales: cianobacterias, clorofitas, euglenofitas). Se utilizaron valores normalizados y estandarizados y la matriz de correlación, los cuales fueron procesados mediante el prograÂma NTSYS (Rohlf, 1990).
Con referencia al material estudiado, las características de los ambientes y las distribuciones de las especies cuantificadas en los sitios de muestreo son detalladas en las tablas 1 y 2.
RESULTADOS
Las aguas de los puntos seleccionados para este estudio fueron alcalinas y de salinidades variables. Los sitios de muestreo se ubicaron por encima de los 3000 m snm (salvo la laguna Carachi Pampa) y, sólo en ocho de los veintiséis sitios estudiados, sus superficies superaron las 8000 hectáreas, destacándose la laguna Pozuelos con 16.470 ha (Tabla 1).
Tabla 1. Características abióticas y georreferenciales de los ambientes estudiados.
Table 1. Abiotic and georeferencing characteristics of the environments studied.
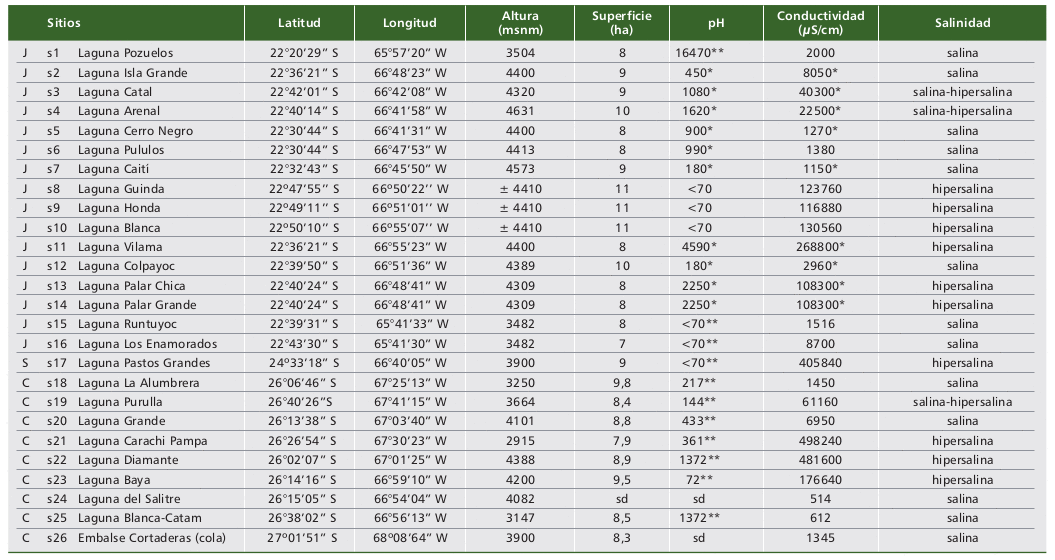
Referencia: Caziani y Derlindati, 1999 (*), Caziani et al., 2001 (**), sd (sin datos), C (Catamarca), J (Jujuy), S (Salta).
Reference: Caziani y Derlindati, 1999 (*), Caziani et al., 2001 (**), sd (no data), C (Catamarca), J (Jujuy), S (Salta).
En relación con la cuantificación de la ficoflora (Tabla 2), se registraron un total de 39 taxones: cianobacterias (18), clorofitas (17) y euglenofitas (4).
Tabla 2. Distribución de las especies e individuos cuantificados en los sitios de muestreo.
Table 2. Distribution of the species and individuals quantified in the sampling sites.
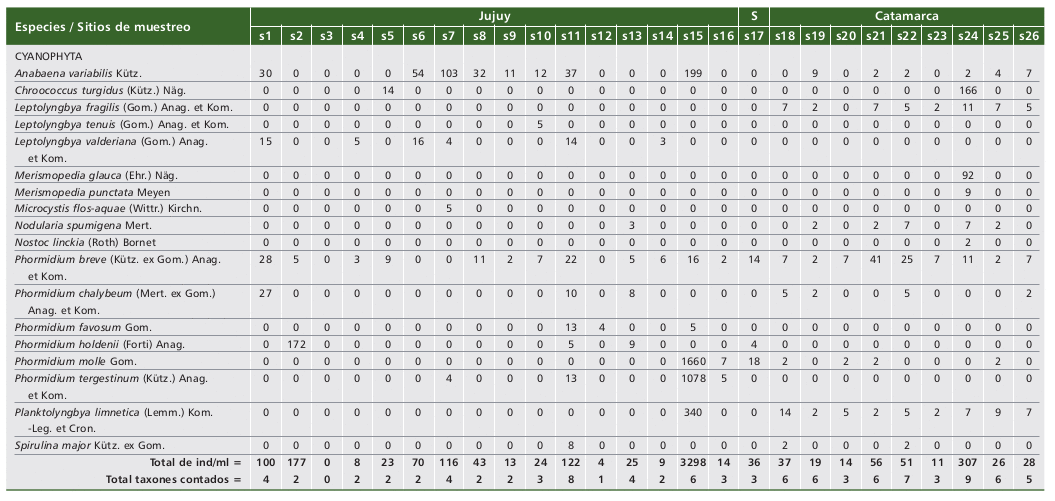
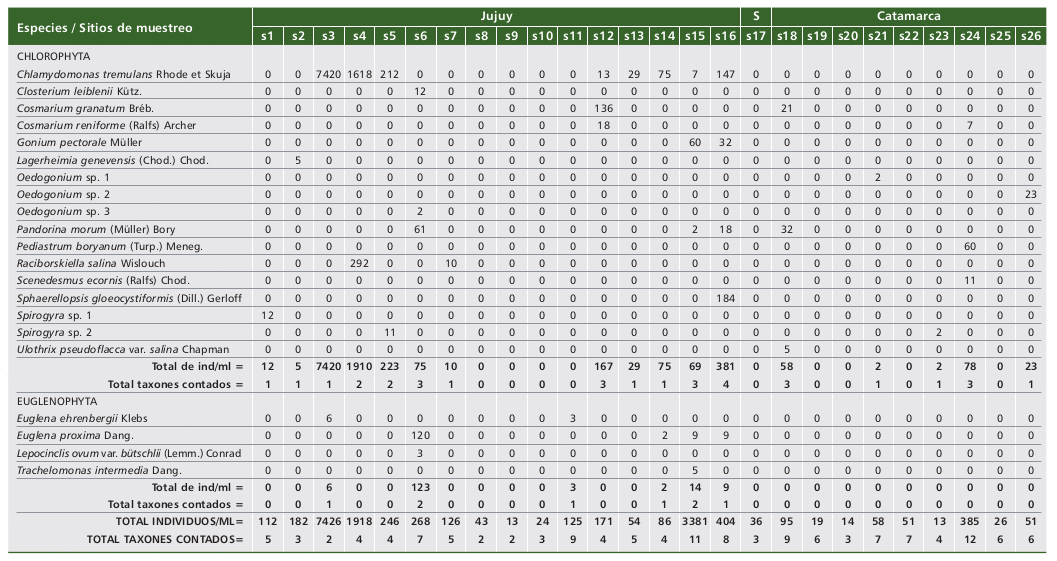
Referencia: S = Salta, 0 = no registrado.
Reference: S = Salta, 0 = not registered.
La mayor densidad se obtuvo en la laguna salina-hipersalina Catal (Jujuy, 7426 ind/ml), debido casi exclusivamente a Chlamydomonas tremulans (7420 ind/ml), y las menores (13 ind/ml) en las lagunas hipersalinas Honda (Jujuy) y Baya (Catamarca), vinculadas sobre todo con las cianobacterias (Fig. 2).
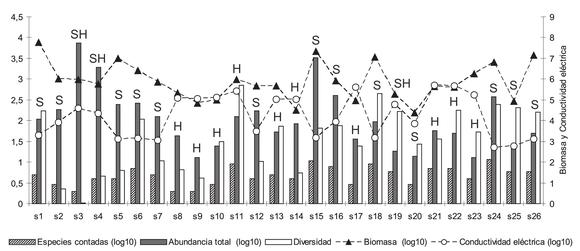
Fig. 2. Distribución de las variables biológicas en relación a la conductividad eléctrica (variables expresadas en log10, excepto la diversidad específica). Referencia: S, ambiente salino; SH, ambiente salino-hipersalino; H, ambiente hipersalino.
Fig. 2. Distribution of biological variables in relation to electrical conductivity (variables expressed in log10, except the specific diversity). Reference: S, saline environment; SH, saline-hypersaline environment; H, hypersaline environment.
Las cianobacterias aportaron más del 80% de los individuos por sitio en dieciséis de los veintiséis puntos seleccionados. No obstante, pudo observarse que los máximos valores se obtuvieron en los ambientes de bajas salinidades, es el caso de Phormidium molle con 1660 ind/ml en la laguna Runtuyoc. En los ambientes salinos-hipersalinos estuvieron a bajos registros o ausentes y el mayor aporte correspondió a Anabaena variabilis (laguna Purulla: 9 ind/ml), mientras que en los cuerpos de agua hipersalinos, la especie P. breve fue registrada con el mayor número de individuos (laguna Carachi Pampa: 41 ind/ml). En relación a las clorofitas sólo fueron contadas en diecisiete sitios, destacándose a su vez que los mayores aportes fueron realizados por Chlamydomonas tremulans en las lagunas salinas-hipersalinas Catal (7420 ind/ml) y Arenal (1618 ind/ml), registros que implicaron contribuciones del 100% y 84% en sus respectivas densidades. Las euglenofitas sólo en la laguna Pululos tuvieron un papel representativo debido a Euglena proxima (120 ind/ml) pero, en realidad, estuvieron a bajas concentraciones (2-9 ind/ml) y ausentes en veinte de los ambientes muestreados, no siendo observadas en las provincias de Salta y Catamarca. Sin embargo, en el ambiente salino antes nombrado (laguna Pululos) dicha especie contribuyó con el 45% de los individuos contados. Si se consideran las veces en que las entidades taxonómicas fueron censadas caben ciertos comentarios. Si se toma en cuenta una frecuencia de aparición del 23%, equivalente a que el taxón fue contado en por lo menos seis de los veintiséis ambientes leníticos estudiados, el listado de los treinta y nueve ejemplares se reduce a Anabaena variabilis, Leptolyngbya fragilis, L. valderiana, Nodularia spumigena, Phormidium breve, P. chalybeum, P. molle, Planktolyngbya limnetica y Chlamydomonas tremulans, en lo cual se aprecia las contribuciones de las cianobacterias a estos ambientes.
La diversidad fue baja en once de los veintiséis ambientes seleccionados y, en los restantes, correspondió a una diversidad específica intermedia, con un mínimo de 0,01 en la laguna Catal (salina-hipersalina) y un máximo de 2,85 en la laguna Vilama (hipersalina) (Fig. 2).
En relación a la biomasa, los valores extremos se observaron en los ambientes salinos, con un máximo de 60.396.324 mg/ml de C (7,78 log10) en la laguna Pozuelos y un mínimo de 24.007 mg/ml de C (4,38 log10) en la laguna Grande (Fig. 2).
En las tablas 3 y 4 se indican las asociaciones significativas ( a = 0,05* significativa, 0,01** altamente significativa) encontradas, entre las cuales pueden comentarse que en condiciones de menor conductividad y salinidad se observaron los valores más altos de biomasa y abundancias total y de clorofitas. Tendencia semejante se dio entre el pH con el número de especies contadas (-0,611**), densidades de euglenofitas (-0,464*) y de Euglena proxima (-0,477*) y con la diversidad (-0,389*).
Tabla 3. Relaciones significativas de las variables abióticas con otras variables ( a = 0,05* significativas; 0,01** altamente significativas).
Table 3. Significant relationships of the abiotic variables with other variables ( a = 0.05* significant; 0.01** highly significant).
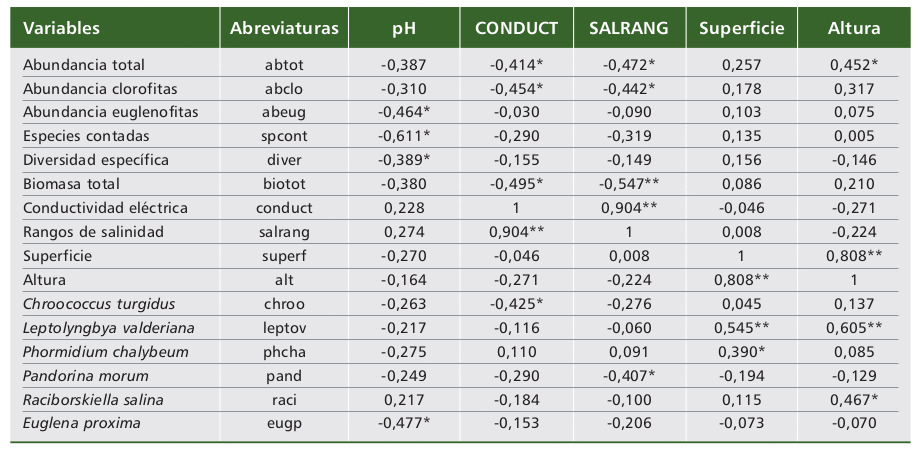
Tabla 4. Relaciones significativas entre las variables bióticas ( a = 0,05* significativas; 0,01** altamente significativas).
Table 4. Significant relationships between biotic variables ( a = 0.05* significant; 0.01** highly significant).
En el análisis de componentes principales, donde se consideró la distribución de los sitios en relación a las variables abióticas, los componentes 1 y 2 explicaron el 92% y 6% de la varianza total (Fig. 3). Ambos ejes ordenaron hacia la parte positiva a los ambientes con mayores valores de pH, conductividad y salinidad (salinoshipersalinos e hipersalinos) y hacia la parte negativa a las muestras salinas y de menor conductividad eléctrica y pH. A su vez, el dos discriminó a los cuerpos de agua de acuerdo a sus superficies, distribuyendo los más pequeños en los cuadrantes inferiores y a los de mayores dimensiones en los superiores. Las variables que contribuyeron a este ordenamiento en el componente 1 (autovectores >0,60) fueron los rangos de salinidad (0,91), conductividad eléctrica (0,88) y pH (0,61), mientras que en el componente dos pesaron la superficie del cuerpo de agua (0,77) y el potencial hidrógeno (-0,62).
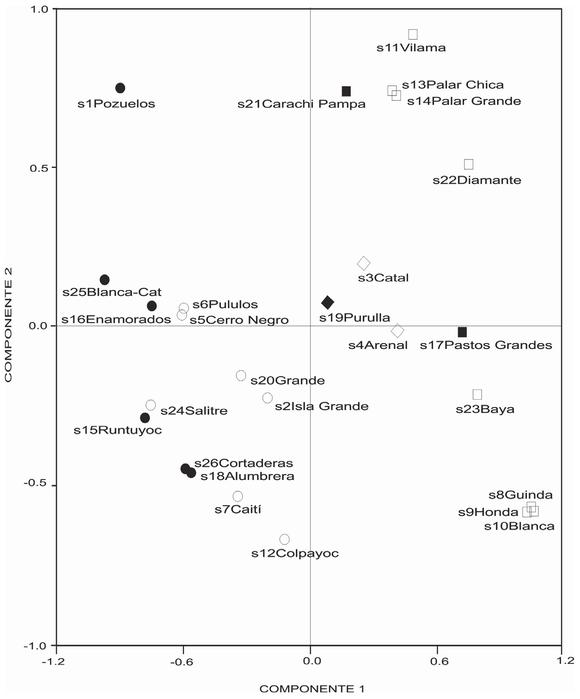
Fig. 3. Distribución de los sitios en relación a las variables abióticas mediante el Análisis de Componentes Principales. Referencia: ambientes hipersalinos (cuadrado negro: <4000 m snm, cuadrado blanco: >4000 m snm); ambientes salinos-hipersalinos (rombo negro: <4000 m snm, rombo blanco: >4000 m snm); ambientes salinos (círculo negro: <4000 m snm, círculo blanco: >4000 m snm).
Fig. 3. Distribution of the study sites in relation to abiotic variables by means of Principal Component Analysis. Reference: hypersaline environments (black quadrate <4000 m asl, white quadrate: >4000 m asl); saline-hypersaline environments (black diamond: <4000 m asl, white diamond: >4000 m asl); saline environments (black circle: <4000 m asl, white circle: >4000 m asl).
También se quiso valorar el rol de las variables bióticas en la separación de los sitios de muestreo. Si se compara el ordenamiento de los puntos de muestreos por los ejes 1 y 2 en base a los datos biológicos, surge que explicaron respectivamente el 88% y 6% de la varianza total (Fig. 4). Los componentes uno y dos ordenaron hacia los cuadrantes superior e inferior derechos a las muestras con los mayores valores de: especies contadas, biomasa y densidades de cianobacterias, euglénidos, Phormidium breve, P. tergestinum, Planktolyngbya limnetica, Chlamydomonas tremulans, Gonium pectorale y Euglena proxima. Las variables que contribuyeron a este ordenamiento en el eje uno (autovectores >0,60) fueron el número de especies contadas (0,77), biomasa (0,62) y las abundancias de cianobacterias (0,68), euglénidos (0,66), Phormidium tergestinum (0,77), Planktolyngbya limnetica (0,60), Gonium pectorale (0,71) y Euglena proxima (0,64). En el eje dos pesaron las densidades de las algas verdes (-0,74), Chlamydomonas tremulans (-0,76), Phormidium breve (0,70) y la total (-0,60) que contribuyeron a que los ambientes con los mayores registros se distribuyesen hacia los sectores inferiores. También, pero a niveles menores, influyeron en el componente uno Pandorina morum (0,58), abundancia total (0,51) y Anabaena variabilis (0,50), mientras que en el dos lo hicieron Leptolyngbya fragilis (0,57), la diversidad (0,52) y la densidad de las euglenofitas (-0,50).
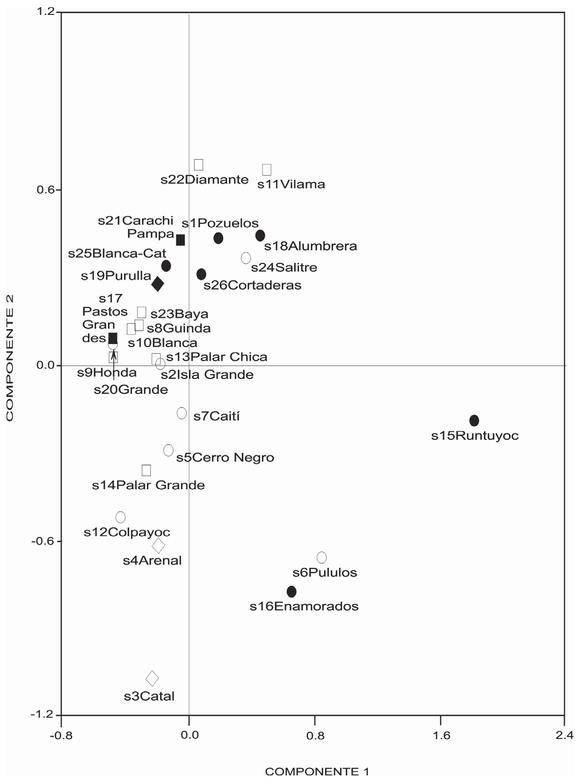
Fig. 4. Distribución de los sitios en relación a las variables bióticas mediante el Análisis de Compo- nentes Principales. Referencia: ambiente hipersalino (cuadrado negro <4000 m snm, cuadrado blanco >4000 m snm); ambiente salino-hipersalino (rombo negro <4000 m snm, rombo blanco >4000 m snm); ambiente salino (círculo negro <4000 m snm, círculo blanco >4000 m snm).
Fig. 4. Distribution of the study sites in relation to biotic variables by means of Principal Component Analysis. Reference: hypersaline environments (black quadrate <4000 m asl, white quadrate: >4000 m asl); saline-hypersaline environments (black diamond: <4000 m asl, white diamond: >4000 m asl); saline environments (black circle: <4000 m asl, white circle: >4000 m asl).
DISCUSIÃN Y CONCLUSIONES
En base a los resultados del muestreo estival de 2005, efectuado en veintiséis sitios pertenecientes a tres provincias argentinas, caben algunos comentarios.
En Catamarca, coincidente con Jujuy y Salta, la mayoría de los ejemplares fueron cosmopolitas y afines con la salinidad, destacándose, en líneas generales, las cianobacterias (Mirande y Tracanna, 2015, 2017). La especie planctónica Chroococcus turgidus fue la que más aportó en los ambientes catamarqueños, la cual es tolerante a diferentes salinidades (Frémy, 1930) y, según Mantilla Díaz (2015) puede ser considerada eurihalina, mientras que en los ambientes jujeños y en el salteño el mayor aporte correspondió a dos especies del género Phormidium provenientes del bentos y del perifiton. En relación a las algas verdes, mostraron sensibilidad a la salinidad (Mirande y Tracanna, 2009) y el mayor registro en la provincia de Catamarca fue de Pediastrum boryanum en la laguna del Salitre y, aunque esta especie no tuvo correlación con las variables abióticas analizadas en este estudio, es típica de aguas leve- mente alcalinas, eutróficas, no poluídas (Komárek y Jaconvská, 2001). Lo expuesto, conduce a expresar que el fitoplancton en estos ambientes someros está constituido por organismos provenientes de otros hábitats, en lo cual favorecería la escasa profundidad y persistencia de vientos de diferentes intensidades. A pesar de que no se dispone de registros numéricos, la escasa profundidad de varias de las lagunas censadas quedó de manifiesto ya que hubo que ingresar varios metros para la toma de las muestras algales y, además, porque las patas de los flamencos estaban (muchas veces) sumergidas hasta el talón. Diversos autores en sus respectivos trabajos llegaron a conclusiones afines, donde el reclutamiento temporal de especies ticoplanctónicas de los sedimentos sería uno de los factores que explicarían la supervivencia de las comunidades algales fluviales y/o de lagos superficiales (Billen et al., 1994; Izaguirre y Vinocur, 1994; Reynolds et al., 1994; Reynolds et al., 2002; Mirande y Tracanna, 2004; Luque y Martínez de Fabricius, 2010; etc.). Podría inferirse que la turbulencia, incrementada por los vientos comunes en estas zonas, además de las escasas profundidades de la mayoría de los cuerpos lacustres estudiados, tendría en ello un rol relevante. La importancia de este factor a nivel de la supervivencia de la biota acuática fue destacada por Ambühl (1960) y Margalef (1983). Rodríguez-Centeno et al. (2010), en un estudio llevado a cabo en la isla La Tortuga (Venezuela), comentaron el rol destacable de la turbulencia generada por el viento en la estructura de la comunidad fitoplanctónica.
Los valores bajos a intermedios de diversidad estuvieron vinculados a una taxocenosis donde pocos ejemplares tuvieron elevados números de individuos y predominaron las especies raras. Según Ceballos (2001), una especie rara se caracteriza porque tiene distribuciones restringidas, poblaciones poco abundantes o combinaciones de ambos factores y, en esta ocasión, estaría más enfocado a lo segundo, ya que muchas fueron cosmopolitas o de una amplia distribución geográfica de acuerdo a las bibliografías consultadas (Mirande y Tracanna, 2015; 2017).
La biomasa mostró sensibilidad a las condiciones ambientales, destacándose, en líneas generales, una disminución de esta variable con el aumento de la salinidad. Esto fue avalado por las correlaciones encontradas (Tabla 3) siendo, además, uno de los autovectores biológicos que pesó en la separación de los sitios de muestreo en el análisis de componentes principales (Fig. 4), así como la salinidad tuvo su importante protagonismo en el discernimiento de los ambientes leníticos al utilizarse las variables abióticas seleccionadas para este estudio (Fig. 3). En esto último, también debe mencionarse, por ejemplo, el potencial hidrógeno donde los altos valores registrados estarían vinculados a aguas bicarbonatadas, en las que generalmente el sodio y potasio son los cationes más frecuentes, además de ser nutrientes esenciales de las cianobacterias (Provasoli, 1969; Cole, 1988). Caziani y Derlindati (1999) registraron valores 60-13.800 (estación húmeda: enero 1997) y 178-48.000 (estación seca: octubre 1997) miligramos por litro de sodio para la laguna Vilama, por lo cual no sería un elemento deficitario en los humedales considerados. Como puede observarse, la aplicación de este método multivariado para ambas situaciones (variables abióticas y bióticas) fue una herramienta útil porque aportó informaciones que son complementarias para el discernimiento de los sitios seleccionados.
Por último, la cuantificación de especies de cianobacterias capaces de ocasionar floraciones en condiciones ambientales apropiadas, como Chroococcus turgidus, Microcystis flos-aquae y Nodularia spumigena conducen a sugerir un control de estos cuerpos de agua, siendo importante el registro de los nutrientes nitrogenados y fosforados, ya que algunas cepas pueden ser potencialÂmente tóxicas (Campos et al., 2005; Mantilla Díaz, 2015). No debe olvidarse que, en el caso del nitrógeno, pueden utilizar varias fuentes de nutrimento (amonio, nitrato y nitrógeno atmosférico), mientras que a nivel del fósforo emplean el ortofosfato como nutriente inorgánico soluble. Asimismo, de acuerdo a la cepa, son capaces de producir dos tipos de toxinas básicas: hepatotoxinas y neurotoxinas. Responsables de lo primero, son algunas cepas de especies de los géneros Microcystis, Anabaena, Nodularia, Oscillatoria, Nostoc, Lyngbya, Tolypothrix entre otros. En las neurotoxinas, en cambio, participan ejemplares correspondientes a Anabaena, Oscillatoria, Cylindrospermopsis, etc. (Mantilla Díaz, 2015).
La fragilidad de estos ambientes, donde la vegetación es escasa a nula, lleva a ser insistente en la protección de estos ecosistemas tanto a nivel de usos recreativos como del turismo en vehículos de doble tracción; exploraciones que impliquen extracciones de agua subterránea que, indefectiblemente, llevan al secado de vegas y bofedales; entre otros. No debe olvidarse que estos reservorios naturales, aparte de su belleza indescriptible, son fuentes de un recurso tan fundamental y vital como el agua, esencial para toda vida.
AGRADECIMIENTOS
A la Dra. Sandra Caziani y su equipo de trabajo por convocarnos para participar en este proyecto. A la Dra. Beatriz Tracanna, ahora jubilada, por ser una gran amiga, profesora y colega (con mayúscula) con quien compartimos muchas experiencias laborales, entre ellas estos magníficos paisajes norteños. También deseo agradecer a la Fundación Miguel Lillo porque si no fuese parte de su plantel no estaría realizando esta publicación.
BIBLIOGRAFÍA
Ambühl, H. (1960). Die Bedeutung der Strömung als ökologister Faktor. Schweiz. Z. Hydrology 21: 133-264. [ Links ]
Billen, G., Garnier, J. y Hanset, P. (1994). Modelling phytoplankton development in whole drainage networks: the RIVERSTRAHLER Model applied to the Seine River System. En: Descy, J. -P., Reynolds, C. S., Padisák, J. (Eds.), Phytoplankton in Turbid Environments: Rivers and Shallow Lakes (pp. 119-137). Hidrobiologia 294. [ Links ]
Campos, V., Lisperguer, S., Weckesser, J., Vera, A. y Muñoz, D. (2005). Cianobacterias y riesgos potenciales de toxicidad en aguas continentales de Chile. Boletín Micológico 20: 73-81. [ Links ]
Canevari, P., Blanco, D. E., Bucher, E. H., Castro, G. y Davidson, I. (1998). Los humedales de la Argentina. Wetlands International Publications 46: 1-208. [ Links ]
Canevari, P., Blanco, D. E. y Bucher, E. H. (1999). Los Beneficios de los Humedales de la Argentina. Amenazas y propuestas de soluciones. Wetlands International. Buenos Aires. 64 pp. [ Links ]
Caziani, S. M. y Derlindati, E. J. (1999). Humedales altoandinos del Noroeste de Argentina: su contribución a la biodiversidad regional. En: Malvárez, A. I. (Ed.), Tópicos sobre humedales subtropicales y templados de Sudamérica (pp. 1-13). Oficina Regional de Ciencia y Tecnología de la UNESCO para América Latina y el Caribe -ORCYT - Montevideo, Uruguay. [ Links ]
Caziani, S. M. y Derlindati, E. J. (2000). Abundance and habitat of High Andean flamingos in Northwestern Argentina. Waterbirds 23 (Special Publication 1): 121-133. [ Links ]
Caziani, S. M., Derlindati, E. J., Tálamo, A., Sureda, A. L., Trucco, C. E. y Nicolossi, G. (2001). Waterbird Richness in Altiplano Wetlands of Northwestern Argentina. Waterbirds 24 (1): 103-117. [ Links ]
Ceballos, C. (2001). Especies raras, el conocimiento de la diversidad biológica y la conservación. CONABIO. Biodiversitas 38: 9-13. [ Links ]
Coconier, E. (2005). Reporte final aves acuáticas en la Argentina. En: Blanco, D. E. (Ed.), La Conservación de las Aves Acuáticas para las Américas (Waterbird Conservation for the Americas) (pp. 2-137). Wetlands International. Buenos Aires. [ Links ]
Cole, G. A. (1988). Manual de Limnología. Ed. Hemisferio Sur S.A. (primera edición). Buenos Aires. 405 pp. [ Links ]
Frémy, P. (1930). Les Myxophycées de lâ Afrique aquatoriale française. Caen Archives de botanique 3 (2): 1-508. [ Links ]
Halloy, S. (1978). Contribución al estudio de la zona de Huaca Huasi, Cumbres Calchaquíes (Tucumán, Argentina). La biota actual en relación con la geología histórica (Tesis de Grado), Universidad Nacional de Tucumán, Argentina. [ Links ]
Halloy, S. (1982). Contribución al estudio de la zona de Huaca Huasi, Cumbres Calchaquíes, (Tucumán, Argentina). Climatología y edafología en relación con la composición y adaptación de las comunidades bióticas (Tesis Doctoral), Universidad Nacional de Tucumán, Argentina. [ Links ]
Hewitt, G. (1991). River quality investigations, Part 1: Some diversity and biotic indices. Journal of Biological Education 25 (1): 44-52. [ Links ]
Izaguirre, I. y Vinocur, A. (1994). Algal assemblages from lakes of the Salado River Basin (Argentina). En: Descy J. -P., Reynolds C. S., Padisák J. (Eds.) Phytoplankton in Turbid Environments: Rivers and Shallow Lakes (pp. 57-64). Hidrobiologia 294. [ Links ]
Kandus, P., Minotti, P. y Malvárez, A. I. (2008). Distribution of wetlands in Argentina, estimated from soil charts. Brasil. Acta Scientiarum 30 (4): 403-409. [ Links ]
Kandus, P., Quintana, R., Minotti, P., Oddi, J., Baigún, C., Gonzalez Trilla, G. y Ceballos, D. (2011). Ecosistemas de humedal y una perspectiva hidrogeomórfica como marco para la valoración ecológica de sus bienes y servicios. En: Laterra, P., Jobbagy, E., Paruelo, J. (Eds.) Valoración de servicios ecosistémicos. Conceptos, herramientas y aplicaciones para el ordenamiento territorial (pp. 265-290). Buenos Aires. INTA. [ Links ]
Komárek, J. y Jancovská, V. (2001). Review of the Green Lagal Genus Pediastrum: Implication for Pollen-analytical Research. Cramer J. Berlin-Stuttgart. Bibliotheca Phycologica. 108 pp. [ Links ]
Lewis, W. M. (Jr). (1976). Surface/Volume ratio: Implications for Phytoplankton Morphology. Science 192: 885-887. [ Links ]
Locascio de Mitrovich C. (1986). Presencia de Pseudoboeckella palustris Harding (Crustacea - Copepoda) en lagunas de altura del Noroeste Argentino. Neotropica 32 (87): 13-21. [ Links ]
Locascio de Mitrovich, C. y Ceraolo, M. (1999). Copépodos de algunos cuerpos de agua en los departamentos de Belén y Antofagasta de la Sierra (Catamarca-Argentina). Buenos Aires. Resúmenes IV Taller sobre Cangrejos y Cangrejales y I Jornadas Argentinas de Carcinología: 44. [ Links ]
Locascio de Mitrovich, C., Villagra de Gamundi, A., Juárez, J. y Ceraolo, M. (2005). Características limnológicas y zooplancton de cinco lagunas de la Puna - Argentina. Ecología en Bolivia 40 (1): 10-24. [ Links ]
Luque, M. E. y Martínez de Fabricius, A. L. (2010). Estudio del componente algal en la cuenca baja del río Cuarto (Córdoba, Argentina). Lilloa 47 (1-2): 95-106. [ Links ]
Maidana, N. I. y Seeligmann, C. (2006). Diatomeas (Bacillariophyceae) de ambientes acuáticos de altura de la provincia de Catamarca, Argentina II. Boletín de la Sociedad Argentina de Botánica 41: 1-13. [ Links ]
Mantilla Díaz, R. (2015). Incidencia del florecimiento de la microalga Cyanophyta Chroococcus turgidus sobre los parámetros de crecimiento de Litopenaeus vannamei en cultivos acuícolas (Tesis de Grado), Universidad de Guayaquil, Ecuador. [ Links ]
Margalef, R. (1983). Limnología. Ed. Omega, S.A. [ Links ]
Mirande, V. y Tracanna, B. (2007). Diversidad de cianobacterias, clorofitas y euglenofitas en humedales de altura (Jujuy, Argentina). Lilloa 44 (1-2): 39-59. [ Links ]
Mirande, V. y Tracanna, B. (2009). Estructura y controles del fitoplancton en humedales de altura. Ecología Austral 19: 119-128. [ Links ]
Mirande, V. y Tracanna B. (2004). Riqueza del fitoplancton en el río Gastona (Tucumán, Argentina): Diatomeas. Lilloa 41 (1-2): 93-146. [ Links ]
Mirande, V. y Tracanna, B. (2015). Cianobacterias de humedales de altura del Noroeste Argentino. Lilloa 52 (2): 122-141. [ Links ]
Mirande, V. y Tracanna, B. (2017). Algas verdes y euglénidos de la Puna argentina. Lilloa 54 (2): 210-228. [ Links ]
Paggi, J. C. y Villagra de Gamundi, A. (1980). Sobre la presencia de Pleuroxus caca Harding (Crustacea - Cladocera) en cuerpos de agua de alta montaña de la provincia de Tucumán, Argentina. Acta Zoologica Lilloana 36 (1): 131-138. [ Links ]
Provasoli, L. (1969). Algal nutrition and eutrophication. En: Eutrophication: causes, consequences, correctives (pp. 574-593). National Academy of Sciences. Washington, D. C. [ Links ]
Reynolds, C. S., Descy, J. P. y Padisák, J. (1994). Are phytoplankton dynamics in rivers so different from those in shallow lakes? Hidrobiologia 294: 1-7. [ Links ]
Reynolds, C. S., Huszar, V., Kurk, C., Naselli-Flores, L. y Melo, S. (2002). Towards a functional classification of the freshwater phytoplankton. Journal of Plankton Research 24: 417-428. [ Links ]
Rodríguez-Centeno, M. E., Díaz-Ramos, J. R., Charzeddine, L., Subero-Pino, S. S. y Troccoli-Ghinaglia, L. E. (2010). Biomasa y abundancia del fitoplancton en la isla La Tortuga, Dependencia Federal, Venezuela. Boletín del Instituto Oceanográfico de Venezuela 49 (1): 77-86. [ Links ]
Rohlf, F. J. (1990). NTSYS-pc. Numerical Taxonomy and Multivariate Analysis System. Version 1.60. Exeter Software. Setauket. New York. [ Links ]
Rott, E. (1981). Some results from phytoplankton counting intercalibrations. Schweizerische Zeitschrift für Hydrologie 43: 34-62. [ Links ]
Salusso, M. y Moraña, L. B. (2015). Estructura y composición del fitoplancton de mina Pirquitas, Jujuy, Argentina. Revista Mexicana de Biodiversidad 86: 711- 718. [ Links ]
Salusso, M., Caziani, S. M. y Moraña, L. B. (1997a). Distribución del plancton en relación a los caracteres limnológicos y a la avifauna de la Puna Jujeña. Resúmenes del Congreso Argentino de Limnología (CAL) II. Buenos Aires, Argentina. [ Links ]
Salusso, M. M., Moraña, L. B. y Caziani, S. M. (1997b). Patrones hidroquímicos en lagunas de la Puna Jujeña. Actas del II Congreso de Limnología. Buenos Aires. [ Links ]
Seeligmann, C. y Maidana, N. I. (2003). Diatomeas de la provincia de Catamarca (Argentina). Boletín de la Sociedad Argentina de Botánica 38: 39-50. [ Links ]
Seeligmann, C., Maidana, N. I. y Morales, M. (2008). Diatomeas (Bacillariophyceae) de humedales de altura de la provincia de Jujuy-Argentina. Boletín de la Sociedad Argentina de Botánica 43 (1-2): 1-17. [ Links ]
Van Dam, H., Mertens, A. y Sinkeldam, J. (1994). A coded checklist and ecological indicator values of freshwater diatoms from the Netherlands. Netherland Journal of Aquatic Ecology 28: 117-133. [ Links ]
Vecinos del Humedal. (2013). Argentina: Humedales Sitios Ramsar âHumedales Península Valdésâ. Recuperado de http://vecinosdelhumedal.blogspot.com. [ Links ]
Villagra de Gamundi, A. (1994). Aspectos bioecológicos de ambientes lénticos de alta montaña (4000 m snm -Tucumán- Argentina) con especial referencia al zooplancton. Tankay 1: 116-119. [ Links ]
Villagra de Gamundi, A. (1998). Tipificación de ambientes acuáticos leníticos de la provincia de Tucumán en base a los atributos del zooplancton y algunas características limnológicas (Tesis Doctoral), Universidad Nacional de Tucumán, Argentina. [ Links ]














