Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.27 no.3 Buenos Aires set. 2016
ARTÍCULO ORIGINAL
Validación del índice compuesto DAPSA (Disease Activity for Psoriatic Arthritis) en una cohorte de pacientes con artritis psoriásica en Argentina y determinación de sus valores de corte
Validation of the composite index DAPSA (Disease Activity for Psoriatic Arthritis) in a cohort of patients with psoriasis arthritis in Argentina and determination of their cut-off values
J. Gallino Yanzi1, E.E. Schneeberger1, O. Cerda1, C.A. Zaffarana1, M. Landi1, M. Rosemffet1, N. Zamora1, T. Cazenave1, F. Dal Pra1, M.P. Kohan2, E. Buschiazzo3, G. Citera1
1Instituto de Rehabilitación Psicofísica, CABA, Argentina.
2Hospital Dr E. Tornú, CABA, Argentina.
3Hospital Señor del Milagro, Salta, Argentina
Correspondencia: E-mail: josefgy@hotmail.com
Resumen
Objetivos: Validar el índice DAPSA en pacientes con Artritis Psoriásica (APs) en Argentina, comparar su rendimiento con índices compuestos y con la ultrasonografía (US) y establecer valores de corte.
Materiales y Métodos: Se incluyeron pacientes con APs según criterios CASPAR. En 10 pacientes se realizó recuento ecográfico de articulaciones tumefactas (66) y se calculó un DAPSA ecográfico. Para establecer valores de corte se realizó la valoración de los estados de actividad de la enfermedad por 10 reumatólogos a través 20 casos hipotéticos de pacientes con APs y según los valores de corte del SDAI.
Resultados: Se incluyeron 112 pacientes. DAPSA m14,3 (RIC 7-22,4). DAPSA presentó muy buena correlación con DAS28 (Rho:0,85), IAS (Rho:0,94), CDAI (Rho:0,95), SDAI (Rho:0,94) y N° de articulaciones dolorosas (Rho:0,84). DAPSA ecográfico m10,6 (RIC 8,5-17,9) presentó muy buena correlación con DAPSA (Rho:0,94). Usando los valores de corte del SDAI, elaboramos curvas ROC para establecer los valores de corte del DAPSA: ≤3,5 remisión, >3,5 a ≤13,4 baja, >13,4 a ≤26,2 moderada y >26,2 alta actividad (sensibilidad y especificidad ≥90%, área bajo la curva de 98%).
Conclusión: Los valores de corte propuestos permitieron definir los diferentes estados de actividad de la enfermedad con muy buena sensibilidad y especificidad.
Palabras clave: artritis psoriásica; DAPSA; índice de actividad.
Abstract
Objective: To validate DAPSA in patients with PsA in Argentina, evaluate its performance using other indexes, the ultrasound and establish tentative cut-off values according to disease activity.
Methods: Patients with PsA according to CASPAR criteria. DAS28, DAPSA, SDAI, CDAI, and CPDAI were calculated. In 10 patients we assessed swollen joints (66) by ultrasound and calculated an ultrasound DAPSA. We tried to establish cut-off values through: the assessment of disease activity states by 10 rheumatologists through 20 hypothetical cases of patients with PsA and according to SDAI cut-off points. Finally, we validated DAPSA cut-off values in the RAPSODIA cohort.
Results: We included 112 patients. DAPSA m14.3 (IQR 7-22.4). DAPSA had excellent correlation with DAS28 (Rho:0.85), CDAI (Rho:0.95), SDAI (Rho:0.94) and tender joint count (Rho:0.84). Ultrasound DAPSA m10.6 (IQR 8.5-17.9), it had excellent correlation with DAPSA (Rho:0.94). Using established cut-off values for SDAI, we performed ROC curves for DAPSA’s cut-off values: ≤3.5 remission, >3.5 to ≤13.4 low, >13.4 to ≤26.2 moderate, and >26.2 high disease activity (sensitivity and specificity ≥90%, area under the curve of 98%).
Conclusion: With these cut-off values is possible to define different disease activity states with a very good sensitivity and specificity.
Key words: psoriatic arthritis; DAPSA; activity index.
Introducción
La Artritis Psoriática (APs) es una artropatía inflamatoria que clínicamente se caracteriza por la presencia de artritis, entesitis, dactilitis, compromiso axial, cutáneo y ungueal1. Desde el punto de vista epidemiológico, afecta a personas de ambos sexos, más frecuentemente entre los 20 y los 40 años2.
Los índices compuestos permiten evaluar en forma conjunta varias características clínicas relevantes junto con alguna característica objetiva de laboratorio. Inicialmente, el índice compuesto utilizado para medir actividad de la enfermedad en APs fue el DAS 28 (Disease Activity Score)3. Si bien este índice tiene la ventaja de presentar valores de corte y buena consistencia interna para medir actividad en APs, considera el recuento de 28 articulaciones, excluyendo de esta manera otras articulaciones comprometidas frecuentemente en APs4. Además, el DAS28 pondera el peso de las variables que lo componen, el recuento de articulaciones dolorosas, por ejemplo, tiene un peso alto dificultando su interpretación. Otra limitante en el caso del DAS28-ERS (eritrosedimentación), es que este reactante de fase aguda puede variar de acuerdo a ciertas condiciones como sexo, edad o embarazo5. Otros índices compuestos utilizados en la Artritis Reumatoidea (AR) como el SDAI (Simplified Disease Activity Index)6 y el CDAI (Clinical Disease Activity Index)7 demostraron también ser útiles en la APs. Si bien el autocuestionario BASDAI (Bath Ankylosing Spondylitis Disease Activity Index)8 mide actividad en Espondilitis Anquilosante (EA), el estudio INSPIRE demostró que puede ser útil para evaluar actividad espinal en APs9. Sin embargo, W. Taylor y A. Harrison demostraron que el BASDAI no discrimina adecuadamente entre pacientes con alta o baja actividad de la enfermedad10. Según nuestra experiencia, el BASDAI resultó subóptimo para evaluar actividad periférica en pacientes con APs, dado que el 16% de los pacientes en remisión por DAS28 presentaron actividad por BASDAI y un tercio de los pacientes en baja actividad por BASDAI presentaron alta actividad por DAS2811.
Durante los últimos años, se han llevado a cabo progresos significativos en el desarrollo y la validación de instrumentos para medir actividad de la enfermedad en APs comandados por GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis) y OMERACT (Outcome Measures in Rheumatology)12. En la actualidad contamos con algunos índices compuestos para medir actividad de la enfermedad en APs. Algunos de ellos miden exclusivamente actividad articular periférica como el DAPSA (Disease Activity for Psoriatic Arthritis)13, el PsARC (Psoriatic Arthritis Response Criteria)14 y el PsAJAI (Psoriatic Arthritis Joint Activity Index)15; otros índices tienen en consideración la evaluación de la dactilitis y entesitis, como el PASDAS (Psoriatic Arthritis Disease Activity Score)16 y el AMDF (Arithmetic Mean of the Desirability Function)16, este último incorpora además la evaluación de la psoriasis y finalmente el CPDAI (Composite Psoriatic Disease Activity Index)17 que también considera el compromiso axial. Los índices que incluyen todos los dominios que pueden estar comprometidos en APs, hasta el momento, no brindaron resultados satisfactorios18. Según nuestra opinión, aquellos pacientes con APs que presenten compromiso articular periférico se beneficiarían al ser evaluados con un índice que exclusivamente considere este compromiso. Uno de estos índices es el DAPSA, el cual fue desarrollado por Schoels y cols. a partir del DAREA (Disease Activity Index for the Assessment of Reactive Arthritis)19. Se calcula sumando de manera lineal 5 variables: 1) número de articulaciones inflamadas (66), 2) número de articulaciones dolorosas (68), 3) dolor medido a través de escala visual numérica (EVN) (0-10), 4) evaluación global del paciente por EVN (0-10) y 5) PCR (mg/dl)13. Este índice ha demostrado ser útil al momento de evaluar de manera más específica la actividad articular periférica en la APs, es de fácil realización y cálculo sencillo14. En el momento de iniciar este trabajo, el DAPSA no presentaba valores de corte establecidos, sólo los valores más altos representaban mayor actividad de la enfermedad. Por este motivo, nos propusimos como objetivos validar el índice compuesto DAPSA en la Argentina, evaluar su rendimiento con otros índices compuestos y con la evaluación ultrasonográfica (US) y establecer sus valores de corte según remisión, baja, moderada o alta actividad de la enfermedad.
Materiales y métodos
Inicialmente, se realizó un estudio de corte transversal, incluimos pacientes ≥18 años con diagnóstico de APs según criterios CASPAR20 pertenecientes a tres centros de Argentina. Se excluyeron aquellos pacientes con algún impedimento físico o psíquico que impidiera la realización de los cuestionarios (analfabetos, ciegos) y pacientes con diagnóstico de fibromialgia21. Se consignaron datos sociodemográficos: edad, sexo, estado civil, ocupación, cobertura social, presencia de comorbilidades y tratamiento actual. Se evaluó: rigidez matinal, dolor, actividad de la enfermedad por el paciente y el médico a través de EVN, recuento articular de 66 articulaciones tumefactas y 68 dolorosas; presencia, ausencia y número de dactilitis. Se consignaron reactantes de fase aguda (ERS en mm/h y PCR en mg/dl). Se realizaron los autocuestionarios para evaluar calidad de vida ASQoL (Ankylosing Spondylitis Quality of Life)22 y PsAQoL (Psoriatic Arthritis Quality of Life)23, para capacidad funcional HAQ-A (Health Assessment Questionnaire Argentinean version)24 y BASFI (Bath Ankylosing Spondylitis Functional Index)25 y para actividad de la enfermedad axial BASDAI. Se calcularon los índices compuestos DAS28, DAPSA, CDAI, SDAI, CPDAI e IAS. Además, en un subgrupo de 10 pacientes se realizó la evaluación de 66 articulaciones tumefactas mediante ecografía, a fin de calcular el DAPSA mediante el recuento ecográfico considerando como positivas aquellas que presentaban power Doppler grado II o III. La evaluación ultrasonográfica fue realizada por un solo investigador experimentado que previamente había mostrado correlación intraobservador para Doppler de 0,91 (Coeficiente de correlación intraclase) y una correlación de 0,89 para sinovitis en escala de grises (Índice Kappa).
Posteriormente, se intentaron establecer los puntos de corte del DAPSA a través de dos maneras. Por un lado, se elaboraron 20 (veinte) casos clínicos hipotéticos de pacientes con APs que presentaban los datos necesarios para el cálculo de los índices DAPSA, DAS28-PCR y SDAI. Cada caso fue evaluado por 10 (diez) médicos reumatólogos entrenados en la evaluación de pacientes con APs, los cuales debían consignar el grado de actividad de la enfermedad de cada caso (remisión, baja, moderada o alta), teniendo en consideración los datos brindados en cada uno de ellos. Por otro lado, se consideraron los valores de corte del SDAI como referencia. Finalmente, los valores de corte establecidos fueron validados luego en la cohorte RAPSODIA (Registro de Artritis Psoriásica IREP Argentina), la cual es una cohorte longitudinal de pacientes con diagnóstico de APs según criterios CASPAR.
Análisis estadístico: Estadística descriptiva, las variables categóricas se expresaron en frecuencia y porcentaje (%) y las continuas en mediana (m) y rango intercuartilo (RIC). Las variables continuas fueron comparadas por test de T de Student y ANOVA y las categóricas por test de Chi2 y test exacto de Fisher. Correlación por test de Spearman. Para evaluar la influencia de los distintos componentes del DAPSA sobre el índice, se realizó un modelo de regresión lineal múltiple. Finalmente, considerando la opinión de expertos y los valores de corte del SDAI se elaboraron curvas ROC para determinar los puntos de corte del índice, calculando área bajo la curva (ABC), sensibilidad y especificidad para cada uno de los estados de actividad de la enfermedad. Una p<0,05 fue considerada significativa.
Resultados
Se incluyeron 112 pacientes, 57 eran varones (50,9%), con una edad mediana de 54 años (RIC 42-63) y un tiempo mediano de evolución de la enfermedad de 9 años (RIC 5-15). 43 pacientes (38,4%) presentaban compromiso mixto, 35 oligoarticular (31,3%), 29 poliarticular (25,9%), 3 axial (2,7%) y 2 mutilante (1,8%). En cuanto al tratamiento, 77 pacientes (68,8%) recibían AINES, 79 (70,4%) DMARDs y 25 (22,3%) terapia biológica. 32 pacientes (28,6%) cumplían criterios de Minimal Disease Activity (MDA). Las medidas de evaluación de los pacientes se presentan en la Tabla 1.
Tabla 1. Medidas de evaluación en 112 pacientes con APs.
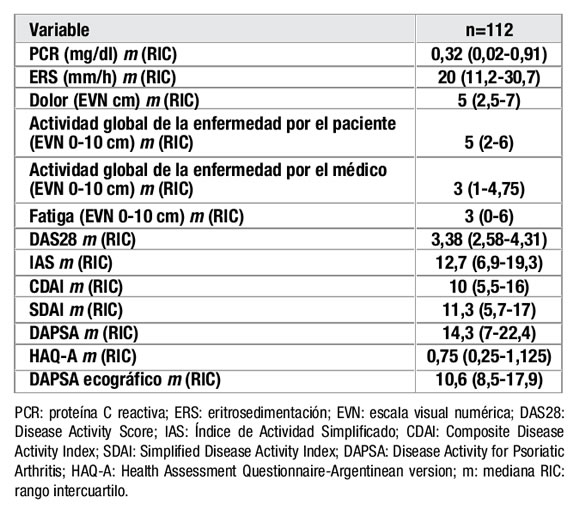
DAPSA presentó muy buena correlación con medidas de actividad de la enfermedad periférica, aceptable con actividad axial y calidad de vida no así con edad ni tiempo de evolución de la enfermedad (Tabla 2).
Tabla 2. Correlación de DAPSA con otras medidas de evaluación.

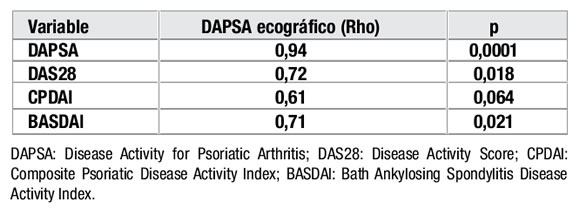
A su vez, la correlación entre DAPSA ecográfico y DAPSA fue excelente, siendo también aceptable su correlación con otras medidas de evaluación (Tabla 3).
Tabla 3. Correlación de DAPSA ecográfico con otras medidas de evaluación.
Las mujeres presentaron mayores niveles de DAS28 (3,8 vs 3,1, p=0,02), CPDAI (7,1 vs 5,36, p=0,009) y DAPSA (18,6 vs 13,73, p=0,05). Los pacientes con dactilitis presentaron valores significativamente mayores de DAPSA (24,63 vs 15,2, p=0,021) y DAS28 (4,37 vs 3,42, p=0,023), no así en otros índices compuestos como CPDAI, CDAI, SDAI e IAS. En la regresión lineal múltiple, al utilizar como variable dependiente el valor de DAPSA todos los componentes del índice se mantuvieron asociados significativamente (p<0,001) (Tabla 4).
Tabla 4. Modelo de regresión lineal múltiple.

Al dividir los pacientes según el criterio de Minimal Disease Activity (MDA), tanto el DAPSA (x4,9±4,21 vs 20,6±12,5, p=0,0001) como el DAS28 (x2,4±0,76 vs 3,9±1,25) difirieron significativamente entre pacientes que cumplían y no cumplían MDA, mientas que otros índices no discriminaron adecuadamente. Los valores de corte del DAPSA determinados por expertos solo presentaron buena concordancia entre 4 expertos. Aun considerando los valores de corte asignados por estos 4 expertos, las AUC no presentaron buen rendimiento. Luego, considerando los valores de corte del SDAI para AR se elaboraron curvas ROC para establecer los diferentes valores de corte del DAPSA. Los puntos de corte establecidos fueron DAPSA ≤3,5: remisión, >3,5 a ≤13,4: baja actividad, >13,4 a ≤26,2: moderada actividad y >26,2: alta actividad. Estos puntos de corte presentaron una sensibilidad y especificidad ≥90%, con un área bajo la curva de 98% (Figura 1).

Figura 1. Puntos de corte estimativos del DAPSA según SDAI. Curvas ROC.
Finalmente, al analizar la evaluación global del paciente y del médico por EVN según los puntos de corte, encontramos buena discriminación entre estos valores y los diferentes estados de la enfermedad (Figura 2).
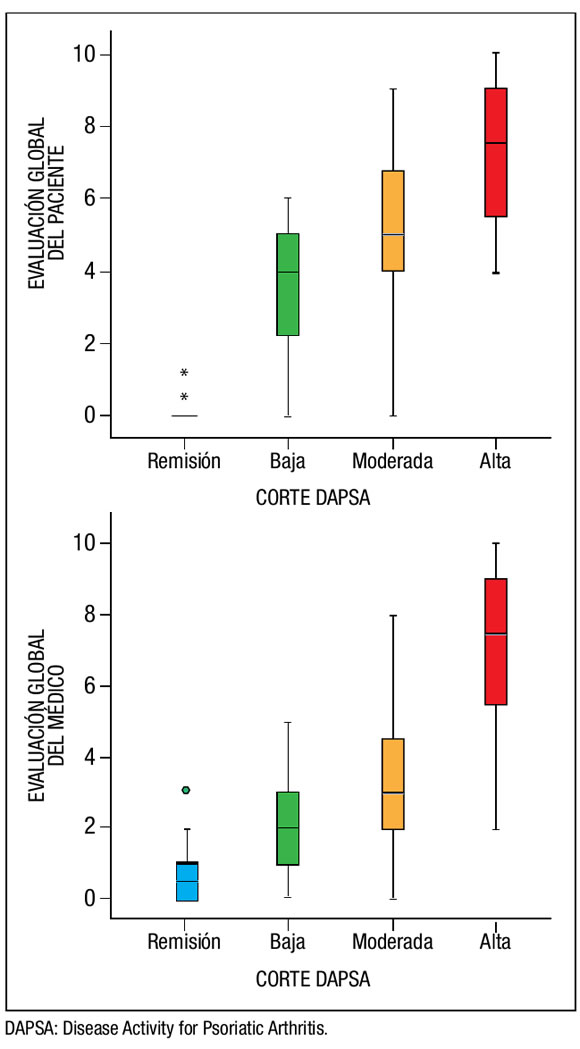
Figura 2. Evaluación global del paciente y del médico según los puntos de corte del DAPSA.
Discusión
Nuestros resultados mostraron un excelente desempeño del DAPSA, demostrando una muy buena consistencia interna y confiabilidad. Todos los componentes del índice se asociaron independientemente al resultado total del mismo. A pesar de que el DAPSA es un índice simplificado, que no pondera a las variables que lo componen, el número de articulaciones dolorosas fue el componente con más peso. Esto se debería a que el recuento de articulaciones dolorosas (0-68) es la variable del índice con mayor rango, siendo el recuento recomendado para la evaluación articular en la APs26.
Este índice incluye en su cálculo otras variables como dolor y evaluación global de la enfermedad por el paciente, los cuales podrían reflejar el compromiso de otras manifestaciones musculoesqueléticas frecuentes de la enfermedad.
El DAPSA no presentó correlación alguna con edad ni con tiempo de evolución de la enfermedad, lo cual representa una ventaja ya que su resultado no se vería influido por estas variables. Además, el valor del DAPSA difirió significativamente, según si el paciente cumplía o no criterios de MDA.
Estudios previos demostraron la excelente correlación entre DAPSA y otros índices compuestos como el DAS28 y el SDAI27,28,29, así como con medidas de capacidad funcional30. Estos resultados son semejantes a nuestros hallazgos.
En cuanto al desempeño del DAPSA en relación a la respuesta al tratamiento, un análisis post hoc del estudio PRESTA, el cual evaluaba dos dosis de etanercept para el compromiso cutáneo y articular en pacientes con APs y psoriasis cutánea concluyó que el CPDAI fue capaz de distinguir respuesta al tratamiento entre los dos grupos mientras que el DAPSA demostró que no fue capaz de distinguir respuesta entre los grupos31. En contraste, en ciertas circunstancias, el CPDAI muestra limitaciones. Un estudio italiano que comparó los índices compuestos de actividad en pacientes con APs en el mundo real detectó que el CPDAI fue el único que mostró menos habilidad discriminatoria28. Recientemente se han publicado estudios que evalúan la importancia de la US en APs, concluyendo que el DAPSA tiene muy buena correlación con la presencia de sinovitis por escala de grises y con la presencia de power Doppler, coincidiendo con nuestros resultados. El CPDAI, en cambio, no correlacionó con los hallazgos ultrasonográficos articulares. Por otro lado, los signos ultrasonográficos de dactilitis, entesitis y tenosinovitis no se asociaron con estos índices clínicos18,32.
Los valores de corte del DPAS establecidos, a través de opinión de expertos sobre los 20 casos hipotéticos tuvieron un rendimiento regular. Sin embargo, los valores de corte del DAPSA establecidos a través de los valores de corte del SDAI mostraron excelente especificidad y sensibilidad.
Algunas cohortes establecieron el punto de corte de remisión del DAPSA ≤3,3 y concluyeron que sería una definición más rigurosa de remisión en comparación con DAS28 y MDA18-33. Recientemente, Schoels y cols. publicaron un estudio en el cual proponen valores de corte para el DAPSA. Seleccionaron 30 pacientes con APs de una base de datos, los cuales fueron evaluados por expertos quienes clasificaron los diferentes niveles de actividad de la enfermedad. Los puntos de corte del DAPSA propuestos son: remisión ≤4, baja >4 y ≤14, moderada >14 y ≤28, alta actividad >2834. Estos valores propuestos no difieren contundentemente de los nuestros, por lo cual creemos interesante comparar el rendimiento de los mismos en otras cohortes internacionales de pacientes con APs.
La fortaleza de nuestro estudio radica en el número aceptable de pacientes estudiados y su procedencia de diferentes centros de salud, proporciona una muestra más representativa. También resaltamos la importancia de la evaluación ecográfica, la cual permitió validar el índice también a través de la ecografía de las articulaciones evaluadas. Además, consideramos como una ventaja que el DAPSA ecográfico fue realizado por un solo operador, permitiendo así una mejor reproducibilidad. Las limitaciones del estudio radican en que al tratarse de un índice que evalúa actividad articular periférica, hay otros aspectos de la enfermedad que no son evaluados y por lo tanto los valores de corte establecidos solo podrían aplicarse al compromiso articular periférico, por lo cual que un paciente se encuentre en remisión por DAPSA no implica que otros aspectos de la enfermedad se encuentren controlados, siendo necesario el uso de otras medidas de evaluación complementarias al realizar la evaluación clínica de los pacientes con APs.
En conclusión, el DAPSA es un índice válido, confiable y de cálculo sencillo para medir actividad articular periférica en pacientes con APs y presenta excelente correlación con la evaluación ultrasonográfica. Los valores de corte propuestos en este estudio deberían ser validados en otras poblaciones de pacientes.
1. Arturi A. Diagnóstico en Reumatología y Enfermedades Autoinmunes Sistémicas. Edición Abbvie. Capítulo 8. Pág. 197-202. 2014. [ Links ]
2. Maldonado Cocco J, Citera G. Reumatología. Segunda Edición, Ediciones Azzurras. Capítulo 33. Pág 462-70. 2012. [ Links ]
3. Felson DT, Anderson JJ, Boers M, Bombardier C, Chernoff M, Fried B, et al. The American College of Rheumatology preliminary core set of disease activity measures for rheumatoid arthritis clinical trials. The Committee on Outcome Measures in Rheumatoid Arthritis Clinical Trials. Arthritis Rheum 1993;36(6):729-40. [ Links ]
4. Wong PC, Leung YY, Li EK, Tam LS. Measuring Disease Activity in Psoriatic Arthritis. Int J Rheumatol 2012;2012:839425. doi: 10.1155/2012/839425. Epub 2012 Dec 25.
5. CastrejonI, Ortiz AM, García Vicuña R, López Bote JP, Humbría A, Carmona L, González Álvaro I. Are the C-reactive protein values and erythrocyte sedimentation rate equivalent when estimating the 28-joint disease activity score in rheumatoid arthritis?. Clin Exp Rheumatol 2008;26(5):769-75. [ Links ]
6. Smolen JS, Breedveld FC, Schiff MH, Kalden JR, Emery P, Eberl G, et al. A simplified disease activity index for rheumatoid arthritis for use in clinical practice. Rheumatolology 2003;42(2):244-57. [ Links ]
7. Aletaha D, Nell VP, Stamm T, Uffmann M, Pflugbeil S, Machold K, et al. Acute phase reactants add little to composite disease activity indices for rheumatoid arthritis: validation of a clinical activity score. Arthritis Res Ther 2005;7(4):796-806. [ Links ]
8. Garrett S, Jenkinson T, Kennedy LG, Whitelock H, Gaisford P, Calin A. A new approach to defining disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index. J Rheumatol 1994;21(12):2286-91. [ Links ]
9. Gladman DD, Inman RD, Cook RJ, Maksymowych WP, Braun J, Davis JC, et al. International spondyloarthritis interobserver reliability exercise— the INSPIRE study: I. Assessment of spinal measures. J Rheumatol 2007;34(8):1733-9.
10. Taylor W, Harrison A. Could the Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) be a valid measure of disease activity in patients with psoriatic arthritis?. Arthritis Rheum 2004;51(3):311-5. [ Links ]
11. Carrillo I, González M. Landi M, Maldonado Ficco H, Maldonado Cocco J, Giraldo C, et al. Desempeño del BASDAI en artritis psoriática ¿es útil para medir actividad periférica? (abstract). Rev Argent Reumatol 2012;23(Supl5):60. [ Links ]
12. Mease P. Measures of Psoriatic Arthritis. Arthritis Care Res 201;63(11)64-85. [ Links ]
13. Schoels M, Aletaha D, Funovits J, Kavanaugh A, Baker D, Smolen JS. Application of the DAREA/DAPSA score for assessment of disease activity in psoriatic arthritis. Ann Rheum Dis 2010;69(8):1441-7. [ Links ]
14. Clegg DO, Reda DJ, Mejias E, Cannon GW, Weisman MH, Taylor T, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Cooperative Study. Arthritis Rheum 1996;39 (12):2013-20. [ Links ]
15. Gladman DD, Tom BD, Mease PJ, Farewell VT. Informing response criteria for psoriatic arthritis (PsA). II: Further considerations and a proposal--the PsA joint activity index. J Rheumatol. 2010;37(12):2559-65. [ Links ]
16. Helliwell PS, FitzGerald O, Fransen J, Gladman DD, Kreuger GG, Callis-Duffin K, et al. The development of candidate composite disease activity and responder indices for psoriatic arthritis (GRACE project). Ann Rheum Dis. 2013;72(6):986-9. [ Links ]
17. Mumtaz A, Gallagher P, Kirby B, Waxman R, Coates LC, Veale JD, et al. Development of a preliminary composite disease activity index in psoriatic arthritis. Ann Rheum Dis 2011;70(2):272-7. [ Links ]
18. Husic R, Gretler J, Felber A, Graninger W, Duftner C, Hermann J, et al. Disparity between ultrasound and clinical findings in psoriatic arthritis. Ann Rheum Dis 2014;73(8):1529-36. [ Links ]
19. Eberl G, Studnicka-Benke A, Hitzelhammer H, Gschnait F, Smolen J, et al. Development of a Disease Activity index for the assessment of Reactive Arthritis (DAREA). Rheumatology 2000;39(2):48-55. [ Links ]
20. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54(8):2665-73. [ Links ]
21. Wolfe F, Smythe HA, Yunus MB, Bennett RM, Bombardier C, Goldenberg DL, et al. The American College of Rheumatology 1990 Criteria for the Classification of Fibromyalgia. Report of the Multicenter Criteria Committee. Arthritis Rheum 1990;33(2):160-72. [ Links ]
22. Doward LC, Spoorenberg A, Cook SA, Whaley D, Helliwell PS, Kay LJ, et al. Development of the ASQoL: a quality of life instrument specific to ankylosing spondylitis. Ann Rheum Dis 2003;62(1):20-6. [ Links ]
23. McKenna SP, Doward LC, Whalley D, Tennant A, Emery P, Veale DJ. Development of the PsAQoL: a quality of life instrument specific to psoriatic arthritis. Ann Rheum Dis 2004;63(2):162-9. [ Links ]
24. Citera G, Arriola MS, Maldonado Cocco JA, Rosemffet MG, Sánchez MM, Goñi MA, et al. Validation and crosscultural adaptation of an Argentine Spanish version of the health assessment questionnaire disability index. J Clin Rheumatol 2004;10(3):110-5. [ Links ]
25. Calin A, Garrett SL, Whitelock H, Kennedy LG, O’Hea J, Mallorie P, et al. A new approach to functional ability in ankylosing spondylitis. J Rheumatol 1994;21(12):2281-5.
26. Smolen JS, Schoels M, Aletaha D. Disease activity and response assessment in psoriatic arthritis using the Disease Activity index for Psoriatic Arthritis (DAPSA). Clin Exp Rheumatol 2015;33(Suppl.93):S48-S50. [ Links ]
27. Helliwell P, Kavanaugh A. Comparison of composite measures of disease activity in psoriatic arthritis using data from an interventional study with golimumab. Arthritis Care Res 2014; 66(5):749-56. [ Links ]
28. Salaffi F, Ciapetti A, Carotti M, Gasparini S, Gutierrez M. Disease activity in psoriatic arthritis: Comparison of the discriminative capacity and construct validity of six composite indices in real world. Biomed Res Int 2014;2014.528105.doi:10.1155/2014/ 528105.
29. Mease P. Measures of psoriatic arthritis: Tender and Swollen Joint Assessment, Psoriasis Area and Severity Index (PASI), Nail Psoriasis Severity Index (NAPSI), Modified Nail Psoriasis Severity Index (mNAPSI), Mander/Newcastle Enthesitis Index (MEI), Leeds Enthesitis Index (LEI), Spondyloarthritis Research Consortium of Canada (SPARCC), Maastricht Ankylosing Spondylitis Enthesis Score (MASES), Leeds Dactylitis Index (LDI), Patient Global for Psoriatic Arthritis, Dermatology Life Quality Index (DLQI), Psoriatic Arthritis Quality of Life (PsAQOL), Functional Assessment of Chronic Illness Therapy-Fatigue (FACIT-F), Psoriatic Arthritis Response Criteria (PsARC), Psoriatic Arthritis Joint Activity Index (PsAJAI), Disease Activity in Psoriatic Arthritis (DAPSA), and Composite Psoriatic Disease Activity Index (CPDAI). Arthritis Care Res 2011;63(11):S64-85. [ Links ]
30. Theander E, Husmark T, Alenius G, Larsson P, Teleman A, Geijer M, et al. Early psoriatic arthritis: short symptom duration, male gender and preserved physical functioning at presentation predict favourable outcome at 5-year follow-up. Results from the Swedish Early Psoriatic Arthritis Register (SwePsA). Ann Rheum Dis 2014;73(2): 407-13. [ Links ]
31. Fitzgeral O, Helliwell P, Mease P, Mumtaz A, Coates L, Pedersen R, et al. Application of composite disease activity scores in psoriatic arthritis to the PRESTA data set. Ann Rheum Dis 2012;71(3):358-62. [ Links ]
32. Michelsen B, Diamantopoulos A, Hammer H, Soldal D, Kavanaugh A, Haugeberg G. Ultrasonographic evaluation in psoriatic arthritis is of major importance in evaluating disease activity. Ann Rheum Dis 2016 April 18.pii: annrheumdis-2015-208806.doi 10.1136/ annrheumdis-2015-208806. [Epub ahead of print]
33. Perrotta F, Marchesoni A, Lubrano E. Minimal disease activity and remission in psoriatic arthritis patients treated with anti-TNFα drugs. J Rheumatol 2016;43(2):350-5.
34. Schoels M, Aletaha D, Alasti F, Smolen J. Disease Activity in Psoriatic Arthritis: defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2016;75(5):811-8. [ Links ]














