Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.29 no.4 Buenos Aires dez. 2018
ARTÍCULO ORIGINAL
Patrones de tratamiento con agentes biológicos. Eficacia y sobrevida a largo plazo en pacientes con artritis reumatoidea
Treatment patterns with biological agents. Efficacy and long-term survival in patients with rheumatoid arthritis
R. Rolón Campuzano1, F. Dal Pra1, E.E. Schneeberger1, A.L. Coronel Ale1, O.L. Cerda1, M.A. Correa1, M.G. Rosemffet1, E. Buschiazzo2, R. García Salinas3, S.B. Papasidero4, B.I. Barrios4, H. Maldonado Ficco5, G. Citera1
1Sección de Reumatología, Instituto de Rehabilitación Psicofísica, Buenos Aires.
2Hospital Señor del Milagro, Salta.
3Hospital Italiano La Plata, Buenos Aires.
4Hospital General de Agudos Dr. E Tornú, Buenos Aires.
5Hospital San Antonio de Padua, Río Cuarto, Córdoba.
Correspondencia: E-mail: roger_rolon@hotmail.com
Resumen
En nuestro país existen pocos datos acerca de los patrones de tratamiento y la sobrevida de las Drogas Modificadoras de la Artritis Reumatoidea biológicas (DMARb) en pacientes con Artritis Reumatoidea (AR). El objetivo de nuestro estudio fue estimar la sobrevida del 1° y 2° agente biológico, determinar sus causas de suspensión y evaluar factores que influyan en la sobrevida de estos agentes.
Material y métodos: Se realizó un estudio multicéntrico retrospectivo. Se incluyeron pacientes ≥18 años de edad que cumplieran con criterios ACR/EULAR 2010 para AR y que iniciaron su 1° y/o 2° DMARb entre 01/2006 y 06/2017, la recolección de datos se realizó mediante la revisión de historias clínicas. Se consignaron variables sociodemográficas y clínicas.
Resultados: Se incluyeron 347 pacientes con edad mediana de 57,8 años, 89,6% mujeres, 96,5% tenían Factor Reumatoideo (FR) positivo. El 53,9% de los pacientes discontinuaron el tratamiento con la 1°DMARb, treinta y ocho pacientes (41,3%) discontinuaron el 2° DMARb. La causa más frecuente de suspensión del primer biológico fue la falta de provisión, mientras que la del segundo biológico fue la ineficacia. Las supervivencias medianas fueron: para la 1° DMARb 31 meses (IC 95%: 21,8-40,1) y para 2° DMARb 11 meses (IC 95%: 4-17,9), no observamos diferencias significativas en la supervivencia entre los distintos agentes, los factores independientemente asociados a menor supervivencia del 1° DMARb fueron el tabaquismo y menor edad y del 2° DMARb fue haber discontinuado el primer agente biológico debido a evento adverso.
Conclusión: Las supervivencias medianas del 1° DMARb y del 2° DMARb fueron 2,6 años y menor a 1 año, respectivamente. A diferencia de otras cohortes de países desarrollados, la causa más frecuente de suspensión del primer biológico fue la falta de provisión de la medicación por parte del pagador, mientras que la del segundo biológico fue la ineficacia.
Palabras clave: artritis reumatoidea; sobrevida; biológicos.
Abstract
In our country there are few data about the treatment patterns and the survival of the Biologic Disease Modifying Antirheumatic Drugs (bDMARD) in patients with Rheumatoid Arthritis (RA). The objective of our study was to evaluate the survival of the 1st and 2nd biological agent, determine the causes of suspension and factors that influence on the survival of these agents.
Material and methods: A retrospective multicenter study was conducted. We included patients ≥18 years of age who met the ACR/EULAR 2010 criteria for RA and who started in 1st and/or 2nd bDMARD between 01/2006 and 06/2017, the data collection was done by reviewing clinical charts The sociodemographic and clinical variables were recorded.
Results: We included 347 patients with a median age of 57.8 years, 89.6% women, 96.5% had positive Rheumatoid Factor (RF). 53.9% of patients discontinued treatment with 1st bDMARD, thirty-eight patients (41.3%) discontinued the 2nd bDMARD. The most frequent cause of suspension of the first biological was the lack of provision, while the second biological was inefficacy. The median survivals were: for the 1st bDMARD 31 months (95% CI: 21.8-40.1) and for the 2nd bDMARD 11 months (95% CI: 4-17.9), we did not observe significant differences in survival between the different agents. The independent factors associated with lower survival of the 1st bDMARD were smoking and lower age and the 2nd bDMARD was to have discontinued the first biological agent due to an adverse event.
Conclusion: The median survivals of the 1st bDMARD and the 2nd bDMARD were 2.6 years and less than 1 year, respectively. Unlike other cohorts of developed countries the most frequent cause of suspension of the first biological was the lack of provision of the drug by the payer, while the second biological was inefficacy.
Key words: rheumatoid arthritis; survival; biologic.
Introducción
La Artritis Reumatoide (AR) es una enfermedad inflamatoria crónica sistémica que compromete las articulaciones, causando daño del cartílago y del hueso articular y que se asocia a manifestaciones extraarticulares1. Estas manifestaciones están asociadas a importante discapacidad, limitaciones en la realización de las actividades de la vida diaria, pérdida en la productividad laboral y deterioro de la calidad de vida2,3-7. La AR está asociada con una gran carga económica para el individuo y la sociedad con un costo anual estimado de € 45.3 billones en Europa y € 41.6 billones en los Estados unidos en 20068. Las recomendaciones de tratamiento para la AR, consideran al metotrexato (MTX), una droga modificadora de la AR convencional (DMARc), como tratamiento de primera línea9-15. Si el MTX falla en alcanzar el objetivo de tratamiento, se recomienda combinar con otro DMARc como sulfasalazina, leflunomida, hidroxicloroquina o asociar un DMAR biológico (DMARb). Basado en el mecanismo de acción de los DMARb, se distinguen dos amplias clases: los agentes anti-TNF (Infliximab, Etanercept, Adalimumab, Golimumab, Certolizumab) y los no anti-TNF (Abatacept, Anakinra, Tocilizumab, Rituximab)16-18. La introducción de los agentes biológicos en el tratamiento de la AR ha sido un importante avance ya que los mismos suelen ser efectivos en pacientes que no responden a DMARc, con una tasa de respuesta promedio de 60-70%11. Sin embargo, no están exentos de eventos adversos (EA) y sus altos costos limitan el acceso y mantenimiento del tratamiento a largo plazo en muchas circunstancias. Los datos de eficacia y seguridad de las DMARb suelen obtenerse de estudios clínicos controlados y registros observacionales. Los estudios clínicos randomizados controlados suelen presentar ciertas limitaciones como: criterios de inclusión estrictos, número limitado de pacientes, corta duración del tratamiento, reducción de la potencia para la detección de su eficacia a largo plazo y tolerabilidad, bajo número de estudios cabeza a cabeza, y tampoco evalúan adherencia al tratamiento en la vida real. Por otro lado, en algunos registros voluntarios puede haber sesgo de inclusión, si los mismos están sujetos a la incorporación voluntaria de pacientes por parte de los investigadores.
En nuestro país, existen pocos datos acerca de los patrones de tratamiento y la sobrevida de los agentes biológicos en pacientes con AR de la vida real. Por este motivo, decidimos: estimar la sobrevida del 1° y 2° DMARb indicado en pacientes con AR, determinar las causas de suspensión, medir el tiempo transcurrido entre la discontinuación del 1° DMARb y el inicio del 2° DMARb, y evaluar factores que influyen en la sobrevida de estos agentes.
Material y métodos
Se realizó un estudio multicéntrico retrospectivo, en el cual participaron cinco centros argentinos de Reumatología. Se incluyeron pacientes ≥18 años de edad que cumplieran con criterios ACR/EULAR 2010 para AR20 y que hubieran iniciado su 1° y/o 2° DMARb entre 01/2006 y 06/2017, la recolección de datos se realizó mediante la revisión de historias clínicas. Se consignaron variables sociodemográficas (edad, sexo, situación laboral, estado civil, cobertura de salud, educación, número de cohabitantes) y clínicas (comorbilidades, el estado de tabaquismo -actual, pasado-, tiempo de evolución de la enfermedad, tratamiento actual y concomitante, tipo de DMARb, uso de DMARc, el tiempo transcurrido entre la interrupción del 1° DMARb y el inicio del 2°, y la respuesta terapéutica a los mismos). Se consignó el número de articulaciones inflamadas (28) y dolorosas (28), la evaluación global de la enfermedad por el paciente (0-10 cm) y por el médico (0-10), con el fin de evaluar la actividad de la enfermedad mediante el cálculo del Clinical Disease Activity Index (CDAI)21 a los 6 meses y al año del tratamiento con DMARb.
Para el análisis estadístico, las variables continuas se expresaron en medianas o medias, según correspondiese, con sus correspondientes medidas de dispersión, rango intercuartilo (RIC) y desvíos estándar (DE), respectivamente. Las variables categóricas, en frecuencia y porcentaje. Las variables continuas se compararon mediante test T de Student y ANOVA, y las categóricas por test Chi2 y test exacto de Fisher. La supervivencia acumulada de los DMARb se evaluó mediante curvas de Kaplan-Meier y fueron comparadas por Log-Rank. Con el objeto de evaluar en una sola medida la supervivencia y la eficacia de la medicación biológica recibida se calculó el índice LUNDEX, para la 1° DMARb a través del producto del porcentaje de pacientes en remisión o baja actividad de la enfermedad por CDAI en tratamiento con DMARb y el porcentaje de pacientes que continuaron recibiendo esa DMARb a los 6 meses y al año22. Para estimar los factores asociados a la supervivencia del tratamiento se utilizó Regresión de Cox, utilizando la duración de tratamiento como variable de tiempo y la suspensión o no como variable dependiente. Aquellas variables con un valor de p menor a 0,1 en el análisis univariado fueron incluidas en los modelos de regresión múltiple. Un valor de p menor a 0,05 fue considerado significativo y se utilizó SPSS como paquete estadístico.
Resultados
Se incluyeron 347 pacientes, con edad mediana de 57,8 años (RIC: 48-65), 89,6% mujeres, 96,5% tenían Factor Reumatoideo (FR) positivo y 60,8% anticuerpos antipéptido cíclico citrulinado (anti-CCP) positivo. El 79,2% de los pacientes poseían cobertura de salud (70,6% obra social y 8,6% medicina prepaga), 1,3% eran fumadores y 51,2% presentaban comorbilidades. Las características de la población se describen en la Tabla 1. La 1° DMARb recibida fue en orden decreciente de frecuencia: Etanercept 46,8%, Adalimumab 28,9%, Certolizumab 7,2%, Abatacept 6,4%, Golimumab 4,3%, Tocilizumab 2,6%, Rituximab 23% e Infliximab 1,4%. Sólo el 5,6% de los pacientes recibió DMARb en monoterapia. El 53,9% de los pacientes discontinuaron el tratamiento con la 1°DMARb y las causas de la interrupción fueron: falta de provisión (33,5%), ineficacia (33%) y eventos adversos (EA) (20,3%). El evento adverso más frecuente fue la infección. La mediana de supervivencia de la 1° DMARb fue de 31 meses (IC 95%: 21,8-40,1) (Figura 1). No encontramos diferencias en la supervivencia entre los diferentes agentes biológicos. La única variable asociada a menor sobrevida de la 1° DMARb fue el tabaquismo con una sobrevida mediana de 41 meses (IC 95%: 21,4-60,5) para no fumadores versus 12 meses (IC 95%: 4,1-19,8) para fumadores p<0,001. Luego de ajustar para otras variables en la regresión proporcional de Cox, esta asociación se mantuvo significativa p=0,002 (Tabla 2 y Figura 2).
Tabla 1. Características sociodemográficas y clínicas de 347 pacientes con AR.
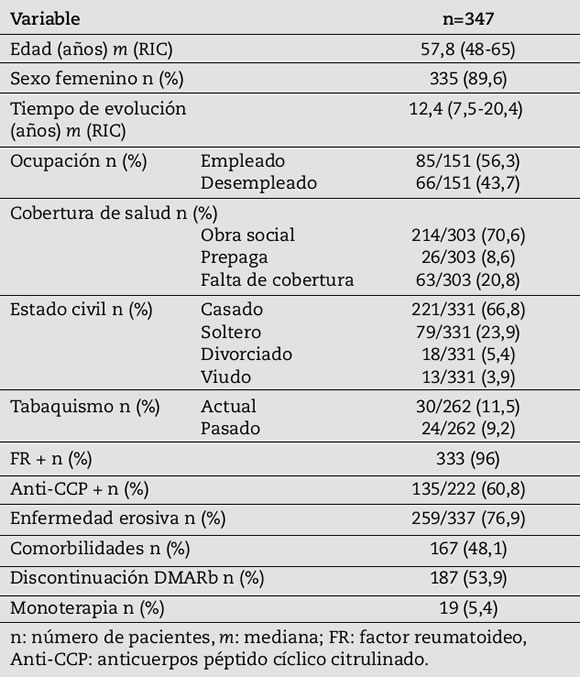
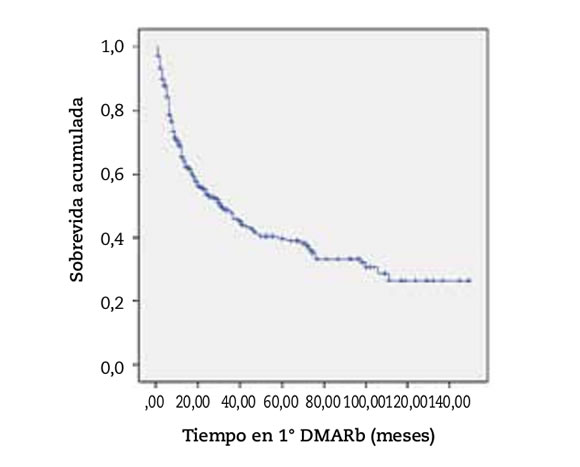
Figura 1. Sobrevida acumulada del 1° DMARb en pacientes con AR.
Tabla 2. Variables asociadas a la discontinuación del 1° DMARb en 347 pacientes con artritis reumatoidea.
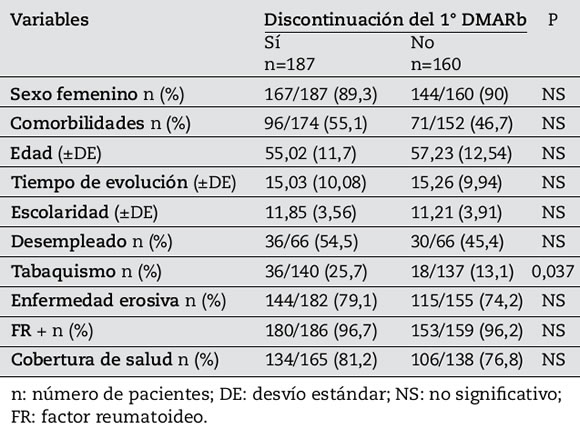

Figura 2. Sobrevida acumulada del 1° DMARb según hábito tabáquico en pacientes con AR.
El CDAI mejoró a través del tiempo, de una media basal de 27,9 (±13,9) comparado con una media de 12,8 (±10,8) a los 6 meses (p<0,001) y de 9,8 (±10,1) al año (p<0,001). El CDAI a los 6 meses del tratamiento con el 1° DMARb fue significativamente menor en los no fumadores que en los fumadores (11,37±9,6 versus 17,71±14, respectivamente, p=0,03). El índice Lundex para la 1° DMARb fue 45,5% a los 6 meses y 41,1% al año.
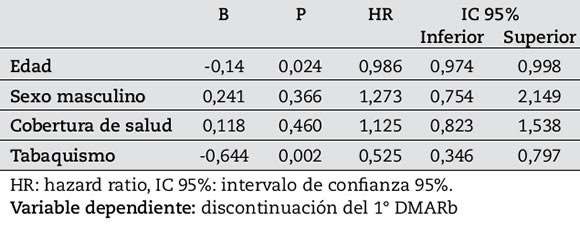
En el análisis multivariado, el tabaquismo (HR 1,8, IC 95%: 1,2-2,8) y la menor edad (HR: 0,98, IC 95%: 0,96-0,99) se asociaron de forma independiente con menores tasas de supervivencia para la 1° DMARb (Tabla 3).
Tabla 3. Variables asociadas a la discontinuación del 1° DMARb. Análisis de regresión de Cox.
Ciento ochenta y siete (187) pacientes suspendieron el 1° DMARb; de ellos, 96 pacientes (27,6%) iniciaron un 2° DMARb. En este caso, la frecuencia de utilización del segundo agente biológico fue: Abatacept 41,2%, Etanercept 25%, Adalimumab 16,7%, Tocilizumab 14,6%, Certolizumab 6,3% y Rituximab 1%. El tiempo promedio entre la suspensión del 1° DMARb y el inicio del 2° fue de 9,5 meses (DE 5,8-13,2). 38 pacientes (41,3%) discontinuaron el 2° DMARb, siendo las causas más frecuentes de discontinuación: ineficacia 35,9%, falta de provisión 30,8% y EA 20,5%. El tiempo mediano de supervivencia del 2° DMARb fue 11 meses (IC 95%: 4-17,9) (Figura 3), no encontrándose diferencias significativas entre los diferentes DMARb. Cuando analizamos aquellos pacientes que recibieron un agente anti-TNF como 1° DMARb y la causa de discontinuación fue falta de provisión, el 86,9% de ellos reinició nuevamente un inhibidor del TNF. Por el contrario, se optó por un cambio de mecanismo de acción en aquellos pacientes que discontinuaron por EA (69,2%) o por ineficacia (77,7%).
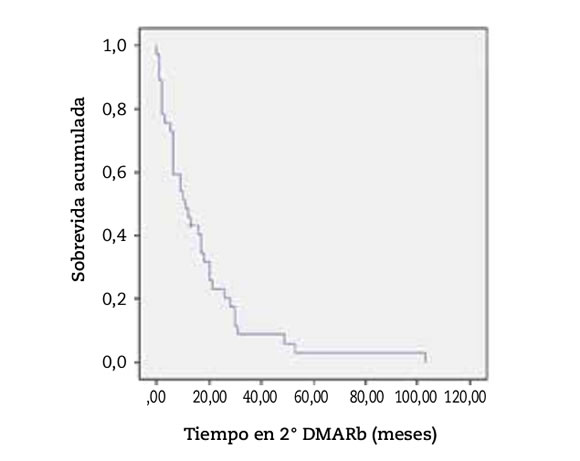
Figura 3. Sobrevida acumulada del 2° DMARb en 96 pacientes con AR.
No encontramos diferencias en la supervivencia tanto del 1° DMARb como del 2° DMARb, con respecto a su uso en monoterapia o en combinación con DMARc. En aquellos pacientes en quienes la causa de suspensión del 1° DMARb fue EA, la sobrevida del 2° DMARb fue significativamente menor (3,6 meses ±1,8) comparado a los que suspendieron el 1° DMARb por ineficacia (21,5 meses ±4,1) o por falta de provisión (20,5 meses ±8,4) (Log-Rank: p=0,03).
Discusión
Según nuestro conocimiento, este es el primer estudio en Argentina en el cual se analizan los patrones y la sobrevida del tratamiento con DMARb en pacientes con artritis reumatoidea. La sobrevida de la 1° DMARb en nuestro estudio fue de aproximadamente 2,6 y de la 2° DMARb fue menor a un año. Estos datos son francamente inferiores a los reportados en otras cohortes del mundo. Por ejemplo en el registro nacional para enfermedades reumáticas de USA (National Data Bank for Rheumatic Diseases –NDB–), la sobrevida del primer biológico fue de 4,1 años y del segundo biológico fue de 3,3 años23, mientras que en el registro británico (BSRBR), la mediana de sobrevida del primer DMARb fue de 3,3 años24.
En nuestro estudio, la causa más frecuente de discontinuación del tratamiento biológico fue la falta de provisión de la medicación; mientras que, en el registro danés DANBIO, la principal causa de discontinuación fue la presencia de EA25, y en el registro húngaro fue ineficacia seguida de eventos adversos2. En países en vías de desarrollo, la pobre situación económica genera por parte de los organismos de salud una falta de suministro de la medicación en forma continua, especialmente en los medicamentos de alto costo. Por este motivo, probablemente en nuestro país, la sobrevida observada es menor a la reportada en países desarrollados. No encontramos diferencia en la sobrevida del DMARb según los diferentes mecanismos de acción.
Como ya ha sido observado en otros estudios26-28, el tabaquismo reduce significativamente la efectividad y la supervivencia del tratamiento biológico y esto coincide con nuestros hallazgos. Recientemente, un análisis de la cohorte CATCH de Canadá demostró que los hábitos higiénicos dietéticos, como la obesidad en mujeres o el hábito de fumar en hombres, son fuertes predictores de no alcanzar la remisión en los primeros 12 meses de tratamiento en artritis temprana29.
En nuestro estudio, el índice LUNDEX para la 1° DMARb fue 45,5% a los 6 meses y 41,1% al año. Lars EK y cols., en su trabajo original del Lundex, observaron datos semejantes aunque con alguna diferencia entre los distintos agentes anti-TNF22. Una de las fortalezas de nuestro estudio es su carácter multicéntrico, situación que permitió incluir pacientes tanto de centros de salud públicos como privados. Otra ventaja es la utilización del Lundex que nos permitió unificar en un solo valor la eficacia y la supervivencia de las drogas evaluadas. Las principales limitaciones comprenden la inclusión de un número limitado de pacientes y la naturaleza retrospectiva del estudio.
En conclusión, la sobrevida acumulada de la 1° y 2° DMARb en nuestro estudio fue aproximadamente de 2,6 y 1 años, respectivamente. No observamos diferencias significativas en la supervivencia entre los distintos agentes biológicos. La principal causa de suspensión del tratamiento biológico fue la falta de provisión. Los factores independientemente asociados a menor supervivencia del 1° DMARb fueron el tabaquismo y menor edad, y de la 2° DMARb fue haber discontinuado el primer agente biológico debido a evento adverso.
1. Brodszky V, Bíró A, Szekanecz Z, Soós B, Baji P, Rencz F, et al. Determinants of biological drug survival in rheumatoid arthritis: evidence from a Hungarian rheumatology center over 8 years of retrospective data. Clinicoecon outcomes Res 2017;9:139-147. [ Links ]
2. Smolen JS, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016;388(10055):2023-2038. [ Links ]
3. Badley E, DesMeules M (2003) Introduction. In: Badley E, DesMeules M, eds. Arthritis in Canada: an ongoing challenge. Ottawa, Canada: Health Canada. http://www.lupuscanada.org/english/resources/pdfs/Arthritis-in-Canada-Health-Canada.pdf. Accessed 13 September 2013. [ Links ]
4. Symmons D, Turner G, Webb R, Asten P, Barrett E, Lunt M, et al. The prevalence of rheumatoid arthritis in the united Kingdom: new estimates for a new century. Rheumatology (Oxford) 2002;41(7):793-800. [ Links ]
5. Helmick CG, Felson DT, Lawrence RC, Gabriel S, Hirsch R, Kwoh CK, et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part I. Arthritis Rheum 2008;58(1):15-25. [ Links ]
6. Wong R, Davis AM, Badley E, Grewal R, Mohammed M. Prevalence of arthritis and rheumatic diseases around the world: a growing burden and implications for health care needs. In: Models in Care in Arthritis, Bone & Joint Disease (MOCA) http://www. modelsofcare.ca/pdf/10-02.pdf. Accessed 13 September 2013. [ Links ]
7. Alamanos Y, Voulgari PV, Drosos AA. Incidence and prevalence of rheumatoid arthritis, based on the 1987 American College of Rheumatology criteria: a systematic review. Semin Arthritis Rheum 2006;36(3):182-188. [ Links ]
8. Taylor PC, Moore A, Vasilescu R, Alvir J, Tarallo M. A structured literature review of the burden of illness and unmet needs in patients with rheumatoid arthritis: a current perspective. Rheumatol Int 2016;36(5):685-695. [ Links ]
9. Smolen JS, Landewé R, Breedveld FC, Buch M, Burmester G, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying anti-rheumatic drugs: 2013 update. Ann Rheum Dis 2014;73(3):492-509. [ Links ]
10. Saag KG, Teng GG, Patkar NM, Anuntiyo J, Finney C, Curtis JR, et al. American College of Rheumatology 2008 recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum 2008;59(6):762-784. [ Links ]
11. Sullivan SD, Alfonso-Cristancho R, Carlson J, Mallya U, Ringold S. Economic consequences of sequencing biologics in rheumatoid arthritis: a systematic review. J Med Econ 2013;16(3):391-396. [ Links ]
12. Wilke T, Mueller S, Lee SC, Majer I, Heisen M. Drug survival of second biological DMARD therapy in patients with rheumatoid arthritis: a retrospective non-interventional cohort analysis. BMC Musculoskelet Disord 2017;18(1):332. [ Links ]
13. Du Pan SM, Scherer A, Gabay C, Finckh A. Differential drug retention between anti-TNF agents and alternative biological agents after inadequate response to an anti-TNF agent in rheumatoid arthritis patients. Ann Rheum Dis 2012;71(6):997-999. [ Links ]
14. Favalli EG, Biggioggero M, Marchesoni A, Meroni PL. Survival on treatment with second-line biologic therapy: a cohort study comparing cycling and swap strategies. Rheumatology (Oxford). 2014;53(9):1664-1668. [ Links ]
15. Smolen JS, Breedveld FC, Burmester GR, Bykerk V, Dougados M, Emery P. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016;75(1):3-15. [ Links ]
16. Navarro-Millán I, Curtis JR. Newest clinical trial results with antitumor necrosis factor and nonantitumor necrosis factor biologics for rheumatoid arthritis. Curr Opin Rheumatol 2013; 25(3):384-390. [ Links ]
17. Nam JL, Ramiro S, Gaujoux-Viala C, Takase K, León-García M, Emery P, et al. Efficacy of biological disease-modifying antirheumatic drugs: a systematic literature review informing the 2013 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2014;73(3):516-528. [ Links ]
18. Ramiro S, Gaujoux-Viala C, Nam JL, Smolen JS, Buch M, Gossec L, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014;73(3):529-535. [ Links ]
19. De la Vega M, Casado G, Citera G, Soriano E, Venarotti H, Saurit V, et al. Primer reporte de eventos adversos de tratamientos biológicos en Argentina. Informe de Registro BIOBADASAR. Rev Arg Reumatol 2011;22(4):40-54. [ Links ]
20. Aletaha D, Neogi T, Silman A, Funovits J, Felson D, Bingham C, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010;69(9):1580-1588. [ Links ]
21. Aletaha D, Smolen J. The Simplified Disease Activity Index (SDAI) and the Clinical Disease Activity Index (CDAI): A review of their usefulness and validity in rheumatoid arthritis. Clin Exp Rheumatol 2005;23 (Suppl. 39):S100-S108. [ Links ]
22. Lars EK, Tore S, Pierre G. The LUNDEX, a new index of drug efficacy in clinical practice: Results of a five‐year observational study of treatment with infliximab and etanercept among rheumatoid arthritis patients in southern Sweden. Arthritis Rheum 2006;54(2):600-606 [ Links ]
23. Ramiro S, Landewé R, van der Heijde D, Collier D, Michaud K. Discontinuation rates of biologics in patients with rheumatoid arthritis: are TNF inhibitors different from non-TNF inhibitors?. RMD open 2015;1(1): e000155. [ Links ]
24. Soliman MM, Ashcroft DM, Watson KD, Lunt M, Symmons DP, Hyrich KL. Impact of concomitant use of DMARDs on the persistence with anti-TNF therapies in patients with rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2011; 70(4):583-589. [ Links ]
25. Hetland ML, Christensen IJ, Tarp U, Dreyer L, Hansen A, Hansen IT, et al. Direct Comparison of Treatment Responses, Remission Rates, and Drug Adherence in Patients With Rheumatoid Arthritis Treated With Adalimumab, Etanercept, or Infliximab. Results From Eight Years of Surveillance of Clinical Practice in the Nationwide Danish DANBIO Registry. Arthritis Rheum 2010;62(1):22-32. [ Links ]
26. Torrente-Segarra V, Bergstra SA, Salomon-Escoto K, Da Silva J, Veale D, Al-Emadi S, et al. Is current smoking status and its relationship to anti-cyclic citrullinated peptide antibodies a predictor of worse response to biological therapies in rheumatoid arthritis patients?. Scand J Rheumatol 2018; doi: 10.1080/03009742.2017.1418423. [Epub ahead of print] [ Links ]
27. Saevarsdottir S, Wedre´n S, Seddighzadeh M, Bengtsson C, Wesley A, Lindblad S, et al. Patients with early rheumatoid arthritis who smoke are less likely to respond to treatment with methotrexate and tumor necrosis factor inhibitors: observations from the Epidemiological Investigation of Rheumatoid Arthritis and the Swedish Rheumatology Register cohorts. Arthritis Rheum 2011;63(1):26-36. [ Links ]
28. Canhão H, Rodrigues AM, Mourão AF, Martins F, Santos MJ, Canas-Silva J, et al. Comparative effectiveness and predictors of response to tumour necrosis factor inhibitor therapies in rheumatoid arthritis. Rheumatology 2012;51(11):2020-2026. [ Links ]
29. Bartlett SJ, Schieir O, Valois MF, Hitchon C, Boire G, Haraoui B, et al. Who is not reaching remission in early RA and Why?. Predictors for persistent disease activity in the first year differ in men and women and are related to lifestyle and treatment. DOI: 10.1136/annrheumdis-2018-eular.2071 [ Links ]














