Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de reumatología
versión impresa ISSN 0327-4411versión On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.30 no.1 Buenos Aires mar. 2019
ARTÍCULO ORIGINAL
Sexto reporte de eventos adversos con tratamientos biológicos en Argentina. Informe del registro BIOBADASAR
Sixth report of adverse events with biological treatments in Argentina. Report of the BIOBADASAR registry
G. Gómez, G. Pons-Estel, G. Citera, E. Soriano, V. Saurit, F. Benavidez, E. Velozo, D. Dubinsky, I. Exeni, C. Gobi, G. Gómez, M. Díaz, A. Granel, A. Smichowsky, G. Garate, A. Quinteros, E. Cavillon, I. Petkovic, M.S. Larroude, M. de la Sota, A.M. Cappuccio, G. Berbotto, A. Alvarez, S. Papasidero, A. Lazaro, M. Garcia, M. Sacnun, S. Soares de Souza, A. Bertoli, V. Bejarano, O. Rillo, E. Kerzberg, R. Quintana, S. Agüero, L. Somma, V. Cruzat, C. Battaglitti, A. Perez Dávila, M. Gallardo, D. Pereira, M. Verando, S. Paira, L. Martinez, N. Aste, C. Pisoni, E. Catay, C. Graf, G. Casado, M. de la Vega
Correspondencia: E-mail: mainadelavega.mdlv@gmail.com
Resumen
Objetivo: Actualizar los resultados del registro BIOBADASAR sobre seguridad, duración y causas de interrupción del tratamiento luego de 8 años de seguimiento.
Métodos: BIOBADASAR es un registro de seguridad de terapias biológicas establecido por la Sociedad Argentina de Reumatología. Se presenta la descripción de BIOBADASAR 3.0, una cohorte compuesta por 53 centros de Argentina seguidos prospectivamente desde agosto de 2010 hasta enero de 2018.
Resultados: Se registraron 4656 pacientes, 6234 tratamientos [3765 casos (terapia con biológicos) y 2469 controles (terapia no biológicos)]. Se interrumpió el tratamiento en el 44,6% en los casos vs. 27,9% en los controles. Causa principal de discontinuación fue por ineficacia (40% casos vs. 32% controles). Se presentaron 3154 eventos adversos (2230 en casos vs. 924 en controles), de los cuales el 13,6% fueron graves (9,8% en casos y 3,7% en controles). El evento adverso (EA) más frecuente en ambos grupos fueron las infecciones (43,56% en casos vs. 34,31% en los controles, RR: 3,42; IC 95%: 3,02-3,88), y de ellas las de vías aéreas superiores (14,5%). Las neoplasias se presentaron en 78 casos vs. 45 en controles (RR: 1,98; IC 95%: 1,37-2,86).
Conclusiones: En este sexto reporte no se observan tendencias diferentes sobre seguridad, duración y causas de interrupción del tratamiento respecto a informes previos. Las infecciones fueron el principal EA y la ineficacia, seguido por EA y la pérdida de pacientes las principales causas de suspensión del tratamiento. El advenimiento de nuevos agentes biológicos y la necesidad de control en seguridad a largo plazo, fortalece el uso de este tipo de registro.
Palabras clave: registro; eventos adversos; biológicos.
Abstract
Objective: Update the results of the BIOBADASAR registry on safety, duration and causes of treatment interruption after 8 years of follow-up.
Methods: BIOBADASAR is a safety record of biological therapies established by the Argentine Society of Rheumatology. The description of BIOBADASAR 3.0 is presented, a cohort of 53 centers in Argentina followed prospectively from August 2010 to January 2018.
Results: 4656 patients were registered, 6234 treatments [3765 cases (therapy with biologicals) and 2469 controls (non-biological therapy)]. Treatment was interrupted in 44.6% in cases vs. 27.9% in controls. Main cause of discontinuation was due to inefficiency (40% cases vs. 32% controls). There were 3154 adverse events (2230 in cases vs. 924 in controls), of which 13.6% were tombs (9.8% in cases and 3.7% in controls). The most frequent adverse event (AE) in both groups were infections (43.56% in cases vs. 34.31% in controls, RR: 3.42, 95% CI: 3.02-3.88), and the upper airway pathways (14.5%). Neoplasms were published in 78 cases versus 45 controls (RR: 1.98, 95% CI: 1.37-2.86).
Conclusions: In this article, there are no different trends regarding safety, duration and causes of interruption of treatment compared to previous reports. Infections were the main causes of treatment discontinuation. The advent of new biological agents and the need for control over long-term security, strengthens the use of this type of registration.
Key words: register; adverse events; biologics.
Introducción
El tratamiento de las enfermedades reumáticas se ha revolucionado con la aparición de los agentes biológicos, mejorando la evolución y el pronóstico de las mismas1.
Gracias al interés de la industria y al desarrollo de la biotecnología molecular y celular, desde la publicacion de nuestro último reporte (referencia), en los últimos 3 años se han aprobado y comenzado a utilizar en Argentina nuevos agentes biológicos, con diferentes dianas moleculares2, como es el caso de los inhibidores de IL-17, IL-12 y 23, y los biosimilares (según la OMS y la Unión Europea: producto bioterapéutico similar en cuanto a calidad, seguridad y eficacia al producto bioterapéutico de referencia ya comercializado)3,4,5. En la actualidad, en Argentina, disponemos de 14 fármacos incluidos en estas categorías para el tratamiento de las enfermedades reumáticas inflamatorias aprobados por el ANMAT.
Sin embargo, el uso de estas terapias genera inquietud, ya que bloquean o inhiben citoquinas o sus receptores (TNF, IL) o células (linfocitos B y T) que participan como mecanismo de defensa contra la infección o el cáncer6. Conocer el perfil de seguridad de estos fármacos a largo plazo ha sido posible, no solo gracias al aporte de ensayos clínicos cuyas poblaciones son homogéneas y seleccionadas7, sino también a la creación de registros nacionales y regionales, que poseen datos que representan a la población general y permiten el seguimiento epidemiológico sobre el uso de los mismos. Muchos países cuentan con estos registros como es el caso de Alemania (RABBIT), Dinamarca (DANBIO), Estados Unidos (CORRONA), Francia (RATIO), Gran Bretaña (BSRBR), Suecia (ARTIS), Suiza (SCQM), República Checa (ATRA), España (BIOBADASER).
La Sociedad Argentina de Reumatología impulsó, en el año 2010, la creación de BIOBADASAR, registro de eventos adversos (EA) de terapias biológicas en enfermedades reumáticas8. El mismo tiene por objetivo principal brindar información sobre seguridad en el uso de las diferentes terapias biológicas utilizadas en Argentina. Desde agosto de 2015 se ha evolucionado a BIOBADASAR 3.0, con el objetivo secundario de evaluar la efectividad del tratamiento.
El objetivo de este informe, con la inclusión de nuevos agentes terapéuticos en el sistema de salud argentino, es actualizar los resultados del registro sobre seguridad, duración y causas de interrupción del tratamiento luego de 8 años de seguimiento.
Pacientes y métodos
BIOBADASAR recoge información procedente de 53 centros de Reumatología del país. Los datos son incorporados en una plantilla digital provista por la Sociedad Española de Reumatología. El protocolo utilizado por todos los centros con la correspondiente definición de variables y medidas de desenlace ha sido descripto en detalle en publicaciones previas (M de la Vega, et al. Rev Arg Reumatol 2016;27(1):14-24).
El protocolo y los materiales de BIOBADASAR 3.0 se encuentran disponibles en el sitio web https://biobadasar.ser.es/. Los participantes de cada centro obtienen los datos en forma retrospectiva y se realiza seguimiento prospectivo de la incidencia de los EA y duración de los tratamientos. A partir de 2016, con el comienzo de la Fase III, es obligatoria la revisión anual de los pacientes. En esta fase se incorporaron los biosimilares y datos como: índice de actividad de las diferentes enfermedades, Índice de Charlson (comorbilidades), Algoritmo Naranjo (causalidad), anti-CCP y FR, vía de administración de biológicos y MTX, dosis de glucocorticoides, quantiferon; con la finalidad de determinar la efectividad del tratamiento.
Se realizan monitoreos online y una vez al año se realiza una monitorización in situ de manera aleatoria. La aplicación informática también contiene filtros que limitan la entrada de datos fuera del margen admisible.
Los datos analizados en este informe, corresponden a los pacientes cargados desde el 1 de agosto de 2010 hasta el 13 de enero de 2018. Las variables categóricas se compararon por Chi cuadrado o test exacto de Fisher y las continuas por test de Student o ANOVA. Se calculó la incidencia de eventos adversos por 1000 personas/año, y se compararon las mismas entre pacientes casos vs. control. La supervivencia del tratamiento fue evaluada por curvas de Kaplan-Meier y la comparación entre los diferentes tratamientos se realizó por análisis de Log Rank. Un valor de p menor a 0,05 se consideró significativo. Se utilizó Infostat 2016 para el análisis estadístico y sus correspondientes gráficos.
Resultados
Al 13 de enero de 2018, BIOBADASAR 3.0 incluye un total de 4656 pacientes, compuesto por 78,9% (3674) de mujeres y 21,1% (982) de hombres con una edad promedio de 56,9 años (rango de edad: 6-101) para casos y 56,2 años (rango de edad: 7-96) para controles. La evolución de la enfermedad fue de 15,15 años en los casos [desvío estándar (DS) 9,2] y 11 años en los controles (DS 8,5).
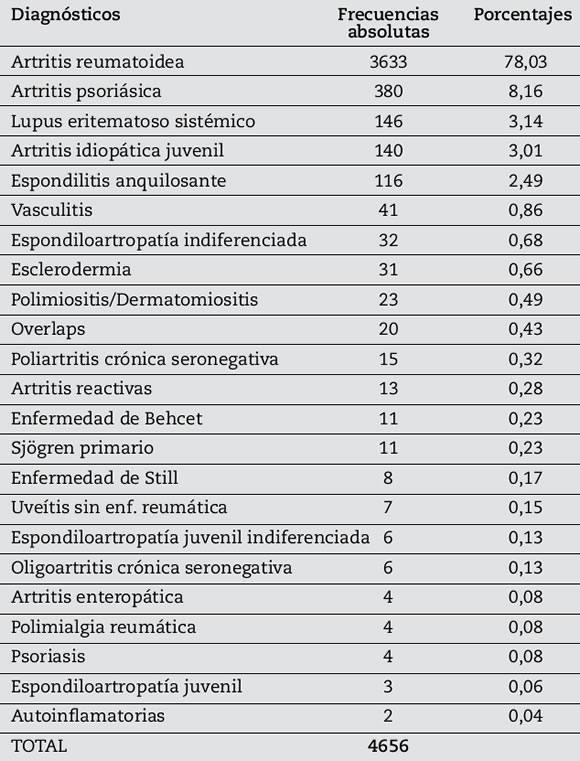
Los diagnósticos principales fueron artritis reumatoidea (1896 pacientes en casos y 1737 en controles), artritis psoriásica (241 pacientes en casos y 139 en controles), artritis idiopática juvenil (84 pacientes en casos y 56 en controles), espondilitis anquilosante (89 pacientes en casos y 27 en controles), lupus eritematoso sistémico (70 pacientes en casos y 76 en controles) y otros diagnósticos (127 pacientes en casos y 114 en controles). Ver frecuencia absoluta y porcentajes de cada patología en Tabla 1.
Tabla 1. Diagnósticos.
Con respecto a las comorbilidades, la más frecuentemente observada fue la hipertensión arterial (24,25% en casos y 21,54% en controles), seguida de osteoporosis (14,88% en casos y 12% en controles) e hipercolesterolemia (13,04% en casos y 11,6% en controles). No se observaron diferencias significativas entre los grupos.
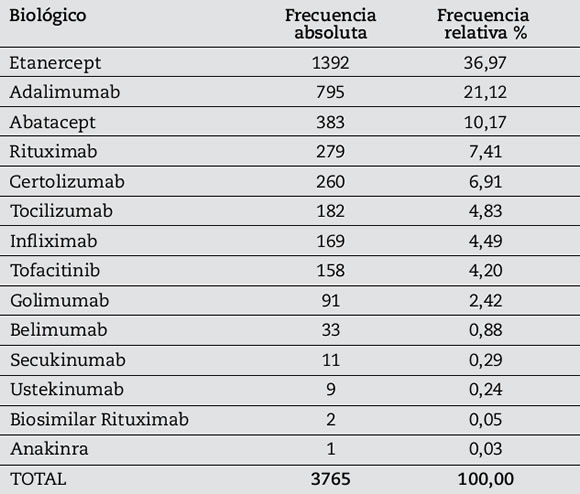
Se analizaron un total de 6234 tratamientos de los cuales 3765 (60,4%) fueron casos y 2469 (39,6%) controles. La frecuencia absoluta y relativa de los casos queda resumida en la Tabla 2.
Tabla 2. Distribución de terapia biológica.
La continuidad media de los tratamientos biológicos fue 34 meses. Las medianas de sobrevida en meses por agente biológico fueron para etanercept 55,9 (DS 49), adalimumab 49,4 (DS 40), belimumab 47,3 (DS 39), infliximab 46,88 (DS 35), abatacept 40,6 (DS 30), rituximab 39,5 (DS 28), anakinra 38 (DS 38), tocilizumab 37,95 (DS 31), golimumab 30,14 (DS 29), certolizumab 25,75 (DS 24), ustekinumab 25,67 (DS 24), tofacitinib 22,22 (DS 19), secukinumab 8,5 (DS 7) y biosimilar rituximab 7,5 (DS 7) (Figura 1).

Figura 1. Curva de supervivencia del tratamiento con biológicos.
La suspensión del tratamiento fue del 44,6% para los casos y 27,9% para los controles. Las principales causas de discontinuación para los casos fueron ineficacia o pérdida de eficacia (40%) seguido por evento adverso (30%). Para los controles, la principal causa de discontinuación fue la ineficacia o pérdida de la eficacia (32%) seguido de pérdida del paciente (28%). Existiendo diferencias significativas entre los diferentes biológicos y el grupo control entre los motivos de abandono (p 0,0001) (Tabla 3).
Tabla 3. Causas de discontinuación.

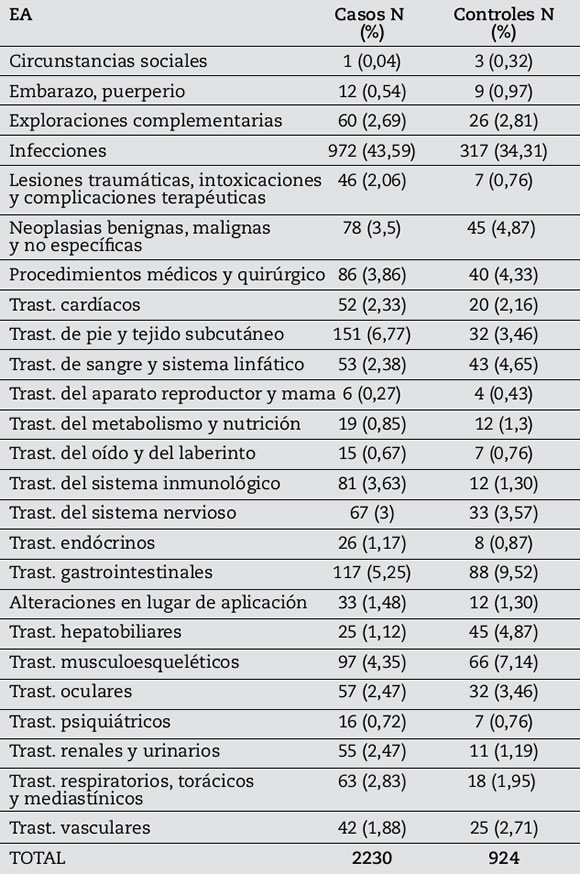
Durante el seguimiento se registró un total de 3154 EA indexados, 2230 (70,7%) en el grupo de los casos y 924 (29,3%) en los controles, y queda reflejado en la Tabla 4.
Tabla 4. EA (SOC) por grupo: casos y control.
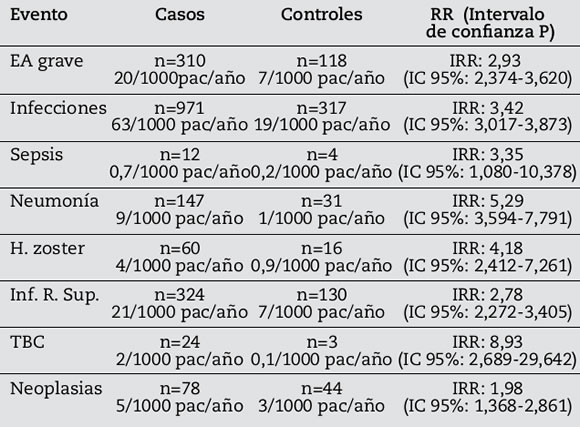
Los eventos graves, definidos como cualquier suceso relacionado o no con el tratamiento, que produzca la muerte, ponga en peligro la vida, precise de ingreso hospitalario o lo prolongue, o bien produzca una discapacidad persistente o importante, fueron 428 (13,6%) de los cuales 9,8% ocurrieron en los casos y 3,7% en controles. La incidencia de eventos graves fue de 20/1000 pacientes/año en el grupo casos vs. 7/1000 pacientes/año en el grupo control, con un RR: 2,93 (IC 95%: 2,374-3,620). Del total de pacientes con EA graves, sólo el 1% en el grupo caso y el 0,2% en los controles tuvieron desenlace mortal (Tabla 5).
Tabla 5. Incidencia (cada 1000 pacientes) de EA graves según biológicos.
![]()
En la Tabla 6 se pueden observar los riesgos relativos de eventos graves, infecciones y neoplasias en pacientes expuestos a tratamientos biológicos frente a los no expuestos.
Tabla 6. Principales eventos adversos. Incidencias y Riesgos Relativos.
En cuanto al desenlace de los mismos, se recuperaron sin secuelas: 1719 (54,5%) en el grupo de casos vs. 687 (21,8%) en controles, y 16 pacientes (2,8%) en casos vs. 3 (0,95%) en controles fallecieron por causa del EA (Tabla 7).
Tabla 7. Desenlace de los eventos adversos.

Discusión
Este sexto reporte de BIOBADASAR, refleja la realidad Argentina sobre el uso de biológicos y la incidencia de EA, patrones de uso y continuidad de los tratamientos biológicos en reumatología7, ya que los pacientes incluidos en nuestro registro son heterogéneos, provenientes de sectores públicos y privados de diferentes provincias de Argentina.
Con respecto al diagnóstico, la Artritis Reumatoidea es la enfermedad más prevalente en el registro representando un 78%, duplicando al observado en otros registros, como el español en el que representa al 38,5%. En este último registro hay mayor prevalencia de Espondilitis Anquilosante (BIOBADASER 19,5% vs. BIOBADASAR 2,49%) y menor prevalencia en Lupus (BIOBADASER 1,8% vs. BIOBADASAR 3,14%) que en nuestro registro9.
Encontramos diferencias en el tiempo de evolución de las enfermedades entre el grupo casos y el grupo control, siendo mayor la duración de la enfermedad en los casos con una diferencia de 4 años. Lo que hace suponer que estos pacientes pueden tener más daño acumulado y que acceden más tardíamente a estos tratamientos. En relación a los últimos reportes se evidenció una disminución en el tiempo de duración de la enfermedad previo a la utilización de un tratamiento biológico o pequeña molécula.
En nuestro medio, el agente biológico más utilizado es el Etanercept (36,97%) seguido por Adalimumab (21,12%) y Abatacept (10,17%) a diferencia de lo que ocurre en otros registros, por ejemplo en España que tienen mayor experiencia con adalimumab (16%) seguido por etanercept (13,7%)9. Podría deberse a los tiempos de aprobación y comercialización de cada agente en cada país7.
Un dato interesante, es que desde la incorporación a la base de las pequeñas moléculas (tofacitinib) fue aumentando rápidamente su tasa de uso. Esta droga fue utilizada en el año 2014 (año de incorporación a la base) por el 0,33%10 de los pacientes y en el análisis actual por el 4,2%.
La media de uso continuado de los agentes biológicos fue de 34 meses, y el principal motivo de discontinuación fue por ineficacia o pérdida de eficacia (40%), similar a lo ocurrido en otros registros11, seguido por los EA (30%), siendo algo mayor este porcentaje comparado con el registro español que presenta 17,6% de EA9. Mientras que en los controles fue por ineficacia (32%) seguido por pérdida de seguimiento del paciente (28%). Existiendo diferencias significativas entre los diferentes biológicos y el grupo control entre los motivos de abandono. Cabe destacar que en los primeros reportes de BIOBADASAR, la principal causa de discontinuación fueron los eventos adversos. Esto quizás demuestre el mejor seguimiento, control y elección de tratamientos según estado clínico del paciente, apoyado por la diversidad de tratamientos disponibles.
En cuanto a los EA, los de mayor prevalencia fueron las infecciones (43,59%), siendo las más frecuentes las de vías aéreas superiores; seguidos por trastornos en piel y tejido subcutáneo (6,77%). Se debe destacar que la neumonía, herpes y TBC presentan un riesgo relativo más alto que los controles.
Los EA con desenlace fatal no han sufrido grandes variaciones con respecto a informes previos. Siendo la mitad de las muertes relacionadas con EA y la otra mitad no relacionada con el fármaco administrado, en ambos grupos (casos y controles).
En resumen, en este informe no se observan diferencias en cuanto al riesgo de EA, duración y causas de interrupción del tratamiento con respecto a informes previos de BIOBADASAR. Es sabido que los registros no son reflejos exactos de la realidad y que sus diseños pueden presentar sesgos7. Para esto se han implementado mecanismos de monitorización para mejorar la calidad de los datos y obtener mejores resultados.
Apéndice
Centros participantes
CABA: Atención Integral en Reumatologia, CEIM, CEMIC, Consultorio Dra. Larroude, Hospital de Clínicas José de San Martín, Hospital Británico, Hospital de Rehabilitación M. Rocca, Hospital Dr. César Milstein, Hospital Fernández, Hospital Italiano, Hospital Penna, Hospital Pirovano, Hospital Ramos Mejía, Hospital Rivadavia, Hospital Tornú, Instituto de Investigaciones Médicas Alfredo Lanari, Instituto de Rehabilitación Psicofísica de Bs. As., REUMAR, Sanatorio Güemes.
Provincia de Bs As: Centro Platense de Reumatologia, Clínica Bessone, Consultorio Dr. Somma, Consultorio Dra. de la Sota, Consultorio Raquis, Hospital Churruca, Hospital San Martín, IARI.
Córdoba: Consultorio Cavillon, Hospital Nacional de Clínicas, Hospital Privado, Hospital San Roque, Instituto Reumatológico Strusberg, Sanatorio Allende, Sanatorio Parque.
Santa Fe: Hospital Cullen, Hospital de Niños Dr. Orlando Alassia, Hospital Eva Perón y Sanatorio Británico, Hospital Provincial, Sanatorio Parque.
Tucumán: Centro Integral Reumatológico, Consultorio Dra. Bellomio, Consultorio Dra. Garrone, Consultorio Reumatología.
Entre Ríos: Centro Médico Mitre, Sanatorio Adventista del Plata.
Mendoza: Consultorio Petkovic.
Chaco: ASTE centro de infusión.
Neuquén: Hospital Castron Rendon.
Río Negro: Bariloche.
Catamarca: Sanatorio Pasteur.
Formosa: Centro Moreno 150.
Salta: Hospital del Milagro.
Estadista: Vanesa Fernández.
1. M de la Vega, et al. Primer reporte de eventos adversos de tratamientos biológicos en Argentina. Informe de Registro BIOBADASAR. Rev Arg Reumatol. 2011; 22(4):40-54. [ Links ]
2. Braun J, Kalden JR. Biologics in the treatment of rheumatoid arthritis and ankylosing spondylitis. Clin Exp Rheumatol. 2009; 27(4 suppl 55):S164-7. [ Links ]
3. MA Descalzo, L Carmona y grupo de estudio BIOBADASER. Biobadaser 2.0: análisis y tendencias en 2009. Reumatol Clin. 2010; 6(5):240-243.
4. World Health Organization. Guidelines on Evaluation of Similar Biotherapeutic Products (SBPs). 2009. http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR _WEB_22APRIL2010.pdf
5. European Medicines Agency. Guideline on similar biological medicinal products containing monoclonal antibodies–non-clinical and clinical issues. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2012/06/WC500128686.pdf
6. C. Rodríguez Lozano. Seguridad de las terapias biológicas: nuevos datos de BIOBADASER. Reumatol Clin. 2011; 6(S3):S1–S6.
7. European Medicines Agency. Questions and answers on biosimilar medicines (similar biological medicinal products). http://www.ema.europa.eu/docs/en_GB/document_library/Medicine_QA/2009/12/WC500020062.pdf
8. Informe Anual Biobadaser 2017. Registro español de acontecimientos adversos de terapia biológica en enfermedades reumáticas. Fase III. Sociedad Española de Reumatologia. 2018.
9. M de la Vega, et al. Características de los tratamientos biológicos en enfermedades reumáticas en Argentina. Quinto informe del registro BIOBADASAR. Rev Arg Reumatol. 2016; 27(1):14-24. [ Links ]
10. M de la Vega, et al. Cuarto reporte de efectos adversos con tratamientos biológicos en Argentina. Informe de registro Biobadasar 2.0. Sociedad Argentina de Reumatologia. 2014.
11. Titton DC, Silveira IG, Louzada-Junior P, et al. Brazilian Biologic Register: Biobadabrasil implementation process and preliminary results. Rev Bras Reumatol 2011; 51(2):145-160. [ Links ]














