Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.30 no.2 Buenos Aires jun. 2019
ARTÍCULO ORIGINAL
La depresión es un determinante mayor de la capacidad funcional en pacientes con artritis reumatoidea, independientemente de la actividad de la enfermedad
Depression is a major driver of functional capacity in patients with rheumatoid arthritis regardless of disease activity
Carolina Ayelen Isnardi1, Dafne Capelusnik1, Emilce Edith Schneeberger1, Marcela Bazzarelli2, Laura Barloco2, Eliana Blanco3, Cristian Alejandro Benítez3, Federico Luján Benavídez3, Santiago Scarafia4, María Alicia Lázaro4, Rodolfo Pérez Alamino5, Francisco Colombres5, María Paula Kohan6, Julia Sosa6, Luciana González Lucero7, Ana Lucía Barbaglia7, Hernán Maldonado Ficco8, Gustavo Citera1
1Instituto de Rehabilitación Psicofísica, Ciudad Autónoma de Buenos Aires.
2Hospital Interzonal General de Agudos Petrona V. de Cordero, Buenos Aires.
3Hospital General de Agudos Dr. Cosme Argerich, Ciudad Autónoma de Buenos Aires.
4Instituto de Asistencia Reumatológica Integral, Buenos Aires.
5Hospital de Clínicas Nicolás Avellaneda, Tucumán.
6Hospital General de Agudos Dr. Enrique Tornú, Ciudad Autónoma de Buenos Aires.
7Hospital Ángel C. Padilla, Tucumán.
8Hospital San Antonio de Padua, Córdoba.
Correspondencia: E-mail: gustavocitera@gmail.com
Resumen
La depresión es una de las comorbilidades más frecuentemente reportadas en pacientes con Artritis Reumatoidea (AR). Su presencia se asocia a mayores costos de salud, mayor mortalidad y reduce las probabilidades de alcanzar una buena respuesta al tratamiento.
Objetivo: Evaluar la prevalencia de depresión en pacientes argentinos con AR y establecer su relación con diferentes factores sociodemográficos y clínicos.
Material y métodos: Se incluyeron pacientes ≥18 años de edad, con diagnóstico de AR según criterios ACR-EULAR 2010. Se consignaron datos sociodemográficos, comorbilidades, características clínicas, actividad de la enfermedad y tratamiento actual. Se administraron los cuestionarios EQ-5D-3L, QOL-RA, HAQ-A y PHQ-9. Los valores de PHQ-9 de 5-9, 10-14, 15-19 y ≥20 determinan la presencia de depresión leve, moderada, moderada/severa y severa, respectivamente y un valor de corte ≥10, depresión mayor. Análisis estadístico: Test T de Student, ANOVA y Chi2. Regresión lineal múltiple.
Resultados: Se incluyeron 258 pacientes, con un tiempo mediano (m) de evolución de la enfermedad de 9 años (RIC 3,6-16,7). La m de depresión valorada por PHQ-9 de 6 (RIC 2-12,5). La prevalencia de depresión mayor fue de 33,8%. Sesenta y seis (25,6%), 42 (16,3%), 27 (10,5%) y 18 (7%) pacientes presentaron depresión leve, moderada, moderada/severa y severa, respectivamente. Los pacientes con depresión mayor mostraron menor capacidad funcional (HAQ-A X1,6±0,8 vs X0,7±0,7, p <0,0001), peor calidad de vida (QOL-RA X5,4±1,8 vs X7,3±1,6, p <0,0001), más dolor (EVN X56,2±27,5 mm vs X33,4±25,7 mm, p <0,0001), mayor actividad de la enfermedad (DAS28-ERS X4,3±1,4 vs X3,3±1,3, p <0,0001), mayor frecuencia de desempleo (71% vs 29%, p=0,015 ) y de comorbilidades (67% vs 33%, p=0,017) y menor frecuencia de actividad física (22% vs 35%, p=0,032). En el análisis multivariado, peor capacidad funcional (OR: 2,1, IC 95%: 1,6-4,3, p <0,0001) y calidad de vida (OR: 0,7, IC 95%: 0,5-0,8, p <0,0001) se asociaron independientemente a la presencia de depresión mayor.
Conclusiones: La prevalencia de depresión mayor medida por PHQ-9 en esta cohorte argentina de pacientes con AR fue de 33,8%. La presencia de depresión tiene un impacto negativo sobre la capacidad funcional y la calidad de vida de estos pacientes, independientemente de la actividad de la enfermedad.
Palabras clave: depresión; PHQ-9; artritis reumatoidea.
Abstract
Depression is one of the most frequent comorbidity in patients with Rheumatoid Arthritis (RA). It's presence is associated with higher healthcare costs, mortality rate and reduced odds of achieving a good treatment response.
Objective: To determine the prevalence of depression in Argentinean patients with RA and to establish its relationship with different sociodemographic and clinical factors.
Material and methods: Consecutive patients ≥18 years old, with a diagnosis of RA according to ACR-EULAR 2010 criteria were included. Sociodemographic data, comorbidities, RA characteristics, disease activity and current treatment were registered. Questionnaires were administered: EQ-5D-3L, QOL-RA, HAQ-A and PHQ-9. PHQ-9 scores of 5-9, 10-14, 15-19, ≥20 represent mild, moderate, moderate/severe and severe depression, respectively and a cut-off value ≥10, major depression. Statistical analysis: Student's T, ANOVA and Chi2 tests. Multiple logistic regression.
Results: 258 patients were included, with a median (m) disease duration of 9 years (IQR 3.6-16.7). The m PHQ-9 score was 6 (IQR 2-12.3). The prevalence of major depression was 33.8%. 66 (25.6%), 42 (16.3%), 27 (10.5%) and 18 (7%) patients presented mild, moderate, moderate/severe and severe depression, respectively. Patients with mayor depression had worse functional capacity (HAQ-A X 1.6±0.8 vs X 0.7±0.7, p <0.0001), poorer quality of life (QOL-RA X 5.4±1.8 vs X 7.3±1.6, p <0.0001), greater pain (NVS X 56.2±27.5 mm vs X 33.4±25.7 mm, p <0.0001), higher disease activity (DAS28-ESR X 4.3±1.4 vs X 3.3±1.3, p <0.0001), higher frequency of unemployment (71% vs 29%, p=0.015 ) and comorbidities (67% vs 33%, p=0.017) and lower frequency of physical activity (22% vs 35%, p=0.032). In the multivariate analysis, patients with moderate and severe depression had worse functional capacity (OR: 2.1, 95% CI: 1.6-4.3, p <0.0001) and quality of life (OR: 0.7, 95% CI: 0.5-0.8, p <0.0001), independently of disease activity.
Conclusion: The prevalence of mayor depression in this Argentinean cohort of patients with RA was 33.8%. The presence of depression had a negative impact on functional capacity and quality of life regardless of disease activity.
Key words: depression; PHQ-9; rheumatoid arthritis.
Introducción
Los pacientes con Artritis Reumatoidea (AR) poseen un riesgo cercano al 50% de desarrollar algún trastorno del humor o de ansiedad, resultados que superan a los encontrados en la población general1. Sturgeon y cols.2 proponen una posible explicación a esta asociación. Signos y síntomas de la enfermedad como la inflamación, el dolor y la fatiga son responsables del desarrollo de discapacidad física, social y laboral. Además, provocan trastornos del humor, alteración de la respuesta conductual y cognitiva, como menor adherencia al tratamiento, disturbios del humor y estrés, influyendo negativamente en la actividad de la enfermedad. De esta manera, se genera un círculo vicioso.
El compromiso de la salud mental más frecuente en pacientes con AR es la depresión2,3, pudiendo observarse hasta en la mitad de ellos. Los porcentajes pueden variar, dependiendo de la cohorte analizada y el instrumento utilizado para su detección4. Desde el punto de vista fisiopatológico, esta asociación ha sido vinculada con el aumento de citoquinas proinflamatorias circulantes, particularmente, interleuquina 6 (IL-6), factor de necrosis tumoral alpha (TNFα) e interleuquina 17 (IL-17)5-7. Las mismas afectarían el correcto funcionamiento de diferentes vías de neurotransmisión, entre ellas el sistema monoaminérgico, eje hipotálamo-hipófiso-adrenal y de las vías dependientes de glutamato y disminuirían la neurogénesis, efectos que han sido involucrados en el desarrollo de la depresión8.
Diferentes estudios han demostrado que la presencia de depresión se asocia a mayores costos directos e indirectos9 y mortalidad10, menor probabilidad de alcanzar la remisión11,12 y menor sobrevida del tratamiento con agentes biológicos13. Por estas razones y con el objetivo de optimizar el control de la enfermedad y mejorar su pronóstico, es sumamente necesario identificar la presencia de síntomas depresivos.
En la actualidad, contamos con múltiples herramientas diseñadas para detectar depresión. Algunas de ellas, deben ser administradas a través del profesional de salud como el Hamilton Depression Rating Scale (HDRS)14, y otras son cuestionarios auto-reportados por los pacientes como el Beck Depression Inventory (BDI)15, el Center for Epidemiological Studies Depression (CES-D)16 y el Patient Health Questionnaire (PHQ)17. Este último, ha sido desarrollado más recientemente y su uso ha crecido por su excelente desempeño18-20. El PHQ-9 está compuesto por 9 preguntas que hacen referencia a la frecuencia del padecimiento de distintos síntomas relacionados a la depresión en el marco de tiempo de las dos últimas semanas. Este autocuestionario no sólo permite identificar pacientes con síntomas depresivos, sino que además es útil para valorar la evolución y respuesta al tratamiento17. Sin embargo, cabe destacar que el diagnóstico definitivo de depresión debe ser realizado por un profesional especializado en el área.
Los objetivos de este estudio fueron evaluar la prevalencia de depresión en pacientes argentinos con AR y establecer su relación con diferentes factores sociodemográficos y clínicos de la enfermedad.
Material y métodos
Se realizó un estudio de corte transversal, en el cual se incluyeron pacientes consecutivos ≥18 años de edad, de ambos sexos, con diagnóstico de AR según criterios ACR-EULAR 201021. Se excluyeron pacientes con dificultades para completar el autocuestionario (analfabetos, no videntes) y aquellos con comorbilidades no compensadas que pudieran influir sobre la calidad de vida de los mismos.
Se consignaron datos sociodemográficos: sexo, edad, estado civil, ocupación, jubilado/pensionado, causa de desocupación, escolaridad, la presencia de comorbilidades: hipertensión, diabetes, tabaquismo, enfermedad pulmonar obstructiva crónica, cardiopatía e hipotiroidismo. Se definió la realización de actividad física en forma regular, como una hora al día al menos tres veces por semana. Se determinaron características de la enfermedad como tiempo de evolución, positividad para Factor Reumatoideo (FR) y anticuerpos antipéptidos cíclicos citrulinados (anti-CCP), presencia de erosiones articulares y nódulos reumatoideos. Se evaluaron dolor y actividad global de la enfermedad según el paciente y el médico por medio de escala visual numérica (EVN), recuento de 28 articulaciones tumefactas y dolorosas, presencia y duración de rigidez matinal y tratamiento actual. Se registraron los valores de eritrosedimentación (ERS) en mm/h y proteína C reactiva (PCR) en mg/dl correspondientes a la visita. Se administraron cuestionarios para determinar calidad de vida: EQ-5D-3L22 y QOL-RA23, capacidad funcional a través de HAQ-A (Health Assessment Questionnaire-Argentinean version)24 y depresión por PHQ-9 (Patient Health Questionnaire 9)17. Se calcularon los índices compuestos: DAS28 (Disease Activity Score-28)25, CDAI (Clinical Disease Activity Index)26, SDAI (Simplified Disease Activity Index)27 e IAS (Índice de Actividad Simplificado)28. Los valores del índice PHQ-9 de 5-9, 10-14, 15-19 y ≥20 reflejan la presencia de depresión leve, moderada, moderada/severa y severa, respectivamente. Un valor de corte de PHQ-9 ≥10 determina depresión mayor17.
Análisis estadístico: Estadística descriptiva. Las variables continuas se expresaron como medianas (m) con su correspondiente rango intercuartilo (RIC), o bien como medias con su desvío estándar. Las variables continuas se compararon por test T de Student o ANOVA y las categóricas por test de Chi2 y test exacto de Fisher. Las correlaciones se realizaron mediante test de Spearman. Se realizó un modelo de regresión logística múltiple utilizando la presencia de depresión mayor como variable dependiente y ajustando por sexo, edad y tiempo de evolución. Las variables con una significancia menor a 0,1 en el univariado, fueron incluidas en el análisis multivariado, así como aquellas variables que a criterio del investigador fueran indispensables analizar.
Para el análisis se utilizó el programa SPSS versión 10.0.
Un valor de p menor a 0,05 se consideró significativo.
Resultados
Se incluyeron 258 pacientes provenientes de 8 centros de la Argentina, tres de Ciudad Autónoma de Buenos Aires, dos de la provincia de Buenos Aires, dos de Tucumán y uno de Córdoba. 85,7% de los pacientes eran mujeres, tenían una edad mediana (m) de 54 años (RIC 45-62), y un tiempo mediano de evolución de la AR de 9 años (RIC 3,6-16,7). La m de actividad de la enfermedad medido por DAS28-ERS fue 3,5 (RIC 2,5-4,5). El resto de las características basales sociodemográficas y clínicas de la enfermedad se describen en la Tabla 1.
Tabla 1. Características basales sociodemográficas y clínicas de la población

La m de índice PHQ-9 fue de 6 (2-12,5). Sesenta y seis (25,6%), 42 (16,3%), 27 (10,5%) y 18 (7%) pacientes presentaron depresión leve, moderada, moderada/severa y severa, respectivamente. La prevalencia de depresión mayor fue de 33,8% (Figura 1).
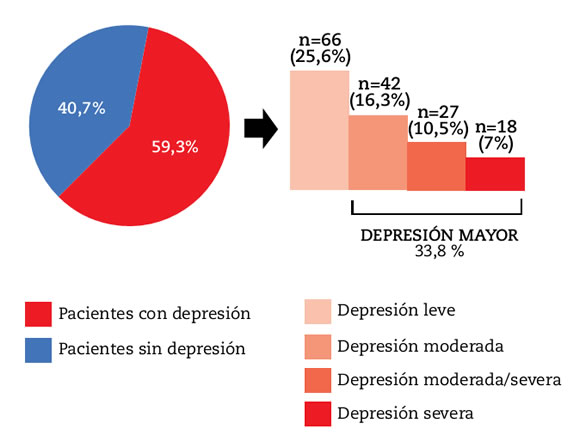
Figura 1. Prevalencia de depresión en pacientes con AR.
Los pacientes con depresión mayor presentaron menor capacidad funcional, peor calidad de vida, mayor dolor y mayor DAS28-ERS (Tabla 2). En este grupo se evidenció además, mayor frecuencia de desempleo, de comorbilidades y de uso de glucocorticoides y menor frecuencia de realización de actividad física de forma regular (Tabla 3).
Tabla 2. Asociación entre la presencia de depresión mayor y diferentes variables sociodemográficas y clínicas

Tabla 3. Asociación entre la presencia de depresión mayor y diferentes variables sociodemográficas y clínicas

No se observaron diferencias en la prevalencia de depresión entre los pacientes con artritis temprana (<2 años) y aquellos con enfermedad establecida (≥2 años) (41,4% vs 33,2%, p=0,57).
En el análisis multivariado, las variables que permanecieron asociadas a depresión mayor fueron: Peor capacidad funcional (OR: 2,1, IC 95%, 1,6-4,3, p <0,0001) y peor calidad de vida (OR: 0,7, IC 95%: 0,5-0,8, p <0,0001). (Tabla 4). Este impacto de la depresión en la capacidad funcional y la calidad de vida, fue independiente de la actividad de la enfermedad como puede observarse en las Figuras 2 y 3.
Tabla 4. Asociación entre depresión mayor y variables sociodemográficas y clínicas. Regresión logística múltiple


Figura 2. Depresión en pacientes con artritis reumatoidea según capacidad funcional y actividad de la enfermedad
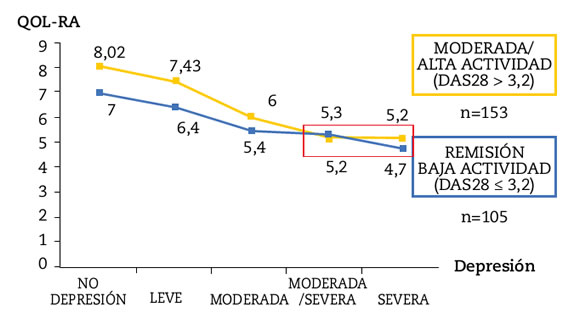
Figura 3. Depresión en pacientes con artritis reumatoidea según calidad de vida y actividad de la enfermedad
Discusión
La prevalencia de depresión mayor en esta cohorte argentina de pacientes con AR evaluada mediante el cuestionario PHQ-9 fue de 33,8%. Si bien la mediana de este índice fue 6, valor que corresponde a depresión leve, cabe destacar que 6 de cada 10 pacientes presentaban algún grado de depresión y que el 17,5% tenían depresión moderada/severa o severa.
Estos resultados son comparables con las cifras encontradas en otros países de la región. En México, Ambriz Murillo y cols. encontraron un valor medio de BDI en pacientes con AR de 18,8, correspondiente a depresión leve/moderada29. En Brasil, reportaron una prevalencia de síntomas depresivos del 53,2% mediante el índice Hospital Anxiety and Depression (HAD), significativamente superior que en pacientes con osteoartritis30. Por otro lado, en Ecuador, la frecuencia de depresión medida por PHQ-9 fue de 42,9% y de depresión mayor de 18,5%31.
La depresión en pacientes con AR también se ha observado en otros países fuera de Latinoamérica. Un estudio prospectivo británico demostró que 1 de cada 3 pacientes con AR presentan depresión dentro de los primeros 5 años luego del diagnóstico32. En Canadá, al analizar más de 10.000 pacientes con AR, se observó un riesgo 50% superior a la población general de desarrollar depresión33. En Estados Unidos, la prevalencia de depresión en pacientes con AR varía entre 12% y 60%4. Pacientes hispánicos y afroamericanos con AR presentan mayor prevalencia de depresión. Esto no estaría relacionado a factores genéticos, sino a las peores condiciones socioeconómicas como desocupación, bajos ingresos y menor nivel educativo34-36. Coincidiendo con estos datos, en nuestro estudio hemos demostrado que los pacientes con depresión mayor presentaban significativamente mayor frecuencia de desocupación y también observamos una correlación negativa entre el PHQ-9 y los años de escolaridad alcanzada (Rho -0,17, p=0,006).
Si bien la depresión mayor se asoció a desocupación, presencia de comorbilidades, falta de realización de actividad física regular, mayor actividad de la enfermedad y discapacidad funcional y peor calidad de vida; sólo las dos últimas se mantuvieron asociadas independientemente a la misma. Uno de los hallazgos más relevantes de nuestro estudio fue haber observado que algunos pacientes con depresión moderada y/o severa, a pesar de estar en remisión o baja actividad de la enfermedad, presentaban valores de QOL-RA y HAQ-A comparables a aquellos que estaban en moderada o alta actividad de la enfermedad. Es decir, que incluso en aquellos pacientes que alcanzan el objetivo terapéutico37, la presencia de depresión moderada y/o severa puede influir negativamente sobre la calidad de vida y la capacidad funcional.
La relación entre la depresión y la discapacidad funcional ha sido descripta por varios grupos38-41. La misma es bidireccional, ya que pacientes con valores más elevados de HAQ, presentan mayor riesgo de desarrollar síntomas depresivos, así como la limitación en las actividades puede ser consecuencia de un trastorno de la salud mental42. Además, la falta de interés y de concentración y la fatiga, que caracterizan a esta enfermedad, afectan el desempeño diario de estos pacientes43.
En la cohorte de artritis temprana de Escocia, los pacientes con un valor de HAD-depresión >11 tuvieron 2,5 más probabilidad de tener discapacidad, definida por un HAQ >1 al año del diagnóstico. La depresión fue uno de los principales factores pronóstico de disfunción física, seguido por la ansiedad, la obesidad y el desempleo44.
Cabe destacar, que la depresión constituye una causa modificable del deterioro funcional. Definiendo como un cambio mínimo clínicamente significativo del valor de HAQ como una disminución de 0,22 puntos, Karpouzas y cols.45, describieron que aquellos pacientes con AR que logran una mejoría de 5 puntos en el cuestionario PHQ-9, tienen 2,7 veces más probabilidad de optimizar su capacidad funcional. De allí, la importancia de la necesidad de la detección temprana de los síntomas depresivos con el fin de lograr un adecuado control de los mismos.
La influencia del componente psicológico sobre los índices compuestos utilizados para valorar la actividad de la AR es un concepto ampliamente discutido. Si bien los datos actuales acerca del efecto que tiene la depresión sobre el resultado total del DAS28 son controvertidos46,47, el impacto sobre sus componentes subjetivos es más claro47-49. Cordingley y cols.47 valoraron la percepción de la enfermedad en pacientes con AR antes de iniciar tratamiento con inhibidores de TNFα a través del cuestionario Brief Illness Perception Questionnaire50, y si bien la ansiedad y la depresión no correlacionaron con el grado de actividad de la enfermedad medida con el DAS-28, tanto la percepción acerca de las consecuencias y la identidad de la enfermedad, como la evaluación global de la actividad de la enfermedad por el paciente fueron estadísticamente mayores en el grupo de pacientes que presentaban compromiso de la salud mental según el cuestionario HAD.
Otro aspecto a considerar es el recuento de articulaciones dolorosas. Según un estudio realizado en Londres46, cada unidad que aumenta el valor del cuestionario HAD-depresión contribuye en el incremento de 0,59 en el valor del recuento articular. En nuestra experiencia, el recuento de articulaciones dolorosas se asoció significativamente a depresión aunque esta asociación no se mantuvo luego de ajustar por otras variables. De esta manera, se entiende que el dolor articular está primariamente asociado a inflamación articular.
Este estudio presenta algunas limitaciones. Primero, no se evaluó la presencia concomitante de fatiga y ansiedad, a pesar de que ambos síntomas están estrechamente relacionados con la depresión. Segundo, los pacientes que padecían fibromialgia no fueron consignados. Sin embargo, se revisaron las historias clínicas de los pacientes pertenecientes al Instituto de Rehabilitación Psicofísica (n=101). Seis pacientes tenían diagnóstico de fibromialgia, todos padecían de depresión y solo 3 de ellos recibían tratamiento específico. Y finalmente, no tenemos registro del uso de medicación psiquiátrica, como benzodiacepinas, antidepresivos, hipnóticos, etc.
Conclusión
La prevalencia de depresión mayor medida por PHQ-9 en esta cohorte argentina de pacientes con AR fue de 33,8%. La presencia de depresión tuvo un impacto negativo sobre la capacidad funcional y la calidad de vida de estos pacientes, independientemente de la actividad de la enfermedad.
1. van ‘t Land H, Verdurmen J, Ten Have M, van Dorsselaer S, Beekman A, de Graaf R. The association between arthritis and psychiatric disorders; results from a longitudinal population-based study. J Psychosom Res 2010;68(2):187-93.
2. Sturgeon JA, Finan PH, Zautra AJ. Affective disturbance in rheumatoid arthritis: psychological and disease-related pathways. Nat Rev Rheumatol 2016;12(9):532-42. [ Links ]
3. Marrie RA, Hitchon CA, Walld R, Patten SB, Bolton JM, Sareen J, et al. Increased Burden of Psychiatric Disorders in Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2018;70(7):970-8. [ Links ]
4. Matcham F, Rayner L, Steer S, Hotopf M. The prevalence of depression in rheumatoid arthritis: a systematic review and meta-analysis. Rheumatology (Oxford) 2013;52(12):2136-48. [ Links ]
5. Alesci S, Martinez PE, Kelkar S, Ilias I, Ronsaville DS, Listwak SJ, et al. Major depression is associated with significant diurnal elevations in plasma interleukin-6 levels, a shift of its circadian rhythm, and loss of physiological complexity in its secretion: clinical implications. J Clin Endocrinol Metab 2005;90(5):2522-30. [ Links ]
6. Hestad KA, Tønseth S, Støen CD, Ueland T, Aukrust P. Raised plasma levels of tumor necrosis factor alpha in patients with depression: normalization during electroconvulsive therapy. JECT 2003;19(4):183. [ Links ]
7. Beurel E, Lowell JA. Th17 cells in depression. Brain Behav Immun. 2018;69(5):28-34. [ Links ]
8. Felger JC, Lotrich FE. Inflammatory cytokines in depression: neurobiological mechanisms and therapeutic implications. Neuroscience 2013;246(29):199-29. [ Links ]
9. Guelfucci F, Kaneko Y, Mahlich J, Sruamsiri R. Cost of Depression in Japanese Patients with Rheumatoid Arthritis: Evidence from Administrative Data. Rheumatol Ther 2018;5(1):171-83. [ Links ]
10. Ang DC, Choi H, Kroenke K, Wolfe F. Comorbid depression is an independent risk factor for mortality in patients with rheumatoid arthritis. J Rheumatol 2005;32(6):1013-9. [ Links ]
11. Boer AC, Huizinga TWJ, van der Helm-van Mil AHM. Depression and anxiety associate with less remission after 1 year in rheumatoid arthritis. Ann Rheum Dis 2019;78(1):e1. doi: 10.1136/annrheumdis-2017-212867. [ Links ]
12. Michelsen B, Kristianslund EK, Sexton J, Hammer HB, Fagerli KM, Lie E, et al. Do depression and anxiety reduce the likelihood of remission in rheumatoid arthritis and psoriatic arthritis?. Data from the prospective multicentre NOR-DMARD study. Ann Rheum Dis 2017;76(11):1906-10. [ Links ]
13. Strand V, Miller P, Williams SA, Saunders K, Grant S, Kremer J. Discontinuation of Biologic Therapy in Rheumatoid Arthritis: Analysis from the Corrona RA Registry. Rheumatol Ther 2017;4(2):489-502. [ Links ]
14. Hamilton M. Development of a rating scale for primary depressive illness. Br J Soc Clin Psychol 1967;6(4):278-96. [ Links ]
15. Beck AT, Ward CH, Mendelson M, Mock J, Erbaugh J. An inventory for measuring depression. Arch Gen Psychiatry 1961;4(6):561-71. [ Links ]
16. Radloff LS. The CES-D scale: A self report depression scale for research in the general population. Applied Psychological Measurements 1977;3(1):385-401. [ Links ]
17. Kroenke K, Spitzer R, Williams J. The PHQ-9: validity of a brief depression severity measure. J Gen Intern Med 2001;16(9):606-13. [ Links ]
18. Siu AL, and the US Preventive Services Task Force (USPSTF). Screening for Depression in Adults: US Preventive Services Task Force Recommendation Statement. JAMA 2016;315(4):380-7.
19. Wittkampf KA, Naeije L, Schene AH, Huyser J, van Weert HC. Diagnostic accuracy of the mood module of the Patient Health Questionnaire: a systematic review. Gen Hosp Psychiatry 2007;29(5):388-95. [ Links ]
20. Gilbody S, Richards D, Brealey S, Hewitt C. Screening for depression in medical settings with the Patient Health Questionnaire (PHQ): a diagnostic meta-analysis. J Gen Intern Med 2007;22(11):1596-602. [ Links ]
21. Funovits J, Aletaha D, Bykerk V, Combe B, Dougados M, Emery P, et al. The 2010 American College of Rheumatology/ European League Against Rheumatism classification criteria for rheumatoid arthritis: methodological report phase I. Ann Rheum Dis 2010;69(9):1589-95. [ Links ]
22. EuroQol Group. EuroQol--a new facility for the measurement of health-related quality of life. Health Policy 1990;16(3):199-208.
23. Isnardi CA, Capelusnik D, Schneeberger EE, Bazzarelli M, Barloco L, Blanco E, et al. Validación del índice QOL-RA (Quality of Life-Rheumatoid Arthritis) en una cohorte Argentina de pacientes con Artritis Reumatoidea. Rev Argent Reumatol 2018;29(1):19-25. [ Links ]
24. Citera G, Arriola M, Maldonado-Cocco J, Rosemffet M, Sánchez M, Goñi M, et al. Validation and crosscultural adaptation of an Argentine spanish version of the health assessment questionnaire disability index. J Clin Rheumatol 2004;10(3):110-5. [ Links ]
25. Prevoo M, van‘ t Hof M, Kuper H, van Leeuven M, van de Putte L, van Riel P. Modified disease activity scores that include twenty-eight-joint counts. Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis. Arthritis Rheum 1995;38(1):44-8.
26. Aletaha D, Nell V, Stamm T, Uffmann M, Pflugbeil S, Machold K, et al. Acute phase reactants add little to composite disease activity indices for rheumatoid arthritis: validation of a clinical activity score. Arthritis Res Ther 2005;7(4):R796-806. [ Links ]
27. Smolen J, Breedveld F, Schiff M, Kalden J, Emery P, Eberl G, et al. A simplified disease activity index for rheumatoid arthritis for use in clinical practice. Rheumatology 2003;42(2):244-57. [ Links ]
28. Curet A, Rillo O, Chaparro del Moral R, Papasidero S, Citera G, Maldonado Cocco JJ, et al. Modificación y aplicación de un índice de actividad simplificado (IAS) en pacientes con artritis reumatoidea. Rev Argent Reumatol 2005;16(1):13. [ Links ]
29. Ambriz Murillo Y, Menor Almagro R, Campos-González ID, Cardiel MH. Health related quality of life in rheumatoid arthritis, osteoarthritis, diabetes mellitus, end stage renal disease and geriatric subjects. Experience from a General Hospital in Mexico. Reumatol Clin 2015;11(2):68-72. [ Links ]
30. Mella LFB, Bértolo MB, Dalgalarrondo P. Depressive symptoms in rheumatoid arthritis. Brazilian Journal of Psychiatry 2010;32(3):257-63. [ Links ]
31. Maldonado G, Ríos C, Paredes C, Ferro C, Intriago MJ, Aguirre C, et al. Depresión en artritis reumatoide. Rev Colom Reumatol 2017;24(2):84-91. [ Links ]
32. Jacob L, Rockel T, Kostev K. Depression Risk in Patients with Rheumatoid Arthritis in the United Kingdom. Rheumatol Ther 2017;4(1):195-200. [ Links ]
33. Marrie RA, Hitchon CA, Walld R, Patten SB, Bolton JM, Sareen J, et al. Increased Burden of Psychiatric Disorders in Rheumatoid Arthritis. Arthritis Care Res 2018;70(7):970-8. [ Links ]
34. Escalante A, del Rincón I, Mulrow CD. Symptoms of depression and psychological distress among Hispanics with rheumatoid arthritis. Arthritis Care Res 2000;13(3):156-67. [ Links ]
35. Margaretten M, Julian L, Katz P, Yelin E. Depression in patients with rheumatoid arthritis: description, causes and mechanisms. Int J Clin Rheumatol 2011;6(6):617-23. [ Links ]
36. Margaretten M, Barton J, Julian L, et al. Socioeconomic determinants of disability and depression in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2011;63(2):240-6. [ Links ]
37. Smolen JS, Breedveld FC, Burmester GR, Bykerk V, Dougados M, Emery P, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016;75(1):3-15. [ Links ]
38. Katz PP, Barton J, Trupin L, Schmajuk G, Yazdany J, Ruiz PJ, et al. Poverty, Depression, or Lost in Translation?. Ethnic and Language Variation in Patient-Reported outcomes in Rheumatoid Arthritis. Arthritis Care Res 2016;68(5):621-8. [ Links ]
39. Margaretten M, Barton J, Julian L, Katz P, Trupin L, Tonner C, et al. Socioeconomic determinants of disability and depression in patients with rheumatoid arthritis. Arthritis Care Res 2011;63(2):240-6. [ Links ]
40. Žagar I, Delimar V, Pap M, Perić D, Laktašić Žerjavić N, Perić P. Prevalence and Correlation of Depressive Symptoms with Functional Scores, Therapy and Disease Activity among Croatian Patients with Rheumatoid Arthritis: A Preliminary Study. Psychiatr Danub 2018;30(4):452-8.
41. Soósová MS, Macejová Ž, Zamboriová M, Dimunová L. Anxiety and depression in Slovak patients with rheumatoid arthritis. J Ment Health 2017;26(1):21-7. [ Links ]
42. Baerwald C, Manger B, Hueber A. Depression as comorbidity of rheumatoid arthritis. Z Rheumatol 2018 doi: 10.1007/s00393-018-0568-5. [ Links ]
43. http://www.euro.who.int/en/health-topics/ noncommunicable-diseases/pages/news/news/2012/10/ depression-in-europe/depression-definition. [ Links ]
44. Kronisch C, McLernon DJ, Dale J, Paterson C, Ralston SH, Reid DM, et al. Brief Report: Predicting Functional Disability: one-Year Results From the Scottish Early Rheumatoid Arthritis Inception Cohort. Arthritis Rheumatol 2016;68(7):1596-602. [ Links ]
45. Karpouzas GA, Draper T, Moran R, Hernandez E, Nicassio P, Weisman MH, et al. Trends in Functional Disability and Determinants of Clinically Meaningful Change over Time in Hispanic Patients With Rheumatoid Arthritis in the US. Arthritis Care Res 2017;69(2):294-8. [ Links ]
46. Matcham F, Ali S, Irving K, Hotopf M, Chalder T. Are depression and anxiety associated with disease activity in rheumatoid arthritis?. A prospective study. BMC Musculoskelet Disord 2016;11(3);17:155. [ Links ]
47. Cordingley L, Prajapati R, Plant D, Maskell D, Morgan C, Ali FR, et al. Impact of psychological factors on subjective disease activity assessments in patients with severe rheumatoid arthritis. Arthritis Care Res 2014;66(6):861-8. [ Links ]
48. Ton E, Bakker MF, Verstappen SM, Ter Borg EJ, van Albada-Kuipers IA, Schenk Y, et al. Look beyond the disease activity score of 28 joints (DAS28): tender points influence the DAS28 in patients with rheumatoid arthritis. J Rheumatol 2012;39(1):22-7. [ Links ]
49. Nikiphorou E, Radner H, Chatzidionysiou K, Desthieux C, Zabalan C, van Eijk-Hustings, et al. Patient global assessment in measuring disease activity in rheumatoid arthritis: a review of the literature. Arthritis Res Ther 2016;18(1):251. [ Links ]
50. Broadbent E, Petrie KJ, Main J, Weinman J. The brief illness perception questionnaire. J Psychosom Res 2006;60(6):631-7. [ Links ]














