Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.30 no.2 Buenos Aires jun. 2019
ARTÍCULO ORIGINAL
Tolerancia, sobrevida y adherencia al tratamiento con Metotrexato en pacientes con artritis reumatoidea
Tolerance, survival and adherence to Methotrexate treatment in patients with rheumatoid arthritis
J.M. Sevillano Gutierrez1, D. Capelusnik1, E.E. Schneeberger1, G. Citera1
1Instituto de Rehabilitación Psicofísica (IREP), Ciudad Autónoma de Buenos Aires.
Correspondencia: E-mail: juan.sevillano88@gmail.com
Resumen
Introducción: Metotrexato (MTX) es la medicación más utilizada en pacientes con Artritis Reumatoidea (AR). Sin embargo, varios autores han cuestionado su éxito debido a la frecuente presencia de eventos adversos y la consiguiente falta de adherencia al tratamiento.
Objetivos: Determinar la sobrevida al tratamiento con MTX, eventos adversos y causas de discontinuación en pacientes con AR.
Material y métodos: Se incluyeron pacientes ≥18 años de edad con diagnóstico de AR (criterios ACR/EULAR 2010), en forma consecutiva, que hubiesen iniciado en algún momento tratamiento con MTX. Se consignaron datos sociodemográficos, clínicos y terapéuticos. Se determinó fecha de inicio y suspensión de MTX, forma de administración, tratamientos concomitantes, consumo de café y tabaco, como también presencia de eventos adversos (EA). La adherencia se evaluó utilizando el cuestionario Compliance Questionnaire Rheumatology de 5 ítems (CQR5). Análisis estadístico: Estadística descriptiva. Test Chi2 o test exacto de Fisher. Sobrevida del tratamiento por Kaplan-Meier y log Rank. Regresión logística múltiple. Una p <0,05 se consideró significativa.
Resultados: Se incluyeron 118 pacientes, 101 mujeres (85,6%), con una edad mediana (m) de 56 años (RIC 49-64) y tiempo m de evolución de 10 años (RIC 6-18). Ochenta y cinco pacientes (72%) recibieron MTX por vía oral. 43,2% presentaron EA asociados al MTX, donde solo 20 pacientes (16,9%) tuvieron que discontinuar. La intolerancia digestiva fue el EA más frecuente (27,1%), seguida por alteraciones del laboratorio (12,7%). 86,6% de los pacientes presentaron una adherencia ≥80%. La supervivencia mediana acumulada del tratamiento con MTX fue de 348 meses (IC 95%: 235-460,9). En los análisis uni y multivariados no se encontró asociación de la sobreviva del MTX con variables sociodemográficas, características de la enfermedad, tratamiento concomitante, vía de administración, consumo de café y nivel de adherencia.
Conclusión: En nuestra cohorte, la adherencia y sobrevida del tratamiento con MTX fueron buenas. La sobrevida acumulada fue de casi 30 años. La presencia de EA no determinó la suspensión del tratamiento en la mayoría de los casos.
Palabras clave: artritis reumatoidea; Metotrexato; tolerancia; adherencia; sobrevida.
Abstract
Background: Methotrexate (MTX) is the most frequently used medication in patients with Rheumatoid Arthritis (RA). However, several authors have questioned its success due to the presence of adverse events and the lack of adherence.
Objectives: To determine cumulative survival of MTX, frequency and type of adverse events and causes of discontinuation in patients with RA.
Methods: Consecutive patients 18 years and older with a diagnosis of RA (ACR/EULAR 2010 criteria), who had begun treatment with MTX during their disease were included. Sociodemographic, clinical and therapeutic data were collected. Date of initiation and suspension of MTX, route of administration, concomitant treatments, consumption of coffee and tobacco, presence of adverse events (AE) were all consigned. Adherence was evaluated using the Compliance Questionnaire Rheumatology questionnaire 5-item summary version (CQR5). Statistical analysis: Descriptive statistics. Chi2 test or Fisher’s exact test; Survival of treatment by Kaplan-Meier and log Rank. Multiple logistic regression. A p value <0.05 was considered significant.
Results: We included 118 patients, 101 were women (85.6%), with a median age (m) of 56 years (IQR 49-64) and disease duration m 10 years (IQR 6-18). Thirty-five patients (29.7%) were smokers and 56 patients (47.5%) consumed coffee. Eighty-five patients (72%) received MTX orally. 43.2% presented AE associated with MTX, but only 20 patients (16.9%) had to discontinue MTX. Gastrointestinal intolerance was the most frequent AE (27.1%), followed by laboratory test abnormalities (12.7%). 86.6% of the patients presented an adherence ≥80%. The median cumulative survival of MTX treatment was 348 months (95% CI: 235-460.9). In the univariate and multivariate analysis, there was no association of survival of MTX with sociodemographic variables, disease characteristics, concomitant treatment, route of administration, coffee consumption nor level of adherence.
Conclusions: In our cohort, adherence and survival of MTX treatment were good. The cumulative survival was almost 30 years. The presence of AE did not determine the suspension of treatment in most cases.
Key words: rheumatoid arthritis; Methotrexate; tolerance; adherence; survival.
Introducción
La Artritis Reumatoidea (AR) es una enfermedad reumática crónica de etiología desconocida caracterizada por inflamación poliarticular y simétrica de pequeñas y grandes articulaciones, con posible compromiso sistémico1. El tratamiento con Metotrexato (MTX) se considera como parte del tratamiento de primera línea para pacientes con AR2. Este fármaco pertenece al grupo drogas modificadoras de la enfermedad convencionales (DMARc) y su uso es extenso dado su favorable perfil de eficacia y seguridad. A pesar de esto, existe evidencia contradictoria en cuanto a su tolerancia y adherencia por parte del paciente.
En la literatura se ha descripto un rango de sobrevida del tratamiento a 5 años que va de 25% a 79%3. Se observa menor sobrevida en estudios más antiguos con respecto a los más recientes, lo cual puede estar en relación con los cambios en la forma de prescripción del MTX en las últimas décadas, con tendencia a dosis mayores y al inicio más precoz del mismo, en enfermedad más temprana4–6. En cuanto a los motivos de suspensión, en un estudio reciente de una gran cohorte del Reino Unido, en aproximadamente un 77,5% de los pacientes, la suspensión del MTX se debió a eventos adversos, siendo la principal causa síntomas gastrointestinales (32,5%)7. Otros EA frecuentes asociados al MTX son: elevación de transaminasas hepáticas, toxicidad pulmonar (fibrosis, neumonitis) y toxicidad hematológica (anemia megaloblástica, trombocitopenia)8.
La adherencia del MTX es altamente variable en todos los estudios realizados, debido a diferencias en las características de las poblaciones, su seguimiento, definición de adherencia y método usado para medirla, como por ejemplo: sistema de monitoreo electrónico, autocuestionario o registro de droguería3. En un estudio, que utilizó el sistema de monitoreo electrónico se observó una adherencia completa de 58% y parcial de al menos 80%9, mientras que en otro usando un registro de droguería la adherencia era de 64%10.
Las metilxantinas (p. ej., café) actúan como antagonistas del receptor de adenosina por lo que podrían mejorar los síntomas de intolerancia del MTX. Un estudio reciente ha valorado el efecto de agregar café a la dieta de pacientes con intolerancia gastrointestinal del metotrexato observando una mejoría completa de los síntomas en hasta un 55%11.
Hasta el momento, existen escasos estudios sobre tolerancia y sobrevida del tratamiento con MTX en nuestra población. Por este motivo, los objetivos de este estudio fueron determinar la proporción de pacientes que suspenden el tratamiento con MTX, las causas de suspensión y la sobrevida del tratamiento. Como objetivos secundarios nos propusimos comparar la tolerabilidad entre la vía oral y parenteral, y estimar el nivel de adherencia al tratamiento con MTX.
Material y métodos
Estudio retrospectivo, donde se incluyeron pacientes consecutivos ≥18 años con diagnóstico de AR según criterios ACR-EULAR 201012, que concurrían a la consulta ambulatoria del Instituto de Rehabilitación Psicofísica (IREP) y que hubieran recibido tratamiento con MTX, entre los años 2002 y 2018. Los datos fueron recabados por revisión de la historia clínica y entrevista presencial del paciente. Se consignaron datos sociodemográficos (edad, sexo, estado civil, escolaridad, ocupación), clínicos (comorbilidades, tabaquismo actual o pasado, tiempo de evolución de la AR) y terapéuticos (fecha de inicio y de suspensión del tratamiento con MTX, dosis previa a la suspensión y vía de administración, tratamiento concomitante). También, se interrogó sobre consumo de café y tabaco por probable efecto sobre la tolerancia del MTX13. Fue consignado el número promedio de tazas de café tomadas por día. Tabaquismo fue definido como actual o pasado, detallando el cálculo de paquetes/año.
Se clasificaron las causas de suspensión de MTX en: evento adverso (EA), falta de provisión, o decisión propia del paciente. Se consignaron también los pacientes que, a pesar de presentar un EA, continuaron con el tratamiento. Los EA fueron clasificados en:
- Gastrointestinales: náuseas, diarrea, vómitos, dolor abdominal, dispepsia y úlceras orales.
- Respiratorios: disnea, neumonía, tos y neumonitis intersticial.
- Alteraciones en el laboratorio: aumento de transaminasas, neutropenia y trombocitopenia.
- Otros EA: mareos, rash cutáneo, cefalea, nodulosis y alopecia.
- Malestar inespecífico.
La adherencia al tratamiento fue evaluada a través del Compliance Questionnaire Rheumatology-5 (CQR5)14, que es una versión abreviada de solo 5 ítems del CQR completo (19 ítems)15. Este último consiste en 19 preguntas que se responden con una escala de Likert del 1 al 4 (desde 1= nada de acuerdo hasta 4= absolutamente de acuerdo). Seis preguntas (#4, #8, #9, #11, #12 y #19) presentan relación inversa. Posteriormente, se suman los resultados de las 19 preguntas, se resta por 19 y se divide por 0,57 para llevarlo a una escala de 0-100, siendo 0= no adherente y 100= adherencia perfecta.
El CQR5 toma solamente 5 preguntas del CQR completo (la pregunta #2, #3, #5, #6 y #17). Se responde de igual forma con la misma escala de Likert categorizada del 1 al 4. Posteriormente, se aplican dos fórmulas (una de baja adherencia y otra de alta adherencia) y se comparan los resultados. Si el resultado de la fórmula de alta adherencia es mayor que la de baja adherencia, el paciente es clasificado como de alta adherencia (≥80% toma correcta de medicación), y viceversa si la fórmula de baja adherencia es mayor que la otra. Las 5 preguntas del CQR5 se tomaron de una versión validada al español del CQR original de 19 ítems16.
Análisis estadístico
Se utilizó estadística descriptiva. Las variables categóricas fueron expresadas en frecuencia y porcentaje y las continuas en medianas y rango intercuartilo o medias y desvío estándar.
Las variables categóricas se compararon por test Chi2 o exacto de Fisher y las variables continuas por test T de Student o test de Mann Whitney y ANOVA, según correspondiera. Se realizó regresión logística múltiple para identificar las variables independientemente asociadas a la suspensión del tratamiento con MTX, incluyendo aquellas variables que en el análisis univariado presentaran un valor de p menor a 0,1. La sobrevida del tratamiento se evaluó por Kaplan-Meier y las comparaciones por log Rank. Las variables asociadas a mayor o menor supervivencia del tratamiento se evaluaron por regresión proporcional de Cox. Se consideró significativa una p <0,05. Se utilizó paquete estadístico SPSS versión 21.
Resultados
Se incluyeron 118 pacientes, 101 mujeres (85,6%), con una edad mediana (m) de 56 años (RIC 49-64) al momento de la evaluación y un tiempo m de evolución de 10 años (RIC 6-18) desde el diagnóstico de la AR. Ochenta y cinco pacientes (72%) recibieron MTX por vía oral (VO), y la dosis m del mismo fue de 15 mg/semana (RIC 15-23,75). El tiempo m de seguimiento del tratamiento con MTX fue de 94,5 meses (RIC 44-164). 68 pacientes (67%) recibieron MTX en monoterapia y 116 pacientes (98%) recibieron concomitantemente ácido fólico. Otras características de la población se detallan en la Tabla 1.
Tabla 1. Características sociodemográficas y clínicas de 118 pacientes con artritis reumatoidea.

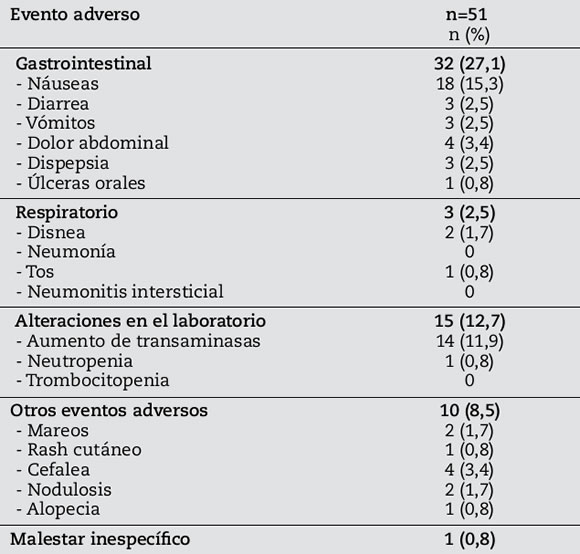
Se observaron EA asociados al MTX en 51 pacientes (43,2%), lo que llevó a la suspensión del mismo en 23 de ellos (45,1%). De los EA asociados al MTX, la intolerancia digestiva (náuseas y dolor abdominal) fue el más frecuente (27,1%), seguido por alteraciones del laboratorio (12,7%), y entre ellas, el más frecuente fue la elevación de las transaminasas hepáticas (Tabla 2).
Tabla 2. Frecuencia de eventos adversos asociados al uso de Metotrexato.
El nivel de adherencia al tratamiento (CQR5 ≥80%) fue de 86,6%. No hubo asociación significativa entre la forma de aplicación, tanto vía oral o parenteral, con la suspensión del MTX.
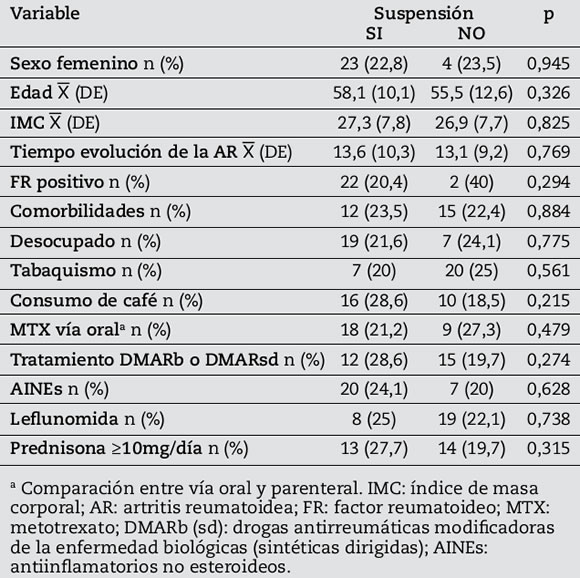
La comparación de las variables sociodemográficas y clínicas entre aquellos pacientes que suspendieron el MTX y los que no lo suspendieron, no mostró asociaciones significativas (Tabla 3). Como puede observarse en la tabla, ninguna de las comparaciones cumplió la premisa establecida para ser incluida en el análisis multivariado, razón por la cual el mismo no se realizó, para evitar un error de tipo 1.
Tabla 3. Asociación entre suspensión del Metotrexato y variables categóricas-continuas.
La mediana de supervivencia acumulada del tratamiento con MTX fue de 348 meses (IC 95% 235-460,9). Gráfico 1. Ninguna de las variables estudiadas se asoció a mayor o menor sobrevida al MTX.

Gráfico 1. Supervivencia acumulada del tratamiento con Metotrexato en 118 pacientes con AR.
Discusión
Metotrexato es utilizado como tratamiento de primera línea en la AR por su eficacia y tolerabilidad. Sin embargo, un importante número de pacientes sufren de efectos adversos relacionados con su uso. En esta cohorte se observó una prevalencia de EA asociados al MTX de un 43,2%. Comparativamente, en dos estudios realizados en Latinoamérica (Colombia y Venezuela) se describen una frecuencia de 44%17,18. Sin embargo, en otros estudios la prevalencia fue algo menor. En el Reino Unido se detectó una frecuencia de 34% de EA asociados al metotrexato y en una revisión sistemática se observó una frecuencia del 20-30% de EA en el primer año del tratamiento7,8.
Alrededor del 20% al 70% de los pacientes tratados con MTX experimentan algún evento adverso gastrointestinal, especialmente durante los primeros dos años del tratamiento8. En Latinoamérica, la frecuencia de EA gastrointestinales es de 27,1%, similar al reportado en nuestro trabajo, siendo el síntoma más común el dolor abdominal. Si bien existe evidencia de que rotar la vía de administración de vía oral a subcutáneo reduce la frecuencia de síntomas gastrointestinales, especialmente náuseas y dispepsia19, esto no fue observado en nuestro estudio, no encontrándose diferencia alguna entre ambas vías de administración.
En este trabajo, 11,9% de los pacientes presentaron elevación de transaminasas. Este valor es menor al encontrado en la literatura, que informa incidencias de 14-35%20,21. Esto podría corresponder a que casi la totalidad de nuestra población presentó tratamiento concomitante con ácido fólico, y el mismo previene el aumento de transaminasas en hasta un 81% cuando se lo usa combinado con el MTX22.
Dentro de los pacientes que presentaron EA, más de la mitad continuaron el tratamiento con MTX a pesar de ello. Esto probablemente se debió a que la mayoría de los síntomas (principalmente gastrointestinales) presentan buena respuesta al tratamiento sintomático. De manera similar, en un estudio del Reino Unido, un 48% de los pacientes que presentan un EA asociado al MTX retomaron la medicación23.
Existe cierta evidencia que indicaría que el consumo de café puede mejorar la tolerancia al MTX, logrando suprimir los síntomas de intolerancia (principalmente gastrointestinales) hasta en un 55%11. En nuestra cohorte, 45,7% de los pacientes eran consumidores de café, con ingesta en la mayoría de los casos de 1 taza por día. Sin embargo, no encontramos diferencias con respecto a la tolerancia gastrointestinal entre los pacientes que consumían y que no consumían café. Esto podría deberse a que la dosis de cafeína usada en otros estudios es mayor y sincronizada al día de toma del MTX (p. ej., 3 tazas de café distribuidas dentro de las 24 hs posteriores a la toma del MTX)11,24.
En cuanto a la adherencia del MTX, la misma varía según el método usado y el tiempo de seguimiento, con valores descriptos entre 60-92%3. El CQR y su forma simplificada de 5 ítems (CQR-5) han sido validados y tienen una eficacia similar a otros métodos más complejos de medición como el sistema de monitoreo de medicación (chip electrónico que registra la apertura de la medicación). En nuestra cohorte se observó muy buena adherencia, llegando a 86,6%, que podría estar relacionado con la gran sobrevida de la medicación.
La supervivencia acumulada fue de 348 meses, equivalente a 29 años. La supervivencia acumulada a los 5 años fue de 85%, siendo mayor a otros estudios donde se observa una probabilidad de supervivencia acumulada a los 5 años entre 62-79%4,25. Esto podría deberse a diferencias sociodemográficas y económicas; una posible explicación sería la mayor dificultad para el acceso a terapias de mayor costo (p. ej., Terapias biológicas)26, lo cual aumenta el tiempo de uso del MTX como monoterapia o combinado con otros DMAR convencionales. Sin embargo, estos factores no fueron analizados en nuestro estudio y esto se trata de una mera especulación de los autores.
Nuestro estudio presenta algunas limitaciones. Primero, su diseño retrospectivo puede generar sesgo por olvido al reinterrogar a los pacientes sobre datos pasados. A pesar de ello, la mayoría de los datos pudieron ser rescatados a través de la revisión de las historias clínicas y la entrevista con los pacientes. Segundo, el número de pacientes analizado no es alto, aunque el tiempo de seguimiento es largo y todos los pacientes provienen de un mismo centro. Tercero, la adherencia fue evaluada a través de un cuestionario de adherencia en el momento de la entrevista, pudiendo ser más precisa pero más dificultosa de obtener a través de otros métodos (p. ej., Chip electrónico)27.
Entre los puntos a favor, este estudio presenta datos sobre las características del tratamiento de la medicación más utilizada en pacientes con AR en Argentina. Asimismo, existen escasos estudios donde se analiza la persistencia del tratamiento de MTX a pesar de presentar EA. Esta información adquiere mayor relevancia en Latinoamérica, por la escasa información sobre tolerancia, adherencia y sobrevida del MTX en pacientes con AR con características sociodemográficas semejantes.
Conclusión
La adherencia y la sobrevida del tratamiento con MTX fueron muy buenas, no encontramos asociación alguna relacionada a las mismas. La sobrevida mediana acumulada fue de 29 años. Si bien se registraron EA en casi la mitad de los pacientes, la presencia de los mismos no necesariamente determinó la suspensión del tratamiento.
1. Maldonado Cocco J, Citera G. Reumatología, Azzurras. Buenos Aires; 2013. [ Links ]
2. Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann. Rheum. Dis. 2017;76(6):960–977.
3. Curtis JR, Bykerk VP, Aassi M, Schiff M. Adherence and persistence with methotrexate in rheumatoid arthritis: A systematic review. J. Rheumatol. 2016;43(11):1997–2009.
4. Ideguchi H, Ohno S, Ishigatsubo Y. Risk factors associated with the cumulative survival of low-dose methotrexate in 273 Japanese patients with rheumatoid arthritis. J. Clin. Rheumatol. 2007;13(2):73–78.
5. Hoekstra M, Van De Laar MAFJ, Bernelot Moens HJ, Kruijsen MWM, Haagsma CJ. Longterm Observational Study of Methotrexate Use in a Dutch Cohort of 1022 Patients with Rheumatoid Arthritis. J. Rheumatol. 2003;30(11):2325–2329.
6. Scully J, Anderson J, Cannon GW. Long-term methotrexate therapy for rheumatoid arthritis. Semin. Arthritis Rheum. 1991;20(5):317–331.
7. Nikiphorou E, Negoescu A, Fitzpatrick JD, Goudie CT, Badcock A, Östor AJK, et al. Indispensable or intolerable? Methotrexate in patients with rheumatoid and psoriatic arthritis: A retrospective review of discontinuation rates from a large UK cohort. Clin. Rheumatol. 2014;33(5):609–614.
8. Wang W, Zhou H, Liu L. Side effects of methotrexate therapy for rheumatoid arthritis: A systematic review. Eur. J. Med. Chem. 2018;158(1):502–516.
9. De Cuyper E, De Gucht V, Maes S, Van Camp Y, De Clerck LS. Determinants of methotrexate adherence in rheumatoid arthritis patients. Clin. Rheumatol. 2016;35(5):1335–1339.
10. Harley CR, Frytak JR, Tandon N. Treatment compliance and dosage administration among rheumatoid arthritis patients receiving infliximab, etanercept, or methotrexate. Am. J. Manag. Care. 2003;9(6 Suppl):S136-43. [ Links ]
11. Malaviya AN. Methotrexate intolerance in the treatment of rheumatoid arthritis (RA): effect of adding caffeine to the management regimen. Clin. Rheumatol. 2017;36(2):279–285.
12. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, et al. 2010 Rheumatoid arthritis classification criteria: An American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum. 2010;62(9):2569–2581.
13. Hoekstra M, van Ede AE, Haagsma CJ, van de Laar MAFJ, Huizinga TWJ, Kruijsen MWM, et al. Factors associated with toxicity, final dose, and efficacy of methotrexate in patients with rheumatoid arthritis. Ann. Rheum. Dis. 2003;62(5):423–6.
14. Hughes LD, Done J, Young A. A 5 item version of the Compliance Questionnaire for Rheumatology (CQR5) successfully identifies low adherence to DMARDs. BMC Musculoskelet. Disord. 2013;14(1):1. [ Links ]
15. de Klerk E, van der Heijde D, Landewé R, van der Tempel H, van der Linden S. The compliance-questionnaire-rheumatology compared with electronic medication event monitoring: a validation study. J. Rheumatol. 2003;30(11):2469–75.
16. Arturi P, Schneeberger EE, Sommerfleck F, Buschiazzo E, Ledesma C, Maldonado Cocco JA, et al. Adherence to treatment in patients with ankylosing spondylitis. Clin. Rheumatol. 2013;32(7):1007–1015.
17. Londono J, Santos AM, Santos PI, Cubidez MF, Guzman C, Valle-Oñate R. Therapeutic efficacy and safety of methotrexate + leflunomide in Colombian patients with active rheumatoid arthritis refractory to conventional treatment. Rev. Bras. Reumatol. 2012;52(6):837–845.
18. Sánchez G, Castro JS, Snih SAl, Blanco LP, Esteva MH, MacGregor EG, et al. Durability of treatment with methotrexate in Venezuelan patients with rheumatoid arthritis. Rheumatol. Int. 2007;27(6):531–536.
19. Kromann CB, Lage-Hansen PR, Koefoed M, Jemec GBE. Does switching from oral to subcutaneous administration of methotrexate influence on patient reported gastro-intestinal adverse effects?. J. Dermatolog. Treat. 2015;26(2):188–190.
20. Sotoudehmanesh R, Anvari B, Akhlaghi M, Shahraeeni S, Kolahdoozan S. Methotrexate hepatotoxicity in patients with rheumatoid arthritis. Middle East J. Dig. Dis. 2010;2(2):104–9.
21. Reed G, Greenberg JD, Kremer JM, Strand V, Beukelman T, Curtis JR, et al. Elevated liver enzyme tests among patients with rheumatoid arthritis or psoriatic arthritis treated with methotrexate and/or leflunomide. Ann. Rheum. Dis. 2009;69(1):43–47.
22. Shea B, Swinden M, Tanjong Ghogomu E, Ortiz Z, Katchamart W, Rader T, et al. Folic acid and folinic acid for reducing side effects in patients receiving. Cochrane Database Syst Rev. 2013;31(6). [ Links ]
23. Kinder AJ, Hassell AB, Brand J, Brownfield A, Grove M, Shadforth MF. The treatment of inflammatory arthritis with methotrexate in clinical practice : treatment duration and incidence of adverse drug reactions. Rheumatology (Oxford) 2005;44(1):61–66.
24. Nesher G, Mates M, Zevin S. Effect of caffeine consumption on efficacy of methotrexate in rheumatoid arthritis. Arthritis Rheum. 2003;48(2):571–572.
25. Yazici Y, Sokka T, Kautiainen H, Swearingen C, Kulman I, Pincus T. Long term safety of methotrexate in routine clinical care: Discontinuation is unusual and rarely the result of laboratory abnormalities. Ann. Rheum. Dis. 2005;64(2):207–211.
26. Ugarte-Gil MF, Silvestre AMR, Pons-Estel BA. Access to an optimal treatment. Current situation. Clin. Rheumatol. 2015;34(1):59–66.
27. Waimann CA, Marengo MF, De Achaval S, Cox VL, Garcia-Gonzalez A, Reveille JD, et al. Electronic monitoring of oral therapies in ethnically diverse and economically disadvantaged patients with rheumatoid arthritis: Consequences of low adherence. Arthritis Rheum. 2013;65(6):1421–1429.














