Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.30 supl.1 Buenos Aires out. 2019
SUPLEMENTO
Guías argentinas de práctica clínica, diagnóstico, evaluación y tratamiento en pacientes con Artritis Psoriásica
Argentinian clinical practice guidelines for diagnosis, assessment and treatment in patients with Psoriatic Arthritis
Sociedad Argentina de Reumatología
Autores:
Grupo de Confección de preguntas PICO:
Acosta Felquer María L, Carlevaris Leandro, Citera Gustavo, Cosentino Vanesa L, Maldonado Ficco Hernán, Scarafia Santiago, Schneeberger Emilce E, Soriano Enrique R, Zamora Natalia
Grupo de Metodología GRADE
Zamora Natalia, Acosta Felquer María L, Carlevaris Leandro, Scarafia Santiago, Vergara Facundo
Panel de Expertos
1. Acosta Felquer María L (AFM), 2. Alvarellos Alejandro (AA), 3. Asnal Cecilia (AC), 4. Berman Alberto (BA), 5. Casado Gustavo (CG), 6. Cazenave Tomás (CT), 7. Cerda Osvaldo L (COL), 8. Citera Gustavo (CG), 9. Cosentino Vanesa L (CVL), 10. García Salinas Rodrigo (GSR), 11. Goñi Mario (GM), 12. Granel Amelia (GA), 13. Gussis Simón (GS), 14. Maldonado Cocco José (MCJ), 15. Maldonado Ficco Hernán (MFH), 16. Marín Josefina (MJ), 17. Martiré María Victoria (MV), 18. Medina Gustavo (MG), 19. Papasidero Silvia (PS), 20. Perez Alamino Rodolfo (PR), 21. Savio Verónica (SV), 22. Schneeberger Emilce E (SEE), 23. Secco Anastasia (SA), 24. Soriano Enrique R (SER), 25. Toloza Sergio (TS)
Redacción de las Recomendaciones:
Cosentino Vanesa L, Zamora Natalia, Schneeberger Emilce E
Revisores
Citera Gustavo, Soriano Enrique R
Realidad de la Artritis Psoriásica en Argentina
Enrique Roberto Soriano1, Gustavo Citera2
1Sección Reumatología, Servicio Clínica Médica, Hospital Italiano, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Epidemiología de la Artritis Psoriásica
Hay pocos datos sobre la epidemiología de la Artritis Psoriásica (APs) en Argentina. En un estudio poblacional de afiliados a un sistema de medicina prepaga en la Ciudad de Buenos Aires, Soriano y col.1 encontraron una incidencia de 6,3 casos (IC 95%: 4,2 a 8,3) por cada 100.000 personas/años. La incidencia fue mayor en varones: 10 (IC 95%: 5,9-14,1) por cada 100.000 personas/años, que en mujeres: 3,7 (IC 95%: 1,6-5,7) por cada 100.000 personas/años1. El pico de incidencia se presenta entre los 45-64 años en ambos sexos. La prevalencia fue estimada en 74 (IC 95%: 57-94) por cada 100.000 afiliados1.
La APs suele ser precedida por la psoriasis en 80 y 90% de los casos. No todos los pacientes con psoriasis (Ps) desarrollan APs. Maldonado Ficco y col., evaluando 100 pacientes consecutivos en un servicio de Dermatologia, encontraron que la prevalencia de APs en pacientes con Ps era del 17%2. Los pacientes con APs tuvieron significativamente mayor duración de la psoriasis y mayor compromiso ungueal2. En un estudio realizado en un servicio de Dermatologia de Resistencia, Chaco, encontraron una prevalencia de APs del 37%, y los factores asociados al desarrollo de la misma fueron mayor compromiso cutáneo medido por PASI, mayor compromiso ungueal, y mayor tiempo de evolución de la Ps3.
Lucero y col. observaron una prevalencia de Ps en pacientes con artritis reumatoidea tratados con agentes biológicos, considerada una reacción paradojal de 3,4% (IC 95% 1,1-7,7), y en ninguno de los pacientes tratados con drogas modificadoras de la enfermedad (DME) convencionales (c)4.
Aún en la actualidad, es tema de controversia el surgimiento de la APs en Latinoamérica. Durante mucho tiempo se consideró que había sido traída a América por los europeos, ya que no se encontraban rastros de la misma en restos arqueológicos en nativos5. Sin embargo, Toloza y col. hallaron evidencia de Ps y APs en nativos de la región andina de Perú6.
Patogenia de la Artritis Psoriásica
Los factores genéticos han sido reconocidos desde hace muchos años en la predisposición al desarrollo de Ps y APs7. Schneeberger y col., estudiando un total de 73 pacientes y 100 controles, observaron que en la población argentina, los alelos HLA-B38 y Cw6 aumentaban la susceptibilidad a padecer APs8.
Hace varios años, Berman y col. describieron la asociación de la APs con el virus de inmunodeficiencia humana (VIH)9.
Por otro lado, en los últimos años se ha dado mucha importancia al rol de la entesitis en la patogenia de la APs y de las Espondiloartritis (EsP) en general10. Acosta Felquer y col. mostraron que los pacientes con Ps y APs con compromiso ungueal tenían significativamente más frecuencia de entesitis de los tendones extensores de las articulaciones interfalángicas distales mediante la evaluación ultrasonográfica, que aquellos sin compromiso ungueal11. Esto podría explicar la mayor frecuencia de APs en pacientes con Ps y compromiso ungueal11.
Screening para el diagnóstico de Artritis Psoriásica
Numerosos cuestionarios han sido desarrollados para tamizar la presencia de APs en población general y en pacientes con Ps12. Algunos de estos cuestionarios han sido validados en Argentina, como el PASE (PsA Screening and Evaluation)13 y el GEPARD (German Psoriasis Arthritis Diagnostic)14.
Manifestaciones clínicas y diagnóstico de la Artritis Psoriásica
En 2011, Pérez Alamino y col. describieron diferencias en el compromiso axial de pacientes con Espondilitis Anquilosante (EA) y pacientes con APs15. Los pacientes con EA pura presentaron en forma significativa un compromiso más severo del esqueleto axial que los pacientes con APs, con un tiempo de evolución de la enfermedad comparable. No hubo diferencias en la capacidad funcional, actividad de la enfermedad ni en la calidad de vida entre ambas formas de espondilitis15.
En forma similar, Landi y col. estudiaron las manifestaciones clínicas, la actividad de la enfermedad, la discapacidad funcional, la movilidad espinal, y los hallazgos radiológicos en 1264 pacientes de una cohorte multicéntrica multiétnica Iberoamericana de pacientes con EsP, RESPONDIA, detectando menor predominancia de varones en los pacientes con espondilitis psoriásica en comparación con los pacientes con EA (58% vs 76%)16. También los hombres con EA tuvieron mayor discapacidad laboral permanente que los pacientes con APs (13,2% vs 6,9%)16. Hace varios años, Secundini y col. encontraron una pobre correlación entre las manifestaciones clínicas y radiológicas y la presencia de entesitis en pacientes con EsP17.
Estudiando 148 pacientes con APs provenientes de distintos centros de la Argentina, Molina y col. observaron que los pacientes con APs de clases sociales bajas tuvieron mayor severidad de enfermedad18. La tenencia de título universitario de los pacientes estuvo asociado con menor actividad de la enfermedad y mejor estado funcional y calidad de vida18. Estos hallazgos evidencian el impacto de ciertos factores socioeconómicos en la evolución de pacientes con APs.
Acosta Felquer y Fitzgerald repasaron, en una revisión, las manifestaciones periféricas de los pacientes con APs19.
A pesar que había sido previamente descripto, Waimann y col. no encontraron ningún paciente con APs con anticuerpos anticitoplasma de neutrófilo (ANCA) positivos, en contraste a la frecuencia del 19% reportado previamente20.
El uso de la ultrasonografía para el diagnóstico y seguimiento de pacientes con APs es cada vez más generalizado. Sandobal y col. mostraron que la ultrasonografía es una herramienta fácil de utilizar y sensible para medir y seguir las características morfológicas y los cambios en las uñas de pacientes con Ps y APs21.
Las comorbilidades son frecuentes en pacientes con APs. García y col. reportaron una alta prevalencia de enfermedad hepática, especialmente hígado graso, asociado con obesidad en pacientes con APs22. Dentro de las comorbilidades, la enfermedad cardiovascular es una de las principales causas de muerte prematura en estos pacientes. Kolliker Fres y col. detectaron un incremento en el espesor de la íntima-media carotídea y en los niveles séricos de sICAM-1 y proteína C reactiva en pacientes con APs de reciente comienzo sin factores de riesgo convencionales para enfermedad cardiovascular, comparados con controles, previamente al inicio del tratamiento específico23.
Remisión y variables de resultado en Artritis Psoriásica
La remisión ha sido definida como el objetivo fundamental del tratamiento de la APs, pero aún al día de hoy hay discusiones en la forma de definir la remisión24-28.
Acosta Felquer y col. mostraron que los diferentes métodos para clasificar a los pacientes en remisión, si bien tienen buena correlación entre sí, clasifican pacientes diferentes en distintos estados de actividad de la enfermedad29.
El grupo GRAPPA, junto con OMERACT, ha sugerido un núcleo mínimo de dominios que deben ser evaluados en los pacientes con APs30.
Uno de los criterios más utilizados para evaluar la actividad de la APs es la mínima actividad de la enfermedad o Minimal Disease Activity (MDA), desarrollado por Coates y col.31. Marin y col. comunicaron que pacientes que cumplían criterios de MDA, tenían mínima actividad articular, pero casi la mitad de ellos persistían con actividad en la piel32.
Ruta y col. encontraron que la ultrasonografía con power Doppler era capaz de predecir recaída en los 6 meses siguientes en aquellos pacientes que estaban en remisión definida por varios criterios33.
La medición de la calidad de vida es sumamente importante en las enfermedades reumáticas. Cazenave y col. validaron al español el PsAQoL (Psoriatic Arthritis Quality of Life), un cuestionario específico para evaluar la calidad de vida en pacientes con APs34.
Tratamiento de la Artritis Psoriásica
Numerosos han sido los aportes de autores argentinos al tratamiento de la APs, motivo por el cual sólo los referenciaremos. Estas contribuciones han sido en revisiones35-48, participación en recomendaciones49,50 y participación en ensayos clínicos51,52.
Referencias
1. Soriano ER, Javier Rosa, Edson Velozo, et al. Incidence and Prevalence of Psoriatic Arthritis (PsA) in a Health Management Organization (HMO) in Argentina. Arthritis Rheum 2006.
2. Maldonado Ficco H, Citera G, Maldonado Cocco JA. Prevalence of psoriatic arthritis in psoriasis patients according to newer classification criteria. Clin Rheumatol 2014;33(2):243-6. doi: 10.1007/s10067-013-2412-2
3. Paniagua Bam, VL; de la Fuente, SM; Escobar Solari, V; Sa, CF; Genero, S; Fiad, ME; Giménez, MF. Asociación entre diferentes factores y artritis psoriásica en pacientes del Centro Dermatológico “Dr. Manuel M. Giménez” en Resistencia, Chaco (Argentina). Rev Arg Reumatol 2015;26(1):31-35.
4. Gonzalez Lucero, W; Barbaglia, AL; Gandur, MV; Guardia, M; Bellomio, V; Berman, H; Sueldo, R; Berman, A; Lucero, E; Spindler, A. Prevalencia de psoriasis secundaria a agentes biológicos en pacientes con artritis reumatoidea. Rev Arg Reumatol 2010;21(3):10-15.
5. Toloza SM, Valle-Onate R, Espinoza LR. Psoriatic arthritis in South and Central America. Curr Rheumatol Rep 2011;13(4):360-8.
6. Toloza SM, Vega-Hinojosa O, Chandran V, et al. Psoriasis and psoriatic arthritis in Peruvian aborigines: a report from the GRAPPA 2011 annual meeting. J Rheumatol 2012;39(11):2216-9. doi: 10.3899/jrheum.120828
7. Solmaz D, Eder L, Aydin SZ. Update on the epidemiology, risk factors, and disease outcomes of psoriatic arthritis. Best Pract Res Clin Rheumatol 2018;32(2):295-311.
8. Schneeberger EE, Citera G, Rodriguez Gil G, et al. Clinical and immunogenetic characterization in psoriatic arthritis patients. Clin Rheumatol 2015;34(8):1413-8. doi: 10.1007/s10067-014-2739-3 [published Online First: 2014/07/11]
9. Espinoza LR, Berman A, Vasey FB, et al. Psoriatic arthritis and acquired immunodeficiency syndrome. Arthritis Rheum 1988;31(8):1034-40.
10. Schett G, Lories RJ, D’Agostino MA, et al. Enthesitis: from pathophysiology to treatment. Nat Rev Rheumatol 2017;13(12):731-41.
11. Acosta-Felquer ML, Ruta S, Rosa J, et al. Ultrasound entheseal abnormalities at the distal interphalangeal joints and clinical nail involvement in patients with psoriasis and psoriatic arthritis, supporting the nail-enthesitis theory. Semin Arthritis Rheum 2017.
12. Iragorri N, Hazlewood G, Manns B, et al. Psoriatic arthritis screening: a systematic review and meta-analysis. Rheumatology (Oxford) 2018.
13. Ferreyra Garrott LG, Soriano ER, Rosa JE, et al. Validation in Spanish of a screening questionnaire for the detection of psoriatic arthritis in patients with psoriasis. Rheumatology (Oxford) 2013;52(3):510-4. doi: 10.1093/rheumatology/kes306
14. Martire, MV; Scarafia, S; Cosentino, V; Tapia Moreira, MJ; Estrella, N; Troitiño, C; Marín, J; Sommerfleck, F; Maldonado Ficco, H; Catay, E; Benegas, M; Soriano, ER. Spanish validation of the GEPARD questionnaire for the detection of psoriatic arthritis in Argentinean patients with psoriasis Dermatology 2019; In press.
15. Perez Alamino R, Maldonado Cocco JA, Citera G, et al. Differential features between primary ankylosing spondylitis and spondylitis associated with psoriasis and inflammatory bowel disease. J Rheumatol 2011;38(8):1656-60.
16. Landi M, Maldonado-Ficco H, Perez-Alamino R, et al. Gender differences among patients with primary ankylosing spondylitis and spondylitis associated with psoriasis and inflammatory bowel disease in an iberoamerican spondyloarthritis cohort. Medicine (Baltimore) 2016;95(51):e5652. doi: 10.1097/ MD.0000000000005652.
17. Secundini R, Scheines EJ, Gusis SE, et al. Clinico-radiological correlation of enthesitis in seronegative spondyloarthropathies (SNSA). Clin Rheumatol 1997;16(2):129-32.
18. Molina, MB; Sueldo, R; Spindler, A; Lucero, E; Berman, H; Bellomio, V; Nitsche, A; Asnal, C; Maldonado Cocco, J; Citera, G; Paira, S; Sandoval, C; Wong. R; Gallo, R; Rillo, O; Chaparro, R; Alvarellos, A; Albiero, JA; Graf, C; Zunino, A; Casado, CG; Romeo, CB; Barreira, JC; Aroca Briones, E; Vázquez Mellado, J; Collantes, E. Influencia de factores sociodemográficos en actividad de enfermedad, estado funcional y calidad de vida de pacientes con artritis psoriásica. Rev Arg Reumatol 2007;18(2):26-31.
19. Acosta Felquer ML, FitzGerald O. Peripheral joint involvement in psoriatic arthritis patients. Clin Exp Rheumatol 2015;33(5 Suppl 93):S26-30. [published Online First: 2015/10/17]
20. Waimann, F; Fernández, LM; Perandones, CE; Correa, MA; Marengo, MF; Zarate, L; Chaparro del Moral, R; Rillo, OL; Schneerberger, EE; Maldonado Cocco, JA; Citera, G. Prevalencia de anticuerpos anticitoplasma de neutrófilos en pacientes con artritis psoriática. Rev Arg Reumatol 2009;20(2).
21. Sandobal C, Carbo E, Iribas J, et al. Ultrasound nail imaging on patients with psoriasis and psoriatic arthritis compared with rheumatoid arthritis and control subjects. J Clin Rheumatol 2014;20(1):21-4. doi: 10.1097/rhu.0000000000000054 [published Online First: 2013/12/21]
22. Santiago Garcia D, Saturansky E, Poncino D, et al. [Liver diseases in rheumatoid and psoriatic arthritis]. Acta Gastroenterologica Latinoamericana 2012;42(2):112-9. [published Online First: 2012/08/11]
23. Kolliker Frers RA, Cosentino V, Tau J, et al. Immune-Mediated Inflammation Promotes Subclinical Atherosclerosis in Recent-Onset Psoriatic Arthritis Patients without Conventional Cardiovascular Risk Factors. Front Immunol 2018;9:139.
24. Helliwell PS, Coates LC. The definition of remission in psoriatic arthritis: can this be accurate without assessment of multiple domains?. Ann Rheum Dis 2015;74(12):e66. doi: 10.1136/ annrheumdis-2015-208509
25. Soriano ER. Defining remission in psoriatic arthritis: are we getting closer?. J Rheumatol 2015;42(6):907-8.
26. Schoels MM, Aletaha D, Alasti F, et al. Disease activity in psoriatic arthritis (PsA): defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2016;75(5):811-8. doi: 10.1136/annrheumdis-2015-207507.
27. Coates LC, Conaghan PG, D’Agostino MA, et al. Remission in psoriatic arthritis-where are we now?. Rheumatology (Oxford) 2018;57(8):1321-31.
28. Helliwell PS, FitzGerald O, Fransen J, et al. The development of candidate composite disease activity and responder indices for psoriatic arthritis (GRACE project). Ann Rheum Dis 2013;72(6):986-91. doi: 10.1136/annrheumdis-2012-201341
29. Acosta Felquer ML, Ferreyra Garrott L, Marin J, et al. Remission criteria and activity indices in psoriatic arthritis. Clin Rheumatol 2014;33(9):1323-30.
30. Gladman DD, Mease PJ, Strand V, et al. Consensus on a core set of domains for psoriatic arthritis. J Rheumatol 2007;34(5):1167-70. doi: 0315162X-34-1167 [pii] [published Online First: 2007/05/05]
31. Coates LC, Fransen J, Helliwell PS. Defining minimal disease activity in psoriatic arthritis: a proposed objective target for treatment. Ann Rheum Dis 2010;69(1):48-53.
32. Marin J, Acosta Felquer ML, Ferreyra Garrot L, et al. Patients with Psoriatic Arthritis Fulfilling the Minimal Disease Activity Criteria Do Not Have Swollen and Tender Joints, but Have Active Skin. J Rheumatol 2016;43(5):907-10.
33. Ruta S, Marin J, Acosta Felquer ML, et al. Utility of Power Doppler Ultrasound-detected Synovitis for the Prediction of Short-term Flare in Psoriatic Patients with Arthritis in Clinical Remission. J Rheumatol 2017;44(7):1018-23.
34. Cazenave, TMC; Citera, G. Validación y adaptación cultural de una versión argentina del cuestionario para calidad de vida PsAQoL en pacientes con artritis psoriática. Rev Arg Reumatol 2011;22(2):42-50.
35. Soriano ER, Marin J, Acosta-Felquer ML. Psoriatic arthritis: new evidence for old concepts. Curr Opin Rheumatol 2018;30(1):87-93.
36. Acosta-Felquer ML, Rosa J, Soriano ER. An evidence-based review of certolizumab pegol in the treatment of active psoriatic arthritis: place in therapy. Open Access Rheumatol 2016;8:37-44. doi: 10.2147/OARRR.S56837
37. Soriano ER. Management of Psoriatic Arthritis: Traditional Disease-Modifying Rheumatic Agents and Targeted Small Molecules. Rheum Dis Clin North Am 2015;41(4):711-22. doi: 10.1016/j.rdc.2015.07.012
38. Soriano ER, Acosta-Felquer ML, Luong P, et al. Pharmacologic treatment of psoriatic arthritis and axial spondyloarthritis with traditional biologic and non-biologic DMARDs. Best Pract Res Clin Rheumatol 2014;28(5):793-806.
39. Acosta Felquer ML, Coates LC, Soriano ER, et al. Drug therapies for peripheral joint disease in psoriatic arthritis: a systematic review. J Rheumatol 2014;41(11):2277-85. doi: 10.3899/ jrheum.140876
40. Soriano ER. The actual role of therapy with traditional disease-modifying antirheumatic drugs in psoriatic arthritis. J Rheumatol Suppl 2012;89:67-70.
41. Soriano ER, Rosa J. Update on the treatment of peripheral arthritis in psoriatic arthritis. Curr Rheumatol Rep 2009;11(4):270-7.
42. Soriano ER, McHugh NJ. Therapies for peripheral joint disease in psoriatic arthritis. A systematic review. J Rheumatol 2006;33(7):1422-30.
43. Maldonado-Ficco H, Perez-Alamino R, Maldonado-Cocco JA. Secukinumab: a promising therapeutic option in spondyloarthritis. Clin Rheumatol 2016;35(9):2151-61.
44. Lubrano E, Soriano E, FitzGerald O. Can traditional disease-modifying anti-rheumatic drugs be withdrawn or tapered in psoriatic arthritis?. Clin Exp Rheumatol 2013;31(4 Suppl 78):S54-8.
45. McHugh NJ, Soriano ER. Conventional therapy of psoriatic arthritis: evidence-based review. Reumatismo 2007;59 Suppl 1:81-4.
46. Taylor WJ, Korendowych E, Nash P, et al. Drug use and toxicity in psoriatic disease: focus on methotrexate. J Rheumatol 2008;35(7):1454-7. doi: 0315162X-35-1454 [pii] [published Online First: 2008/07/09]
47. Helliwell P, Coates LC, FitzGerald O, et al. Disease-specific composite measures for psoriatic arthritis are highly responsive to a Janus kinase inhibitor treatment that targets multiple domains of disease. Arthritis Res Ther 2018;20(1):242.
48. Rose S, Toloza S, Bautista-Molano W, et al. Comprehensive treatment of dactylitis in psoriatic arthritis. J Rheumatol 2014;41(11):2295-300. doi: 10.3899/jrheum.140879 [published Online First: 2014/11/05]
49. Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016;68(5):1060-71.
50. Ritchlin CT, Kavanaugh A, Gladman DD, et al. Treatment recommendations for psoriatic arthritis. Ann Rheum Dis 2008. doi: ard.2008.094946 [pii]10.1136/ard.2008.094946 [published Online First: 2008/10/28]
51. Mease PJ, Gottlieb AB, Berman A, et al. The Efficacy and Safety of Clazakizumab, an Anti-Interleukin-6 Monoclonal Antibody, in a Phase IIb Study of Adults With Active Psoriatic Arthritis. Arthritis Rheumatol 2016;68(9):2163-73.
52. Scali JJ, Kaminsky A, Salomon J, et al. Open-label 24-month study evaluating infliximab therapy in patients with psoriatic spondyloarthropathy. Ann N Y Acad Sci 2005;1051:543-50.
Diagnóstico y criterios de clasificación en Artritis Psoriásica
María Laura Acosta Felquer1, Osvaldo Luis Cerda2, Enrique Roberto Soriano1
1Sección Reumatología, Servicio Clínica Médica, Hospital Italiano, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
El diagnóstico temprano en pacientes con Artritis Psoriásica (APs) es importante debido al curso crónico y progresivo de esta enfermedad, con la consecuente pérdida de la capacidad funcional y de la calidad de vida y la presencia concomitante de comorbilidades. La APs es una enfermedad heterogénea, a diferencia de otras artritis inflamatorias, puede presentar cierta dificultad en su diagnóstico.
Cuestionarios para la detección de Artritis Psoriásica en pacientes con Psoriasis
En la mayoría de los casos la psoriasis (Ps) precede el compromiso articular en un promedio de 10 años, mientras que el porcentaje de pacientes que inician con compromiso articular es de alrededor del 15%1.
La prevalencia de APs en pacientes con Ps es poco clara y varía ampliamente entre 6 y 42%2,3,4.
Haroon y col. observaron que un 29% de pacientes con Ps atendidos en clínicas dermatológicas tenían APs subdiagnosticada5, por esto, creemos que los dermatólogos están en una posición ideal para detectar pacientes con APs en los estadios iniciales de la enfermedad y derivar oportunamente al reumatólogo. En los últimos años se desarrollaron cuestionarios para la detección temprana de APs, algunos de ellos son el PASE, ToPAS, PEST, ToPAS-2 y EARP6-7 (Early Arthritis for Psoriatic patients).
En la Figura 1 se muestran ejemplos de 2 cuestionarios de detección temprana, en español.


Figura 1. Cuestionarios para la detección de Artritis Psoriásica en pacientes con Psoriasis
-PSORIATIC ARTHRITIS SCREENING AND EVALUATION (PASE)8-9. Cuestionario desarrollado para ser aplicado en consultorios de dermatología en pacientes con Ps para detectar pacientes con APs. Tiene la ventaja adicional de evaluar respuesta al tratamiento. Consta de 15 preguntas, las cuales están divididas en 2 subescalas: una de síntomas (7 preguntas) y otra de función (8 preguntas), con un puntaje del 1 al 5 en cada pregunta. El puntaje total máximo es de 75, la subescala de síntomas y de función suman 35 puntos y 40 puntos, respectivamente. En el año 2013 se validó el cuestionario en su versión en español conocido como PASE-E10.
-THE TORONTO PSORIATIC ARTHRITIS SCREENING (ToPAS)11. Este cuestionario incluye 12 preguntas que se focalizan en dolor, rigidez articular y axial, e incluye imágenes de psoriasis y lesiones ungueales. Los 3 dominios importantes son: compromiso cutáneo, articular y ungueal. Este cuestionario fue diseñado para ser utilizado en pacientes con Ps y en la población general. Un valor de corte de 8 tiene una sensibilidad de 86,8% y una especificidad de 93,1%.
-PSORIASIS EPIDEMIOLOGY SCREENING TOOL (PEST)12. Otro cuestionario desarrollado para detectar pacientes con APs en la población de pacientes con Ps; consta de 5 preguntas y un maniquí para la evaluación articular. Un puntaje mayor o igual a 3 es sugestivo de APs y el paciente debe ser derivado a un reumatólogo.
-EARLY ARTHRITIS FOR PSORIATIC PATIENTS (EARP)7. Cuestionario fácil y rápido de realizar, desarrollado para detectar APs temprana en población de psoriasis, consta de 10 preguntas relacionadas a manifestaciones articulares, cada pregunta afirmativa suma 1 punto. Puntaje EARP ≥3 debe ser derivado a un reumatólogo.
En general, el TOPAS y el PEST demostraron tener una elevada sensibilidad y el TOPAS una alta especificidad. El PASE tiene menor sensibilidad y especificidad comparado con los otros dos cuestionarios. Estos cuestionarios no fueron desarrollados para realizar diagnóstico de APs, ni reemplazar el examen clínico realizado por el reumatólogo. En la Tabla 1 se ven los distintos cuestionarios y sus respectivos valores de sensibilidad y especificidad.
Tabla 1. Comparación entre distintos cuestionarios para la detección de Artritis Psoriásica en pacientes con Psoriasis. Desempeño en Cohortes donde fueron desarrolladas y en la práctica diaria

Criterios de clasificación de Artritis Psoriásica
En el campo de las Espondiloartritis (EsP), resulta de gran importancia distinguir entre criterios de clasificación y criterios diagnósticos. Los criterios diagnósticos son un conjunto de síntomas o signos que permiten confirmar una determinada enfermedad; se aplican sobre cada paciente individualmente, dependiendo de la prevalencia de la enfermedad en la población sobre la cual se aplica, y por ello es conveniente que permitan estimar la probabilidad diagnóstica con una alta sensibilidad, para poder determinar si el paciente tiene o no la enfermedad. Los criterios de clasificación, por el contrario, se aplican en un grupo de pacientes previamente diagnosticados y se utilizan en estudios experimentales y ensayos clínicos, facilitando a los investigadores seleccionar grupos homogéneos de pacientes con un acuerdo sobre los diferentes componentes de la enfermedad y requieren de una alta especificidad14.
En cuanto a los criterios de clasificación desarrollados para APs, el primero fue desarrollado por Moll y Wright en 1973, en Leeds, basado en una artritis inflamatoria establecida (compromiso axial o periférico), asociada a la presencia de psoriasis cutánea y serología para Factor Reumatoideo negativa15. Debido a que estos criterios excluyen otras características de la enfermedad (compromiso ungueal, dactilitis, entesitis y espondilitis), en 1979, Bennett desarrolla nuevos criterios que combinan características clínicas y radiológicas de la enfermedad16, los cuales posteriormente fueron simplificados por Vasey y Espinoza en 198417. En 1991, el grupo de estudio European Spondyloarthropaty Study Group (ESSG) decide incluir a la APs dentro del grupo de las Espondiloartritis, siendo el primer criterio de clasificación que incluye la historia familiar de psoriasis18.
Estos diferentes criterios de clasificación han contribuido al desarrollo de los actuales criterios CASPAR (The Classification of Psoriatic Arthritis)19 (Tabla 2) establecidos en 2006 por el grupo GRAPPA, mediante un estudio prospectivo multicéntrico realizado en 588 pacientes, basándose en los criterios originales propuestos por Vasey Espinoza17 y en función de la necesidad de unificar criterios para clasificar y caracterizar pacientes con APs, como enfermedades múltiples o una entidad propia.
Tabla 2. Criterios CASPAR19

Actualmente, los criterios de clasificación CASPAR son los más utilizados en los ensayos clínicos para incluir pacientes con APs; presentan una especificidad de 98,7% y una sensibilidad de 91,4% para APs establecida, y han demostrado una mayor sensibilidad que los criterios Moll y Wright a la hora de ser utilizados en pacientes con APs temprana (Sensibilidad del 99,1% y una Especificidad del 94,6%) teniendo en cuenta una puntuación >2, donde la negatividad del Factor Reumatoide y la presencia de PSO fueron las características más influyentes para detectarla; por otra parte, una puntuación >3 como establecen los criterios originales, determinó una sensibilidad del 87,4% y una especificidad del 99,1%, demostrando mejor sensibilidad que los criterios Moll y Wright para detectar APs temprana. Los puntos débiles residen en la puerta de entrada de los mismos, por ejemplo, un paciente que cumpla criterios CASPAR puede tener una espondilitis subclínica o una entesitis subclínica20,21.
Como mencionamos antes, el grupo de estudio ESSG incluyó a la APs dentro del grupo de las EsP (Espondiloartritis), y en la clasificación por medio de los criterios ASAS (Assessment of Spondyloarthritis International Society), estos criterios incluyen pacientes que presenten dolor lumbar inflamatorio crónico22,23 y fueron desarrollados con el objetivo de identificar pacientes con Espondiloartritis axial (EsPax) temprana, debido a que son de utilidad en aquellos pacientes que no cumplen criterios New York por ausencia de daño radiológico (sacroileítis), y donde podríamos incluir pacientes con APs que presenten compromiso axial.
Por otra parte, los pacientes con APs que presentan síntomas periféricos sin compromiso axial, podrían clasificarse mediante criterios ASAS periféricos desarrollados para aquellas Espondiloartritis que presentan síntomas predominantemente periféricos (EsPp)20.
Pero cuando se trata de APs, existe cierta superposición entre los criterios axiales y periféricos, como por ejemplo, aquellos pacientes con APs que presentan compromiso periférico sumado a un HLAB-27 positivo y compromiso axial, pueden ser clasificados como EsPax, mientras que aquellos pacientes con síntomas axiales, presencia de imágenes de sacroileítis, sumado a la presencia de artritis periférica, también pueden ser considerados como EsPp. Esta superposición genera una pequeña confusión al momento de clasificar pacientes con APs como EsPax o EsPp. Por lo tanto, existe evidencia de que los criterios ASAS son menos precisos que los CASPAR para clasificar pacientes APs, debido a la especificidad que presenta cada criterio (52% vs 98,7% respectivamente).24 Esto explica porqué los criterios de clasificación ASAS no se estén utilizando en APs para ensayos clínicos y no sean recomendables para la clasificación de APs, aunque sí son de utilidad como diagnóstico de EsP25.
Compromiso articular en Artritis Psoriásica
Considerando el compromiso articular periférico, las manifestaciones pueden variar desde una simple monoartritis hasta una poliartritis, similar a la artritis reumatoidea (AR). Los 5 patrones clínicos clásicos de compromiso articular en APs fueron descriptos por Moll y Wright en los años 70 (Tabla 3). Es frecuente ver la superposición de estas manifestaciones clínicas en un mismo paciente.
Tabla 3. Clasificación de Moll y Wright32

En relación al tipo de compromiso articular, los datos son controvertidos; durante las últimas décadas varias publicaciones sugieren que la poliartritis es el patrón de compromiso articular que predomina con una frecuencia aproximada del 60%26,27,28.
Por otra parte, en otras cohortes predomina de inicio el patrón oligoarticular. Los trabajos sugieren que el patrón de compromiso articular cambia a lo largo de la evolución de la enfermedad por lo que pacientes con inicio de compromiso oligoarticular pueden progresar a un patrón poliarticular y simétrico29,30,31.
Artritis de interfalángicas distales (IFD): Es considerada una manifestación distintiva del compromiso articular en APs; puede ser simétrica o asimétrica y afectar una o varias articulaciones. Usualmente, se presenta como parte de la afectación poliarticular33,34. En los últimos años se vio una asociación entre el compromiso de las articulaciones interfalángicas distales y la presencia de distrofia ungueal. Estudios de resonancia magnética y de ecografia mostraron esta asociación que podría explicar esta manifestación clínica35,36.
Oligoartritis: Se caracteriza por el compromiso asimétrico de ≤4 articulaciones. Puede afectar pequeñas o grandes articulaciones de miembros inferiores. Predomina en hombres34,37.
Poliartritis: Definida como el compromiso de más de 4 pequeñas articulaciones de manos o pies y/o grandes articulaciones, distribuidos en forma simétrica o asimétrica. Muy difícil de diferenciar de la artritis reumatoidea30,34,38,39.
Artritis Mutilante: Es la forma de presentación más severa, se caracteriza por deformidad irreversible y pérdida de la función. Se puede ver acortamiento digital y osteólisis severa en las radiografías. El grupo GRAPPA definió por consenso a la Artritis Mutilante como el compromiso de al menos 1 articulación con artritis mutilante40,41.
Entesitis: Se define como la inflamación de tendones, ligamentos o cápsulas articulares a nivel de su inserción ósea. Es una manifestación clínica característica de la EsP. Los sitios más frecuentemente afectados en APs son el tendón de Aquiles, la fascia plantar y los ligamentos de la pelvis42,43,44.
Dactilitis o “dedo en salchicha”: Es la inflamación difusa de un dedo de mano o pie, que se produce por la combinación de sinovitis, entesitis y tenosinovitis, y edema de partes blandas. Puede ser aguda o crónica, de distribución asimétrica o simétrica, predominando en pies38,45,46. Se asocia a mayor daño articular47.
Compromiso Axial: La afectación axial tiende a ser “en parches” con un frecuente compromiso de la columna cervical; como característica se observa la presencia de sindesmofitos gruesos distribuidos de manera asimétrica, a lo largo de todo el esqueleto axial. El compromiso sacroilíaco puede ser bilateral asimétrico o unilateral48,49.
Referencias
1. Gladman DD, Antoni C, Mease P, Clegg DO, Nash P. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis 2005;64 Suppl 2:ii14-7.
2. Ibrahim G, Waxman R, Helliwell PS. The prevalence of psoriatic arthritis in people with psoriasis. Arthritis Rheum 2009;61(10):1373-1378.
3. Salvarani C, Lo Scocco G, Macchioni P, et al. Prevalence of psoriatic arthritis in Italian psoriatic patients. J Rheumatol 1995;22(8):1499-1503. http://www.ncbi.nlm.nih.gov/ pubmed/7473473. Accessed June 2, 2015.
4. Zachariae H. Prevalence of joint disease in patients with psoriasis: implications for therapy. Am J Clin Dermatol 2003;4(7):441-447. http://www.ncbi.nlm.nih.gov/ pubmed/12814334. Accessed June 2, 2015.
5. Haroon M, Kirby B, FitzGerald O. High prevalence of psoriatic arthritis in patients with severe psoriasis with suboptimal performance of screening questionnaires. Ann Rheum Dis 2013;72(5):736-40.
6. Maldonado Ficco, H; Perez Alamino, R; Fornaro M; Schneeberger, E; Kohan, P; Papasidero, S; Benítez, A; De La Vega; MC; Correa M; Landi, M; Citera G. Validación del cuestionario ToPAS-2. In: Abstract #108. 49° Congreso Argentino de Reumatologia. Mendoza, Argentina; 2016.
7. Tinazzi I, Adami S, Zanolin EM, Caimmi C, Confente S, Girolomoni G, Gisondi P, Biasi D, McGonagle D. The early psoriatic arthritis screening questionnaire: a simple and fast method for the identification of arthritis in patients with psoriasis. Rheumatology (Oxford). 2012 Nov;51 (11):2058-63.
8. Husni ME, Meyer KH, Cohen DS, Mody E, Qureshi AA. The PASE questionnaire: Pilot-testing a Psoriatic Arthritis Screening and Evaluation tool. J Am Acad Dermatol 2007;57(4):581-7.
9. Dominguez PL, Husni ME, Holt EW, Tyler S, Qureshi AA. Validity, reliability, and sensitivity-to-change properties of the psoriatic arthritis screening and evaluation questionnaire. Arch Dermatol Res 2009;301(8):573-9.
10. Ferreyra Garrott LG, Soriano ER, Rosa JE, et al. Validation in Spanish of a screening questionnaire for the detection of psoriatic arthritis in patients with psoriasis. Rheumatology (Oxford) 2013;52(3):510-4.
11. Gladman DD, Schentag CT, Tom BDM, et al. Development and initial validation of a screening questionnaire for psoriatic arthritis: the Toronto Psoriatic Arthritis Screen (ToPAS). Ann Rheum Dis 2009;68(4):497-501.
12. Ibrahim GH, Buch MH, Lawson C, Waxman R, Helliwell PS. Evaluation of an existing screening tool for psoriatic arthritis in people with psoriasis and the development of a new instrument: the Psoriasis Epidemiology Screening Tool (PEST) questionnaire. Clin Exp Rheumatol 27(3):469-74. http://www. ncbi.nlm.nih.gov/pubmed/19604440. Accessed November 1, 2016.
13. Tristan Boyd, and Arthur Kavanaugh. Novel Treatment Concepts in Psoriatic Arthritis. Rheum Dis Clin N Am 2015; 41(4):739-54.
14. Rudwaleit M, Khan MA, Sieper J. The challenge of diagnosis and classification in early ankylosing spondylitis: Do we need new criteria?. Arthritis Rheum 2005;52(4):1000-8.
15. Moll JM, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973;3(1):55-78. http://www.ncbi.nlm.nih.gov/ pubmed/4581554. Accessed November 1, 2016.
16. RM B. Psoriatic arthritis. In: McCarty D, ed. Psoriatic Arthritis 9th ed. Philadelphia: Lea & Febiger; 1979:645.
17. Vasey EL, Vasey F. In: AC, ed. Spondyloarthropathies. Orlando Florida: Grune & Stratton; 1984:151–85.
18. Dougados M, van der Linden S, Juhlin R, et al. The European Spondylarthropathy Study Group preliminary criteria for the classification of spondylarthropathy. Arthritis Rheum 1991;34(10):1218-27. http://www.ncbi.nlm.nih.gov/ pubmed/1930310. Accessed November 8, 2016.
19. Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54(8):2665-73.
20. Rudwaleit M, Taylor WJ. Classification criteria for psoriatic arthritis and ankylosing spondylitis/axial spondyloarthritis. Best Pract Res Clin Rheumatol 2010;24(5):589-604.
21. Coates LC, Conaghan PG, Emery P, Green MJ, Ibrahim G, MacIver H, Helliwell PS. Sensitivity and specificity of the classification of psoriatic arthritis criteria in early psoriatic arthritis. Arthritis Rheum. 2012 Oct; 64(10):3150-5.
22. Rudwaleit M, Landewé R, van der Heijde D, et al. The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann Rheum Dis 2009;68(6):770-6.
23. Rudwaleit M, van der Heijde D, Landewe R, et al. The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009;68(6):777-83.
24. van den Berg R, van Gaalen F, van der Helm-van Mil A, Huizinga T, van der Heijde D. Performance of classification criteria for peripheral spondyloarthritis and psoriatic arthritis in the Leiden early arthritis cohort. Ann Rheum Dis 2012;71(8):1366-9.
25. Taylor WJ, Robinson PC. Classification Criteria: Peripheral Spondyloarthropathy and Psoriatic Arthritis. Curr Rheumatol Rep 2013;15(4):317.
26. Jones SM, Armas JB, Cohen MG, Lovell CR, Evison G, McHugh NJ. Psoriatic arthritis: outcome of disease subsets and relationship of joint disease to nail and skin disease. Br J Rheumatol 1994;33(9):834-9. http://www.ncbi.nlm.nih.gov/ pubmed/8081668. Accessed November 1, 2016.
27. Reich K, Krüger K, Mössner R, Augustin M. Epidemiology and clinical pattern of psoriatic arthritis in Germany: a prospective interdisciplinary epidemiological study of 1511 patients with plaque-type psoriasis. Br J Dermatol 2009;160(5):1040-7.
28. Veale D, Rogers S, Fitzgerald O. Classification of clinical subsets in psoriatic arthritis. Br J Rheumatol 1994;33(2):133-8. http:// www.ncbi.nlm.nih.gov/pubmed/8162477. Accessed June 2, 2015.
29. McHugh NJ, Balachrishnan C, Jones SM. Progression of peripheral joint disease in psoriatic arthritis: a 5-yr prospective study. Rheumatology (Oxford) 2003;42(6):778-3.
30. Helliwell PS, Hetthen J, Sokoll K, et al. Joint symmetry in early and late rheumatoid and psoriatic arthritis: comparison with a mathematical model. Arthritis Rheum 2000;43(4):865-71.
31. Dönmez S, Pamuk ÖN, Akker M, Ak R: Clinical features and types of articular involvement in patients with psoriatic arthritis. Clin Rheumatol 2015; 34: 1091-6.
32. Moll JM, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973;3(1):55-78. http://www.ncbi.nlm.nih.gov/ pubmed/4581554. Accessed May 22, 2015.
33. Torre Alonso JC, Rodriguez Perez A, Arribas Castrillo JM, Ballina Garcia J, Riestra Noriega JL, Lopez Larrea C. Psoriatic arthritis (PA): a clinical, immunological and radiological study of 180 patients. Br J Rheumatol 1991;30(4):245-50. http://www.ncbi. nlm.nih.gov/pubmed/1863819. Accessed May 26, 2015.
34. Veale D, Rogers S, Fitzgerald O. Classification of clinical subsets in psoriatic arthritis. Br J Rheumatol 1994;33(2):133-8. http:// www.ncbi.nlm.nih.gov/pubmed/8162477. Accessed November 1, 2016.
35. Tan AL, Benjamin M, Toumi H, et al. The relationship between the extensor tendon enthesis and the nail in distal interphalangeal joint disease in psoriatic arthritis--a high-resolution MRI and histological study. Rheumatology (Oxford) 2007;46(2):253-6.
36. Acosta Felquer ML, Ruta S, Rosa J, Marin J, Ferreyra-Garrot L, Galimberti ML, Galimberti R, Garcia-Monaco R, Soriano ER. Ultrasound entheseal abnormalities at the distal interphalangeal joints and clinical nail involvement in patients with psoriasis and psoriatic arthritis, supporting the nail-enthesitis theory. Semin Arthritis Rheum. 2017 Dec;47(3):338-342.
37. Helliwell PS, Porter G, Taylor WJ. Polyarticular psoriatic arthritis is more like oligoarticular psoriatic arthritis, than rheumatoid arthritis. Ann Rheum Dis 2007;66(1):113-7.
38. Gladman DD. Psoriatic arthritis. Dermatol Ther 2009;22(1):40-55.
39. Krueger GG. Clinical features of psoriatic arthritis. Am J Manag Care 2002;8(6 Suppl):S160-70. http://www.ncbi.nlm.nih.gov/ pubmed/11990861. Accessed June 2, 2015.
40. FitzGerald O, Mease PJ, Helliwell PS, Chandran V. GRAPPA 2013 Annual Meeting, rheumatology updates: psoriatic arthritis (PsA) biomarker project, arthritis mutilans, PsA-peripheral spondyloarthritis epidemiology project. J Rheumatol. 2014;41(6):1244-8.
41. Jadon DR, Shaddick G, Tillett W, et al. Psoriatic Arthritis Mutilans: Characteristics and Natural Radiographic History. J Rheumatol May 2015.
42. Yasser R, Yasser E, Hanan D, Nashwa ES, Rasker JJ. Enthesitis in seronegative spondyloarthropathies with special attention to the knee joint by MRI: a step forward toward understanding disease pathogenesis. Clin Rheumatol 2011;30(3):313-22.
43. Mease PJ, Garg A, Gladman DD, Helliwell PS. Development of simple clinical criteria for the definition of inflammatory arthritis, enthesitis, dactylitis, and spondylitis: a report from the GRAPPA 2012 annual meeting. J Rheumatol 2013;40(8):1442-5.
44. Haibel H, Sieper J. Enthesitis in connection with spondyloarthritides. Orthopade 2015;44(5):395-404.
45. Gladman DD, Ziouzina O, Thavaneswaran A, Chandran V. Dactylitis in psoriatic arthritis: prevalence and response to therapy in the biologic era. J Rheumatol 2013;40(8):1357-9.
46. Payet J, Gossec L, Paternotte S, et al. Prevalence and clinical characteristics of dactylitis in spondylarthritis: a descriptive analysis of 275 patients. Clin Exp Rheumatol 30(2):191-6. http://www.ncbi.nlm.nih.gov/pubmed/22341154. Accessed February 4, 2014.
47. Brockbank JE, Stein M, Schentag CT, Gladman DD. Dactylitis in psoriatic arthritis: a marker for disease severity?. Ann Rheum Dis 2005;64(2):188-190. doi:10.1136/ard.2003.018184.
48. Khan M, Schentag C, Gladman DD. Clinical and radiological changes during psoriatic arthritis disease progression. J Rheumatol 2003;30(5):1022-6. http://www.ncbi.nlm.nih.gov/ pubmed/12734899. Accessed June 2, 2015.
49. Gladman DD, Brubacher B, Buskila D, Langevitz P, Farewell VT. Differences in the expression of spondyloarthropathy: a comparison between ankylosing spondylitis and psoriatic arthritis. Clin Invest Med 1993;16(1):1-7. http://www.ncbi.nlm. nih.gov/pubmed/8467576. Accessed November 28, 2016.
Compromiso articular periférico en Artritis Psoriásica
Hernán Maldonado Ficco1, Emilce Edith Schneeberger2
1Sección Reumatología, Servicio de Clínica Médica, Hospital San Antonio de Padua, Río Cuarto, Córdoba
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
La Artritis Psoriásica (APs) es una enfermedad inflamatoria crónica caracterizada por artritis, entesitis, dactilitis y uveítis generalmente asociada a la presencia de psoriasis (Ps) cutánea. Afecta tanto las articulaciones periféricas como el esqueleto axial comprendiendo el grupo de las espondiloartritis (EsP). La prevalencia de APs oscila del 0,02 al 0,42% en la población general1 y en pacientes con psoriasis varía del 6 al 42%2. En la Argentina, diferentes estudios han demostrado una prevalencia de APs en pacientes con Ps del 0,074% al 30%3-6. Afecta tanto a hombres como mujeres con un inicio de la enfermedad entre los 30-50 años, aunque existen formas juveniles de la APs que comienzan antes de los 16 años, y formas tardías después de los 50 años. La afectación cutánea precede en aproximadamente 10 años la afectación articular. Moll and Wright describieron 5 diferentes subtipos de APs según el compromiso sea: oligoarticular asimétrico, poliarticular simétrico, axial, afectación de articulaciones interfalángicas distales y artritis mutilante7. Estos patrones de afectación pueden estar superpuestos en un mismo paciente y variar de un patrón a otro con la evolución de la enfermedad.
Los síntomas articulares pueden ser agudos o insidiosos, mono, oligo o poliarticulares. Las articulaciones más frecuentemente afectadas son las interfalángicas proximales y distales. Además de los síntomas articulares periféricos, los pacientes pueden presentar compromiso del esqueleto axial presentado como manifestación clínica dolor lumbar y/o cervical de tipo inflamatorio de características bien definidas por un tiempo mayor a 3 meses, edad de inicio del mismo menor de 40-45 años, curso insidioso, con mejoría luego del ejercicio, y empeoramiento con el reposo8. Aquellos pacientes que presentan compromiso axial presentan más frecuentemente positividad para el gen HLA-B27. El compromiso axial sintomático es infrecuente en los pacientes con APs4,9.
Ciertos genes están asociados con susceptibilidad a padecer la enfermedad como el HLA-B27 en ausencia de DR7, HLA-39 y DQw3 en ausencia de DR7, mientras que el HLA-B22 se comporta como gen protector10. El polimorfismo de la interleuquina 4 (IL4-I50V) se asoció a enfermedad erosiva en pacientes con APs11. En un estudio realizado en la Argentina, los genes HLA-B38 y CW6 prevalecieron en forma significativa en los pacientes con APs vs controles.12
Una manifestación clínica característica pero no patognomónica de la APs es la dactilitis o “dedo en salchicha”, que consiste en la inflamación de la articulación proximal y distal acompañado de una tenosinovitis. Las dactilitis se clasifican en agudas o crónicas, siendo la presencia o ausencia del dolor, respectivamente, el principal síntoma clínico para dicha diferenciación.
Otra manifestación de los pacientes con APs es la entesitis caracterizada por la inflamación del sitio de inserción del tendón en el hueso pudiendo ocurrir en cualquier sitio de inserción tendinosa, aunque los sitios más frecuentemente comprometidos son: tendón de Aquiles, fascia plantar, rodilla, trocánter mayor, hombro y huesos de la pelvis13.
Se estima que entre el 80% y el 90% de los pacientes con Ps tienen compromiso ungueal14,15, predisponiendo esto al desarrollo futuro de APs16,17. Las lesiones pueden afectar tanto la matriz (pitting o puntillado, leuconiquia, manchas rojas en la lúnula y el levantamiento ungueal) como el lecho ungueal (onicólisis, hemorragias en astilla, manchas de aceite e hiperqueratosis).
Referencias
1. Alamanos Y, Voulgari PV, Drosos AA. Incidence and prevalence of psoriatic arthritis: a systematic review. J Rheumatol 2008;35(7):1354-8.
2. Gladman DD, Antoni C, Mease P, Clegg DO, Nash P. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis 2005;64 Suppl 2:ii14-7.
3. Soriano ER, Rosa J, Velozo E. Incidence and prevalence of psoriatic arthritis in Buenos Aires, Argentina: a 6-year health management organization-based study. Rheumatology 2011; 50(4):729-4.
4. Maldonado Ficco H, Citera G, Maldonado Cocco JA. Prevalence of psoriatic arthritis in psoriasis patients according to newer classification criteria. Clin Rheumatol 2014; 33(2):243-6.
5. Kogan N, Veira R, Chaparro E, Cottet H, Gusis S, Hassan M. Psoriasis y artropatía psoriásica: epidemiología, manifestaciones clínicas y enfermedades asociadas. Revista Latinoamericana de Psoriasis y Artritis Psoriásica 2010; 1(1):36-54.
6. Guardia M. Rev Argent Reumatol 2010 -33.Suppl.
7. Moll JM, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973; 3(1):55-78.
8. Sieper J, van der Heijde D, Landewé R, Brandt J, Burgos-Vagas R, Collantes-Estevez E. New criteria for inflammatory back pain in patients with chronic back pain: a real patient exercise by experts from the Assessment of SpondyloArthritis International Society (ASAS). Ann Rheum Dis 2009; 68(6):784-8.
9. Battistone MJ, Manaster BJ, Reda DJ, Clegg DO. Radiographic diagnosis of sacroiliitis – are sacroiliac views really better?. J Rheumatol 1998; 25(12):2395-401.
10. Gladman DD, Farewell VT, Kopciuk K, Cook RJ. HLA markers and progression in psoriatic arthritis. J Rheumatol 1998; 25(4):730-3.
11. Rahman P, Snelgrove T, Peddle L, Siannis F, Farewell V, Schentag C, et al. A variant of the IL4 I50V single-nucleotide polymorphism is associated with erosive joint disease in psoriatic arthritis. Arthritis Rheum 2008; 58(7):2207-8.
12. Schneeberger EE, Citera G, Rodríguez Gil G, Granel A, Arturi A, Rosemffet GM, et al. Clinical and immunogenetic characterization in psoriatic arthritis patients. Clin Rheumatol 2015; 34(8):1413-8.
13. Secundini R, Scheines E, Gusis S, Riopedre M, Citera G, Maldonado Cocco JA, et al. Clinico-radiological correlation of enthesitis in Seronegative Spondiloarthropathies. Clin Rheumatol 1997; 16(2):129-32.
14. Baran R. The burden of nail psoriasis: an introduction. Dermatology 2010; 221 Suppl 1:1-5.
15. de Berker D. Management of nail psoriasis. Clin Exp Dermatol 2000; 25(5):357-62.
16. Love TJ, Gudjonsson JE, Valdimarsson H, Gudbjornsson B. Small joint involvement in psoriatic arthritis is associated with onycholysis: the Reykjavik Psoriatic Arthritis Study. Scand J Rheumatol 2010; 39(4):299-302.
17. Wilson FC, Icen M, Crowson CS, McEvoy MT, Gabriel SE, Kremers HM. Incidence and clinical predictors of psoriatic arthritis in patients with psoriasis: a population-based study. Arthritis Rheum 2009; 61(2):233-9.
Comorbilidades en Artritis Psoriásica
Santiago Scarafia1, Gustavo Citera2
1Servicio Reumatología, Hospital B Rivadavia, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
La presencia de más de una comorbilidad se observa en aproximadamente el 50% de los pacientes con Artritis Psoriásica (APs). Esto tiene un impacto negativo importante en la capacidad funcional y en la calidad de vida1,2 y debe ser tenido en cuenta a la hora de definir la conducta terapéutica3.
Las comorbilidades más frecuentemente observadas en pacientes con APs incluyen: enfermedad cardiovascular, obesidad, síndrome metabólico, hígado graso, depresión, ansiedad, por lo tanto es crucial para su manejo la interacción con los especialistas adecuados a la necesidad de cada paciente1. La uveítis y la enfermedad inflamatoria intestinal serán desarrolladas en otros capítulos.
Riesgo cardiovascular
Los pacientes con APs tienen un riesgo aumentado de enfermedad cardiovascular, incluyendo IAM y ACV, comparado con la población general4. Este aumento está en parte asociado a la mayor prevalencia de factores de riesgo cardiovascular (FRCV) tradicionales y, por otro lado, a la inflamación, que al igual que en otras enfermedades crónicas tiene un rol importante1. Si bien la asociación es conocida, aún nos faltan certezas para entender su intrincado mecanismo. La inflamación acelera la ateroesclerosis y también tiene efecto sobre los FRCV tradicionales y no tradicionales5,6. El rol de los FR no tradicionales parece tener bastante peso, ya que, por ejemplo en 30-50% de pacientes con APs se encuentra ateromatosis carotídea sin evidencia de otro FRCV7.
Los pacientes con APs deben ser estudiados para FRCV tradicionales, al menos con glucemia en ayunas, perfil lipídico y control de la tensión arterial. Idealmente, el riesgo cardiovascular se debe objetivar con alguno de los estimadores existentes (SCORE, Framingham)1, a pesar que estos no tienen en cuenta los FRCV No tradicionales (fundamentalmente el rol de la inflamación).
Jamnistki A y col., en una revisión sistemática, observaron que los estudios para evaluar el impacto global del RCV son muy heterogéneos y discrepantes en cuanto a los objetivos primarios que evalúan5. En todos los estudios revisados, los pacientes con APs tienen un aumento de la morbilidad cardiovascular, incluyendo cardiopatía isquémica, disfunción del ventrículo izquierdo, insuficiencia cardíaca, accidente cerebrovascular, enfermedad vascular periférica, ateromatosis carotídea y muerte cardiovascular5,7.
Roubile C y col. publicaron en 2015 recomendaciones basadas en evidencia para el manejo de comorbilidades Artritis Reumatoidea, Psoriasis y APs. No encontraron asociación entre la actividad de la artritis y el aumento de los eventos cardiovasculares, aunque podría estar más ligada al compromiso cutáneo8.
Si bien es factible considerar que el adecuado control de la enfermedad de base provoque una reducción del proceso inflamatorio y consecuentemente una reducción en el riesgo CV, esto no ha sido demostrado aún en estudios longitudinales1,8. El aumento del RCV atribuido a AINEs y corticoides es extrapolado de la población general, y si bien el impacto parece ser menor que en AR, deben ser utilizados cuidadosamente en pacientes con APs1,8. El uso de metotrexato y agentes anti-TNFα parecen tener un efecto beneficioso en el manejo del RCV, por su capacidad de disminuir la inflamación sistémica y el uso de medicaciones concomitantes como AINEs y corticoides8. Sin embargo, esto no fue confirmado en el estudio de Odgie A y col., quienes comparan el riesgo incidente de eventos cardiovasculares mayores, IAM, ACV y muerte CV en pacientes con APs con y sin tratamiento DME (Drogas Modificadoras de la Enfermedad). En un registro de población general de Reino Unido y luego de ajustar por edad, sexo, HTA, dislipemia, diabetes y tabaquismo, no observaron diferencias significativas9.
Sobrepeso y obesidad
La mayoría de los pacientes con APs tienen sobrepeso y obesidad; diferentes reportes de distintos lugares del mundo confirman esta afirmación. Un estudio del IREP (Buenos Aires), en 110 pacientes con APs de la cohorte RAPSODIA la prevalencia de sobrepeso fue 43,6% y de obesidad de 37,3%10. En CONEART (Consorcio Argentino de Espondiloartritis Temprana) se observó una prevalencia similar, de sobrepeso 46% y menor de obesidad 30% en 92 pacientes con APs temprana, no observándose asociación alguna con la actividad de la enfermedad11. El registro CORRONA observó 36% de sobrepeso y 45% de obesidad.12
Es recomendable calcular el IMC (Índice de Masa Corporal) en todos los pacientes, ya que este es uno de los principales criterios de Síndrome Metabólico y su impacto es conocido sobre los FRCV. Se debe estimular el descenso de peso1,5-9 como una intervención fundamental para mejorar la calidad de vida y la salud cardiovascular7.
Di Minno M y col. observaron que la obesidad fue un factor de riesgo para no alcanzar MDA en pacientes con APs. Luego de 2 años de tratamiento con agentes anti-TNFα, los pacientes obesos tuvieron un HR de 4,90 (IC 95% 3,04-7,87) de no alcanzar MDA comparado con los no obesos13. Esto fue confirmado en otro estudio prospectivo de Eder L y col., quienes observaron que los pacientes con mayor IMC tenían menor probabilidad de alcanzar MDA (OR 0,52, p <0,0001)14.
El efecto de la obesidad sobre la enfermedad puede estar asociado a un aumento en la producción de adipokinas: adiponectina, leptina, PAI-1, TNFα e IL-6 por parte del tejido adiposo15.
Síndrome metabólico
El Síndrome Metabólico (SM) definido ya sea por ATPIII (2001) o bien por la International Diabetes Foundation (IDF) incluye factores de RCV tradicionales tales como sobrepeso/obesidad, resistencia a la insulina, dislipemia e HTA16. En 2014, Cerda O y col. presentaron un estudio de prevalencia de SM en 101 pacientes con APs en seguimiento en IREP, Buenos Aires. De estos, el 40,3% cumplían criterios para SM según IDF y el 53,2% según ATPIII17. Haroon M y col., en un estudio observacional que incluyó 283 pacientes con APs, reportaron una prevalencia de SM de 44% y un 16% tenía resistencia a la insulina18. Estos datos duplican lo observado en la población general de 45 a 60 años, donde se observó una prevalencia de 17,2% (por ATP III) y 20,7% (por IDF)19,20.
Otras artritis inflamatorias crónicas también se asocian con mayor prevalencia de SM. Los elevados niveles de TNFα interfieren en el metabolismo de los lípidos y la glucosa, disminuyendo la expresión de proteínas que conforman el receptor de la insulina y aumentando la producción de leptina y los niveles de triglicéridos21.
A) Diabetes
La prevalencia e incidencia de diabetes (DBT) están aumentadas en pacientes con APs. Un estudio del Reino Unido incluyó 4196 pacientes con APs, se observaron 179 nuevos casos de DBT y luego de ajustar por edad y sexo, la APs tuvo un HR de 1,72 (IC 95% 1,46-2,02) para el desarrollo de esta comorbilidad22. En un estudio observacional realizado en Israel que incluyó 549 pacientes adultos con APs y controles de la población general, hallaron un prevalencia de DBT de 15,3%, en APs vs 10,3% en controles, con un OR 1,5 (IC 95% 1,11-2,03, p=0,008)23.
La mayor prevalencia de DBT en el contexto de la APs, puede ser explicado en parte por la elevada proporción de pacientes con sobrepeso y obesidad, su estilo de vida no saludable con tendencia al sedentarismo y posiblemente por la resistencia a la insulina generada por la inflamación crónica7.
Dada esta mayor prevalencia de DBT en pacientes con APs, es recomendable: el control de la glucemia en ayunas y de considerarse necesario de Hemoglobina glicosilada (HbA1C) en estos pacientes, evitar dosis elevadas y tratamiento prolongado con esteroides y optimizar el tratamiento con DME convencionales o biológicos para un adecuado control de la enfermedad de base1,5,7,8.
B) Hipertensión Arterial
No hay muchos estudios que hayan evaluado la incidencia y prevalencia de HTA en APs. En una revisión sistemática de la literatura y metaanálisis de estudios observacionales se observó una prevalencia de HTA que varió entre 28,5% y 56%24.
Se recomienda controlar la tensión arterial en todos los pacientes. Tanto los AINEs como los esteroides pueden favorecer el desarrollo de HTA o bien empeorarla, por lo cual se recomienda un uso discrecional de los mismos1,3,8.
C) Dislipemia y Ateroesclerosis
Las alteraciones lipídicas más frecuentemente observadas en pacientes con APs son el aumento de los triglicéridos y la disminución de los niveles de HDL colesterol5. Si bien la relación entre APs y dislipemia no es del todo clara, la presencia de la misma se asocia a mayor riesgo de ateroesclerosis.6,25
La combinación de inflamación, dislipemia y estrés oxidativo predisponen a la disfunción endotelial, la cual está directamente relacionada con la formación de la placa de ateroma6,26. El aumento en la media de la íntima carotídea en APs está asociado a la duración del compromiso cutáneo y articular, FRCV tradicionales, pero no con los niveles de PCR y fibrinógeno25. Los pacientes con APs tienen mayor frecuencia de placas de ateroma y de espesor íntima-media que los controles y que los pacientes con psoriasis cutánea sin artritis27.
Al igual que en otras artritis crónicas, el riesgo CV es subestimado por los índices tradicionales. Varios estudios han observado que la US carotídea para medir espesor íntima-media y la presencia de placa, es una evaluación más sensible y específica para estimar el riesgo en pacientes con APs28,29.
Enfermedad hepática crónica
Se ha observado una mayor prevalencia de Esteatosis Hepática No Alcohólica (EHNA) en pacientes con Ps y APs7.
Di Minno M y col. observaron una prevalencia de 28,1% de esteatosis hepática y esta fue un predictor independiente de no alcanzar MDA luego de 1 año de tratamiento con inhibidores del TNFα (HR 1,91; IC 95% 1,04-3,38); esto se mantuvo luego de ajustar por la presencia de síndrome metabólico y otras variables clínicas y demográficas30.
La presencia de EHNA debe ser considerada a la hora de elegir el tratamiento en APs, ya que muchos fármacos como metotrexato, leflunomida, sulfasalazina y AINEs pueden precipitar una esteatohepatitis y evolucionar a cirrosis7. La presencia de obesidad, diabetes, hepatopatía previa y dosis acumulada de metotrexato son factores de riesgo para hepatotoxicidad por metotrexato. La adición de agentes anti-TNFα al metotrexato, disminuye el riesgo de elevación de enzimas hepáticas y fibrosis respecto a pacientes tratados sólo con metotrexato3.
Osteoporosis
La prevalencia de osteoporosis (OP) en APs no es diferente a la de la población general de acuerdo a la mayor parte de los estudios3,7. Sin embargo, Kocijan y col. evaluaron la masa ósea por tomografía cuantitativa de radio ultradistal en 50 pacientes con APs, comparándolo con pacientes con Ps y controles. Los pacientes con APs tuvieron una disminución de la masa ósea trabecular vs los controles, sin afectación del hueso cortical31. Debemos tener en cuenta, que la hiperostosis característica de los pacientes con APs cuando está presente a nivel de la cadera puede alterar los resultados de la evaluación por DEXA31.
Neoplasias
Varios estudios analizaron la asociación de APs con neoplasias. En la cohorte de Toronto se reportó una frecuencia de neoplasias de 10,2% en pacientes con APs con una edad media de 62,4 años. Las neoplasias más frecuentemente observadas fueron cáncer de mama (20,6%), de pulmón (13,2%) y de próstata (8,8%)32. En otro estudio, Wilton KM y col. no detectaron un aumento del riesgo de neoplasias en pacientes con APs en comparación a la población general (HR 1,41; IC 95% 0,96-2,07)33.
Los estudios que analizaron el riesgo de neoplasias asociado al tratamiento de la APs, no arrojaron resultados concluyentes. Sin embargo, en aquellos pacientes que han recibido radiación UV como parte del tratamiento de la psoriasis, se recomienda que realicen un examen de piel en busca de lesiones tumorales al menos 1 vez al año34,35.
Respecto al riesgo de desarrollo de linfomas y trastornos linfoproliferativos, el RI es bajo, de 3,57/10.000 personas/año (IC 95% 3,14-4,04)34.
Referencias
1. Ogdie A, Schwartzman S, Husni ME. Recognizing and managing comorbidities in psoriatic arthritis. Curr Opin Rheumatol, 2015;27(2):118-26.
2. Husted JA, Thavaneswaran A, Chandran V, Gladman DD. Incremental effects of comorbidity on quality of life in patients with psoriatic arthritis. J Rheumatol 2013;40(8):1349-56.
3. Ogdie A, Schwartzman S, Eder L, Ajesh B, Maharaj AB, Devy Zisman D, et al. Comprehensive treatment of psoriatic arthritis: managing comorbidities and extraarticular manifestations. J Rheumatol 2104; 41(11):2315-22.
4. Horreau C, Pouplard C, Brenaut E, Barnetche T, Misery L, Cribier B. Cardiovascular morbidity and mortality in psoriasis and psoriatic arthritis: a systematic literature review. J Eur Acad Dermatol Venereol 2013; 27(Suppl 3):12-29.
5. Jamnitski A, Symmons D, Peters MJ, Sattar N, McInnes I, Nurmohamed MT. Cardiovascular comorbidities in patients with psoriatic arthritis: a systematic review. Ann Rheum Dis 2013;72(2):211-6.
6. Yim KM, Armstrong AW. Updates on cardiovascular comorbidities associated with psoriatic diseases: epidemiology and mechanisms. Rheumatol Int 2016; 37(1):97-105.
7. Husni ME. Comorbidities in Psoriatic Arthritis. Rheum Dis Clin North Am 2015; 41(4):677-98.
8. Roubille C, Richer V, Starnio T, McCourt C, McFarlane A, Fleming P, et al. Evidence-based Recommendations for the Management of Comorbidities in Rheumatoid Arthritis, Psoriasis, and Psoriatic Arthritis: Expert Opinion of the Canadian Dermatology-Rheumatology Comorbidity Initiative. J Rheumatol 2015;42(10):1767-80.
9. Ogdie A, Yu YD, Haynes K, Haynes K, Love TJ, Maliha S, et al. Risk of major cardiovascular events in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a population-based cohort study. Ann Rheum Dis 2015; 74(2):326-32.
10. Zaffarana CA, Gallino Yanzi J, Cerda OL, Landi M, Schneerberger EE, Citera G. Prevalencia de obesidad en una cohorte de pacientes con Artritis Psoriásica y factores asociados. Rev Argent Reumatol 2015;26(Supl esp):66.
11. Scarafia S, Duarte V, Romanini FE, Schneeberger EE, Zamora N, Sommerfleck FA, et al. Prevalencia de Obesidad en pacientes con Artritis Psoriásica Temprana. Rev Arg Reumatol 2015;26(Supl esp):45.
12. Labitigan M, Senabach A, Bace-Altunas A, Kremer JM, Reed G, Greenberg JD, et al. Higher Rates and Clustering of Abnormal Lipids, Obesity, and Diabetes Mellitus in Psoriatic Arthritis Compared With Rheumatoid Arthritis. Arthritis Car Res 2014; 66(4):600-7.
13. Di Minno MN, Peluso R, Iervolino S, Lupoli R, Russolillo A, Scarpa R, et al. Obesity and the Prediction of Minimal Disease Activity: A Prospective Study in Psoriatic Arthritis. Arthritis Care Res 2013;65(1):141-7.
14. Eder L, Thavaneswaran A, Chandran V, Cook RJ, Gladman DD. Obesity is associated with a lower probability of achieving sustained minimal disease activity state among patients with psoriatic arthritis. Ann Rheum Dis 2015; 74(5):813-7.
15. Russolillo A, Iervolino S, Peluso R, Lupoli R, Di Minno A, Pappone N. Obesity and psoriatic arthritis: from pathogenesis to clinical outcome and management. Rheumatology (Oxford) 2013; 52(1):62-7.
16. Alberti KG, Zimmet P, Shaw J. Metabolic syndrome: a new world-wide definition. A consensus statement from the International Diabetes Federation. Diabet Med 2006;23(5):469-80.
17. Cerda LO, Gallino-Yanzi J, Landi M, Zaffarana CA, Schneeberger EE, González-Guzmán MC, et al. Prevalencia de Síndrome Metabólico en pacientes con Artritis Psoriásica y su asociación con características clínicas y terapéuticas de la enfermedad. Rev Arg Reumatol 2014; 25(Supl esp.):72.
18. Haroon M, Gallagher P, Heffernan E, FitzGerald O. High prevalence of metabolic syndrome and of insulin resistance in psoriatic arthritis is associated with the severity of underlying disease. J Rheumatol 2014; 41(7):1357-65.
19. Coniglio RI, Nellem J, Gentili R, Sibechi N, Agusti E, Torres M. Síndrome metabólico en empleados en Argentina. Medicina (Buenos Aires) 2009; 69(2):246-52.
20. Lúquez H, De-Loredo L, Madoery RJ, Lúquez H (h), Senestradi D. Síndrome metabólico: prevalencia en dos comunidades de Córdoba, Argentina, de acuerdo con definiciones ATP-III y OMS. Rev Fed Arg Card 2005; 34(1):80-95.
21. Maruotti N, D’Onofrio F, Cantatore FP. Metabolic syndrome and chronic arthritis: effects of anti-TNF-a therapy. Clin Exp Med 2015; 15(4):433-8.
22. Dubreuil M, Rho YH, Man A, Zhun Y, Zhang Y, Jon Love T. Diabetes incidence in psoriatic arthritis, psoriasis and rheumatoid arthritis: a UK population-based cohort study. Rheumatology (Oxford) 2014; 53(2):356-52.
23. Dreiher J, Freud T, Cohen AD. Psoriatic Arthritis and Diabetes: A Population-Based Cross-Sectional Study. Dermatol Res Pract 2013:580404. doi: 10.1155/2013/580404.
24. Armstrong AW, Harskamp C, Armstrong EJ. The association between psoriasis and hypertension: a systematic review and meta-analysis of observational studies. J Hypertens 2013; 31(3):433-42.
25. Eder L, Jayakar J, Shanmugarajah S, Thavaneswaran A, Pereira D, Chandran V, et al. The burden of carotid artery plaques is higher in patients with psoriatic arthritis compared with those with psoriasis alone. Ann Rheum Dis 2013; 72(5):715-20.
26. Costa L, Caso F, D’Elia L, Atteno M, Peluso R, Del Puente A, et al. Psoriatic arthritis is associated with increased arterial stiffness in the absence of known cardiovascular risk factors: a case control study. Clin Rheumatol 2012; 31(4):711-5.
27. Ramonda R, Lo-Nigro A, Modesti V, Nalotto L, Musacchio E, Iaccarino L, et al. Atherosclerosis in psoriatic arthritis. Autoimmun Rev 2013; 81(5):773-8.
28. Ramonda R, Puato M, Punzi L, Rattazzi M, Zanon M, Balbi G, et al. Atherosclerosis progression in psoriatic arthritis patients despite the treatment with tumor necrosis factor-alpha blockers: A two-year prospective observational study. Joint Bone Spine 2014;81(5):421-5.
29. Di Minno MN, Iervolino S, Peluso R, Scarpa R, Di Minno G, on behalf of the CaRRDs study group. Carotid Intima-Media Thickness in Psoriatic Arthritis Differences Between Tumor Necrosis Factor Blockers and Traditional Disease-Modifying Antirheumatic Drugs. Arterioscler Thromb Vasc Biol 2011;31(3):705-12.
30. Di Minno MN, Ievolino S, Peluso R, Russolillo A, Lupoli R, Scarpa R, et al. Hepatic steatosis and disease activity in subjects with psoriatic arthritis receiving tumor necrosis factor-alpha blockers. J Rheumatol 2012; 39(5):1042-6.
31. Kocijan R, Englbrecht M, Haschka J, Simon D, Kleyer A, Finzel S. Quantitative and Qualitative Changes of Bone in Psoriasis and Psoriatic Arthritis Patients. J Bone Miner Res 2015;30(10):1775-83.
32. Rohekar S, Tom BD, Hassa A, Schentag CT, Farewell VT, Gladman DD. Prevalence of malignancy in psoriatic arthritis. Arthritis Rheum 2008; 58(1):82-7.
33. Wilton KM, Crowson CS, Matteson EL. Malignancy incidence in patients with psoriatic arthritis: a comparison cohort-based incidence study. Clin Rheumatol 2016;35(10):2603-7.
34. Armstrong AW, Coates L, Espinoza LR, Ogdie AR, Rich P, Soriano ER. Infectious, Oncologic, and Autoimmune Comorbidities of Psoriasis and Psoriatic Arthritis: A Report from the GRAPPA 2012 Annual Meeting. J Rheumatol 2013;40(8):1438-41.
35. Dommasch ED, Abuabara K, Shin DB, Nguyen J, Troxel AB, Gelfand JM. The risk of infection and malignancy with tumor necrosis factor antagonists in adults with psoriatic disease: A systematic review and meta-analysis of randomized controlled trials. J Am Acad Dermatol 2011;64(6):1035-50.
Manifestaciones extraarticulares en Artritis Psoriásica
Leandro Carlevaris1, Gustavo Citera2
1Servicio Reumatología, Hospital B Rivadavia, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Enfermedad inflamatoria intestinal
La Artritis Psoriásica (APs), al igual que el resto de las Espondiloartritis (EsP), se puede asociar al compromiso inflamatorio del intestino. Esta Enteropatía Inflamatoria (EI) puede ser secundaria a la enfermedad de base, deberse al uso crónico de AINEs, o ser una entidad primaria del intestino superpuesta a la EsP. Representada principalmente por la Enfermedad de Crohn (EC) y la Colitis ulcerosa (CU), ambas se enmarcan dentro de la Enfermedad Inflamatoria Intestinal (EII)1.
EC y CU: Son enfermedades intestinales inflamatorias crónicas, caracterizadas por presentar una respuesta inmune inapropiada a la microbiota intestinal. La pérdida de tolerancia inmunológica secundaria al aumento de la permeabilidad epitelial sería el factor desencadenante, y varios estudios han descripto la asociación epidemiológica, patogénica y genética entre APs y EII2.
Enteropatía inflamatoria secundaria a las EsP: Puede tener dos patrones de presentación. Tipo agudo: arquitectura de la mucosa conservada, infiltración polimorfonuclear de vellosidades, lámina propia infiltrada por granulocitos, linfocitos y células plasmáticas; característica de la artritis reactiva, y tipo crónico: similar a la EC, presenta arquitectura alterada, vellosidades irregulares, lámina propia infiltrada por mononucleares, pudiendo asociarse a úlceras aftoides y granulomas tipo sarcoide1.
Enteropatía inflamatoria secundaria al uso crónico de AINEs: En más de la mitad de los pacientes que consumen crónicamente AINEs se observan erosiones o ulceraciones de la mucosa, y en menor medida estenosis o perforaciones. Suelen ser subclínicas o presentar síntomas inespecíficos, mejorando al retirar el AINEs1.
Artritis y Psoriasis secundarias a la EII: La artritis ocurre en el 9-53% de los pacientes con EII, pudiendo ser periférica o axial. La artritis periférica se presenta con dos patrones: Oligoarticular (tipo 1), afecta grandes articulaciones y se asocia a la actividad intestinal. Poliarticular (tipo 2), afecta pequeñas articulaciones y suele ser independiente a la actividad intestinal1. En cuanto a la Psoriasis (Ps), múltiples estudios han descripto su asociación con la EII2,3.
Microbiota y tolerancia inmunológica: La microbiota intestinal está representada por la vasta comunidad microbiana que habita en nuestro intestino, simbiosis dependiente de la tolerancia inmunológica.
Se describe que en las EsP y la EII, al estar alterada la vía IL-23/Th-17 entre otras, se generaría disbiosis microbiana, inflamación intestinal, incremento de permeabilidad epitelial, aumento de exposición antigénica transepitelial, situación que finalmente desencadenaría la pérdida de tolerancia en aquellos sujetos genéticamente predispuestos4,5.
La prevalencia de enteropatía inflamatoria en la EsP es muy variable y depende en gran medida de las etnias que se estudien. Las mayores tasas de incidencia y prevalencia de EC y CU se han reportado en el norte de Europa y Norteamérica, especialmente en el pueblo judío. Mientras que en el sur de Europa, Asia y en la mayoría de los países en desarrollo parecería ser menor2.
En 2012, Li WQ y col. publicaron un estudio prospectivo y observacional, donde evaluaron el riesgo de incidencia de EC en 174.476 mujeres norteamericanas con psoriasis y APs inscriptas en el Nurse´s Health Study (NHS) (1996-2008) y NHS II (1991-2007). Documentaron 188 casos incidentes de EC y 240 casos incidentes de CU durante el seguimiento. En el análisis conjunto de ambas cohortes, las mujeres con Ps experimentaron un riesgo significativamente mayor de EC (RR: 3,86; IC 95% 2,23-6,67), pero no de CU (RR: 1,17; IC 95% 0,41-3,36). El riesgo de EC fue especialmente alto en aquellas pacientes con APs (RR: 6,43; IC 95% 2,04-20,32)5.
Recientemente Egeberg A y col. publicaron un estudio prospectivo y observacional utilizando la cohorte nacional Danesa con 5.554.100 individuos seguidos durante 17 años (1991-2008). Evaluaron la asociación entre la enfermedad psoriásica y EII, reportando 75.209 casos incidentes de psoriasis, 11.309 casos incidentes de EC y 30.310 casos incidentes de CU durante el seguimiento. La incidencia estimada a 10 años de EC en la enfermedad psoriásica fue de 2-5 por 1000 pacientes y la de CU 7-11 por 1000 pacientes, dependiendo de la gravedad de la psoriasis y la presencia de APs. Este estudio sugiere que existe un riesgo asociado de EC y CU en pacientes con Ps, siendo mayor en el subgrupo que presenta APs6.
Respecto a los estudios retrospectivos que evalúan esta asociación, en 2011 el equipo de Binus AM y col. publicó un estudio de casos y controles donde evaluaron las comorbilidades asociadas en pacientes con Ps y EII. Incluyeron 146 pacientes con Ps y EII y 146 controles con Ps pura. Y observaron que los niveles PCR y ERS del primer grupo fueron significativamente mayores a los de los controles (ERS: X33,5 vs X4 mm/h y PCR: X9,1 vs X2,3 mg/l, p <0,0001), y la presencia de artritis seronegativa fue 40% en aquellos con EII asociada7. Posteriormente en 2013, Parque SA y col. reportaron resultados similares3. Recientemente, el equipo de Zohar A y col. evaluaron comorbilidades gastrointestinales en 3161 pacientes con APs, encontrando una asociación positiva con EC y CU [OR: 2,4 (IC 95% 1,75-3,32), p <0,0001) y OR: 2,1 (IC 95% 1,33-3,26), p=0,001)], respectivamente8.
Los estudios prospectivos observacionales, no permiten determinar causalidad entre EII y APs.
En conclusión, la mayoría de los estudios coinciden en que los pacientes con APs tienen un riesgo aumentado para desarrollar compromiso inflamatorio del intestino. Este puede responder a diferentes etiologías, como representar una MEA de la EsP, una complicación del tratamiento crónico con AINEs, una superposición de EsP y EII (EC principalmente) o en algunas ocasiones, corresponder a una EII primaria con manifestaciones extraintestinales correspondientes a EsP1-8.
Referencias
1. Orlando A, Renna S, Perricone G, Cottone M. Gastrointestinal lesions associated with spondyloarthropathies. World J Gastroenterol 2009;15(20):2443-8.
2. Gisondi P, Gioglio M, Cozzi A, Girolomoni G. Psoriasis, the liver, and the gastrointestinal tract. Dermatologic Therapy 2010;23(2):155-9.
3. Park HS, Koh SJ, Park GY, Lee DH, Yoon HS,Yoon JI, et al. Psoriasis concurrent with inflammatory bowel disease. J Eur Acad Dermatol Venereol 2014;28(11):1436-41.
4. García-Vicuña R, Zarco P, González CM, Vanaclocha F, Jiménez IM y Calvo L. Incidencia a los 2 años de psoriasis, uveítis y enfermedad inflamatoria intestinal en la cohorte de pacientes con espondiloartritis del estudio AQUILES. Reumatol Clin 2016;12(1): 22-6.
5. Li WQ, Han JL, Chan AT, Qureshi AA. Psoriasis, Psoriatic Arthritis and increased risk of incident Crohn´s disease in US women. Ann Rheum Dis 2013;72(7):1200-5.
6. Egeberg A, Mallbris L, Warren RB, Bachelez H, Gislason GH, Hansen PR, et al. Association between psoriasis and inflammatory bowel disease: a Danish nationwide cohort study. Br J Dermatol 2016;175(3):487-92.
7. Binus AM, Han J, Qamar AA, Mody EA, Holt EW, Qureshi AA. Associated comorbidities in psoriasis and inflammatory bowel disease. J Eur Acad Dermatol Venereol 2012;(26):644-50.
8. Zohar A, Cohen AD, Bitterman H, Feldhamer I, Greenberg-Dotan S, Lavi I, et al. Gastrointestinal comorbidities in patients with psoriatic arthritis. Clin Rheumatol 2016; 35(11):2679-84.
Uveítis
El compromiso oftalmológico, específicamente la uveítis, forma parte del conjunto de manifestaciones extraarticulares (MEA) características de las Espondiloartritis (EsP) e incluso puede presentarse como la primera manifestación de la misma. La uveítis está incluida dentro de los criterios de clasificación de las EsP y puede observarse con cierta frecuencia en pacientes con Artritis Psoriásica (APs).
El término uveítis describe una variedad de condiciones inflamatorias de la úvea, capa media del ojo que suministra la mayor parte del flujo sanguíneo a la retina. La uveítis debe sospecharse en todo paciente con ojo rojo y doloroso, asociado a fotofobia y disminución de la agudeza visual. Suele presentarse como una complicación grave de la enfermedad sistémica y el retraso en su reconocimiento aumenta el riesgo de secuelas irreversibles, principalmente la ceguera. La clasificación más usada para las uveítis, basándose en la localización anatómica primaria de la inflamación, se estableció en 1987 por el International Uveitis Study Group (IUSG) y las dividió en cuatro formas: anteriores, intermedias, posteriores y panuveítis. También se clasifican en crónicas, agudas o recurrentes1. Esta afección tiene múltiples etiologías, incluyendo infecciones, síndromes inmunomediados propios del ojo y enfermedades sistémicas inmunomediadas2.
La asociación entre uveítis y APs fue reportada por primera vez en 1976 por Lambert y Wright3, y desde entonces los diferentes reportes la describen como la MEA más frecuentemente asociada a las espondiloartritis4. En la Espondilitis Anquilosante (EA), considerada el prototipo de EsP, la prevalencia puede llegar al 40%5, mientras que en la Artritis Psoriásica (APs) varía del 2% al 25%6.
En el año 2000, Paiva ES y col. publicaron un análisis retrospectivo donde caracterizan el patrón de presentación de uveítis en 16 pacientes con APs, y en 89 pacientes con EA. Reportan dos fenotipos, en los pacientes con EA: una uveítis anterior, aguda, unilateral y recurrente y en los pacientes con APs: una uveítis de inicio insidioso, bilateral simultánea, con mayor participación del polo posterior y tendencia a la cronicidad7. Sin embargo, tanto en la APs como en la EA, la forma más frecuentemente reportada es la uveítis anterior, aguda y unilateral, siendo el compromiso axial y el HLA-B27(+) los principales factores de riesgo asociados en ambos grupos2,5,7-9. Al poco tiempo, en el año 2013, el grupo RESPONDIA publicó un estudio de cohorte prospectivo, observacional, multicéntrico y multinacional, evaluando la población Iberoamericana. Siguieron 2012 pacientes con EsP desde 2006 a 2008. El 20% tenía APs y el 63% EA. Reportan uveítis en 372 pacientes con EsP (18,5%), y la uveítis se asoció negativamente con el número de articulaciones periféricas dolorosas (p=0,03) y tumefactas (p=0,005) , APs (p <0,001), Psoriasis (Ps) (p <0,001), afectación de las uñas (p <0,001) y dactilitis (p=0,062), y positivamente con dolor lumbar inflamatorio (p <0,001), sacroileítis radiográfica (p <0,001), entesopatías (p=0,004), y presencia de HLA-B27 (p=0,003)5. Posteriormente, en 2015, un grupo Danés también publica un estudio prospectivo y observacional, utilizando la cohorte nacional Danesa con más de 5 millones de pacientes seguidos desde 1997 hasta 2011. Estos evaluaron la asociación entre enfermedad psoriásica y uveítis. En 74.129 pacientes con enfermedad psoriásica incidente. De los 6735 pacientes con APs, 294 tenían EsP asociada. Solo 16 pacientes con APs tuvieron uveítis, estimando un RI (radio de incidencia) de uveítis por cada 10.000 pacientes/año de 2,5 (IC 95% 1,53-4,08) y para el subgrupo de pacientes con Espondiloartritis Axial asociado a APs un RI de 8,35 (IC 95% 2,09-33,38), en ambos casos ajustado a sexo, edad y comorbilidades. Este estudio sugiere que la incidencia de uveítis en APs en el seguimiento a dos años es baja, siendo una manifestación tardía en la evolución de la enfermedad, y que el subgrupo de pacientes con afectación axial es el más involucrado10. Recientemente, el grupo de García-Vicuña R y col. evaluaron prospectivamente, a través de tres cohortes, la incidencia a dos años de psoriasis, uveítis y enfermedad inflamatoria intestinal en una cohorte de pacientes con espondiloartritis (estudio AQUILES). En 513 pacientes con EsP, 25% tenían APs. Ninguno de los pacientes con APs desarrolló uveítis en el seguimiento a 2 años. Estimaron una incidencia acumulada para el desarrollo de MEA en EsP del 4,3% (IC 95% 2,4-6,1) y una RI de 17/10.000 pacientes/año. Para uveítis informan una incidencia acumulada del 3,1%4.
Existen varias limitaciones para el análisis de la relación entre APs y uveítis. Primero, a pesar de contar con estudios prospectivos, al ser todos observacionales, no nos permiten establecer causalidad. Segundo, estos estudios tampoco fueron diseñados para estudiar la asociación de uveítis con APs, por lo cual no se determinó el número necesario de pacientes con APs y uveítis a incluir, y el tiempo de seguimiento pudo no haber sido suficiente, si tenemos en cuenta que en estos pacientes la uveítis se presenta más tardíamente en comparación a la EA4,5,7,10. Tercero, debemos considerar la heterogeneidad de los criterios clasificatorios utilizados, los diferentes métodos complementarios para evaluar y caracterizar la enfermedad axial y la discrepancia en el tiempo de seguimiento de los pacientes1-11. Por último, posiblemente la utilización de agentes anti-TNFα (Factor de Necrosis Tumoral Alfa) para el tratamiento de las EsP sea otro factor que subestime la prevalencia de uveítis en estos pacientes, y podría explicar la tendencia decreciente de la misma que se observa en los últimos años6.
En conclusión, la mayoría de las publicaciones coinciden en que la uveítis es una manifestación con una baja incidencia en la APs y que habitualmente se presenta más tardíamente en la evolución de la enfermedad si la comparamos con las demás Espondiloartritis. La forma más frecuentemente reportada es la uveítis anterior, aguda y unilateral; pero al compararla con la EA, se describe que en la APs sería más frecuente el inicio insidioso con compromiso bilateral, tendencia a la cronicidad y mayor participación del polo posterior2,4-8,10,11.
Referencias
1. Civera AM, Benítez del Castillo JM, Blanco AR, Pato-Cour E, Sellas-Fernández A, Banares-Cañizares A. Carga y costes de la uveítis no infecciosa en España. Reumatol Clin 2016; 12(4):196-200.
2. Rosenbaum J. Uveitis in spondyloarthritis including psoriatic arthritis, ankylosing spondylitis, and inflammatory bowel disease. Clin Rheumatol 2015;34(6):999-1002.
3. Fraga NA, Oliveira M de F, Follador I, Rocha B de O, Rêgo VR. Psoriasis and uveítis: a literatura review. An Bras Dermatol 2012;87(6):877-83.
4. García-Vicuña R, Zarco P, González CM, Vanaclocha F, Jiménez I, Calvo L. Incidencia a los 2 años de psoriasis, uveítis y enfermedad inflamatoria intestinal en la cohorte de pacientes con espondiloartritis del estudio AQUILES. Reumatol Clin 2016;12(1):22-6.
5. Sampaio-Barros D, Pereira I, Hernández-Cuevas C, Berman A, Burgos-Vargas R, Gutiérrez MA, et al. An analysis of 372 patients with anterior uveitis in a large Ibero-American cohort of spondyloarthritis: the RESPONDIA Group. Clin Exp Rheumatol 2013;31(4):484-9.
6. Cantini F, Nannini C, Cassarà E, Kaloudi O, Niccoli L. Uveitis in Spondyloarthitis: An Overview. J Rheumatol 2015;(93):27-9.
7. Paiva ES, Macaluso DC, Edwards A, Rosenbaum JT. Characterisation of uveitis in patients with psoriatic arthritis. Ann Rheum Dis 2000;59(1):67-70.
8. Abbouda A, Abicca I, Fabiani C, Scappatura N, Peña-García P, Scrivo R, et al. Psoriasis and Psoriatic Arthritis-Related Uveitis: Different Ophthalmological Manifestations and Ocular Inflammation Features. Seminars in Ophthalmology, Early Online, 1–6, 2016. (http://dx.doi.org/10.3109/08820538.2016.11 70161)
9. Peluso R, Iervolino S, Vitiello M, Bruner V, Lupoli G, Di Minno MN. Extra-articular manifestations in psoriatic arthritis patients. Clin Rheumatol 2015;34(4):745-53.
10. Egeberg A, Khalid U, Gislason GH, Mallbris L, Skov L, Riis Hansen P. Association of Psoriatic Disease With Uveitis A Danish Nationwide Cohort Study. JAMA Dermatol 2015; 151(11):1200-5.
11. Queiro R, Torre JC, Belzunegui J, González C, De Dios J, Unanue F, et al. Clinical Features and Predictive Factors in Psoriatic Arthritis-Related Uveitis. Semin Arthritis Rheum 2002(31):264-70.
Psoriasis y medidas de evaluación
Cristina Mariela Echeverría1, Luis Daniel Mazzuoccolo2, Emilce Edith Schneeberger3
1Servicio Dermatología, Hospital Interzonal General de Agudos Eva Perón, San Martín, Buenos Aires
2Servicio Dermatología, Hospital Italiano, Buenos Aires
3Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Introducción
La psoriasis (Ps) es una enfermedad inflamatoria, sistémica, crónica e inmunomediada. Afecta entre el 2 y el 3% de la población mundial. Compromete primariamente la piel y las articulaciones pero se asocia a múltiples comorbilidades, entre ellas, enfermedad cardiovascular, síndrome metabólico y diabetes1,2.
Cualquier sitio del tegumento puede estar comprometido siendo más frecuente la localización en cuero cabelludo, codos y rodillas, en forma simétrica. Las lesiones son placas eritemato-escamosas, induradas, de bordes bien definidos y en general pruriginosas1.
Si bien las características clínicas en general son suficientes para realizar el diagnóstico, en casos dudosos se puede realizar un “raspado metódico” o bien un estudio histopatológico.
Existen diferentes formas de clasificar la psoriasis, de acuerdo a sus formas clínicas y la localización de las lesiones3.
Formas clínicas de Psoriasis
1. Psoriasis vulgar (en placas):
Es la forma más frecuente ya que afecta al 80% de los pacientes. Se caracteriza por la presencia de lesiones en placa eritemato-escamosas, de tamaño variable y borde bien definido que se localizan preferentemente en forma simétrica en cuero cabelludo (forma de inicio), áreas extensoras de miembros (codos, rodillas), tronco y región pre-sacra. Sin embargo, puede comprometerse cualquier sitio del tegumento. Se calcula que hasta un 45% de los pacientes pueden presentar lesiones en genitales. Al igual que en las otras formas clínicas, las lesiones son en general pruriginosas. Deben considerarse los siguientes diagnósticos diferenciales: eccemas, linfoma cutáneo a células T (micosis fungoide), lupus cutáneo subagudo, tiñas, entre otros1,3.
2. Psoriasis en gotas:
Es la forma de presentación más frecuente en niños y adolescentes. Habitualmente, es precedida por una infección del tracto respiratorio superior. Se presenta como pequeñas pápulas y placas eritemato-escamosas (1-10 mm), múltiples que se localizan predominantemente en tronco y extremidades.
Entre los diagnósticos diferenciales se encuentran: pitiriasis rosada de Gilbert, sífilis secundaria, parapsoriasis en pequeñas placas, pitiriasis liquenoide crónica, eccema numular3.
3. Eritrodermia psoriásica:
Es poco frecuente (2% de los casos) y predomina en varones. Se caracteriza por un eritema generalizado con escamas que puede tener un inicio agudo o crónico. Puede ser una forma de inicio o desarrollarse en pacientes con psoriasis vulgar. Se puede acompañar de compromiso del estado general, con alteración del equilibrio hidro-electrolítico, requeriendo internación. Existen factores desencadenantes como: suspensión abrupta de corticoides sistémicos, infecciones, tratamientos irritativos locales (coaltar) y fototoxicidad. Los diagnósticos diferenciales incluyen otras causas de eritrodermia como dermatitis atópica, farmacodermias, linfoma a células T, entre otros3,4.
4. Psoriasis pustulosa:
Es infrecuente y puede presentarse en forma localizada (palmo-plantar, acrodermatitis continua de Hallopeau) o generalizada (Von Zambusch, patrón anular, exantemática). Se caracteriza por la presencia de eritema y pústulas estériles. Como factores desencadenantes de las formas generalizadas se consideran: suspensión abrupta de corticoides sistémicos, embarazo, hipocalcemia e infecciones y de las formas localizadas: tópicos irritantes e infecciones. En las formas generalizadas puede haber también compromiso del estado general1,2.
Localizaciones especiales
Si bien no son consideradas formas clínicas, según la localización, la Ps puede clasificarse como:
1. Psoriasis invertida:
Las lesiones son eritematosas y brillantes pero en general no presentan escamas por asentar en zonas húmedas de pliegues. Se localizan en axilas, región inguinal, pliegue interglúteo, región inframamaria y retroauricular y área del pañal. Debe considerarse como diagnóstico diferencial a los intertrigos micóticos3.
2. Psoriasis de cuero cabelludo:
Es una localización muy frecuente y puede ser una forma de inicio. Las lesiones son placas eritematosas con escamas que son habitualmente gruesas y adherentes. Puede extenderse a la cara y al cuello y son en general muy pruriginosas. La alopecia puede coexistir con las placas2.
3. Psoriasis de localización palmo-plantar:
Además de las formas pustulosas ya descriptas, los pacientes pueden presentar afectación de palmas y plantas con eritema, escamas y fisuras que le producen una considerable afección de su calidad de vida2.
4. Psoriasis ungueal:
Las lesiones de las uñas dependen del sitio afectado del aparato ungular. Pueden ocurrir en la matriz o en el lecho ungueal. La afectación de las uñas se asocia en un alto porcentaje (50-80%) con compromiso articular1-3.
Evaluación clinimétrica de la Psoriasis
Los instrumentos de evaluación en la Ps se utilizan con el objetivo de determinar la severidad de la enfermedad y a partir de allí poder establecer el tratamiento a seguir y el cumplimiento de los objetivos terapéuticos. Estas medidas de evaluación se usan fundamentalmente en los ensayos clínicos, pero su inclusión en la práctica diaria es de utilidad para realizar un seguimiento más estrecho del paciente. En general, los sistemas de salud los solicitan para dar cobertura a algunos medicamentos.
Son herramientas que si bien buscan ser objetivas y reproducibles no lo son en forma absoluta en la medida en que dependen de la subjetividad del evaluador, de ahí la sugerencia de que sea siempre el mismo médico quien las realiza en un paciente dado.
Las más utilizadas son las siguientes:
1. BSA (Body Surface Area):
Consiste en el cálculo directo de la superficie corporal comprometida en quienes padecen una psoriasis vulgar utilizando la palma del paciente como patrón. Se considera que cada una de ellas corresponde al 1% de la superficie. De esta forma entre la cabeza y el cuello se suman un máximo de 10 palmas, las extremidades superiores 20, las inferiores 40 y el tronco 30. Hay que destacar que no sirve en los casos de placas muy pequeñas aisladas ni para las formas de psoriasis en gotas5.
2. PASI (Psoriasis Area Severity Index):
Es la escala más usada y en ella se basa la medición de la eficacia de las drogas en la mayoría de los ensayos clínicos. Al igual que el BSA es útil solo en la psoriasis vulgar.
Evalúa las características individuales de las lesiones e incluye la medición de la superficie corporal.
En primer lugar, se considera el eritema, la induración y la escama de la placa más representativa de cada área corporal (cabeza, tronco, miembros superiores y miembros inferiores). A cada uno de los atributos se le asigna una escala de 1 (leve) a 4 (muy severo). En el caso del eritema: al número 1 le corresponde un color rosado, al 2 rojo, al 3 rojo oscuro y al 4 rojo muy oscuro. Para la escama: 1 corresponde a la presencia de escamas finas apenas perceptibles que cubren poca superficie de la placa; 2 escamas finas, perceptibles pero que cubren casi toda la lesión; 3 escamas gruesas, que cubren también casi toda la lesión, y 4 escamas gruesas que la cubren totalmente. En cuanto a la induración: se considera que 1 es leve (0,25 mm), 2 moderada (0,50 mm), 3 severa (1 mm) y 4 muy severa (1,25 mm). Posteriormente, se suma el puntaje de las tres características evaluadas en cada área quedando un rango de 0-12 para cada una. Esta suma se multiplica por el cálculo de la superficie corporal correspondiente a cada área. Para este cálculo de la superficie corporal se utiliza el mismo esquema que en el BSA considerando que a la cabeza le corresponde el 10%, al tronco el 30%, a las extremidades superiores el 20% y a las inferiores el 40%. Este porcentaje se traduce en una escala de 0 a 6 para cada sitio corporal (cabeza, tronco, miembros superiores e inferiores), donde 0 es nada, 1=0-9%, 2=10-29%, 3=30-49%, 4=50-69%, 5=70-89% y 6=90-100%. Finalmente, se multiplica ese valor por un cociente con el fin de ponderar la superficie de cada área evaluada (0,10 para cabeza, 0,30 para tronco, 0,20 para miembros superiores y 0,40 para miembros inferiores), y el puntaje final surge de la sumatoria de esos 4 valores, siendo el rango de 0-72 (Figura 2).

Figura 2. Esquema para el cálculo de PASI
En la actualidad existen aplicaciones para los teléfonos celulares que permiten realizar el cálculo en forma automática6-8.
3. NAPSI (Nail Psoriasis Severity Index):
Es una herramienta numérica, objetiva y reproducible que se utiliza para calcular la severidad de la psoriasis ungular. Evalúa los cambios que se producen diferenciando la afectación del lecho ungueal y de la matriz. Si el daño se encuentra en el lecho se podrán observar: “manchas en gota de aceite” (también denominadas “manchas salmón”), onicolisis, hiperqueratosis subungueal y hemorragias en astilla. Si lo que se afectó es la matriz se verán: hoyuelos (“pitting”), leuconiquia, manchas rojas en la lúnula y traquioniquia (desestructuración de la lámina ungueal). Para el cálculo del índice: se divide a cada uña en cuadrantes y se evalúa la presencia o no de cada una de las características descriptas. La presencia de signos de afectación de lecho o de matriz se puntúa con 1 punto por cuadrante, es decir que por cada uña el valor puede ir de 0 (sin afectación) a 8 (presencia de cambios por daño en la matriz y en el lecho en todos los cuadrantes). Así el score máximo considerando las 10 uñas de las manos es de 80 y las 20 uñas (entre manos y pies) puede ascender a 1609.
4. mNAPSI:
Es un score que surge de la modificación del NAPSI. El objetivo es establecer la severidad de la afectación ungular. Se elimina la medición por cuadrantes para facilitar la detección de los cambios.
Se calcula solo en las uñas de las manos. Considera en detalle las tres manifestaciones más frecuentes que aparecen en las uñas:
Hoyuelos: El puntaje va de 0 a 3 dependiendo de su número (0=no hay hoyuelos, 1=1-10, 2=11-49, 3=≥50)
Onicolisis (incluye la presencia de manchas en gota de aceite debido a que se considera que ambos procesos se producen por el mismo mecanismo patológico): 0-3 según el porcentaje de la uña afectado (0=ausencia, 1=1-10%, 2=11-30%, 3>30%)
Traquioniquia: 0-3 según el porcentaje afectado (0=ausencia, 1=1-25%, 2=26-50%, 3>50%)
A las otras cuatro manifestaciones (leuconiquia, hemorragias en astilla, manchas rojas en la lúnula e hiperqueratosis subungueal) se les asigna un valor de 0 o 1 según si están o no presentes, respectivamente.
De acuerdo con lo descripto, el rango de la sumatoria de los signos incluidos va de 0-13 para cada una de las uñas y de 0-130 considerando todas las uñas de las 2 manos10,11.
5. Psoriasis Nail Severity Score (PNSS):
En la escala PNSS, se asigna un punto por la presencia de cada cambio de los siguientes: pitting, hiperqueratosis subungual, onicolisis y deformación de ambos bordes ungueales. El máximo puntaje es 4 para cada uña12,13.
6. DLQI (Dermatology Life Quality Index):
Es un cuestionario cuyo objetivo consiste en determinar qué efecto ha tenido la enfermedad en la vida del paciente durante la última semana, es decir, el impacto sobre la calidad de vida.
Está formado por 10 preguntas que el paciente debe contestar en una escala de 0 a 3. Evalúa 6 dominios: síntomas y sentimientos, actividades diarias, ocio, trabajo y estudio, relaciones personales y peso del tratamiento. El cálculo consiste en la simple sumatoria de los resultados de los 10 dominios, y el puntaje máximo es 30 que representa mayor afectación14.
El cuestionario está traducido al español y se puede descargar en forma gratuita en: http://www.solapso.org/archivos/evaluacion/DLQI-es.pdf
Referencias
1. van der Kerkhof P, Nestle O, Bolognia JL, Jorizzo JL, Shaffer JV. Psoriasis en Dermatology 3er edition. Ed Elseiver 2012:139-47.
2. Consenso Latinoamericano de Psoriasis. Actualización 2009. http://www.solapso.org/archivos/LATINOAMERICANO-1_2010.pdf
3. Chalela Mantilla J, González Ardila C, Castro Gómez L. Guías de Manejo de Psoriasis. Consenso Colombiano. 2008:14-22. http://www.solapso.org/archivos/conscol.pdf
4. Rosenbach M, Hsu S, Korman NJ, Lebwohl MG, Young M, Bebo BF Jr, et al. Treatment of erythrodermic psoriasis: from the medical board of the National Psoriasis Foundation. J Am Acad Dermatol 2010;62(4):655-62.
5. Krueger GG, Feldman SR, Camisa C, Duvic M, Elder JT, Gottlieb AB, et al. Two considerations for patients with psoriasis and their clinicians: what defines mild, moderate, and severe psoriasis?. What constitutes a clinically significant improvement when treating psoriasis?. J Am Acad Dermatol 2000; 43(2 Pt 1):281-5.
6. Feldman SR, Krueger GG. Psoriasis assessment tools in clinical trials. Ann Rheum Dis 2005; 64 Suppl 2:ii65-8.
7. Fredriksson T, Petterson U. Severe psoriasis: oral therapy with a new retinoid. Dermatológica 1978; 157(4):238-44.
8. Langley R, Ellis S. Evaluating psoriasis with Psoriasis Area and Severity Index, Psoriasis Global Assessment, and Lattice System Physician’s Global Assessment. J Am Acad Dermatol 2004; 51(4):563-569.
9. Rich P, Scher RK. Nail Psoriasis Severity Index: a useful tool for evaluation of nail psoriasis. J Am Acad Dermatol 2003;49(2):206-12.
10. Cassell SE, Bieber JD, Rich P, Tutuncu ZN, Lee SJ, Kalunian KC, et al. The modified Nail Psoriasis Severity Index: validation of an instrument to assess psoriatic nail involvement in patients with psoriatic arthritis. J Rheumatol 2007; 34(1):123-9.
11. Parrish CA, Sobera JO, Elewski BE. Modification of the Nail Psoriasis Severity Index. J Am Acad Dermatol 2003; 53(4):745-6.
12. Sobolewski P, Walecka I, Dopytalska K. Nail involvement in psoriatic arthritis. Reumatología 2017; 55(3):131-5.
13. Klassen KM, van de Kerkhof PC, Bastiaens MT, Plusjé LG, Baran RL, Pasch MCJ. Scoring nail psoriasis. Am Acad Dermatol 2014; 70(6):1061-6.
14. Finlay AY, Khan GK. Dermatology Life Quality Index (DLQI) - a simple practical measure for routine clinical use. Clin Exp Dermatol 1994; 19(3):210-6.
Estrategia de tratamiento dirigido al objetivo y medidas de evaluación en Artritis Psoriásica
Vanesa Cosentino1, Emilce Edith Schneeberger2
1Servicio de Reumatología, Hospital Dr. J.M Ramos Mejía, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Estrategia de tratamiento (T2T)
El enfoque del tratamiento a objetivos (T2T) se ha implementado en varias especialidades en medicina, incluida la reumatología. En los últimos años se ha convertido en el tratamiento standard de la Artritis Reumatoidea1,2. El tratamiento dirigido al objetivo, “treat to target” (T2T) tiene como meta alcanzar el estado de remisión o mínima actividad de la enfermedad con el fin de optimizar la mejoría clínica y minimizar el daño a largo plazo. Esta estrategia, requiere de la cuantificación de la actividad de la enfermedad a través de medidas validadas.
En 2014 fueron publicadas las recomendaciones de la Task Force Internacional para Espondiloartritis (EsP) y Artritis Psoriásica (APs). A pesar de que hasta ese momento no había ensayos clínicos que directamente evaluaran el T2T en estas patologías, las mismas se establecieron basadas en opinión de expertos3. Estas recomendaciones fueron posteriormente actualizadas y publicadas en el año 2018, por el mismo grupo. Es importante mencionar que mientras en el 2012 todas las recomendaciones tenían muy bajo grado de evidencia y un grado de recomendación D, actualmente 5 de 11 recomendaciones están basadas en un grado B, un claro avance en el nivel de evidencia gracias a los estudios publicados en los últimos 5 años4. (Tabla 4) Las Guías GRAPPA así como también la actualización de las guías EULAR 2015 recomiendan la utilización del T2T basada en nueva evidencia principalmente del ensayo clínico TICOPA5-6. Este es el primer trial en evaluar T2T, confirmando el beneficio del control estricto (cada 4 semanas) versus el standard usando los criterios MDA (Minimal Disease Activity) como objetivo terapéutico5-8.
Tabla 4. Recomendaciones 2017 para tratar todas formas de EsP y APs por objetivos

MDA es definida por el OMERACT (Outcomes Measures in Rheumatology Clinical Trials) como “ese estado de actividad de la enfermedad considerado, objetivo útil de tratamiento, por el paciente y el médico, teniendo en cuenta las posibilidades de tratamiento actuales y sus limitaciones”10,11. Los criterios de MDA en APs incluyen varios aspectos de la enfermedad: enfermedad articular, compromiso cutáneo, evaluación de la enfermedad y del dolor por el paciente y función. (Tabla 5)
Tabla 5. Minimal Disease Activity11

El criterio de MDA fue probado en otros estudios12-14. Mease P y col. propusieron un MDA modificado en el cual se sustituye el PASI por una medida de evaluación de actividad en piel más simple, a través de la evaluación global del médico, PGA (Physician Global Assessment). Este consiste en una escala de 7 puntos (1=LIMPIO, 2=CASI LIMPIO, 3=LEVE, 4=LEVE A MODERADO, 5=MODERADO, 6=MODERADO A SEVERO y 7=SEVERO). La simplicidad del PGA lo hace más adecuado que el PASI para ser usado en la práctica diaria o registro de pacientes. Tiene buena confiabilidad entre evaluadores y no parece estar afectado por el nivel de experiencia del médico. El PGA tiene alta correlación con el PASI, por lo tanto un PASI ≤1 puede ser usado en forma intercambiable con un PGA “limpio” o “casi limpio”14.
Medidas de evaluación en APs
La evaluación de la APs es compleja debido a la variedad de sus manifestaciones. La misma comprende la evaluación de la artritis periférica, el compromiso axial, la entesitis, la dactilitis y la psoriasis. Muchas de las herramientas de medición de actividad para APs fueron tomadas de la evidencia y el conocimiento que se disponía de enfermedades como la Artritis Reumatoidea y la Espondilitis Anquilosante15.
Recientemente, GRAPPA y OMERACT han llegado a un consenso sobre el conjunto de los dominios de esta enfermedad. Su validación preliminar se obtuvo a través del proceso OMERACT16. Estos dominios pueden ser evaluados por medidas individuales o compuestas17,18.
Los 6 dominios principales son: actividad articular periférica, actividad cutánea, evaluación global de la enfermedad (EGEp) y del dolor por el paciente a través de una EVN (escala visual numérica), función física y calidad de vida. Otros dominios que también son importantes pero no mandatorios, son: entesitis, dactilitis, compromiso axial, compromiso ungueal, fatiga, evaluación global por el médico (EGEm), reactantes de fase aguda (RFA) y evaluación del daño estructural mediante radiografías. Otras medidas adicionales como ser: tomografía computada (TC), resonancia magnética (RM), sistema de score por ECO, análisis de tejido (Biopsia de piel) y “participación” (habilidad de participar en actividades significativas de la vida) se encuentran en agenda de investigación17,18. (Figura 3)

Figura 3. Dominios de artritis psoriásica
Medidas individuales
Evaluación articular periférica – Conteo articular
Se recomienda el recuento articular de 66 articulaciones inflamadas y 68 articulaciones dolorosas16-18.
• Conteo articular de 66 articulaciones inflamadas
• Conteo articular de 68 articulaciones dolorosas
- Temporomandibulares bilaterales
- Esternoclaviculares bilaterales
- Acromioclaviculares bilaterales
- Hombros
- Codos; carpos; metacarpofalángicas derechas e izquierdas
- Interfalángicas proximales; Interfalángicas Distales
- Caderas; rodillas
- Tobillos
- Tarsos medios
- Art. Metatarsofalángicas
Las caderas son articulaciones profundas, por lo tanto mediante palpación no se puede evaluar inflamación, solo se evalúa dolor de las mismas.
Escalas de evaluación
Las escalas son útiles para medir el dolor, la evaluación global de la enfermedad, la rigidez, el compromiso cutáneo y otros síntomas. La principal ventaja es que son rápidas y simples tanto para completar como para calcular.
Si bien existen varios tipos de escalas, la más recomendada es la visual numérica (EVN). La cual consiste en una línea horizontal que va desde 0=muy bien, ausencia de actividad de enfermedad hasta 10=muy mal con síntomas severos19. (Figura 4)

Figura 4. Escalas
Evaluación global de la enfermedad (EGE)
Puede ser determinada tanto por el médico como por el paciente. La redacción homologada y validada por el estudio de GRAPPA para realizar la pregunta al paciente es: “Teniendo en cuenta la afectación que le provoca tanto la psoriasis como la artritis, en todas sus formas, globalmente. ¿Cómo calificaría la forma en que se sintió la semana pasada?”15.
Un estudio demostró que un EGE <2 cm tuvo buena concordancia con índices de baja actividad de enfermedad como el MDA. A pesar de esto, hay que tener en cuenta que no discrimina qué dominios de la enfermedad se encuentran activos y no se considera tan amplio como para reemplazar otras medidas de actividad compuestas de enfermedad20.
Un estudio realizado en el IREP, analizó la concordancia entre el EGEp y EGEm en una cohorte de pacientes con APs. Ellos observaron que hubo una buena concordancia entre ambos, siendo el dolor la variable que más influencia tuvo en ambas evaluaciones21.
Evaluación del dolor
Es evaluada de acuerdo a la intensidad del dolor que el paciente padeció durante la última semana, a través de una escala en la que 0 representa AUSENCIA DE DOLOR y 10 representa DOLOR MÁS SEVERO. La mínima diferencia clínica importante de dolor medido por EVN es considerado de 1 cm18.
Entesitis
La entesitis se caracteriza por la inflamación en los sitios de inserción, de tendones, ligamentos y cápsula articular al hueso. Si bien los tendones más frecuentemente afectados son el tendón de Aquiles y la fascia plantar, puede comprometer diferentes sitios como: rodilla, pelvis, columna (inserción del ligamento vertebral), costillas, hombros, codos, etc.18
Los índices clínicos para determinar la presencia de entesitis se evalúan mediante la palpación del sitio de entesis, aplicando una fuerza de presión capaz de blanquear el lecho ungueal del examinador y constatando la presencia/ausencia de dolor en dicha zona y en algunos casos también se constata la severidad de ese dolor18.
Índices para medir entesitis
1. Índice de entesitis de MANDER/NEWCASTLE (MEI)
Evalúa 66 sitios, utiliza un rango de medición de 0 a 3 en cada sitio, basado en la respuesta a la palpación. 0: NO HAY DOLOR, 1: DOLOR LEVE; 2: DOLOR MODERADO; 3: CONTRAE O RETIRA18,22. El resultado final surge de la sumatoria de todos los puntos y va desde 0 a 90.
Limitaciones MEI
Presenta un gran número de sitios a examinar (Figura 5)
• Consume mucho tiempo
• Se superpone con muchos puntos de fibromialgia
• El sistema de puntaje de 0-3 puede contribuir a inconsistencia intra e interexaminador
• No se ha evaluado su confiabilidad o grado de respuesta18,22

Figura 5. Localización de los puntos de entesis a evaluar en los cuatro índices27
2. Índice de entesitis de espondilitis anquilosante de MAASTRICHT – (MASES)
Consiste en la palpación de 13 sitios18,23.
Se aplica una presión local en cada uno de los 13 sitios, constatando PRESENCIA (1) o AUSENCIA (0) de dolor y luego se suman los puntos positivos, el rango de la puntuación es de 0 a 13.
Los sitios de entesis a evaluar son: (Figura 5)
• Primeras articulaciones costo-condrales bilaterales
• Séptimas articulaciones costo-condrales bilaterales
• Espinas ilíacas póstero-superiores bilaterales
• Espinas ilíacas antero-superiores bilaterales
• Crestas ilíacas bilaterales
• Inserción proximal de ambos tendones de Aquiles
• Proceso espinoso de la quinta lumbar
La reducción de los sitios de entesitis a evaluar lo hace más aceptable para ser utilizado en la práctica diaria18.
Existe un MASES modificado para APs, que evalúa 15 sitios de entesis. Este agrega las inserciones de ambas fascias plantares, derecha e izquierda. En este caso el rango va desde 0 a 1524.
3. SPARCC – Spondyloarthritis Research Consortium of Canada
La selección de los sitios se determinó de acuerdo a los puntos más frecuentemente comprometidos en la práctica diaria y en estudios por imágenes (Power doppler y RM)25. El sistema de puntuación es idéntico al MASES y el rango de puntuación es de 0 a 1618,25.
Los sitios de entesis a evaluar son: (Figura 5)
• Ambos tendones de Aquiles
• Inserción de ambas fascias plantares en el calcáneo
• Inserción del tendón patelar en la base de ambas patelas
• Inserción de cuádriceps en el borde superior de ambas patelas
• Inserción del supraespinoso en la tuberosidad mayor del húmero
• Epicóndilos laterales
• Epicóndilos mediales
4. Índice de entesitis de LEEDS - LEEDS Enthesitis Index (LEI)
Consideraron también los sitios comprometidos más frecuentemente, reduciéndolos a 6 sitios.
Estos son: (Figura 5)
• Tendón de Aquiles (bilateral)
• Epicóndilo lateral de codo (bilateral)
• Cóndilo medial de la rodilla (bilateral)
El índice fue probado en pacientes con APs y demostró ser sensible al cambio26. Identifica más pacientes con entesopatía27. Es fácil de usar y consume menos tiempo18. (Tabla 6)
Tabla 6. Cuadro comparativo de las características de los índices de entesitis

Dactilitis
La dactilitis se define como una “Inflamación uniforme del dedo tal, que las partes blandas entre la metacarpofalángica y la interfalángica proximal, interfalángica proximal y distal y/o interfalángica distal y el penacho distal están difusamente inflamadas en toda su extensión, de forma que la inflamación en la articulación real ya no pueda ser identificada”29. Esto es la expresión de una sinovitis más una tenosinovitis, entesitis y edema de partes blandas18,28. Su presencia ayuda a identificar la APs de otras formas de artritis y está descripta en el 16% al 48% de los casos de APs18,28,29.
El simple conteo digital por el investigador de aquellos dedos inflamados, dolorosos o no, ha sido utilizado en varios estudios como por ejemplo, el IMPACT 1 y el IMPACT 2 los cuales han demostrado que esta medida tiene buena sensibilidad al cambio18,30,31. En ocasiones, también se ha usado un puntaje de severidad que va del 0 al 3 (0=no inflamación ni dolor y 3=severa inflamación y/o dolor). Ambos métodos han demostrado buena respuesta al cambio y discriminación en los ensayos clínicos con agentes anti-TNF18,30.
Índices para medir dactilitis
1. Índice de dactilitis de LEEDS (LDI)
Recientemente, se ha desarrollado una medida cuantitativa, más objetiva, para medir dactilitis. El LDI usa un instrumento conocido como dactilómetro. En este método se miden: la circunferencia del dedo afectado, la circunferencia del contralateral y el dolor, en los 20 dedos.
Método de administración:
Marcar qué dedos están afectados en un dibujo que muestra los dedos de las manos y los pies.
Medir las circunferencias de los dedos afectados y los contralaterales alrededor de la falange proximal ya sea con una cinta métrica o mejor aún, con un dactilómetro. Si el contralateral también está afectado se compara con la información de la tabla de referencia. (Apéndice 1)
Apéndice 1. Índice de dactilitis de LEEDS

Una diferencia en la circunferencia del dedo ≥10% se usa para definir un dedo con dactilitis. El valor total más alto se asocia con peor dactilitis.
Palpar el dedo afectado con una presión moderada y establezca el puntaje de la respuesta.
0=NO DOLOR
1=DOLOR
2=DOLOR Y CONTRAE
3=DOLOR Y RETIRA
(Una modificación posterior del LDI básico, reemplazó el puntaje del dolor por uno que solo refleja la presencia o ausencia de dolor, 1 o 0, respectivamente)
• Realizar el cálculo para cada dedo y registrar el resultado total. (Apéndice 1)
Medidas compuestas:
La gran heterogeneidad de la APs ha motivado que el grupo GRAPPA/OMERACT defina los dominios principales que deberían ser evaluados en todos los pacientes con esta enfermedad. Para esto existen herramientas que miden cada dominio por separado y otras medidas compuestas, que incluyen varios dominios de la enfermedad, incluso las evaluaciones globales por el paciente mediante una EVN. Estas pueden facilitar una evaluación más precisa sobre el estatus global de actividad32.
Actualmente continúa siendo un verdadero desafío la evaluación de la APs ya que hay autores que consideran la utilización de medidas compuestas que valoren todos los dominios principales de la enfermedad, mientras otros prefieren la utilización de medidas compuestas que hagan foco principalmente en el compromiso musculoesquelético del paciente, excluyendo al compromiso cutáneo ya que consideran que la actividad en piel puede cursar en forma independiente y requerir una estrategia diferente de tratamiento33.
DAS 28 (Disease Activity Score)
Existen algunos que apoyan la utilidad del DAS 28 en APs. Aunque los conteos articulares reducidos pierden una proporción significativa de aproximadamente >20% de pacientes con APs y compromiso oligoarticular34. Debemos recordar que dentro de las 28 articulaciones incluidas en el DAS 28 no están contempladas articulaciones ampliamente comprometidas en esta enfermedad, como las interfalángicas distales de las manos ni tobillos y pies33. El DAS 28 en su cálculo incluye: número de articulaciones dolorosas (0 a 28), número de articulaciones inflamadas (0-28), eritrosedimentación (ERS) o proteína C reactiva (PCR) y evaluación global de la enfermedad por el paciente, por EVN (0 a 100). (Figura 6)

Figura 6. Fórmula del DAS 28
El rango del DAS 28 va de 0 a 9,4
Puntos de corte del DAS 28:
DAS 28 <2,6: Remisión
DAS 28 ≤3,2: Baja actividad
DAS 28 >3,2 ≤5,1: Actividad moderada
DAS 28 >5,1: Alta actividad
Un cambio en el DAS 28 de 1,2 se considera significativo. Se recomienda realizar cada tres meses de acuerdo al grado de actividad de la enfermedad19.
CPDAI – Composite Psoriatic Disease Activity Index
La primera medida compuesta de actividad de la enfermedad creada por GRAPPA para guiar las decisiones terapéuticas en APs, fue el “Índice compuesto de actividad de la enfermedad psoriásica” (Composite psoriatic disease activity index) - CPDAI. A pesar de la amplia cobertura de todos los dominios de la enfermedad, este ha sido criticado por la selección empírica de sus puntos de corte.
Sin embargo, en el estudio PRESTA, el CPDAI mostró ser una herramienta más sensible que el DAPSA para detectar cambios en diferentes dominios de la enfermedad18,35.
Es fácil de utilizar, con un promedio de 7 a 8 minutos para realizar una examinación completa y calcular el índice32.
El CPDAI mide actividad de la enfermedad en cinco dominios (compromiso articular periférico, axial, cutáneo, entesitis y dactilitis), para cada dominio se utilizan herramientas individuales para evaluar actividad, el impacto en la capacidad funcional y calidad de vida del paciente.
La actividad de la enfermedad para cada dominio se puntúa de 0 al 3 (0=no compromiso, 1=compromiso leve, 2=moderado y 3=severo). El puntaje final surge de la sumatoria de los 5 componentes y va de 0 a 15. Los puntajes más altos corresponden a mayor severidad de la enfermedad. Los puntos de corte descriptos son: <4=baja actividad de enfermedad, 5 o 6=indeterminado y >6=alta actividad de enfermedad32.
Recientemente, el grupo del Hospital Italiano en conjunto con el Hospital Universitario de St. Vincent´s en Dublin, han presentado un trabajo en donde proponen diferentes puntos de corte para el CPDAI. Estos puntos de corte definen los siguientes estados de actividad de enfermedad: remisión <2; baja actividad de enfermedad ≥2 y <4; moderada actividad de enfermedad ≥4 y <7 y alta actividad de enfermedad ≥736. (Tabla 7)
Tabla 7. CPDAI32

Criterios de respuesta en Artritis Psoriásica
- ACR (American College of Rheumatology) response criteria
Hay dos tipos de índices compuestos. Los índices de respuesta, como el ACR 20 en AR que mide cambio de estado de enfermedad debido a una intervención terapéutica y un segundo tipo de índice, como el DAS 28, que mide tanto actividad en un determinado momento y cambios en la actividad luego de un tratamiento. Funcionando como una medida estática de actividad y un índice de respuesta37.
Un paciente alcanza una respuesta ACR 20 cuando tiene al menos una mejoría del 20% tanto en el conteo de articulaciones dolorosas e inflamadas y al menos una mejoría del 20% en 3 de los siguientes 5 dominios: evaluación global de la enfermedad por el paciente; evaluación del dolor por el paciente; evaluación global de la enfermedad por el médico; eritrosedimentación; HAQ. Las evaluaciones globales tanto del médico como del paciente medidas con una EVN38,39.
- PSARC (Psoriatic Arthritis Response Criteria)
Los criterios de respuesta de la APs fueron desarrollados originalmente en el contexto de un ensayo clínico de sulfasalazina versus placebo18,31. Posteriormente fue validado en otro ensayo clínico con etanercept18,40. Consiste en alcanzar respuesta en 2/4 ítems, uno de los cuales debe ser el conteo articular inflamadas y/o dolorosas y no debe empeorar ninguna otra medida. La mejoría del conteo articular debe ser ≥30% y la mejoría en la EGE por el paciente o médico debe ser de al menos un punto por escala de Likert.
Los cuatro ítems que lo componen son:
• Conteo de articulaciones dolorosas (68)
• Conteo de articulaciones inflamadas (66)
• EGEm (mediante escala Likert)
• EGEp (mediante escala Likert)
Estos criterios tienen algunas limitaciones. Su desempeño sería menor en comparación con los criterios de respuesta ACR 20 y EULAR18,41,42. No incluye los RFA ni la evaluación del dolor, un síntoma predominante en pacientes con APs33. Una modificación reciente sugiere para la EGE, que sea evaluada por una escala visual análoga18.
- PSAJAI (Psoriatic Arthritis Joint Activity Index)
El PSAJAI presenta un desempeño mejor que el ACR 20 y el PsARC18. Pero su confiabilidad y validez no han sido aún evaluadas.
Consiste en la mejoría del 30% en las siguientes 6 medidas:
• Conteo de articulaciones dolorosas
• PCR
• EGEm
• Evaluación del dolor
• EGEp
• HAQ
- PASDAS (Psoriatic Arthritis Disease Activity Score)
El PASDAS surgió del Proyecto GRACE (GRAPPA composite exercise), diseñado por GRAPPA. Incluye 7 dominios: conteo de articulaciones inflamadas (0 a 66), conteo de articulaciones dolorosas (0 a 68), EGEm (0-100 mm), EGEp (0-100 mm), entesitis por LEI (0- 6), número de dactilitis dolorosas (0-20), PCR y componente físico del SF3626,37,43.
Este índice se calcula mediante la siguiente fórmula:
PASDAS: (((0,18 √ EGEm
+ (0,159 √ EGEp
- (0,253 x √ SF36- PCS
+ (0,101 x LN (conteo de articulaciones + 1))
+ (0,048 x LN (conteo de articulaciones dolorosas +1)
+ (0,23 x LN (conteo de entesitis de Leeds +1)
+ (0,37 LN (conteo de dactilitis dolorosas +1)
+ (0,102 x LN (PCR +1))+2) * 1,5
El rango de puntuación del PASDAS es de 0 a 1043.
El punto de corte para baja actividad de enfermedad fue acordado por GRAPPA en 3,243.
Este índice tiene algunas limitaciones: consume tiempo y requiere de un cálculo matemático complejo37,44.
- AMDF (Arithmetic Mean Desirability Function Composite Score)
El AMDF también surge del proyecto GRACE37. Consiste en la transformación algorítmica predefinida de las variables que lo componen: conteo articular de inflamadas (66) y dolorosas (68), EGEp (0-100), dolor (0-100), PASI (0-72) y HAQ (0-3). La puntuación final se expresa como una media que va de 0 a 1. 1 indica un estado mejor que 026,45.
En un estudio retrospectivo, el PASDAS y AMDF demostraron mejor discriminación que DAPSA y CPDAI en distinguir tratamiento de placebo45.
Sin embargo, hasta el momento no está definido cuál es la mejor medida compuesta a utilizar44.
- DAPSA (Disease Activity for Psoriatic Arthritis)
El DAPSA fue desarrollado a partir del DAREA, un índice para medir actividad articular periférica en la artritis reactiva33-46. El DAPSA mostró ser válido con buena capacidad de discriminación y sensible al cambio tanto en ensayos clínicos como en estudios observacionales33,47.
Se basa en la simple suma de 5 variables: conteo articular de inflamadas (66) y dolorosas (68), dolor mediante EVN (0-10), EGEp mediante EVG (0-10) y PCR (mg/dl)33,47.
Dos grupos proponen sus valores de corte. El grupo austríaco que desarrolló el DAPSA propuso los siguientes valores de corte para este índice: ≤4 para REMISIÓN; >4 y ≤14 para baja actividad de la enfermedad; >14 y ≤28 para moderada actividad de la enfermedad y >28 para alta actividad33. Y el grupo argentino del Instituto de Rehabilitación Psicofísica (IREP) recientemente ha validado y propuesto los siguientes puntos de corte: DAPSA ≤3,5 se consideraría remisión, >3,5 a ≤13,4 baja actividad, >13,4 a ≤26,2 moderada actividad y >26,2 alta actividad48.
También, existe un DAPSA clínico modificado - cDAPSA (el cual excluye la PCR de su cálculo). Como los valores de corte son muy semejantes a los del DAPSA (<4 remisión; >4 ≤13: baja actividad de enfermedad; >13 ≤27: moderada actividad de enfermedad; >27: alta actividad de enfermedad) se propone utilizar los mismos que los del DAPSA original33,47.
El grupo del IREP desarrolló recientemente el DAPSA-ERS, el cual consiste en la simple sumatoria de los componentes del DAPSA, reemplazando el valor de la PCR por el valor de la ERS por método de Westergren dividida por 10. Los puntos de corte sugeridos son: <6,75 remisión; ≥6,75 y ≤15,5 baja actividad de enfermedad; ≥15,5 y ≤30,7 moderada actividad de enfermedad y >30,7 alta actividad49.
También se han propuesto niveles de respuesta DAPSA:
• Respuesta mínima: 50% de reducción en el valor del DAPSA
• Respuesta moderada: 75% de reducción en el valor del DAPSA
• Respuesta alta: 85% de reducción en el valor del DAPSA
La principal crítica se refiere a que este índice solo incluye tres aspectos clínicos importantes en la APs de los 6 descriptos50.
- PsAID (Psoriatic Arthritis Impact of Disease)
Recientemente EULAR desarrolló un cuestionario para evaluar el impacto de la enfermedad en APs. El mismo ha sido validado en más de 13 países. Cuenta con dos versiones: el PsAID 9, para ensayos clínicos y el PsAID 12, para la práctica clínica26.
El PsAID evalúa 12 dominios de salud desde el dolor o actividad física hasta ansiedad y vergüenza. Cada dominio es evaluado mediante una escala numérica del 0 al 10. El puntaje final surge del promedio de los resultados de los 12 dominios y va del 0 al 10, valores más altos indican peor status51,52.
El punto de corte para el estado de síntomas aceptable por el paciente es de 4 y el valor necesario para encontrar una mejoría clínicamente aceptable es de 351. (Tabla 8)
Tabla 8. PsAID12

Función física
La función física ha sido evaluada en forma confiable en ensayos clínicos mediante el HAQ.
Este contiene 20 ítems divididos en 8 dominios: 1) Vestirse y asearse, 2) Levantarse, 3) Comer, 4) Caminar, 5) Higiene, 6) Alcanzar, 7) Agarrar y 8) Actividades diarias comunes. Los pacientes puntúan el grado de dificultad que han tenido durante la última semana en una escala de 4 puntos, que tiene un rango desde 0 (NO DIFICULTAD) hasta 3 (IMPOSIBLE DE REALIZAR). El valor más alto en cada categoría se suma (0-24) y se divide por el número de categorías anotadas, arrojando una puntuación final que varía de 0 a 3.
El HAQ es un instrumento ampliamente utilizado en AR. El HAQ ha sida validado en nuestro país53. (Apéndice 2). Una variante del mismo para APs es el HAQ expandido. Aunque, no se encontró que estas modificaciones fueran psicométricamente superiores al HAQ original, por lo tanto no se recomienda su uso18,54,55.
Apéndice 2. Health Assessment Questionnaire (HAQ)

La “mínima diferencia clínicamente importante” puede variar entre diferentes enfermedades y fue definida como 0,35 para la APs26,56.
Referencias
1. National Institute for health and clinical excellence. The management of rheumatoid artrhritis in adults. 2009. http://www.nice.org.uk/guidance/cg79
2. Smolen JS, Breedveld FC, Burmester GR, Bykerk V, Dougados M, Emery P, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016; 1(75):3-15.
3. Smolen J, Braun J, Dougados M, Emery P, Fitzgerald O, Helliwell P, et al. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: Recommendations of an international Task force. Ann Rheum Dis 2014; 1(73):6-16.
4. Smolen JS, et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 recommendations by an international task force. Ann Rheum Dis 2018; 77:3-17.
5. Gossec L, Smolen JS, Ramiro S, de Wit M, Cutolo M, Dougados M, et al. European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 3(75):499-510.
6. Coates L, Kavanaugh A, Mease P, Soriano E, Acosta-Felquer ML, Armstrong AW, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015. Treatment recommendations for psoriatic arthritis. Arthritis Rheumatol 2016; 5(68):1060-71.
7. Coates L, Moverley A, McParland L, Brown S, Navarro-Coy N, O’Dwyer, et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): a UK multicentre, open-label, randomised controlled trial. Lancet 2015; 386(10012):2489-98.
8. Coates L, Navarro-Coy N, Brown SR, Brown S, McParland L, Collier H, et al. The TICOPA protocol (Tight Control of Psoriatic Arthritis): a randomised controlled trial to compare intensive management versus standard care in early psoriatic arthritis. BMC Musculoskelet Disord 2013; (14):101.
9. Coates L, Helliwell PS. Treating to target in Psoriatic arthritis: How to implement in Clinical practice. Ann Rheum Dis 2016; 4(75):640-3.
10. Wells GA, Boers M, Shea B, Brooks PM, Simon LS, Strand CV, et al. Minimal disease activity for rheumatoid arthritis: a preliminary definition. J Rheumatol 2005; 10(32):2016-24.
11. Coates LC, Fransen J, Helliwell PS. Defining minimal disease activity in psoriatic arthritis: a proposed objective target for treatment. Ann Rheum Dis 2010;1(69):48-53.
12. Coates LC, Cook R, Lee KA, Chandran V, Gladman DD. Frequency, predictors and prognosis of sustained minimal disease activity in an observational psoriatic arthritis cohort. Arthritis Care Res (Hoboken) 2010;7(62):970-6.
13. Coates LC, Helliwell PS. Validation of Minimal Disease Activity criteria for psoriatic arthritis using Intervencional Trial data. Arthritis Care Res (Hoboken) 2010;7(62):965-9.
14. Mease PJ, Heckaman M, Kary S, Kupper H. Application and modifications of Minimal Disease Activity Measures for patients with Psoriatic arthritis treated with Adalimumab: Subanalyses of ADEPT. J Rheumatol 2013; 5(40):647-52.
15. Cauli A, Gladman DD, Mathieu A, Olivieri I, Porru G, Tak PP, et al. Patient Global Assessment in Psoriatic Arthritis: A Multicenter GRAPPA and OMERACT Study. J Rheumatol 2011;5(38):898-903.
16. Mease PJ, Antoni CE, Gladman DD, Taylor WJ. Psoriatic arthritis assessment tools in clinical trials. Ann Rheum Dis 2005; Suppl 2(64):49-54.
17. Gladman DD, Mease PJ, Strand V, Healy P, Helliwell PS, et al. Consensus on a core set of domains for psoriatic arthritis. J Rheumatol 2007; 34:1167-70.
18. Mease PJ. Measures of psoriatic Arthritis. Arthritis Care Res (Hoboken). 2011;(63)Suppl 11:64-85.
19. Actualización de las Guías de Práctica Clínica en el tratamiento de la Artritis Reumatoidea. Grupo de estudio de Artritis Reumatoidea. Sociedad Argentina de Reumatología. Rev Arg Reumatol 2013.
20. Lubrano E, Perrotta FM, Parsons WJ, Marchesoni A. Patients Global assessment as an outcome measure for Psoriatic Arthritis in clinical practice: A surrogate for measuring Low disease activity?. J Rheumatol 2015;12(42):2332-8.
21. Gallino Yanzi J, Cerda OL, Landi M, Zaffarana C, Schneeberger E, Citera G. Concordance between patient and physician global assessment of the disease in patients with psoriatic arthritis [abstract]. Arthritis Rheumatol 2016; 68 Suppl 10: Abstract 2750.
22. Mander M, Simpson JM, McLellan A, Walker D, Goodacre JA, Dick WC. Studies with an enthesis index as a method of clinical assessment in ankylosing spondylitis. Ann Rheum Dis 1987;3(46):197-202.
23. Heuft-Dorenbosch L, Spoorenberg A, van Tubergen A, Landewé R, van der Tempel H, Mielants H, et al. Assessment of enthesitis in ankylosing spondylitis. Ann Rheum Dis 2003;2(62):127-32.
24. Kavanaugh A, Mease P. Treatment of Psoriatic Arthritis with Tumor Necrosis Factor Inhibitors: Longer-term Outcomes Including Enthesitis and Dactylitis with Golimumab Treatment in the Longterm Extension of a Randomized, Placebo-controlled Study (GO-REVEAL). J Rheumatol 2012; Suppl 89(39):90-3.
25. Maksymowych WP, Mallon C, Morrow S, Shojania K, Olszynski WP, Wong RL, et al. Development and validation of the Spondyloarthritis Research Consortium of Canadá (SPARCC) Enthesitis Index. Ann Rheum Dis 2009; 6(68):948-53.
26. Coates L. Outcome measures in psoriatic arthritis. Rheum Dis Clin North Am 2015; 41(4):699-710.
27. Healy PJ, Helliwell PS. Measuring clinical Enthesitis in Psoriatic arthritis: Assessment of existing measures and development of an instrument specific to psoriatic arthritis. Arthritis Rheum 2008;5(59):686-91.
28. Coates LC, Helliwell PS. Disease measurement – enthesitis, skin, nails, spine and dactylitis. Best Pract Res Clin Rheumatol 2010;24(5):659-70.
29. Helliwell PS, Firth J, Ibrahim GH, Melsom RD, Shah I, Turner D. Development of an Assessment Tool for Dactylitis in Patients with Psoriatic Arthritis. J Rheumatol 2005;9(32):1745-50.
30. Healy PJ, Helliwell PS. Measuring Dactylitis in Clinical Trials: Which Is the Best Instrument to use?. J Rheumatol 2007;6(34):1302-6.
31. Clegg DO, Reda DJ, Mejías E, Cannon GW, Weisman MH, Taylor T, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Cooperative Study. Arthritis Rheum 1996; 39(12):2013-20.
32. Mumtaz A, Gallagher P. Development of a preliminary composite disease activity index in psoriatic arthritis. Ann Rheum Dis 2011;2(70):272-7.
33. Schoels MM, Aletaha D, Alasti F, Smolen JS. Disease activity in psoriatic arthritis (PsA): Defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2016;5(75):811-8.
34. Coates LC, FitzGerald O, Gladman DD, McHugh N, Mease P, Strand V, et al. On behalf of the GRACE collaboration. Reduced joint counts misclassify patients with oligoarticular psoriatic arthritis and miss significant numbers of patients with active disease. Arthritis Rheum 2013;6(65):1504-9.
35. FitzGerald O, Helliwell P, Mease P, Mumtaz A, Coates L, Pedersen R, et al. Application of composite disease activity scores in psoriatic arthritis to the PRESTA data set. Ann Rheum Dis 2012; 3(71):358-62.
36. Acosta Felquer ML, Elmamoun M, Szentpetery A, Gallagher P, Soriano ER, FitzGerald O. Composite Psoriatic Disease Activity Index (CPDAI), defining Remission and Disease Activity States using Data from Daily Clinical Practice. [Abstract]. Arthritis Rheumatol 2016; 68 Suppl 10: Abstract 1723.
37. Helliwell PS, FitzGerald O, Fransen J, Gladman DD, Kreuger GG, Callis-Duffin K, et al. The development of candidate composite disease activity and responder indices for psoriatic arthritis (GRACE project). Ann Rheum Dis 2013; 6(72):986-91.
38. Gladman DD; ACCLAIM Study Investigators, Sampalis JS, Illouz O, Guérette B. Responses to Adalimumab in patients with active psoriatic arthritis who have not adequately responded to prior therapy: Effectiveness and safety results from an open-label study. J Rheumatol 2010;9(37):1898-906.
39. Gladman DD, Mease PJ, Healy PJ, Helliwell PS, Fitzgerald O, Cauli A. Outcome Measures in Psoriatic Arthritis. J Rheumatol 2007; 5(34):1159-66.
40. Mease PJ, Goffe BS, Metz J, VanderStoep A, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial. Lancet 2000; 9227(356):385-90.
41. Fransen J, Antoni C, Mease PJ, Uter W, Kavanaugh A, Kalden JR, et al. Performance of response criteria for assessing peripheral arthritis in patients with psoriatic arthritis: analysis of data from randomised controlled trials of two tumor necrosis factor inhibitors. Ann Rheum Dis 2006; 10(65):1373-8.
42. Gladman DD, Tom BD, Mease PJ, Farewell VT. Informing Response Criteria for Psoriatic Arthritis. I: Discrimination Models Based on Data from 3 Anti-Tumor Necrosis Factor Randomized Studies. J Rheumatol 2010; 9(37):1892-7.
43. Coates LC, Helliwell P. Defining low disease activity states in Psoriatic Arthritis using novel composite disease instruments. J Rheumatol 2016; 2(43):371-5.
44. Salaffi F, Ciapetti A, Carotti M, Gasparini S, Gutiérrez M. Disease activity in psoriatic arthritis: Comparison of the discriminative capacity and construct validity of six composite indices in a real world. Biomed Res Int 2014; 528105.
45. Helliwell PS, Kavanaugh A. Comparison of Composite Measures of Disease Activity in Psoriatic Arthritis using Data from an Interventional Study with Golimumab. Arthritis Care Res (Hoboken)2014;5(66):749-56.
46. Eberl G, Studnicka-Benke A, Hitzelhammer H, Gschnait F, Smolen JS. Development of a disease activity index for the assessment of Reactive arthritis (DAREA). Rheumatology (Oxford) 2000;2(39):148-55.
47. Smolen JS, Schoels M, Aletaha D. Disease activity and response assessment in psoriatic arthritis using the Disease activity index for Psoriatic arthritis (DAPSA). A brief review. Clin Exp Rheumatol 2015; Suppl 5(33):48-50.
48. Gallino Yanzi J, Schneeberger EE, Cerda O, Zaffarana CA. Construct validity of (Disease Activity for Psoriatic Arthritis) Composite Index and Tentative Cut-Off Values in a cohort of patients with psoriatic arthritis. Arthritis Rheum 2015; 67:Suppl 10.
49. Coronel Ale AL, Zaffarana CA, Cerda OL, Schneeberger EE, Landi M, Citera G. El DAPSA-ERS es una medida alternativa para medir actividad articular de la enfermedad en pacientes con artritis psoriásica: desarrollo, validación y estimación de sus valores corte. Rev Arg Reumatol 2016; 27 (Supl esp):29.
50. Helliwell PS, Coates L. The definition of remission in psoriatic arthritis: can this be accurate without assessment of multiple domains?. Ann Rheum Dis 2015; 12(74):66-7.
51. Tälli S, Etcheto A, Fautrel B, Balanescu A, Braun J, Cañete JD, et al. Patient global assessment in psoriatic arthritis - What does it mean?. An analysis of 223 patients from the psoriatic arthritis impact of disease (PsAID) study. Joint Bone Spine 2016;3(83):335-40.
52. Gossec L, de Wit M, Kiltz U, Braun J, Kalyoncu U, Scrivo R, et al. On behalf of the EULAR PsAID Taskforce. A patient-derived and patient-reported outcome measure for assessing psoriatic arthritis: elaboration and preliminary validation of the Psoriatic Arthritis Impact of Disease (PsAID) questionnaire, a 13-country EULAR initiative. Ann Rheum Dis 2014; 6(73):1012-9.
53. Citera G, Arriola MS, Maldonado-Cocco JA, Rosemffett MM, Sánchez MM, Goñi MA, et al. Validation and crosscultural adaptation of an argentine spanish version of the health assessment questionnaire disability index. J Clin Rheumatol 2004; 3(10):110-5.
54. Blackmore MG, Gladman DD, Husted J, Long JA, Farewell VT. Measuring health status in psoriatic arthritis: the Health Assessment Questionnaire and its modification. J Rheumatol 1995; 5(22):886-93.
55. Husted JA, Gladman DD, Long JA, Farewell VT. A modified version of the Health Assessment Questionnaire (HAQ) for psoriatic arthritis. Clin Exp Rheumatol 1995; 4(13):439-43.
56. Mease PJ, Woolley JM, Bitman B, Wang BC, Globe DR, Singh A. Minimally Important Difference of Health Assessment Questionnaire in Psoriatic Arthritis: Relating Thresholds of Improvement in Functional Ability to Patient-rated Importance and Satisfaction. J Rheumatol 2011; 11(38):2461-5.
Medidas de evaluación del compromiso axial en la Artritis Psoriásica
Rodolfo Pérez Alamino1, Emilce Edith Schneeberger2
1Sección Reumatología, Servicio de Clínica Médica, Hospital Avellaneda, Tucumán
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Manifestaciones clínicas
El compromiso axial en la Artritis Psoriásica (APs) constituye una de las formas de Espondiloartritis axial (EsPax). Frecuentemente se asocia a la presencia de HLA-B27. Asimismo, la frecuencia de la positividad del HLA-B27en APs varía de 40-50%1. La EsPax asociada a APs se distingue de la Espondilitis Anquilosante (EA) pura por la menor preponderancia de sexo masculino, psoriasis más severa y un curso clínico menos severo2-4.
Medidas de evaluación del compromiso axial en Artritis Psoriásica
La evaluación del compromiso axial en la APs se realiza con los mismos instrumentos utilizados para evaluar la EsPax.
Para la valoración de la actividad del compromiso axial se utiliza el cuestionario BASDAI (Bath Ankylosing Spondylitis Disease Activity Index)5, el cual consiste en seis preguntas relacionadas con cinco síntomas importantes de la enfermedad: 1) Fatiga; 2) Dolor musculoesquelético axial (columna, pelvis, cintura escapular y pelviana); 3) Dolor y/o tumefacción articular; 4) Molestias en cualquier área dolorosa a la palpación o presión y 5) Grado de rigidez matinal y 6) Duración de la misma. El paciente debe dar un valor promedio sobre cada uno de los ítems descriptos, marcando en una escala visual numérica (EVN) de 0 a 10. El resultado final surge del promedio de la pregunta Nº 5 y 6 por separado y luego se suma este valor a las otras 4 preguntas (Nº 1, 2, 3 y 4) y luego se promedia, es decir se divide por cinco, el puntaje final oscila de 0 a 10. Un valor ≥4 mayor refleja enfermedad activa (Anexo 1). Diferentes estudios han evaluado la validez del uso de BASDAI para pacientes con APs con compromiso axial6-8.
Anexo 1. Cuestionario BASDAI para valoración actividad de compromiso axial5

Para la evaluación del grado de discapacidad funcional se utiliza el cuestionario BASFI (Bath Ankylosing Spondylitis Functional Index)9, el cual mide la capacidad funcional mediante 10 preguntas que se responden a través de una EVN de 10 cm que va desde 0 (sin dificultad) a 10 (imposible de realizar). Las ocho primeras son relativas a actividades de capacidad física del paciente y las dos restantes a actividades de la vida diaria. El cálculo de este cuestionario se realiza a través del promedio de las 10 preguntas y el resultado va de 0 a 10, a mayor puntaje mayor discapacidad funcional (Anexo 2). Tanto el BASDAI como el BASFI han sido adaptados al español y validados para su uso en América Latina10.
Anexo 2. Cuestionario BASFI para valoración capacidad funcional9

Para la evaluación de la movilidad espinal se utiliza el BASMI (Bath Ankylosing Spondylitis Metrology Index)11. Este índice considera 5 medidas: la extensión cervical mediante la distancia tragus-pared, la flexión lumbar por prueba de Schober, la rotación cervical mediante goniómetro, la flexión lumbar lateral y la abducción bilateral de caderas a través de la distancia intermaleolar. A cada medida se le aplica una fórmula aritmética que la lleva a un rango de 0 a 10 y luego se promedian los valores de las 5 medidas. El puntaje final va de 0 a 10, los valores mayores reflejan mayor limitación en la movilidad axial.
En los últimos años se desarrolló un índice compuesto para medir la actividad de la enfermedad, llamado ASDAS (Ankylosing Spondylitis Disease Activity Score)12, la cual a diferencia del BASDAI, incluye datos objetivos del laboratorio. El ASDAS incluye la valoración de 4 dominios clínicos referidos por el paciente: pregunta Nº2 del BASDAI sobre dolor lumbar (0-10), pregunta Nº 3 del BASDAI sobre dolor/inflamación en articulaciones periféricas (0-10), pregunta Nº 6 del BASDAI sobre duración de rigidez matinal (0-10), evaluación global de la enfermedad por el paciente (0-10) y medición de reactantes de fase aguda (ERS en mm/h o PCR mg/dl). Los puntos de corte para ASDAS son: enfermedad inactiva (<1,3); actividad moderada (1,3-2,1); actividad alta (2,1-3,5); actividad muy alta (>3,5). Se considera una mejoría clínicamente importante una diferencia ≥1,1 y gran mejoría ≥2. Dos estudios recientes compararon la capacidad discriminativa del ASDAS y BASDAI en un grupo de pacientes con APs axial, teniendo ambos instrumentos una similar capacidad discriminativa en la valoración de actividad de enfermedad13,14.
Una versión simplificada del ASDAS (SASDAS-Simplified Ankylosing Spondylitis Disease Activity Score) fue desarrollada y validada recientemente por el grupo del IREP. El cálculo del mismo se realiza con la simple suma de los 5 componentes del ASDAS. Existen dos versiones, el SASDAS-ERS que considera el valor de la ERS dividido 10 y el SASDAS-PCR que incluye el valor de la PCR en mg/dl. Los valores de corte difieren, para el SASDAS-ERS son: enfermedad inactiva (<7,9), actividad moderada (7,9-13,9), actividad alta (13,9-27,6) y actividad muy alta (>27,6). Para el SASDAS-PCR son: enfermedad inactiva (<10,5), actividad moderada (10,5-19,1), actividad alta (19,1-36) y para actividad muy alta (>36). Ambos índices mostraron una excelente correlación con las diferentes medidas convencionales de evaluación, siendo una herramienta de cálculo fácil que puede ser utilizada en la práctica clínica15,16.
Para la valoración de la calidad de vida en EsPax se utiliza el cuestionario ASQoL (Ankylosing Spondylitis Quality of Life)17, el cual consta de 18 afirmaciones sobre el estado de salud de los pacientes que se responden en forma dicotómica por SI o NO. A las respuestas afirmativas se les otorga un punto y el cálculo se realiza a través de la sumatoria de dichos puntos. El resultado final va de 0 a 18, un mayor puntaje indica peor calidad de vida (Anexo 3). El ASQoL fue adaptado y validado para su uso en nuestro país, a partir de un estudio sobre discapacidad laboral en pacientes argentinos con EA18.
Anexo 3. Cuestionario ASQoL para valoración calidad de vida17

A fin de evaluar la respuesta de la actividad de la enfermedad al tratamiento, el grupo ASAS (Ankylosing Spondylitis Assessment Society) desarrolló criterios de respuesta terapéutica como medidas de mejoría, especialmente para uso en ensayos clínicos19. Se han establecido criterios de mejoría ASAS 20, ASAS 40, ASAS 5/6 y ASAS remisión parcial20. (Tabla 9)
Tabla 9. Criterios de respuesta ASAS20

Imágenes en APs con compromiso axial
La radiografía convencional sigue siendo considerada como el gold standard para la identificación de elementos que distinguen la APs de otras entidades inflamatorias y/o degenerativas. El compromiso radiológico del dominio axial en la APs tiene algunos patrones distintivos que la diferencian de la EA pura, como ser: sacroileítis asimétrica, presencia de sindesmofitos no marginales y asimétricos, y frecuente compromiso de columna cervical21-23. Incluso la distribución del compromiso en columna difiere de la observada en EA, en la cual la progresión de sindesmofitos desde columna lumbar a cervical es la regla, mientras que en la APs la distribución puede ser saltatoria24.
Hasta recientemente, ningún instrumento había sido validado para la valoración radiológica de la AxAPs. Dos índices radiológicos utilizados para la evaluación del compromiso espinal en EA fueron validados para su uso en APs25: el BASRI (Bath Ankylosing Spondylitis Radiology Index)26 y el m-SASSS (modified Stoke Ankylosing Spondylitis Spine Score)27. El BASRI combina modificaciones radiológicas a nivel de columna (incluyendo sacroilíacas, columna lumbar y cervical) y caderas (Tabla 10). El m-SASSS evalúa la columna cervical (desde borde inferior de C2 a borde superior de T1) y la columna lumbar (desde borde inferior de T12 a borde superior de S1) en radiografías de perfil. A cada esquina vertebral evaluada se le asigna grados que van de 0 a 3 (0=normal; 1=erosión, esclerosis o cuadratura; 2=sindesmofitos sin puente; 3=sindesmofitos con puente óseo). El rango total surge de la sumatoria de los puntos asignados y va de 0 a 7227. Sin embargo, ambos índices tienen limitaciones para el uso en la práctica diaria. Además, no incluyen la valoración de las articulaciones zigo-apofisarias a nivel cervical posterior, región frecuentemente afectada en estos pacientes. Ante estas limitaciones, dos nuevos índices fueron desarrollados para la valoración radiológica de APs con compromiso axial: el índice PASRI (PsA Spondylitis Radiology Index)28 y el RASSS (Radiographic Ankylosing Spondylitis Spinal Score)29. El índice PASRI permite valorar en forma más global las características radiológicas del esqueleto axial en APs, evaluando además el compromiso cervical posterior (desde el borde inferior de C2 al borde superior de C6), agregando 1 punto por cada articulación interapofisaria cervical con fusión. El índice RASSS evalúa columna cervical, lumbar y últimas vértebras dorsales en radiografías de perfil (desde borde inferior de C2 a borde superior de T1 y del borde inferior de T10 a borde superior de S1), utilizando el mismo sistema de puntaje que el mSASSS (de 0 a 3). Las diferencias radican en que las erosiones no son evaluadas y la cuadratura es evaluada solo para columna dorsal y lumbar29. (Tabla 11) Ambos son instrumentos válidos, que han demostrado una buena correlación con medidas antropométricas y de escalas de valoración de pacientes.
Tabla 10. Índice radiográfico BASRI26

Tabla 11. Índice radiográfico PASRI28

Un estudio que comparó todos estos índices radiológicos mostró que el PASRI sería superior para la evaluación del daño estructural en AxAPs30.
En los últimos años se ha destacado el rol de la Resonancia Magnética (RM) con técnica de STIR sin uso de gadolinio, para el diagnóstico y la evaluación de los pacientes con EsPax y la detección precoz de sacroileítis radiológica31,32.
Los pacientes con EsPax presentan un riesgo incrementado de osteoporosis y fracturas vertebrales33. Por dicho motivo, se recomienda una correcta evaluación de la densidad mineral ósea (DMO) por medio de la densitometría ósea. En pacientes con EsPax sin sindesmofitos en columna lumbar, la evaluación de la DMO debe ser evaluada en región lumbar y cadera y en aquellos pacientes con sindesmofitos en columna lumbar, la evaluación de la DMO debe realizarse sólo en caderas34.
Diagnóstico de EsPax asociada a APs
Aunque en la APs con compromiso axial la lumbalgia inflamatoria y la limitación de la movilidad espinal suelen ser menos severas que en la EA, continúan siendo los síntomas cardinales para el diagnóstico de EsPax. Los criterios de New York modificados son útiles para el diagnóstico de enfermedad establecida, los cuales requieren de síntomas y/o signos de compromiso de la columna vertebral y evidencias radiológicas de sacroileítis de grado 2 o mayor35. Para el diagnóstico de EA se requiere la presencia de sacroileítis grado 2 bilateral o grado 3 ó 4 unilateral en radiografías simples y la presencia de al menos un criterio clínico (Tabla 12). Los criterios de Nueva York tienen la desventaja de no detectar enfermedad temprana, cuando aún no hay cambios radiológicos. Por dicho motivo, el grupo ASAS desarrolló nuevos criterios de clasificación para las EsPax que son útiles en pacientes con sospecha clínica que aún no tiene signos radiológicos característicos, incluyendo como criterios adicionales la sacroileítis por MRI y la presencia del HLA-B2731. (Tabla 13)
Tabla 12. Criterios de New York modificados35

Tabla 13. Criterios de clasificación ASAS para EsPax (en pacientes con dolor lumbar >3 meses y edad de comienzo <45 años)31

Referencias
1. Gladman DD. Axial disease in psoriatic arthritis. Curr Rheumatol Rep 2007;9(6):455-460.
2. Lubrano E, Spadaro A. Axial psoriatic arthritis: an intriguing clinical entity or a subset of an intriguing disease?. Clin Rheumatol 2012;31(7):1027-32.
3. Pérez-Alamino R, Maldonado-Cocco JA, Citera G, Arturi P, Vázquez-Mellado J, Sampaio-Barros P, et al. Differential features between primary ankylosing spondylitis and spondylitis associated with psoriasis and inflammatory bowel disease. J Rheumatol 2011;38(8):1656-60.
4. Busquets-Pérez N, Rodríguez-Moreno J, Gómez-Vaquero C, Nolla-Solé JM. Relationship between psoriatic arthritis and moderate-severe psoriasis: analysis of a series of 166 psoriatic arthritis patients selected from a hospital population. Clin Rheumatol 2012;31(1):139-43.
5. Garrett S, Jenkinson T, Kennedy LG, Whitelock H, Gaisford P, Calin A. A new approach to defining disease status in ankylosing spondylitis: the Bath Ankylosing Spondylitis Disease Activity Index. J Rheumatol 1994; 21(12):2286-91.
6. Fernández-Sueiro JL, Willisch A, Pértega-Diaz S, Tasende J, Fernandez-Lopez C, Galdo F, et al. Evaluation of ankylosing spondylitis spinal mobility measurements in the assessment of spinal involvement in psoriatic arthritis. Arthritis Rheum 2009;61(3):386-92.
7. Fernández-Sueiro JL, Willisch A, Pértega-Diaz S, Tasende J, Fernández-López JC, Villar NO, et al. Validity of the Bath Ankylosing Spondylitis Disease Activity in Axial Psoriatic Arthritis. Arthritis Care Res 2010;62(1):78-85.
8. Taylor WJ, Harrison AA. Could the Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) be a valid measure of disease activity in patients with psoriatic arthritis?. Arthritis Rheum 2004;51(3):311-5.
9. Calin A, Garret S, Whitelock H, Kennedy L, O´Hea J, Mallorie P, et al. A new approach to defining functional ability in ankylosing spondylitis: the development of the Bath Ankylosing Spondylitis Functional Index. J Rheumatol 1994;21(12):2281-5.
10. Citera G, Maldonado Cocco J, Moroldo M, Burgos-Vargas R, Anaya J, López I, et al. Validación de la versión en español de los cuestionarios de capacidad funcional (BASFI) y actividad de la enfermedad (BASDAI) en pacientes con Espondilitis Anquilosante en cuatro países latinoamericanos. Rev Argent Reumatol 1999; 10 (Supl 1):25 [abstract].
11. Jenkinson T, Mallorie P, Whitelock H, Kennedy L, Garrett S, Calin A. Defining spinal mobility in ankylosing spondylitis. The Bath Ankylosing Spondylitis Metrology Index. J Rheumatol 1994;21(9):1694-8.
12. Lukas C, Landewé R, Sieper J, Dougados M, Davis J, Braun J, et al. Development of an ASAS-endorsed disease activity score (ASDAS) in patients with ankylosing spondylitis. Ann Rheum Dis 2009;68(1):18-24.
13. Eder L, Chandran V, Shen H, Cook R, Gladman D. Is ASDAS better than BASDAI as a measure of disease activity in axial psoriatic arthritis?. Ann Rheum Dis 2010;69(12):2160.
14. Kilic G, Kilic E, Nas K, Karkucak M, Capkin E, Dagli A, et al. Comparison of ASDAS and BASDAI as measure of disease activity in axial psoriatic arthritis. Clin Rheumatol 2015;34(3):515-21.
15. Sommerfleck F, Schneeberger E, Buschiazzo E, Maldonado-Cocco J, Citera G. A simplified version of Ankylosing Spondylitis Disease Activity Score in patients with ankylosing spondylitis. Clin Rheumatol 2012; 31(11):1599-603.
16. Schneeberger EE, Zamora N, Citera G. SASDAS (Simplified version of ankylosing spondylitis disease activity score)-ESR performance and development of SASDAS-CRP and their agreement with ASDAS-ESR and ASDAS-CRP in patients with ankylosing spondylitis. Clin Rheumatol 2016;35(11):2865-6.
17. Doward L, Spoorenberg A, Cook S, Whalley D, Helliwell P, Kay L, et al. Development of the ASQoL: a quality of life instrument specific to ankylosing spondylitis. Ann Rheum Dis 2003;62(1):20-6.
18. Marengo MF, Schneeberger E, Citera G, Maldonado-Cocco J. Work status among patients with ankylosing spondylitis in Argentina. J Clin Rheumatol 2008;14(5):273-7.
19. Anderson J, Baron G, van der Heijde D, Felson D, Dougados M. Ankylosing spondylitis assessment group preliminary definition of short-term improvement in ankylosing spondylitis. Arthritis Rheum 2001; 44(8):1876-86.
20. Sieper J, Rudwaleit M, Baraliakos X, Brandt J, Braun J, Burgos-Vargas R, et al. The Assessment of SpondyloArthritis International Society (ASAS) handbook: a guide to assess spondyloarthritis. Ann Rheum Dis 2009; 68(Suppl II):ii1-ii44.
21. Baraliakos X, Coates L, Braun J. The involvement of the spine in psoriatic arthritis. Clin Exp Rheumatol 2015;33(Suppl 93):S31-S35.
22. Lubrano E, Marchesoni A, Olivieri I, D´Angelo S, Palazzi C, Scarpa R, et al. The radiologic assessment of axial involvement in psoriatic arthritis. J Rheumatol 2012;89 Suppl:54-56.
23. Lubrano E, Parsons W, Marchesoni A, Olivieri I, D´Angelo S, Cauli A, et al. The definition and measurement of axial psoriatic arthritis. J Rheumatol 2015;93 Suppl:40-2.
24. Helliwell PS, Hickling P, Wright V. Do the radiological changes of classic ankylosing differ from the changes found in the spondylitis associated with inflammatory bowel diseases, psoriasis, and reactive arthritis?. Ann Rheum Dis 1998;57(3):135-40.
25. Lubrano E, Marchesoni A, Olivieri I, D´Angelo S, Spadaro A, Parsons W, et al. The radiological assessment of axial involvement in psoriatic arthritis: a validation study of the BASRI total and the modified SASSS scoring system. Clin Exp Rheumatol 2009;27(6):977-80.
26. MacKay K, Mack C, Brophy S, Calin A. The Bath Ankylosing Spondylitis Radiology Index (BASRI): a new, validated approach to disease assessment. Arthritis Rheum 1998;41(12):2263-70.
27. Creemers M, Franssen M, van´t Hof M, Gribnau F, van de Putte L, van Riel P. Assessment of outcome in ankylosing spondylitis: an extended radiographic scoring system. Ann Rheum Dis 2005;64(1):127-9.
28. Lubrano E, Marchesoni A, Olivieri I, D´Angelo S, Spadaro A, Parsons W, et al. Psoriatic arthritis spondylitis radiology index: a modified index for radiological assessment of axial involvement in psoriatic arthritis. J Rheumatol 2009;36(5):1006-11.
29. Baraliakos X, Listing J, Rudwaleit M, Sieper J, Braun J. Development of a radiographic scoring tool for ankylosing spondylitis only based on bone formation: addition of the thoracic spine improves sensitivity to change. Arthritis Rheum 2009;61(6):764-71.
30. Biagioni BJ, Gladman DD, Cook RJ, Eder L, Wakhlu A, Shen H, et al. Reliability of radiographic scoring methods in axial psoriatic arthritis. Arthritis Care Res 2014;66(9):1417-22.
31. Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, et al. The development of Assessment of SpondyloArthritis International Society (ASAS) classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis 2009;68(6):777-83.
32. Rudwaleit M, Jurik A, Hermann KG, Landewé R, van der Heijde D, Baraliakos X, et al. Defining active sacroiliitis on magnetic resonance imaging (MRI) for classification of axial spondyloarthritis: a consensual approach by the ASAS/OMERACT MRI group. Ann Rheum Dis 2009;68(10):1520-7.
33. Klingberg E, Lorentzon M, Mellström D, Geijer M, Göthlin J, Hilme E, et al. Osteoporosis in ankylosing spondylitis-prevalence, risk factors and methods of assessment. Arthritis Res Ther 2012;14:R108.
34. Mandl P, Navarro-Compán V, Terslev V, Aegerter P, van der Heijde D, D´Agostino M, et al. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015; 74(7):1327-39.
35. van der Linden S, Valkenburg HA, Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis Rheum 1984; 27(4):361-8.
Otras medidas de evaluación en Artritis Psoriásica: calidad de vida, fatiga, depresión y ansiedad
Adrián Salas1, Emilce Edith Schneeberger2
1Servicio Reumatología, Hospital San Martín, La Plata
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
Calidad de vida
Tanto la Psoriasis (Ps) como la Artritis Psoriásica (APs) generan un impacto en la calidad de vida para los individuos que las padecen. Algunos estudios muestran peor calidad de vida en los pacientes con APs comparados con los pacientes con Ps1,2.
Algunas comorbilidades como la fibromialgia, trastornos neurológicos, la obesidad, la depresión y la ansiedad, pueden colaborar con el deterioro de la calidad de vida de estos pacientes3.
La determinación de la calidad de vida relacionada con la salud (Health Related Quality of Life), consta de seis aspectos o dimensiones a considerar: social, físico, cognitivo, movilidad, cuidado personal y bienestar emocional4.
Para la evaluación de calidad de vida se pueden utilizar cuestionarios genéricos o específicos. Estos cuestionarios sirven para objetivar los beneficios en la salud producido por los tratamientos, evaluar costos de salud y comprometer al paciente en el cuidado de su salud.
Cuestionarios genéricos
El “Medical Outcome Study 36 - item Short Form Health Survey” o SF-36 fue diseñado para evaluar el estado funcional de la salud y el bienestar en distintas poblaciones y circunstancias de la atención de la salud. Está constituido por 35 ítems puntuables que evalúan 8 dimensiones: función física, dolor, vitalidad, funcionamiento social, salud mental, percepción general de la salud, limitaciones en rol por problemas físicos y limitaciones en rol por problemas emocionales, con un ítem adicional que evalúa el cambio de la salud en el tiempo5. Las puntuaciones de cada una de las 8 dimensiones del SF-36 oscilan entre los valores 0 y 100. Siendo 100 un resultado que indica una salud óptima y 0 reflejaría un estado de salud muy malo. Su utilización ha sido validada en APs6. Se encuentra disponible previo abono de licencia en http://www.qualitymetric.com
El EuroQoL-5 (EQ-5D) fue creado por el grupo EULAR para determinar calidad de vida. Define la salud en términos de movilidad, autocuidado, desempeño en actividades generales, dolor/incomodidad y ansiedad/depresión7. También requiere de licencia.
Cuestionarios específicos
El cuestionario PsAQoL (Psoriatic Arthritis Quality of Life) es el primero desarrollado específicamente para evaluar la calidad de vida en pacientes con APs. Es válido, reproducible y sensible al cambio8-10. Este cuestionario fue adaptado culturalmente en Argentina y posteriormente validado en una cohorte de pacientes con APs10. Consta de 20 preguntas con respuestas dicotómicas sí/no. Se suman las respuestas positivas, y el rango es de 0 a 20. A mayor número de repuestas positivas, peor calidad de vida.
Vitacora-19 es un cuestionario específico para evaluar calidad de vida en pacientes con APs. Fue desarrollado en España11. Consta de 19 preguntas, que otorgan puntaje de 1 a 5 de acuerdo a si la condición ha estado presente siempre, muy frecuentemente, ocasionalmente, rara vez o nunca. Requiere más estudios.
Referencias
1. Truong B, Riche-Garg N, Ehst BD, Deohdar A, Ku J, Vakil-Gilani K, et al . Demographics, clinical disease characteristics, and quality of life in a large cohort of psoriasis patients with and without psoriatic arthritis. Clin Cosmet Investig Dermatol 2015:(8):563-9.
2. Rosen CF, Mussani F, Chandran V, Eder L, Thavaneswaran A, Gladman DD. Patients with psoriatic arthritis have worse quality of life than those with psoriasis alone. Rheumatology 2012; 51(3):571-6.
3. Ciocon DH, Horn EJ, Kimball AB. Quality of life and treatment satisfaction among patients with psoriasis and psoriatic arthritis and patients with psoriasis only: results of the 2005 Spring US National Psoriasis Foundation Survey. Am J Clin Dermatol 2008;9(2):111-7.
4. Naughton MJ, Shumaker SA. The case for domains of function in quality of life assessment. Qual Life Res 2003;12(Suppl 1):73-80.
5. Ware JE, Sherbourne CD. The MOS 36-item short form Health Survey (SF-36). Conceptual framework and item selection. Med Care 1992;30(6):473-83.
6. Husted JA, Gladman DD, Farewell VT. Validating the SF-36 health survey questionnaire in patients with psoriatic arthritis. J Rheumatol 1997;24(3):511-7.
7. Rabin R, de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med 2001;33(5):337-43.
8. McKenna SP, Doward LC, Whalley D, Tennant A, Emery P, Veale DJ. Development of the PsAQoL: a quality of life instrument specific to psoriatic arthritis. Ann Rheum Dis 2004;63(2):162-9.
9. Cazenave T, Citera G, Maldonado Cocco JA. Rev Arg Reumatol 2011;22(2):42-50.
10. Healy PJ, Helliwell PS. Psoriatic Arthritis Quality of Life Instrument: An Assessment of Sensitivity and Response to Change. J Rheumatol 2008;35(7):1359-61.
11. Torre-Alonso JC, Gratacós J, Rey-Rey JS, Valdazo de Diego JP, Urriticoechea-Arana A, Daudén E, et al. Development and Validation of a New Instrument to Measure Health-related Quality of Life in Patients with Psoriatic Arthritis: The VITACORA-19. J Rheumatol 2014; 41(10):2008-17.
Fatiga
La fatiga es definida como una sensación abrumadora de agotamiento y disminución de la capacidad para el trabajo físico y mental. Este síntoma es reconocido cada vez con mayor frecuencia como un problema en pacientes con artropatías inflamatorias, entre ellas la APs1. Su prevalencia estudiada en APs va desde 50 a 100% de los pacientes, pudiendo ser severa hasta en el 26,2% de los casos2,3.
En diferentes estudios la presencia de fatiga se ha asociado tanto a factores relacionados a la enfermedad (severidad de la Ps, número de articulaciones dolorosas y entesitis) como a factores demográficos (años de educación, sexo femenino, pérdida de la capacidad laboral)3,4.
Existen sólo cuestionarios genéricos para medirla, y los cuestionarios que fueron probados en APs son el FSS y el FACIT-F.5-7 Otra forma de medirla es a través de una escala visual graduada8.
Referencias
1. Coates L. Outcome measures in Psoriatic Arthritis. Rheum Dis Clin North Am 2015; 41(4):699-710.
2. Husted JA, Tom BD, Farewell VT, Gladman D. Longitudinal analysis of fatigue in psoriatic arthritis. J Rheumatol 2010;37(9):1878-84.
3. Walsh J, Mc Fadden M, Morgan M, Sawitzke A, Duffin K, Krueger K, et al. Work productivity loss and fatigue in psoriatic arthritis. J Rheumatol 2014;41(8):1670-4.
4. Gudu T, Etcheto A, de Wit M, Heiberg T, Maccarone M, Balanesco A, et al. Fatigue in psoriatic arthritis – a cross-sectional study of 246 patients from 13 countries. Joint Bone Spine 2016;83(4):439-43.
5. Schentag C, Cichon J, MacKinnon A, Gladman D, Urowitz MB. Validation and normative data for the 0-10-point scale version of the fatigue severity scale (FSS). Arthritis Rheum 2000;3(Suppl):S177.
6. Schentag C, Gladman D. Changes in fatigue in psoriatic arthritis: disease activity of fibromyalgia. Arthritis Rheum 2002;46(Suppl):S177.
7. Chandran V, Bhella S, Schentag C, Gladman D. Functional assessment of chronic illness therapy-fatigue scale is valid in patients with psoriatic arthritis. Ann Rheum Dis 2007;66(7):936-9.
8. Gallino Yanzi J, Cerda O, Zaffarana CA, Landi M, Schneeberger EE, Carrillo I, et al. Evaluación de la fatiga en pacientes con artritis psoriásica y su relación con otras variables de la enfermedad. Rev Arg Reumatol 2016; 27(3):16-20.
Depresión y ansiedad
Depresión y ansiedad son comorbilidades frecuentes en pacientes con APs1-6, motivo por el cual se recomienda su evaluación.
La prevalencia de depresión y ansiedad medidas de forma conjunta ha sido evaluada en distintos trabajos con un rango de 7,9 a 29,7%2-6.
En un estudio reciente Mc Donough y col., encontraron prevalencias de depresión del 22,2% y de ansiedad del 36,6%, que fueron significativamente superiores a las encontradas en pacientes con Ps limitada a la piel6.
Tanto la depresión como la ansiedad en APs se asocian a actividad de la enfermedad, discapacidad funcional, fatiga y peor calidad de vida y también al elevado índice de desempleo como consecuencia de la enfermedad. La ansiedad es más frecuente en el sexo femenino, pero también se vincula al desempleo, a la actividad articular periférica, a la discapacidad, fatiga y calidad de vida1-6.
No existen cuestionarios específicos para evaluar ansiedad y depresión en APs. Cuestionarios auto-reportados genéricos han sido utilizados para la evaluación de los pacientes con APs, como el HADS (Hospital Anxiety and Depression Scale)3,7 o el PHQ-9 (Patient Health Questionnaire)2,8.
Referencias
1. Bandinelli F, Prignano F, Bonciani D, Pallanti S, Lotti T, Salaffi F, et al. Clinical and demographic factors influence on anxiety and depression in early psoriatic arthritis (ePsA). Clin Exp Rheumatol 2013;31(2):318-9.
2. Kotsis K, Voulgari PV, Tsifetaki N, Machado MO, Carvalho AF, Creed F, et al. Anxiety and depressive symptoms and illness perceptions in psoriatic arthritis and associations with physical health related quality of life. Arthritis Care Res (Hoboken) 2012;64(10):1593-1601.
3. Freire M, Rodríguez J, Moller I, Valcarcel A, Tornero C, Díaz G, et al. Prevalence of symptoms of anxiety and depression in patients with psoriatic arthritis attending rheumatology clinics [Spanish]. Reumatol Clin 2011;7(1):20-6.
4. Khraishi M, MacDonald D, Rampakakis E, Vaillancourt J, Sampalis JS. Prevalence of patient-reported comorbidities in early and established psoriatic arthritis cohorts. Clin Rheumatol 2011; 30(7):877-85.
5. Husted JA, Thavaneswaran A, Chandran V, Eder L, Rosen CF, Cook RJ, et al. Cardiovascular and other comorbidities in patients with psoriatic arthritis: a comparison with patients with psoriasis. Arthritis Care Res 2011;63(12):1729-35.
6. McDonough E, Ayearst R, Eder L, Chandran V, Rose CF, Thavaneswaran A, et al. Depression and anxiety in psoriatic disease: prevalence and associated factors. J Rheumatol 2014; 41(5):887-96.
7. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand 1983; 67(6):361-70.
8. Kroenke KS, Spitzer L. The PHQ-9: a new depression diagnostic and severity measure. Psychiatr Ann 2002; 32(9):509-15.
Laboratorio en Artritis Psoriásica
Adrián Salas1, Emilce Edith Schneeberger2
1Servicio Reumatología, Hospital San Martín, La Plata
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
La Artritis Psoriásica (APs) es usualmente negativa para Factor Reumatoideo. No existe actualmente ningún anticuerpo específico para el diagnóstico de la enfermedad. Los anticuerpos anti-CCP han sido reportados con baja frecuencia en APs (5,6%-16,7%), y su presencia ha sido asociada a enfermedad poliarticular y erosiva1-5.
Biomarcadores de actividad de enfermedad
• Proteína C reactiva (PCR): Es un reactante de fase aguda (RFA) específico, con baja sensibilidad. Se recomienda su utilización para evaluar actividad de la artritis en estos pacientes. En un estudio se observó correlación entre la PCR y la actividad de la APs6. En otros dos trabajos no logró demostrarse relación entre estos dos parámetros7,8.
• Velocidad de eritrosedimentación (ERS): Es un marcador menos específico, pero más económico. Algunos estudios mostraron su utilidad para evaluar actividad de la artritis7. Se recomienda su utilización para evaluar actividad de la artritis.
• Calprotectina sérica: Es un miembro de las proteínas S100 secretadas por granulocitos, que une calcio y tiene propiedades antibacterianas. Los estudios realizados hasta la fecha fallaron en mostrar relación entre actividad de la artritis y la elevación de la calprotectina sérica6,9. No se recomienda su utilización en la práctica clínica.
Referencias
1. vander Cruyssen B, Hoffman IE, Zmierczak H, Van den Berghe M, Kruithof E, De Rycke L, et al. Anti-citrullinated peptide antibodies may occur in patients with psoriatic arthritis. Ann Rheum Dis 2005; 64(8):1145-9.
2. Korendowych E, Owen P, Ravindran J, Carmichael C, McHugh N. The clinical and genetic associations of anti-cyclic citrullinated peptide antibodies in psoriatic arthritis. Rheumatology (Oxford) 2005; 44(8):1056-60.
3. Bogliolo L, Alpini C, Caporali R, Scirè CA, Moratti R, Montecucco C. Antibodies to cyclic citrullinated peptides in psoriatic arthritis. J Rheumatol 2005; 32(3):511-5.
4. Pérez-Alamino R, García-Valladares I, Cuchacovich R, Iglesias-Gamarra A, Espinoza LR. Are anti-CCP antibodies in psoriatic arthritis patients a biomarker of erosive disease?. Rheumatol Int 2014; 34(9):1211-6.
5. Payet J, Goulvestre C, Bialé L, Avouac J, Wipff J, Job-Deslandre C, et al. Anticyclic citrullinated peptide antibodies in rheumatoid and non rheumatoid rheumatic disorders: experience with 1162 patients. J Rheumatol 2014;41(12):2395-402.
6. Madland TM, Larsen A, Brun JG. S100 proteins calprotectin and S100A12 are related to radiographic changes rather than disease activity in psoriatic arthritis with low disease activity. J Rheumatol 2007; 34(10):2089-92.
7. Helliwell PS, Marchesoni A, Peters M, Platt R, Wright V. Cytidine de aminase activity, C reactive protein, histidine, and erythrocyte sedimentation rate as measures of disease activity in psoriatic arthritis. Ann Rheum Dis 1991;50(6):362-5.
8. Odink K, Cerletti N, Brüggen J, Clerc RG, Tarcsay L, Zwadlo G, et al. Two calcium-binding proteins in infiltrate macrophages of rheumatoid arthritis. Nature 1987; 330(6143):80-2.
9. Hansson C, Eriksson C, Alenius GM. S-calprotectin (S100A8/ S100A9): a potential marker of inflammation in patients with psoriatic arthritis. J Immunol Res 2014; 2014:696415.
Imágenes I: radiografía convencional y resonancia magnética en Artritis Psoriásica
1Sección Reumatología, Servicio de Clínica Médica, Hospital Italiano, Buenos Aires
1) Uso de la Radiografía simple (Rx) en APs
Introducción
La Artritis Psoriásica (APs), alguna vez pensada como una enfermedad reumática benigna, se la considera actualmente como una enfermedad progresiva, en la cual un número sustancial de pacientes pueden desarrollar enfermedad erosiva severa y deformidad articular con daño estructural importante1-4. Los pacientes con afección inicial de tipo poliarticular y quienes han recibido dosis elevadas de medicamentos5,6, están en riesgo de progresar hacia una enfermedad articular deformante. Las radiografías son accesibles, económicas y seguras. La incapacidad de visualizar los tejidos blandos; la proyección bidimensional y la exposición a la radiación, son limitaciones que condujeron al desarrollo de nuevas técnicas de imágenes, tales como el ultrasonido (US) y la resonancia magnética (RM)7. El US con Doppler de poder es especialmente útil para la evaluación del compromiso musculoesquelético (articulaciones, tendones, entesis) y cutáneo (piel, uñas), así como para monitorizar la terapéutica y servir como guía en los procedimientos invasivos (infiltraciones con corticoides)8,9. La RNM ha incrementado su uso debido a la capacidad para permitir un diagnóstico temprano a través de la visualización del proceso inflamatorio a nivel de articulaciones periféricas, compromiso axial y entesis, contribuyendo a definir los distintos patrones de afectación en las espondiloartritis (EsP)10,11. La Tabla 14 muestra información sobre el uso de la radiografía convencional, US y RM en la evaluación y diagnóstico de APs, acorde a las diferentes estructuras comprometidas.
Tabla 14. Estructuras musculoesqueléticas vistas por distintas modalidades de imagen (radiografía convencional, ultrasonido (US) y resonancia nuclear magnética (RNM))

Hallazgos radiográficos en APs
Existen diferentes hallazgos radiográficos en el compromiso axial y periférico de la APs. En el año 2003, Taylor y col. publicaron una revisión sistemática de la literatura para conceptualizar y estandarizar definiciones operacionales de características radiográficas12. (Tabla 15)
Tabla 15. Definiciones operacionales de los principales hallazgos radiográficos en APs

Describiremos a continuación algunas características, acordes a las diferentes localizaciones de compromiso articular:
Manos
• Mineralización normal: una característica típica de la APs es la falta de osteopenia periarticular. En fases tempranas de la enfermedad podría aparecer una osteopenia yuxta-articular transitoria; sin embargo, el restablecimiento de la mineralización normal ocurre en la mayoría de los casos.
• Reducción uniforme del espacio articular: es la expresión radiográfica de la pérdida del cartílago, y puede ser observada en cualquier articulación comprometida; típicamente a nivel de las articulaciones interfalángicas distales (IFD), interfalángicas proximales (IFP), e infrecuentemente a nivel de las metacarpofalángicas (MCF).
• Erosiones: en estadios tempranos ocurren fenómenos erosivos en los márgenes articulares, dando el aspecto en “orejas de ratón”, las cuales son diferentes de las erosiones centrales “en alas de golondrina” (Figura 8) que se presentan en la osteoartritis erosiva (OAE). Las erosiones de la APs progresan en el tiempo y pueden afectar las áreas centrales. Cuando son muy extensas, pueden dañar el hueso subcondral, conduciendo a un ensanchamiento del espacio articular. Las epífisis óseas pueden afinarse, resultando en la típica imagen “en lápiz y copa”. (Figura 9). También, puede haber resorción ósea a nivel de los penachos de las articulaciones distales (acro-osteólisis), casi siempre acompañada de lesiones ungueales severas. Una osteólisis pronunciada puede conducir a la pérdida de la falange completa. La presencia de erosiones y anquilosis en la misma mano, y en ocasiones en un mismo dedo, es un hallazgo único e intrigante propio de la APs7. (Figura 9) El compromiso de articulaciones IFD y la distribución asimétrica también puede ayudar al diagnóstico diferencial con la artritis reumatoidea (AR).

Figura 8. Rx de mano. Erosiones marginales con proliferación ósea a nivel del hueso subcondral en 4° articulación IFD (“erosión en orejas de ratón”) (círculo rojo).

Figura 9. Rx de ambas manos frente. Círculo rojo: tumefacción de partes blandas a nivel de 3° IFP bilateral. Círculo celeste: erosión con reabsorción (imagen “en lápiz y copa”) a nivel de la 2° IFD de mano izquierda. Círculo verde: imagen de anquilosis ósea en 4° IFP bilateral.
• Proliferación ósea: se pueden observar fenómenos de neoformación o sobrecrecimiento óseo adyacente a las erosiones, con una apariencia irregular (de aspecto plumosa o vellosa). La periostitis se puede presentar inicialmente en forma más localizada, con aspecto algodonoso, para luego formar estructuras óseas más sólidas, simulando un agrandamiento de las diáfisis de las falanges.
Pies
• Los hallazgos son similares, aunque con ciertas características particulares. El compromiso de la primer IF del hallux puede provocar un proceso destructivo extenso.
• Un hallazgo característico de APs a nivel del pie es la llamada “falange de marfil”, la cual involucra clásicamente a las falanges distales (especialmente el primer dedo), con esclerosis, entesitis, periostitis, e inflamación de tejidos blandos7. También pueden presentarse fenómenos de luxación y subluxación ósea.
• El compromiso de articulaciones metatarsofalángicas (MTF) es más común que las MCF.
• La erosión del calcáneo y la proliferación ósea ocurren en la inserción posterosuperior del tendón de Aquiles y en el borde inferior por la inserción de la aponeurosis plantar, creando entesofitos gruesos e irregulares.
Otras articulaciones periféricas
• El compromiso del hombro, codo, rodilla y tobillo tiende a ser asimétrico, con cambios erosivos y proliferación ósea adyacente; la pérdida del cartílago es uniforme. Se puede observar proliferación ósea en la inserción del manguito rotador, ligamento coraco-clavicular, tendón patelar, tuberosidad isquiática y trocánter femoral.
• El compromiso de cadera es poco frecuente.
Artritis mutilante
La prevalencia de artritis mutilante (AM) oscila entre el 1,5 y 4,9% (Figura 11). Representa una forma agresiva de artritis, caracterizada por erosiones importantes en pequeñas articulaciones de manos y pies, progresando a daño articular irreversible. Ha sido definida como una osteólisis que afecta el 50% o más de la superficie articular sobre ambos lados de la articulación13. El desarrollo de AM se ha asociado con una mayor duración de la artritis, con compromiso de falanges distales, y con discapacidad funcional. El tratamiento con drogas modificadoras de la enfermedad (DME) convencionales parece ser ineficaz para la prevención de su desarrollo. Un rol potencial de los agentes biológicos podría ser alentador, aunque se necesitan estudios prospectivos a la brevedad14.
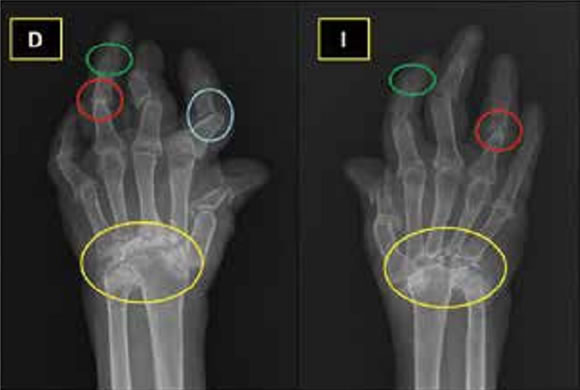
Figura 11. Rx de ambas manos frente. Círculo amarillo: artropatía reabsortiva en ambos carpos. Círculo rojo: imagen “en lápiz y copa” a nivel de 4° IFP bilateral. Círculo verde: anquilosis ósea a nivel de la 4° IFD de mano derecha y la 2° IFD de mano izquierda. Círculo celeste: reabsorción de la epífisis distal de la segunda falange del segundo dedo de mano derecha, con fenómeno de subluxación a nivel de la 2° IFP derecha.
Enfermedad axial
La APs puede también comprometer el esqueleto axial, un hallazgo que ocurre en el 20-40% de los pacientes con artritis periférica15,16. Algunas descripciones características en las radiografías de la APs axial son potencialmente útiles para el diagnóstico, tales como la sacroileítis asimétrica, la presencia de sindesmofitos no marginales y asimétricos, la osificación paravertebral y el compromiso frecuente de la columna cervical15.
Las articulaciones sacroilíacas pueden mostrar signos inflamatorios, con esclerosis en el hueso subcondral, erosiones óseas, irregularidad en el espacio articular con leve ensanchamiento, y eventual estrechamiento del espacio articular, hasta llegar a la anquilosis ósea. El compromiso sacroilíaco en APs puede ser unilateral o bilateral, simétrico o asimétrico. Afecta inicialmente el lado ilíaco de la articulación sinovial; cuando las erosiones incrementan y comprometen el lado sacro, la proliferación ósea puede hacerse más extensa que lo que ocurre en Espondilitis Anquilosante (EA).
También es posible la osificación de los ligamentos sacroilíacos, aún en ausencia de anquilosis de la articulación sinovial. Otras regiones de entesis que se pueden osificar son la cresta ilíaca, el trocánter femoral y la tuberosidad isquiática. La sacroileítis radiográfica fue definida utilizando los criterios de New York acorde a la siguiente graduación: grado 2 bilateral o grado 3 a 4 unilateral17.
La columna tóraco-lumbar puede mostrar osificaciones paravertebrales en forma de coma; sin embargo, la presencia de espondilitis es rara en ausencia de sacroileítis. Las facetas articulares están relativamente respetadas, y hay ausencia de “cuadratura vertebral”. Un estudio encontró una frecuencia de compromiso de columna cervical en el 45% de los pacientes examinados y en el 36% de aquellos que se sometieron a estudios radiográficos18. El patrón más frecuente fue el compromiso anquilosante en el 85% de los pacientes, caracterizados por anquilosis, sindesmofitos y osificación ligamentaria18.
Los sindesmofitos pueden tomar 3 tipos de morfología: marginal, no marginal (incluyen aquellos en forma de coma y los llamados “chunky”) y la osificación paravertebral (la cual puede ser simplemente un estadio inicial de los no marginales).
Las lesiones disco-vertebrales, como la osteítis, lesión de Romanus (erosión en esquina vertebral) y la cuadratura vertebral son menos comunes en APs axial que en EA.
Están descriptas otras lesiones de columna cervical que incluyen pinzamiento del espacio discal y a nivel apofisario; calcificación del ligamento posterior, subluxación atlanto-axoidea, erosión de la apófisis odontoide, y erosiones sub-axiales.
La expresión radiográfica de las entesitis se manifiesta como erosión y/u osificación a nivel insercional, pudiendo comprometer las siguientes localizaciones: aspecto plantar y posterior del calcáneo, trocánter femoral, tuberosidad isquiática, maléolos, porción distal de los cóndilos femorales, olécranon, cresta ilíaca, margen inferior de clavícula, región patelar anterior, y procesos espinosos de las vértebras15,16.
Radiografía simple en el diagnóstico de APs
El examen radiográfico debería incluir manos y pies en proyección anteroposterior y lateral, en pacientes con compromiso articular periférico; y columna cervical, torácica inferior y lumbar y ambas articulaciones sacroilíacas, cuando se presentan síntomas axiales.
Los hallazgos radiográficos distintivos de APs son el resultado de una combinación de cambios erosivos y proliferativos óseos. Ellos incluyen la deformidad en catalejo de ópera (“opera-glass”), la cual resulta de una destrucción articular erosiva con telescopaje de los dedos; periostitis vellosa o plumosa (“fluffy”) causada por osificación perióstica; deformidad en lápiz y copa (“pencil in cup”), en la cual hay destrucción simultánea de la cabeza de la falange media y expansión de la base de la falange distal; y la acro-osteólisis, consistente con la resorción del penacho distal de la falange16.
El compromiso de varias estructuras musculoesqueléticas en un mismo dedo, con tumefacción de partes blandas, provoca la aparición de dactilitis o “dedo en salchicha”19. La proliferación ósea produce una apariencia irregular en el borde marginal óseo de la articulación afectada, la cual se describe como de aspecto difuminado o irregular (“fuzzy” o “whiskering”).
La periostitis puede adoptar diferentes formas: puede aparecer como una capa perióstica fina de neoformación ósea adyacente a la corteza; una capa gruesa irregular, o como engrosamiento irregular de la corteza por sí misma19.
La osteopenia yuxtaarticular es poco común en APs, aunque cuando está presente constituye un signo de pobre pronóstico20. De todos modos, la evaluación de la osteopenia yuxtaarticular es conocida de ser altamente dependiente de la técnica radiográfica.
La proliferación ósea, característica de la APs y de otras EsP, raramente se ve en AR.
Una de las características usuales de la APs es el compromiso asimétrico. La definición habitual de simetría requiere que al menos un 50% de las articulaciones comprometidas sean pares simétricos. Acorde a esta definición, y dado que hay un número finito de posibles articulaciones que pueden comprometerse, se argumentó que la presencia de simetría está fuertemente influenciada por el número total de articulaciones afectadas21.
Varios criterios de clasificación de APs incluyen características radiográficas7. La presencia de erosiones en pequeñas articulaciones con una relativa ausencia de osteoporosis se incluyó como uno de los criterios propuestos por Bennett y col.22. McGonagle y col. propusieron la presencia radiográfica de entesitis como una de las características de los criterios de clasificación de la enfermedad23. La evidencia radiográfica de entesitis fue sugerida como hallazgo discriminatorio de AR; sin embargo; constituye un fenómeno radiográfico infrecuente. Los criterios CASPAR incluyen la presencia de fenómenos de neoformación ósea detectados por radiografía24.
Radiografía simple en el diagnóstico diferencial de APs
La radiografía convencional en APs es de suma utilidad en el diagnóstico diferencial con otras patologías reumáticas.
• Artritis Reactiva (ARe): las características radiográficas son similares a la APs e incluyen la presencia de inflamación articular, proliferación ósea, periostitis, y entesitis, con una distribución uni o bilateral y simétrica o asimétrica.
• Espondilitis anquilosante (EA): afecta predominantemente el esqueleto axial, aunque puede comprometer grandes articulaciones de miembros inferiores. Los sindesmofitos usualmente son simétricos, regulares y marginales, mientras que en APs y ARe son generalmente asimétricos, irregulares y no marginales. La distribución a lo largo de la columna puede ser diferente en las EsP. En EA, la regla es la progresión de los sindesmofitos desde la columna lumbar hacia la columna cervical, mientras que el compromiso axial en APs es más aleatorio15. También existen diferencias en el tipo de sindesmofitos. En APs predominan los sindesmofitos llamados “chunky”, de aspecto más grueso que los observados en EA típica (Figura 7).

Figura 7. Rx de columna lumbar perfil. Flecha amarilla: sindesmofitos finos en paciente con espondilitis anquilosante. Flecha verde: sindesmofitos gruesos en paciente con artritis psoriásica.
• Artritis reumatoidea (AR): los hallazgos radiográficos típicos de AR incluyen osteopenia periarticular, pérdida uniforme del espacio articular, erosiones óseas, y tumefacción de partes blandas. La periostitis, osteólisis, proliferación ósea yuxtaarticular y la anquilosis no son tan frecuentes en AR, y debería despertar la sospecha de APs. La AR tiene una distribución proximal del compromiso articular en manos y pies. Las erosiones óseas en APs en general son menos demarcadas, probablemente por la aposición ósea concomitante, un hallazgo habitualmente ausente en AR. Además, las erosiones óseas en APs no sólo se presentan a nivel de articulaciones IFP, MCF y carpos, sino también en articulaciones IFD. Si la inflamación articular se limita a una sola articulación, se debe descartar rápidamente la presencia de infección.
• Artritis séptica: los hallazgos radiográficos abarcan aquellos de una artropatía inflamatoria: osteopenia periarticular, pérdida uniforme del espacio articular, tumefacción de partes blandas, y erosiones óseas19.
• Osteoartritis Erosiva (OAE): se caracteriza por destrucción severa de la articulación IF, con relativa preservación del compromiso de articulaciones MCF, y frecuente afectación de la articulación trapecio-metacarpiano. La artritis simultánea de articulaciones MCF e IF es más prevalente en APs que OAE. El compromiso difuso de carpo, radiocarpiano y radio-cubital es común en APs (Figura 11), pero raro en OAE25. El compromiso articular, tanto en APs como en OAE, se asocia típicamente con pérdida uniforme del espacio articular. Sin embargo, en OAE, algunas articulaciones pueden exhibir pérdida no uniforme del cartílago, sobre todo aquellas no severamente comprometidas25. En APs, las erosiones sobre la superficie distal de las articulaciones IFD tienen una apariencia característica en “orejas de ratón” (Figura 8). Por el contrario, las erosiones de las articulaciones IF en OAE son consecuencia primordialmente de la destrucción del cartílago articular. La deformidad resultante a nivel de la corteza subcondral distal sugiere el aspecto en “alas de golondrina”, dado que la erosión ósea predomina en áreas más periféricas. La aposición ósea perióstica es bien conocida en APs, pero no es un hallazgo ampliamente reconocido en OAE. Otro hallazgo radiográfico significativo de relevancia diagnóstica en APs es el compromiso selectivo denominado “ray-pattern”, el cual consiste en la afectación severa de algunas articulaciones, con respeto de otras, en un mismo rayo. Este patrón puede ser relativamente específico de APs, dado que no ha sido descripto en otras enfermedades reumáticas25. La presencia de artritis en una mano, sin compromiso de la contralateral, es raro en OAE, pero se puede ver en APs25. Los trastornos de alineación de los dedos de las manos se pueden observar en OAE y APs. En OAE suceden deformidades leves en flexión y desviación medial o lateral, mientras que en APs los trastornos de alineación pueden ser severos y llevar a fenómenos de subluxación y luxación articular. La artritis de la IF del hallux, con erosiones óseas subcondrales irregulares no fue descripto en OAE. La fusión interfalángica de los dedos de las manos es comúnmente considerada en el diagnóstico radiográfico de APs; sin embargo, este hallazgo puede ser más frecuente en OAE. La fusión también ocurre en los pies de pacientes con APs, pero no en OAE25,26.

Figura 10. Rx de mano frente. Círculo verde: erosiones con proliferación ósea a nivel del hueso subcondral en 3° y 4° IFD.

Figura 12. Rx de ambos pies frente. Círculo rojo: importante fenómeno erosivo reabsortivo, con tendencia a la anquilosis ósea, a nivel de 1° IF de ambos pies. Círculo verde: fenómeno de subluxación ósea a nivel de la 2° MTF de pie derecho. Círculo celeste: fenómeno de luxación ósea a nivel de la 3° MTF de pie izquierdo.
Radiografía simple en el pronóstico de APs
La radiografía convencional ha sido utilizada en APs para establecer la severidad, extensión y pronóstico del daño articular27. El daño radiográfico es frecuente en APs, con una frecuencia de alrededor del 47% de pacientes a 2 años de seguimiento28. El daño radiográfico basal en estudios observacionales de APs demostró ser un fuerte predictor de daño estructural y mortalidad29. Varios estudios han demostrado que los agentes biológicos, particularmente los inhibidores del factor de necrosis tumoral alfa (TNFi), disminuyen en forma significativa la progresión del daño articular en APs30-36. Más recientemente, otros agentes como Ustekinumab y Secukinumab, también han demostrado inhibir el daño estructural37.
Sistemas de puntaje radiográficos en APs
La radiografía convencional es una medida de desenlace utilizada en estudios controlados y randomizados, así como en estudios observacionales longitudinales, con el objetivo de aprobar nuevas drogas. Existen varios sistemas de puntaje, algunos de ellos modificados a partir de su aplicación en AR, que fueron utilizados en APs. Ellos incluyen el score de Sharp modificado (SSm), el método de Sharp van der Heijde modificado para APs (SHS), el método de Steinbrocker, el score de Ratingen y el ReXSPA. Todos ellos se resumen en la Tabla 16.
Tabla 16. Resumen de sistemas de puntaje radiográficos en APs

En el año 2012, el grupo internacional GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis) discutió la elección de la medida de desenlace radiográfico para utilizar en ensayos controlados randomizados y estudios observacionales longitudinales de APs38. Hubo consenso sobre utilizar el score de SHS como herramienta óptima en los estudios randomizados, donde la sensibilidad al cambio fue el atributo más relevante. No se pudo definir el método óptimo para los estudios observacionales. Tillet y col. evaluaron la confiabilidad, reproducibilidad, y sensibilidad al cambio de estos 4 sistemas de puntaje radiográfico en pacientes con APs27. Ellos demostraron que ninguna de las medidas utilizadas fue suficientemente confiable y sensible al cambio para aplicar fácilmente en grandes estudios observacionales longitudinales. El tiempo requerido para aplicar cada método difiere considerablemente desde 6,2 a 14,6 min. El método de Steinbrocker fue el más factible de realizar por ser un score global; el método de SHS el más sensible al cambio comparado con el SSm. Finalmente, el método de Ratingen es más sensible que el de Steinbrocker, dado que es un sistema de puntaje compuesto y no global, permitiendo graduar los fenómenos de erosión y proliferación ósea27. La tumefacción de partes blandas que incluye el score de Steinbrocker es una fuente adicional de variabilidad, particularmente en las articulaciones MTF, donde hay claramente menor grado de visualización de estos tejidos a ese nivel. La medición del pinzamiento articular no es específico de la APs y puede ocurrir en osteoartritis, por lo tanto, puede sobreestimar la progresión radiográfica. El score de Ratingen incluye una medida de proliferación ósea, la cual demostró ser el único cambio radiográfico suficientemente específico de la APs para justificar su inclusión en los criterios de clasificación CASPAR. El mínimo cambio detectable (MCD) del score de Ratingen está cercano al método de SSm y SHS, pero es más rápido de realizar y puede ser más específico de APs por incluir la proliferación ósea27.
En el año 2016, se publicó un estudio novedoso como prueba de concepto, referido a un score radiográfico reducido en pacientes con APs, para ser utilizado en estudios longitudinales observacionales39. El score se denomina ReXSPA40 (Reductive X-ray Score for Psoriatic Arthritis) e incluye la evaluación de 22 articulaciones en manos, muñecas y pies, con 117 puntos de observación (Tabla 16). Evalúa en forma combinada erosión (según el score de SHS), pinzamiento del espacio articular (según el score de SHS) y osteo-proliferación ósea (según el score de Ratingen). Se evaluaron 50 pacientes con APs (criterios CASPAR) en forma cronológica y se los comparó con los scores de SSm, SHS y Ratingen. El score ReXSPA demostró buena sensibilidad y factibilidad para ser aplicado en grandes estudios observacionales. Un estudio del IREP (Instituto de Rehabilitación Psicofísica) validó el índice ReXSPA en una cohorte de pacientes con APs, demostrando muy buena correlación con el score de SHS40. Su tiempo de lectura y cálculo fue significativamente menor. Ellos se plantearon si evaluaciones posteriores longitudinales podrían demostrar un beneficio adicional, al incluir una medida de osteoproliferación en la evaluación radiográfica de los pacientes con APs.
Conclusiones
Las radiografías convencionales son ampliamente accesibles, económicas y seguras, y pueden ayudar en el diagnóstico de APs. Son útiles para diferenciar APs de otras enfermedades reumáticas y son medidas de desenlace (o outcomes) aceptadas para ensayos clínicos y estudios observacionales. Las radiografías podrían mostrar algunas características típicas que obligan al profesional a pensar en APs. A pesar del desarrollo de nuevas modalidades de imagen más sensibles y específicas, los rayos X tienen aún un rol primordial en el abordaje diagnóstico y terapéutico de la APs.
2) Uso de la Resonancia Magnética (RM) en APs
Introducción
La Resonancia Magnética (RM) es una técnica con alta resolución para valorar las distintas estructuras anatómicas. Nos permite evaluar el compromiso de esta enfermedad a nivel periférico como a nivel del esqueleto axial, y con el uso de distintas secuencias se puede identificar tanto lesiones debidas a actividad de la enfermedad como lesiones secundarias a daños estructurales.
A pesar de ser una técnica útil, existen pocos trabajos publicados comparados con los trabajos que existen en AR e incluso mucho de los conocimientos actuales derivan de trabajos en pacientes con EsP en los cuales se han incluidos pocos pacientes con APs y un mayor número de pacientes con EA.
Descripción de la técnica
Las secuencias que se utilizan son T1 y STIR (Short Time Inversion Recovery). La secuencia T1 es la secuencia anatómica por excelencia y nos permite identificar distintas estructuras. En esta secuencia, la grasa se ve blanca y el líquido, negro. Dependiendo de la proporción de grasa y agua que la estructura anatómica presente, la misma se verá con distinta tonalidad de gris.
La secuencia STIR es una secuencia con poca resolución imagenológica. El líquido se ve blanco y la grasa está suprimida (negra), motivo por el cual se produce un realce de las estructuras con alto contenido de agua, de esta manera se pone en evidencia sin requerir el uso de contraste la presencia de fenómenos inflamatorios.
Otra secuencia es la secuencia T2, en la cual el líquido se ve blanco y la grasa, gris claro, y por este motivo no es tan fácil identificar procesos inflamatorios comparándola con la secuencia STIR (Tabla 17).
Tabla 17. Tabla comparativa entre las características de los distintos tejidos en secuencia T1 y STIR

El uso de gadolinio nos permite resaltar aquellas estructuras con aumento de la vascularización como sucede en los procesos inflamatorios. Si bien es más sensible que la secuencia STIR, genera un aumento de los costos del estudio, del tiempo del mismo y aumenta el riesgo de fibrosis retroperitoneal. En la actualidad, la RM con gadolinio está relegada para la evaluación del compromiso periférico, ya que permite apreciar mejor la membrana sinovial y prácticamente no se utiliza para evaluar el compromiso de las estructuras axiales.
Las principales lesiones inflamatorias y cambios estructurales que se pueden visualizar a nivel periférico por RM son: sinovitis, entesitis, tenosinovitis, edema óseo, erosiones y proliferación ósea41,42.
Las lesiones inflamatorias se observan como imágenes hiperintensas (blancas) en STIR o por la presencia de hiperintensidad en T1 con contraste.
Las lesiones estructurales se identifican en secuencia T1. Las erosiones se definen por la presencia de pérdida del borde cortical y la pérdida de la intensidad normal del hueso adyacente transformándose en una zona hipointensa (oscuras)41,42.
La proliferación ósea también se identifica en secuencia T1, como un crecimiento óseo anormal a nivel periarticular.
Las principales lesiones inflamatorias y estructurales que se identifican por RM a nivel del esqueleto axial son: edema óseo u osteítis, entesitis, infiltración grasa, erosiones óseas, proliferación ósea y anquilosis41,42.
Las lesiones inflamatorias (osteitis, entesitis) se visualizan con las secuencias STIR o T1 con gadolinio, mientras que las lesiones estructurales (infiltración grasa, erosiones óseas, proliferación y anquilosis) se identifican en la secuencia T1, al igual que sucede con la RM de estructuras periféricas.
Con la secuencia STIR, observamos edema a nivel óseo (osteítis), de entesis (entesitis) como imágenes hiperintensas.
Las erosiones y proliferaciones óseas se observan en T1 y son similares a las ya descriptas a nivel periférico.
La infiltración grasa o cambios grasos se definen como imágenes hiperintensas en T1, y demuestran la presencia de fenómenos reparativos posteriores a fenómenos inflamatorios. Los puentes óseos se identifican como imágenes hiperintensas en T1 que unen una vértebra con otra.
Utilidad diagnóstica de la RM y compromiso periférico en APs
Tanto las lesiones inflamatorias como las lesiones estructurales se pueden observar mediante la RMN43-45, pero estos cambios no son específicos de APs. McQueen y col. demostraron que no es factible diferenciar entre AR y APs mediante la evaluación de sinovitis y erosiones41.
Otro estudio, comparando la RM de manos y carpos de pacientes con AR y APs, observó que las erosiones eran más frecuentes en AR y la periostitis en APs46.
El estudio de Narváez y col. identificó edema óseo en diáfisis y/o entesitis en el 71% de los pacientes con APs, no encontrando dichos hallazgos en ningún paciente con AR47.
El sitio de localización del edema óseo resulta en pacientes con APs, ya que el edema se localiza cercano a la entesis, mientras que en la AR se localiza cercano a la cápsula articular y en la osteoartritis cercano al hueso subcondral46,48.
También, el sitio de localización de las erosiones es diferente, en APs, las erosiones son más marginales, con respecto a la osteoartritis, en que las erosiones son centrales49.
Estos trabajos demuestran que no podemos sólo basarnos en la presencia de determinadas lesiones para el diagnóstico, sino que debemos evaluar las características de las mismas, como la localización, distribución, etc, con el fin de llegar al diagnóstico.
Utilidad diagnóstica de la RM y compromiso axial en APs
El compromiso axial de la APs incluye tanto la columna vertebral como las articulaciones sacroilíacas. El compromiso inflamatorio a nivel de la columna se evidencia por la presencia de osteítis y/o entesitis. Estas lesiones pueden comprometer las esquinas vertebrales anterior y posterior, las uniones discovertebrales, intervertebrales y costovertebrales50-52. El compromiso de las articulaciones sacroilíacas se evidencia por la presencia de edema óseo adyacente a la articulación, comprometiendo la región sinovial de dicha articulación53,54.
Son pocos los estudios realizados en pacientes con APs. Si bien los hallazgos son comparables con EA, el compromiso tiende a ser más asimétrico en APs55-57, y comprometer en un porcentaje menor las articulaciones sacroilíacas (entre 30-38%) por RM comparado con EA56,58,59. La afectación axial tiende a ser “en parches” con un frecuente compromiso de la columna cervical.
Utilidad pronóstica de la RM y compromiso periférico en APs
Existen pocos trabajos que evalúen la utilidad pronóstica de la RM y el compromiso periférico en APs. El edema óseo detectado por RM se asocia a mayor probabilidad de erosiones60,61.
Se han desarrollado varios scores semicuantitativos para evaluar sinovitis, edema óseo y/o erosiones42,44,62, aunque han sido utilizados en pocos pacientes. Un estudio evaluó la respuesta a adalimumab a 24 semanas en 11 pacientes con APs. Se les realizó RM de muñeca y de rodilla, demostrando mejoría a nivel del edema óseo, pero no de la sinovitis60.
El grupo OMERACT desarrollo un score por RM para pacientes con APs (PsAMRIS) para evaluar el compromiso inflamatorio y cambios estructurales en manos42,62,63. Este score demostró tener un buen coeficiente de correlación intra e inter observador para todos los parámetros evaluados64-66.
Utilidad pronóstica de la RM y compromiso axial en APs
No existen scores específicos para evaluar el compromiso axial en APs, por este motivo se utilizan los scores para EsP.
Tanto para evaluar el compromiso inflamatorio de columna y de las articulaciones sacroilíacas, los dos scores más utilizados son: SPARCC (The Spondyloarthritis Research Consortium of Canada) y el score de Berlin57,67,68,69,70.
Para evaluar el daño estructural existen varios sistemas validados57,67,68,71,72.
Algunos trabajos han demostrado que el riesgo de desarrollo de erosiones en vértebras con edema óseo es 6,5 veces mayor que el riesgo de desarrollo de erosiones en vértebras sin edema óseo72. Por lo tanto, podría considerarse a la presencia de edema óseo como un factor de mal pronóstico; al igual que la presencia de cambios grasos tanto a nivel de columna vertebral como de articulaciones sacroilíacas71,73. Un trabajo en pacientes con EsP, demostró que el riesgo de desarrollo de sindesmofitos es 20 veces mayor en aquellas esquinas vertebrales que presentan cambios grasos73.
Con respecto al seguimiento de estos pacientes con compromiso axial y bajo el uso de TNFi, la RM mostró datos contradictorios que hacen muy difícil la interpretación de los mismos. Estudios en pacientes con EsP mostraron que un 9% de los pacientes que se encontraban sin tratamiento presentaban disminución del edema óseo en forma espontánea y en aquellos pacientes en tratamiento con TNFi y que presentaban disminución de edema óseo, en el seguimiento a 2 años hasta un 20% presentaban progresión por este método74.
Por otro lado, varios estudios en EsP han demostrado que la desaparición del edema óseo ocurre en la mitad de los pacientes con TNFi independientemente de la mejoría clínica64,68,74.
Es por esto que el uso de la RM en el seguimiento de los pacientes con compromiso axial debe ser individualizado para cada paciente y se deben tener en cuenta estos datos a la hora de tomar una conducta terapéutica. Queda relegado a las circunstancias clínicas particulares75.
Conclusiones
La RMN juega un rol importante para el diagnóstico y seguimiento de los pacientes con APs. Existen pocos trabajos en pacientes con APs, por lo que se utiliza la información obtenida de estudios con pacientes con Espondiloartritis donde la mayoría de los pacientes incluidos tienen EA.
Existe acuerdo en su uso para diagnóstico tanto del compromiso axial como periférico, existiendo poco acuerdo en lo que respecta al seguimiento de los pacientes por este método.
Se requieren más estudios en pacientes con APs para establecer en forma clara el rol potencial de esta técnica de imágenes.
Referencias
1. Torre Alonso JC, Rodríguez Pérez A, Arribas Castrillo JM, Ballina García J, Riestra Noriega JL, López Larrea C. Psoriatic arthritis (PA): a clinical, immunological and radiological study of 180 patients. Br J Rheumatol 1991;30(4):245-50.
2. Gladman DD, Shuckett R, Russell ML, Thorne JC, Schachter RK. Psoriatic arthritis (PSA) - an analysis of 220 patients. Q J Med 1987;62(238):127-41.
3. Ory PA, Gladman DD, Mease PJ. Psoriatic arthritis and imaging. Ann Rheum Dis 2005; 64 Suppl 2:ii55-7.
4. Siannis F, Farewell VT, Cook RJ, Schentag CT, Gladman DD. Clinical and radiological damage in psoriatic arthritis. Ann Rheum Dis 2006;65(4):478-81.
5. Gladman DD, Farewell VT, Nadeau C. Clinical indicators of progression in psoriatic arthritis: multivariate relative risk model. J Rheumatol 1995;22(4):675-9.
6. Queiro-Silva R, Torre-Alonso JC, Tinture-Eguren T, Lopez-Lagunas I. A polyarticular onset predicts erosive and deforming disease in psoriatic arthritis. Ann Rheum Dis 2003; 62(1):68-70.
7. Anandarajah A. Imaging in psoriatic arthritis. Clin Rev Allergy Immunol 2013; 44(2):157-65.
8. Naredo E, Moller I, de Miguel E, Batlle-Gualda E, Acebes C, Brito E, et al. Ultrasound School of the Spanish Society of R, Spanish ECOAG. High prevalence of ultrasonographic synovitis and enthesopathy in patients with psoriasis without psoriatic arthritis: a prospective case-control study. Rheumatology (Oxford) 2011;50(10):1838-48.
9. Freeston JE, Coates LC, Nam JL, Moverley AR, Hensor EM, Wakefield RJ, et al. Is there subclinical synovitis in early psoriatic arthritis?. A clinical comparison with grayscale and power Doppler ultrasound. Arthritis Care Res 2014;66(3):432-9.
10. Ostergaard M, Poggenborg RP. Magnetic resonance imaging in psoriatic arthritis – update on current status and future perspectives: a report from the GRAPPA 2010 annual meeting. J Rheumatol 2012;39(2):408-12.
11. Coates LC, Hodgson R, Conaghan PG, Freeston JE. MRI and ultrasonography for diagnosis and monitoring of psoriatic arthritis. Best Pract Res Clin Rheumatol 2012; 26(6):805-22.
12. Taylor WJ, Porter GG, Helliwell PS. Operational definitions and observer reliability of the plain radiographic features of psoriatic arthritis. J Rheumatol 2003; 30(12):2645-58.
13. Haddad A, Chandran V. Arthritis mutilans. Curr Rheumatol Rep 2013;15(4):321.
14. Bruzzese V, Marrese C, Ridola L, Zullo A. Psoriatic arthritis mutilans: case series and literature review. J Rheumatol 2013; 40(7):1233-6.
15. Lubrano E, Marchesoni A, Olivieri I, D’Angelo S, Palazzi C, Scarpa R, et al. The radiological Assessment of axial involvement in psoriatic arthritis. J Rheumatol Suppl 2012; 89:54-6.
16. Day MS, Nam D, Goodman S, Su EP, Figgie M. Psoriatic arthritis. J Am Acad Orthop Surg 2012; 20(1):28-37.
17. Gofton JP. Report from the subcommittee on diagnostic criteria for ankylosing spondylitis. In: Population studies of the rheumatic diseases. New York: Excerpta Medica; 1966.
18. Jenkinson T, Armas J, Evison G, Cohen M, Lovell C, McHugh NJ. The cervical spine in psoriatic arthritis: a clinical and radiological study. Br J Rheumatol 1994;33(3):255-9.
19. Jacobson JA, Girish G, Jiang Y, Resnick D. Radiographic evaluation of arthritis: inflammatory conditions. Radiology 2008; 248(2):378-89.
20. Sankowski AJ, Lebkowska UM, Cwikla J, Walecka I, Walecki J. Psoriatic arthritis. Pol J Radiol 2013;78(1):7-17.
21. Helliwell P, Marchesoni A, Peters M, Barker M, Wright V. A re-evaluation of the osteoarticular manifestations of psoriasis. Br J Rheumatol 1991;30(5):339-45.
22. Bennett RM. Psoriatic arthritis. In: Arthritis and allied conditions. 9th ed. Philadelphia: Lea & Febiger;1979.
23. McGonagle D, Conaghan PG, Emery P. Psoriatic arthritis: a unified concept twenty years on. Arthritis Rheum 1999;42(6):1080-6.
24. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H, Group CS. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54(8):2665-73.
25. Martel W, Stuck KJ, Dworin AM, Hylland RG. Erosive osteoarthritis and psoriatic arthritis: a radiologic comparison in the hand, wrist, and foot. Am J Roentgenol 1980; 134(1):125-35.
26. Punzi L, Frigato M, Frallonardo P, Ramonda R. Inflammatory osteoarthritis of the hand. Best Pract Res Clin Rheumatol 2010;24(3):301-12.
27. Tillett W, Jadon D, Shaddick G, Robinson G, Sengupta R, Korendowych E, et al. Feasibility, reliability, and sensitivity to change of four radiographic scoring methods in patients with psoriatic arthritis. Arthritis Care Res 2014;66(2):311-7.
28. Kane D, Stafford L, Bresnihan B, FitzGerald O. A prospective, clinical and radiological study of early psoriatic arthritis: an early synovitis clinic experience. Rheumatology (Oxford) 2003; 42(12):1460-8.
29. van der Heijde D, Sharp J, Wassenberg S, Gladman DD. Psoriatic arthritis imaging: a review of scoring methods. Ann Rheum Dis 2005; 64 Suppl 2:ii61-4.
30. Mease PJ, Antoni CE. Psoriatic arthritis treatment: biological response modifiers. Ann Rheum Dis 2005;64 Suppl 2:ii78-82.
31. Mease PJ, Kivitz AJ, Burch FX, Siegel EL, Cohen SB, Ory P, et al. Continued inhibition of radiographic progression in patients with psoriatic arthritis following 2 years of treatment with etanercept. J Rheumatol 2006;33(4):712-21.
32. Gladman DD, Mease PJ, Ritchlin CT, Choy EH, Sharp JT, Ory PA, et al. Adalimumab for long-term treatment of psoriatic arthritis: forty-eight-week data from the adalimumab effectiveness in psoriatic arthritis trial. Arthritis Rheum 2007;56(2):476-88.
33. Mease PJ, Ory P, Sharp JT, Ritchlin CT, van den Bosch F, Wellborne F, et al. Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT). Ann Rheum Dis 2009;68(5):702-9.
34. van der Heijde D, Kavanaugh A, Gladman DD, Antoni C, Krueger GG, Guzzo C, et al. Infliximab inhibits progression of radiographic damage in patients with active psoriatic arthritis through one year of treatment: results from the induction and maintenance psoriatic arthritis clinical trial 2. Arthritis Rheum 2007;56(8):2698-707.
35. Kavanaugh A, van der Heijde D, McInnes IB, Mease P, Krueger GG, Gladman DD, et al. Golimumab in psoriatic arthritis: one-year clinical efficacy, radiographic, and safety results from a phase III, randomized, placebo-controlled trial. Arthritis Rheum 2012;64(8):2504-17.
36. van der Heijde D, Fleischmann R, Wollenhaupt J, Deodhar A, Kielar D, Woltering F, et al. Effect of different imputation approaches on the evaluation of radiographic progression in patients with psoriatic arthritis: results of the RAPID-PsA 24-week phase III double-blind randomised placebo-controlled study of Certolizumab pegol. Ann Rheum Dis 2014; 73(1):233-7.
37. Kavanaugh A, Ritchlin C, Rahman P, Puig L, Gottlieb AB, Li S, et al. Ustekinumab, an anti-IL-12/23 p40 monoclonal antibody, inhibits radiographic progression in patients with active psoriatic arthritis: results of an integrated analysis of radiographic data from the phase 3, multicentre, randomised, double-blind, placebo-controlled PSUMMIT-1 and PSUMMIT-2 trials. Ann Rheum Dis 2014; 73(6):1000-6.
38. Proceedings of the annual meeting of the Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA), June 26-27, 2012, Stockholm, Sweden. J Rheumatol 2013;40(8):1407-58.
39. Tillett W, Shaddick G, Jadon D, Robinson G, Korendowych E, McHugh N. Novel Composite Radiographic Score for Longitudinal Observational Studies of Psoriatic Arthritis: A Proof-of-concept Study. J Rheumatol 2016;43(2):367-70.
40. Isnardi CA, Schneeberger EE, Dal Pra F, Scheines E, Coronel Ale AL, Fornaro MN, et al. Validation of the ReXSPA (Reductive X-ray Score for Psoriatic Arthritis) in an Argentinian Cohort of Patients with Psoriatic Arthritis. Arhtritis Rheumatol 2018;70(Suppl 10).
41. McQueen F, Lassere M, Ostergaard M. Magnetic resonance imaging in psoriatic arthritis: a review of the literature. Arthritis Res Ther 2006;8 (2):207.
42. Østergaard M, McQueen F, Wiell C, Bøyesen P, Ejbjerg B, Peterfy C, et al. The OMERACT psoriatic arthritis magnetic resonance imaging scoring system (PsAMRIS): definitions of key pathologies, suggested MRI sequences, and preliminary scoring system for PsA Hands. J Rheumatol 2009;36 (8):1816-24.
43. Tehranzadeh J, Ashikyan O, Anavim A, Shin J. Detailed analysis of contrast-enhanced MRI of hands and wrists in patients with psoriatic arthritis. Skeletal Radiol. 2008;37 (5):433-42.
44. Ghanem N, Uhl M, Pache G, Bley T, Walker UA, Langer M, et al. MRI in psoriatic arthritis with hand and foot involvement. Rheumatol Int. 2007;27 (4):387-93.
45. Wiell C, Szkudlarek M, Hasselquist M, Møller JM, Vestergaard A, Nørregaard J, et al. Ultrasonography, magnetic resonance imaging, radiography, and clinical assessment of inflammatory and destructive changes in fingers and toes of patients with psoriatic arthritis. Arthritis Res Ther. 2007; 9 (6):R119.
46. Schoellnast H, Deutschmann HA, Hermann J, Schaffler GJ, Reittner P, Kammerhuber F, et al. Psoriatic arthritis and rheumatoid arthritis: findings in contrast-enhanced MRI. Am J Roentgenol. 2006;187(2):351-7.
47. Narvaez J, Narvaez JA, de Albert M, Gómez-Vaquero C, Nolla JM. Can magnetic resonance imaging of the hand and wrist differentiate between rheumatoid arthritis and psoriatic arthritis in the early stages of the disease?. Semin Arthritis Rheum 2012;42(3):234-45.
48. Totterman SM. Magnetic resonance imaging of psoriatic arthritis: insight from traditional and three-dimensional analysis. Curr Rheumatol Rep 2004;6(4):317-21.
49. Braum LS, McGonagle D, Bruns A, Philipp S, Hermann S, Aupperle K, et al. Characterisation of hand small joints arthropathy using high-resolution MRI - limited discrimination between osteoarthritis and psoriatic arthritis. Eur Radiol 2013;23(6):1686-93.
50. Queiro R, Tejon P, Alonso S, Alperi M, Ballina J. Erosive discovertebral lesion (Andersson lesion) as the first sign of disease in axial psoriatic arthritis. Scand J Rheumatol 2013;42(3):220-5.
51. Bochkova AG, Levshakova AV, Bunchuk NV, Braun J. Spinal inflammation lesions as detected by magnetic resonance imaging in patients with early ankylosing spondylitis are more often observed in posterior structures of the spine. Rheumatology (Oxford) 2010;49(4):749-55.
52. Lambert RG, Pedersen SJ, Maksymowych W. Active inflammatory lesions detected by magnetic resonance imaging in the spine of patients with spondyloarthritis – definitions, assessment system and reference image set. J Rheumatol 2009;36 Suppl 84:3-17.
53. Sieper J, Rudwaleit M, Baraliakos X, Brandt J, Braun J, Burgos-Vargas R, et al. The Assessment of SpondyloArthritis International Society (ASAS) handbook: a guide to assess spondyloarthritis. Ann Rheum Dis 2009;68 Suppl 2:ii1–44.
54. Poggenborg RP, Eshed I, Pedersen SJ, Krabbe S, Weckbach S, Lambert RGW, et al. Whole-body MRI for assessment of enthesitis in psoriatic arthritis, axial spondyloarthritis and healthy subjects – a comparison with 7 clinical enthesitis indices [abstract]. Ann Rheum Dis 2012;71 Suppl 3:110.
55. Helliwell PS, Hickling P, Wright V. Do the radiological changes of classic ankylosing spondylitis differ from the changes found in the spondylitis associated with inflammatory bowel disease, psoriasis, and reactive arthritis?. Ann Rheum Dis. 1998;57(3):135-40.
56. Williamson L, Dockerty JL, Dalbeth N, McNally E, Ostlere S, Wordsworth BP. Clinical assessment of sacroiliitis and HLA-B27 are poor predictors of sacroiliitis diagnosed by magnetic resonance imaging in psoriatic arthritis. Rheumatology (Oxford). 2004;43(1):85-8.
57.Østergaard M, Poggenborg RP, Axelsen MB, Pedersen SJ. Magnetic resonance imaging in spondyloarthritis-how to quantify findings and measure response. Best Pract Res Clin Rheumatol 2010;24(5):637-57.
58. Castillo-Gallego C, Aydin SZ, Emery P, McGonagle DG, Marzo-Ortega H. Magnetic resonance imaging assessment of axial psoriatic arthritis: extent of disease relates to HLA-B27. Arthritis Rheum 2013;65(9):2274-8.
59. Gossec L, Smolen JS, Gaujoux-Viala C, Ash Z, Marzo-Ortega H, van der Heijde D, et al. European league against rheumatism recommendations for the management of psoriatic arthritis with pharmacological therapies. Ann Rheum Dis 2012;71(1):4-12.
60. Tan YM, Østergaard M, Doyle A, Dalbeth N, Lobo M, Reeves Q, et al. MRI bone edema scores are higher in the arthritis mutilans form of psoriatic arthritis and correlate with high radiographic scores for joint damage. Arthritis Res Ther 2009;11(1):R2.
61. Poggenborg RP, Wiell C, Boyesen P, Boonen A, Bird P, Pedersen SJ, et al. No overall damage progression despite persistent inflammation in adalimumab-treated psoriatic arthritis patients: results from an investigator-initiated 48-week comparative magnetic resonance imaging, computed tomography and radiography trial. Rheumatology (Oxford) 2014; 53(4):746-56.
62. McQueen F, Lassere M, Bird P, Haavardsholm EA, Peterfy C, Conaghan PG, et al. Developing a magnetic resonance imaging scoring system for peripheral psoriatic arthritis. J Rheumatol 2007; 34(4):859-61.
63. Boyesen P, McQueen FM, Gandjbakhch F, Lillegraven S, Coates L, Wiell C. The OMERACT Psoriatic Arthritis Magnetic Resonance Imaging Score (PsAMRIS) is reliable and sensitive to change: results from an OMERACT workshop. J Rheumatol 2011; 38(9):2034-8.
64. McQueen F, Lloyd R, Doyle A, Robinson E, Lobo M, Exeter M, et al. Zoledronic acid does not reduce MRI erosive progression in PsA but may suppress bone edema: the Zoledronic Acid in Psoriatic Arthritis (ZAPA) Study. Ann Rheum Dis 2011;70(6):1091-4.
65. Mease P, Genovese MC, Gladstein G, Kivitz AJ, Ritchlin C, Tak PP, et al. Abatacept in the treatment of patients with psoriatic arthritis: results of a six-month, multicenter, randomized, double-blind, placebo-controlled, phase II trial. Arthritis Rheum 2011;63(4):939-48.
66. Østergaard M, Glinatsi D, Pedersen SJ. Utility in Clinical Trials of Magnetic Resonance Imaging for Psoriatic Arthritis: A Report from the GRAPPA 2014 Annual Meeting. J Rheumatol 2015 42(6):1044-47.
67. Hermann KG, Braun J, Fischer T, Reisshauer H, Bollow M. Magnetic resonance tomography of sacroiliitis: anatomy, histological pathology, MR-morphology, and grading. Radiologe 2004; 44(3):217-28.
68. Maksymowych WP, Inman RD, Salonen D, Dhillon SS, Williams M, Stone M, et al. Spondyloarthritis research consortium of Canada magnetic resonance imaging index for assessment of sacroiliac joint inflammation in ankylosing spondylitis. Arthritis Rheum 2005;53(5):703-9.
69. Haibel H, Rudwaleit M, Brandt HC, Grozdanovic Z, Listing J, Kupper H, et al. Adalimumab reduces spinal symptoms in active ankylosing spondylitis: clinical and magnetic resonance imaging results of a fifty-two-week open-label trial. Arthritis Rheum 2006; 54(2):678-81.
70. Maksymowych WP, Wichuk S, Chiowchanwisawakit P, Lambert RG, Pedersen SJ. Fat metaplasia and backfill are key intermediaries in the development of sacroiliac joint ankylosis in patients with ankylosing spondylitis. Arthritis Rheumatol 2014; 66(11):2958-67.
71. Maksymowych WP, Wichuk S, Chiowchanwisawakit P, Lambert RG, Pedersen SJ. Development and preliminary validation of the spondyloarthritis research consortium of Canada magnetic resonance imaging sacroiliac joint structural score. J Rheumatol 2015;42(1):79-86.
72. Anandarajah AP, Schwarz EM, Totterman S, Monu J, Feng CY, Shao T, et al. The effect of etanercept on osteoclast precursor frequency and enhancing bone marrow edema in patients with psoriatic arthritis. Ann Rheum Dis 2008 67(3):296-301.
73. Chiowchanwisawakit P, Lambert RG, Conner-Spady B, Maksymowych WP. Focal fat lesions at vertebral corners on magnetic resonance imaging predict the development of new syndesmophytes in ankylosing spondylitis. Arthritis Rheum 2011 63(8):2215-25.
74. Sieper J, Baraliakos X, Listing J, Brandt J, Haibel H, Rudwaleit M, et al. Persistent reduction of spinal inflammation as assessed by magnetic resonance imaging in patients with ankylosing spondylitis after 2 yrs of treatment with the anti-tumour necrosis factor agent infliximab. Rheumatology (Oxford). 2005 44(12):1525-30.
75. Mandl P, Navarro-Compán V, Terslev L, Aegerter P, van der Heijde D, D’Agostino MA, et al. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015 74(7):1327-39.
Imágenes II. Ultrasonografía en Artritis Psoriásica
María Victoria Martire1, Tomás Cazenave2, Javier Rosa3
1Sección Reumatología, Instituto Médico Platense, La Plata
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
3Sección Reumatología, Servicio de Clínica Médica, Hospital Italiano, Buenos Aires
Introducción
La ultrasonografía (US) es una modalidad diagnóstica que permite evaluar el compromiso articular, tendinoso, entésico, cutáneo y ungueal, en pacientes con Artritis Psoriásica (APs). Las recomendaciones EULAR (European League Against Rheumatism) sobre el uso de imágenes en espondiloartritis (EsP), proponen la utilización de la US con fines diagnósticos para la detección de entesitis, artritis periférica, tenosinovitis y bursitis. También podría utilizarse para monitorear la actividad de la enfermedad y evaluar el daño estructural1. A continuación, se describen los puntos más relevantes de la utilidad de la US en pacientes con APs.
Evaluación del compromiso articular y tendinoso
El compromiso articular en APs, detectado por US, es muy similar al que se observa en pacientes con Artritis Reumatoidea (AR). Esta técnica permite evaluar los cambios inflamatorios y el daño estructural. El hallazgo inflamatorio más común es la presencia de sinovitis, la cual se presenta como distensión de la cápsula articular a expensas de líquido sinovial (proceso exudativo), hipertrofia sinovial (proceso proliferativo) o ambos. El grupo OMERACT (Outcomes Measures in Rheumatoid Arthritis Clinical Trials) estableció las siguientes definiciones:
• Derrame sinovial (proceso exudativo): presencia de material intraarticular anormal hipoecoico o anecoico, que es desplazable y compresible.
• Hipertrofia sinovial: presencia de tejido intraarticular anormal hipoecoico y que puede mostrar señal Doppler de poder(DP)2.
Los hallazgos de estas lesiones definen la presencia de sinovitis en escala de grises (EG) (proceso exudativo e hipertrofia sinovial) y suelen graduarse a través de un sistema semicuantitativo con un rango de 0 a 3 [Grado 0=ausente, Grado 1=leve, Grado 2=moderado, y Grado 3=marcado]. Del mismo modo, para evaluar la intensidad de la vascularización por DP, se utiliza una escala semicuantitativa: Grado 0: ausencia de señal; Grado 1: señal solitaria; Grado 2: señal confluyente que ocupa menos del 50% del área de proliferación sinovial; Grado 3: señal que ocupa más del 50% del área de proliferación sinovial3.
Las erosiones óseas pueden detectarse tempranamente con la US y se definen como una solución de continuidad de la cortical del hueso que debe ser visible en dos planos perpendiculares2.
En APs temprana, la sinovitis activa presenta un comportamiento asimétrico y es más frecuente en muñecas (22,3% de las muñecas evaluadas) y manos (2,5% de metacarpofalángicas (MCF) y 0,3% de las articulaciones interfalángicas proximales (IFP))4. Scarpa y col. reportaron una mayor frecuencia del compromiso de IFP y articulaciones interfalángicas distales (IFD)5.
La tenosinovitis se define como la presencia de un tejido engrosado anormal hipoecoico o anecoico, con o sin fluido, dentro de la vaina del tendón, confirmado en dos planos perpendiculares, y que puede presentar señal DP2.
Un hallazgo clínico característico de la APs es la presencia de dactilitis. Las características ecográficas que conforman a esta lesión varían según diferentes estudios, pero lo más comúnmente descripto es la presencia simultánea de tenosinovitis de los tendones flexores, engrosamiento o inflamación de los tendones extensores digitales (paratenonitis), sinovitis y engrosamiento del tejido celular subcutáneo (“pseudotenosinovitis”). Todas las estructuras de la dactilitis pueden presentar señal DP6-7.
Diferentes estudios han demostrado que la US es una técnica sensible para la detección de lesiones inflamatorias y daño estructural en pacientes con APs, aún en aquellos sin compromiso clínico8. En varios estudios se demostró que la US y la resonancia magnética (RM) son más sensibles para detectar cambios inflamatorios y estructurales, comparados con la radiología convencional y la evaluación clínica9-11. Sankowski y col. evaluaron a 50 pacientes con APs y no encontraron diferencias entre la US y la RM para detectar la presencia de erosiones, calcificaciones y reacción perióstica, siendo ambas técnicas superiores a la radiología12. La US también mostró mayor sensibilidad que el examen clínico para la detección de sinovitis en rodillas, caderas y pies13-16. El índice ecográfico SOLAR, diseñado para la evaluación de grandes articulaciones en pacientes con AR, demostró ser una herramienta útil para la detección de sinovitis, con buena sensibilidad al cambio, en pacientes con APs17.
Evaluación de las entesis
La entesis se define como el sitio de unión de los tendones, ligamentos y cápsulas en el hueso. El compromiso de las entesis es una característica distintiva de las EsP. La US ha demostrado mayor sensibilidad en la evaluación de las entesis de pacientes con EsP, comparados con el examen físico y la radiología18. En APs también se encuentran afectadas entesis de menor tamaño (microentesis), como por ejemplo la inserción del tendón extensor en la articulación interfalángica distal en el área de la uña. Además, existen las llamadas “entesitis funcionales”, como la inflamación del tendón extensor digital a nivel de las articulaciones metacarpofalángicas y las poleas digitales19-20.
El grupo OMERACT definió a la entesopatía evaluada por US como la presencia de un tendón alterado en su grosor y su ecoestructura (engrosamiento, hipoecogenicidad y pérdida de la estructura fibrilar) en su inserción al hueso (dentro de 2 mm de la corteza ósea), que puede presentar DP, erosiones, entesofitos y/o calcificaciones (ver Tabla 18)2,21.
Tabla 18. Componentes inflamatorios y estructurales aceptados para la definición ecográfica de entesitis (OMERACT)

Existen otras lesiones, como las bursitis que, a pesar de no estar incluidas en esta definición, pueden ser halladas en estos pacientes22.
Los sitios de entesis evaluados por ecografía en pacientes con EsP se localizan principalmente en la rodilla (tendón del cuádriceps en su inserción distal y tendón rotuliano proximal y distal) y en el hueso calcáneo (inserción distal del tendón de Aquiles y fascia plantar). Otra localización que puede estar afectada es el codo (inserción de los tendones extensores en epicóndilo, tendones flexores en epitróclea y el tendón del tríceps en el olécranon)23.
En varios estudios se demostró que la US y la RM presentan mayor sensibilidad que la evaluación clínica para la detección del compromiso de entesis, incluyendo sitios asintomáticos. La mayoría de estos estudios evaluaron pacientes con EsP, incluyendo a un pequeño número de pacientes con APs23-28.
Se han desarrollado distintos sistemas de puntaje para la evaluación de las entesis en pacientes con EspA, entre ellos el índice GUESS (Glasgow Ultrasound Enthesitis Scoring System)18 y el SEI (Sonographic Entheseal Index)29. D’Agostino y col. evaluaron la utilidad del DP en la entesis para el diagnóstico de EspA. Su detección en al menos una entesis mostró una sensibilidad de 76,5%, especificidad de 81,3% y un likelihood ratio positivo (LR+) de 4,123. De Miguel y col. desarrollaron el índice MASEI, con el cual se determinó un valor de corte ≥18 puntos para el diagnóstico de EspA, alcanzando una sensibilidad de 83,33%, especificidad de 82,76% y un LR+ de 4,8330. Otra herramienta para la evaluación de entesis por US es el Belgrade ultrasound enthesitis score (BUSES)31. En la Tabla 19 se resumen las principales características de los diferentes sistemas de puntaje para la evaluación de las entesis en pacientes con EspA y APs.
Tabla 19. Índices para la evaluación ecográfica de entesis en EspA y APs

También existen índices compuestos que nos dan información no sólo del compromiso de entesis sino de otras estructuras que pueden estar comprometidas en APs. Se desarrollaron dos índices específicos para APs: el PsAS on-Score del cual existen dos versiones, una extendida de 22 articulaciones y 4 entesis (PsASon22) y la versión reducida que evalúa de manera unilateral a 13 articulaciones y 2 entesis3. Gutiérrez y col. desarrollaron un score compuesto en pacientes con APs, que consiste en la evaluación con DP de “5 blancos o targets”: articulaciones, tendones, entesis, placa psoriásica y uñas, el cual mostró buena sensibilidad al cambio con el monitoreo del tratamiento32. Ruta y col. evaluaron la respuesta terapéutica evaluada por US en pacientes con EspA, a través de un sistema de puntaje compuesto. El mismo incluyó la evaluación del compromiso articular, tendinoso y de entesis. Luego de 3 meses desde el cambio o inicio del tratamiento, se observó una reducción estadísticamente significativa en el puntaje del score, demostrando buena sensibilidad al cambio33. En la Tabla 20 se resumen las principales características de estos índices compuestos.
Tabla 20. Índices compuestos

Existe evidencia en la literatura sobre la presencia de entesitis subclínica, detectada por US, en pacientes con psoriasis cutánea34-38. Un estudio comparó los hallazgos de entesopatía en pacientes con APs, psoriasis cutánea y controles sanos. Se observó un mayor puntaje del score MASEI en pacientes con APs, comparado con pacientes con psoriasis cutánea y los controles sanos (p <0,0001). La sensibilidad del MASEI, con un valor de corte ≥20 puntos para clasificar a los pacientes con APs, fue del 30%, con una alta especificidad39. Otro estudio evaluó el valor pronóstico de los hallazgos ecográficos para el desarrollo de APs en pacientes con psoriasis cutánea, luego de 3 años de seguimiento. El mayor espesor del tendón del cuádriceps fue un predictor basal independiente para el desarrollo de APs40. Cazenave y col. evaluaron pacientes con APs, psoriasis cutánea y controles sanos y encontraron que la puntuación media del score GUESS fue significativamente mayor en los pacientes con compromiso cutáneo, comparado con los controles sanos: 8±4 vs 3±2 (p <0,01) y a su vez, mayor en el grupo con APs (13±4) comparado con los otros dos grupos (p <0,01). Con un valor de corte ≥8, el score GUESS mostró una sensibilidad de 94% y una especificidad de 60% para el diagnóstico de APs, considerando a los criterios CASPAR como estándar de oro41.
Evaluación del compromiso cutáneo y ungueal
Piel
Los hallazgos más comunes en la placa psoriásica evaluada por US son el engrosamiento de la epidermis y la dermis, en relación con la piel sana que la rodea. Puede observarse una banda hipoecogénica por debajo cuando el espesor de la placa es marcado e impide el paso del haz de ultrasonido. Estos cambios representan la acantosis, hiperqueratosis y el infiltrado inflamatorio de la dermis. La evaluación con DP permite evidenciar la presencia de aumento de flujo en la dermis generado por la neovascularización42. En diferentes estudios se ha demostrado la mejoría, evaluada por US, del compromiso cutáneo luego del tratamiento con corticoides, ciclosporina, inhibidores del TNF alfa y anti-interleuquina 12/2343-47.
Uñas
Los pacientes con APs y psoriasis cutánea pueden presentar alteraciones ungueales, detectadas por US, observándose una pérdida en la definición de sus bordes, cambios en las placas ungueales (dorsal y ventral), engrosamiento del lecho ungueal (aumento de la distancia entre la placa ventral y el margen óseo de la falange distal) y alteraciones morfológicas de la matriz. Ambas placas pueden verse engrosadas y se pueden fusionar, lo que genera pérdida de la capa anecoica intermedia (pérdida de la trilaminaridad). En condiciones normales puede observarse una mínima cantidad de vascularización en el lecho ungueal, encontrándose aumentada en pacientes con enfermedad psoriásica48.
En un estudio de Aydin y col. se observó que los pacientes con psoriasis tuvieron mayor frecuencia de hallazgos anormales por US a nivel ungueal, comparados con controles sanos [42/86 (48,8%) vs 2/20 (10,0%), p <0,002]. También observaron una mayor frecuencia del compromiso de entesis a nivel de la inserción del tendón extensor en la articulación IFD, en pacientes que presentaban anormalidades clínicas de la uña adyacente (35/83 vs 15/86, p=0,001)49. En un reciente estudio se encontró que el US fue más sensible que el examen clínico para la detección de lesiones ungueales en pacientes con APs (67% vs 37% (p <0,05))50.
Utilidad en el monitoreo terapéutico
La evaluación por US fue utilizada en diferentes estudios para la evaluación de la respuesta al tratamiento con inhibidores del anti-TNF en pacientes con EsP y con APs, específicamente51-56. Fiocco y col. evaluaron prospectivamente a 8 pacientes con APs que recibieron terapia con etanercept, los cuales presentaron a los 3 y 12 meses de seguimiento una reducción significativa (p <0,001) del engrosamiento sinovial y de la señal DP52. En un estudio de Naredo y col. se evaluó la respuesta terapéutica por US luego de seis meses de tratamiento con adalimumab, en pacientes con EsP. Hubo una mejoría significativa en las lesiones inflamatorias a nivel de las entesis (p <0,05) (ecoestructura, bursitis y señal DP), pero no hubo modificaciones en las lesiones corticales (erosiones y entesofitos)53. En cambio, De Miguel y col. utilizando una sonda volumétrica tridimensional, demostraron la desaparición del 50% de las erosiones óseas en la inserción del tendón de Aquiles, luego de 12 meses de seguimiento, en 68 pacientes con EsP54.
Un estudio comparó los hallazgos ecográficos en pacientes con APs, utilizando dosis habituales de anti-TNF alfa y dosis reducidas o aumento en el intervalo de dosis, y no se hallaron diferencias significativas en la presencia de lesiones inflamatorias entre ambos grupos55.
En un estudio prospectivo reciente se observó una mejoría significativa de la señal DP, luego de 24 semanas de tratamiento con secukinumab, en 20 pacientes con APs56. También se observó una buena respuesta ecográfica con el uso de apremilast, luego de 45 días de tratamiento, en 13 pacientes con APs57.
La presencia basal de DP demostró ser un fuerte predictor para el desarrollo de recaídas en pacientes con APs (Riesgo relativo: 11, IC 95% 2,8-44, p <0,001)58. Actualmente se están enrolando pacientes en el estudio UPSTREAM (Ultrasound in PSoriatic arthritis TREAtMent) que tiene como objetivo evaluar el valor adicional de la US sobre el examen clínico para determinar predictores de respuesta al tratamiento en pacientes con APs que logran una mínima actividad de la enfermedad por un período superior a los 6 meses59.
Utilidad para evaluación de diagnósticos diferenciales
La US ha sido propuesta como una herramienta para diferenciar a la APs de otras patologías inflamatorias, principalmente de la AR60. Wiell y col. demostraron un mayor compromiso de las articulaciones interfalángicas distales en pacientes con APs, comparados con AR, principalmente en el desarrollo de erosiones y proliferación ósea. La frecuencia de sinovitis fue similar en ambas entidades, pero los pacientes con AR presentaron una mayor tendencia a presentar sinovitis en articulaciones MCF e IFP9. En otro estudio se observó que la sinovitis y la tenosinovitis fueron hallazgos comunes a ambas entidades, mientras que las lesiones extrasinoviales fueron más frecuentes en pacientes con APs (21 de 24 dedos (87%) en pacientes con APs y ningún dedo en pacientes con AR). El compromiso extrasinovial incluye la presencia de entesofitos a nivel de la inserción capsular, reacción perióstica yuxtaarticular, entesopatía en la inserción del tendón flexor profundo en la falange distal y engrosamiento del tejido celular subcutáneo61.
Gutiérrez y col. evaluaron el aspecto dorsal de 83 articulaciones MCF de 18 pacientes con AR y 82 articulaciones MCF de 20 pacientes con APs. En los pacientes con AR ningún paciente presentó inflamación peritendinosa a nivel de los tendones extensores digitales, mientras que el 65,8% de las articulaciones MCF de los pacientes con APS presentaron dicho patrón (p=0,001)62. Recientemente, Zabotti y col. confirmaron estos hallazgos en pacientes con AR y APs temprana. Además, a nivel de las articulaciones interfalángicas proximales, la entesitis y el edema de partes blandas fueron hallazgos exclusivos del grupo de pacientes con APs temprana63.
Marchesoni y col. mostraron las principales diferencias a nivel de las entesis, comparando pacientes con fibromialgia y APs. En este último grupo, se encontraron mayores fenómenos inflamatorios (70% vs 23%). La presencia de erosiones y señal DP fue muy específica de APs64.
US como guía de procedimientos invasivos
A pesar de la escasa literatura que existe en pacientes con APs, la US puede ser una guía útil para realizar artrocentesis e infiltraciones terapéuticas. Algunos estudios apoyan el uso de la ecografía para la realización de infiltraciones, dado que son más efectivos que el método convencional guiado por palpación65-67.
Conclusiones
La US es una herramienta útil para evaluar la actividad inflamatoria y el daño estructural en pacientes con APs. Existe evidencia que muestra que es más sensible para la detección del compromiso inflamatorio y el daño estructural que el examen físico y otras técnicas de imágenes, reflejando la utilidad adicional para el diagnóstico y monitoreo de la enfermedad. Además, algunas características evaluadas por US, permiten distinguir a los pacientes con APs de otras patologías, principalmente la AR. Por otro lado, es una herramienta útil para guiar procedimientos invasivos. Es necesario contar con más estudios que nos permitan determinar su rol en la optimización del tratamiento de los pacientes con APs y su valor como herramienta pronóstica.
Referencias
1. Mandl P, Navarro-Compán V, Terslev L, Aegerter P, van der Heijde D, D'Agostino MA, et al; European League Against Rheumatism (EULAR). EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015;74(7):1327-39.
2. Wakefield RJ, Balint PV, Szkudlarek M, Filippucci E, Backhaus M, et al. OMERACT 7 Special Interest Group. Musculoskeletal ultrasound including definitions for ultrasonographic pathology. J Rheumatol 2005;32(12):2485-7.
3. Ficjan A, Husic R, Gretler J, Lackner A, Graninger WB, Gutiérrez M, et al. Ultrasound composite scores for the assessment of inflammatory and structural pathologies in Psoriatic Arthritis (PsASon-Score). Arthritis Res Ther 2014;31;16(5):476.
4. Bandinelli F, Denaro V, Prignano F, Collaku L, Ciancio G, Matucci-Cerinic M. Ultrasonographic wrist and hand abnormalities in early psoriatic arthritis patients: correlation with clinical, dermatological, serological and genetic indices. Clin Exp Rheumatol. 2015;33(3):330-5.
5. Scarpa R, Cuocolo A, Peluso R, Atteno M, Gisonni P, Iervolino S, et al. Early psoriatic arthritis: the clinical spectrum. J Rheumatol 2008; 35(1):137-41.
6. Olivieri I, Barozzi L, Favaro L, Pierro A, de Matteis M, Borghi C, et al. Dactylitis in patients with seronegative spondylarthropathy. Assessment by ultrasonography and magnetic resonance imaging. Arthritis Rheum 1996; 39(9):1524-8.
7. Kane D, Greaney T, Bresnihan B, Gibney R, FitzGerald O. Ultrasonography in the diagnosis and management of psoriatic dactylitis. J Rheumatol 1999;26(8):1746-51.
8. Weiner SM, Jurenz S, Uhl M, Lange-Nolde A, Warnatz K, Peter HH, et al. Ultrasonography in the assessment of peripheral joint involvement in psoriatic arthritis: a comparison with radiography, MRI and scintigraphy. Clin Rheumatol. 2008;27(8):983-9.
9. Wiell C, Szkudlarek M, Hasselquist M, Møller JM, Vestergaard A, Nørregaard J, et al. Ultrasonography, magnetic resonance imaging, radiography, and clinical assessment of inflammatory and destructive changes in fingers and toes of patients with psoriatic arthritis. Arthritis Res Ther 2007;9(6):R119.
10. Backhaus M, Kamradt T, Sandrock D, Loreck D, Fritz J, Wolf KJ, et al. Arthritis of the finger joints: a comprehensive approach comparing conventional radiography, scintigraphy, ultrasound, and contrast-enhanced magnetic resonance imaging. Arthritis Rheum 1999;42(6):1232-45.
11. Backhaus M, Burmester GR, Sandrock D, Loreck D, Hess D, Scholz A, et al. Prospective two year follow up study comparing novel and conventional imaging procedures in patients with arthritic finger joints. Ann Rheum Dis 2002;61(10):895-904.
12. Sankowski AJ, Lebkowska UM, Cwikła J, Walecka I, Walecki J. The comparison of efficacy of different imaging techniques (conventional radiography, ultrasonography, magnetic resonance) in assessment of wrist joints and metacarpophalangeal joints in patients with psoriatic arthritis. Pol J Radiol 2013;78(1):18-29.
13. Delle Sedie A, Riente L, Filippucci E, Scirè CA, Iagnocco A, Gutierrez M, et al. Ultrasound imaging for the rheumatologist XXVI. Sonographic assessment of the knee in patients with psoriatic arthritis. Clin Exp Rheumatol 2010;28(2):147-52.
14. Riente L, Delle Sedie A, Sakellariou G, Filippucci E, Meenagh G, Iagnocco A, et al. Ultrasound imaging for the rheumatologist XXXVIII. Sonographic assessment of the hip in psoriatic arthritis patients. Clin Exp Rheumatol 2012; 30(2):152-5.
15. Delle Sedie A, Riente L, Filippucci E, Scirè CA, Iagnocco A, Meenagh G, et al. Ultrasound imaging for the rheumatologist. XXXII. Sonographic assessment of the foot in patients with psoriatic arthritis. Clin Exp Rheumatol 2011; 29(2):217-22.
16. Riente L, Delle Sedie A, Filippucci E, Iagnocco A, Sakellariou G, Talarico R, et al. Ultrasound imaging for the rheumatologist XLV. Ultrasound of the shoulder in psoriatic arthritis. Clin Exp Rheumatol 2013;31(3):329-33.
17. Schäfer VS, Fleck M, Kellner H, Strunk J, Sattler H, Schmidt WA, et al. Evaluation of the novel ultrasound score for large joints in psoriatic arthritis and ankylosing spondylitis: six month experience in daily clinical practice. BMC Musculoskelet Disord 2013;19;14:358.
18. Balint PV, Kane D, Wilson H, McInnes IB, Sturrock RD. Ultrasonography of entheseal insertions in the lower limb in spondyloarthropathy. Ann Rheum Dis 2002;61(10):905-10.
19. Zabotti A, Idolazzi L, Batticciotto A, De Lucia O, Scirè CA, Tinazzi I, et al. Enthesitis of the hands in psoriatic arthritis: an ultrasonographic perspective. Med Ultrason. 2017; 29;19(4):438-443.
20. Aydin SZ, Castillo-Gallego C, Ash ZR, Marzo-Ortega H, Emery P, Wakefield RJ, et al. Ultrasonographic assessment of nail in psoriatic disease shows a link between onychopathy and distal interphalangeal joint extensor tendon enthesopathy. Dermatology 2012; 225(3):231-5.
21. Balint PV, Terslev L, Aegerter P, Bruyn GAW, Chary-Valckenaere I, Gandjbakhch F, et al; OMERACT Ultrasound Task Force members. Reliability of a consensus-based ultrasound definition and scoring for enthesitis in spondyloarthritis and psoriatic arthritis: an OMERACT US initiative. Ann Rheum Dis. 2018;77(12):1730-1735.
22. Falcao S, de Miguel E, Castillo-Gallego C, Peiteado D, Branco J, Martín Mola E. Achilles enthesis ultrasound: the importance of the bursa in spondyloarthritis. Clin Exp Rheumatol. 2013; 31(3):422-7.
23. D’Agostino MA, Said-Nahal R, Hacquard-Bouder C, Brasser JL, Dougados M, Breban M. Assessment of Peripheral Enthesitis in the Spondylarthropathies by ultrasonography Combined with Power Doppler. A Cross-Sectional Study. Arthritis Rheum 2003;48(2):523-33.
24. Lehtinen A, Taavitsainen M, Leirisalo-Repo M. Sonographic analysis of enthesopathy in the lower extremities of patients with spondylarthropathy. Clinical and Experimental Rheumatology 1994; 12(2):143-8.
25. Ruta S, Gutiérrez M, Pena C, García M, Arturi A, Filippucci E, et al. Prevalence of subclinical enthesopathy in patients with spondyloarthropathy: an ultrasound study. J Clin Rheumatol 2011;17:18-22.
26. Scarpa R, Cuocolo A, Peluso R, Atteno M, Gisonni P, Iervolino S, et al. Early psoriatic arthritis: the clinical spectrum. J Rheumatol 2008; 35(1):137-41.
27. Kamel M, Eid H, Mansour R. Ultrasound detection of heel enthesitis: a comparison with magnetic resonance imaging. J Rheumatol. 2003; 30(4):774-8.
28. Kamel M, Eid H, Mansour R. Ultrasound detection of knee patellar enthesitis: a comparison with magnetic resonance imaging. Ann Rheum Dis 2004;63(2):213-4.
29. Alcalde M, Acebes JC, Cruz M, González-Hombrado L, Herrero-Beaumont G, Sánchez-Pernaute O. A sonographic enthesitic index of lower limbs is a valuable tool in the assessment of ankylosing spondylitis. Ann Rheum Dis 2007; 66(8):1015-9.
30. de Miguel E, Cobo T, Muñoz-Fernández S, Naredo E, Usón J, Acebes JC, et al. Validity of enthesis ultrasound assessment in spondyloarthropathy. Ann Rheum Dis 2009; 68(2):169-74.
31. Milutinovic S, Radunovic G, Veljkovic K, Zlatanovic M, Zlatkovic Svenda M, Perovic Radak M, et al. Development of ultrasound enthesitis score to identify patients with enthesitis having spondyloarthritis: prospective, double-blinded, controlled study. Clin Exp Rheumatol 2015; 33(6):812-7.
32. Gutiérrez M, Di Geso L, Salaffi F, Bertolazzi C, Tardella M, Filosa G, et al. Development of a preliminary US power Doppler composite score for monitoring treatment in PsA. Rheumatology (Oxford) 2012; 51(7):1261-8.
33. Ruta S, Acosta Felquer ML, Rosa J, Navarta DA, García Monaco R, Soriano ER. Responsiveness to therapy change of a global ultrasound assessment in spondyloarthritis patients. Clin Rheumatol 2015; 34(1):125-32.
34. Gutiérrez M, Filippucci E, De Angelis R, Salaffi F, Filosa G, Ruta S, et al. Subclinical entheseal involvement in patients with psoriasis: an ultrasound study. Semin Arthritis Rheum 2011; 40(5):407-12.
35. Naredo E, Möller I, de Miguel E, Batlle-Gualda E, Acebes C, Brito E, et al. Ultrasound School of the Spanish Society of Rheumatology and Spanish ECO-APs Group. High prevalence of ultrasonographic synovitis and enthesopathy in patients with psoriasis without psoriatic arthritis: a prospective case-control study. Rheumatology (Oxford). 2011; 50(10):1838-48.
36. Gisondi P, Tinazzi I, El-Dalati G, Gallo M, Biasi D, Barbara LM, et al. Lower limb enthesopathy in patients with psoriasis without clinical signs of arthropathy: a hospital-based case-control study. Ann Rheum Dis 2008; 67(1):26-30.
37. Acquacalda E, Albert C, Montaudie H, Fontas E, Danre A, Roux CH, et al. Ultrasound study of entheses in psoriasis patients with or without musculoskeletal symptoms: A prospective study. Joint Bone Spine 2015; 82(4):267-71.
38. Pistone G, La Vecchia M, Pistone A, Bongiorno MR. Achilles tendon ultrasonography may detect early features of psoriatic arthropathy in patients with cutaneous psoriasis. Br J Dermatol 2014; 171(5):1220-2.
39. Eder L, Jayakar J, Thavaneswaran A, Haddad A, Chandran V, Salonen D, et al. Is the Madrid Sonographic Enthesitis Index useful for differentiating psoriatic arthritis from psoriasis alone and healthy controls?. J Rheumatol 2014; 41(3):466-72.
40. Tinazzi I, McGonagle D, Biasi D, Confente S, Caimmi C, Girolomoni G, et al. Preliminary evidence that subclinical enthesopathy may predict psoriatic arthritis in patients with psoriasis. J Rheumatol 2011; 38(12):2691-2.
41. Cazenave T, Waimann C, Citera G, Latorre C, Ubogui J, Saposnik M, et al. La utilidad de la ultrasonografía como herramienta diagnóstica para detectar artritis psoriásica en pacientes con psoriasis. Rev Arg Reumatol. 2017; 28(1):17-21.
42. Gutierrez M, Wortsman X, Filippucci E, De Angelis R, Filosa G, Grassi W. High-frequency sonography in the evaluation of psoriasis: nail and skin involvement. J Ultrasound Med 2009;28(11):1569-74.
43. Cucoş M, Crişan M, Lenghel M, Dudea M, Croitoru R, Dudea SM. Conventional ultrasonography and sonoelastography in the assessment of plaque psoriasis under topical corticosteroid treatment - work in progress. Med Ultrason 2014;16(2):107-13.
44. Gutierrez M, De Angelis R, Bernardini ML, Filippucci E, Goteri G, Brandozzi G, et al. Clinical, power Doppler sonography and histological assessment of the psoriatic plaque: short-term monitoring in patients treated with etanercept. Br J Dermatol 2011;164(1):33-7.
45. De Agustín JJ, Moragues C, De Miguel E, Möller I, Acebes C, Naredo E, et al. A multicentre study on high-frequency ultrasound evaluation of the skin and joints in patients with psoriatic arthritis treated with infliximab. Clin Exp Rheumatol 2012;30(6):879-85.
46. Micali G, Lacarrubba F, Santagati C, Egan CG, Nasca MR, Musumeci ML. Clinical, ultrasound, and videodermatoscopy monitoring of psoriatic patients following biological treatment. Skin Res Technol 2016; 22(3):341-8.
47. Musumeci ML, Lacarrubba F, Fusto CM, Micali G. Combined clinical, capillaroscopic and ultrasound evaluation during treatment of plaque psoriasis with oral cyclosporine. Int J Immunopathol Pharmacol 2013; 26(4):1027-33.
48. Sandobal C, Carbó E, Iribas J, Roverano S, Paira S. Ultrasound nail imaging on patients with psoriasis and psoriatic arthritis compared with rheumatoid arthritis and control subjects. J Clin Rheumatol 2014; 20(1):21-4.
49. Aydin SZ, Castillo-Gallego C, Ash ZR, Marzo-Ortega H, Emery P, Wakefield RJ, et al. Ultrasonographic assessment of nail in psoriatic disease shows a link between onychopathy and distal interphalangeal joint extensor tendon enthesopathy. Dermatology 2012;225(3):231-5.
50. Arbault A, Devilliers H, Laroche D, Cayot A, Vabres P, Maillefert JF, et al. Reliability, validity and feasibility of nail ultrasonography in psoriatic arthritis. Joint Bone Spine. 2016;83(5):539-44.
51. Litinsky I, Balbir-Gurman A, Wollman J, Arad U, Paran D, Caspi D, et al. Ultrasound assessment of enthesis thickening in psoriatic arthritis patients treated with adalimumab compared to methotrexate. Clin Rheumatol 2016;35(2):363-70.
52. Fiocco U, Ferro F, Vezzú M, Cozzi L, Checchetto C, Sfriso P, et al. Rheumatoid and psoriatic knee synovitis: clinical, grey scale, and power Doppler ultrasound assessment of the response to etanercept. Ann Rheum Dis 2005; 64(6):899-905.
53. Naredo E, Batlle-Gualda E, García-Vivar ML, García-Aparicio AM, Fernández-Sueiro JL, Fernández-Prada M, et al. Ultrasound Group of the Spanish Society of Rheumatology. Power Doppler ultrasonography assessment of entheses in spondyloarthropathies: response to therapy of entheseal abnormalities. J Rheumatol 2010;37(10):2110-7.
54. de Miguel E, Falcao S, Castillo C, Plasencia C, García M, Branco JC, et al. Enthesis erosion in spondyloarthritis is not a persistent structural lesion. Ann Rheum Dis 2011 Nov;70(11):2008-10.
55. Janta I, Martínez-Estupiñán L, Valor L, Montoro M, Baniandres Rodríguez O, Hernández Aragüés I, et al. Comparison between full and tapered dosages of biologic therapies in psoriatic arthritis patients: clinical and ultrasound assessment. Clin Rheumatol 2015;34(5):935-42.
56. Kampylafka E, d'Oliveira I, Linz C, Lerchen V, Stemmler F, Simon D, et al. Resolution of synovitis and arrest of catabolic and anabolic bone changes in patients with psoriatic arthritis by IL-17A blockade with secukinumab: results from the prospective PSARTROS study. Arthritis Res Ther 2018; 20(1):153.
57. Ceccarelli F, Lucchetti R, Spinelli FR, Perricone C, Truglia S, Miranda F, et al. Early response to apremilast treatment in psoriatic arthritis: a real-life ultrasonographic follow-up study. Rheumatology (Oxford). 2018; 57(8):1490-1.
58. Ruta S, Marin J, Acosta Felquer ML, Ferreyra-Garrot L, Rosa J, García-Monaco R, et al. Utility of Power Doppler ultrasound-detected Synovitis for the Prediction of Short-term Flare in Psoriatic Patients with Arthritis in Clinical Remission. J Rheumatol. 2017 Jul; 44(7):1018-1023.
59. Canzoni M, Piga M, Zabotti A, Scirè CA, Carrara G, Olivieri I, et al. Clinical and ultrasonographic predictors for achieving minimal disease activity in patients with psoriatic arthritis: the UPSTREAM (Ultrasound in PSoriatic arthritis TREAtMent) prospective observational study protocol. BMJ Open. 2018 Jul 10;8(7):e021942
60. Lin Z, Wang Y, Mei Y, Zhao Y, Zhang Z. High-Frequency ultrasound in the Evaluation of Psoriatic Arthritis: A Clinical Study. Am J Med Sci 2015;350(1):42-6.
61. Fournié B, Margarit-Coll N, Champetier de Ribes TL, Zabraniecki L, Jouan A, Vincent V, et al. Extrasynovial ultrasound abnormalities in the psoriatic finger. Prospective comparative power-Doppler study versus rheumatoid arthritis. Joint Bone Spine 2006;73(5):527-31.
62. Gutierrez M, Filippucci E, Salaffi F, Di Geso L, Grassi W. Differential diagnosis between rheumatoid arthritis and psoriatic arthritis: the value of ultrasound findings at metacarpophalangeal joints level. Ann Rheum Dis 2011;70(6):1111-4.
63. Zabotti A, Salvin S, Quartuccio L, De Vita S. Differentiation between early rheumatoid and early psoriatic arthritis by the ultrasonographic study of the synovio-entheseal complex of the small joints of the hands. Clin Exp Rheumatol 2016;34(3):459-65.
64. Marchesoni A, De Lucia O, Rotunno L, De Marco G, Manara M. Entheseal power Doppler ultrasonography: a comparison of psoriatic arthritis and fibromyalgia. J Rheumatol Suppl 2012; 89:29-31.
65. Cunnington J, Marshall N, Hide G, Bracewell C, Isaacs J, Platt P, et al. A randomized, double-blind, controlled study of ultrasound-guided corticosteroid injection into the joint of patients with inflammatory arthritis. Arthritis Rheum. 2010;62(7):1862-9.
66. Sibbitt WL Jr, Band PA, Chavez-Chiang NR, Delea SL, Norton HE, Bankhurst AD. A randomized controlled trial of the cost-effectiveness of ultrasound-guided intraarticular injection of inflammatory arthritis. J Rheumatol. 2011; 38(2):252-63.
67. Di Geso L, Filippucci E, Meenagh G, Gutierrez M, Ciapetti A, Salaffi F, et al. CS injection of tenosynovitis in patients with chronic inflammatory arthritis: the role of US. Rheumatology (Oxford). 2012; 51(7):1299-303.
Recomendaciones de tratamiento en Artritis Psoriásica: Guías argentinas de práctica clínica, diagnóstico, evaluación y tratamiento en pacientes con Artritis Psoriásica
Sociedad Argentina de Reumatología
Introducción
La Artritis Psoriásica (APs) es una enfermedad heterogénea con afectación de uno o múltiples dominios y con un curso variable en su forma de presentación y pronóstico.
Estas guías tienen como principal objetivo asistir al médico reumatólogo durante su práctica diaria en el manejo de pacientes adultos con Artritis Psoriásica, con el fin de brindar un cuidado óptimo. También pretende ser de utilidad para todos los integrantes del sistema de salud, incluyendo administradores de salud, financiadores y autoridades regulatorias. En definitiva, para todos aquellos quienes tengan un rol determinado en el cuidado de estos pacientes. Cabe remarcar, que estas recomendaciones no están dirigidas a pacientes que presenten solo compromiso cutáneo, ya que existe una guía, recientemente actualizada sobre manejo de Psoriasis, desarrollada por dermatólogos expertos en el tema.
International Journal of Dermatology 2019, 58 (Suppl. 1), 4-28
Al momento de formular las recomendaciones se tuvieron en cuenta las demandas y preferencias de los pacientes así como también los distintos escenarios clínicos que se pudieran presentar dentro del diverso sistema de cobertura médica de nuestro país. Por este motivo, destacamos la importancia del desarrollo de estas guías de tratamiento, que representan las necesidades particulares de nuestro medio. Consideramos además, la necesidad de actualizaciones en forma periódica.
Metodología
Natalia Zamora1, Emilce Schneeberger1
1Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
La Guía argentina de diagnóstico y tratamiento en Artritis Psoriásica (APs) fue desarrollada en dos partes. Una primera parte contiene diferentes capítulos sobre: Introducción a la APs, Realidad de la APs en Argentina, Compromiso articular, Manifestaciones extraarticulares y Medidas de evaluación; la misma fue escrita mediante una exhaustiva búsqueda bibliográfica. La segunda parte se refiere a las Recomendaciones de tratamiento en APs. Este segmento consistió en tres etapas: en la primera etapa, un panel de médicos desarrolló las preguntas PICO (Población, Intervención, Comparador y Outcomes). En la segunda etapa, un equipo de médicos se encargó de la búsqueda bibliográfica y de la categorización de la evidencia científica. En una tercera etapa, un panel de expertos luego de la presentación de la evidencia científica sobre cada una de las preguntas PICO, votó la fuerza de la recomendación. Todos los médicos participantes declararon sus conflictos de interés relevantes para el desarrollo de esta guía.
1° etapa. Desarrollo de las preguntas PICO (Suplemento 1 online http://www.revistasar.org.ar)
Un grupo de 10 médicos reumatólogos desarrolló preguntas PICO (población, intervención, comparador y resultados) relacionadas con tratamiento farmacológico y no farmacológico. Las intervenciones y los comparadores fueron seleccionados con el fin de lograr un adecuado balance entre factibilidad y relevancia clínica.
2° etapa. Revisión sistemática de la literatura (Suplemento 2 online http://www.revistasar.org.ar)
El equipo de metodología fue liderado por un especialista en búsquedas bibliográficas y metodología GRADE (Grading of Recommendations Assessment, Development, and Evaluation) y 4 médicos reumatólogos. Se realizaron revisiones sistemáticas de la literatura para identificar evidencia relevante a las preguntas PICO. Las bases de datos utilizadas fueron Medline (hasta 03/2017) y PubMed, Lilacs y Biblioteca Cochrane (hasta 3/2018). Además, se consideró literatura gris obtenida a través de los archivos de resúmenes de los congresos ACR y EULAR. Las revisiones fueron realizadas utilizando términos específicos y palabras claves relacionadas a los dominios de interés: APs, eventos adversos, fisioterapia, AINEs, Corticoides, Bifosfonatos, DMARDs (disease-modifying antirheumatic drugs) convencionales, inhibidores del factor de necrosis tumoral alfa (TNFi) (Adalimumab, Certolizumab pegol, Etanercept, Golimumab, o Infliximab), agentes biológicos no-TNFα (Ustekinumab, Secukinumab). También, se incluyeron agentes con inminente aprobación en APs (Apremilast, Tofacitinib, Abatacept e Ixekizumab). Las búsquedas fueron limitadas a adultos, los artículos duplicados fueron eliminados. Se excluyeron revisiones narrativas, reportes de casos y editoriales.
a) Selección de estudios: El proceso de selección de artículos fue realizado en Covidence software1. El proceso de tamizaje de títulos, resúmenes y de artículos completos, fue llevado a cabo por cuatro de los integrantes del equipo, en forma independiente, trabajando de a pares y un tercer revisor (el líder del equipo) resolvió los conflictos de inclusión versus exclusión. Los artículos incluidos fueron juzgados y seleccionados para cada pregunta PICO.
b) Extracción de datos y análisis: La extracción de datos para cada pregunta PICO fue realizada en RevMan software2. La metodología GRADE fue seguida para la inclusión, teniendo en cuenta la mayor calidad de evidencia. Los desenlaces continuos fueron analizados usando el método de inversa de varianza en modelo de efectos aleatorizados reportados como media con 95% de intervalo de confianza y desvío estándar. Los dicotómicos fueron incluidos y analizados por método Mantel-Haenszel en modelo de efectos aleatorizados reportados como riesgo de radios (RR) con 95% de intervalo de confianza.
c) Evaluación de calidad y formulación de reporte de evidencia: Cada carpeta creada en RevMan software fue exportada en GRADE software3 para la creación de las tablas con el resumen de la evidencia (Summary of findings tables). La evaluación de calidad fue evaluada y realizada por los evaluadores independientes siguiendo los estándares de GRADE. En esta etapa, los conflictos fueron resueltos por consenso. La evaluación para cada desenlace incluyó el análisis de: riesgo de sesgo, posibilidad de sesgo de publicación, inconsistencia, incongruencia en dirección de la evidencia e imprecisión. La metodología GRADE diferencia 4 niveles de calidad, basado en el grado de confianza que la medida de efecto alcanzada luego del análisis de los estudios sea cercana al efecto real. Por tal motivo, la calidad de evidencia final de cada desenlace puede ser: alta, moderada, baja o muy baja. En caso de ausencia de evidencia o evidencia obtenida a través de expertos, el desenlace fue catalogado como de calidad muy baja.
3° etapa. Votación de las recomendaciones - Consenso
Un panel de 25 reumatólogos con experiencia clínica en tratar pacientes con APs representantes de todas las filiales de la Sociedad Argentina de Reumatología (SAR), recibió con anticipación, el reporte de la evidencia, con el fin de que el mismo pueda ser revisado antes de la votación.
Posteriormente, se organizó una reunión presencial, a la cual asistió el panel de reumatólogos, quienes recibieron una presentación oral con la evidencia seleccionada de cada pregunta PICO resumida. El proceso de votación fue anónimo y para la definición de cada recomendación fue utilizado el Poll Everywhere software4. Si mediante la votación no se alcanzaba un consenso de acuerdo ≥70% en primera instancia, se discutía el tema y se realizaba una segunda votación. Si luego de tres votaciones no se alcanzaba el nivel de acuerdo deseado se consideraba, finalmente, como falta de acuerdo.
Cada recomendación fue realizada considerando el balance riesgo/beneficio y la calidad de la evidencia. Las recomendaciones pueden ser: a favor o en contra de la intervención y fuertes o débiles. De acuerdo a GRADE, una recomendación es fuerte si la mayor parte del panel de expertos está confiado que los beneficios superan ampliamente a los riesgos o viceversa. Por el contrario, una recomendación es débil cuando genera incertidumbre entre el balance riesgo/beneficio y daño o cuando posee una calidad de evidencia baja o muy baja.





Referencias
1. Covidence systematic review software, Veritas Health Innovation, Melbourne, Australia. Disponible en: www. covidence.org.
2. Review Manager (RevMan) [Computer program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014. Disponible en: https://community.cochrane.org/help/tools-and-software/revman-5.
3. GRADEpro GDT: GRADEpro Guideline Development Tool [Software]. McMaster University, 2015 (developed by Evidence Prime, Inc.). Disponible en: gradepro.org.
4. Poll Everywhere software. Disponible en: https://www. polleverywhere.com.
Algoritmo de tratamiento
V Cosentino1, G Citera2, EE Schneeberger2, ER Soriano3
1Sección Reumatología, Servicio Clinica Médica. Hospital Dr. J.M Ramos Mejía, Buenos Aires
2Sección Reumatología, Instituto de Rehabilitación Psicofísica (IREP), Buenos Aires
3Sección Reumatología, Servicio Clínica Médica, Hospital Italiano, Buenos Aires
El algoritmo de tratamiento ha sido construido con fines prácticos a los efectos de una rápida visualización de las principales recomendaciones sugeridas por expertos. Solamente hemos incluido las recomendaciones a favor, ya sea fuertes o débiles y NO hemos incluido las recomendaciones en contra, las cuales están detalladas en los capítulos correspondientes.
Para su mejor aplicación en la práctica diaria, ha sido dividido por dominios característicamente involucrados en la APs, aunque hay que tener en cuenta, que muchos pacientes suelen manifestar compromiso de varios dominios en forma simultánea. Teniendo en cuenta esto, sumado a las comorbilidades concomitantes frecuentemente asociadas a esta enfermedad, recomendamos que las decisiones de tratamiento en pacientes individuales sean siempre basadas en el buen juicio del médico reumatólogo tratante y teniendo en cuenta la actividad de la enfermedad, los factores pronósticos y el acceso local a las diferentes terapias.
Las referencias de cómo interpretar el algoritmo se encuentran al pie de página. Cada recuadro presenta un color distintivo refiriendo la fuerza de recomendación del panel de expertos, para esa estrategia terapéutica.



Guía Argentina de diagnóstico y tratamiento en Artritis Psoriásica. Recomendaciones de tratamiento en Artritis Psoriásica
Sociedad Argentina de Reumatología
Tabla 26. Tabla de referencia para las recomendaciones
![]()
Importancia de diagnóstico temprano y tratamiento intensivo en pacientes con Artritis Psoriásica (APs)

El ensayo TICOPA (Tight COntrol in Psoriatic Arthritis) comparó el efecto de la estrategia de “tratamiento intensivo” (tight control), utilizando una estrategia de tratamiento dirigido al objetivo o “treat to target” versus una estrategia de “cuidado estándar” (standard care) en pacientes con APs temprana a 48 semanas. Este estudio concluyó que los pacientes que fueron seguidos bajo la estrategia de tratamiento intensivo presentaron mejores resultados en diferentes evaluaciones, como BASDAI, BASFI, PsAQoL, HAQ y ASAS, sin presentar mayores eventos adversos.1 (Ver TABLA 1 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Alta
Un subanálisis del ensayo clínico PRESTA comparó la eficacia de Etanercept (ETN) en pacientes con APs de menos de 2 años de evolución vs APs de más de 2 años de evolución, a 24 semanas. Este estudio encontró que los pacientes con APs respondieron al tratamiento con ETN irrespectivamente del tiempo de evolución de la enfermedad. Los desenlaces extraídos en la tabla no reflejaron diferencias significativas entre los grupos, probablemente debido al diseño del estudio. Sin embargo, aquellos pacientes con menor tiempo de evolución tuvieron mejorías significativas en algunos desenlaces reportados por pacientes (PROs), no reflejados en la tabla (ej: dolor articular, EQ-5D VAS, actividad de artritis)2. (Ver TABLA 2 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Baja
Fuerza de recomendación: Fuerte a favor
Referencias
1. Coates L, Moverley A, McParland L, Brown S, Collier H, Brown SR, et al. Effect of tight control of inflammation in early psoriatic arthritis (TICOPA): A multicentre, open-label, randomised controlled trial. Lancet 2015;386(10012):2489-98.
2. Kirkham B, de Vlam K, Li W, Boggs R, Mallbris L, Nab HW, et al. Early treatment of psoriatic arthritis is associated with improved patient-reported outcomes: findings from the etanercept PRESTA trial. Clin Exp Rheumatol 2015;33(1):11-9.
Antiinflamatorios No Esteroides (AINEs)

En un ensayo clínico de Celecoxib realizado en pacientes con APs, el cual fue randomizado y doble ciego, se evaluó eficacia y seguridad de Celecoxib 200 mg o 400 mg vs placebo (PBO), en pacientes que se encontraban activos de la enfermedad. A la semana 2, la respuesta ACR 20 fue significativamente superior para ambas dosis de Celecoxib versus PBO. Sin embargo, este estudio no alcanzó significancia estadística para los desenlaces evaluados en las dos dosis de Celecoxib con respecto a PBO en la semana 123. (Ver TABLA 3 - Suplemento 3 online http://www.revistasar.org.ar)
No se encontró evidencia disponible para extraer otros datos, de ensayos clínicos o de estudios observacionales con diferentes AINEs o con AINEs versus PBO.
Calidad de la evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
3. Kivitz AJ, Espinoza LR, Sherrer YR, Liu-Dumaw M, West CR. A comparison of the efficacy and safety of celecoxib 200 mg and celecoxib 400 mg once daily in treating the signs and symptoms of psoriatic arthritis. Semin Arthritis Rheum 2007;37(3):164-73.

Si bien no hay estudios realizados exclusivamente en población de pacientes con APs y compromiso axial, en Espondilitis Anquilosante (EA) hay evidencia suficiente que los AINEs mejoran los síntomas de compromiso axial (dolor, rigidez, BASDAI y BASFI)4-8.
Si bien la calidad de la evidencia es alta para esta pregunta PICO en EA, al extrapolarlo a la población de APs se baja en un punto el nivel de evidencia.
Calidad de la evidencia: Moderada
Fuerza de recomendación: Débil a favor
Referencias
4. Barkhuizen A, Steinfeld S, Robbins J, West C, Coombs J, Zwillich S. Celecoxib is efficacious and well tolerated in treating signs and symptoms of ankylosing spondylitis. J Rheumatol 2006;33(9):1805-12.
5. Benhamou M, Gossec L, Dougados M. Clinical relevance of C-reactive protein in ankylosing spondylitis and evaluation of the NSAIDs/coxibs’ treatment effect on C-reactive protein. Rheumatology (Oxford) 2010;49(3):536-41.
6. Dougados M, Behier JM, Jolchine I, Calin A, van der Heijde D, Olivieri I, et al. Efficacy of celecoxib, a cyclooxygenase 2-specific inhibitor, in the treatment of ankylosing spondylitis: a six-week controlled study with comparison against placebo and against a conventional nonsteroidal antiinflammatory drug. Arthritis Rheum 2001;44(1):180-5.
7. Dougados M, Gueguen A, Nakache JP, Velicitat P, Veys EM, Zeidler H, et al. Ankylosing spondylitis: what is the optimum duration of a clinical study?. A one year versus a 6 weeks non-steroidal anti-inflammatory drug trial. Rheumatology (Oxford) 1999;38(3):235-44.
8. van der Heijde D, Baraf HS, Ramos-Remus C, Calin A, Weaver AL, Schiff M, et al. Evaluation of the efficacy of etoricoxib in ankylosing spondylitis: results of a fifty-two-week, randomized, controlled study. Arthritis Rheum 2005;52(4):1205-15.

No existen hasta el momento ensayos clínicos o estudios observacionales realizados en población de pacientes con APs. Solo contamos con consensos y opinión de expertos que muestran una limitada respuesta9.
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Débil a favor
Referencias
9. Rohekar S, Chan J, Tse SML, Haroon N, Chandran V, Bessette L, et al. 2014 update of the Canadian rheumatology association/ spondyloarthritis research consortium of Canada treatment recommendations for the management of spondyloarthritis. Part I: Principles of the management of spondyloarthritis in Canada. J Rheumatology 2015; 42(4):654-64.
Corticoides

No existen ensayos clínicos o estudios observacionales realizados en población de pacientes con APs. Hay escasa evidencia en consensos y por opinión de expertos sobre una respuesta favorable en artritis. Un ensayo clínico en EA no demostró beneficio sobre compromiso axial10.
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Débil en contra
Referencias
10. Haibel H, Fendler C, Listing J, Callhoff J, Braun J, Sieper J. Efficacy of oral prednisolone in active ankylosing spondylitis: results of a double-blind, randomised, placebo-controlled short-term trial. Ann Rheum Dis 2014;73(1):243-6.
Tabla 32. DMEc: Drogas Modificadoras de la Enfermedad convencionales. DMEb: Drogas Modificadoras de la Enfermedad biológicas.

Un estudio observacional abierto, en pacientes con APs, mostró que las infiltraciones fueron efectivas en pacientes en tratamiento concomitante con DMEc o DMEb, especialmente en aquellos con menor tiempo de evolución de la APs. La presencia de compromiso de articulaciones grandes y reactantes de fase aguda elevados, se asoció con mayor frecuencia de recaídas11.
Calidad de evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
11. Eder L, Chandran V, Ueng J, Bhella S, Lee KA, Rahman P, et al. Predictors of response to intra-articular steroid injection in psoriatic arthritis. Rheumatology (Oxford) 2010;49(7):1367-73.

No existe ningún ensayo clínico o estudio observacional. Solo se dispone de consensos y opinión de expertos con moderada eficacia12.
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Débil a favor
Referencias
12. Coates LC, Kavanaugh A, Ritchlin CT, Committee GTG. Systematic review of treatments for psoriatic arthritis: 2014 update for the GRAPPA. J Rheumatol 2014;41(11):2273-6.

No se pudo extraer evidencia de ningún ensayo clínico o estudio observacional. Solo opinión de expertos con moderada eficacia12.
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Débil a favor
Referencias
12. Coates LC, Kavanaugh A, Ritchlin CT, Committee GTG. Systematic review of treatments for psoriatic arthritis: 2014 update for the GRAPPA. J Rheumatol 2014;41(11):2273-6.

Con respecto a las infiltraciones con corticoides a nivel de las articulaciones sacroilíacas, no hay disponibles ensayos clínicos o estudios observacionales en pacientes con APs, pero sí existen este tipo de estudios realizados en EA. Dos estudios randomizados, uno con desenlaces no estandarizados y el otro sin ciego de evaluadores o con desenlaces de mejoría a corto plazo. También dos estudios observacionales con seguimiento a 18 meses, demuestran mejoría en la escala de dolor13-16.
Calidad de evidencia: Muy baja
Fuerza de recomendación: Débil a favor
Referencias
13. Maugars Y, Mathis C, Berthelot JM, Charlier C, Prost A. Assessment of the efficacy of sacroiliac corticosteroid injections in spondylarthropathies: a double-blind study. Br J Rheumatol 1996;35(8):767-70.
14. Luukkainen RK, Wennerstrand PV, Kautiainen HH, Sanila MT, Asikainen EL. Efficacy of periarticular corticosteroid treatment of the sacroiliac joint in non-spondylarthropathic patients with chronic low back pain in the region of the sacroiliac joint. Clin Exp Rheumatol 2002;20(1):52-4.
15. Fischer T, Biedermann T, Hermann KG, Diekmann F, Braun J, Hamm B, et al. Sacroiliitis in children with spondyloarthropathy: therapeutic effect of CT-Guided intra-articular corticosteroid injection. Rofo 2003;175(6):814-21.
16. Migliore A, Bizzi E, Massafra U, Vacca F, Martin-Martin LS, Granata M, et al. A new technical contribution for ultrasound-guided injections of sacro-iliac joints. European review for medical and pharmacological sciences. Eur Rev Med Pharmacol Sci 2010;14(5):465-9.
Bifosfonatos

Con respecto al uso de bifosfonatos en el compromiso axial de APs, no hay evidencia disponible, pero sí hay ensayos clínicos de bifosfonatos en EA con respuestas en distintos desenlaces17-19.
Calidad de la evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
17. Maksymowych WP, Jhangri GS, Fitzgerald AA, LeClercq S, Chiu P, Yan A, et al. A six-month randomized, controlled, double-blind, dose-response comparison of intravenous pamidronate (60 mg versus 10 mg) in the treatment of nonsteroidal antiinflammatory drug-refractory ankylosing spondylitis. Arthritis Rheum 2002;46(3):766-73.
18. Viapiana O, Gatti D, Idolazzi L, Fracassi E, Adami S, Troplini S, Povino MR, et al. Bisphosphonates vs infliximab in ankylosing spondylitis treatment. Rheumatology (Oxford). 2014 Jan;53(1):90-4.
19. Clunie GP, Ginawi A, O’Conner P, Bearcroft PW, Garber SJ, Bhagat S, et al. An open-label study of zoledronic acid (Aclasta 5 mg iv) in the treatment of ankylosing spondylitis. Ann Rheum Dis. 2014 Jun;73(6):1273-4.
Fisioterapia

Existe un ensayo clínico de fisioterapia realizado en pacientes con APs. El objetivo de este estudio fue evaluar la efectividad de un programa de entrenamiento de resistencia dos veces por semana durante 12 semanas, en un grupo de pacientes con APs comparado con un grupo control que solo continuó con tratamiento médico. Los pacientes que realizaron el entrenamiento, presentaron mejorías significativas en HAQ y BASDAI, dolor y estado de salud general, comparado con el grupo control, a las 12 semanas20. (Ver TABLA 4 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada
Fuerza de recomendación: Fuerte a favor
Referencias
20. Roger-Silva D, Natour J, Moreira E, Jennings F. A resistance exercise program improves functional capacity of patients with psoriatic arthritis: a randomized controlled trial. Clin Rheumatol 2018;37(2):389-95.

No existen ensayos clínicos o estudios observacionales que evalúen la eficacia de la fisioterapia sobre la entesitis, en pacientes con APs. Solo muy baja evidencia mediante opinión de expertos12.
Calidad de evidencia: Muy baja
Fuerza de recomendación: Débil a favor
Referencias
12. Coates LC, Kavanaugh A, Ritchlin CT, Committee GTG. Systematic review of treatments for psoriatic arthritis: 2014 update for the GRAPPA. J Rheumatology 2014;41(11):2273-6.
Drogas Modificadoras de la Enfermedad convencionales (DMEc)
Existen cinco ensayos clínicos realizados con DMEc en pacientes con APs: un ensayo con Metotrexate, uno con Leflunomida y tres con Sulfasalazina.

Con respecto a la artritis periférica, el Metotrexate no mostró mejoría respecto a PBO en la mayoría de los desenlaces evaluados a las 24 semanas21. En cambio, la Leflunomida resultó ser efectiva a las 24 semanas aunque con mayores discontinuaciones por eventos adversos con respecto al PBO22. (Ver TABLAS 5 y 6 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de evidencia: Baja
Fuerza de recomendación: Fuerte a favor
Referencias
21. Kingsley GH, Kowalczyk A, Taylor H, Ibrahim F, Packham JC, McHugh NJ, et al. A randomized placebo-controlled trial of methotrexate in psoriatic arthritis. Rheumatology (Oxford) 2012;51(8):1368-77.
22. Kaltwasser JP, Nash P, Gladman D, Rosen CF, Behrens F, Jones P, et al. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis: a multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum 2004;50(6):1939-50.

Los ensayos clínicos realizados con sulfasalazina no lograron alcanzar mejoría significativa en los desenlaces evaluados23-25. (Ver TABLA 7 - Suplemento 3 online http://www. revistasar.org.ar)
Calidad de evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
23. Clegg DO, Reda DJ, Mejias E, Cannon GW, Weisman MH, Taylor T, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Cooperative Study. Arthritis Rheum 1996;39(12):2013-20.
24. Combe B, Goupille P, Kuntz JL, Tebib J, Liote F, Bregeon C. Sulphasalazine in psoriatic arthritis: a randomized, multicentre, placebo-controlled study. Br J Rheumatol 1996;35(7):664-8.
25. Farr M, Kitas GD, Waterhouse L, Jubb R, Felixdavies D, Bacon PA. Sulfasalazine in Psoriatic Arthritis - A double blind placebo-controlled study. Br J Rheumatol 1990;29(1):46-9.

Con respecto al compromiso axial en pacientes con APs, fue incluido un estudio observacional retrospectivo de una cohorte de pacientes con APs tratados con Metotrexate, Leflunomida y Sulfasalazina en los cuales no se observan mejorías significativas26.
Calidad de evidencia: Baja
Fuerza de recomendación: Fuerte en contra
Referencias
26. Roussou E, Bouraoui A. Real-life experience of using conventional disease-modifying anti-rheumatic drugs (DMARDs) in psoriatic arthritis (PsA). Retrospective analysis of the efficacy of methotrexate, sulfasalazine, and leflunomide in PsA in comparison to spondyloarthritides other than PsA and literature review of the use of conventional DMARDs in PsA. Eur J Rheumatol 2017; 4(1):1-10.

Para entesitis y dactilitis, hay solo un ensayo con sulfasalazina con seguimiento a 36 semanas en donde la droga activa no fue mejor que placebo23.
Calidad de evidencia: Baja
Fuerza de recomendación: Fuerte en contra

Para entesitis y dactilitis hay solo un ensayo con sulfasalazina con seguimiento a 36 semanas en donde la droga activa no fue mejor que placebo23.
Calidad de evidencia: Baja
Fuerza de recomendación: Débil en contra (Metotrexate)
Fuerte en contra (Leflunomida, Sulfazalasina)
Referencias
23. Clegg DO, Reda DJ, Mejias E, Cannon GW, Weisman MH, Taylor T, et al. Comparison of sulfasalazine and placebo in the treatment of psoriatic arthritis. A Department of Veterans Affairs Cooperative Study. Arthritis Rheum 1996;39(12):2013-20.
Inhibidores del Factor de Necrosis Tumoral Alfa (anti-TNFα)

El estudio ADEPT solo reporta respuesta ACR 20 en pacientes DMEc naïve tratados con Adalimumab27. (Ver TABLA 8 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada
El estudio RESPOND, abierto, mostró beneficio en pacientes DMEc naïve tratados con Infliximab en varios de los desenlaces reportados28. (Ver TABLA 8 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Fuerte a favor para los cinco agentes inhibidores del TNFα
Referencias
27. Mease PJ, Choy EHS, Gladman DD, Ritchlin CT, Ruderman EM, Steinfeld SD, et al. 24-Week efficacy and safety results from the adalimumab effectiveness in psoriatic arthritis trial (ADEPT). Rheumatology. 2005;44:I3-I.
28. Baranauskaite A, Raffayova H, Kungurov NV, Kubanova A, Venalis A, Helmle L, et al. Infliximab plus methotrexate is superior to methotrexate alone in the treatment of psoriatic arthritis in methotrexate-naive patients: the RESPOND study. Ann Rheum Dis 2012;71(4):541-8.

Existe amplia evidencia sobre la efectividad de los agentes anti-TNFα en aquellos pacientes que han fallado a DMEc. Hay cinco ensayos clínicos en Adalimumab de pacientes que fallaron a DME convencionales más otros de fase abierta que evaluaron también esta droga29-33. Dos ensayos clínicos de Etanercept34-36, uno de Certolizumab37,38, dos de Golimumab39,40 y dos de Infliximab41,42. Todas las drogas demostraron ser efectivas y seguras tanto en los ensayos clínicos como en su evaluación a largo plazo. (Ver TABLAS 9, 10, 11, 12 y 13 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada / Alta
Fuerza de recomendación: Fuerte a favor para los cinco agentes inhibidores del TNFα
La mayoría de los estudios clínicos demostraron efectividad en entesitis y dactilitis29-42. (Ver TABLAS 9, 10, 11, 12 y 13 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada / Alta
Fuerza de recomendación: Fuerte a favor
Tres de los ensayos clínicos mencionados previamente, reportaron eficacia en pacientes con Adalimumab, Certolizumab y Golimumab usados como monoterapia comparados con PBO (Ver TABLA 14 - Suplemento 3 online http://www.revistasar.org.ar), comparados con la combinación con DMEc no hubo diferencias. (Ver TABLA 15 - Suplemento 3 online http://www.revistasar.org.ar)29,37,40. Además, dos estudios observacionales, uno realizado en una cohorte de pacientes con agentes anti-TNFα y otro con Adalimumab mostraron eficacia comparable en monoterapia como en tratamiento concomitante con DMEc. Uno de ellos mostró mayor sobrevida para Infliximab en tratamiento combinado con DMEc43,44. Existen otros dos estudios de cohorte de los cuales no fue posible extraer datos debido a que utilizaron distintas medidas de desenlace a las extraídas. El primero de ellos mostró que el uso de DMEc concomitante mejoró la sobrevida de los biológicos, en cambio el segundo, similar a los anteriores, demostró sobrevida comparable con la combinación45,46. (Ver TABLA 15 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia de ensayos clínicos o subanálisis: Baja a Moderada
Fuerza de recomendación: Fuerte a favor para Adalimumab, Etanercept, Golimumab y Certolizumab

Calidad de la evidencia de estudios observacionales: Baja
Fuerza de recomendación: Débil en contra para Infliximab
Referencias
29. Mease PJ, Gladman DD, Ritchlin CT, Ruderman EM, Steinfeld SD, Choy EH, et al. Adalimumab for the treatment of patients with moderately to severely active psoriatic arthritis: results of a double-blind, randomized, placebo-controlled trial. Arthritis Rheum 2005;52(10):3279-89.
30. Genovese MC, Mease PJ, Thomson GT, Kivitz AJ, Perdok RJ, Weinberg MA, et al. Safety and efficacy of adalimumab in treatment of patients with psoriatic arthritis who had failed disease modifying antirheumatic drug therapy. J Rheumatol 2007;34(5):1040-50.
31. Gladman DD, Mease PJ, Cifaldi MA, Perdok RJ, Sasso E, Medich J. Adalimumab improves joint-related and skin-related functional impairment in patients with psoriatic arthritis: patient-reported outcomes of the Adalimumab Effectiveness in Psoriatic Arthritis Trial. Ann Rheum Dis 2007;66(2):163-8.
32. Mease PJ, van der Heijde D, Ritchlin CT, Okada M, Cuchacovich RS, Shuler CL, et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab) - controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017;76(1):79-87.
33. Mease PJ, Ory P, Sharp JT, Ritchlin CT, van den Bosch F, Wellborne F, et al. Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the Adalimumab Effectiveness in Psoriatic Arthritis Trial (ADEPT). Ann Rheum Dis 2009;68(5):702-9.
34. Mease PJ, Goffe BS, Metz J, VanderStoep A, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: a randomised trial. Lancet 2000;356(9227):385-90.
35. Mease PJ, Woolley JM, Singh A, Tsuji W, Dunn M, Chiou CF. Patient-reported outcomes in a randomized trial of etanercept in psoriatic arthritis. J Rheumatol 2010;37(6):1221-7.
36. Mease PJ, Kivitz AJ, Burch FX, Siegel EL, Cohen SB, Ory P, et al. Etanercept treatment of psoriatic arthritis: safety, efficacy, and effect on disease progression. Arthritis Rheum 2004;50(7):2264-72.
37. Mease PJ, Fleischmann R, Deodhar AA, Wollenhaupt J, Khraishi M, Kielar D, et al. Effect of certolizumab pegol on signs and symptoms in patients with psoriatic arthritis: 24-week results of a Phase 3 double-blind randomised placebo-controlled study (RAPID-PsA). Ann Rheum Dis 2014;73(1):48-55.
38. Gladman D, Fleischmann R, Coteur G, Woltering F, Mease PJ. Effect of certolizumab pegol on multiple facets of psoriatic arthritis as reported by patients: 24-week patient-reported outcome results of a phase III, multicenter study. Arthritis Care Res 2014;66(7):1085-92.
39. Kavanaugh A, Melnnes I, Mease P, Krueger GG, Galdman D, Gomez-Reino JJ, et al. Golimumab, a new, human, TNF-alpha antibody administered as a subcutaneous injection in psoriatic arthritis: 24-week results of the randomized, placebo-controlled go-reveal study. Clin Exp Rheumatol 2008;26(4):747-8.
40. Kavanaugh A, Husni ME, Harrison DD, Kim L, Lo KH, Leu JH, et al. Safety and Efficacy of Intravenous Golimumab in Patients With Active Psoriatic Arthritis: Results Through Week Twenty-Four of the GO-VIBRANT Study. Arthritis Rheumatol 2017;69(11):2151-61.
41. Antoni CE, Kavanaugh A, Kirkham B, Tutuncu Z, Burmester GR, Schneider U, et al. Sustained benefits of infliximab therapy for dermatologic and articular manifestations of psoriatic arthritis - Results from the infliximab multinational psoriatic Arthritis Controlled Trial (IMPACT). Arthritis Rheum 2005;52(9):2951.
42. Antoni C, Krueger GG, de Vlam K, Birbara C, Beutler A, Guzzo C, et al. Infliximab improves signs and symptoms of psoriatic arthritis: results of the IMPACT 2 trial. Ann Rheum Dis 2005;64(8):1150-7.
43. Fagerli KM, Lie E, van der Heijde D, Heiberg MS, Lexberg AS, Rodevand E, et al. The role of methotrexate co-medication in TNF-inhibitor treatment in patients with psoriatic arthritis: results from 440 patients included in the NOR-DMARD study. Ann Rheum Dis 2014; 73(1):132-7.
44. Behrens F, Koehm M, Arndt U, Wittig BM, Greger G, Thaci D, et al. Does Concomitant Methotrexate with Adalimumab Influence Treatment Outcomes in Patients with Psoriatic Arthritis?. Data from a Large Observational Study. Journal of Rheumatology. 2016;43(3):632-9.
45. Kristensen LE, Gulfe A, Saxne T, Geborek P. Efficacy and tolerability of anti-tumour necrosis factor therapy in psoriatic arthritis patients: results from the South Swedish Arthritis Treatment Group register. Ann Rheum Dis 2008; 67:364-9.
46. Mease PJ, Collier DH, Saunders KC, Guo L, Kremer JM, Greenberg JD. Comparative effectiveness of biologic monotherapy versus combination therapy for patients with psoriatic arthritis: results from Corrona registry. RMD Open 2015; 1(1):e000181.

Únicamente el estudio GO-VIBRANT evaluó la respuesta de Golimumab sobre el compromiso axial a través del BASDAI, encontrando mejoría significativa luego de 24 semanas40. Por otro lado, en los estudios realizados en pacientes con EA con falla a AINEs, la evidencia de respuesta de este grupo de drogas es de moderada a alta. (Ver TABLA 12 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada
Fuerza de recomendación: Fuerte a favor
Referencias
40. Kavanaugh A, Husni ME, Harrison DD, Kim L, Lo KH, Leu JH, et al. Safety and Efficacy of Intravenous Golimumab in Patients With Active Psoriatic Arthritis: Results Through Week Twenty-Four of the GO-VIBRANT Study. Arthritis Rheumatol 2017;69(11):2151-61.

Hay dos estudios observacionales realizados en dos cohortes de APs, que evalúan la respuesta ante un cambio de tratamiento a otro agente anti-TNFα. En la cohorte DANBIO se observó que las tasas de respuesta luego del segundo switch, fueron menores47. Y en la cohorte NOR-DMARD también se observó menor respuesta en aquellos pacientes que realizaron switch48. Ninguno de estos estudios evaluó compromiso axial. Sin embargo, los estudios observacionales realizados en EA no son concluyentes49,50.
A pesar de que la evidencia es baja/muy baja y que en los estudios observacionales se evaluó el cambio a otro agente anti-TNFα, la fuerza de recomendación brindada por los expertos es fuerte a favor tanto para el cambio a otro anti-TNFα como a otro biológico. (Ver TABLA 16 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia APs periférica: Baja / Muy baja
Calidad de la evidencia APs axial: Muy baja
Fuerza de recomendación: Fuerte a favor
Referencias
47. Glintborg B, Ostergaard M, Krogh NS, Andersen MD, Tarp U, Loft AG, et al. Clinical response, drug survival, and predictors thereof among 548 patients with psoriatic arthritis who switched tumor necrosis factor alpha inhibitor therapy: results from the Danish Nationwide DANBIO Registry. Arthritis Rheumatism 2013;65(5):1213-23.
48. Fagerli KM, Lie E, van Der Heijde D, Heiberg MS, Kalstad S, Rodevand E, et al. Switching between TNF inhibitors in psoriatic arthritis: Data from the NOR-DMARD study. Ann Rheum Dis 2013;72(11):1840-4.
49. Lie E, van der Heijde D, Uhlig T, Mikkelsen K, Rodevand E, Koldingsnes W, et al. Effectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from the NOR-DMARD register. Ann Rheum Dis 2011;70(1):157-63.
50. Cantini F, Niccoli L, Benucci M, Chindamo D, Nannini C, Olivieri I, et al. Switching from infliximab to once-weekly administration of 50 mg etanercept in resistant or intolerant patients with ankylosing spondylitis: Results of a fifty-four-week study. Arthritis Rheum 2006;55(5):812-6.
Inhibidor de las interleuquinas 12 y 23 (Anti-IL-12/23) Ustekinumab

No existe evidencia disponible que reporten eficacia y seguridad de Ustekinumab en pacientes naïve a DMEc.
No hay evidencia disponible hasta el momento
Fuerza de la recomendación: Débil a favor

En tres ensayos clínicos, los pacientes tratados con Ustekinumab presentaron buenos resultados tanto de eficacia como de seguridad en APs periférica, dactilitis y entesitis51-53. Los PSUMMIT I y II además evaluaron BASDAI 50 para compromiso axial pero al momento del análisis, el objetivo primario, no logró alcanzar significancia estadística. (Ver TABLA 17 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia para artritis periférica, entesitis y dactilitis: Alta
Fuerza de recomendación: Fuerte a favor

Calidad de la evidencia para compromiso axial: Baja
Fuerza de recomendación: Fuerte en contra
Si bien el estudio no fue diseñado para evaluar droga en monoterapia versus combinada con DMEc, el PSUMMIT II mostró a través de una comparación indirecta que la respuesta ACR 20 de Ustekinumab en monoterapia sería similar a Ustekinumab en combinación con DMEc52. (Ver TABLA 18 - Suplemento 3 online http://www.revistasar.org. ar)
Calidad de la evidencia: Baja
Fuerza de recomendación: Fuerte a favor
Referencias
51. McInnes IB, Kavanaugh A, Gottlieb AB, Puig L, Rahman P, Ritchlin C, et al. Efficacy and safety of Ustekinumab in patients with active psoriatic arthritis: 1 year results of the phase 3, multicentre, double-blind, placebo-controlled PSUMMIT 1 trial. Lancet 2013;382(9894):780-9.
52. Ritchlin C, Rahman P, Kavanaugh A, McInnes IB, Puig L, Li S, et al. Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicentre, double-blind, placebo-controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014;73(6):990-9.
53. Gottlieb A, Menter A, Mendelsohn A. Ustekinumab, a human interleukin 12/23 monoclonal antibody, for psoriatic arthritis: Randomised, double-blind, placebo-controlled, crossover trial. Lancet 2010;376(9752):1542.

El estudio PSUMMIT II incluyó pacientes que fallaron a agentes anti-TNFα aunque el número de pacientes expuestos fue bajo52. (Ver TABLA 19 - Suplemento 3 online http://www. revistasar.org.ar)
Calidad de la evidencia: Baja
Fuerza de recomendación: Fuerte a favor
Referencias
52. Ritchlin C, Rahman P, Kavanaugh A, McInnes IB, Puig L, Li S, et al. Efficacy and safety of the anti-IL-12/23 p40 monoclonal antibody, ustekinumab, in patients with active psoriatic arthritis despite conventional non-biological and biological anti-tumour necrosis factor therapy: 6-month and 1-year results of the phase 3, multicentre, double-blind, placebo-controlled, randomised PSUMMIT 2 trial. Ann Rheum Dis 2014;73(6):990-9.
Inhibidores de la interleuquina 17 (Anti-IL-17) Secukinumab e Ixekizumab

Se analizó la evidencia de los dos agentes inhibidores de IL-17 disponibles hasta el momento:
Ixekizumab: En el estudio SPIRIT-P1, hay un bajo porcentaje de pacientes DMEc naïve (alrededor del 15% de los pacientes). Aunque no se exponen los datos numéricos en el ensayo clínico, un subanálisis demostró que Ixekizumab en pacientes DMEc naïve en monoterapia fue superior al PBO53. (Ver TABLA 20 - Suplemento 3 online http://www.revistasar.org.ar)
Secukinumab: El FUTURE II reseña que un porcentaje de los pacientes TNFα naïve, eran también naïve para DMEc. Si bien no está descripta la respuesta en estos pacientes por separado, los resultados fueron positivos53-56.
Calidad de la evidencia: Ixekizumab: Muy baja / Secukinumab: Muy baja
Fuerza de recomendación: Fuerte a favor
Referencias
53. Coates LC, Kishimoto M, Gottlieb A, Shuler CL, Lin CY, Lee CH, et al. Ixekizumab efficacy and safety with and without concomitant conventional disease-modifying antirheumatic drugs (cDMARDs) in biologic DMARD (bDMARD)-naive patients with active psoriatic arthritis (PsA): results from SPIRIT-P1. RMD Open 2017;3(2):e000567.
54. Strand V, Mease P, Gossec L, Elkayam O, van den Bosch F, Zuazo J, et al. Secukinumab improves patient-reported outcomes in subjects with active psoriatic arthritis: results from a randomised phase III trial (FUTURE 1). Ann Rheum Dis 2017;76(1):203-7.
55. McInnes IB, Mease PJ, Kirkham B, Kavanaugh A, Ritchlin CT, Rahman P, et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015;386(9999):1137-46.
56. Mease PJ, McInnes IB, Kirkham B, Kavanaugh A, Rahman P, van der Heijde D, et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med 2015;373(14):1329-39.

Secukinumab: Dos ensayos clínicos a 24 semanas (FUTURE I y II)54-56 y otro con desenlaces reportados a las 6 y 24 semanas de tratamiento, demostraron seguridad y eficacia en pacientes con APs y compromiso periférico que han fallado a DMEc57. También demostraron eficacia en los índices de evaluación de entesitis y dactilitis. (Ver TABLA 21 - Suplemento 3 online http://www.revistasar.org.ar)
Ixekizumab: Un ensayo clínico a 24 semanas (SPIRIT I) reportó que Ixekizumab en sus dos dosis (dosis de carga de 160 mg seguidos de 80 mg cada 4 o 2 semanas) presentó eficacia y seguridad en pacientes con APs con falla a DMEc. También mostró eficacia para dactilitis y entesitis32. (Ver TABLA 22 - Suplemento 3 online http://www.revistasar.org. ar)
Calidad de la evidencia: Alta
Fuerza de recomendación: Fuerte a favor
Secukinumab: Un subanálisis del FUTURE I y II muestra que los pacientes con Secukinumab en monoterapia tuvieron significativamente mayor respuesta ACR 20 que los pacientes con PBO. A través de una comparación indirecta, Secukinumab monoterapia fue similar en seguridad y eficacia al tratamiento combinado con DMEc54,55. (Ver TABLA 23 - Suplemento 3 online http://www.revistasar.org.ar)
Ixekizumab: Un subanálisis demostró mediante comparación indirecta que Ixekizumab monoterapia versus tratamiento combinado con DMEc demostró eficacia y eventos adversos comparables53. (Ver TABLA 20 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Ixekizumab: Muy baja / Secukinumab: Baja
Fuerza de recomendación: Fuerte a favor
Referencias
32. Mease PJ, van der Heijde D, Ritchlin CT, Okada M, Cuchacovich RS, Shuler CL, et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017;76(1):79-87.
53. Coates LC, Kishimoto M, Gottlieb A, Shuler CL, Lin CY, Lee CH, et al. Ixekizumab efficacy and safety with and without concomitant conventional disease-modifying antirheumatic drugs (cDMARDs) in biologic DMARD (bDMARD)-naive patients with active psoriatic arthritis (PsA): results from SPIRIT-P1. RMD Open. 2017; 3(2):e000567.
54. Strand V, Mease P, Gossec L, Elkayam O, van den Bosch F, Zuazo J, et al. Secukinumab improves patient-reported outcomes in subjects with active psoriatic arthritis: results from a randomised phase III trial (FUTURE 1). Ann Rheum Dis 2017;76(1):203-7.
55. McInnes IB, Mease PJ, Kirkham B, Kavanaugh A, Ritchlin CT, Rahman P, et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015;386(9999):1137-46.
56. Mease PJ, McInnes IB, Kirkham B, Kavanaugh A, Rahman P, van der Heijde D, et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med 2015;373(14):1329-39.
57. McInnes IB, Sieper J, Braun J, Emery P, van der Heijde D, Isaacs JD, et al. Efficacy and safety of secukinumab, a fully human anti-interleukin-17A monoclonal antibody, in patients with moderate-to-severe psoriatic arthritis: a 24-week, randomised, double-blind, placebo-controlled, phase II proof-of-concept trial. Ann Rheumtic Dis 2014;73(2):349-56.

Secukinumab: Ninguno de los ensayos clínicos disponibles para APs mostró información de respuesta de los inhibidores de IL-17 en el compromiso axial de esta enfermedad hasta el momento, aunque actualmente existen estudios en desarrollo. Sin embargo, existe información suficiente en EA a través de tres ensayos clínicos de Secukinumab publicados, en los cuales se demostró seguridad y eficacia con el uso de esta droga. Si bien la calidad de evidencia es alta para esta comparación, al realizar una extrapolación se baja un nivel de evidencia58-60.
Ixekizumab: No hay publicaciones en EA aunque sí trabajos en desarrollo. Información disponible sólo en formato de abstracts.
Calidad de la evidencia para compromiso axial: Secukinumab: Moderada
Fuerza de recomendación: Fuerte a favor
Referencias
58. Baeten D, Sieper J, Braun J, Baraliakos X, Dougados M, Emery P, et al. Secukinumab, an Interleukin-17A Inhibitor, in Ankylosing Spondylitis. N Eng J Med 2015;373(26):2534-48.
59. Sieper J, Deodhar A, Marzo-Ortega H, Aelion JA, Blanco R, Jui-Cheng T, et al. Secukinumab efficacy in anti-TNF-naive and anti-TNF-experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2017;76(3):571-92.
60. Pavelka K, Kivitz A, Dokoupilova E, Blanco R, Maradiaga M, Tahir H, et al. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double-blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017;19(1):285.

Secukinumab: Los tres ensayos clínicos de Secukinumab reportan eficacia en pacientes que fallaron previamente a agentes inhibidores del TNFα. Todos los desenlaces reportados mostraron buena respuesta cuando fueron comparados con PBO55-57. (Ver TABLA 24 - Suplemento 3 online http://www.revistasar.org.ar)
Ixekizumab: El ensayo clínico de Ixekizumab, SPIRIT II, fue realizado en pacientes con falla a un agente inhibidor del TNFα. El Ixekizumab mostró ser eficaz y seguro en pacientes con APs, incluso en dactilitis y entesitis61. (Ver TABLA 25 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia Secukinumab: Moderada
Calidad de la evidencia Ixekinumab: Alta
Fuerza de recomendación: Fuerte a favor
Referencias
55. McInnes IB, Mease PJ, Kirkham B, Kavanaugh A, Ritchlin CT, Rahman P, et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015;386(9999):1137-46.
56. Mease PJ, McInnes IB, Kirkham B, Kavanaugh A, Rahman P, van der Heijde D, et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med 2015;373(14):1329-39.
57. McInnes IB, Sieper J, Braun J, Emery P, van der Heijde D, Isaacs JD, et al. Efficacy and safety of secukinumab, a fully human anti-interleukin-17A monoclonal antibody, in patients with moderate-to-severe psoriatic arthritis: a 24-week, randomised, double-blind, placebo-controlled, phase II proof-of-concept trial. Ann Rheum Dis 2014;73(2):349-56.
61. Nash P, Kirkham B, Okada M, Rahman P, Combe B, Burmester GR, et al. Ixekizumab for the treatment of patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors: results from the 24-week randomised, double-blind, placebo-controlled period of the SPIRIT-P2 phase 3 trial. Lancet 2017;389(10086):2317-27.
Apremilast

Existen dos ensayos clínicos en pacientes con Apremilast monoterapia que aportan evidencia al respecto: PALACE 4 y ACTIVE. Los dos estudios con Apremilast como monoterapia demostraron ser eficaces y seguros. Además, los pacientes incluidos en el PALACE 4 eran DMEc naïve62,63. (Ver TABLA 26 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Moderada
Fuerza de recomendación: Fuerte a favor
Referencias
62. Nash P, Ohson K, Walsh J, Delev N, Nguyen D, Teng L, et al. Early onset of efficacy with apremilast monotherapy in biologic-naive patients with active psoriatic arthritis: A phase IIIb, randomized, controlled trial. Arthritis Rheum 2016;68:2132-4.
63. Wells AF, Edwards CJ, Adebajo AO, Kivitz AJ, Bird P, Shah K, et al. Apremilast in the treatment of DMEc-naive psoriatic arthritis patients: Results of a phase 3 randomized, controlled trial (PALACE 4). Arthritis Rheum 2013;65(12):3320-1.

Tres ensayos clínicos en pacientes con Apremilast que fallaron a DMEc, demostraron eficacia y seguridad en todos los desenlaces evaluados, incluso dactilitis y entesitis64-66. (Ver TABLA 27 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Alta
Fuerza de recomendación: Fuerte a favor
Referencias
64. Kavanaugh A, Mease PJ, Gomez-Reino JJ, Adebajo AO, Wollenhaupt J, Gladman DD, et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014;73(6):1020-6.
65. Cutolo M, Myerson GE, Fleischmann RM, Liote F, Diaz-Gonzalez F, Van den Bosch F, et al. A Phase III, Randomized, Controlled Trial of Apremilast in Patients with Psoriatic Arthritis: Results of the PALACE 2 Trial. J Rheumatol 2016;43(9):1724-34.
66. Edwards CJ, Blanco FJ, Crowley J, Birbara CA, Jaworski J, Aelion J, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis and current skin involvement: a phase III, randomised, controlled trial (PALACE 3). Ann Rheum Dis 2016;75(6):1065-73.

Ninguno de los ensayos clínicos de Apremilast en APs reportan desenlaces sobre compromiso axial en estos pacientes. Sin embargo, hay evidencia reportada en un ensayo clínico de pacientes con EA que demuestra mejoría en el BASFI, con sólo tendencia a mejor respuesta sobre otros desenlaces en el compromiso axial de estos pacientes67.
Calidad de la evidencia: Baja
Fuerza de recomendación: Débil en contra
Referencias
67. Pathan E, Abraham S, Van Rossen E, Withrington R, Keat A, Charles PJ, et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in ankylosing spondylitis. Ann Rheum Dis 2013;72(9):1475-80.

El PALACE I incluyó pacientes que habían recibido y/o fallado a otros agentes biológicos, previo al uso de Apremilast. Si bien el diseño del estudio no fue realizado para evaluar este desenlace, la respuesta ACR 20 de los pacientes que habían presentado previamente ineficacia a agentes biológicos no fue significativa en comparación a PBO, y fue significativa en los pacientes que por otro motivo habían suspendido el agente biológico previo64. (Ver TABLA 28 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
64. Kavanaugh A, Mease PJ, Gomez-Reino JJ, Adebajo AO, Wollenhaupt J, Gladman DD, et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo-controlled trial with apremilast, an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014; 73(6):1020-6.
Tofacitinib

Ninguno de los ensayos clínicos de Tofacitinib en APs, reportan desenlaces de eficacia o seguridad en pacientes DMEc naïve.
Calidad de la evidencia: No hay evidencia
Fuerza de recomendación: Fuerte en contra

Tofacitinib tanto en su dosis de 5 mg como 10 mg dos veces por día, demostró buena respuesta y buen perfil de seguridad en pacientes con APs que han fallado a DMEc.
Calidad de la evidencia: Alta
Fuerza de recomendación: Fuerte a favor

Los desenlaces evaluados de entesitis y dactilitis no alcanzaron mejoría significativa a las 24 semanas de evaluación en la dosis de 5 mg dos veces al día, pero sí para la dosis de 10 mg dos veces al día.68 (Ver TABLA 29 - Suplemento 3)
Calidad de la evidencia: Alta
Fuerza de recomendación: Débil a favor
Ninguno de los ensayos clínicos de Tofacitinib en APs reportan desenlaces de eficacia o seguridad de Tofacitinib empleado como monoterapia.
Calidad de la evidencia: No hay evidencia
Fuerza de recomendación: Débil a favor
Referencias
68. Mease P, Hall S, FitzGerald O, van der Heijde D, Merola JF, Avila-Zapata F, et al. Efficacy and safety of tofacitinib, an oral Janus kinase inhibitor, or adalimumab in patients with active psoriatic arthritis and an inadequate response to conventional synthetic DMARDS: A randomized, placebo-controlled, phase 3 trial. N Engl J Med 2017; 377(16):1537-50.

Ninguno de los ensayos clínicos de Tofacitinib en APs reportan desenlaces de eficacia o seguridad en pacientes con APs y compromiso axial. Un estudio de Tofacitinib en EA resultó ser efectivo en reducir los signos y síntomas de la enfermedad69. Si bien la calidad de evidencia en EA es alta, se baja un punto por extrapolación de la evidencia.
Calidad de la evidencia: Baja
Fuerza de recomendación: Débil a favor
Referencias
69. van der Heijde D, Deodhar A, Wei JC, Drescher E, Fleishaker D, Hendrikx T, et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16-week, randomised, placebo-controlled, dose-ranging study. Ann Rheum Dis 2017;76(8):1340-7.

Se reportan datos de un ensayo clínico en pacientes con Tofacitinib con falla previa a agentes anti-TNFα que muestran eficacia y seguridad de ambas dosis de Tofacitinib, también con buena respuesta en entesitis y dactilitis70. (Ver TABLA 30 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Alta
Fuerza de Recomendación: Fuerte a favor
Referencias
70. Gladman DD, Rigby W, Azevedo VF, Behrens F, Blanco R, Kaszuba A, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. N Engl J Med 2017;377(16):1525-36.
Abatacept

Ninguno de los ensayos clínicos de Abatacept en APs reportan desenlaces de eficacia o seguridad en pacientes DMEc naïve.
Calidad de la evidencia: No hay evidencia
Fuerza de recomendación: Fuerte en contra

Dos ensayos clínicos con Abatacept demostraron evidencia de eficacia y seguridad de esta droga ante la falla a DMEc. Las vías y frecuencia de administración empleadas en ambos trabajos fueron distintas pero decidieron agruparse debido a que las mediciones evaluadas y los criterios de inclusión de pacientes fueron muy similares. Las dosis empleadas fueron 125 mg subcutáneo semanal y 10 mg/kg peso EV mensual.
Algunos de los desenlaces de respuesta fueron buenos para Abatacept (Respuesta ACR 20) y entesitis (no dactilitis)71,72. (Ver TABLA 31 - Suplemento 3 online http://www. revistasar.org.ar)
Calidad de la evidencia: Alta
Fuerza de recomnedación: Débil a favor
Ninguno de los ensayos clínicos de Abatacept en APs reportan desenlaces de eficacia o seguridad empleado como monoterapia.
Calidad de la evidencia: No hay evidencia
Fuerza de recomendación: Débil a favor

Ninguno de los ensayos clínicos de Abatacept en APs reportan desenlaces de eficacia o seguridad en pacientes con APs y compromiso axial. Dos estudios abiertos en pacientes con EA no mostraron eficacia a las 24 semanas71-72.
Calidad de la evidencia: Muy baja
Fuerza de recomendación: Fuerte en contra

Uno de los estudios de Abatacept aportó desenlaces para evaluación de respuesta en pacientes que fallaron a agentes inhibidores del TNFα.71 (Ver TABLA 32 - Suplemento 3 online http://www.revistasar.org.ar)
Calidad de la evidencia: Alta
Fuerza de recomendación: Débil a favor
Referencias
71. Mease PJ, Gottlieb AB, van der Heijde D, FitzGerald O, Johnsen A, Nys M, et al. Efficacy and safety of abatacept, a T-cell modulator, in a randomised, double-blind, placebo-controlled, phase III study in psoriatic arthritis. Ann Rheum Dis 2017;76(9):1550-8.
72. Mease PJ, Genovese MC, Gladstein GS, Kivitz AJ, Ritchlin CT, Tak PP, et al. Abatacept (ABA) in the treatment of psoriatic arthritis (PsA): 12-month results of a phase II study. Arthritis Rheum 2011;63(4):939-48.
73. Lekpa FK, Farrenq V, Canoui-Poitrine F, Paul M, Chevalier X, Bruckert R, et al. Lack of efficacy of abatacept in axial spondylarthropathies refractory to tumor-necrosis-factor inhibition. Joint, Bone, Spine 2012;79(1):47-50.
74. Song IH, Heldmann F, Rudwaleit M, Haibel H, Weiss A, Braun J, et al. Treatment of active ankylosing spondylitis with abatacept: an open-label, 24-week pilot study. Ann Rheum Dis 2011;70(6):1108-10.
Conflictos de intereses
No se obtuvo financiamiento de ningún tipo para el desarrollo de estas guías. Las mismas han sido realizadas con completa independencia editorial. Los conflictos de intereses de los expertos están numerados al final del documento.
1. (AFM)
Declara haber participado como consultor y/o disertante de los siguientes laboratorios: Novartis, Janssen, Pfizer, Eli Lilly y Montpellier.
2. (AA)
Declara no tener conflictos de intereses.
3. (AC)
Declara haber participado como investigadora, disertante y consultora de los siguientes laboratorios: Eli Lilly, Pfizer, Astra, Roche, Genentech, Abbvie, Janssen, R-Pharm.
4. (BA)
Declara haber participado como disertante, investigador o consultor de los siguientes laboratorios: Abbvie, Astra-Zeneca, Biogen, Bristol Myers Squibb, Boehringer Ingelheim, Centocor, Eli Lilly, Janssen, Medimmune, Merck Serono, MSD, Pfizer, Roche, Sanofi, UCB Pharma.
5. (CG)
Declara haber participado como investigador, disertante y consultor de los siguientes laboratorios: Raffo, Pfizer, Novartis, Abbvie, Janssen, Eli Lilly y Bristol Myers Squibb.
6. (CT)
Declara no tener conflictos de intereses.
7. (COL)
Declara haber participado como disertante, investigador o consultor de los siguientes laboratorios: Bristol Myers Squibb, Roche, Pfizer, Abbvie, Novartis, Sanofi, Gema Biotech, Eli Lilly, Gilead.
8. (CG)
Declara haber participado como investigador, disertante y consultor de los siguientes laboratorios: Abbvie, Bristol Myers Squibb, Eli Lilly, Genzyme, Gema Biotech, Janssen, Novartis, Pfizer, Roche.
9. (CVL)
Declara haber participado como disertante y consultor de los siguientes laboratorios: Abbvie, Pfizer, Novartis, Janssen, Bristol Myers Squibb, Celgene.
10. (GSR)
Declara haber participado como disertante, investigador o consultor para los siguientes laboratorios: Abbvie, Bristol Myers Squibb, GSK, Janssen Cilag, Montpellier-UCB, Novartis, Roche-Genetech, Sanofi, Pfizer, Merck Serono.
11. (GM)
Declara no tener ningún conflicto de interés.
12. (GA)
Declara no tener ningún conflicto de interés.
13. (GS)
Declara haber participado como investigador, disertante y consultor para los siguientes laboratorios: Abbvie, Pfizer, Novartis y Janssen.
14. (MCJ)
Declara haber participado como investigador, disertante y consultor para los siguientes laboratorios: Pfizer, Merck Sharp Dohme, Sanofi-Aventis, Novartis, Bristol Myers Squibb, Roche, Boehringer Ingelheim, Schering-Plough, Abbott, UCB, Eli Lilly, Gilead.
15. (MFH)
Declara haber participado como disertante y consultor para los siguientes laboratorios: Pfizer, Novartis, Eli Lilly, Bristol Myers Squibb, Celgene.
16. (MJ)
Declara haber participado como disertante, investigadora o consultora de los siguientes laboratorios: UCB, Novartis, Montpellier, Genzyme.
17. (MMV)
Declara haber participado como disertante para los siguientes laboratorios: Novartis, Abbvie y Janssen.
18. (GM)
Declara haber participado como disertante para los siguientes laboratorios: Abbvie, Bristol Myers Squibb, Pfizer, Merck Sharp & Dohme, Novartis y como investigador para AstraZeneca y Eli Lilly.
19. (PS)
Declara no tener conflictos de intereses.
20. (PR)
Declara haber participado como investigador, disertante y consultor para los siguientes laboratorios: Pfizer, Abbvie, Janssen, Roche, Novartis, Eli Lilly, Bristol Mayer Squibb.
21. (SV)
Declara haber participado como investigador y disertante para los siguientes laboratorios: Abbvie, Novartis, Brystol Myers Squibb, Janssen, Eli Lilly.
22. (SEE)
Declara haber participado como investigadora, disertante y consultora para los siguientes laboratorios: Abbvie, Amgen, Brystol Myers Squibb, Genzyme, Janssen, Eli Lilly, Novartis, Pfizer, Raffo.
23. (SA)
Declara haber participado como investigadora, consultora o disertante de los siguientes laboratorios: Novartis, Eli Lilly, Pfizer, Abbie, Janssen, Montpellier, Bristol, Sanofi-Aventis, Roche, Glaxo, Raffo.
24. (SER)
Declara haber participado como investigador, consultor o disertante de los siguientes laboratorios: Abbvie, Amgen, Bristol, Elea, Genzyme, Janssen, Montpellier, Novartis, Pfizer, Roche, Sandoz, UCB.
25. (TS)
Declara no tener ningún conflicto de interés.














