Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de reumatología
Print version ISSN 0327-4411On-line version ISSN 2362-3675
Rev. argent. reumatolg. vol.31 no.2 Buenos Aires June 2020
ARTÍCULO ORIGINAL
Relación entre los anticuerpos contra antígenos extraíbles del núcleo y las enfermedades del tejido conectivo identificados por Immunoblots en un hospital y universidad de Lima
Relationship between antibodies against extractable nucleus antigens and connective tissue diseases identified by Immunoblot in a hospital in Lima, Peru
José Enrique Oliva Menacho1, Jorge Luis Arroyo Acevedo2, Jose Arturo Oliva Candela1, Percy Genaro Salas Ponce1, Marco Antonio Garcia Hjarles3
1Hospital Nacional Arzobispo Loayza (Lima, Perú)
2Laboratorio de Farmacología Experimental, Facultad de Medicina, Universidad Nacional Mayor de San Marcos (Lima, Perú)
3Facultad de Ciencias y Filosofía, Universidad Peruana Cayetano Heredia (Lima, Perú)
Correspondencia: José Enrique Oliva Menacho, Celular: +51 990009733, jose.enrique.oliva@hotmail.com / jose.oliva.m@upch.pe
Resumen
Objetivos: Determinar la relación de los anticuerpos con los antígenos del núcleo extraíble y las enfermedades del tejido conectivo identificadas por Immunoblot en un hospital de Lima, Perú.
Material y métodos: Estudio de tipo observacional, ciencias básicas, analíticas y transversales, realizado en el Servicio de Inmunología del Hospital Nacional Arzobispo Loayza entre enero de 2018 y junio de 2018. Analizamos 291 historias clínicas de pacientes con enfermedad del tejido conectivo y para la detección de anticuerpos contra los antígenos extraíbles del núcleo se empleó el método de Immunoblots.
Resultados: La frecuencia de los anticuerpos contra antígenos nucleares extraíbles en pacientes con enfermedad del tejido conectivo identificados por Immunoblot fue 789 (100%). Se demostró que existe una relación significativa p <0.05 de Anti-histonas (X2 = 64.19; p = 0,000), anti-nucleosomas (X2 = 71,16; p = 0,000), anti-dsDNA (X2 = 71,44; p = 0,000), anti-SM (X2 = 10,08; p = 0,003) y lupus eritematoso sistémico con prueba de Chi-cuadrado de Pearson. Se demostró que existe una relación significativa p <0.05 del Anti-SSA (X2 = 61,33; p = 0.001), anti-SSB (x2 = 51,00; p = 0.001), anti-Ro 52 (X2 = 62,60; p = 0,000) y síndrome de Sjogren con prueba de Chi-cuadrado de Pearson. Se demostró que existe una relación significativa p <0.05 de Anti-CENP B (p = 0.001) y calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y Telangiectasia (CREST) con Fisher.
Conclusiones: Existe relación de anticuerpos con antígenos de núcleo extraíbles y lupus eritematoso sistémico, síndrome de Sjogren, enfermedad mixta del tejido conectivo, enfermedad del CREST, esclerodermia y polimiositis.
Palabras clave: Anticuerpos contra antígenos del núcleo extraíbles; Immunoblots; Enfermedades autoinmunes; Perú.
Abstract
Objectives: To determine the relationship of antibodies to extractable nucleus antigens and connective tissue diseases identified by Immunoblot in a hospital in Lima, Peru.
Material and methods: Study of the observational type, basic sciences, analytical and transversal, carried out in the Immunology service of the national Hospital Archbishop Loayza between January 2018 and June 2018. We analyzed 291 clinical histories of patients with connective tissue disease and for the detection of antibodies to the extractable antigens of the nucleus the method of Immunoblot was employed.
Results: The frequency of the antibodies against extractable nuclear antigens in patients with connective tissue disease identified by Immunoblot was 789 (100%). It was demonstrated that there is significant relationship p < 0.05 of Anti-histones (X2 = 64.19; p = 0,000), anti-nucleosomas (X2 = 71,16; p = 0,000), anti-dsDNA (X2 = 71,44; p = 0,000), anti-SM (X2 = 10,08; p = 0,003) and Lupus Systemic erythematosus with Pearson Chi-square test. It was demonstrated that there is significant relationship p < 0.05 of the Anti-SSA (X2 = 61,33; p = 0.001), anti-SSB (X2 = 51,00; p = 0.001), anti-Ro 52 (X2 = 62,60; p = 0,000) and Sjogren’s syndrome with Pearson Chi-square test. It was demonstrated that there is significant relationship p < 0.05 of Anti-CENP B (p = 0.001) and calcinosis, Raynaud’s phenomenon, esophageal dysmotility, sclerodactyly and Telangiectasia (CREST) with exact Fisher statistician.
Conclusions: There is a relationship of antibodies to extractable nucleus antigens and systemic lupus erythematosus, Sjogren’s syndrome, mixed connective tissue disease, calcinosis, Raynaud’s phenomenon, esophageal dysmotility, sclerodactyly and Telangiectasias (CREST), Scleroderma and Polymyositis.
Key words: Antibodies against removable nucleus antigens; Immunoblot; Autoimmune diseases; Peru.
Introducción
Las enfermedades del tejido conectivo son enfermedades inflamatorias y autoinmunes; las más conocidas son: lupus eritematoso sistémico (LES), la esclerosis sistémica progresiva (ESP), polimiositis (PM), dermatomiositis (DM), la artritis reumatoidea (AR), el síndrome de Sjögren (SS) y la enfermedad mixta del tejido conectivo (EMTC); los síntomas más frecuentes son: el dolor articular, rigidez articular, fatiga. Amenaza la vida y la calidad de vida.1,2
Los autoanticuerpos que abundan en los pacientes con enfermedades del tejido conectivo son los que están dirigidos frente a las ribonucleoproteínas Ro/SSA, La/SSB, Sm y RNP, las cuales tienen la propiedad de ser extraíbles o solubles en soluciones salinas y se denominan extractable nuclear antigens (ENA). El antígeno Ro existe en 2 formas antigénicas de distinto peso molecular: la proteína de 52 kD (Ro52) y la de 60 kD (Ro60). La función celular de las proteínas Ro aún está en investigación; los datos obtenidos sostienen que el Ro52 es una ligasa E3, proteína inducible por el interferón (IFN) que funciona como un regulador negativo de la producción de citocinas proinflamatorias.3
La molécula Ro60 participa en la degradación del ARN defectuoso y a partir de estudios en modelos de animales se ha concluido que pudiera desempeñar un papel protector contra las respuestas autoinmunes.4
El autoantígeno La es una fosfoproteína de 47 kD, la cual es un factor de terminación de la transcripción de la ARN polimerasa III. El nombre completo del antígeno RNP es el de U1 snRNP y es un complejo de ARN-proteínas que comprende 8 subunidades (U1-70kd, A, B’/B, C, D, E, F y G). Las proteínas B’/B, D, E, F, y G están reunidas en una partícula que es reactiva con el antisuero anti-Sm. El antisuero anti-RNP reconoce la partícula de U1-70kD, la U1-A y la U1-C.5
No todos los pacientes con LES poseen niveles detectables de anticuerpos de especificidades anti-ENA y cuando se presentan pueden hacerlo de forma aislada o en combinación. Su presencia ayuda a establecer el diagnóstico, pero apenas se disponen evidencias a favor de que la especificidad o los niveles de los anticuerpos anti-ENA puedan reflejar la actividad del LES. Aunque el anti-Ro está asociado a diversas manifestaciones clínicas como trastornos cutáneos, hematológicos, neumonía intersticial y nefritis y el anti-La con enfermedad renal reducida,3 los títulos de anti-Ro y anti-La aumentan más lentamente que los de los anticuerpos anti-ADNdc durante las recaídas y su cuantificación seriada para monitorear la evolución del LES es de escasa utilidad.6
A diferencia del LES, se ha señalado que en el síndrome de Sjögren los títulos de los anticuerpos anti-La aumentan en las exacerbaciones clínicas.7
Recientemente se ha comunicado que los pacientes con LES poseen una sub-especificidad de anticuerpos anti-Ro52 dirigida frente a un dominio funcional activo de la proteína Ro52 denominado RING, los cuales inhiben la capacidad funcional de la ligasa E3. La inhibición de la función de la ligasa E3 del Ro52 por los anticuerpos puede promover teóricamente la producción de citocinas pro-inflamatorias, incluyendo los interferones tipo 1 y conducir al incremento en la actividad de la enfermedad. Un grupo de investigación ha demostrado que la presencia de la sub-especificidad de anticuerpos anti-Ro52-RING estuvo asociada a una actividad mayor de la enfermedad en pacientes con LES, a diferencia del total de los anticuerpos anti-Ro52, pues contienen otras sub-especificidades no bloqueadoras de la actividad funcional de la molécula Ro52.8
La presencia de los anticuerpos anti-Sm es uno de los criterios diagnósticos del LES9,10 por ser altamente específicos de esta enfermedad. Los anticuerpos anti-Sm pueden acompañarse de los anti-RNP porque ambas proteínas se asocian con RNA comunes en el espliceosoma. Los anticuerpos anti-Sm y los anti-RNP parecen ejercer efectos opuestos sobre la afección renal en el LES; mientras que los anti-Sm se asocian a la presencia de nefritis, los anti-RNP están asociados con una menor probabilidad de desarrollar nefritis.5
Los títulos de los anticuerpos anti-Sm y anti-RNP pueden fluctuar en el curso del LES, pero carecen de valor predictivo de las recaídas.11
No obstante, existen comunicaciones acerca de la relación de los anticuerpos anti-Sm con las exacerbaciones neurológicas y con la actividad de la enfermedad del LES.12
Estudios posteriores, sin embargo, no han podido confirmar el papel de los anticuerpos anti-Sm como biomarcadores de la actividad del LES.13
Una especificidad de autoanticuerpos, la anti-Scl-70, considerada exclusiva de la esclerosis sistémica, se ha encontrado en pacientes con LES en porcentajes considerables (25 %). Además, los niveles de los anticuerpos anti-Scl-70 se han correlacionado con la actividad de la enfermedad, la presencia de hipertensión pulmonar y nefritis.14
Los anticuerpos anti-dsDNA de cadena doble, los anti-Sm y las anti-histonas son positivos en pacientes con lupus eritematoso sistémico.15,16 Los anti-ribonucleoproteinas hacen parte de los criterios diagnósticos de la enfermedad mixta del tejido conectivo.17 Los anticuerpos Ro60 (SS-A) y el anti-Ro52 son detectados en pacientes con síndrome de Sjögren.18
Los anticuerpos anti topoisomerasa (anti-Scl70) reaccionan contra el ADN topoisomerasa I, en los pacientes con esclerosis sistémica.19
Los anti Jo-1 se dirigen contra la enzima histidil-RNAt-sintetasa y son detectados en pacientes con dermatomiositis y polimiositis.20
Materiales y Métodos
Estudio de tipo observacional, analítico, ciencias básicas y transversal realizado en el Servicio de Inmunología del Hospital Nacional Arzobispo Loayza entre Enero y Junio del 2018. Se revisaron 291 historias clínicas y se procesaron muestras de sangre de pacientes con enfermedad del tejido conectivo. Las historias clinicas se revisaron para obtener el diagnóstico de la enfermedad. Para la detección de los anticuerpos contra antígenos nucleares extraíbles en suero de los pacientes se empleó el método Immunoblot.
Se usó estadística descriptiva y el paquete estadístico SPSS versión 25.
Este estudio fue conducido de acuerdo con los principios éticos que tienen su origen en la Declaración de Helsinki, fue evaluado y aprobado por el comité de ética en investigación del Instituto de Ética en Salud de la Universidad Nacional Mayor de San Marcos y el Hospital Nacional Arzobispo Loayza.
Metodología de Immunoblot (Anti-ENA)
Preparación del buffer: el buffer concentrado se diluye 1/10 con agua destilada.
Preparación del suero: diluir 1500 µl de buffer con 15 µl de muestra (1:101).
Activar las tiras llevándolas a un soporte de plástico y colocando 1600 µl de buffer. Homogeneizar con rotador por 6 minutos.
Eliminar el buffer y colocar 1515 µl de muestra diluida, dejarlo en el rotador por 30 minutos. Eliminar el contenido y lavar con 1500 µl de buffer por 5 minutos en rotación; repetir este paso dos veces más. Eliminar el contenido y colocar 1500 µl de conjugado correspondiente al kit ANA prolife 3 Euroline Euroimmun (Germany) y dejarlo por 30 minutos en el rotador. Eliminar el contenido y lavar con 1600 µl de buffer por 5 minutos en el rotador. Eliminar el contenido y agregar 1700 µl de sustrato, dejándolo por 10 minutos en rotación en la oscuridad. Eliminar el contenido y lavar con 1500 µl de agua destilada por 6 minutos en rotación. Repetir este paso dos veces más, secar en estufa y leer en el escáner. Importante: Se colocó control positivo estandarizado en cada tira de reacción Immunoblot (suero humano) con anticuerpos anti-SSA(Ro), anti-SSB(La), anti-Sm, anti-Sm/RNP, antiJo1 y anti-Scl70, azida de sodio 15 mmol/L; calibrados frente al correspondiente suero de referencia ANA de los Centers for Disease Control (CDC), Atlanta, USA y se colocó control negativo estandarizado, (suero humano) negativo a tamizaje infeccioso y AAN negativo.
Resultados
De 291 casos de pacientes con enfermedad del tejido conectivo, el 85(29,21%) presentaron lupus eritematoso sistémico, 77(26,46%) síndrome de Sjögren, 72(24,74%) enfermedad mixta del tejido conectivo, 34(11,68%) CREST, 15(5,15%) esclerodermia y 8(2,75%) polimiositis.
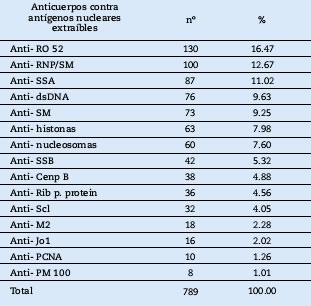
La frecuencia de los anticuerpos contra antígenos nucleares extraíbles en pacientes con enfermedad del tejido conectivo identificados por Immunoblot fueron 789(100%). La positividad de reactividad más frecuente de anticuerpos contra antígenos nucleares extraíbles fueron 130(16,47%) Anti-Ro52, 100(12,67%) Anti-RNP/SM, 87(11,02%) Anti-SSA, 76(9,63%) Anti-dsDNA, 73(9,25%) Anti-SM, 63(7,98%) Anti-histonas, 60(7,60%) Anti-nucleosomas, 42(5,32%) Anti-SSB, 38(4,88%) Anti-Cenp B, 36(4,56%) Anti RIB-p. protein, 32(4,05%) Anti-Scl, 18(2,28%) Anti-M2, 16(2,02%) Anti-Jo1, 10(1,26%) Anti-PCNA, 8(1,01%) Anti- PM 100 (Tabla 1).
Tabla 1. Anticuerpos contra antígenos nucleares extraíbles en pacientes con enfermedad del tejido conectivo identificados por Immunoblot en el Hospital Nacional Arzobispo Loayza
Se demostró que existe relación significativa p<0,05 de los Anti-histonas (X2=64,19; p=0,000; OR=10,56), Anti-nucleosomas (X2=71,16; p=0,000;OR=12,74), Anti-dsDNA (X2=71,44; p=0,000;OR=10,86) (Tabla 2), Anti-Cenp B(X2=12,12; p=0,000;OR=0,11), Anti-SSA(X2=26,88; p=0,001;OR=0,14), Anti-SSB(X2=17,08; p=0,001;OR=0,28), Anti-SM(X2=10,08; p=0,003;OR=2,43) y Anti-Ro 52 (X2=38,64; p=0,000;OR=0,15), Anti-RNP/SM (X2=4,96; p=0,030;OR=0,52), Anti-Scl (X2=9,16; p=0,002;OR=0,141) y el Lupus eritematoso sistémico con la prueba de Chi-cuadrado de Pearson.
Tabla 2. Relación de los Anti-dsDNA y el lupus eritematoso sistémico

No existe relación significativa p>0,05 de los Anti-Rib p. protein (X2=0,94; p=0,333; OR=1,43), Anti-M2(X2=0,15; p=0,789; OR=1,22) y el lupus eritematoso sistémico con la prueba de Chi-cuadrado de Pearson.
No existe relación significativa p>0,05 de los Anti-Jo1 (p=1,000; OR=0,798), Anti-PCNA (p=0,163; OR=2,51) y Anti-PM100(p=0,238; OR=2,49) y el lupus eritematoso sistémico con el estadístico exacto de Fisher.
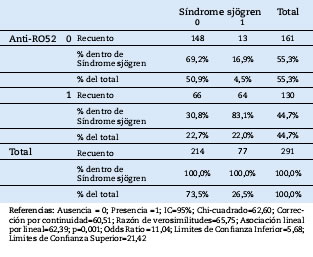
Se demostró que existe relación significativa p<0,05 de los Anti-histonas (X2 =28,93; p=0,001;OR=0,662), Anti-nucleosomas (X2=17,88; p=0,001;OR=0,112), Anti-dsDNA(X2=33,42; p=0,001;OR=0,024) , Anti-Cenp B(X2=10,09; p=0,001;OR=0,132), Anti-SSA (X2=61,33; p=0,001;OR=8,85), Anti-SSB(X2=51,00; p=0,001;OR=10,74), Anti-SM(X2=28,17; p=0,000;OR=0,054), Anti-Ro 52 (X2=62,60; p=0,000;OR=11,04) (Tabla 3), Anti-RNP/SM (X2=18,71; p=0,000;OR=0,23), Anti-Scl (X2=12,93; p=0,001;OR=0,703), Anti-Rib p. protein (X2=3,33; p=0,072; OR=0,410) y el síndrome de Sjögren con la prueba de Chi-cuadrado de Pearson.
Tabla 3. Relación de los Anti-Ro 52 y el Síndrome sjögren
No existe relación significativa p>0,05 de los Anti-M2(p=0,418; OR=0,538) Anti-Jo1(p=0,008; OR=0,720), Anti-PCNA (p=0,464; OR=0,300) y Anti-PM100(p=0,686; OR=0,389) y el síndrome de Sjögren con el estadístico exacto de Fisher.
Se demostró que existe relación significativa p<0,05 de los Anti-SM(X2=19,07; p=0,000;OR=3,47), Anti-RNP/SM (X2=107,56; p=0,000; OR=25,59), Anti-Scl (X2=4,87; p=0,048; OR=2,31), Anti-Rib p. protein (X2=11,15; p=0,002; OR=3,25) y la enfermedad mixta del tejido conectivo con la prueba de Chi-cuadrado de Pearson.
No existe relación significativa p>0,05 de los Anti-histonas (X2 =0,038; p=1,000; OR=0,938), Anti-nucleosomas (X2=2,64; p=0,131; OR=0,545), Anti-dsDNA(X2=0,137; p=0,758; OR=1,120), Anti-Cenp B(X2=4,74; p=0,028;OR=0,320), Anti-SSA(X2=0,024; p=1,000; OR=0,955), Anti-SSB(X2=0,023; p=1,000;OR=0,943), Anti-Ro 52(X2=3,48; p=0,076;OR=1,66) y la enfermedad mixta del tejido conectivo con la prueba de Chi-cuadrado de Pearson.
No existe relación significativa p>0,05 de los Anti-M2(p=1,000; OR=0,86) Anti-Jo1(p=1,000; OR=1,01), Anti-PCNA (p=0,713; OR=1,31) y Anti-PM100(p=0,207; OR=0,746) y la enfermedad mixta del tejido conectivo con el estadístico exacto de Fisher.
Se demostró que existe relación significativa p < 0,05 de los Anti-nucleosomas(X2=7,35; p=0,005;OR=0,102), Anti-dsDNA(X2=10,71; p=0,001;OR=0,074), Anti-SSA(X2=6,03; p=0,016;OR=0,280), Anti-SSB(X2=6,49; p=0,007;OR=0,863), y Anti-Ro 52(X2=5,16; p=0,027;OR=0,405), Anti-RNP/SM (X2=18,71; p=0,000;OR=0,101) y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST) con la prueba de Chi-cuadrado de Pearson.
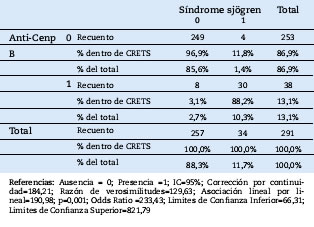
Se demostró que existe relación significativa p < 0,05 de los Anti-Cenp B (p=0,001;OR=233,43) y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST) con estadístico exacto de Fisher. (Tabla 4)
Tabla 4. Relación de los Anti-Cenp B y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST)
No existe relación significativa p>0,05 de los Anti-histonas (X2 =3,73; p=0,074;OR=0,318), Anti-SM(X2=3,63; p=0,060;OR=0,363) y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST) con la prueba de Chi-cuadrado de Pearson.
No existe relación significativa p>0,05 de los Anti-Rib p. protein (p=0,095; OR=0,192); Anti-Scl (p=0,396;OR=0,473), Anti-M2(p=0,45; OR=3,23) Anti-Jo1(p=0,231; OR=0,876), Anti-PCNA (p=0,612; OR=0,879) y Anti-PM100(p=0,054; OR=4,8) y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST) con el estadístico exacto de Fisher.
Se demostró que existe relación significativa p<0,05 de los Anti-Ro 52 (X2=6,285; p=0,015; OR=0,178), Anti-Scl (X2= 128,00; p=0,000; OR=1,88) y la esclerodermia con la prueba de Chi-cuadrado de Pearson.
No existe relación significativa p>0,05 de los Anti-nucleosomas (p=0,321;OR=0,263), Anti-dsDNA (p=0,766;OR=0,695), Anti-Cenp B (p=0,232;OR=0,941), Anti-SSA( p=0,776;OR=1,183), Anti-SSB(p=0,705;OR=0,409), y, Anti-RNP/SM (p=0,277;OR=0,461), Anti-histonas (p=0,205;OR=0,247), Anti-SM(p=0,768;OR=0,736), Anti-Rib p. protein (p=0,230; OR=0,941), Anti-M2(p=0,610; OR=0,945), Anti-Jo1 (p=1,000; OR=0,945), Anti-PCNA (p=1,000; OR=0,947), Anti-PM100(p=1,000; OR=0,947) y la esclerodermia con el estadístico exacto de Fisher.
Se demostró que existe relación significativa p<0,05 de los Anti-Jo1 (p=0,001; OR=2,000) y la polimiositis con el estadístico exacto de Fisher.
No existe relación significativa p>0,05 de los Anti-Ro 52 (p=0,305; OR=0,404), Anti-Scl (p=0,605; OR=0,969), Anti-nucleosomas (p=1,000;OR=0,542), Anti-dsDNA(p=0,117;OR=0,963), Anti-Cenp B(p=0,602;OR=0,968), Anti-SSA( p=0,111;OR=0,961), Anti-SSB (p=0,608;OR=0,968), y Anti-RNP/SM (p=0,719;OR=0,629), Anti-histonas (p=0,208;OR=0,965), Anti-SM(p=0,208;OR=0,963), Anti-Rib p. protein (p=0,602; OR=0,969), Anti-M2(p=1,000; OR=0,971), Anti-PCNA (p=0,247; OR=4,349) y Anti-PM100(p=1,000; OR=0,972) y la polimiositis con el estadístico exacto de Fisher.
Discusión
Los anticuerpos anti-ADN son inmunoglobulinas dirigidas contra el ADN puro o en complejo con proteínas como lo son las histonas. Estos anticuerpos son inmunoglobulinas que tienen distintas especificidades, se clasifican en anti-ssADN (ADN de cadena simple) y anti-dsADN (ADN de cadena doble).
Los anticuerpos anti-ssADN son los que se identifican, sin embargo, debido a su baja especificidad tienen muy poca relevancia clínica. Así, los anticuerpos anti-dsADN tienen mayor importancia por su alta especificidad en el diagnóstico de LES, específicamente en aquellos con nefritis lúpica.21,22 La utilidad clínica del anti-dsADN se fundamenta en el apoyo diagnóstico frente a un paciente con sospecha de LES, como método de seguimiento o como marcador de futuras recaídas de la enfermedad. En esta investigación se demostró que existe relación de los anti-dsDNA, anti-Sm, anti-nucleosomas, anti-histonas y el lupus eritematoso sistémico y que existe más de 10,86 veces la probabilidad que los pacientes que tengan anti-dsADN tengan el lupus eritematoso sistémico.
Los anticuerpos anti-Ro o SSA (anti-Sjögren’s syndrome related antigen A) son inmunoglobulinas contra proteínas de 52 kD y 60 kD asociadas a ARN.23,24 La presencia de niveles elevados de anticuerpos contra SSA (Ro) es indicativa de síndrome de Sjögren primario y de lupus eritematoso sistémico. Estos anticuerpos se encuentran en aproximadamente el 60-70% de pacientes con síndrome de Sjögren y el 40-50% de pacientes con lupus eritematoso sistémico.25,26 En la presente investigación 50 (64,9%) casos presentaron Anti-SSA y síndrome de Sjögren y 7 (8,2%) casos presentaron Anti-SSA y lupus eritematoso sistémico.
La presencia de niveles elevados de anticuerpos contra SSB (La) es indicativa de síndrome de Sjögren primario y de lupus eritematoso sistémico. Estos anticuerpos se encuentran en aproximadamente el 10-40% de pacientes con síndrome de Sjögren y el 6-15% de pacientes con lupus eritematoso sistémico.27,28 En la presente investigación 30 (39,0%) casos presentaron Anti-SSB y síndrome de Sjögren; además se identificó 1 (1,2%) caso de Anti-SSB y el lupus eritematoso sistémico.
Los anticuerpos anti-centromeros se asocian a la esclerosis sistémica limitado y se pueden encontrar en 80-95% de pacientes.29 También pueden ser detectados en 8% de los pacientes con la forma difusa, pero también ocurren en el 10-30% de los pacientes con cirrosis biliar primaria.30,31 En la presente investigación 30 (80,2%) casos presentaron anti Cenp-B y la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST) y existe relación significativa p < 0,05 de los Anti-Cenp B y existe 233,43 veces más la probabilidad de que los pacientes que tengan anti Cenp-B tengan la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST).
En conclusión existe relación de los anticuerpos contra antígenos extraíbles del núcleo y el lupus eritematoso sistémico, síndrome de Sjögren, enfermedad mixta del tejido conectivo, la calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias (CREST), esclerodermia y la polimiositis.
1. Kumar S, Aggarwa A. Approach to a patient with connective tissue disease. The Indian Journal of Pediatrics. 2010;77(10): 1157-1164. [ Links ]
2. Abumohor P. Enfermedades del tejido conectivo: importancia del diagnóstico precoz. Revista Médica de Clínica Las Condes. 2012; 23(4): 391-400. [ Links ]
3. Yoshimi R, Ueda A, Ozato K, Ishigatsubo Y. Clinical and pathological roles of Ro/SSA autoantibody system. Clinical and Developmental Immunology. 2012; 2012(1):1-12. [ Links ]
4. Xue D, Shi H, Smith JD, Chen X, Noe DA, Cedervall T, et al. A lupus-like syndrome develops in mice lacking the Ro 60-kDa protein, a major lupus autoantigen. Proceedings of the National Academy of Sciences. 2003;100(13):7503-8. [ Links ]
5. Migliorini P, Baldini C, Rocchi V, Bombardieri S. Anti-Sm and anti-RNP antibodies. Autoimmunity. 2005;38(1):47-54. [ Links ]
6. Agarwal S, Harper J, Kiely PDW. Concentration of antibodies to extractable nuclear antigens and disease activity in systemic lupus erythematosus. Lupus. 2009;18(5):407-12. [ Links ]
7. Kurien BT, Scofield RH. Autoantibody Determination in the Diagnosis of Systemic Lupus Erythematosus. Scandinavian Journal of Immunology. 2006;64(3):227-35. [ Links ]
8. Kvarnstrom M, Dzikaite-Ottosson V, Ottosson L, Gustafsson JT, Gunnarsson I, Svenungsson E, et al. Autoantibodies to the functionally active RING-domain of Ro52/SSA are associated with disease activity in patients with lupus. Lupus. 2013;22(5):477-85. [ Links ]
9. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheumatology. 1982;25(11):1271-7. [ Links ]
10. Petri M, Orbai AM, Alarcon GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheumatology. 2012;64(8):2677-86. [ Links ]
11. Egner W. The use of laboratory tests in the diagnosis of SLE. Journal of Clinical Pathology. 2000;53(6):424-432. [ Links ]
12. Martinez-Cordero E, Martinez-Miranda E, Negrete-Garcia MC, Padilla A, Aguilar Leon DE. Anti-dsDNA and Sm autoantibodies in systemic lupus erythematosus. Clinical Rheumatology. 1992;11(3):341-345. [ Links ]
13. Agarwal S, Harper J, Kiely P. Concentration of antibodies to extractable nuclear antigens and disease activity in systemic lupus erythematosus. Lupus. 2009;18(5):407-12. [ Links ] 14.
14. Gussin H, Ignat G, Varga J, Teodorescu M. Anti-topoisomerase I (anti-Scl-70) antibodies in patients with systemic lupus erythematosus. Arthritis Rheumatology. 2001;44(2):376-383. [ Links ]
15. Albon S, Bunn C, Swana G. Performance of a multiplex assay compared to enzyme and precipitation methods for anti-ENA testing in systemic lupus and systemic sclerosis. Journal of Immunological Methods. 2011;365(1-2): 126-131. [ Links ]
16. Ghedira I, Landolsi H, Mankai A. Antihistones antibodies in systemic lupus erythematosus, comparison of three assays: elisa, dot blot and immunoblot. Pathologie Biologie. 2006; 54(3): 148-154. [ Links ]
17. Albon S, Bunn C, Swana G. Performance of a multiplex assay compared to enzyme and precipitation methods for anti-ENA testing in systemic lupus and systemic sclerosis. Journal of Immunological Methods. 2011; 365(1-2):126-131. [ Links ]
18. Schulte J, Fritzler M, Mahler M. Latest update on the Ro/SSA autoantibody system. Autoimmunity Reviews. 2009; 8(7): 632-637. [ Links ]
19. Catoggio L, Bernstein R, Black C. Serological markers in progressive systemic sclerosis: clinical correlations. Annals of the Rheumatic Diseases.1983.42(1): 23-27. [ Links ]
20. Shinjo S, Levy-Neto M. Anti-Jo-1 antisynthetase syndrome. Revista Brasileira de Reumatología. 2010. 50(5): 492-500. [ Links ]
21. Tozzoli R, Bizzarro N, Tonutti E, Villalta D, Bassetti D, Manoni F, et al. Guidelines for the laboratory use of autoantibody test in the diagnosis and monitoring of autoimmune rheumatic diseases. American Journal of Clinical Pathology. 2002;117(2):316-24. [ Links ]
22. Severiche D, Escobar M, Naranjo L, García A, Vahos C, Duque G. Ciento quince pacientes con lupus eritematoso sistémico: Características clínicas e inmunológicas. Revista Colombiana de Reumatologia. 2004; 21(4):183-92. [ Links ]
23. Aggarwal A. Role of autoantibody testing. Best Practice & Research Clinical Rheumatology. 2014; 28(6): 907–20.
24. Mierendorf S, Shmerling RH. Antinuclear antibody testing. Hosp Med Clin. 2012;1: 370–7.
25. Manoussakis M, Kistis K, Liu X, Aidinis V, Guialis A, Moutsopoulos H. Detection of anti-Ro (SSA) antibodies in autoimmune diseases: comparison of five methods. British J Rheumatol.1993; 32(6): 449-455. [ Links ]
26. Reichlin M and Scofield RH. SSA(Ro) autoantibodies. En: James B. Peter and Yehuda Shoenfeld eds. Autoantibodies. Elsevier, 1996. [ Links ]
27. Tzioufas A, Moutsopoulos H. Clinical significance of autoantibodies to Ro/SSA and La/SSB. En: van Venrooij WJ and Maini RN eds. Manual of Biological Markers of Diseases. Kluwer Academic Publishers, 1996. [ Links ]
28. Wahren M, Téngner P, Gunnarsson I, Lundberg I, Hedfors E, Ringertz NR, Pettersson I. Ro/SS-A and La/SS-B antibody level variation in patients with Sjogren’s syndrome and systemic lupus erythematosus. J Autoimmun 1998;11(1):29-38.
29. Boire G, Gendron M, Monast N, Bastin B, Menard H. Purification of antigenically intact Ro ribonucleoproteins; biochemical and immunological evidence that the 52-kD protein is not a Ro protein. Clinical and experimental Immunology.1995;100(3):489-498. [ Links ]
30. Le Roy EC, Black C, Fleischmajer R. Scleroderma (systemic sclerosis): Classification subsets and pathogenesis. J Rheumatol. 1980; 15(2):202-205. [ Links ]
31. Hanke K, Uibel S, Bruckner C, Dahnrich C, Egerer K, Hiepe F, Schulumberger W, Riemekasten G. Antibodies to CENP-B antigen identify a subgroup of systemic sclerosis patients presenting more frequently sicca syndrome and less frequently lung fibrosis, cardiac and vascular involvement - analysis of the Charite SSc cohort. En: Conrad K et al. (Hrsg.). From Etiopathogenesis to the prediction of autoimmune diseases: Relevance of Autoantibodies. Pabst Science Publisher ;5(2007): 477-478. [ Links ]














