Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de reumatología
Print version ISSN 0327-4411On-line version ISSN 2362-3675
Rev. argent. reumatolg. vol.32 no.1 Buenos Aires Mar. 2021
ARTÍCULO ORIGINAL
Características epidemiológicas y desenlaces de la infección por SARS-CoV-2 en pacientes con patologías reumáticas: Primer reporte del registro argentino SAR-COVID
Epidemiological characteristics and outcomes of SARS-CoV-2 infection in patients with rheumatic diseases: First report from the Argentine SAR-COVID registry
Isnardi, Carolina A1; Gómez, Gimena1; Quintana, Rosana1; Roberts, Karen1; Berbotto, Guillermo2; Baez, Roberto Miguel3; Maldonado, Federico N4; Castro Coello, Vanessa4; Graf, César5; Pons-Estel, Guillermo1; Grupo de investigadores del Registro SAR-COVID (ver anexo I).
2Hospital Escuela Eva Perón, Granadero Baigorria. Sanatorio Británico, Rosario, Santa Fe
3Hospital General Roca y Policonsultorio Holos, General Roca, Río Negro
5Sociedad Argentina de Reumatología
Correspondencia: Dra. Carolina Isnardi, Sociedad Argentina de Reumatología. Av. Callao 384 (C1022AAQ) CABA. Argentina. TE: +54-11-4371-1643, mail: carolina.isnardi@reumatologia.org.ar
Resumen
Con el fin de evaluar el impacto de la infección por SARS-CoV-2 en pacientes con enfermedades reumáticas, la Sociedad Argentina de Reumatología desarrolló el Registro Nacional de Pacientes con Enfermedades Reumáticas y COVID-19 (SAR-COVID). El objetivo del presente trabajo fue evaluar las características sociodemográficas y clínicas de los pacientes con enfermedades reumáticas e infección por SARS-CoV-2 incluidos en el registro SAR-COVID y describir las complicaciones y desenlaces de la COVID-19 en esta población.
Material y métodos: SAR-COVID es un registro nacional, multicéntrico y observacional, en el cual se incluyen de manera consecutiva pacientes ≥18 años de edad, con diagnóstico de alguna enfermedad reumática que hayan cursado infección por SARS-CoV-2. Se consignan datos sociodemográficos, comorbilidades, enfermedad reumática y su tratamiento, características clínicas, laboratorio, complicaciones y tratamientos de la infección por SARS-CoV-2.
Resultados: Se incluyeron 525 pacientes, con una edad media de 51.3 años (DE 15.2). Las enfermedades reumatológicas más frecuentes fueron artritis reumatoidea (40.4%), lupus eritematoso sistémico (14.9%) y espondiloartritis (8.2%). El 72.9% recibía tratamiento inmunosupresor o inmunomodulador al momento del inicio de la infección y 36.9% glucocorticoides. En la mayoría de los casos, el diagnóstico de infección por SARS-CoV-2 se llevó a cabo mediante RT-PCR (95%), 39.4% en la consulta externa, 32.2% en el departamento de urgencias, y 14.7% durante la hospitalización. La mayoría de los pacientes presentaron síntomas, siendo los más frecuentes fiebre (56.2%), tos (46.7%) y cefalea (39.2%). Durante la infección, 35.1% requirieron hospitalización y 11.6% en unidad de cuidados intensivos. El 75.1% se recuperó completamente, 8.4% presentó secuelas y 6.9% murieron a causa de COVID-19.
Conclusión: En este primer reporte del registro SAR-COVID encontramos una amplia distribución de enfermedades reumáticas. La mayoría de los pacientes tuvieron una buena evolución de la infección, sin embargo un 7% falleció como consecuencia de la misma, datos comparables a los reportados por otros registros latinoamericanos con poblaciones similares.
Palabras clave: SARS-CoV-2; COVID-19; Enfermedades reumáticas; Tratamientos inmunosupresores
Abstract
In order to assess the impact of SARS-CoV-2 infection in patients with rheumatic diseases, the Argentine Society of Rheumatology has developed the National Registry of Patients with Rheumatic Diseases and COVID-19 (SAR-COVID). The aim of this study was to evaluate the sociodemographic and clinical characteristics of patients with rheumatic diseases and SARS-CoV-2 infection included in the SAR-COVID registry and to describe the complications and outcomes of COVID-19 in this population.
Methods: SAR-COVID is a national, multicenter and observational registry, in which patients ≥18 years of age, with a diagnosis of a rheumatic disease who had SARS-CoV-2 infection are consecutively included. Sociodemographic data, comorbidities, underlying rheumatic disease and treatment, clinical characteristics, complications, laboratory and treatment of the SARS-CoV-2 infection were recorded.
Results: A total of 525 patients were included, with a mean age of 51.3 years (SD 15.2). The most frequent rheumatic diseases were rheumatoid arthritis (40.4%), systemic lupus erythematous (14.9%) and spondyloarthritis (8.2%). At the time of the infection, 72.9% were receiving immunosuppressive or immunomodulatory treatment and 36.9% glucocorticoids. Most of the patients were diagnosed using RT-PCR (95%), at outpatient consultation (39.4%), at the emergency room (32.2%) or during hospitalization (14.7%). Symptoms were present in 96% of the patients, the most frequent being fever (56.2%), cough (46.7%) and headache (39.2%). During infection, 35.1% were hospitalized, 11.6% were admitted to the ICU and 6.9% died due to COVID-19. Most of them (75.1%) recovered completely.
Conclusions: In this first report of the SAR-COVID registry we found a wide distribution of rheumatic diseases. Most of the patients had a good evolution of the infection, however 7% died as a result of it, comparable to other Latin American registries with similar populations.
Key words: SARS-CoV-2; COVID-19; Rheumatic diseases; Immunosuppressive treatments
Introducción
COVID-19 (Corona Virus Disease-2019) es una enfermedad infecciosa transmitida por una nueva cepa de betacoronavirus, llamado SARS-CoV-2 por sus siglas en inglés de “severe acute respiratory syndrome coronavirus - 2” por el Comité Internacional de Taxonomía de Virus1. En diciembre de 2019 se produjo el primer brote de casos de neumonía severa en Wuhan, una ciudad de la provincia de Hubei en China2. Posteriormente, debido al aumento exponencial de casos y la gran diseminación geográfica, la Organización Mundial de la Salud (OMS) declaró a esta enfermedad como emergencia de salud pública de importancia internacional (ESPII) el 30 de enero de 20203.
Tradicionalmente, las enfermedades reumáticas, incluyendo a las de origen autoinmune, se han asociado a mayor riesgo a infecciones virales tanto por el riesgo intrínseco relacionado con la enfermedad como por el efecto de los tratamientos utilizados4,5. Sin embargo, a pesar de que los datos disponibles son limitados, existe cierta evidencia científica sobre el rol de diferentes medicamentos inmunomoduladores e inmunosupresores utilizados como tratamiento estándar en las patologías autoinmunes, en el manejo de formas severas de COVID-19. Los mismos podrían tener un efecto beneficioso en el manejo del síndrome de distrés respiratorio del adulto (SDRA) que ha sido asociado a tormenta de citoquinas, disfunción endotelial y coagulación intravascular diseminada6-8. Dentro de este grupo se incluyen: drogas antimaláricas9, colchicina10, glucocorticoides11,12, inhibidores de las proteínas Janus Kinasa13, y agentes biológicos como inhibidores de interleuquina (IL)-1, IL-614, receptor de IL-6 (IL-6R)15,16, factor de necrosis tumoral α (TNFα)17, entre otros18-20.
Debido a la carencia de datos en nuestro país, la Sociedad Argentina de Reumatología (SAR) diseñó un registro nacional denominado Registro Nacional de Pacientes con Enfermedades Reumáticas y COVID-19 (SAR-COVID). El objetivo del presente trabajo fue evaluar las características sociodemográficas y clínicas de los pacientes con enfermedades reumáticas e infección por SARS-CoV-2 incluidos en el registro SAR-COVID y describir las complicaciones y desenlaces del COVID-19 en esta población.
Material y métodos
SAR-COVID es un registro multicéntrico, observacional, desarrollado por la SAR con el fin de evaluar la evolución y el desenlace de la infección por SARS-CoV-2 en pacientes con patologías reumáticas de Argentina. Además, colaborar de manera activa con el registro internacional Global Rheumatology Alliance.
El periodo de inclusión comenzó el 13 de agosto de 2020 y para este estudio se realizó un corte el 15 de enero de 2021. A la fecha, se reclutaron más de 100 investigadores de todo el país, quienes fueron los responsables de detectar e incluir pacientes consecutivos del territorio argentino con diagnóstico de enfermedades reumáticas e infección documentada por SARS-CoV-2, evaluados durante la consulta ambulatoria, sala de emergencias o durante la hospitalización. Se realizó una visita basal, al momento del diagnóstico de la infección y el protocolo contempla una visita de seguimiento a los 12 meses. El registro se encuentra aún en etapa de reclutamiento.
Población y criterios de selección
Se incluyeron pacientes consecutivos, mayores de 18 años con diagnóstico previo de enfermedad reumática inflamatoria o degenerativa, según criterios del American College of Rheumatology (ACR) o la European League against Rheumatism (EULAR), según corresponda, tratados o no con fármacos inmunomoduladores y/o inmunosupresores. Las patologías evaluadas fueron: artritis reumatoidea21, espondiloartritis (espondilitis anquilosante, espondiloartritis axial no radiográfica, artritis psoriásica, otras)22-24, lupus eritematoso sistémico25, síndrome antifosfolípido26, esclerodermia27, síndrome de Sjögren28, enfermedad mixta del tejido conectivo29, miopatías inflamatorias30, vasculitis (asociada a ANCA, arteritis de células gigantes, otras vasculitis incluyendo enfermedad de Kawasaki)31-37, enfermedad de Behcet’s38, enfermedad por IgG439, sarcoidosis, artritis idiopática juvenil40, enfermedad de Still del adulto41, síndrome autoinflamatorio42-43, condrocalcinosis, gota44, polimialgia reumática45, osteoartritis46-48, osteopenia/osteoporosis49, fibromialgia50, síndrome de dolor miofascial, osteomielitis multifocal recurrente crónica51 e inflamación ocular.
Los pacientes debían tener diagnóstico de infección por SARS-CoV-2 confirmado a través de detección del genoma viral mediante reacción en cadena de polimerasa - transcripción inversa (RT-PCR) o serologías positivas, independientemente de la presencia de síntomas. El diagnóstico se llevó a cabo de manera local en cada uno de los centros.
Se excluyeron a aquellos pacientes que manifestaran su deseo de no participar en el estudio.
Variables de interés
Los datos fueron recolectados a través de una base de datos electrónica (ARTHROS-Web), de manera telefónica, consulta médica virtual, entrevista presencial o por revisión de historias clínicas, según disponibilidad. Se consignaron datos sociodemográficos (edad, sexo, etnia, residencia, nivel socioeconómico -escala de Graffar52-, educación, cobertura médica), comorbilidades, enfermedad reumática de base y su tratamiento previo a la intercurrencia infectológica. Con respecto a la infección por SARS-CoV-2, se registraron fecha, lugar y método diagnóstico, características clínicas y de laboratorio, tratamientos recibidos, complicaciones, requerimientos e intervenciones médicas (hospitalización, admisión a unidad de cuidados intensivos, oxigenoterapia y sus formas) y su evolución (recuperación total, recuperación con secuelas, no recuperado, muerte asociada a COVID-19, muerte por otra causa).
Consideraciones éticas
Este estudio fue aprobado por un comité de ética independiente y se llevó a cabo en concordancia con las guías de Buenas Prácticas Clínicas, el Consejo Internacional de Armonización y con los principios éticos establecidos por la Declaración de Helsinki, la ley 3301/09 y las guías del comité de ética local. Todos los pacientes fueron debidamente informados y firmaron el correspondiente consentimiento informado previamente a su inclusión. Los datos personales de los pacientes fueron tratados según la normativa de la ley nacional de Protección de datos personales (Ley 25.326)53. Este estudio se encuentra registrado en Clinical Trials bajo el número de identificación NCT04568421.
Análisis estadístico
Se realizó estadística descriptiva. Las variables continuas se expresaron en medianas y rango intercuartilo (RIC) o bien como medias con su correspondiente desvío estándar (± DE), según corresponda y las categóricas en frecuencia y porcentaje. Los análisis se llevaron a cabo mediante el programa R.
Resultados
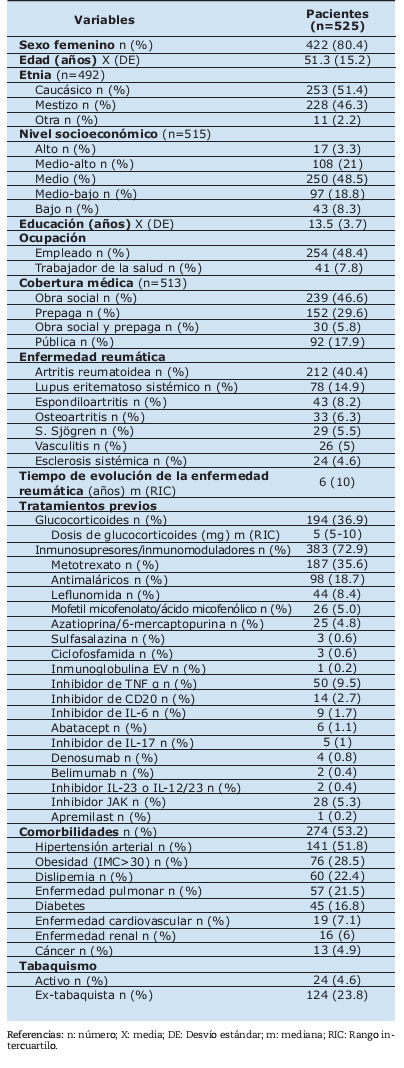
Entre el 13 de agosto 2020 y el 15 de enero 2021, un total de 525 pacientes con enfermedad reumática e infección por SARS-CoV-2 fueron incluidos. La mayoría de los mismos eran de sexo femenino (80.4%), con una edad media de 51.3 años (DE 15.2). Las etnias predominantes fueron la caucásica y la mestiza, 51.2% y 46.3%, respectivamente. Aproximadamente, la mitad de los pacientes estaban empleados (48.4%) y el 82,1% tenía algún tipo de cobertura de salud. Con respecto al nivel socioeconómico, el 48.8% fue clasificado como clase media, el 21% media-alta y el 18.8% media-baja. La educación media fue de 13.5 años (DE 3.7).
En relación a la patología reumática, la más frecuentemente registrada fue la artritis reumatoidea (40.4%), seguida por el lupus eritematoso sistémico (14.9%) y el grupo de las espondiloartritis (8.2%). Al momento de la infección por SARS-CoV-2, el 36.9% de los pacientes estaba recibiendo glucocorticoides y el 72.9% alguna droga inmunosupresora y/o inmunomoduladora. La mayoría, el 68.2% se encontraba en remisión o baja actividad de su enfermedad de base. El 53.2% reportó el antecedente de alguna comorbilidad. (Tabla I)
Tabla I. Características basales de los 525 pacientes con infección por SARS-CoV-2 y patologías reumáticas del registro argentino SAR-COVID
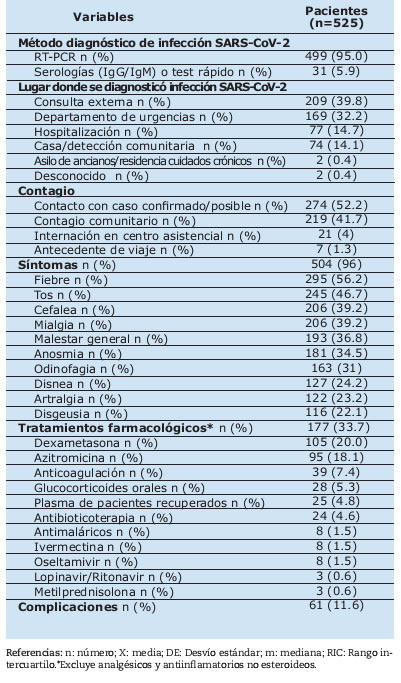
Con respecto a la forma de adquisición de la infección por SARS-CoV-2, la mayoría de los pacientes reportó un contacto cercano con infección confirmada o probable (52.2%) y el 41.7% fue considerado contagio comunitario. En el 95% de los casos se arribó al diagnóstico por prueba de RT-PCR y la misma fue solicitada durante una evaluación en consultorio externo en el 39.8% de los pacientes, en el departamento de urgencias en el 32.2% y durante la hospitalización en el 14.7%.
El 96% de los pacientes incluidos presentaron síntomas asociados a la infección, los más frecuentes fueron: fiebre (56.2%), tos (46.7%), cefalea (39.2%), mialgia (39.2%) y malestar general (36.8%). Solo el 4% tuvieron formas asintomáticas. La duración mediana de los síntomas fue 15 días (RIC 11-21.75). El 33.7% de los pacientes recibieron algún tratamiento distinto a analgésico o antiinflamatorio no esteroideo para el manejo de la infección, siendo los más comunmentes utilizados: dexametasona (20%), azitromicina (18.1%), anticoagulación (7.4%) (Tabla II).
Tabla II. Características epidemiológicas y clínicas de la infección por SARS-CoV-2
Durante la infección por SARS-CoV-2, 184 (35.1%) pacientes debieron ser hospitalizados. El tiempo mediano de estancia hospitalaria fue de 10 días (RIC 7-17). Debido a la severidad de los síntomas, 11.6% de los mismos fueron ingresados a la unidad de cuidados intensivos. Durante la internación, 32.1% requirió oxigenoterapia, 7.1% ventilación mecánica no invasiva o dispositivos de oxígeno a alto flujo y 21.7% ventilación mecánica invasiva (Figura I).

Figura I. Requerimiento de oxigenoterapia en los pacientes internados (n= 184)
Se registraron complicaciones en el 11.6% de los casos, la más frecuente fue el síndrome de dificultad respiratoria aguda (SDRA) (8.8%), seguida por la sepsis y/o shock séptico (3.2%) y la tormenta de citoquinas (1.5%). Se registraron tres casos de miocarditis o insuficiencia cardíaca nueva, tres casos de coagulación intravascular diseminada, dos casos de trombosis venosa y uno de trombosis arterial. Se reportaron otras 18 complicaciones graves, dentro de las que se destacan: cuatro pacientes con insuficiencia renal aguda con requerimiento de hemodiálisis, un paciente con hipertensión pulmonar, otro con hemorragia alveolar, otro neumomediastino asociado a tromboembolismo pulmonar, otro con hepatitis y por último un paciente con hemorragia digestiva alta y baja y colangitis litiásica.
La mayoría de los pacientes se recuperaron completamente (75.1%), mientras que 8.4% presentaron secuelas y 7.9% no se habían recuperado al momento de su ingreso al registro (Figura II). Las secuelas más frecuentemente reportadas fueron: hiposmia/anosmia, astenia, artromialgias y disnea de esfuerzos y dos pacientes con requerimiento de oxígeno domiciliario. Además, cinco pacientes reportaron daño pulmonar intersticial o progresión de lesión previa, dos presentaron polineuropatía del paciente crítico, uno tuvo miositis postviral.
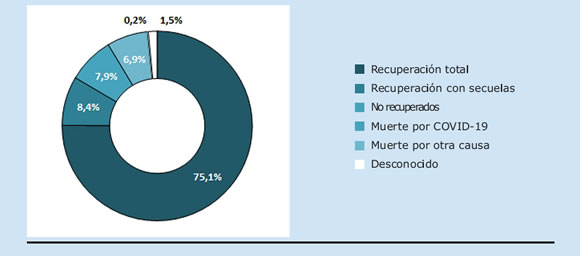
Figura II. Desenlace de la infección por SARS-CoV-2
En total, 36 (6.9%) pacientes murieron como consecuencia de la infección por SARS-CoV-2. Dentro de este último grupo, el 27.8% eran hombres, la edad media fue de 62.3 años (DE 11.2) y el 66.7% presentaba alguna comorbilidad.
Discusión
Este es el primer reporte que informa acerca de las características sociodemográficas, clínicas y desenlace de la infección por SARS-CoV-2 en pacientes con patologías reumáticas en Argentina a partir de datos provenientes del registro nacional SAR-COVID, en el que se han analizado datos de más de 500 pacientes de todo el país.
En Argentina, el primer caso de COVID-19 fue reportado el 3 de marzo de 2020. Desde entonces, el Gobierno Nacional impuso diferentes medidas con el fin de disminuir la propagación del virus, incluyendo el aislamiento obligatorio a partir del día 20 del mismo mes. Las restricciones fueron variando con el correr del tiempo y la situación epidemiológica en las diferentes regiones del país. Según el reporte de situación del Ministerio de Salud del 15 de enero de 2021, fecha de corte del presente análisis, se habían confirmado 1783047 casos de infección por SARS-CoV-2, de los cuales, 1561963 pacientes se habían recuperado y 45228 habían fallecido54. Recientemente, se ha publicado un análisis de los datos provenientes de la base de datos del Sistema Integrado de Información Sanitaria Argentina (SIISA) obtenidos durante el periodo comprendido entre el 3 de marzo y el 2 de octubre de 2020, en el que se detallan las características de más de 700 mil casos confirmados por RT-PCR55. De manera similar a lo observado en nuestro estudio, los síntomas más frecuentemente reportados fueron fiebre, tos y cefalea. En este caso, la mortalidad global fue de 2.7%, inferior a lo detectado en nuestra cohorte. Esta diferencia puede deberse a varios factores. En primer lugar, la población general era más joven (40.4 años, DE 18 vs 51.3, DE 15.2) y tenía menor frecuencia de comorbilidades (41% vs 53.2%), ambos factores de mal pronóstico. Además, como consecuencia de la pandemia y de las medidas de aislamiento, el control regular de los pacientes con patologías crónicas se ha visto afectado, provocando una disminución en el contacto paciente-reumatólogo. Esto probablemente produjo al momento del análisis actual un sub-registro de pacientes asintomáticos o con síntomas leves. En nuestro reporte, el grupo de pacientes que cursaron la infección de manera asintomática representa solo el 4%.
Comparando nuestros datos con aquellos reportados por el subanálisis de los pacientes latinoamericanos incluidos en el registro internacional Global Rheumatology Alliance56, observamos que estos últimos presentaron mayor frecuencia de hospitalización (61%), de complicaciones (38%), de requerimiento de ventilación mecánica invasiva (20%) y mortalidad (12%). Cabe destacar que en esta cohorte solo se incluyeron pacientes con patología inmunomediada y que la frecuencia de uso de glucocorticoides era superior (51% vs 36.9%), aunque el tratamiento con agentes biológicos era comparable.
En Brasil, datos provenientes del registro ReumaCoV Brasil57,58 mostraron una frecuencia de hospitalización, ingreso a unidad de cuidados intensivos, requerimiento de ventilación mecánica invasiva y muerte en pacientes con enfermedades reumáticas comparable a nuestra población, 33%, 15%, 10.5% y 8.4%, respectivamente. Al igual que lo observado en Argentina, la mortalidad reportada a nivel nacional es inferior a lo observado en la cohorte del registro ReumaCoV Brasil. Según datos del Ministerio de Salud de Brasil, la misma es de 2.4%59.
Otro punto a destacar, es que los pacientes que fallecieron a causa de la COVID-19 en comparación con los datos de la población analizada en este corte del registro, eran con mayor frecuencia hombres, eran más añosos y tenían mayor prevalencia de comorbilidad. Estas tres características han sido identificadas como factores de mal pronóstico en esta enfermedad tanto a nivel local como en otras cohortes internacionales55,60. Pero no solo la mortalidad es un desenlace a tener en cuenta, sino que además debemos señalar que de los 184 pacientes que debieron ser hospitalizados, aproximadamente el 30% requirió ventilación mecánica invasiva o no invasiva o dispositivos de alto flujo y que un tercio de ellos presentaron alguna complicación grave. Estos datos son comparables a los reportados por el registro brasilero y la población incluida en Global Rheumatology Alliance, aunque menor a lo observado en el subanálisis latinoamericano de este mismo grupo56,58. Todas estas consideraciones deben ser tenidas en cuenta al momento de pensar las necesidades edilicias, recursos sanitarios, personal de salud y gastos totales en relación a la infección por SARS-CoV-2 en este grupo de pacientes.
Con respecto a los tratamientos instaurados para el manejo de la infección por SARS-CoV-2, en nuestra cohorte podemos observar el uso de una gran variedad de drogas. Incluso, la mayoría de los pacientes tratados (63.6%) recibió dos o más fármacos. Si bien el único tratamiento farmacológico recomendado en nuestro país es la dexametasona 6 mg/día en pacientes con neumonía e insuficiencia respiratoria61, en esta población de la vida real se identifica el uso de drogas como antimaláricos, azitromicina, ivermectina y antivirales. Cabe destacar que las recomendaciones tanto locales como internacionales se han ido modificando desde el advenimiento de esta pandemia. En esta cohorte no se indicaron otras drogas para el manejo de la infección, incluyendo agentes inhibidores de TNFα, inhibidores de IL-6, inhibidores de IL-1 o inhibidores de JAK.
Para finalizar, este estudio tiene fortalezas y limitaciones. En primer lugar, existe un sesgo de inclusión, ya que el reporte de datos por parte del reumatólogo reviste característica voluntaria. Asimismo, la mayoría de los pacientes que se incluyen en este estudio pertenecen a la Ciudad Autónoma de Buenos Aires y de Gran Buenos Aires, sin embargo esto responde a la distribución de la población de nuestro país y a las zonas con mayor incidencia de casos de infección por SARS-CoV-2. Se espera que para los futuros informes tengamos mayor representatividad de los pacientes y reumatólogos del resto del país. Por otro lado, la mayoría de los pacientes registrados son de nivel socio-económico medio, empleados y con cobertura social, siendo este el grupo de pacientes que ha tenido mayor acceso al sistema de atención médica. Esto último probablemente se deba a que muchos hospitales y consultorios privados, al momento del corte de este reporte, aún no habían retomado las actividades asistenciales de manera habitual. Además, como se mencionó previamente, la mayoría de los datos fueron recolectados durante la implementación del aislamiento preventivo obligatorio y por lo tanto existe probablemente un sub-registro de casos asintomáticos o leves. En segundo lugar, podemos identificar un sesgo de recolección de datos, ya que en algunos casos, la información ha sido recabada de manera retrospectiva o por interrogatorio a familiares, pudiendo resultar en datos faltantes.
Como fortaleza, este trabajo constituye el primer y más grande reporte de pacientes con enfermedades reumáticas de nuestro país e incluye datos de más de 500 pacientes, en el que participaron más de 100 investigadores de 12 de las 23 provincias de la Argentina.
Conclusiones
En este primer reporte del registro SAR-COVID encontramos una amplia distribución de enfermedades reumáticas en pacientes con infección por SARS-CoV-2. La mayoría de los pacientes tuvieron una buena evolución de la infección, sin embargo un 7% falleció como consecuencia de la misma, datos comparables a los reportados por otros registros latinoamericanos con poblaciones similares.
En un futuro, luego de la inclusión de un mayor número de pacientes en el registro SAR-COVID, esperamos realizar análisis en los que se evalúen los predictores de mal pronóstico, incluyendo mortalidad, en este grupo de pacientes.
Agradecimientos
SAR-COVID es un registro multisponsor. Agradecemos a los siguientes laboratorios por la adjudicación de subsidios irrestrictos: Pfizer, Abbvie, Elea Phoenix. Ninguno de ellos tiene acceso a los datos de los pacientes. La UNISAR agradece el trabajo de Leandro Cino en tareas de gestión del registro y a Leonardo Grasso por su asistencia técnica sobre el software ARTHROS-web. Agradecemos también al Dr. Gustavo Citera por su colaboración y lectura crítica de este trabajo.
1. Zavascki AP, Falci DR. Clinical Characteristics of Covid-19 in China. Reply. N Engl J Med. 2020; 382(19):1861-1862. [ Links ]
2. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020; 382(18):1708-1720. [ Links ]
3. Organización Mundial de la Salud; 2021 [acceso 14 de febrero de 2021]. Cronología de la respuesta de la OMS a la COVID-19. Disponible en: Sitio web de la Organización Mundial de la Salud: https://www.who.int/es/news/item/29-06-2020-covidtimeline. [ Links ]
4. Furst DE. The risk of infections with biologic therapies for rheumatoid arthritis. Semin Arthritis Rheum. 2010;39(5):327-346. [ Links ]
5. Favalli EG, Ingegnoli F, De Lucia O, Cincinelli G, Cimaz R, Caporali R. COVID-19 infection and rheumatoid arthritis: Faraway, so close!. Autoimmun Rev. 2020;19(5):102523. [ Links ]
6. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033-1034. [ Links ]
7. Sarzi-Puttini P, Giorgi V, Sirotti S, Marotto D, Ardizzone S, Rizzardini G, et al. COVID-19, cytokines and immunosuppression: what can we learn from severe acute respiratory syndrome?. Clin Exp Rheumatol. 2020;38(2):337-342. [ Links ]
8. Zhai Z, Li C, Chen Y, Gerotziafas G, Zhang Z, Wan J, et al. Prevention and Treatment of Venous Thromboembolism Associated with Coronavirus Disease 2019 Infection: A Consensus Statement before Guidelines. Thromb Haemost. 2020;120(6):937-948. [ Links ]
9. Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020;14(1):72-73. [ Links ]
10. Deftereos SG, Siasos G, Giannopoulos G, Vrachatis DA, Angelidis C, Giotaki SG, et al. The Greek study in the Effects of Colchicine in Covid-19 complications prevention (GRECCO-19 study): rationale and study design. Hellenic J Cardiol. 2020;61(1):42-45. [ Links ]
11. Rubin EJ, Baden LR, Morrissey S. Audio Interview: New Research on Possible Treatments for Covid-19. N Engl J Med. 2020; 382(12):e30. [ Links ]
12. Zhao JP, Hu Y, Du RH, Chen ZS, Jin Y, Zhou M, et al. Expert consensus on the use of corticosteroid in patients with 2019-nCoV pneumonia. Zhonghua Jie He He Hu Xi Za Zhi. 2020;43(3):183-184. [ Links ]
13. Favalli EG, Biggioggero M, Maioli G, Caporali R. Baricitinib for COVID-19: a suitable treatment? [published online ahead of print, 2020 Apr 3]. Lancet Infect Dis. 2020; S1473-3099(20)30262-0. [ Links ]
14. Conti P, Ronconi G, Caraffa A, Gallenga CE, Ross R, Frydas I, et al. Induction of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19 (COVID-19 or SARS-CoV-2): anti-inflammatory strategies. J Biol Regul Homeost Agents. 2020; 34(2):327-331. [ Links ]
15. Zhang C, Wu Z, Li JW, Zhao H, Wang GQ. The cytokine release syndrome (CRS) of severe COVID-19 and Interleukin-6 receptor (IL-6R) antagonist Tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents. 2020;55(5):105954. [ Links ]
16. Sitio web de Clinical Trials: https://clinicaltrials.gov/ct2/show/NCT04315298. [ Links ]
17. Haga S, Yamamoto N, Nakai-Murakami C, Osawa Y, Tokunaga K, Sata T, et al. Modulation of TNF-alpha-converting enzyme by the spike protein of SARS-CoV and ACE2 induces TNF-alpha production and facilitates viral entry. Proc Natl Acad Sci USA. 2008; 105(22):7809-7814. [ Links ]
18. Lu CC, Chen MY, Chang YL. Potential therapeutic agents against COVID-19: What we know so far. J Chin Med Assoc. 2020; 83(6):534-536. [ Links ]
19. Rosenbaum L. Facing Covid-19 in Italy - Ethics, Logistics, and Therapeutics on the Epidemic’s Front Line. N Engl J Med. 2020; 382(20):1873-1875.
20. Russell B, Moss C, George G, Santaolalla A, Cope A, Papa S, et al. Associations between immune-suppressive and stimulating drugs and novel COVID-19 - a systematic review of current evidence. Ecancermedicalscience. 2020; 14:1022. [ Links ]
21. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum. 2010; 62(9):2569-81. [ Links ]
22. Rudwaleit M, van der Heijde D, Landewé R, Listing J, Akkoc N, Brandt J, Braun J, et al. The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part II): validation and final selection. Ann Rheum Dis. 2009;68(6):777-83. [ Links ]
23. Rudwaleit M, van der Heijde D, Landewé R, Akkoc N, Brandt J, Chou CT, et al. The Assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann Rheum Dis. 2011; 70(1):25-31. [ Links ]
24. Taylor W, Gladman D, Helliwell P, Marchesoni A, Mease P, Mielants H, CASPAR Study Group. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum. 2006; 54(8):2665-73. [ Links ]
25. Petri M, Orbai A, Alarcón GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics Classification criteria for systemic lupus erythematosus. Arthritis Rheum. 2012; 64(8):2677-86. [ Links ]
26. Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006; 4(2):295-306. [ Links ]
27. van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A, et al. 2013 classification criteria for systemic sclerosis: an American College of Rheumatology/European League against Rheumatism collaborative initiative. Arthritis Rheum. 2013; 65(11):2737-47. [ Links ]
28. Shiboski SC, Shiboski CH, Criswell LA, Baer AN, Challacombe S, Lanfranchi H, et al. American College of Rheumatology classification criteria for Sjögren’s syndrome: a data-driven, expert consensus approach in the Sjögren’s International Collaborative Clinical Alliance cohort. Arthritis Care Res (Hoboken) 2012; 54(4):475-87.
29. Kasukawa R. Mixed connective tissue disease. Intern Med. 1999; 38(5):386-93. [ Links ]
30. Lundberg IE, Tjärnlund A, Bottai M, Werth VP, Pilkington C, Visser M, et al. 2017 European League Against Rheumatism/American College of Rheumatology classification criteria for adult and juvenile idiopathic inflammatory myopathies and their major subgroups. Ann Rheum Dis. 2017; 76(12):1955-64. [ Links ]
31. Watts R, Lane S, Hanslik T, Hauser T, Hellmich B, Koldingsnes W, et al. Development and validation of a consensus methodology for the classification of the ANCA-associated vasculitides and polyarteritis nodosa for epidemiological studies. Ann Rheum Dis. 2007; 66(2):222-7. [ Links ]
32. Lightfoot RW, Michel BA, Bloch DA, Hunder GG, Zvaifler NJ, McShane DJ, et al. The American College of Rheumatology 1990 criteria for the classification of polyarteritis nodosa. Arthritis Rheum. 1990; 33(8):1088-93. [ Links ]
33. Leavitt RY, Fauci AS, Bloch DA, Michel BA, Hunder GG, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener’s granulomatosis. Arthritis Rheum. 1990; 33(8):1101-7.
34. Leavitt RY, Fauci AS, Bloch DA, Michel BA, Hunder GG, Arend WP, et al. The American College of Rheumatology 1990 criteria for the classification of Wegener’s granulomatosis. Arthritis Rheum. 1990; 33(8):1101-7.
35. Hunder GG, Bloch DA, Michel BA, Stevens MB, Arend WP, Calabrese LH, et al. The American College of Rheumatology 1990 criteria for the classification of giant cell arteritis. Arthritis Rheum. 1990; 33(8):1122-8. [ Links ]
36. Arend WP, Michel BA, Bloch DA, Hunder GG, Calabrese LH, Edworthy SM, et al. The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis. Arthritis Rheum. 1990; 33(8):1129-34. [ Links ]
37. Sharma BK, Jain S, Suri S, Numano F. Diagnostic criteria for Takayasu arteritis. International Journal of Cardiology. 1996; 54:S141-S147. [ Links ]
38. Newburger JW, Takahashi M, Gerber MA, Gewitz MH, Tani LY, Burns JC, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Circulation. 2004; 110(17):2747-71. [ Links ]
39. Criteria for diagnosis of Behçet’s disease. International Study Group for Behçet’s Disease. Lancet. 1990; 335(8697):1078-80.
40. Wallace ZS, Naden RP, Chari S, Choi H, Della-Torre E, Dicaire JF, et al. The 2019 American College of Rheumatology/European League Against Rheumatism Classification Criteria for IgG4-Related Disease. Arthritis Rheumatol. 2020; 72(1):7-19. [ Links ]
41. Martini A, Ravelli A, Avcin T, Beresford MW, Burgos-Vargas R, Cuttica R, et al. Toward New Classification Criteria for Juvenile Idiopathic Arthritis: First Steps, Pediatric Rheumatology International Trials Organization International Consensus. J Rheumatol. 2019; 46(2):190-7. [ Links ]
42. Yamaguchi M, Ohta A, Tsunematsu T, Kasukawa R, Mizushima Y, Kashiwagi H, et al. Preliminary criteria for classification of adult Still’s disease. J Rheumatol. 1992; 19(3):424-30.
43. Kuemmerle-Deschner JB, Ozen S, Tyrrell PN, Kone-Paut I, Goldbach-Mansky R, Lachmann H, et al. Diagnostic criteria for cryopyrin-associated periodic syndrome (CAPS). Ann Rheum Dis. 2017; 76(6):942-7. [ Links ]
44. Vanoni F, Caorsi R, Aeby S, Cochard M, Antón J, Berg S, et al. Towards a new set of classification criteria for PFAPA syndrome. Pediatr Rheumatol Online J. 2018; 16(1):60. [ Links ]
45. Neogi T, Jansen TL, Dalbeth N, Fransen J, Schumacher HR, Berendsen D, et al. 2015 Gout Classification Criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheumatol. 2015; 67(10):2557-68. [ Links ]
46. Dasgupta B, Cimmino MA, Kremers HM, Schmidt WA, Schirmer M, Salvarani C, et al. 2012 Provisional classification criteria for polymyalgia rheumatica: a European League Against Rheumatism/American College of Rheumatology collaborative initiative. Arthritis Rheum. 2012; 64(4):943-54. [ Links ]
47. Altman R, Alarcón G, Appelrouth D, Bloch D, Borenstein D, Brandt K, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum. 1990; 33(11):1601-10. [ Links ]
48. Altman R, Alarcón G, Appelrouth D, Bloch D, Borenstein D, Brandt K, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip. Arthritis Rheum. 1991; 34(5):505-14. [ Links ]
49. Altman R, Asch E, Bloch D, Bole G, Borenstein D, Brandt K, et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and Therapeutic Criteria Committee of the American Rheumatism Association. Arthritis Rheum. 1986; 29(8): 1039-49. [ Links ]
50. World Health Organization. 1994. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. WHO, Geneva, Switzerland. [ Links ]
51. Bennett RM, Friend R, Marcus D, Bernstein C, Han BK, Yachoui R, et al. Criteria for the diagnosis of fibromyalgia: validation of the modified 2010 preliminary American College of Rheumatology criteria and the development of alternative criteria. Arthritis Care Res (Hoboken). 2014; 66(9):1364-73. [ Links ]
52. Handrick W, Hörmann D, Voppmann A, Schille R, Reichardt P, Tröbs RB, et al. Chronic recurrent multifocal osteomyelitis-report of eight patients. Pediatr Surg Int. 1998; 14(3):195-8. [ Links ]
53. Méndez H. Sociedad y estratificación. Método Graffar-Méndez Castellano. Caracas: Fundacredesa, 1994. [ Links ]
54. Ley 25.326 Protección de datos personales. Disposiciones Generales. Principios generales relativos a la protección de datos. Derechos de los titulares de datos. Usuarios y responsables de archivos, registros y bancos de datos. Control. Sanciones. Acción de protección de los datos personales. Sancionada: Octubre 4 de 2000. Promulgada Parcialmente: Octubre 30 de 2000. Senado y Cámara de Diputados de la Nación Argentina reunidos en Congreso. [ Links ]
55. Ministerio de Salud. Argentina; 2021 [acceso 14 de febrero de 2021]. Reporte diario vespertino nro 493. Situación de COVID-19 en Argentina. Disponible en: https://www.argentina.gob.ar/coronavirus/informes-diarios/reportes/enero2021 [ Links ]
56. Schönfeld D, Arias S, Bossio JC, Fernández H, Gozal D, Pérez-Chada D. Clinical presentation and outcomes of the first patients with COVID-19 in Argentina: Results of 207079 cases from a national database. PLoS One. 2021; 16(2):e0246793. [ Links ]
57. Ugarte-Gil MF, Marques CDL, Alpizar-Rodriguez D, Pons-Estel GJ, Xibille-Friedmann D, Paiva E, et al. Characteristics associated with Covid-19 in patients with Rheumatic Disease in Latin America: data from the Covid-19 Global Rheumatology Alliance physician-reported registry. https://www.globalrheumpanlar.org/node/254. [ Links ]
58. Marques C, Kakehasi AM, Gomides APM, Paiva EDS, Dos Reis Neto ET, Pileggi GCS, et al. A Brazilian Cohort of Patients With Immuno-Mediated Chronic Inflammatory Diseases Infected by SARS-CoV-2 (ReumaCoV-Brasil Registry): Protocol for a Prospective, Observational Study. JMIR Res Protoc. 2020; 9(12):e24357. [ Links ]
59. Marques CDL, Kakehasi AM, Pinheiro MM, Mota LMH, Albuquerque CP, Silva CR, et al. High levels of immunosuppression are related to unfavourable outcomes in hospitalised patients with rheumatic diseases and COVID-19: first results of ReumaCoV Brasil registry. RMD Open. 2021; 7(1):e001461. [ Links ]
60. Ministério da Saúde. Brasil; 2021 [acceso 14 de febrero de 2021]. Reporte de situación COVID-19. Disponible en: https://susanalitico.saude.gov.br/extensions/covid-19_html/covid-19_html.html. [ Links ]
61. Santos CS, Morales CM, Álvarez ED, Castro CÁ, Robles AL, Sandoval TP. Determinants of COVID-19 disease severity in patients with underlying rheumatic disease. Clin Rheumatol. 2020; 39(9):2789-96. [ Links ]
62. Ministerio de Salud. Argentina; 2021 [acceso 14 de febrero de 2021]. Recomendaciones condicionales para el abordaje terapéutico de COVID-19 - Versión 3.0. Disponible en: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/abordaje-terapeutico. [ Links ]
Anexo I - Grupo de investigadores del Registro SAR-COVID
María J Haye Salinas 1, Hernán Maldonado Ficco 2, Cecilia Pisoni 3, Alvaro A Reyes Torres 4, Gelsomina Alle 4, María Julieta Gamba 5, Carla Gobbi 6, Yohana Tissera 7, Romina Nieto 8, Noelia German 9, Leandro Carlevaris 10, Micaela Cosatti 3, Mercedes García 11, Juan Alejandro Albiero 12, Romina Tanten 4, Ivana R Rojas Tessel 13, Verónica Savio 14, María Alejandra Cusa 15, Karina Cogo 16, Julia Scafati 11, Luciana González Lucero 17, María Alejandra Medina 18, María de la Vega 19, Tatiana Barbich 20, Alba Paula 21, Verónica Bellomio 22, Rodolfo Pérez Alamino 23, María Soledad Gálvez Elkin 24, Lorena Takashima 25, Silvana Conti 26, María Alicia Lázaro 27, Gustavo Fabián Rodríguez Gil 28, Fabián Risueño 29, Sofía Ornella 11, Mariana Pera 22, Sebastián Moyano 4, Luciana Casalla 30, Sandra Petruzzelli 31, Susana I Pineda 32, Marina L Werner 33, Natalia L Cuchiaro 34, Boris Kisluk 35, Jonathan E Rebak 36, María Elena Calvo 37, Ana Bertoli 38, Pablo Maid 39, Débora Guaglianone 40, Julieta Silvana Morbiducci 41, Sabrina Porta 42, María Severina 43, Carla G Alonso 44, María Victoria Martire 45, Carla Maldini 46, Natalia Herscovich 47, Mara Guinsburg 48, María Sol Castaños Menescardi 49, Rosana Gallo 50, Carla Matellan 51, Cinthya Retamozo 52, Carolina Dieguez 53, Cecilia Goizueta 54, Sabrina S De La Vega Fernández 55, Carolina Aeschlimann 56, Gisela Subils 50, Eugenia Picco 34
1. CEMMA, La Rioja, La Rioja; 2. Hospital San Antonio de Padua y Clínica Regional Del Sud, Río Cuarto, Córdoba; 3. CEMIC, CABA; 4. Hospital Italiano de Buenos Aires, CABA; 5. Hospital Nacional Posadas, El Palomar, Buenos Aires; 6. Consultorio Privado, Córdoba, Córdoba; 7. Hospital Córdoba, Córdoba, Córdoba; 8. Hospital Intendente Carrasco, Hospital Escuela Eva Perón y Centro Regional de Enfermedades Autoinmunes y Reumáticas, Rosario, Santa Fe; 9. Htal J.M Penna, CABA; 10. Hospital Mendoza, Mendoza; 11. HIGA San Martin de la Plata, La Plata, Buenos Aires; 12. Hospital Córdoba y Sanatorio Alliende, Córdoba, Córdoba; 13. Hospital Señor del Milagro y Centro Médico Pueyrredón, Salta, Salta; 14. Hospital Córdoba y Consultora Integral de Salud CMP, Córdoba, Córdoba; 15. Hospital Central de San Isidro y Medicina Reumatológica, Buenos Aires; 16. Hospital Interzonal Luis Güemes y Hospital San Juan de Dios, Buenos Aires; 17. Centro de Investigaciones Reumatológicas, SM de Tucumán, Tucumán; 18. Hospital General de Agudos Dr. E. Tornú, CABA; 19. Hospital Argerich, CABA; 20. Instituto de Rehabilitación Psicofísica, CABA; 21. Hospital Córdoba, Hospital Materno neonatal y Hospital Italiano de Córdoba, Córdoba, Córdoba; 22. Hospital Padilla y Consultorio del Pilar, SM de Tucumán, Tucumán; 23. Hospital Avellaneda, SM de Tucumán, Tucumán; 24. Instituto de Cardiología, Santiago del Estero, Santiago del Estero; 25. Hospital Churruca y Orionis, CABA; 26. Hospital Provincial de Rosario y Hospital Privado Rosario, Rosario, Santa Fe; 27. IMAC SI, San Isidro, Buenos Aires; 28. Hospital Municipal Dr. Leónidas Lucero y IRREDIM Centro, Bahía Blanca, Buenos Aires; 29. Consultorio de Reumatología Dr. Fabián Risueño, Bahía Blanca, Buenos Aires; 30. Genea Centro Médico, CABA; 31. Hospital Francisco Santojanni, CABA; 32. Instituto del Diagnóstico, Venado Tuerto, Santa Fe; 33. Hospital Nacional de Clínicas e Instituto Humanas, Córdoba, Córdoba; 34. Hospital Señor del Milagro, Salta, Salta; 35. Hospital Escuela Eva Perón y Sanatorio Británico, Santa Fe; 36. Sanatorio Güemes, CABA; 37. Hospital 4 de Junio e Instituto privado; Presidencia Roque Sáenz Peña, Chaco; 38. Clínica Universitaria Reina Fabiola, Córdoba, Córdoba; 39. Hospital Austral, Derqui, Buenos Aires; 40. Sanatorio Parque, Rosario, Santa Fe; 41. Hospital Bernardino Rivadavia, CABA; 42. Hospital Gral. de Agudos Dr. J.M. Ramos Mejía, CABA; 43. CPMN, Río Cuarto, Córdoba; 44. Hospital Córdoba, Córdoba; 45. Hospital San Roque, La Plata, Buenos Aires; 46. Paviotti División Salud, Villa María, Córdoba; 47. Consultorio privado, CABA; 48. Centro Médico Castelli, Bahía Blanca, Buenos Aires; 49. DASPU, Córdoba, Córdoba; 50. Hospital Dr. A. Gutiérrez y Sanatorio San Martin, Venado Tuerto, Santa Fe; 51. Institución CEMEP, Río Grande, Tierra del Fuego; 52. Hospital San Vicente de Paul y Cedyr, Oran, Salta; 53. IPAM, Rosario, Santa Fe; 54. Sanatorio 9 de Julio, SM de Tucumán, Tucumán; 55. Hospital de Clínicas Virgen María de Fátima, La Rioja, La Rioja; 56. Hospital Provincial de Rosario, Rosario, Santa Fe; 57. Hospital Rawson y Hospital Italiano de Córdoba, Córdoba, Córdoba.














