Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de reumatología
versão impressa ISSN 0327-4411versão On-line ISSN 2362-3675
Rev. argent. reumatolg. vol.32 no.4 Buenos Aires dez. 2021
ARTÍCULO ORIGINAL
Respuesta immune humoral asociada a las vacunas contra SARS-CoV-2 en pacientes con artritis reumatoidea: datos del registro SAR-CoVAC
Humoral immune response associated to the vaccines against SARS-CoV-2 in patients with rheumatic arthritis: data from the SAR-CoVAC registry
Carolina A Isnardi1,2, Margarita Landi3, Natalia Laufer4,5, Pablo Maid3, Claudia Calle Montoro3, Agustina Alfaro2, Brian Roldán2, Andrea Gómez Vara2, Pamela Giorgis2, Alejandro Ezquer2, María G Crespo Rocha2, Camila Reyes2, María de los Ángeles Correa2, Osvaldo L Cerda2, Marcos Rosemffet2, Virginia Carrizo Abarza2, Santiago Catalán Pellet3, Miguel Perandones2, Cecilia Reimundes3, Leonel Cruces5, Yesica Longueira4,5, Gabriela Turk4,5, Florencia Quiroga4,5, Rosana Quintana1, María Celina de la Vega6, Rosana Quintana1, Roberts Karen1, Gustavo Citera2, Guillermo Pons Estel1, Emilce Schneeberger2
1Unidad de Investigación, Sociedad Argentina de Reumatología, Ciudad Autónoma de Buenos Aires, Argentina
2Sección Reumatología, Instituto de Rehabilitación Psicofísica, Ciudad Autónoma de Buenos Aires, Argentina
3Servicio Reumatología, Hospital Universitario Austral, Provincia de Buenos Aires, Argentina
4Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Universidad de Buenos Aires (UBA), Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS), Ciudad Autónoma de Buenos Aires, Argentina
5Universidad de Buenos Aires (UBA), Facultad de Medicina, Ciudad Autónoma de Buenos Aires, Argentina
6Sociedad Argentina de Reumatología, Ciudad Autónoma de Buenos Aires, Argentina
Contacto de la autora: Emilce Schneeberger: E-mail: eschneeb@gmail.com
Fecha de trabajo recibido: 16/12/21
Fecha de trabajo aceptado: 26/12/21
Resumen
Introducción: la artritis reumatoidea (AR) y los tratamientos indicados para su manejo pueden afectar la respuesta a la vacuna para SARS-CoV-2. Sin embargo, aún no se cuenta con datos locales.
Objetivos: evaluar la respuesta humoral de la vacuna para SARS-CoV-2 y su seguridad en esta población.
Materiales y métodos: estudio observacional. Se incluyeron pacientes ≥18 años, con AR ACR/EULAR 2010 que recibieron la vacunación para SARS-CoV-2. Detección de IgG anti-proteína S (kit COVIDAR).
Resultados: se incluyeron 120 pacientes con AR. El 24,4% recibió tratamiento con glucocorticoides, 50,9% drogas biológicas y 13,3% inhibidores de JAK (janus kinases). El 6% había tenido infección por SARS-CoV-2 previamente. La vacuna más utilizada en la primera dosis fue Sputnik V (52,9%). El 25% recibió esquemas heterólogos. Luego de la primera dosis, el 59% presentó una prueba no reactiva o indeterminada, y un 18% luego de la segunda dosis. La aplicación de esquemas homólogos de vacuna Sinopharm (63,6% vs 13,3%, p<0,0001), y el uso de abatacept (27,3% vs 5,1%, p=0,005) y rituximab (18,2% vs 0%, p=0,001) al momento de la vacunación se asociaron a un resultado no reactivo o indeterminado.
Conclusiones: similar a lo reportado en otras poblaciones internacionales, en esta cohorte, dos de cada 10 pacientes no desarrollaron anticuerpos. Una menor respuesta se asoció con la vacuna Sinopharm y al tratamiento con abatacept y rituximab.
Palabras clave: artritis reumatoidea; COVID-19; vacunas COVID-19.
Abstract
Introduction: rheumatoid arthritis (RA) and its treatments can affect the response to the SARS-CoV-2 vaccine. However, we still do not have local data.
Objectives: to evaluate the humoral response of the SARS-CoV-2 vaccine and its safety in this population.
Materials and methods: observational study. Patients ≥18 years of age, with RA ACR/EULAR 2010 who had received vaccination for SARS-CoV-2 were included. Detection of anti-protein S IgG (COVIDAR Kit).
Results: a total of 120 patients with RA were included. A quarter was receiving glucocorticoids, 50.9% biological drugs and 13.3% JAK inhibitors (janus kinases). Only 6% had a history SARS-CoV-2 infection. The most used vaccine was Sputnik V (52.9%) and 25% received mixed regimenes. After the first dose, 59% had a non-reactive or indeterminate test, and after the second, 18% were still having this result. The application of homologous Sinopharm vaccine regimen (63.6% vs 13.3%, p<0.0001) and the use of abatacept (27.3% vs 5.1%, p=0.005) and rituximab (18.2% vs 0%, p=0.001) at vaccination was associated with a non-reactive or indeterminate result.
Conclusions: similar to other international populations, in this cohort, two out of 10 patients did not develop antibodies. A lower response was associated with the Sinopharm vaccine and treatment with abatacept and rituximab.
Key words: rheumatoid arthritis; COVID-19; COVID-19 vaccines.
Introducción
La vacunación para SARS-CoV-2 se ha convertido en una herramienta fundamental para combatir la pandemia por la COVID-19. En Argentina, la vacunación comenzó el 29 de diciembre de 2020 y el 4 de junio de 2021 se amplió la recomendación para pacientes con enfermedades inmunomediadas1. Sin embargo, no contamos con datos acerca de su eficacia y seguridad provenientes de ensayos clínicos randomizados y controlados en esta población.
Estudios realizados en pacientes de la vida real demostraron que aquellos con enfermedades inmunomediadas presentan menor seroconversión y menores títulos de anticuerpos en comparación con la población general, así como también una cinética de desarrollo de anticuerpos más lenta. Además, se ha descrito afectación de la respuesta celular. Algunas patologías, como la vasculitis o la miositis, se han asociado a menor seroconversión, al igual que ciertos fármacos como glucocorticoides, rituximab, abatacept y mofetil micofenolato2-4. Con respecto a la artritis reumatoidea (AR), se ha notificado que dos de cada 10 pacientes no logran la seropositividad2, aunque estos datos provienen de países con pacientes con características sociodemográficas e incluso clínicas distintas a los argentinos, y en la mayoría de los casos utilizan únicamente vacunas con plataforma ARNm.
En nuestro país, seis vacunas están disponibles para su aplicación: Sputnik V, Covishield/AstraZeneca, Sinopharm, Moderna/Spikevax, Convidecia/CanSino y Cominarty/Pfizer-BioNTech. Las tres primeras fueron las más frecuentemente utilizadas. Otro punto interesante, y que distingue a nuestra población, es el empleo de esquemas heterólogos que combinan vacunas, incluso de distintas plataformas5,6.
Por esta razón, la Sociedad Argentina de Reumatología (SAR) se propuso desarrollar un registro nacional de pacientes con enfermedades reumáticas que hayan recibido la vacuna para SARS-CoV-2 (SAR-CoVAC) con el fin de conocer su eficacia y seguridad en esta población.
Objetivos
El objetivo fue estudiar la respuesta inmune humoral a la vacuna para SARS-CoV-2 en pacientes con AR y su seguridad en Argentina.
Materiales y Métodos
Diseño del estudio
Estudio longitudinal, observacional, multicéntrico, en el cual se incluyeron pacientes con AR de dos centros reumatológicos, uno privado y otro público, del Área Metropolitana de Buenos Aires, que recibieron la vacunación para SARS-CoV-2. El período de reclutamiento se desarrolló entre el 28 de abril y el 2 de julio de 2021. Se tomaron muestras de sangre entre 21 y 45 días luego de la aplicación de la primera y segunda dosis. Se consignaron datos sociodemográficos (sexo, fecha de nacimiento, lugar de residencia, etnia, cobertura médica, educación, nivel sociodemográfico según escala de Grafar7, grupo y factor sanguíneo, ocupación), presencia de comorbilidades, fecha de diagnóstico de la AR y actividad de la misma, tratamiento recibido previo a la vacunación y cambios realizados al momento de su aplicación. Se identificaron: fecha, lugar y tipo de vacuna aplicada. Se registraron el desarrollo de eventos adversos, brotes de la enfermedad y nuevas manifestaciones inmunomediadas. En todos los casos se estableció la relación con la vacunación utilizando el algoritmo de Naranjo8. Por último, se monitorizó el desarrollo de infección por SARS-CoV-2 luego de la vacunación, y en caso de existir, se recabaron fecha, método diagnóstico y severidad de la misma.
Luego de cada dosis de la vacuna, se extrajeron 20 ml de sangre venosa periférica que se almacenaron en tubos con ácido etilenodiaminatetraacético(EDTA). Posteriormente, se efectuó el estudio serológico en muestras de suero, el cual consistió en la detección de IgG específicas contra SARS-CoV-2 por técnica de ELISA (kit comercial COVIDAR). Los resultados se expresaron de manera semicuantitativa según la absorbancia con las siguientes categorías: reactivo (>0,35+1DE), indeterminado (0,35±1DE) y no reactivo (<0,35-1DE). Además, se estableció la unidad de densidad óptica normalizada (normalized optical density, NOD) evaluada a 450 nm y normalizada al punto de corte, y el control positivo del ensayo.
Población de estudio
Se incluyeron pacientes de manera consecutiva con diagnóstico de AR según criterios ACR/EULAR 2010 (American College of Rheumatology/ European League Against Rheumatism)9, ≥18 años de edad, que se atendieron en los consultorios del Instituto de Rehabilitación Psicofísica y del Hospital Universitario Austral, y que se aplicaron la vacuna para COVID-19 en el territorio argentino o en cualquier otro país. Se excluyeron aquellos que expresaron su deseo de no participar en el estudio o que no fueron capaces de dar su consentimiento informado.
Consideraciones éticas
Este estudio se realizó acorde a las guías de buenas prácticas clínicas (Good Clinical Practice, GCP), definidas en la Conferencia Internacional de Armonización (International Conference on Harmonisation, ICH), y de acuerdo con los principios éticos establecidos en la Declaración de Helsinki, la Ley 3301/09 y los lineamientos del Comité de Ética. Los datos identificatorios personales se mantuvieron anónimos y protegidos según las normas internacionales y nacionales vigentes para garantizar la confidencialidad, acorde a la Ley de Protección de los Datos Personales N° 25.326/2000.
El protocolo y el consentimiento informado de los pacientes fueron aprobados por un Comité de Ética independiente, previo a la iniciación del estudio. Para los fines de este proyecto, solo los médicos investigadores accedieron a las historias clínicas de los pacientes a fin de obtener los datos requeridos para la investigación, asegurando así la confidencialidad de los mismos.
Análisis estadístico
Se realizó un análisis descriptivo de los datos sociodemográficos y clínicos. Las variables continuas se expresaron como media y desviación estándar (DE) cuando la distribución se consideró normal, o como mediana (m) y rango intercuartil (RIC) en caso de distribución no normal. Las variables categóricas se presentaron como frecuencias y porcentajes.
Se identificaron las variables asociadas a un resultado no reactivo o indeterminado utilizando las pruebas de Chi2 o Fischer según correspondiera. Las diferencias del valor de la NOD entre grupos se establecieron mediante pruebas T de Student o U de Mann-Whitney, según correspondiera.
Una p<0,05 se consideró significativa. El análisis estadístico se realizó mediante el programa R, versión 3.6.2.
Resultados
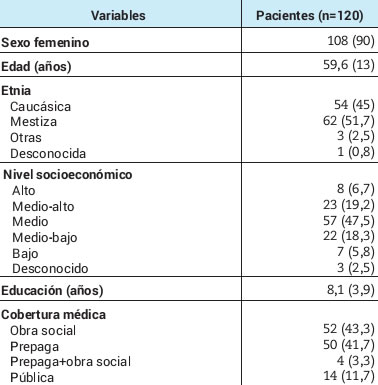
Se incluyó un total de 120 pacientes con AR. Se obtuvieron muestras de 100 personas luego de la primera dosis y de 120 luego de la segunda. La mayoría (90%) fue de sexo femenino, con una edad media de 59,6±13 años, y de etnia mestiza o caucásica, de nivel socioeconómico medio y con cobertura de salud, ya sea obra social o prepaga. El 65% reportó al menos una comorbilidad, y siete (5,8%) de ellos habían tenido infección por SARS-CoV-2 previamente entre 1 y 6,5 meses antes de la primera dosis. El tiempo promedio de evolución de la AR fue de 13,2±8 años. La mayoría se encontraba en remisión y baja actividad de la enfermedad al momento de la vacunación. Con respecto al tratamiento, 25% usaba glucocorticoides, 50,9% agentes biológicos y 13,3% inhibidores de JAK (janus kinases) (Tabla 1, Pt1-Pt2).
Tabla 1. Características sociodemográficas, clínicas y terapéuticas de la población estudiada.

La mayoría de los pacientes recibió esquemas homólogos: el más frecuente fue Sputnik V (27,5%), seguido por Covishield (25%), Sinopharm (22,5%) y Cominarty (0,8%). El 25% contempló esquemas heterólogos, incluyendo Sputnik V/Moderna (21,7%), Sputnik V/Covishield (2,5%) y un paciente (0,8%) recibió Covishield/Cominarty. El tiempo promedio entre dosis fue de 82±35,5 días.
Inmunogenicidad
En total, solo el 41% de los pacientes tuvo anticuerpos detectables luego de la primera dosis y esto mejoró luego de la aplicación de la segunda, alcanzando el 82%. El 14% presentó un resultado no reactivo y el 4% indeterminado luego de completado el esquema de vacunación.
El uso de la vacuna Sinopharm se asoció a una respuesta no reactiva o indeterminada. De los 27 pacientes que recibieron este esquema, solo el 48,1% alcanzó anticuerpos detectables luego de la segunda dosis, 14,8% tuvo una prueba indeterminada y 37% no reactiva (p=0,005). Además, los valores de NOD fueron estadísticamente más bajos en este grupo (m 0,03, RIC-0,2; 0,9, p<0,0001) (Figura 1A). Si bien los pacientes con esquemas heterólogos tuvieron mayor frecuencia de anticuerpos detectables en comparación con aquellos con homólogos, esta diferencia no alcanzó significancia estadística (93,8% vs 77,8%, p=0,141) (Figura 1B). El 85,7% (6/7) de los pacientes que había tenido infección por SARS-CoV-2 previo a la vacunación, presentó una prueba reactiva luego de la primera dosis, y en el caso del paciente restante la misma fue indeterminada. Pero luego de la segunda, todos tuvieron anticuerpos detectables. (Tabla 2). El valor de NOD también fue mayor en este grupo, aunque la diferencia no alcanzó significancia estadística (m 1,3, RIC 1,1; 1,6 vs m 0,9, RIC 0,2; 1,5, p=0,119). No se encontró asociación entre el resultado y las características sociodemográficas y la presencia de comorbilidades.
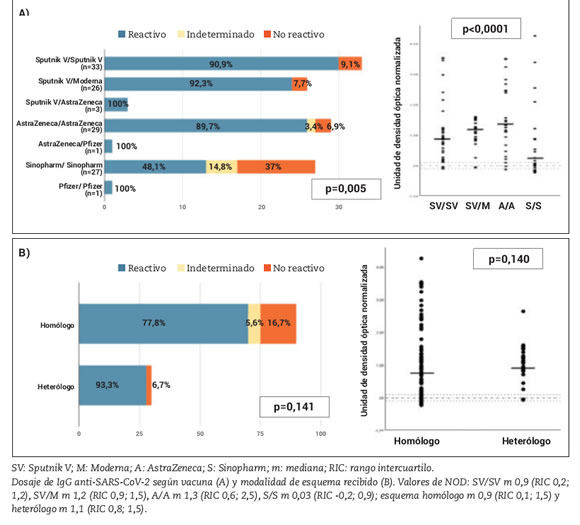
Figura 1. Evaluación de la respuesta humoral de la vacuna para SARS-CoV-2 según vacuna (A) y modalidad de esquema recibido (B).
Tabla 2. Comparación de variables demográficas, clínicas y terapéuticas entre pacientes con reactividad a las vacunas SARS-CoV-2 y pacientes con resultado no reactivo o indeterminado.

Cuando se analizaron estos resultados en función de las características de la AR, no se encontraron diferencias en relación al tiempo de evolución, la actividad de la misma al momento de la vacunación, así como tampoco con el uso de glucocorticoides, drogas convencionales o inhibidores de JAK. Con respecto a los agentes biológicos, el uso de abatacept y de rituximab se asoció a un resultado no reactivo o indeterminado (27,3% vs 5,1, p=0,005 y 18,2% vs 0%, p=0,001, respectivamente) (Tabla 2). En relación al abatacept, solo cuatro de los 11 pacientes no suspendieron el mismo peri-vacunación, y tres de ellos no presentaron anticuerpos detectables. De los seis que no respondieron adecuadamente, tres usaban concomitantemente metotrexato, uno leflunomida, uno azatioprina y en un caso, el abatacept se empleó en monoterapia. Con respecto a las vacunas recibidas por este grupo, en cuatro casos fue Sinopharm y en dos Sputnik V, todos de manera homóloga. Por otro lado, ninguno de los pacientes que recibió rituximab al momento de la vacunación, seroconvirtió. El tiempo entre la última aplicación de rituximab y la vacuna fue entre 5,5 y 6,8 meses; uno de los pacientes utilizaba concomitantemente hidroxicloroquina y otro metotrexato. Todos recibieron esquemas homólogos, dos Covishield, uno Sputnik V y uno Sinopharm.
Infección por SARS-CoV-2 luego de la vacunación
Se reportaron tres casos de infección por SARS-CoV-2 luego de la vacunación, que correspondieron al 2,5% de la población estudiada. Todos se confirmaron por RT-PCR (reverse transcription-polymerase chain reaction) y fueron de manejo ambulatorio: una mujer con esquema incompleto de Covishield con resultado no reactivo luego de la primera dosis, que se encontraba en tratamiento con metotrexato, el cual no había sido suspendido; otra, con esquema completo de Sinopharm, con resultado indeterminado luego de la segunda dosis, que recibió tofacitinib, el cual fue suspendido 7 días posteriores a la aplicación; y, por último, un hombre con esquema completo de Sinopharm, con resultado reactivo luego de la segunda dosis, que recibió metotrexato y etanercept, continuados a igual dosis en el período peri-vacunación.
Seguridad
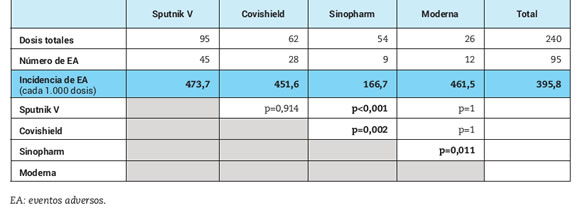
El 43% de los pacientes reportó al menos un evento adverso (EA) luego de la primera dosis y 28% luego de la segunda. Los más frecuentes fueron las reacciones en el sitio de inyección y el síndrome pseudogripal (Figura 2A y Figura 2B). Todos fueron leves/moderados y no requirieron hospitalización. La incidencia total de EA fue de 395,8 eventos cada 1.000 dosis aplicadas. La misma fue significativamente menor con el uso de la vacuna Sinopharm, 166,7 eventos cada 1.000 dosis aplicadas, en comparación con las otras vacunas: Sputnik V 473,7 eventos cada 1.000 dosis, Covishield 451,6 eventos cada 1.000 dosis y Moderna 461,5 eventos cada 1.000 dosis (p<0,002 en todos los casos) (Tabla 3).
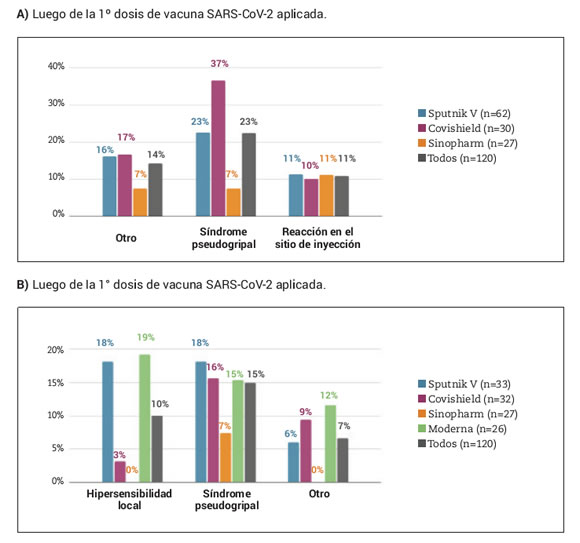
Figura 2. Eventos adversos reportados luego de ambas dosis según tipo de vacuna para SARS-CoV-2 aplicada.
Tabla 3. Incidencia de eventos adversos según vacuna para SARS-CoV-2 aplicada y comparación entre ellas.
Además, cinco (4,1%) pacientes tuvieron un brote de la enfermedad que requirió ajuste del tratamiento. En cuanto a la asociación del evento con la vacunación, cuatro de ellos se clasificaron como probables y uno como posible.
Discusión
Según nuestro conocimiento, este es el primer estudio que evaluó la inmunogenicidad asociada a la vacunación por SARS-COV-2 en pacientes con AR de nuestro país. En esta cohorte, el 80% desarrolló anticuerpos anti SARS-CoV-2 luego de un esquema completo de vacunación de dos dosis. Sin embargo, cabe destacar que en dos de cada 10 pacientes no se detectaron anticuerpos. Además, tres pacientes presentaron infección por SARS-CoV-2 durante el seguimiento, todas de curso leve.
Varios autores reportaron la necesidad de la segunda dosis de vacuna en pacientes con enfermedades inmunomediadas para alcanzar la seroconversión. Un estudio austríaco, por ejemplo, demostró que solo el 52,5% de los pacientes con AR y el 54% de aquellos con espondiloartritis presentaban anticuerpos detectables luego de la primera dosis de vacuna ARNm, significativamente inferior a lo observado en controles sanos (98%)10. Luego de completado el esquema de vacunación con vacunas ARNm, un metaanálisis informó que la frecuencia de detección de anticuerpos en pacientes con AR fue del 79,5%11, similar a lo observado en nuestra cohorte. A la menor respuesta en este grupo de pacientes, se suma además una cinética de producción de anticuerpos neutralizantes más lenta4,12. En este sentido, si bien los datos provienen de pequeños estudios, se destaca la importancia de completar el esquema primario de vacunación y, además, la necesidad de incluir una tercera dosis en esta población.
Asimismo, estos resultados son de gran interés, ya que se han estudiado las vacunas (y esquemas) más frecuentemente aplicadas en nuestro país, incluyendo aquellas con plataforma vector viral, virus inactivado, ARNm y combinaciones de las mismas, según normativa del Ministerio de Salud de la Nación6,13. Similar a lo reportado en la población general14, observamos que el uso de esquemas heterólogos se asoció con mayor frecuencia de detección de anticuerpos. Si bien más del 90% de este grupo de pacientes presentó un resultado reactivo, las diferencias no fueron significativas. Cabe destacar que este estudio no tiene el poder para detectar estas diferencias. Además, menos del 50% de aquellos que recibieron la vacuna Sinopharm, presentó anticuerpos detectables. Resultados similares publicaron Shenoy et al.15, quienes descubrieron una tasa de seroconversión del 40,5% en pacientes con enfermedades inmunomediadas luego de aplicar la vacuna inactivada Covaxin, valores significativamente inferiores a lo detectado con Covishield.
En esta cohorte de pacientes descubrimos que el 54,5% de los tratados con abatacept y ninguno de los que recibieron rituximab, desarrollaron anticuerpos detectables. La asociación entre estas drogas y una pobre respuesta vacunal también fue observada por otros grupos2,11,16. En una cohorte israelí, los pacientes con enfermedades inmunomediadas tratados con rituximab presentaron la tasa de seropositividad más baja, del 39%, en comparación con el 86% reportado en el resto de los pacientes. Un punto interesante es que el intervalo de tiempo entre la vacunación y la última infusión de rituximab tuvo un impacto significativo en la inmunogenicidad de la vacuna. Mientras que los pacientes vacunados dentro de los 6 meses posteriores a la administración del rituximab presentaron una seroconversión menor del 20%, aquellos con un intervalo superior a un año lograron valores cercanos al 50%2. Por otro lado, si bien algunas cohortes informaron un efecto negativo de los glucocorticoides sobre la inmunogenicidad de la vacuna para COVID-192,15, en nuestro caso no encontramos asociación entre el uso de los mismos y la ausencia de detección de anticuerpos. Si bien dentro del grupo tratado con glucocorticoides, los seis pacientes que presentaron una respuesta no reactiva usaban dosis superiores en comparación con aquellos que sí tenían anticuerpos detectables (media 8,3±4,4 mg/día vs 5,9±2,8 mg/día), esta diferencia tampoco alcanzó significancia estadística. Estos resultados podrían deberse a que un grupo reducido (24%) utilizaba esteroides y las dosis eran más bajas (m 5 mg/d), comparadas con otras cohortes en las que se incluyeron enfermedades del tejido conectivo2,11.
Para finalizar, este estudio tiene fortalezas y debilidades. Dentro de estas últimas, debemos destacar que, dado que los pacientes fueron vacunados en el marco del Plan Nacional Estratégico de Vacunación y que recibieron sus turnos en sus distritos con poco margen de tiempo, no pudimos realizar una muestra de sangre antes de la vacunación. Si bien sabíamos que siete pacientes tuvieron infección confirmada por SARS-CoV-2 previo a la vacunación, existe la posibilidad que alguno haya presentado infección asintomática y que la misma no haya sido detectada. Por otro lado, cabe destacar que esta es la primera cohorte de pacientes con AR argentinos que recibió las vacunas disponibles en nuestro país, con una variedad de plataformas y combinaciones representativa de lo aplicado localmente. Asimismo, detectamos una frecuencia de seropositividad comparable a lo reportado por otras cohortes internacionales que recibieron vacunas ARNm. Estos datos nos permiten, como reumatólogos, tomar decisiones en el contexto de la vacunación para SARS-CoV-2 basadas en evidencia propia y, a nivel de políticas sanitarias nacionales, fomentar estrategias que favorezcan un mejor resultado en esta población.
Conclusiones
En esta cohorte de pacientes con AR de Argentina, el 60% presentó niveles de anticuerpos no detectables luego de la primera dosis, resultado que mejoró luego de completado el esquema. Sin embargo, de manera comparable a lo reportado por otras cohortes, dos de cada 10 pacientes no desarrollaron anticuerpos. Una menor respuesta se asoció con la vacuna Sinopharm, y al tratamiento con rituximab y abatacept.
Conflictos de interés
Los autores declaran que no existe conflicto de interés.
1. Ministerio de Salud de la Nación, 2021. Memorándum. Ampliación de la población objetivo a vacunar. Acceso 18/12/2021. Disponible en: https://bancos.salud.gob.ar/recurso/memorandum-ampliacion-de-la-poblacion-objetivo-vacunar. [ Links ]
2. Furer V, Eviatar T, Zisman D, Peleg H, Paran D, Levartovsky D, et al. Immunogenicity and safety of the BNT162b2 mRNA COVID-19 vaccine in adult patients with autoimmune inflammatory rheumatic diseases and in the general population: a multicentre study. Ann Rheum Dis 2021;80(10):1330-1338. [ Links ]
3. Haberman RH, Herati R, Simon D, Samanovic M, Blank RB, Tuen M, et al. Methotrexate hampers immunogenicity to BNT162b2 mRNA COVID-19 vaccine in immune-mediated inflammatory disease. Ann Rheum Dis 2021;80(10):1339-1344. [ Links ]
4. Simon D, Tascilar K, Fagni F, Krönke G, Kleyer A, Meder C, et al. SARS-CoV-2 vaccination responses in untreated, conventionally treated and anticytokine-treated patients with immune-mediated inflammatory diseases. Ann Rheum Dis 2021;80(10):1312-1316. [ Links ]
5. Ministerio de Salud de la Nación, 2021. Características de las vacunas contra la COVID-19 disponibles en Argentina. Acceso 18/12/2021. Disponible en: https://bancos.salud.gob.ar/recurso/caracteristicas-de-las-vacunas-contra-la-covid-19-disponibles-en-argentina. [ Links ]
6. Ministerio de Salud de la Nación, 2021. Memorándum coadministración de vacunas contra COVID-19 con otras vacunas. Acceso 18/12/2021. Disponible en: https://bancos.salud.gob.ar/recurso/memorandum-coadministracion-de-vacunas-contra-covid-19-con-otras-vacunas. [ Links ]
7. Méndez H. Sociedad y estratificación. Método Graffar-Méndez Castellano. Caracas: Fundacredesa; 1994. [ Links ]
8. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30(2):239-245. [ Links ]
9. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO, et al. Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum 2010;62(9):2569-2581. [ Links ]
10. Simader E, Tobudic S, Mandl P, Haslacher H, Perkmann T, Nothnagl T, et al. Importance of the second SARS-CoV-2 vaccination dose for achieving serological response in patients with rheumatoid arthritis and seronegative spondyloarthritis. Ann Rheum Dis 2021. doi: 10.1136/annrheumdis-2021-221347. [ Links ]
11. Jena A, Mishra S, Deepak P, Kumar MP, Sharma A, Patel YI, et al. Response to SARS-CoV-2 vaccination in immune mediated inflammatory diseases: systematic review and meta-analysis. Autoimmun Rev 2021;21(1):102927. doi: 10.1016/j.autrev.2021.102927. [ Links ]
12. Rubbert-Roth A, Vuilleumier N, Ludewig B, Schmiedeberg K, Haller C, von Kempis J. Anti-SARS-CoV-2 mRNA vaccine in patients with rheumatoid arthritis. Lancet Rheumatol 2021;3(7):e470-e472. doi: 10.1016/S2665-9913(21)00186-7. [ Links ]
13. Ministerio de Salud de la Nación, 2021. 14º Informe de vigilancia de seguridad en vacunas. Acceso 18/12/2021. Disponible en: https://bancos.salud.gob.ar/recurso/14o-informe-de-vigilancia-de-seguridad-en-vacunas. [ Links ]
14. Ministerio de Salud de la Nación, 2021. Estudio colaborativo para la evaluación de esquemas heterólogos de vacunación contra COVID-19 en la República Argentina (ECEHeVac). Disponible en: https://www.argentina.gob.ar/sites/default/files/2021/04/2021-08-13-avance-estudio-intercambiabilidad-vacunas-covid19-ecehevac.pdf. [ Links ]
15. Shenoy P, Ahmed S, Paul A, Cherian S, Vijayan A, Babu SA, et al. Inactivated vaccines may not provide adequate protection in immunosuppressed patients with rheumatic diseases. Ann Rheum Dis 2021. doi: 10.1136/annrheumdis-2021-221496. [ Links ]
16. Deepak P, Kim W, Paley MA, Yang M, Carvidi AB, El-Qunni AA, et al. Glucocorticoids and B cell depleting agents substantially impair immunogenicity of mRNA vaccines to SARS-CoV-2. medRxiv 2021. doi: 10.1101/2021.04.05.21254656. [ Links ]














