Introducción
El lupus eritematoso sistémico (LES) es una enfermedad compleja y multiorgánica. Uno de los principales mecanismos fisiopatológicos es la activación de células B autorreactivas que dan como resultado niveles elevados de autoanticuerpos o formación de inmunocomplejos que causan inflamación y daño tisular1.
El manejo de estos pacientes está anclado en el treat to target (T2T) o tratamiento según objetivos, para controlar la actividad de la enfermedad, minimizar comorbilidades y prevenir el daño a fin de garantizar la sobrevida a largo plazo y optimizar la calidad de vida de los pacientes2-5.
La incorporación de los conceptos remisión de la enfermedad, con o sin tratamiento inmunosupresor y baja actividad de la enfermedad, permitieron ajustar el tratamiento y ser los pilares fundamentales de la estrategia del T2T6-10. Estos conceptos han variado con el tiempo y en la actualidad incluyen dosis menores de corticoides y la evaluación global del médico4.
El belimumab (también conocido como LymphoStat-B™, BENLYSTA®) es un inhibidor específico del estimulador de linfocitos B (BLyS) que bloquea la unión de BLyS soluble, un factor de supervivencia de las células B, a sus receptores en las células B. De esta manera, inhibe la supervivencia de las células B, incluidas las células B autorreactivas, y reduce la diferenciación de las células B en células plasmáticas productoras de inmunoglobulinas11,12. BENLYSTA® está aprobado en Argentina desde 2012 para el tratamiento de pacientes con autoanticuerpos positivos en la enfermedad activa a pesar del tratamiento estándar13,14.
Experiencias previas en nuestro país con belimumab en la vida real demostraron una disminución de la actividad de la enfermedad, menor utilización de corticoides, con un perfil de seguridad adecuado15.
El Registro de Lupus Eritematoso Sistémico de la Sociedad Argentina de Reumatología (RELESSAR) es un registro de corte transversal, multicéntrico de pacientes adultos con LES que cumplían criterios de clasificación del American College of Rheumatology (ACR 1997)16. Ha sido el primer registro nacional con más de 1.500 pacientes incluidos durante 4 años (2014-2018).
Objetivos
El objetivo principal de este estudio fue describir las características generales de los pacientes ingresados en el registro y el uso del belimumab según el estado de la enfermedad, además del perfil de pacientes que potencialmente podrían haberse beneficiado con el tratamiento con belimumab.
Como objetivos secundarios se planteó: a) describir la proporción de pacientes potencialmente elegible para el tratamiento con belimumab, (SLEDAI ≥6 y anticuerpos antinucleares -anti-DNA- positivo y/o hipocomplementemia, independientemente de la manifestación clínica) a pesar del tratamiento estándar17,18; b) describir las hospitalizaciones relacionadas con brotes de LES o infecciones, estratificadas por estado de la enfermedad; c) describir la prevalencia de infecciones graves según el estado de la enfermedad; d) describir la proporción de pacientes con lupus refractario potencialmente elegible para el tratamiento con belimumab.
Materiales y Métodos
Estudio de corte transversal, que incluyó pacientes pertenecientes al registro RELESSAR que contaron con los datos necesarios para la estratificación según las siguientes categorías (independientemente del uso de drogas inmunosupresoras): remisión: Systemic Lupus Erythematosus Disease Activity Index (SLEDAI)=0 y sin tratamiento con corticoides en la actualidad; baja actividad de la enfermedad o low disease activity status (LDAS): SLEDAI >0 y ≤4 y sin tratamiento con corticoides en la actualidad; control no óptimo: SLEDAI >4 y cualquier dosis de corticoides.
El empleo de estas categorías de análisis estuvo acorde a las variables predeterminadas del registro. La dosis mínima de corticoides registrada fue igual o menor a 10 mg/día de prednisona, sin especificar dosis.
Otras definiciones en este estudio fueron: a) LES refractario: definido por cualquiera de las siguientes: uso de rituximab o ineficacia de ciclofosfamida (CFC) o ineficacia de dos o más inmunosupresores convencionales o esplenectomía; b) hospitalizaciones: se diferenciaron aquellas relacionadas con el LES o por infecciones graves; c) infección grave: aquella que requirió de hospitalización y la necesidad de tratamientos antimicrobianos intravenosos. Las variables hospitalizaciones e infecciones graves se categorizaron como variables dicotómicas, independientemente del tiempo de su presentación (pasado o presente).
Otras variables consignadas fueron: sociodemográficas, clínicas, de tratamiento, score SLEDAI19, Systemic Lupus International Collaborating Clinics/American College of Rheumatology (SLICC-ACR), score de daño (SLICC)20, índice de Charlson de comorbilidades21, entre otras.
Análisis estadístico
Se realizó un análisis descriptivo para las variables según el estado del LES. Las variables categóricas se compararon con el test chi-cuadrado o test de Fisher, y las continuas con el test t-Student, si se cumplía el supuesto de normalidad, o el test de Kruskall Wallis en caso que no se verificara dicho supuesto. Para analizar el supuesto de normalidad de las variables continuas, se aplicó el test de Shapiro-Wilk. Para determinar qué variables se asociaron a la hospitalización e infección grave, se ajustaron dos modelos de regresión logística. Para las variables significativas se estimaron las razones de odds (RO) con sus intervalos del 95% de confianza. En todos los test el nivel de significación empleado fue de 0,05. Se utilizó el software R para el análisis de los datos.
Aspectos éticos
Este estudio se realizó acorde a las guías de buenas prácticas clínicas (Good Clinical Practice, GCP), definidas en la Conferencia Internacional de Armonización (International Conference on Harmonisation, ICH), y de acuerdo con los principios éticos establecidos en la Declaración de Helsinki, la Ley 3301/09 y los lineamientos del Comité de Ética. Los datos personales se mantuvieron anónimos y protegidos según las normas internacionales y nacionales vigentes para garantizar la confidencialidad, acorde a la Ley de Protección de los Datos Personales N° 25.326/2000. El protocolo y el consentimiento informado fueron aprobados por un Comité de Ética independiente.
Resultados
En este análisis se incluyó un total de 1.277 pacientes, 299 (23,4%) cumplieron con la definición de remisión, 162 (12,6%) con LDAS y 816 (63,8%) con control no óptimo de la enfermedad. En la Tabla 1 se observa que los pacientes que no estaban controlados eran más jóvenes y con menor duración de la enfermedad, presentaban mayores índices de actividad y cronicidad, así como mayor utilización de inmunosupresores convencionales y biológicos. Además, eran pacientes con menor nivel de educación y pertenecían a un menor estrato social, con mayor prevalencia de mestizos.
Tabla 1: Características de los pacientes según el estado del lupus eritematoso sistémico.
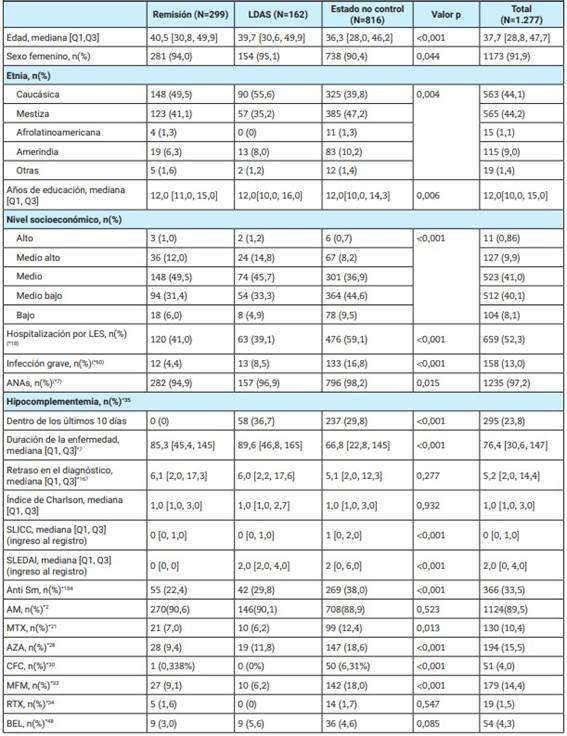
Q1, Q3: quartil 1, quartil 3; AM: antimaláricos; MTX: metotrexato; MFM: mofetil micofenolato; AZA: azatioprina; RTX: rituximab: CFC: ciclofosfamida; BEL: belimumab; LDAS: low disease activity status; ANA: anticuerpos antinucleares; LES: lupus eritematoso sistémico; SLICC: Systemic Lupus International Collaborating Clinics/American College of Rheumatology; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index; anti Sm: anti Smith. * datos faltantes.
Un total de 201 pacientes cumplía criterios para el potencial uso de belimumab y solo 45/201 (22,3%) lo recibían en esos momentos, representando el 4,3% de la población total. En la Tabla 2 se detalla que la única variable clínica según criterios de SLEDAI que tuvo significancia estadística fue el eritema malar en concordancia con la indicación del belimumab.
Tabla 2: Comparación entre aquellos que cumplían criterios de tratamiento con belimumab** y lo recibían en esos momentos vs los que cumplían criterios y no lo recibían.

Q1, Q3: quartil 1, quartil 3; SLICC: Systemic Lupus International Collaborating Clinics/American College of Rheumatology; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index. * datos faltantes ** (SLEDAI ≥6 y/o anti ADN positivo y/o hipocomplementemia) a pesar del tratamiento estándar.
En relación al belimumab en el LES refractario, 13 (17,6%) pacientes lo recibieron durante ese período. En la Tabla 3 se muestra que las variables que tuvieron diferencia significativa fueron la historia de hospitalización y la menor utilización de corticoides al momento del ingreso al registro para los pacientes con belimumab.
Tabla 3: Comparación entre aquellos pacientes con lupus eritematoso sistémico refractario en tratamiento con belimumab vs quienes no lo recibían.

Q1, Q3: quartil 1, quartil 3; SLICC: Systemic Lupus International Collaborating Clinics/American College of Rheumatology; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index; LES: lupus eritematoso sistémico. * datos faltantes.
En la Tabla 4 se describen los pacientes hospitalizados y se observa que pertenecían a un menor estrato social, con menor grado de educación, mayores comorbilidades, mayor duración de la enfermedad y mayor presencia de síndrome antifosfolípido (SAF); asimismo tenían más actividad serológica, pero no clínica, según SLEDAI. Presentaban mayores índices de cronicidad, mayor utilización de corticoides a dosis altas dentro de sus antecedentes como mayor uso de inmunosupresores. No hubo diferencia en relación al empleo de belimumab entre ambos grupos. Las manifestaciones clínicas severas como neurológica, hematológica y renal fueron más comunes en los pacientes hospitalizados.
Tabla 4: Características de los pacientes hospitalizados por lupus eritematoso sistémico.


Q1-Q3: quartil 1, quartil 3; AM: antimaláricos; MTX: metotrexato; MFM: mofetil micofenolato; AZA: azatioprina; RTX: rituximab; BEL: belimumab; AAS: aspirina; ACO: anticoagulantes orales; Igiv: gammaglobulinas; CFC: ciclofosfamida; LDAS: low disease activity status; SAF: síndrome antifosfolípido; HTA: hipertensión arterial; ACVI: accidente cerebrovascular isquémico; aCL: anticuerpos anticardiolipinas; AL: anticoagulante lúpico; SLICC: Systemic Lupus International Collaborating Clinics/American College of Rheumatology; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index; LDAS: low disease activity status; anti Sm: anti Smith. * datos faltantes. ** la n se modificó por los datos faltantes.
En relación a los pacientes con infecciones graves, se describe que pertenecían a un menor estrato social, con menor grado de educación y mayores comorbilidades. Al momento de ingresar al registro, presentaban mayores índices de cronicidad, mayor hipocomplementemia, mayor utilización de corticoides a dosis altas y mayor uso de inmunosupresores. No hubo diferencia entre los grupos en relación al empleo del belimumab (Tabla 5).
Tabla 5: Características de los pacientes con infección grave.


Q1-Q3: quartil 1, quartil 3; AM: antimaláricos; MTX: metotrexato; MFM: mofetil micofenolato; AZA: azatioprina; RTX: rituximab; Igiv: gammaglobulinas; CFC: ciclofosfamida; BEL: belimumab; LDAS: low disease activity status; HTA: hipertensión arterial; ICC: insuficiencia cardíaca; ACVI: accidente cerebrovascular isquémico; anti Sm; anti Sm: anti Smith; SLICC: Systemic Lupus International Collaborating Clinics/American College of Rheumatology; SLEDAI: Systemic Lupus Erythematosus Disease Activity Index. * datos faltantes. ** la n se modificó por los datos faltantes.
Las variables asociadas a hospitalizaciones en el análisis multivariado fueron: tratamiento crónico de corticoides (OR 4,6; IC 95% 2,5- 8,2), uso de CFC (OR 7,4; IC 95% 2,0-26,9), SAF (OR 2,2; IC 95% 1,3-3,7) y mayor score de daño medido por SLICC (OR 1,1; IC 95% 1,0-1,3). Las variables asociadas a infecciones graves fueron: uso de mofetil micofenolato (OR 2,1; IC 95% 1,3- 3,5), azatioprina (OR 2,0; IC 95% 1,2-3,3), tratamiento crónico de corticoides (OR 2,5; IC 95% 1,1-5,6) y mayor SLICC (OR 1,5; IC 95% 1,3-1,7).
Discusión
Este trabajo describe la distribución de los pacientes lúpicos en Argentina según el estado de la enfermedad, siendo similar a otras cohortes, por ejemplo, la del Grupo Latinoamericano de Estudio del Lupus (GLADEL), a pesar de las diferencias en las categorías utilizadas4,22-25. La definición presentada se centró en el valor del SLEDAI y en el empleo de los corticoides, independientemente del uso de los inmunosupresores. Esta decisión arbitraria de los autores se fundó en el diseño de la cohorte y las variables para categorizar el uso diario de corticoides. Al intentar comparar nuestros resultados con otras cohortes con diferentes definiciones, la remisión sin tratamiento fue similar a la observada en este trabajo, alrededor del 15-20%4,22-24.
En relación a la LDAS, también fue similar a la cohorte de GLADEL y la del Lupus Clinical Trials Consortium (LCTC)21,23. En concordancia con otros estudios, los pacientes que estaban en remisión y LDAS presentaron menores índices de actividad de cronicidad y menor necesidad de tratamientos inmunosupresores. Estos datos son comparables a las cohortes Italiana, Holandesa y Canadiense23,24,26,27. De manera opuesta, los pacientes categorizados como no controlados eran más jóvenes, con diagnóstico más reciente, más índice de hospitalizaciones e infecciones graves. Además, pertenecían a un menor estrato social, con menor grado de educación y mayor prevalencia de mestizos. Estos hallazgos exponen otros factores asociados a la falta de control del LES, como sociales, económicos y educativos, lo cual revela problemas más profundos, como la desigualdad e inequidad en salud27-29.
En relación al belimumab, solo un tercio de la población con potencial criterio de uso estaba en tratamiento en ese período. A pesar de la definición utilizada en este trabajo, la cual no tuvo en cuenta la manifestación clínica de los pacientes durante el tiempo del empleo del belimumab, los principales motivos pueden deberse a la falta de acceso a tratamientos de alto costo por una gran parte de la población que se atiende en centros de atención pública y al momento de la recolección de los datos, muy cercano al inicio de la comercialización del medicamento en Argentina. No hubo diferencias entre los grupos analizados en relación al uso de belimumab. En contrapartida a lo descrito en estudios de la vida real, incluso realizados en Argentina, se observó que los pacientes en tratamiento con belimumab presentaron menores índices de actividad, menos brotes de la enfermedad, menor utilización de recursos de salud y menor necesidad de corticoides14,30-33. Las diferencias detectadas con estos estudios pueden deberse al bajo número de pacientes incluidos en el presente estudio. El uso del belimumab en el LES refractario se asoció a menos hospitalizaciones y menor empleo de corticoides.
Los pacientes hospitalizados por su enfermedad representaron más del 50%, dato similar a otros trabajos34-38. Pertenecían a un menor estrato social, con menor nivel de educación, mayores comorbilidades y mayor duración de la enfermedad. Presentaban mayor actividad según SLEDAI y estaban categorizados dentro del grupo de no control. Tenían mayores índices de cronicidad y mayor utilización de corticoides a dosis altas e inmunosupresores. En concordancia con otros estudios, las variables asociadas en el análisis multivariado fueron: tratamiento crónico de corticoides, uso de ciclofosfamida y mayor SLICC33,35,38,39.
Las infecciones graves se reflejaron en el 13,9% del total de la población, valores similares a los publicados por otros autores34,40,41. De manera similar a lo observado en pacientes hospitalizados, estos pertenecían a un menor estrato social, con menor grado de educación y mayores comorbilidades. Presentaban mayores índices de cronicidad, mayor hipocomplementemia, mayor utilización de corticoides a dosis altas y mayor uso de inmunosupresores, sin diferencias en relación de belimumab. Varios trabajos de la vida real informaron menor empleo de los recursos de salud, menos hospitalizaciones debidas al lupus y visitas al departamento de urgencia asociadas al uso de belimumab15,32,42,43. Estos hallazgos no pudieron demostrarse en el presente estudio debido probablemente al bajo número de pacientes en tratamiento con belimumab. Las variables que se mantuvieron en el análisis multivariado fueron el uso de mofetil micofenolato, azatioprina, tratamiento crónico de corticoides y mayor SLICC, similar a lo publicado en otros estudios40,41,44-46.
En contrapartida a otros autores22,41,47-49, en el presente trabajo no se encontró diferencia con el uso de antimaláricos, ni pudo demostrarse su efecto beneficioso porque su empleo en este grupo de pacientes representó más del 90%.
Dentro de las principales limitaciones de este trabajo se mencionan: el bajo número de pacientes en tratamiento con belimumab, la recolección de datos de manera retrospectiva y la ausencia de registro de dosis menores a 10 mg/día de corticoides, lo que condicionó las definiciones utilizadas en la construcción de los grupos, los datos faltantes y la falta de seguimiento de los pacientes para estimar otros datos de la seguridad del belimumab.
Dentro de las fortalezas, es importante remarcar que es el primer estudio de estas características que incluyó una gran cantidad de pacientes argentinos con LES, con buena representatividad geográfica.
Conclusiones
Este trabajo refleja la complejidad del manejo de los pacientes lúpicos y permite visualizar aspectos estructurales, como la desigualdad o inequidad en salud. La opción de nuevos tratamientos aprobados para el LES, como el caso del belimumab, podría resultar beneficiosa en pacientes seleccionados.














