Introducción
La artritis reumatoidea (AR) tiene una prevalencia de aproximadamente del 0,4-1,3%1. Esta enfermedad puede afectar el pulmón de diversas formas, incluyendo el compromiso de la vía aérea, hipertensión pulmonar, derrame pleural y enfermedad pulmonar intersticial (EPI)2. La EPI es la más severa de estas y afecta al 12-40% de los pacientes con AR, según el método utilizado para su detección, con gran impacto en el pronóstico y en la calidad de vida3,4. Los pacientes con AR y EPI presentan una mortalidad tres veces mayor que aquellos sin EPI, siendo esta la complicación responsable del 7% de las muertes en personas con AR5,6. La mediana de sobrevida varía entre 3,2 y 6,6 años según el patrón tomográfico y/o histológico hallado7. Los biomarcadores son moléculas medibles en diferentes fluidos corporales, capaces de brindar información clínicamente relevante como, por ejemplo, pronóstica o de otro tipo. Se han estudiado diferentes en EPI asociada a AR, aunque su aplicabilidad clínica aún no se ha establecido8,9.
La IL13 es una citoquina producida principalmente por linfocitos del perfil Th2, que juega un rol relevante en la reparación y la fibrosis de tejidos luego de un fenómeno inflamatorio10. Esta función se debe a su capacidad para activar al fibroblasto a través de receptores específicos11. De esta forma, el fibroblasto se diferencia a miofibroblasto, incorporando la capacidad de producir mayores cantidades de matriz extracelular, con la consecuente fibrosis y pérdida de la función del órgano12. El balance entre inflamación y reparación depende de la relación entre los perfiles Th1 (que favorecen la inflamación) y el perfil Th213. En este contexto, la IL13 podría representar un puente entre el daño inmunomediado y la fibrosis de los tejidos. En consecuencia, esta citoquina tendría un rol en el desarrollo de la EPI, especialmente en presencia de enfermedades autoinmunes, lo cual la convierte en un potencial biomarcador para este contexto clínico específico14.
El perfil linfocitario Th2 no está involucrado directamente en la patogenia del daño articular en la AR. Por el contrario, el perfil Th1 y sus citoquinas (TNF alfa, IL 6, etc.) parecieran mediar el daño sinovial15. Sin embargo, dado el diferente comportamiento que presenta la AR en ambos sitios, con predominio del fenómeno fibrótico en el pulmón, es posible sostener la hipótesis según la cual la IL13 jugaría un rol relevante en su génesis.
Sobre la base de estas especulaciones fisiopatológicas, y dado que hasta la fecha no se publicaron estudios que evalúen el desempeño de la IL13 como biomarcador pronóstico en la EPI-AR, diseñamos un estudio para conocer la relación entre las concentraciones de IL13 en suero, y la severidad y pronóstico de la EPI en pacientes con AR.
Materiales y métodos
Se desarrolló un estudio de cohorte prospectiva. Se incluyeron, de forma consecutiva, pacientes con diagnóstico de EPI asociada a AR evaluados en un consultorio especializado en EPI, entre enero de 2017 y diciembre de 2018. El diagnóstico de AR se estableció según los criterios del American College of Rheumatology/European League Against Rheumatism (ACR/EULAR 2010), mientras que el de EPI se realizó mediante la valoración por tomografía computada de alta resolución (TACAR) de un especialista en imágenes con experiencia en EPI16. Se realizaron pruebas de función pulmonar, evaluación de la enfermedad articular y extracción de sangre para la medición de factor reumatoideo (FR), anti-CCP e IL13.
La TACAR se analizó por un único lector que la clasificó como neumonía intersticial usual (NIU), NIU posible o inconsistente con NIU de acuerdo con el consenso intersocietario de 201117. Asimismo, se calculó el score propuesto por Goh et al. para estimar la extensión de la EPI (extensión total, inflamación y fibrosis)18. Se estudiaron la capacidad vital forzada (CVF) y la difusión de monóxido de carbono (DLCO) utilizando las recomendaciones de las sociedades de referencia19,20. La actividad de la enfermedad articular se midió con el Disease Activity Score 28 (DAS28)21. Los valores séricos de IL13 se midieron con el Enzyme Linked Immunosorbent Assay (ELISA) de acuerdo con las instrucciones de los fabricantes (Legend Max Human ELISA kit, Bio Legend). El FR se midió con nefelometría y el anti-CCP con ELISA CCP2. Se registraron los tratamientos recibidos durante un período de al menos un mes.
Los resultados se expresaron mediante media y desvío estándar (DE) o mediana y rango intercuartílico (RIC) según su distribución en el caso de las variables continuas. Las variables categóricas se resumieron mediante frecuencia absoluta y porcentaje. Para las comparaciones se utilizaron T-test, test de Mann Whitney, test exacto de Fisher y chi2.
La cohorte se dividió en dos grupos utilizando la mediana de los valores de IL13 como punto de corte, y se compararon variables clínicas, demográficas, funcionales y tomográficas entre los pacientes cuyos valores de IL13 se encontraban por encima de la mediana, y aquellos con valores más bajos.
Se analizó la evolución funcional de los pacientes con el método de Kaplan Meier (KM) para estimar el tiempo en meses hasta una caída de la CVF mayor o igual al 5%. De este análisis se excluyeron a aquellos con un tiempo de seguimiento menor de los 3 meses por ser este el período mínimo de seguimiento que permite estimar la evolución funcional de la enfermedad. Se estudió la tasa de eventos a 15 meses en ambos grupos con el estimador de KM y su intervalo de confianza del 95% (IC 95%). Se compararon ambos grupos con log rank test. Se aplicó un modelo de Cox para el análisis de regresión univariado y multivariado con los valores de IL13 como primera variable independiente. En el análisis multivariado se incluyeron la CVF%, el score de Goh total, el patrón de NIU en TACAR, el tabaquismo y el DAS28 por considerarse variables que podrían confundir la relación entre el evento de interés y la principal variable de predictora (IL13). Se reportaron los HR crudos y ajustados con sus IC 95%. Se consideró significativo un valor de p menor o igual a 0,05.
Se estimó el tamaño muestral para el objetivo principal. Para aplicar un modelo de riesgos proporcionales de Cox, con un error alfa de 0,05, un poder del 80%, un HR considerado clínicamente significativo de 0,5, se obtuvo un tamaño muestral de 23 pacientes por grupo (46 en total).
El estudio lo aprobó el Comité de Ética de nuestra institución. Los pacientes dieron su consentimiento por escrito para participar. El manuscrito se redactó según las recomendaciones de la iniciativa STROBE para el reporte de estudios observacionales22.
Resultados
Se incluyeron 47 pacientes, de los cuales 28 (59,5%) eran mujeres. Sus características generales se muestran en la Tabla 1. La media (DE) de edad fue de 63,03 (10) años. Treinta y un pacientes eran tabaquistas activos o extabaquistas (65,9%). La mediana (RIC) de tiempo desde el comienzo de la disnea fue de 6 (3-12) meses. Los pacientes tuvieron una media (DE) de tiempo de seguimiento de 12,7 (12,5) meses. La mediana (RIC) de niveles plasmáticos de IL13 fue de 141,58 pg/ml (105,4-217). Un solo paciente falleció (2,13%).
Tabla 1: Características generales de la cohorte de pacientes con artritis reumatoidea y enfermedad pulmonar intersticial. Comparación entre pacientes con niveles mayores y menores de IL13.
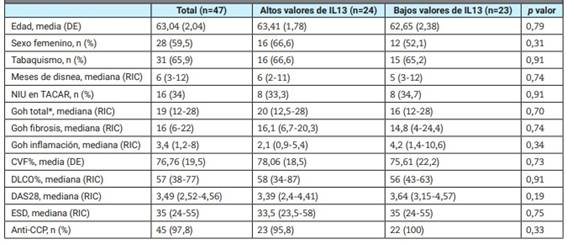
*Se refiere a la extensión porcentual del compromiso TACAR mediante el score propuesto por Goh. DE: desvío estándar; RIC: rango intercuartílico; NIU: neumonía intersticial usual; TACAR: tomografía computada de alta resolución; CVF: capacidad vital forzada; DLCO: difusión de monóxido de carbono; DAS28: Disease Activity Score 28; ESD: velocidad de eritrosedimentación.
Con respecto a la enfermedad articular, la mediana (RIC) de DAS28 fue de 3,49 (2,5-4,5). En relación al laboratorio inmunológico, 41/43 pacientes (95,3%) presentaron FR positivo y 45/46 (97,8%) anti-CCP positivo. En relación al tratamiento, 12 pacientes habían recibido metotrexato (26%), 13 (28%) leflunomida, seis (13%) sulfasalazina, siete azatioprina (14,8%), cinco micofenolato mofetil (10,8%), uno ciclofosfamida (2,1%), cinco abatacept (10,8%), cuatro rituximab (8,5%) y dos (4,3%) agentes anti-TNF (uno certolizumab y otro adalimumab).
La media (DE) de CVF% fue de 76,76 (19,51) y la mediana (RIC) de DLCO% de 57 (38-77). Presentaron un patrón típico de NIU en la TACAR 16 pacientes (34%), 11 (23%) un patrón de NIU posible y 20 (42.5%) un patrón inconsistente con NIU. La mediana (RIC) de extensión en TACAR medida con el score de Goh total fue de 19% (12-28).
Se compararon las características clínicas, tomográficas, funcionales y serológicas entre los pacientes con valores de IL13 por encima y por debajo de la mediana y no se encontraron diferencias estadísticamente significativas (Tabla 1).
Se estudió el valor pronóstico de los niveles plasmáticos de IL13 analizando el tiempo en meses hasta una caída de la CVF igual o mayor al 5%. Este análisis no pudo realizarse en 13 pacientes (27%) por pérdida en el seguimiento. Se compararon las características basales de este grupo de pacientes con las de aquellos que sí pudieron completar el seguimiento para estimar si la pérdida de seguimiento podría estar asociada a una enfermedad más severa. Se encontró que los pacientes con pérdida en el seguimiento tuvieron similares valores basales de IL13 (mediana (RIC) 152,4 (108,7-217) vs. 138,7 (105,4-216,9); p=0,83), CVF% (mediana (RIC) 58 (41-107) vs. 76 (63-93), p=0,41), y DAS28 (mediana (RIC) 3,35 (2,45-4,08) vs. 3,65 (2,79-4,61; (p=0.31)) que aquellos que completaron el seguimiento.
Finalmente, se incluyeron 34 pacientes en el análisis del tiempo a una caída de la CVF mayor o igual al 5% (17 del grupo con valores plasmáticos más altos y 17 del grupo con valores más bajos de IL13). Estos grupos no mostraron diferencias significativas en cuanto a la media (DE) de edad (61,3 (2,2) vs. 63,8 (3,02); p=0,50), sexo femenino (70,5 vs. 52,9; p=0,29), patrón de NIU en TACAR (64,7 vs. 64,7; p=1), mediana (RIC) de score de Goh total (20 (18-30) vs. 16 (12-28); p=0,64), media (DE) de CVF% (73,8 (3,4) vs. 76,2 (4,7); p=0,68), ni mediana (RIC) de DAS28 (3,81 (2,37-4,62) vs. 3,61 (3,19-4,56) p=0,67). Se encontraron seis eventos en el primer grupo y dos en el segundo. El estimador de KM a 15 meses fue de 0,48 (IC 95% 0,13-0,76) en el primer grupo y de 0,86 (IC 95% 0,54-0,93) en el segundo (p=0,037) (Figura 1). El análisis univariado y multivariado mediante regresión de Cox se muestra en la Tabla 2. Luego de ajustar por posibles confundidores, los valores más altos de IL13 se asociaron significativamente con una mayor declinación de la CVF% en el seguimiento (HR 5,71 (IC 95% 1,11-29,33) p=0,037).
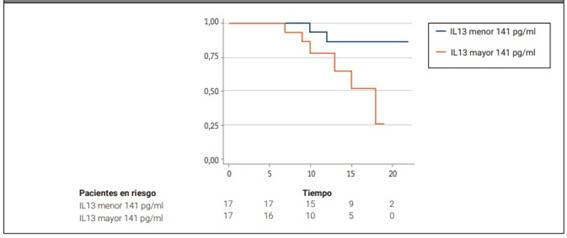
Figura 1: Gráfico de Kaplan Meier que muestra el tiempo en meses hasta una caída de la capacidad vital forzada mayor o igual al 5% de acuerdo con los niveles plasmáticos de IL13 en pacientes con enfermedad pulmonar intersticial asociada a artritis reumatoidea.
Tabla 2: Análisis de regresión de Cox univariado y multivariado para el tiempo hasta una caída de la CVF% mayor o igual al 5% en la cohorte de pacientes con artritis reumatoidea y enfermedad pulmonar intersticial.
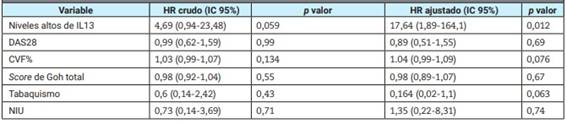
DAS28: Disease Activity Score 28; CVF: capacidad vital forzada; NIU: neumonía intersticial usual.
Independientemente de los valores de IL13 plasmáticos, se analizó el impacto del tratamiento en la evolución funcional. Se agruparon a los pacientes que habían recibido abatacept y/o rituximab, dado que son los dos fármacos que cuentan con mayor evidencia como tratamiento del componente pulmonar de la enfermedad, y se compararon con aquellos que habían recibido otros tratamientos. El abordaje estadístico fue el mismo que se empleó para estudiar el rol pronóstico de la IL13 (tiempo a una caída mayor o igual al 5% del a CVF%). No se halló una asociación estadísticamente significativa entre haber recibido alguno de estos fármacos y haber presentado una mejor evolución funcional (HR 0.52 (IC 95% 0,06-4,2; p=0,54)).
Discusión
Se presentan los resultados de un estudio de cohorte prospectiva diseñado para conocer la relación entre los valores plasmáticos de IL13, y la severidad y el pronóstico en pacientes con AR y EPI. Nuestros resultados muestran que aquellos pacientes con valores más altos de IL13 tienen una peor evolución funcional, con una mayor declinación de la CVF% en el seguimiento. No encontramos diferencias en la severidad basal de la enfermedad entre pacientes con valores diferentes de IL13, aunque podría deberse a un poder insuficiente.
Las principales citoquinas involucradas en la patogenia de la AR son el TNF alfa, la IL 6 y la IL 115. Debido a su capacidad para activar el macrófago y otras células de la inmunidad innata, estas citoquinas conducen a la inflamación y el daño articular. Si bien estos mecanismos son centrales en la génesis del daño articular, el desarrollo de la EPI pareciera seguir un camino diferente. En primer lugar, los infiltrados y las células inflamatorias halladas en el parénquima pulmonar (plasmocitos, linfocitos y folículos linfoides) son muy distintos de los que pueden observarse en el tejido sinovial de estos pacientes (macrófagos, neutrófilos, sinoviocitos tipo fibroblasto, etc.), evidenciando que no serían los actores de la inmunidad innata, sino los de la inmunidad adaptativa los que en mayor medida contribuyen a la inflamación del parénquima pulmonar23,24. Por otro lado, el proceso de reparación exagerada que sucede en el intersticio pulmonar, con activación del fibroblasto y el depósito de grandes cantidades de matriz extracelular, no ocurre a nivel articular7.
La expresión clínica de estas diferencias -en cuanto a los mecanismos involucrados en ambas manifestaciones de la AR- es la pobre correlación que existe entre ambos tipos de compromiso (pulmonar y articular)25. Tomando como base estas consideraciones fisiopatológicas, decidimos investigar como posible biomarcador a un mediador humoral que pudiera representar un link entre la activación de la inmunidad adaptativa y el fenómeno fibrótico en EPI asociada a AR.
La IL13 es una citoquina que pertenece al perfil Th2 y es capaz de activar el fibroblasto a miofibroblasto, el cual a través de la expresión de alfa actina del músculo liso desarrolla capacidad contráctil, a la vez que incorpora la capacidad de sintetizar y depositar grandes cantidades de matriz extracelular10,11. Su efecto profibrótico pareciera estar mediado en parte por su capacidad para activar al TGF-B, aunque también por acción directa a través de receptores específicos10. Por lo anteriormente mencionado, la IL13 se ha propuesto como un poderoso mediador de fibrosis, en especial en el contexto de reparación posterior a un fenómeno inflamatorio13,26,27. Habitualmente, una vez establecido el fenómeno inflamatorio, un cambio en la respuesta inmune desde el perfil Th1 al perfil Th2 conduce a un freno a la inflamación e inicia la reparación del tejido13. Citoquinas del perfil Th2, especialmente la IL13, resultan fundamentales en este cambio de perfil linfocitario. Este fenómeno se estudió en enfermedades extrapulmonares como la esquistosomiasis, así como en patologías pulmonares como el asma bronquial, en la cual la IL13 juega un rol central en el remodelado y en la fibrosis bronquiolar28,29. En la esclerosis sistémica, la IL13 demostró estar relacionada con el desarrollo de fibrosis cutánea y pulmonar11. Finalmente, se sabe que en la actualidad la IL13 está involucrada en la patogenia de la fibrosis pulmonar idiopática (FPI), siendo un potencial blanco para tratamientos dirigidos30. Dada esta evidencia, decidimos estudiar a la IL13 como un posible factor pronóstico en la EPI asociada a AR. Nuestros resultados parecen apoyar esta hipótesis. Un estudio publicado recientemente apoya el rol de la IL13 como indicador de severidad en este contexto clínico, aunque no abordó su rol como marcador pronóstico31.
Dado que los pacientes con EPI asociada a AR y valores elevados de IL13 presentan peor pronóstico, es válido proponer que el bloqueo de la IL13 podría resultar beneficioso en estos casos. Un anticuerpo monoclonal anti IL13 se estudió con éxito para el tratamiento de la dermatitis atópica, aunque hasta la fecha no se han desarrollado estudios en el contexto de EPI asociada a AR32. Sin embargo, existe un grupo de drogas utilizadas ampliamente en el tratamiento de la AR con la capacidad de inhibir la cascada intracelular que sigue a la unión de la IL13 a su receptor de membrana. La IL13, al igual que otras citoquinas, utiliza la vía de JAK/STAT (especialmente JAK1 y JAK 3) para mediar sus acciones a nivel intracelular33. Los inhibidores de JAK, como el tofacitinib, baricitinib y upadacitinib, han sido aprobados para el tratamiento de la AR y son capaces de bloquear estas quinasas (especialmente JAK1)34,35. En consecuencia, estos agentes aparecen como una opción interesante para el tratamiento de pacientes con AR y EPI, no solo por su habilidad para frenar el fenómeno inflamatorio, sino por su potencial efecto antifibrótico. En consonancia con estos datos, un estudio demostró una baja incidencia de EPI en pacientes con AR tratados con tofacitinib comparados con placebo36.
Este estudio presenta algunas limitaciones. En primer lugar, si bien el trabajo se desarrolló de forma prospectiva, el seguimiento no pudo realizarse en una proporción importante de pacientes, lo cual pudo haber sesgado los resultados. Con respecto al seguimiento, es importante aclarar que, si bien se estandarizó en el protocolo, no fue posible realizarlo a intervalos regulares en todos los pacientes, lo cual se vincula a la naturaleza observacional del estudio. En segundo lugar, para establecer una relación entre el pronóstico y los valores de IL13 hubiera sido interesante repetir la determinación de IL13 luego del seguimiento para determinar el impacto del cambio en los valores plasmáticos de IL13 en la evolución de la CVF. En tercer lugar, no pudo alcanzarse el tamaño muestral calculado inicialmente, aunque finalmente esto no fue un obstáculo para demostrar la asociación entre los valores plasmáticos de IL13 y la caída de la CVF%, pero sí podría haber generado falta de poder para obtener resultados más precisos. Finalmente, el estudio se realizó en un centro único, con el consecuente riesgo de sesgo de selección.
Conclusiones
Nuestro estudio es el primero en analizar el rol de la IL13 en pacientes con AR y EPI, y aporta datos que, de confirmarse, podrían tener implicancias pronósticas y terapéuticas. Sin embargo, consideramos que nuestros resultados deben ser validados por otros estudios prospectivos, con mayor cantidad de pacientes, idealmente multicéntricos.














