Introducción
El tratamiento de las principales enfermedades reumáticas se ha modificado sustancialmente en los últimos 20 años. La profundización de los conocimientos acerca de la fisiopatogenia de las enfermedades, el diagnóstico temprano, la aplicación de objetivos claros y en busca de la remisión, y el desarrollo de nuevas terapias han mejorado el pronóstico de los pacientes1-3.
Actualmente contamos con una amplia variedad de drogas, incluyendo las modificadoras de la enfermedad (DME) biológicas (-b), pequeñas moléculas y sus biosimilares y genéricos, respectivamente. Todas han sido aprobadas por las agencias reguladoras locales e internacionales. Sin embargo, los pacientes incluidos en ensayos clínicos son estrictamente seleccionados y vigilados, y no reflejan las características generales de la población habitualmente evaluada en la práctica diaria, así como tampoco se tienen en cuenta los problemas de acceso a la medicación y las preferencias de los pacientes. Por este motivo es tan valiosa la información proveniente de registros de la vida real4.
Sabemos que nuestra población difiere íntegramente de la europea o estadounidense, tanto en aspectos genéticos como culturales y, por lo tanto, la respuesta al tratamiento y la seguridad de estas drogas no necesariamente son comparables entre los pacientes de diferentes orígenes. Si bien en la actualidad Argentina ha aumentado su representación en estudios pivotales, es fundamental evaluar la seguridad de las drogas luego de su aprobación en el contexto de escenarios locales de la vida real5-7.
Conocer la eficacia y seguridad a largo plazo de las drogas disponibles teniendo en cuenta sus comorbilidades, fallas terapéuticas, preferencias y características clínicas, todo esto englobado en un escenario real, se convierte en una herramienta fundamental al momento de tomar decisiones terapéuticas objetivas e individualizadas en la consulta médica diaria. En este contexto, la Sociedad Argentina de Reumatología (SAR) se incorporó al programa BIOBADAMERICA (Registro Panamericano de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas) propulsado por la Sociedad Española de Reumatología y la Liga Panamericana de Asociaciones de Reumatología (PANLAR)8, y desarrolló en 2010 el Registro Argentino de Acontecimientos Adversos de Terapias Biológicas en Enfermedades Reumáticas, BIOBADASAR9. El objetivo original del mismo fue identificar los principales eventos adversos (EA) que surjan del tratamiento crónico con DME-b y pequeñas moléculas en pacientes argentinos.
Los objetivos de este trabajo fueron describir los EA reportados, estimar su frecuencia e identificar los factores relacionados con su desarrollo.
Materiales y métodos
Registro BIOBADASAR. Diseño del estudio
El registro BIOBADASAR se describió previamente8-9. De manera abreviada, es un registro voluntario, prospectivo, de seguimiento de acontecimientos adversos y seguridad de tratamientos biológicos y sintéticos dirigidos en pacientes con enfermedades reumatológicas inmunomediadas. Actualmente se cuenta con datos de 56 centros públicos y privados de 13 provincias argentinas, de los cuales 38 trabajan activamente en el proyecto. Los investigadores obtienen los datos por revisión de historias clínicas y los pacientes son seguidos hasta la muerte, pérdida de seguimiento o retiro del consentimiento informado.
Para este análisis se extrajeron datos recopilados hasta el 31 de enero de 2023.
Población y variables de estudio
Se incluyeron pacientes ≥18 años de edad, con diagnóstico de enfermedades reumáticas inflamatorias tratados con DMEs-b (originales y biosimilares) o pequeñas moléculas (originales o genéricas). A este grupo se lo identificó como “pacientes expuestos”. Simultáneamente, se formó un grupo de pacientes apareado por diagnóstico, edad y sexo, tratado con DMEs convencionales, que se clasificó como “controles”. Cada uno de los pacientes aportó uno o más ciclos de tratamiento.
Basalmente se consignaron datos demográficos, de diagnóstico y su fecha, y comorbilidades al momento del inicio del tratamiento. Se registraron la fecha de inicio del tratamiento, droga, dosis, vía de administración y marca comercial utilizada, y actividad de la enfermedad al momento del corte del presente análisis. En cada visita anual se evaluó la actividad de la enfermedad. En caso de suspensión del fármaco, se consignaron la fecha y causa de la misma, utilizando las siguientes categorías: inefectividad, desarrollo de EA, embarazo no planificado, remisión, pérdida de seguimiento, otro o desconocido.
Se recolectó información acerca del desarrollo de los EA, definidos como aquellos acontecimientos perjudiciales para la salud del paciente que se hayan producido durante el tratamiento con la DME (convencional, biológica innovadora, biosimilar o sintética dirigida original o genérica). Los mismos se clasificaron según el Superior Order Classification (SOC) de MedDRA. Para evaluar la causalidad entre el EA y el tratamiento se utilizó el algoritmo de Naranjo10. En caso de presencia de un EA, se consignaron la fecha, descripción y gravedad del mismo, entendiendo por EA serio (EAS) aquel que desencadene la muerte, amenace la vida, demande hospitalización o la prolongue, produzca invalidez o incapacidad permanente, o se asocie a una anomalía o malformación congénita.
Aspectos éticos
Este estudio lo aprobó un comité de ética independiente (Comité de Ética Dr. Claude Bernard, número de aprobación 20230123.E, 23 de enero de 2023) y se realizó en concordancia con las guías de Buenas Prácticas Clínicas, el Consejo Internacional de Armonización y con los principios éticos establecidos por la Declaración de Helsinki, la ley 3301/09 y las guías del comité de ética local. Todos los pacientes fueron debidamente informados y firmaron el correspondiente consentimiento informado previamente a su inclusión. Los datos personales de los pacientes se trataron según la normativa de la ley nacional de protección de datos personales (ley 25326).
Análisis estadístico
Se analizaron todos los ciclos de tratamiento de los pacientes incluidos, pudiendo cada uno aportar a más de un ciclo en ambos grupos. Los grupos se conformaron de la siguiente manera: sin DME-b/sd, esquemas terapéuticos en los cuales no se incluyen agentes biológicos o sintéticos dirigidos; con DME-b/sd, esquemas terapéuticos en los cuales no se incluyen agentes biológicos o sintéticos dirigidos, incluyendo drogas originales, biosimilares y genéricas.
Se realizó estadística descriptiva. La distribución de las variables continuas se evaluó con diagrama de caja, inspección visual del histograma y prueba de Shapiro-Wilk, y se expresaron en medianas y primer cuartil (Q1) - tercer cuartil (Q3) o bien como medias con su correspondiente desvío estándar (DE), según la distribución de las mismas, y las categóricas, en frecuencia y porcentaje. Las primeras se compararon mediante el test T de Student o Wilcoxon, y las segundas con chi cuadrado o test exacto de Fisher, según corresponda.
La incidencia de EA se expresó en eventos cada 1000 pacientes/año y se comparó entre grupos. Se calculó el tiempo entre el inicio del tratamiento y la aparición del primer EA en ambos grupos con el fin de establecer la sobrevida libre de EA mediante curvas de sobrevida de Kaplan-Meier. La comparación entre las curvas de supervivencia se realizó con el test Log-Rank. Para establecer los factores asociados al tiempo hasta el desarrollo del primer EA, se realizaron modelos de regresión de Cox ajustándolos a las siguientes variables: edad, sexo, comorbilidades, tipo de enfermedad, tiempo de evolución de la enfermedad, uso de glucocorticoides, DME convencionales, biológicas y sintéticas dirigidas.
Para los test se utilizó un nivel de significación del 5%. Los análisis se efectuaron con el programa R versión 4.0.0 (Free Software Foundation, Inc., Boston, USA).
Resultados
Se incluyó un total de 6253 pacientes, los cuales aportaron 9533 ciclos de tratamiento, incluyendo 3647 (38,3%) ciclos sin DME-b/sd y 5886 (61,7%) con DME-b/sd. Dentro del primer grupo, los agentes más utilizados fueron los glucocorticoides (47,3%), metotrexato (74,1%) y leflunomida (27,3%), mientras en el segundo, los inhibidores de TNF (63,0%) y tofacitinib (9,5%) fueron los fármacos biológicos y sintéticos dirigidos más frecuentemente reportados, respectivamente (Tabla 1). Las enfermedades reumáticas más prevalentes en ambos grupos fueron artritis reumatoidea (78,6%), artritis psoriásica (8,4%), lupus eritematoso sistémico (2,9%) y espondiloartritis axial (2,1%), aunque las espondiloartritis fueron significativamente más frecuentes en el grupo tratado con agentes biológicos y sintéticos dirigidos y, a la inversa, el lupus eritematoso sistémico entre aquellos pacientes que no utilizaban dichas drogas. Quienes recibieron una DME-b/sd eran significativamente más añosos y con menor frecuencia de sexo femenino. Asimismo, presentaban una enfermedad más larga al momento del inicio de la misma y mayor frecuencia de comorbilidades, a excepción de cáncer y linfoma que se observaron significativamente más frecuentemente en el grupo no expuesto a DME-b/sd (Tabla 2).
Tabla 1: Drogas utilizadas durante los ciclos de tratamiento.
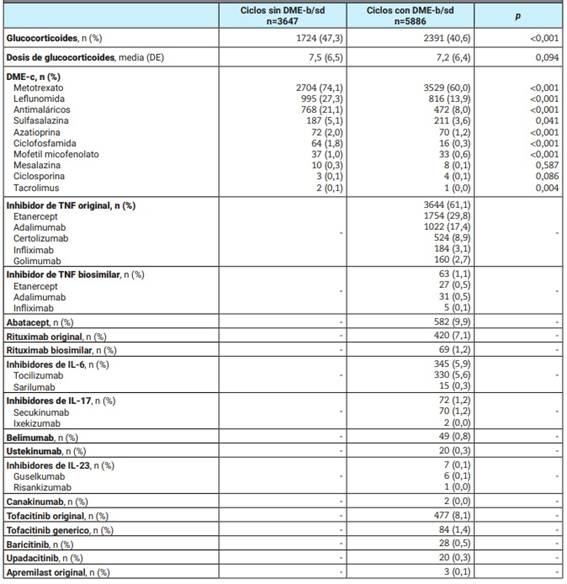
DME: droga modificadora de la enfermedad; b: biológica; sd: sintética dirigida; n: número; DE: desvío estándar; IL: interleuquina; TNF: tumor necrosis factor (factor de necrosis tumoral).
Tabla 2: Características de los pacientes de acuerdo al ciclo de tratamiento recibido.
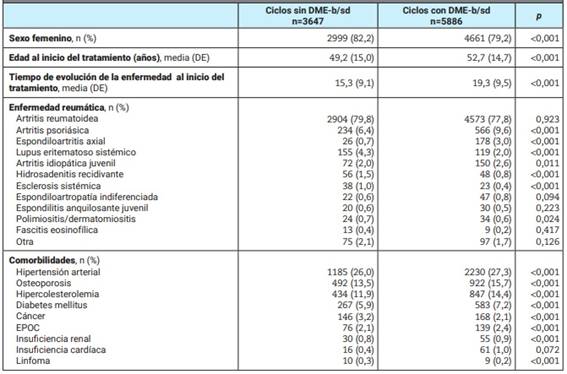
DME: droga modificadora de la enfermedad; b: biológica; sd: sintética dirigida; n: número; DE: desvío estándar; EPOC: enfermedad pulmonar obstructiva crónica.
El seguimiento medio fue de 5,2 años (DE 5,2), con un total de 49461 pacientes/año. Los ciclos con DME-b/sd aportaron 24493 pacientes/año. Durante este período se reportaron 5890 EA en un total de 2701 tratamientos (844 y 1857 sin y con DME-b/sd, respectivamente), y la incidencia global de los mismos fue de 53,9 eventos cada 1000 pacientes/año (IC 95% 51,9-55,9). El 31,5% de los ciclos de tratamiento con DME-b/sd presentó al menos un EA, significativamente menor a lo observado en los ciclos sin estas drogas (23,1%; p<0,001). La incidencia de EA también fue mayor en este grupo (71,1 eventos cada 1000 pacientes/año, IC 95% 70,7-77,5 versus 33,7, IC 95% 31,5-36,1; p<0,001). El tiempo desde el inicio del tratamiento hasta el desarrollo del primer EA también fue menor durante el uso de DME-b/sd (media 1,7±2,3 meses versus 3,6±5,4 meses; p<0,001) y el número de EA por ciclo entre los que reportó algún EA fue mayor (media 2,2±3,3 versus 2,1±2,2; p<0,001). En el análisis univariado, la sobrevida libre de EA también fue menor en los ciclos con DME-b/sd (p<0,001).
Las infecciones, particularmente las de la vía aérea superior, fueron los EA más frecuentes en ambos grupos. Sin embargo, fueron más comunes durante los ciclos con DME-b/sd, al igual que los trastornos de la piel y el tejido subcutáneo, los renales y urinarios, y los respiratorios, torácicos y mediastínicos. A la inversa, las neoplasias, los trastornos de la sangre y del sistema linfático, del sistema nervioso, gastrointestinales y hepatobiliares fueron significativamente más prevalentes durante los ciclos sin DME-b/sd (Tabla 3).
Tabla 3: Eventos adversos más frecuentes reportados durante los diferentes ciclos de tratamiento.


DME: droga modificadora de la enfermedad; b: biológica; sd: sintética dirigida; n: número; SOC: Superior Order Classification; EA: evento adverso.
Si bien la mayoría de los EA fue leve o moderado, el 10,9% fue EAS y el 1,1% provocó la muerte del paciente; esto fue comparable entre grupos (Tabla 3). El 18,7% de los ciclos con DME-b/sd fue discontinuado a causa de un EA, significativamente mayor a lo reportado en el otro grupo (11,5%; p<0,001). La frecuencia de al menos un EA según el uso de DME-b/sd y el tipo de droga se detallan en la Tabla 4.
Tabla 4: Frecuencia de al menos un evento adverso según ciclo de tratamiento.
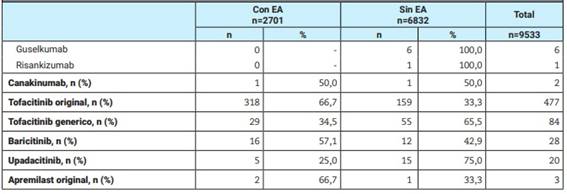

DME: droga modificadora de la enfermedad; b: biológica; sd: sintética dirigida; n: número; IL: interleuquina; EA: evento adverso; TNF: tumor necrosis factor (factor de necrosis tumoral).
Se identificaron 15 casos de tuberculosis latente y 43 de tuberculosis activa, de los cuales dos fueron identificados como tuberculosis pleurales, dos miliares, un caso ganglionar y otro anexial/peritoneal. El 25% de los casos ocurrió durante ciclos sin DME-b/sd, mientras que el 60% sucedió durante el tratamiento con inhibidores de TNF. En todos los casos los pacientes evolucionaron favorablemente.
Se reportaron 148 casos de infección por herpes zóster, cinco de ellos con extensión multidermatoma, tres oftálmicos y uno con compromiso neurológico. Uno de los casos oftálmicos provocó la ceguera permanente del paciente. El 21,1% de los mismos ocurrió durante esquemas terapéuticos que no incluían DME-b/sd. Cabe destacar que el 3,4% de los ciclos en los cuales se incluían inhibidores JAK presentó algún evento de infección por herpes zóster, teniendo la incidencia más alta de todos los medicamentos, 11,2 eventos cada 1000 pacientes/año (IC 95% 6,2-16,2). La misma fue de 6,8 eventos cada 1000 pacientes/ año (IC 95% 3,5-10,2) para abatacept, 6,2 eventos cada 1000 pacientes/año (IC 95% 1,9-10,5) para rituximab, 5,0 eventos cada 1000 pacientes/año (IC 95% 1,0-9,1) para inhibidores de IL-6 y 3,2 eventos cada 1000 pacientes/año (IC 95% 2,4-4,1) para inhibidores de TNF.
Con respecto al desarrollo de neoplasias, se reportaron 254 eventos, de los cuales 144 se consideraron malignos (incidencia 2,9 eventos cada 1000 pacientes/año, IC 95% 2,4-3,4). Los más frecuentes fueron los genitourinarios (52 casos), cutáneos (33 casos), hematológicos (23 casos) y pulmonares (9 eventos). Dentro del primer grupo la localización más prevalente fue la mama (31 casos), seguida de la próstata (7 casos). Si bien la mayoría de los cánceres de piel correspondió a carcinoma basocelular (20 casos) y escamoso (2 casos), se reportaron también cuatro eventos de melanoma, dos de ellos de tipo superficial y uno se asoció a la muerte del paciente. De manera global, 14 (5,5%) de los pacientes con neoplasias fallecieron por su causa.
Finalmente, en el análisis multivariado, los ciclos con DME-b/sd se asociaron a 1,82 (IC 95% 1,64-1,96) veces más riesgo de desarrollar al menos un EA. Asimismo, presentar mayor edad y mayor tiempo de evolución de la enfermedad al inicio del ciclo de tratamiento, tener enfermedad pulmonar obstructiva crónica y lupus eritematoso sistémico, y el uso glucocorticoides demostraron tener el mismo efecto. En un segundo modelo en el que se incluyeron las DME-b/sd de manera independiente según mecanismo de acción, se identificó a los inhibidores de TNF, abatacept, rituximab original y biosimilar, inhibidores de IL-6, belimumab e inhibidores de JAK como factores de riesgo para desarrollo de al menos un EA (Tabla 5).
Tabla 5: Factores asociados al desarrollo de al menos un evento adverso.
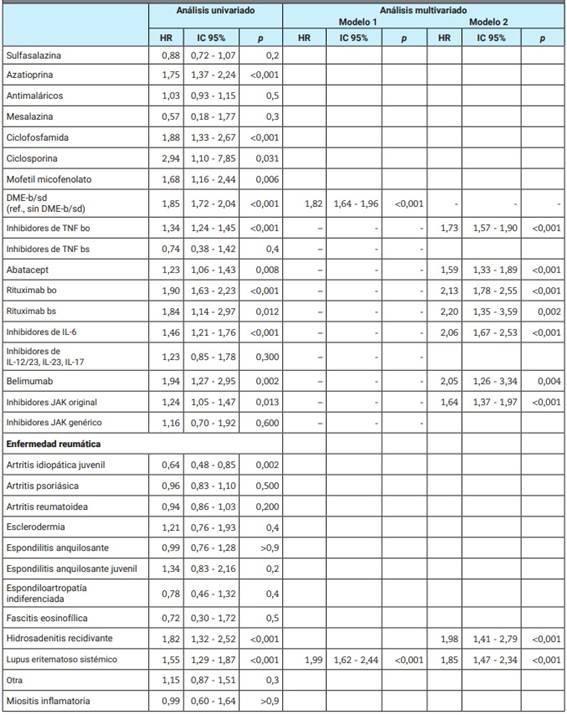

*Se excluyeron los grupos inhibidores de IL-1 y apremilast del modelo 2 del análisis multivariado debido al pequeño número de pacientes incluidos, 2 y 3 ciclos, respectivamente. HR: hazard ratio; IC: intervalo de confianza; EPOC: enfermedad pulmonar obstructiva crónica; ref.: referencia; mg: miligramos; DME: drogas modificadoras de la enfermedad; b: biológicas; sd: sintéticas dirigidas; TNF: tumor necrosis factor (factor de necrosis tumoral); bo: biooriginal; bs: biosimilar; IL: interleuquina; JAK: janus kinase.
Discusión
En este reporte del registro nacional BIOBADASAR se evaluó la seguridad de los agentes biológicos innovadores y biosimilares, y sintéticos dirigidos originales y genéricos utilizados por pacientes de la vida real de hospitales públicos y privados de Argentina. Se observó una incidencia global de EA de 184,4 eventos cada 1000 pacientes/año que fue significativamente mayor durante aquellos ciclos de tratamientos que incluían agentes biológicos y sintéticos dirigidos. Los EA mayormente reportados en ambos grupos fueron las infecciones. Mientras las infecciones, los trastornos cutáneos, de las vías urinarias y pulmonares fueron más frecuentes durante los ciclos con DME-b/sd, las neoplasias, los trastornos hematológicos, del sistema nervioso central, gastrointestinales y hepatobiliares fueron significativamente más prevalentes durante los ciclos sin DME-b/sd.
Cabe destacar la importante cantidad de pacientes reclutados con datos de más de 9 mil ciclos de tratamiento con amplia representatividad de las patologías reumáticas inmunomediadas que se presentan habitualmente en la práctica diaria y de los fármacos actualmente disponibles en nuestro país. Con respecto a este punto, en este nuevo reporte de BIOBADASAR se incluyeron datos de 216 ciclos de tratamiento de nueve biosimilares (tres de adalimumab, dos de etanercept, dos de infliximab y dos de rituximab) y cuatro genéricos de tofacitinib. Desde nuestro conocimiento, este es el primer trabajo que incluye un número tan grande de este tipo de drogas en nuestro país11.
Como se mencionó previamente, los pacientes que recibían ciclos de tratamiento que incluían DME-b/sd, presentaron mayor frecuencia y número de EA, y menor tiempo hasta el desarrollo de los mismos. Esto fue similar a lo observado en otros registros iberoamericanos, en los cuales, al igual que en nuestro caso, las infecciones, particularmente las de la vía aérea superior fueron las más frecuentemente reportadas12-15. Ciertos EA, incluyendo los trastornos gastrointestinales, hepatobiliares y neurológicos, fueron más prevalentes durante los ciclos de tratamientos sin DME-b/sd, situación que se observa habitualmente en la práctica diaria con el uso de agentes convencionales como el metotrexato o la leflunomida, que se incluyeron en más del 80% de los ciclos analizados.
En el análisis multivariado, los ciclos que incluían alguna droga biológica y sintética dirigida se asociaron con la presencia de al menos un EA. Además, los inhibidores de TNF, abatacept, rituximab original y biosimilar, inhibidores de IL-6, belimumab e inhibidores de JAK presentaron esta asociación de manera independiente. Asimismo, se identificaron otros factores, incluyendo la mayor edad y el mayor tiempo de evolución al inicio del tratamiento, el diagnóstico de enfermedad pulmonar obstructiva crónica y de lupus eritematoso sistémico, y el uso de glucocorticoides. En este sentido, y en relación a las guías de práctica clínica vigentes, sabemos que los pacientes que inician DME-b/sd son quienes presentan enfermedad más severa, y probablemente con mayor carga. Por esta razón reciben mayores dosis de glucocorticoides durante la evolución e incluso suelen tener comorbilidades con mayor frecuencia producto de la enfermedad y las drogas recibidas como esteroides y AINEs. En función de la secuencia de uso recomendada de las diferentes drogas convencionales, biológicas y sintéticas dirigidas, y de las dificultades en el acceso a medicamentos de alto costo en nuestro país, el inicio de los ciclos con DME-b/sd ocurre en pacientes de mayor edad y tiempo de evolución. Todos estos factores fueron significativamente más frecuentes en los ciclos de tratamiento con DME-b/sd y, a su vez, se asociaron independientemente con el desarrollo de EA en el análisis ajustado. Cabe destacar que la introducción reciente de algunos fármacos -como los inhibidores de IL-23, biosimilares y genéricos- muestran cortos períodos de exposición a los mismos. Esto podría explicar la menor frecuencia de EA, particularmente de aquellos más raros y los que suelen aparecer durante mayor tiempo de seguimiento como las neoplasias.
En este registro se reportó un total 58 casos de tuberculosis durante el período de seguimiento, tres de ellos de tipo diseminado; el 60% ocurrió durante ciclos de tratamiento con inhibidores de TNF. Se demostró que estas drogas interfieren en la respuesta inmune antituberculosa16 y por lo tanto es importante realizar pruebas de tamizaje antes del inicio de las mismas y estar atentos ante posibles eventos de infección durante su aplicación, particularmente en Argentina, país endémico de Mycobacterium tuberculosis17,18. En el registro nacional de Brasil (BIOBADABRASIL), otro país endémico para esta micobacteria, se detectó infección en 6,8% de los ciclos19.
Por otro lado, cabe destacar la mayor prevalencia de casos de herpes zóster durante los ciclos de tratamiento que incluían inhibidores de JAK. Esta asociación se reportó previamente20. Datos recabados de los ensayos clínicos de tofacitinib demostraron que la incidencia de herpes zóster en pacientes con artritis reumatoidea fue de 4,5 eventos cada 100 pacientes/año (IC 95% 3,67-5,5), y fue mayor en quienes recibían tofacitinib 10 mg cada 12 horas, tratamiento combinado con DME convencionales y glucocorticoides21. Datos provenientes de registros de la vida real demuestran que el riesgo de desarrollar este tipo de infección es entre 2-4 veces mayor en quienes reciben inhibidores JAK en comparación con inhibidores de TNF22-24.
Respecto de los eventos por infección por SARS-CoV-2, cabe remarcar que representaron una tasa de mortalidad comparable a lo reportado por el registro argentino SAR-COVID, en el cual fue de 4,4%25. Incluso la mayoría de los pacientes que falleció estaba recibiendo glucocorticoides y uno de ellos, rituximab, drogas que se han asociado a peor pronóstico de la infección, tanto a nivel local como a partir de los datos del COVID-19 Global Rheumatology Alliance25,26.
Otros EA de interés son las neoplasias. En este caso se reportaron 144 neoplasias malignas, las más frecuentes en mama, cutáneas, hematológicas y pulmonares. Solo dos se asociaron de manera probable con el tratamiento. Una distribución similar se observó en el registro BIOBADASER, aunque en este caso, el cáncer de piel no melanoma fue el más frecuente, seguido por el de mama y pulmón27.
Nuestro estudio tiene fortalezas y limitaciones. En primera instancia, es el registro más grande de pacientes de la vida real tratados con agentes biológicos y sintéticos dirigidos de nuestro país, con más de 9 mil ciclos de tratamiento analizados. Su diseño prospectivo favorece la recolección de datos de seguridad. En este reporte se observó la representatividad de las enfermedades reumáticas inmunomediadas habitualmente presentes en la práctica diaria, así como también la inclusión de fármacos biosimilares y genéricos actualmente disponibles en Argentina. Sin embargo, cabe aclarar que este registro es voluntario y que no todas las provincias argentinas están presentes, aunque sí lo están todas las filiales de la SAR. Esta distribución coincide con las regiones con mayor población, incluyendo la Ciudad Autónoma de Buenos Aires, Gran Buenos Aires, Córdoba, Santa Fe, Entre Ríos, Mendoza y Tucumán28. Lamentablemente no se tuvieron en cuenta otros datos que podrían explicar la diferencia en la incidencia de EA entre los grupos, como la actividad de la enfermedad y la discapacidad funcional. Tampoco contamos con datos de vacunación, factor que podría tener algún grado de efecto sobre los resultados. Asimismo, no se realizó un subanálisis entre los pacientes con biológicos o drogas sintéticas que estaban sin medicamentos tradicionales para estimar su efecto en forma exclusiva en los EA. Por otro lado, la reciente introducción de algunos fármacos condiciona el número y la duración de los períodos de exposición a los mismos, pudiendo explicar la menor frecuencia de EA en estos grupos. En este sentido, continuaremos con la vigilancia en términos de seguridad a través del registro BIOBADASAR y se realizarán nuevos reportes en el futuro.
Conclusiones
En este reporte de BIOBADASAR se identificó una incidencia de EA de 53,9 eventos cada 1000 pacientes/año, que fue significativamente superior durante aquellos ciclos de tratamientos que incluían DME-b/sd. Al ajustar por factores confundidores, estas drogas se asociaron a 1,8 veces más riesgo de EA. Otros factores de riesgo fueron la mayor edad, el mayor tiempo de evolución de la enfermedad, el antecedente de enfermedad pulmonar obstructiva crónica y de lupus eritematoso sistémico, y el uso de glucocorticoides.














