Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista FAVE. Sección Ciencias veterinarias
versión On-line ISSN 2362-5589
FAVE, Secc. Cienc. vet. vol.15 no.1-2 Santa Fe dic. 2016
COMUNICACIÓN CORTA
"Candidatus Rickettsia andeanae" en Amblyomma tigrinum, San Luis, Argentina
Cicuttin GL1*, De Salvo MN1, Serna C2, Machado R2, Silva D1, Gury Dohmen FE3, Lencinas O4
1 Laboratorio de Zoonosis Bacterianas y Parasitarias Transmitidas por Vectores - Instituto de Zoonosis Luis Pasteur (IZLP).
2 Práctica privada de la medicina veterinaria
3 Departamento de Diagnóstico y Producción - IZLP
4 Dirección - IZLP
* Correspondencia: Gabriel L. Cicuttin, Instituto de Zoonosis Luis Pasteur. Av. Díaz Vélez 4821 (CP: C1405DCD), CABA (Argentina). E-mail: gcicuttin@gmail.com
Editor: J.M. Venzal
doi: www.dx.doi.org/10.14409/favecv.v15i1/2.6093
Recibido: 14 Octubre 2016.
Aceptado: 2 Noviembre 2016.
Disponible en línea: 8 Noviembre 2016
RESUMEN
El objetivo del estudio fue detectar especies del género Rickettsia en garrapatas de la especie Amblyomma tigrinum colectadas sobre carnívoros domésticos y en sangre de caninos domésticos de la provincia de San Luis (Argentina). Entre 2013 y 2015 se colectaron 56 garrapatas adultas de la especie A. tigrinum sobre caninos y felinos domésticos, y se obtuvieron 65 muestras sanguíneas de caninos. Tres garrapatas resultaron positivas mediante la amplificación de un fragmento del espacio intergénico 23S-5S ARNr del género Rickettsia, lográndose secuenciar uno de los productos positivos. La muestra positiva secuenciada también resultó positiva por PCRs de los fragmentos de los genes gltA y ompA. Las secuencias obtenidas resultaron tener una identidad del 100 % de identidad con "Candidatus Rickettsia andeanae". Todas las muestras sanguíneas resultaron negativas. "Ca. R. andeanae" no ha sido asociada con enfermedad en humanos o animales, sin embargo, es necesario realizar nuevas investigaciones para lograr un mayor conocimiento del riesgo potencial de transmisión de rickettsiosis en la región.
Palabras clave: Rickettsia; Amblyomma tigrinum; Perro; Gato; San Luis.
SUMMARY
"Candidatus Rickettsia andeanae" in Amblyomma tigrinum ticks from San Luis (Argentina)
The aim of this study was to detect species of Rickettsia in Amblyomma tigrinum ticks collected from domestic carnivores and blood of domestic dogs of San Luis (Argentina). Between 2013 and 2015, 56 adults of A. tigrinum from dogs and cats and 65 blood from dogs were collected. Three ticks were positive by amplification of a 23S-5S rRNA fragment, and the sequence of one of the positive products was obtained. The positive sample sequenced was positive by PCRs of fragments of genes gltA and ompA. The sequences obtained were 100% identical with "Candidatus Rickettsia andeanae". All blood samples were negative. "Ca. R. andeanae" has not been associated with disease in humans or animals; however, further research is necessary to achieve greater awareness of the potential risk of transmission of rickettsial diseases in the region.
Key words: Rickettsia; Amblyomma tigrinum; Dog; Cat; San Luis.
Introducción
Amblyomma tigrinum (Acari: Ixodidae) es una especie de garrapata neotropical distribuida desde Venezuela a Argentina, con una gran plasticidad adaptativa a diferentes ecosistemas, y forma parte del grupo Amblyomma maculatum, que incluye a A. maculatum, A. tigrinum y Amblyomma triste (Guglielmone et al., 2000; EstradaPeña et al., 2005). En Argentina, la distribución de esta especie es amplia, abarcando todas las regiones fitogreográficas al norte del paralelo 40º S (Guglielmone et al., 2000). Los principales hospedadores para larvas y ninfas son roedores de las familias Cricetidae (Sigmodontinae) y Caviidae (Caviinae), y aves (Nava et al., 2006). Los adultos se encuentran en carnívoros (domésticos y silvestres), aunque pueden parasitar a otros mamíferos grandes, incluyendo al hombre (Guglielmone et al., 2000; Romer et al., 2014). Estudios realizados en Córdoba, indicaron que todos los estadios de A. tigrinum están activos durante el año, probablemente con más de una generación por año. Las larvas y ninfas presentan un pico de abundancia entre fin de primavera y mitad de otoño, mientras que los adultos se encuentran principalmente en el verano (Guglielmone et al., 2000; Nava et al., 2009). La gran capacidad adaptativa de esta especie de garrapata posiblemente esté relacionada con su parasitismo en carnívoros domésticos, con lo cual presenta un ciclo de vida ligado a microhábitats y/o factores locales que contribuyen a su plasticidad ambiental (Guglielmone et al., 2000; Nava et al., 2006).
En A. tigrinum se detectaron distintas rickettsias, tales como Rickettsia parkeri en Bolivia (Tomassone et al., 2010b), Uruguay (Lado et al., 2014) y Argentina (Romer et al., 2014; Linares, no publicado), "Candidatus Rickettsia andeanae" en Argentina (SarachoBottero et al., 2015) y Chile (Abarca et al., 2013) y Rickettsia bellii en Argentina (Tomassone et al., 2010a). Por otra parte, "Ca. R. andeanae" fue descripto por primera vez en A. maculatum e Ixodes boliviensis de Perú, y posteriormente en A. maculatum de EEUU y otras especies de garrapatas de Argentina, Brasil y Chile (Paddock et al., 2015).
El objetivo del presente estudio fue detectar especies del género Rickettsia en garrapatas A. tigrinum colectadas de carnívoros domésticos y en sangre de caninos domésticos de San Luis (Argentina).
Materiales y Métodos
Entre 2013 y 2015, con el consentimiento de los propietarios, se colectaron garrapatas de caninos de la localidad de Merlo (32°20′52"S, 65°00′57"O) y de felinos de la localidad de Cortaderas (32°30′24" S, 64°59′02" O), en la provincia de San Luis (Argentina). Los especímenes se mantuvieron en etanol al 70 % hasta su identificación siguiendo las claves descriptas en EstradaPeña et al. (2005). Complementariamente, mediante venipunción de vena cefálica antebraquial, se tomó sangre entera con anticoagulante EDTA de caninos de Merlo (San Luis). La sangre se mantuvo a 20ºC hasta su procesamiento.
Las localidades de Merlo y Cortaderas se sitúan en el noreste de la provincia de San Luis, sobre la ladera occidental de las Sierras Comechingones. Presentan un clima templado subhúmedo serrano con una temperatura media anual de 20º C y 600 mm de precipitaciones anuales (Del Vitto et al., 1994).
El ADN fue extraído de las garrapatas y de las muestras sanguíneas mediante el High Pure PCR Template Preparation Kit (Roche, Mannheim, Germany) siguiendo las instrucciones del fabricante. Se utilizó agua libre de nucleasas como control negativo de extracción.
En primer término se realizó una PCR de tamizaje para detectar el género Rickettsia, mediante la amplificación de una porción del espacio intergénico 23S5S ARNr (Jado et al., 2006), siguiendo la metodología descripta por los autores. A las muestras positivas se les realizaron otras dos PCRs para una mejor caracterización genética, mediante cebadores para un fragmento del gen de la citrato sintasa (gltA) (Labruna et al., 2004) y para un fragmento del gen de proteína de membrana externa (ompA) (Regnery et al., 1991). Rickettsia massiliae fue utilizada como control positivo.
Los productos amplificados fueron purificados con Wizard® SV Gel and PCR CleanUp System (Promega, Madison, USA) y secuenciados en un secuenciador 3500 Genetic Analyzer sequencer (Applied Biosystems, Foster City, CA, EEUU). Las secuencias obtenidas fueron comparadas con secuencias disponibles en GenBank, mediante BLAST (www.ncbi.nlm.nih.gov/blast).
El alineamiento múltiple fue realizado con el algoritmo CLUSTAL W y la construcción del árbol filogenético fue hecha con el software MEGA versión 5 (Tamura et al., 2011). Para cada gen analizado, un filograma fue construido usando el método del vecino más cercano (neighborjoining, NJ) y los parámetros del modelo TamuraNei. Los valores de confianza para cada rama de los árboles resultantes fueron determinados mediante 1000 replicaciones de remuestreo (bootstrap).
Las secuencias obtenidas en este estudio fueron depositadas en la base de datos GenBank con los siguientes números de acceso: KX576679 (fragmento espacio intergénico 23S5S ARNr), KX576677 (fragmento del gen gltA) y KX576678 (fragmento del gen ompA).
Resultados
En total se colectaron 56 garrapatas (23 sobre caninos y 32 sobre felinos) y todas fueron identificadas como adultos de A. tigrinum. Además, se obtuvieron 65 muestras sanguíneas de caninos.
En la PCR para el fragmento del espaciador intergénico 23S5S del género Rickettsia, 3 garrapatas resultaron positivas (5,4 %), mientras que todas las muestras sanguíneas fueron negativas. Las garrapatas positivas fueron colectadas sobre los felinos. Uno de los tres positivos pudo ser secuenciado, resultando en un 99,1 % de identidad respecto a Rickettsia raoultii (CP010969) y 98,8 % con Rickettsia montanensis (KJ796427). La disponibilidad de secuencias del fragmento del espaciador intergénico 23S5S de especies de Rickettsia presentes en Sudamérica es limitada, impidiendo un diagnóstico específico en muchos casos, y resultando sólo informativo a nivel genérico.
La muestra positiva secuenciada también resultó positiva a las PCRs de los fragmentos de los genes gltA y ompA. La secuencia obtenida del fragmento gltA resultó en un 100 % de identidad con "Ca. R. andeanae" detectado en garrapatas Amblyomma parvum de Córdoba (Argentina, EF451001) y Brasil (KT153033) y A. maculatum de Perú (GU169050), entre otras, y un 99,7 % con "Ca. R. andeanae" detectada en garrapatas A. tigrinum de Tucumán (Argentina, KT878724). Mientras que la secuencia obtenida del fragmento ompA resultó en un 100 % de identidad con "Ca. R. andeanae" detectada en garrapatas A. tigrinum de Tucumán (Argentina, KT878725) y A. parvum de Córdoba (Argentina, EF451004), Paraguay (KF179352) y Brasil (KF030932), entre otras.
Los árboles filogenéticos construidos con los fragmentos de los genes gltA y ompA se muestran en la figura 1.
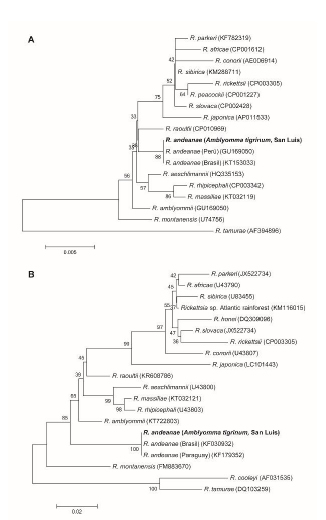
Figura 1. Árboles filogenéticos inferidos por la comparación de secuencias parciales de los genes gltA (A) y ompA (B) del género Rickettsia. Los números en los nodos son los valores de remuestreo. La barra de escala representa la diferencia en nucleótidos de las secuencias. Los números de acceso de GenBank están entre paréntesis.
Discusión
Según nuestro conocimiento, esta es la primera detección de "Ca. R. andeanae" en garrapatas A. tigrinum de San Luis.
La relación entre A. tigrinum y "Ca. R. andeanae" fue reportada previamente en Chile con un 64,5 % de garrapatas infectadas (Abarca et al., 2013) y Tucumán (Argentina) con un 79,5 % de prevalencia (SarachoBottero et al., 2015). Además, "Ca. R. andeanae" se encontró en alta prevalencia en otras especies de garrapatas de nuestro país como A. parvum en Córdoba (Pacheco et al., 2007), A. parvum y A. pseudoconcolor en el noreste argentino (Tomassone et al., 2010a), así como en países limítrofes: A. parvum en Paraguay (Ogrzewalska et al., 2014) y A. maculatum en Perú (Blair et al., 2004). Por otra parte, reportes de "Ca. R. andeanae" en A. maculatum de EEUU presentaron prevalencias variables del 3,2 al 73,0 % (Paddock et al., 2015). En comparación, la prevalencia de nuestro estudio fue muy baja (5,4 %) con respecto a los estudios previos en Argentina, aunque similar a reportes de EEUU.
Los resultados negativos en las muestras sanguíneas de perros eran esperables dado que hay muy pocas notificaciones de detección de rickettsias en sangre de perros (Tomassone et al., 2010b; Cicuttin, 2014; SolanoGallego et al., 2008). Sin embargo, queda por determinar el rol que podrían tener los felinos domésticos como reservorios.
En nuestro estudio no encontramos R. parkeri, mientras que en una zona cercana (Valle de Traslasierra, Córdoba) esta rickettsia fue detectada con ocurrencia de casos humanos (Romer et al., 2014). Aunque nosotros estudiamos un bajo número de garrapatas, la interferencia entre "Ca. R. andeanae" y R. parkeri ha sido sugerida en distintos estudios realizados en EEUU (Paddock et al., 2015). Además, investigaciones realizadas sobre transmisión vertical de otras especies de Rickettsia en garrapatas duras, demostraron que la infección primaria de los ovarios por una especie de Rickettsia, excluye la infección ovárica por otra especie (Macaluso et al., 2002).
Por último, desde una perspectiva sanitaria, "Ca. R. andeanae" permanece como una bacteria de patogenicidad desconocida para humanos y animales. Sin embargo, otros simbiontes rickettsiales, como Rickettsia amblyommatis (="Candidatus Rickettsia amblyommii") y R. montanensis se han relacionado con patología en humanos, perros y otros animales (Paddock et al., 2015).
En conclusión, la circulación del género Rickettsia en San Luis plantea la necesidad de realizar futuras investigaciones especialmente en garrapatas asociadas a animales de compañía, para lograr un mayor conocimiento del riesgo potencial de transmisión de rickettsiosis en la región.
Bibliografía
1. Abarca K, López J, Acosta-Jamett G, Martinez-Valdebenito C. 2013. Identificación de Rickettsia andeanae en dos regiones de Chile. Rev. Chil. Infectología. 30: 388-394. [ Links ]
2. Blair PJ, Schoeler GB, Moron C, Anaya E, Caceda R, Cespedes M, Cruz C, Felices V, Guevara C, Huaman A, Luckett R, Mendoza L, Richards AL, Rios Z, Sumner JW, Villaseca P, Olson JG. 2004. Evidence of Rickettsial and Leptospira infections in Andean northern Peru. Am. J. Trop. Med. Hyg. 70: 357-363. [ Links ]
3. Cicuttin GL. 2014. Rickettsiosis urbanas: Rickettsia massiliae. (pp. 281-286). En: Basualdo Farjat J, Enría D, Martino P, Rosenzvit M, Seijo A (eds.). Temas de Zoonosis VI. Ed. Asociación Argentina de Zoonosis, Buenos Aires. [ Links ]
4. Del Vitto LA, Petenatti EM, Nellar MM, Petenatti ME. 1994. Las áreas naturales protegidas de San Luis, Argentina. Multequina. 3: 141-156. [ Links ]
5. Estrada-Peña A, Venzal JM, Mangold AJ, Cafrune MM, Guglielmone AA. 2005. The Amblyomma maculatum Koch, 1844 (Acari: Ixodidae: Amblyomminae) tick group: diagnostic characters, description of the larva of A. parvitarsum Neumann, 1901, 16S rDNA sequences, distribution and hosts. Syst. Parasitol. 60: 99-112. [ Links ]
6. Guglielmone AA, Mangold AJ, Luciani CE, Viñabal AE. 2000. Amblyomma tigrinum (Acari: Ixodidae) in relation to phytogeography of central-northern Argentina with notes on hosts and seasonal distribution. Exp. Appl. Acarol. 24: 983-989. [ Links ]
7. Jado I, Escudero R, Gil H, Jiménez-Alonso MI, Sousa R, García-Pérez AL, Rodríguez-Vargas M, Lobo B, Anda P. 2006. Molecular method for identification of Rickettsia species in clinical and environmental samples. J. Clin. Microbiol. 44: 4572-4576. [ Links ]
8. Labruna MB, McBride J, Bouyer DH, Camargo LMA, Camargo EP, Walker DH. 2004. Molecular evidence for a spotted fever group Rickettsia species in the tick Amblyomma longirostre in Brazil. J. Med. Entomol. 41: 533-537. [ Links ]
9. Lado P, Castro O, Labruna MB, Venzal JM. 2014. First molecular detection of Rickettsia parkeri in Amblyomma tigrinum and Amblyomma dubitatum ticks from Uruguay. Ticks Tick Borne Dis. 5: 660-662. [ Links ]
10. Macaluso KR, Sonenshine DE, Ceraul SM, Azad AF. 2002. Rickettsial infection in Dermacentor variabilis (Acari: Ixodidae) inhibits transovarial transmission of a second Rickettsia. J. Med. Entomol. 39: 809-813. [ Links ]
11. Nava S, Lareschi M, Abba A, Beldomenico P, Venzal J, Mangold A, Guglielmone A. 2006. Larvae and nymphs of Amblyomma tigrinum Koch, 1844 and Amblyomma triste Koch, 1844 (Acari: Ixodidae) naturally parasitizing sigmodontinae rodents. Acarologia 56: 135-141. [ Links ]
12. Nava S, Mangold AJ, Guglielmone AA. 2009. Seasonal distribution of larvae and nymphs of Amblyomma tigrinum Koch , 1844 (Acari: Ixodidae). Vet. Parasitol. 166: 340-342. [ Links ]
13. Ogrzewalska M, Literak I, Martins TF, Labruna MB. 2014. Rickettsial infections in ticks from wild birds in Paraguay. Ticks Tick Borne Dis. 5: 83-89. [ Links ]
14. Pacheco RC, Moraes-Filho J, Nava S, Brandão PE, Richtzenhain LJ, Labruna MB. 2007. Detection of a novel spotted fever group rickettsia in Amblyomma parvum ticks (Acari: Ixodidae) from Argentina. Exp. Appl. Acarol. 43: 63-71. [ Links ]
15. Paddock CD, Denison AM, Dryden MW, Noden BH, Lash RR, Abdelghani SS, Evans AE, Kelly AR, Hecht JA, Karpathy SE, Ganta RR, Little SE. 2015. High prevalence of "Candidatus Rickettsia andeanae" and apparent exclusion of Rickettsia parkeri in adult Amblyomma maculatum (Acari: Ixodidae) from Kansas and Oklahoma. Ticks Tick Borne Dis. 6: 297-302. [ Links ]
16. Regnery R, Spruill C, Plikaytis B. 1991. Genotypic identification of rickettsiae and estimation of intraspecies sequence divergence for portions of two rickettsial genes. J. Bacteriol. 173: 1576-1589. [ Links ]
17. Romer Y, Nava S, Govedic F, Cicuttin G, Denison AM, Singleton J, Kelly AJ, Kato CY, Paddock CD. 2014. Rickettsia parkeri Rickettsiosis in Different Ecological Regions of Argentina and Its Association with Amblyomma tigrinum as a Potential Vector. Am. J. Trop. Med. Hyg. 91: 1156-1160. [ Links ]
18. Saracho-Bottero MN, Tarragona EL, Nava S. 2015. Spotted fever group rickettsiae in Amblyomma ticks likely to infest humans in rural areas from northwestern Argentina. Medicina (Buenos Aires). 75: 391-395. [ Links ]
19. Solano-Gallego L, Trotta M, Caldin M, Furlanello T. 2008. Molecular survey of Rickettsia spp. in sick dogs in Italy. Zoonoses Public Health. 55: 521-525. [ Links ]
20. Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: Molecular Evolutionary Genetics Analysis using Maximum Likelihood, Evolutionary Distance, and Maximum Parsimony Methods. Mol. Biol. Evol. 28: 2731-2739. [ Links ]
21. Tomassone L, Nuñez P, Ceballos L, Gürtler R, Kitron U, Farber M. 2010a. Detection of "Candidatus Rickettsia sp. strain Argentina" and Rickettsia bellii in Amblyomma ticks (Acari: Ixodidae) from Northern Argentina. Exp. Appl. Acarol. 52: 93-100. [ Links ]
22. Tomassone L, Conte V, Parrilla G, Meneghi D. 2010b. Rickettsia infection in dogs and Rickettsia parkeri in Amblyomma tigrinum ticks, Cochabamba Department, Bolivia. Vector borne zoonotic Dis. 10: 953-958. [ Links ]














