Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista FAVE. Sección Ciencias veterinarias
versión On-line ISSN 2362-5589
FAVE, Secc. Cienc. vet. vol.17 no.2 Santa Fe dic. 2018
COMUNICACIÓN CORTA
Brote de “pie de festuca” en un rodeo de cría de Salta, Argentina
Sandoval GV1, Aguirre LS1, Araoz V2, Rada M3, Micheloud JF1,2*
1 Facultad de Ciencias Agrarias y Veterinarias-UCASAL.
2 Área de Salud Animal, Instituto Nacional de Tecnología Agropecuaria (INTA), Centro de Investigaciones Agropecuarias (CIAP) Córdoba / Instituto de Investigación Animal del Chaco Semiárido (IIACS) Salta, Argentina.
3 Actividad profesional privada.
* Correspondencia: JF Micheloud. Área de Sanidad Animal-IIACS Salta/INTA. RN 68, km 72- Salta, Argentina. E-mail: micheloud.juan@correo.inta.gob.ar
Editor: P. Beldomenico
doi: https://doi.org/10.14409/favecv.v17i2.7581
Recibido: 13 Junio 2018.
Aceptado: 11 Julio 2018.
Disponible en línea: 26 Julio 2018
RESUMEN
Festuca arundinacea es una gramínea perenne de uso forrajero muy difundida mundialmente. Aquí se describe un brote de “pie de festuca” en el Noroeste Argentino que afectó a un rodeo de cría con una incidencia del 5%. Los signos clínicos fueron claudicación, edema en los miembros, gangrena en las extremidades y exungulación. La pastura donde los animales permanecían correspondía a un lote naturalizado de festuca siendo el nivel de infestación con Neotyphodium coenophialum del 71%. El cuadro de pie de festuca es muy conocido pero poco informado en Argentina. En el brote el diagnostico se confirmó por los antecedentes clínicos y epidemiológicos sumado al elevado grado de infestación del hongo en la pastura. La toxicidad de la festuca es un problema mundialmente distribuido y en Argentina ha sido más estudiado en la región centro del país. Los antecedentes de toxicidad de esta especie son escasos y aislados en el Noroeste Argentino.
Palabras clave: Festuca; Plantas toxicas; Neotyphodium coenophialum; Ergoalcaloides.
SUMMARY
Outbreak of fescue foot in a livestock in Salta, Argentina
Festuca arundinacea is a perennial grass which use as forage is widespread worldwide. This report describes a “fescue foot” outbreak in the Northwest of Argentina. Beef cattle herd were affected and the incidence was 5%. The clinical signs were claudication, edema in the limbs, gangrene in the extremities and exungulation. The grazing areas where the animals remained corresponded to a natural batch of fescue. Neotyphodium coenophialum infestation level was 71%. The clinical presentation of fescue root is well described but barely reported in Argentina. In the outbreak presented here diagnosis was confirmed by the clinical and epidemiological antecedents as well as the high level of infestation of the pasture. The toxicity of fescue is a worldwide distributed problem. In Argentina, the disease is well known in the central region of the country. Scarce information is available regarding the toxicity of this species for northwestern Argentina.
Key words: Fescue; Poisoning plants; Neotyphodium coenophialum; Ergot alkaloids.
Festuca arundinacea (Schreb), Fam. Poaceae, es una gra-mínea forrajera, perenne de crecimiento otoño-inverno-primaveral, de gran valor debido a su plasticidad, producción y persistencia (Borrajo, 2016; Campero, 1996). Esta especie es resistente a la sequía y se adapta a zonas con poco drenaje y distintos tipos de suelos (Dennis, 2011). La festuca una vez implantada se caracteriza por su agresividad, persistencia y resistencia al pisoteo (Borrajo, 2016). Su toxicidad es conocida desde hace años y se debe a la presencia de ergoalcaloides producidos por el hongo endófito Neotyphodium coenophialum (Fam. Clavicipitaceae), que se transmite a través de la semilla (Dennis, 2011). Estos ergoalcaloides (ergovalina, ergo-valinina y chanoclavina) son capaces de producir alteraciones orgánicas múltiples (Smith et al., 2010). Su estruc-tura química está emparentada con los alcaloides del cornezuelo (Flieger et al., 1997) y comparten similitudes con las aminas biológicas norepinefrina, dopamina y serotonina (Berde et al., 1978; Pertz y Eckart, 1999). Particularmente, se demostró la acción de la ergovalina sobre los receptores de estos neurotransmisores. Este agonismo induce contracción de las paredes vasculares que resultan en los efectos tóxicos de la festuca (Dyer, 1993; Campero, 1996).
La festucosis en los bovinos puede desencadenar dos cuadros clínicos bien diferenciables: 1) síndrome distérmico y 2) “pie de festuca” (Campero, 1996). El síndrome distérmico es la forma de más frecuente presentación y se da en condiciones de temperatura y humedad ambiente elevadas (Hemken et al.; 1979). Los animales afectados cursan con hipertermia, sialorrea, polipnea, caída del consumo y descenso en la producción de leche (Campero, 1996). Por otro lado, el pie de festuca es una forma de presentación menos frecuente y se caracteriza por cuadros de gangrena seca en miembros, cola, orejas, etc. (Smith et al.; 2010). Esta última forma de presentación, si bien es históricamente conocida en Argentina, ha sido poco reportada según los antecedentes bibliográficos. El objetivo de este trabajo es describir un brote de pie de festuca en el Noroeste argentino, poniendo énfasis sobre aspectos clínicos, epidemiológicos y patológicos de la enfermedad.
El brote ocurrió en noviembre de 2015 en un establecimiento ganadero dedicado a la cría bovina ubicado próximo a la localidad de “El Carril” en la provincia de Salta, Argentina. El motivo de la consulta fue la aparición de lesiones podales con gangrena. El rodeo estaba compuesto por alrededor de 400 vacas adultas de raza Bradford con ternero al pie. Al momento de la inter-vención, la tropa se encontraba en un lote de festuca naturalizado en estado de anegación parcial debido a la presencia de vertientes y cursos de agua dentro del potrero. La abundancia de F. arundinacea fue del 90% aproximadamente. Según los datos anamnésicos, el productor indicó que los primeros casos ocurrieron en el mes de julio previo. Durante la visita, se procedió a inspeccionar el lote y los animales enfermos. Se identificaron unos 11 animales afectados con gangrena bilateral de los miembros posteriores y unos 20 animales con gangrena del extremo de la cola. Inicialmente los miembros afec-tados presentaban edema que posteriormente progresaba a necrosis (gangrena) y finalmente terminaba con la exungulación del miembro (Fig. 1). Desde el inicio de los signos se observó severa claudicación y pérdida de peso.

Figura 1. A- vaca afectada con gangrena bilateral de los miembros posteriores. B- Detalle de uno de los miembros afectados donde se puede apreciar la línea de gangrena. C-Potrero problema con festuca naturalizada. En el inserto de la imagen se aprecia la inflorescencia de la planta. D- Planta de festuca consumida.
Debido a la sospecha de la enfermedad, se colectaron muestras de pastura de dos de los lotes problemas para determinar el porcentaje de infestación de festuca me-diante el método descripto por Casaro et al. (1987). En los dos lotes analizados el porcentaje de infestación fue del 71%. En la Fig. 2 se muestra la microscopia de N. coenophialum. Este hongo es endocelular y se distribuye en toda la planta (excepto en la raíz) sin afectar la apariencia externa de la misma (Dennis, 2011). El material proveniente de los macollos es ideal para el diagnóstico de su presencia. Como ya se mencionó, N. coenophialum se trasmite a través de la semilla por lo que hoy se comercializan variedades libres (Dennis, 2011; Borrajo, 2016). Sin embargo, el porcentaje de infestación de plantas se incrementa año a año dentro del lote. La presencia del hongo dentro de la pastura asegura su diseminación y la sobrevivencia de la misma ya que N. coenophialum incrementa su tolerancia a factores de estrés ambientales y su habilidad competitiva frente a plantas no infectadas (Bence, 2015; Bacon et al., 1984). De este modo, en festucas viejas o naturalizadas (como en este caso) la presencia del endófito es inevitable (Bence, 2015).
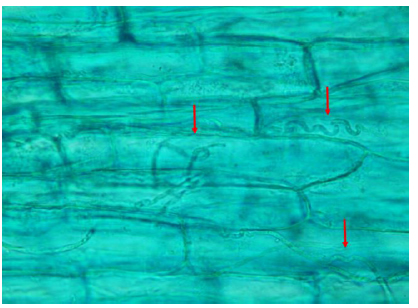
Figura 2. Estructuras fúngicas (flechas) típicas en tallos finos infectados por Neotyphodium ceonophyalum.
Los ergoalcaloides sintetizados por N. coenophialum son los principales agentes causantes de la toxicidad de la festuca (Strickland et al., 2011). A causa del efecto perjudicial de las pasturas de festuca infectadas, el Instituto Nacional de Semillas (INASE), en su Resolución 067/95 ha establecido niveles de tolerancia del hongo en semillas ofrecidas en el mercado. Según éste sólo se aceptan porcentajes de infección inferiores al 5%, y dicha información debe acompañar los rótulos de los lotes comercializados (INASE, 1995). Otro factor que puede afectar la toxicidad de la festuca es la variación en la concentración de dichos alcaloides, que se modifica durante las diferentes estaciones del año y de acuerdo con el estado fenológico de las plantas (Borrajo, 2016). Por otro lado su nivel se incrementa con la fertilización nitrogenada y el déficit hídrico (Smith et al., 2010).
Los ergoalcaloides son resistentes a la degradación ruminal y se absorben a nivel intestinal (Hill, 1994). Una vez en circulación se unen a los receptores adrenérgicos en el músculo liso y actúan como agonistas estimulando la vasoconstricción periférica (Klotz, et al., 2007). En el caso del pie de festuca, el bloqueo adrenérgico da lugar a una vasoconstricción persistente que genera disminución general del flujo sanguíneo a las extremidades dando como resultado la gangrena (Vuong, et al., 2002). Normalmente se ven afectadas las porciones distales de los miembros, pero la gangrena también puede ocurrir en las orejas, la cola e incluso en la piel del tronco (Smith et al., 2010). En general, el daño en los miembros es tan severo que ocurre exungulación y pérdida de las falanges. El efecto de los ergoalcaloides y los cuadros clínicos varían según las condiciones climáticas, en el caso del pie festuca las temperaturas bajas (0 C° o menos) reducen la circulación periférica y exacerban el efecto vasoconstrictor de los alcaloides (Garner et al., 1984). En este brote, tal como se menciona anteriormente, los casos comenzaron en los meses más fríos, detectándose los primeros individuos afectados en julio. Según datos históricos climáticos en Salta (climate-Data.org) las temperaturas mínimas registradas fueron de 1,6°C en julio, de 3°C en agosto, de 7,3 °C en septiembre, de 10,9°C en octubre y de 13,6°C en noviembre. Otro factor que pudo agravar las condiciones fue el encharcamiento de las áreas de pastoreo (Bence, 2015). En general la morbilidad es reducida, aunque en algunas circunstancias puede verse afectado el 20- 30% del rodeo (Smith et al., 2010). En el brote aquí descripto los animales afectados con lesiones severas constituían aproximadamente el 5 %.
En Argentina la toxicidad de la festuca es bien conocida, aunque las descripciones de pie de festuca son aisladas. Uno de los reportes más importantes fue descripto por el INTA EEA-Balcarce en el año 1972 en vacas de cría de la zona de General Lamadrid. En este brote la necrosis de extremidades se presentó luego de un período de pastoreo de 90 días sobre festuca tóxica (Campero, 1996). En nuestro caso se estimaron un período de 120 días de exposición y los casos empezaron al comienzo del invierno. En el NOA no hay registros de antecedentes de este cuadro, aunque en la década del '80, Habich et al. (1983), describieron un brote de síndrome distérmico en vacas pastoreando un potrero con festuca en el Valle de Lerma, provincia de Salta.
La difusión del cultivo de festuca en Argentina se inició en las décadas del ´50-´60 (Campero, 1996). En el NOA está pastura fue empleada inicialmente pero luego cayó en desuso y hoy persiste en algunas áreas como especie naturalizada. El consumo de festuca tóxica genera severas pérdidas subclínicas (Dennis, 2011). Entre ellas se señalan una menor ganancia diaria de peso y disminución de la ingesta voluntaria (Osborn et al., 1988). Estos efectos se atribuyen principalmente a cambios hormonales, como la disminución de la prolactina sérica (Thompson et al., 1987).
Ante la presencia de lesiones gangrenosas como las observadas en ese caso deben tenerse en cuenta otras causas posibles como la intoxicación por Claviceps purpurea. De hecho, los signos del pie de festuca son idénticos a los del ergotismo gangrenoso (Smith et al., 2010). En nuestro caso esto fue descartado ya que no se encontraron los esclerotos típicos de esta especie.
La intoxicación por festuca está bien descripta en la región central del país (Borrajo, 2016). En el NOA los registros se limitan a un único brote en vacas de leche (Habich, 1983). Pese a esto, la naturalización de esta forrajera en algunos pastizales indica que debe ser tenida en cuenta como especie toxica en la región. El brote de la enfermedad que presentamos en esta comunicación alerta sobre su toxicidad y pone en evidencia el desconocimiento regional que se tiene sobre la especie. En los potreros donde esta especie sea dominante es recomendable evaluar el nivel de infestación de la pastura.
Es necesario un correcto examen clínico de los animales afectados identificando las lesiones características, contemplando siempre los factores externos que influyen en la aparición de estos brotes. Finalmente, a pesar de la gran difusión de los efectos nocivos de la festuca tóxica, existen zonas en nuestro país donde la eliminación de la pastura produciría pérdidas económicas mayores que su uso. Por lo anteriormente mencionado, son necesarias más investigaciones a fin de poder establecerse medidas de manejo tendientes a mitigar el efecto tóxico de esta especie vegetal.
Bibliografía
1. Bacon CW, Lyons PC, Porter JK, Robbins JD. 1984. Ergot toxicity from endophyte infected grasses: A review. Agronomy J. 78: 106-116. [ Links ]
2. Bence A, Cantón G, Odriozola E. 2015. Festucas tóxicas. Información y recomendaciones de manejo. Grupo de Sanidad Animal. INTA Balcarce. Visión Rural N° 108. [ Links ]
3. Berde B, Stürmer E. 1978. Introduction to the pharmacology of Ergot Alkaloids and related compounds as a basis of their therapeutic action. En: Ergot Alkaloids and Related Compounds. Berde, B., Schild, H.O. Springer, Berlin, Germany. Pp. 1-28. [ Links ]
4. Borrajo CI. 2016. Festucas y festucosis: explorando alternativas. Divulgación INTA. https://inta.gob.ar/sites/default/files/inta_festucas_y_festucosis_alternativas_2016.pdf [ Links ]
5. Campero CM. 1996. Efectos de la festuca tóxica sobre el desempeño reproductivo y producción en bovinos; una revisión. Therios 132: 306-316. [ Links ]
6. Casaro AO, Odeon A, Poso MA. 1987. Muestreo, coloración y diagnóstico microscópico de Acremonium coenophialum en plantas y semillas. Memorias de la II Reunión Anual de la Asoc. Arg. Vet. Lab. Diag. Pp. 59-60. [ Links ]
7. Dyer DC. 1993. Evidence that ergovaline acts on serotonin receptors. Life Sci. 53: 223-228. [ Links ]
8. Flieger M, Wurst M, Shelby R.1997. Ergot alkaloids. Sources, structures and analytical methods. Folia Microbiol. 42: 3-30. [ Links ]
9. Garner GB, Morrow R, Fairbrother T, Gerrish J, Nelson C. 1984. Nursing cow, calves, and steers response to simultaneously grazed tall fescue pastures with varying levels of endophyte E. typhina. Proceedings of the Forage and Grassland Conference. Pp. 46-250. [ Links ]
10. Habich GE, Echaide IE, González RN. 1983. Efecto de la temperatura ambiente sobre parámetros clínicos de vacas con festuquismo estival. Med. Vet. (Bs. As) 64: 83-96. [ Links ]
11. Hemken RW, Bull LS, Boling JA, Kane E, Bush LP, Buckner RC. 1979. Summer fescue toxicosis lactanting dairy cows and sheep fed experimental strains of ryegrass-tall fescue hybrids. J. Anim. Sci. 49: 641-646. [ Links ]
12. Hill NS, Thompson FN, Dawe DL, Stuedemann JA. 1994. Antibody binding of circulating ergot alkaloids in cattle grazing tall fescue. Am. J. Vet. Res. 55: 419-424. [ Links ]
13. Klotz JL, Bush LP, Smith DL, Shafer W.D, Smith LL, Arrington BC, Strickland JR. 2007. Ergovaline induced vasoconstriction in an isolated bovine lateral saphenous vein bioassay. J. Anim. Sci. 85: 2330-2336. [ Links ]
14. Osborn TG. 1988. Effect of consuming fungus infected and fungus free tall fescue and ergotamine tartate on certain physiological variables of cattle in environmentally controlled conditions. M.S. Thesis. Auburn Universil AL, 123 pp. [ Links ]
15. Pertz HH, Eckart E. 1999. Ergot Alkaloids and their derivatives as ligands for serotoninergic, dopaminergic, and adrenergic receptors. En: Kren V, Cvak L (ed), Ergot: the genus Claviceps. Harwood Academic Publishers, Amsterdam, The Netherlands. Pp. 411-440 [ Links ]
16. Smith BP. 2010. Trastornos de los huesos, las articulaciones y el tejido conjuntivo. En: Dawis EW (ed). Medicina interna de grandes animales. 4ta edición. Elsevier España S.A. Pp: 1234 [ Links ]
17. Strickland JR, Looper ML, Matthews JC, Rosenkrans CF Jr, Flythe MD, Brown KR. 2011. Board-invited review: St. Anthony's fire in livestock: causes, mechanisms, and potential solutions. J. Anim. Sci. 89: 1603-1626. [ Links ]
18. Thompson FN, Stuedeman JA, Sartin JL, Belesky DP, Devine OJ. 1987. Selected hormonal changes with summer fescue toxicosis. J. Anim. Sci. 65: 727-733. [ Links ]
19. Vuong PN, Berry C. 2002. Fundamental lesions in vascular pathology. En: The Pathology of Vessels. Springer, Paris. Pp 35-67. [ Links ]














