Introducción
La ehrlichiosis monocítica canina (EMC) es una enfermedad que afecta caninos domésticos a nivel mundial, de importancia en la clínica veterinaria debido a la gravedad de sus síntomas, produciendo inclusive la muerte de los animales (Harrus et al., 1997). Su agente causal, Ehrlichia canis, es una bacteria intracitoplasmática, Gram negativa, que pertenece a la familia Anaplasmataceae, orden Rickettsiales. Morfológicamente es una bacteria pleomórfica y se dispone en forma individual o en agrupaciones compactas (mórulas) dentro del fagosoma de monocitos, linfocitos y/o macrófagos (Dumler et al., 2001). Esta bacteria es transmitida a un hospedador susceptible por ninfas y adultos de garrapatas pertenecientes al complejo Rhipicephalus sanguineus sensu lato (s.l.) (Bremer et al., 2005; Groves et al., 1975). Tras su inoculación, luego de un período de 8 a 20 días de incubación, el curso de la infección por E. canis se puede dividir secuencialmente en una fase aguda (de 2 a 4 semanas de duración), una fase subclínica (meses a años de duración) y una fase crónica. Fiebre, letargia, depresión, anorexia, linfadenomegalia, esplenomegalia, anemia, citopenias, trombocitopenia, tendencia al sangrado, uveítis, petequias, equimosis subcutáneas, melena, ataxia, disfunción vestibular, edema escrotal, neumonía, entre otras manifestaciones clínicas y alteraciones hematológicas, han sido descriptas en perros con EMC (Codner y Farris-Smith, 1986; Harrus, 2015; Harrus y Waner, 2011; Harrus et al., 1999; Komnenou et al., 2007; Mylonakis et al., 2011; Reardon y Pierce, 1981; Woody y Hoskins, 1991). Durante la fase subclínica pueden observarse alteraciones leves en el hemograma, como citopenias, fiebre intermitente y esplenomegalia. Este estado puede mantenerse por meses o años, o evolucionar hacia la forma crónica y muchas veces fatal de la enfermedad (Waner et al., 1997).
En cuanto al diagnóstico, dentro de los métodos directos, el examen citológico mediante la observación de mórulas en extendidos de sangre periférica tiene baja sensibilidad, aumentando si se utiliza la tinción de la capa leucocitaria (buffy-coat) o linfonódulo (Mylonakis et al., 2003; Woody y Hoskins, 1991). Además, técnicas moleculares como la PCR (reacción en cadena de la polimerasa) y la secuenciación, pueden permitir un diagnóstico prematuro y específico de la EMC. Con respecto a métodos indirectos, existen técnicas serológicas cuali y cuantitativas accesibles para el veterinario clínico, aunque solo indican exposición al agente si no se demuestra la seroconversión (Harrus y Waner, 2011; Iqbal et al., 1994).
En el cono sur de América, se ha demostrado la presencia de al menos dos especies de garrapatas pertenecientes al complejo R. sanguineus, cuya distribución y competencia vectorial en la transmisión de E. canis son diferentes (Moraes-Filho et al., 2015, Cicuttin et al., 2017). Una corresponde a R. sanguineus sensu stricto (descripta anteriormente como R. sanguineus s.l. “linaje templado”), que se distribuye en partes de Europa, Argentina, Chile, Uruguay, sur de Brasil y EE.UU., sobre la cual existen escasas evidencias sobre su capacidad vectorial para transmitir E. canis (Cicuttin et al., 2017; Nava et al., 2018). En cambio, la otra especie, R. sanguineus s.l. “linaje tropical”, que en Sudamérica se distribuye principalmente en regiones tropicales, incluyendo el norte de Argentina y Chile y gran parte de Brasil, es un vector comprobado de E. canis(Cicuttin et al., 2015; Moraes-Filho et al., 2015; Nava et al., 2018).
Sobre la situación epidemiológica de la EMC por E. canis en Argentina, casos clínicos han sido reportados para el Área Metropolitana de Buenos Aires (AMBA), con la confirmación de E. canis mediante detección molecular (Eiras et al., 2013; Cicuttin et al., 2016), así como recientemente en Santa Fe (Tarragona et al., 2019). También ha sido reportada en R. sanguineus s.l. en Formosa y en R. sanguineus s.s. en Buenos Aires (Cicuttin et al., 2015, 2016, 2017; Borrás et al., 2019). En la provincia de Mendoza se halló evidencia serológica en perros (Mera y Sierra y Neira, 2014). Mientras que para la provincia de San Luis existe un reporte de un canino con hallazgos de mórulas en extendidos sanguíneos y PCR positiva para la familia Anaplasmataceae (Aubert et al., 2016). En Chaco el 51% de muestras caninas con sospecha de hemoparásitos fue diagnosticado como Ehrlichia sp. en extendidos sanguíneos y/o de médula ósea (Brunel y Cainzos, 2018).
El objetivo del siguiente trabajo fue confirmar la presencia de E. canis por diagnóstico molecular, a partir de muestras de perros con diagnósticos presuntivos, oriundos de la ciudad de Concordia, provincia de Entre Ríos.
Materiales y Métodos
Las muestras utilizadas en el presente estudio corresponden a 53 caninos diagnosticados con presencia de mórulas de Ehrlichia sp. durante noviembre de 2017 a diciembre de 2019 en el Laboratorio Mesopotámico de Diagnóstico Veterinario (Concordia, Entre Ríos).
Los diagnósticos se realizaron a partir de muestras de sangre con ácido etilendiaminotetraacético (EDTA), enviadas para hemograma y/o para diagnóstico de hemoparásitos mediante la observación de un extendido sanguíneo y de la capa leucocitaria (buffy coat) teñidos con tinción de May Grunwald-Giemsa. Las mórulas se observaron como formaciones basófilas redondeadas o irregulares en infecciones únicas o múltiples en el citoplasma de monocitos y linfocitos (Figura 1a, b, c). En algunos monocitos se observaron formas cocobacilares difusamente agrupadas (Figura 1d).
Complementariamente, a las muestras enviadas para hemograma, se les realizó además una estimación del número de plaquetas al extendido, tomando el número promedio de plaquetas en 10 campos del área de monocapa a 1000x de magnificación. Valores promedio por debajo de ocho plaquetas por campo fueron considerados como inadecuados (Paltrinieri et al., 2018). Las muestras de sangre positivas mediante extendidos sanguíneos a la presencia de mórulas de Ehrlichia sp., fueron conservadas a -20°C. De estas muestras, 14 fueron seleccionadas al azar para realizar la detección molecular de representantes de la familia Anaplasmataceae en el Laboratorio de Vectores y Enfermedades Transmitidas de la Universidad de la República (Salto–Uruguay). A partir de 200 µl de sangre se realizó la extracción de ADN utilizando el kit comercial PureLink®Genomic DNA Mini Kit (Invitrogen, Alemania) siguiendo las instrucciones del fabricante. La calidad y concentración del ADN fue cuantificada con un espectrofotómetro Nanodrop 2000 (Thermo Fisher Scientific, Waltham, MA, USA). Con el ADN obtenido se realizó una primer PCR a modo de tamizaje utilizando los cebadores EHR16SD (5′-GGTACCYACAGAAGAAGTCC-3′) y EHR16SR (5′-TAGCACTCATCGTTTACAGC-3′) que amplifican un fragmento de 345 pb del gen ARNr 16S de la familia Anaplasmataceae, incluidos los géneros Anaplasma, Ehrlichia, Neorickettsia y Wolbachia(Parola et al., 2000). Agua de grado molecular fue utilizada como control negativo y ADN de Anaplasma marginale como control positivo.
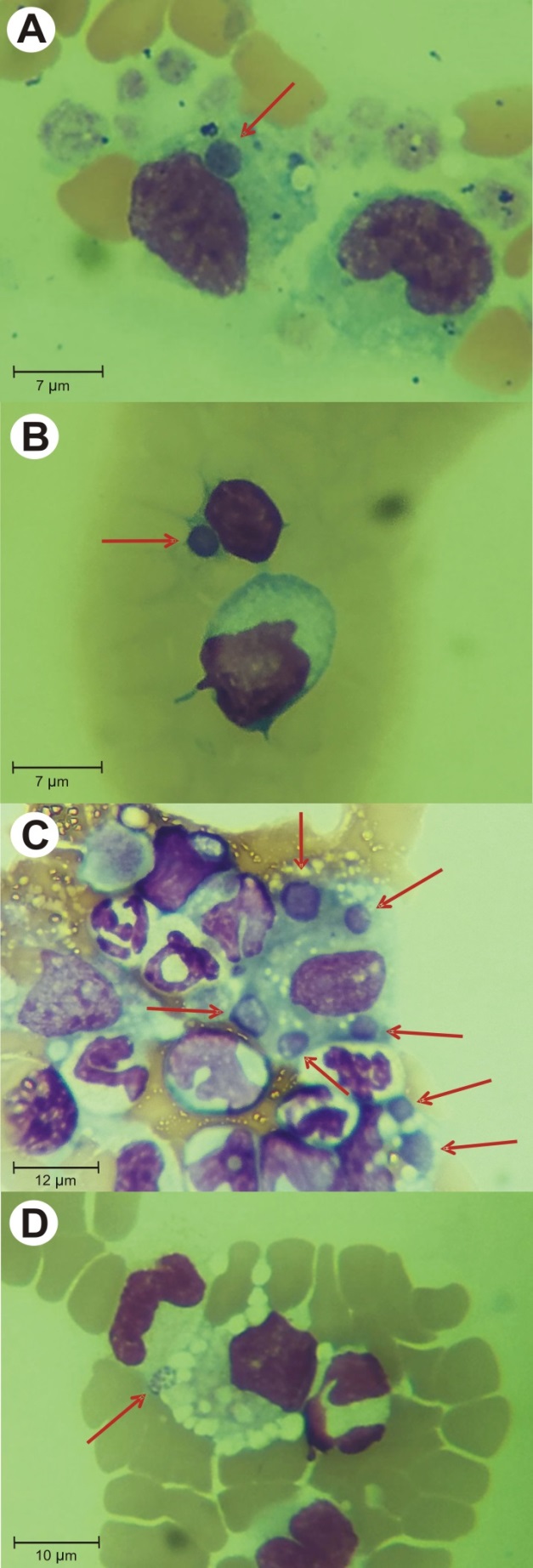
Figura 1. A) Monocito con una mórula compacta de Ehrlichia sp. (indicada con flecha roja). B) Linfocito con una mórula compacta de Ehrlichia sp. (indicada con flecha roja). C) Monocitos con mórulas múltiples de Ehrlichia sp. (indicadas con flechas rojas). D) Monocito con mórula difusa de Ehrlichia sp. (indicada con flecha roja).
Posteriormente, a las muestras positivas a esta PCR, se les realizaron otras dos PCRs con cebadores específicos para la detección de Ehrlichia spp. y Anaplasma platys. La detección de ADN de Ehrlichia spp. se realizó mediante una PCR semianidada dirigida al gen dsb (Disulfuro oxidoreductasa) siguiendo los protocolos descriptos por Doyle et al. (2005) y Almeida et al. (2013). La primera reacción se realizó usando los cebadores Dsb-330 (5′-GATGATGTTTGAAGATATSAAA CAAAT-3′) y Dsb-720 (5′-CTATTTTACTTCTTAAAGTTG ATAWATC-3′) que amplifican un fragmento de 401 pb y la segunda reacción con los cebadores Dsb-380 (5′-ATTTTTAGRGATTTTCCAATACTTGG-3′) y Dsb-720 que amplifican un fragmento de 349 pb. Para la detección de ADN de A. platys se utilizaron los cebadores PLATYS (5′-GATTTTTGTCGTAGCTTGCTATG-3′) y EHR16SR que amplifican un fragmento de 678 pb del ARNr 16S siguiendo a Inokuma et al. (2000).
Adicionalmente se colectaron garrapatas de perros presuntivos a EMC, las que fueron determinadas morfológicamente en el laboratorio mediante una lupa estereoscópica binocular, siguiendo las claves propuestas por Nava et al. (2017) y sometidas a extracción de ADN. Las garrapatas fueron seccionadas longitudinalmente, utilizando una de las mitades para la extracción de ADN, la cual se realizó con el kit comercial anteriormente mencionado. Al ADN obtenido se le realizó la PCR descripta anteriormente para determinar la presencia de ADN de la familia Anaplasmataceae. Además, para caracterizar a que linaje pertenecen estas garrapatas, se realizó una PCR para amplificar un fragmento de aproximadamente 460 pb correspondiente al gen mitocondrial ARNr 16S utilizando los cebadores 16S+1 (5’-CCGGTCTGAACTCAG ATCAAG T-3’) y 16S-1 (5’-GCTCAATGATTTTTTAAATTGCTGTGG-3’) siguiendo a Mangold et al. (1998). Los productos resultantes de las PCRs se verificaron mediante electroforesis en gel de agarosa al 1,5% conteniendo un intercalante GoodViewTM Nucleic Acid Stain (Beijing SBS Genetech Co. LTd), y visualizados bajo un transiluminador UV. Los amplicones de tamaño esperado fueron purificados mediante el kit comercial PureLink® Quick PCR Purification kit (Invitrogen, Alemania) y enviados a secuenciar a la empresa MACROGEN (Seúl, Corea del Sur).
Las secuencias obtenidas fueron editadas y ensambladas utilizando el programa MEGA 7 (Kumar et al., 2016). Para la determinación de las homologías se compararon con secuencias disponibles en el GenBank utilizando la herramienta BLASTn. (https://blast.ncbi.nlm.nih.gov/Blast.cgi)
Resultados
De las 14 muestras de sangre de perros con observación previa de mórulas de Ehrlichia sp. seleccionadas al azar para realizar el diagnóstico molecular por PCR (Tabla 1, Fig. 1 a-d), 12 de ellas presentaron una banda de tamaño esperado en la primera reacción que amplifica un fragmento del ARNr 16S de la familia Anaplasmataceae. Estas muestras también pudieron ser amplificadas mediante la segunda PCR para el gen dsb, especifico del género Ehrlichia (Tabla 1). Las mismas resultaron negativas a la amplificación del ARNr 16S para A. platys. Las secuencias obtenidas del gen dsb demostraron tener entre un 98-100% de homología con secuencias depositadas como E. canis en Genbank. A partir del ADN de una de las muestras positivas del gen dsb (caso perro P1091) se obtuvo una secuencia consenso de 305 pb, la cual fue depositada en GenBank bajo el número de acceso MT163170. Esta secuencia resultó ser idéntica a secuencias de E. canis obtenidas de perros y garrapatas (R. sanguineus s.s./s.l.) de diferentes partes del mundo, incluidas secuencias de Brasil, Chile y Argentina. En los hemogramas de los 12 caninos con diagnóstico molecular de E. canis, se observó: trombocitopenia en el 100%, anemia en el 92%, linfopenia en el 75%, leucopenia en el 42% y neutropenia en el 25% (Tabla 1).
Tabla 1. Identificación, fecha, resultados del hemograma y PCR de las muestras de casos presuntivos a EMC seleccionadas para el diagnóstico molecular de E. canis de la ciudad de Concordia, Entre Ríos. (+)= Presencia; (-)= Ausencia.

* Incluye sólo los animales PCR+ para E. canis.
Solamente se obtuvieron garrapatas del perro P1090, que fueron clasificadas morfológicamente como tres machos y dos ninfas de R. sanguineus. Todas las garrapatas resultaron negativas a la amplificación del ARNr 16S de Anaplasmataceae. A partir del ADN de dos machos de R. sanguineus se amplificó un fragmento del gen mitocondrial ARNr 16S, y se obtuvo una secuencia consenso de 415 pb, depositada en GenBank bajo el número de acceso MT152825, la cual demostró tener entre 99-100% de homología con secuencias de R. sanguineus s.s.
Discusión
Las enfermedades transmitidas por vectores en caninos incluyen una serie de patologías de gran importancia en medicina veterinaria. Su incidencia varía en las diferentes regiones del mundo asociadas a factores como el aumento poblacional y el tránsito de caninos, abundancia de vectores competentes, población canina susceptible, realidad socioeconómica de la población, calentamiento global, entre otros (Gubler, 2009; Harrus y Baneth, 2005; Irwin, 2002). En este trabajo se confirman casos de EMC mediante diagnóstico molecular de E. canis para la ciudad de Concordia, provincia de Entre Ríos (Argentina), en muestras de casos clínicos compatibles donde previamente se habían observado mórulas similares a Ehrlichia sp. Los reportes previos de E. canis en caninos y garrapatas de nuestro país han sido realizados en Buenos Aires, Ciudad Autónoma de Buenos Aires, Santa Fe y Formosa (Eiras et al., 2013; Cicuttin et al., 2015, 2016; Tarragona et al., 2019; Borrás et al., 2019). Su distribución parece ser aún mayor, ya que en Chaco se han reportado un alto porcentaje de perros con mórulas de Ehrlichia sp., y existe evidencia por diagnóstico directo y serológico en perros de San Luis y Mendoza (Brunel y Cainzos, 2018; Aubert et al., 2016; Mera y Sierra y Neira, 2014).
Si bien la presencia de E. canis está asociada a su principal vector, R. sanguineus s.l., hasta el momento, Argentina es el único país del cono sur de América donde se ha logrado determinar E. canis en R. sanguineus s.s. (mencionada previamente como “linaje templado”) y asociarla a casos clínicos de EMC (Cicuttin et al., 2017; Borrás et al., 2019). Esto coincide con nuestro resultado obtenido de las secuencias del gen mitocondrial ARNr 16S, ya que las garrapatas procesadas del perro P1090 se determinaron como R. sanguineus s.s. Aunque estas garrapatas resultaron negativas a la presencia de ADN de E. canis, se observó la presencia de mórulas en el citoplasma de monocitos y linfocitos sanguíneos y la PCR fue positiva para el caso clínico P1090, además en el hemograma se observaron parámetros compatibles con EMC (Tabla 1).
Este nuevo hallazgo de E. canis en la ciudad de Concordia, podría ser explicado basándonos en alguna de las tres hipótesis postuladas por Cicuttin et al. (2017) para el AMBA: 1) una eventual introducción de R. sanguineus s.l. con perros migrantes de áreas endémicas del país y posterior establecimiento durante una temporada favorable climáticamente; 2) que efectiva-mente R. sanguineus s.s. posee competencia vectorial; 3) que directamente llegaran perros infectados a Concordia y que R. sanguineus s.s. se adaptara a transmitirla. En este aspecto son necesarios estudios moleculares en un mayor número de garrapatas para descartar una eventual colonización de R. sanguineus s.l. en la ciudad.
En cuanto al diagnóstico, el método directo mediante extendido sanguíneo carece de sensibilidad, aunque es una herramienta valiosa sobre todo en laboratorios de baja complejidad. La tinción de la capa leucocitaria mejora la sensibilidad de la prueba llevándola al 66 % (Mylonakis et al., 2003). Si bien en algunos casos las mórulas son observadas claramente, existe la posibilidad de encontrar otro tipo de inclusiones que pueden llegar a originar falsos positivos, como por ejemplo restos de colorantes, macrófagos con restos celulares, plaquetas u otro material fagocitado (Mylonakis et al., 2003). La presencia de anemia, trombocitopenia y monocitos activados, es una combinación que fue hallada frecuentemente en animales infectados, aunque no es específico de EMC. El uso del diagnóstico molecular por PCR puede ser complementario a la observación directa de mórulas y a las pruebas serológicas rápidas que son actualmente las de uso de rutina para diagnosticar la EMC. La PCR es un método más sensible, especialmente en la etapa aguda de la infección y detecta la presencia de E. canis antes de que ocurra la seroconversión por anticuerpos (Harrus et al., 2012; Martin et al., 2019). Como desventaja, continúa siendo una técnica más costosa y que requiere mayor inversión en equipamiento e instalaciones, y que puede dar falsos negativos en algunas situaciones (Harrus y Waner, 2011).
En la ciudad de Concordia y alrededores otros patógenos han sido diagnosticados y confirmados en perros mediante PCR como, Leishmania infantum(Sánchez et al., 2011), Rangelia vitalii(Sánchez et al., 2014) y Trypanosoma evansi(Bono Battistoni et al., 2016). También existen diagnósticos mediante visualización directa de Hepatozoon sp., Anaplasma sp., Trypanosoma sp. (Sánchez R.O. datos sin publicar). Debido a que estos patógenos pueden solaparse en su sintomatología, es necesario un diagnóstico correcto, para instaurar el tratamiento adecuado. El diagnóstico de E. canis mediante PCR y secuenciación pudo ser confirmado en 12 de las 14 muestras de perros estudiadas. En base a los resultados obtenidos, se confirma la presencia de E. canis en la ciudad de Concordia, donde la EMC podría ser considerada como una enfermedad emergente y con transmisión de forma autóctona. El precoz diagnóstico de la enfermedad es fundamental para el inicio del tratamiento y lograr un mejor pronóstico de los perros afectados. Dada la amplia distribución de su vector, es de esperar la aparición de más casos a nivel regional por lo cual es fundamental promover el control de vectores mediante uso de productos aprobados para tal fin.













