Introducción
La leptospirosis es considerada una zoonosis mayor, tanto por su amplia distribución geográfica como por su frecuencia. Se estima que anualmente más de 1 millón de personas adquieren la enfermedad, de las cuales hasta 60 mil pueden llegar tener un desenlace fatal (Costa et al., 2015). En Argentina, durante el 2019 se notificaron 2976 casos en total (Ministerio de Salud de la Nación, 2019). Actualmente es considerada una de las zoonosis reemergentes más relevantes por la Organización Mundial de la Salud (OMS) (Karpagam, 2020), lo cual pone en evidencia la gran importancia que representa principalmente para las poblaciones vulnerables del mundo.
La enfermedad es causada por bacterias del género Leptospira spp. que abarca tanto especies capaces de infectar animales (domésticos y silvestres) como especies propias del medioambiente (Faine, 1982). Este género bacteriano, en permanente crecimiento, actual-mente comprende 42 especies clasificadas en 4 subgrupos: P1 (antes conocidas como patógenas), P2 (antes consideradas intermedias), S1 y S2 (antes consideradas saprófitas) (Guglielmini et al., 2019). Los primeros dos subgrupos son capaces de infectar a los animales y a los humanos, mientras que las últimas solo han sido aisladas de muestras ambientales y no existen evidencias hasta el momento de su capacidad de establecer una infección. La transmisión de la enfermedad ocurre por contacto directo con la orina de los animales infectados o de manera indirecta a través de la exposición a fuentes ambientales contaminadas con esta orina (ej. cursos de agua, barro). La leptospirosis puede variar en severidad desde un cuadro febril inespecífico y de curso benigno hasta severos cuadros de falla renal o multiorgánica o de hemorragia pulmonar que llevan a la muerte. La intensidad de la enfermedad depende de diversos factores, tanto del agente como del hospedador (Adler, 2015).
La incidencia de la leptospirosis es mayor en regiones tropicales y subtropicales con abundantes precipitaciones debido a que el ciclo epidemiológico de la enfermedad suele requerir de cursos de agua dulce (Goarant, 2019). Sin embargo, existen escasos estudios sobre esta enfermedad en regiones con climas más áridos. Por ejemplo, en Argentina solamente existen estudios sobre leptospiras en muestras ambientales (aguas) en Santa Fe (Francois, 2013) y Buenos Aires (Gatti, 2004; Scialfa, 2018). A su vez, es sabido que las zoonosis emergentes y reemergentes como la leptospirosis afectan principalmente a las poblaciones de bajos recursos económicos, debido a que las precarias condiciones de infraestructura habitacional predisponen a una mayor exposición a los reservorios y las fuentes de infección (roedores, fuentes de agua dulce como ser charcos o zonas de inundación por ejemplo) (Adler, 2015). Así, la ausencia de información sobre esta enfermedad en las poblaciones vulnerables del norte argentino abre el interrogante del riesgo epidemiológico al cual están expuestas estos grupos poblacionales.
En el presente trabajo, se tomaron muestras ambientales (distintos cursos de agua dulce y barro) de diversas regiones geográficas de las provincias del norte argentino, habitadas por poblaciones de bajos recursos socioeconómicos, con el objetivo de determinar la presencia de leptospiras en las mismas.
Materiales y métodos
Se tomaron muestras de agua dulce (ej. agua de aljibe, de pozo, de represa, entre otros) y barro de distintos puntos geográficos en las provincias de Misiones, Formosa, Chaco, Salta y Santiago del Estero (Figura 1), durante los meses de agosto a diciembre de 2018. Estas localidades fueron seleccionadas por la facilidad de poder realizar el trabajo en terreno con personal local de la Fundación Mundo Sano. Los puntos de muestreo fueron seleccionados a conveniencia teniendo en cuenta las características previamente asociadas a la presencia de la bacteria (i.e. basurales, presencia de animales domésticos o de granja, lugares inundables, etc.).
Al momento del muestreo se anotó para cada muestra los siguientes datos según observación del personal de muestreo: tipo de muestra (agua o barro), tipo de cuerpo de muestreo (pozo, aljibe, río, represa, arroyo, zona inundada, otros), grado de urbanización (zona urbanizada o no urbanizada), presencia de animales (sí, no), presencia de caninos en la zona (sí, no), presencia de basurales a menos de 100 m del sitio de muestreo (sí, no). Estos datos fueron colectados para explorar alguna asociación entre éstas variables y el hallazgo de leptospiras.
Las muestras de agua y barro fueron tomadas en tubos tipo Falcon de 50 mL hasta su capacidad máxima y remitidas refrigeradas al Laboratorio de Leptospirosis (Centro de Referencia de la OIE), Instituto de Patobiología, CICVyA, INTA Castelar, en Buenos Aires, para su procesamiento.
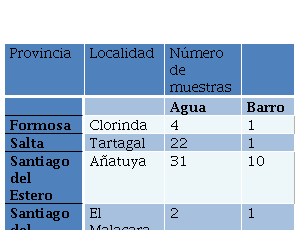
Una vez recibidas en el laboratorio, las mismas se mantuvieron congeladas a -20 °C hasta su procesamiento. Del total de muestras, se seleccionaron 74 aguas y 15 barros para su estudio bacteriológico y molecular (Tabla 1). El presente trabajo es un estudio preliminar, por lo que las muestras fueron seleccionadas en base a los datos recolectados para maximizar las probabilidades de detección bacteriana (ej. presencia de animales, basurales, etc). Las aguas y los barros fueron procesados de distinta forma, según los siguientes protocolos:
1. Muestras de agua: las mismas fueron sometidas a diagnóstico bacteriológico y molecular directo.
Se descongeló el agua a temperatura ambiente.
Se centrifugó a 8000 rpm durante 15 minutos a temperatura ambiente (rotor n° 5, centrífuga modelo RC5C, Sorvall Instruments).
Se sembraron 5 gotas del sobrenadante en 10 mL de medio de cultivo semisólido Fletcher (Difco) suplementado con neomicina (10 mg/L) y 5-fluorouracilo (100 mg/L), por triplicado.
Luego de descartar el 50 % del volumen de agua restante, se centrifugó nuevamente a 13000 rpm durante 10 minutos a 4 °C (rotor n° 5, centrífuga modelo RC5C, Sorvall Instruments).
Se descartó el sobrenadante y se aspiraron 30ml del pellet formado para extracción de ADN con resina Chelex-100 (BioRad) según protocolo establecido (Grune, 2014).
El ADN extraído fue sometido a una PCR dúplex a punto final diseñada in house para detectar y diferenciar Leptospira spp. de los subgrupos P1 y P2 en un mismo paso (ver más adelante).
2. Muestras de barro: fueron sometidas a diagnóstico bacteriológico.
Se descongeló el barro a temperatura ambiente y se alicuotaron 5 g en otro tubo tipo Falcon de 50 mL.
Se agregaron 30 mL de PBS estéril (pH 8), se agitó vigorosamente para homogeneizar la muestra y se dejó decantar durante 2 horas a temperatura ambiente.
Se sembraron 5 gotas del sobrenadante en mL de medio de cultivo semisólido Fletcher (Difco) suplementado con neomicina (10 mg/L) y 5-fluorouracilo (100 mg/L), por triplicado.
Los cultivos se incubaron a 30 °C en aerobiosis y se controlaron con microscopía de campo oscuro cada 15 días en busca de crecimiento de bacterias compatibles por morfología y motilidad con Leptospira spp.
A todos aquellos cultivos que presentaron desarrollo de bacterias sospechosas de Leptospira spp. (aguas y barros) se les extrajo ADN mediante el uso de la resina Chelex-100 y se sometió el templado a una PCR dúplex para detectar la presencia de leptospiras de los subgrupos P1 y P2. Los controles positivos utilizados fueron Leptospira interrogans serovar Pomona cepa Pomona para el clado P1y L. fainei serovar Hurstbridge cepa BUT6 para el clado P2. Todas las reacciones se llevaron a cabo con agua libre de nucleasas como control negativo.
Descripción de la PCR dúplex
La misma fue diseñada de manera tal de detectar diferencialmente la presencia de material genético de leptospiras de los subgrupos P1 y P2. Para la detección del grupo P1, se amplificó el gen secY mediante el set de cebadores G1/G2 (Gravekamp et al., 1993). En el caso del grupo P2 se amplificó el gen rrs mediante el uso del set de cebadores 16SFw/16SRv, los cuales fueron diseñados de novo utilizando las secuencias disponibles en GenBank (Tabla 2).
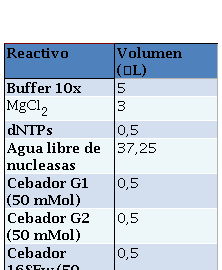
La reacción se realizó a un volumen final de 50 mL por muestra con la mezcla de reactivos según la Tabla 3.
La reacción de amplificación se llevó a cabo en el termociclador MyCycler (BioRad) de la siguiente manera: 1 ciclo de 5 minutos a 94 °C, luego 35 ciclos de 1,5 minutos a 94 °C, 1 minuto a 57 °C y 2 minutos a 72 °C, y un ciclo final de 10 minutos a 72 °C.
Los productos de PCR (15 µL) se revelaron por electroforesis en un gel de agarosa al 2% en buffer TAE (Trisacetato 40 mM, EDTA 1 mM) con bromuro de etidio a 100 V durante 60 minutos (PowerPac Basic, BioRad). Las bandas de ADN amplificadas se visualizaron mediante exposición a luz UV (transiluminador UVI Tec BTS-20.M). Los tamaños de los amplicones se estimaron usando CienMarker (PB-L).
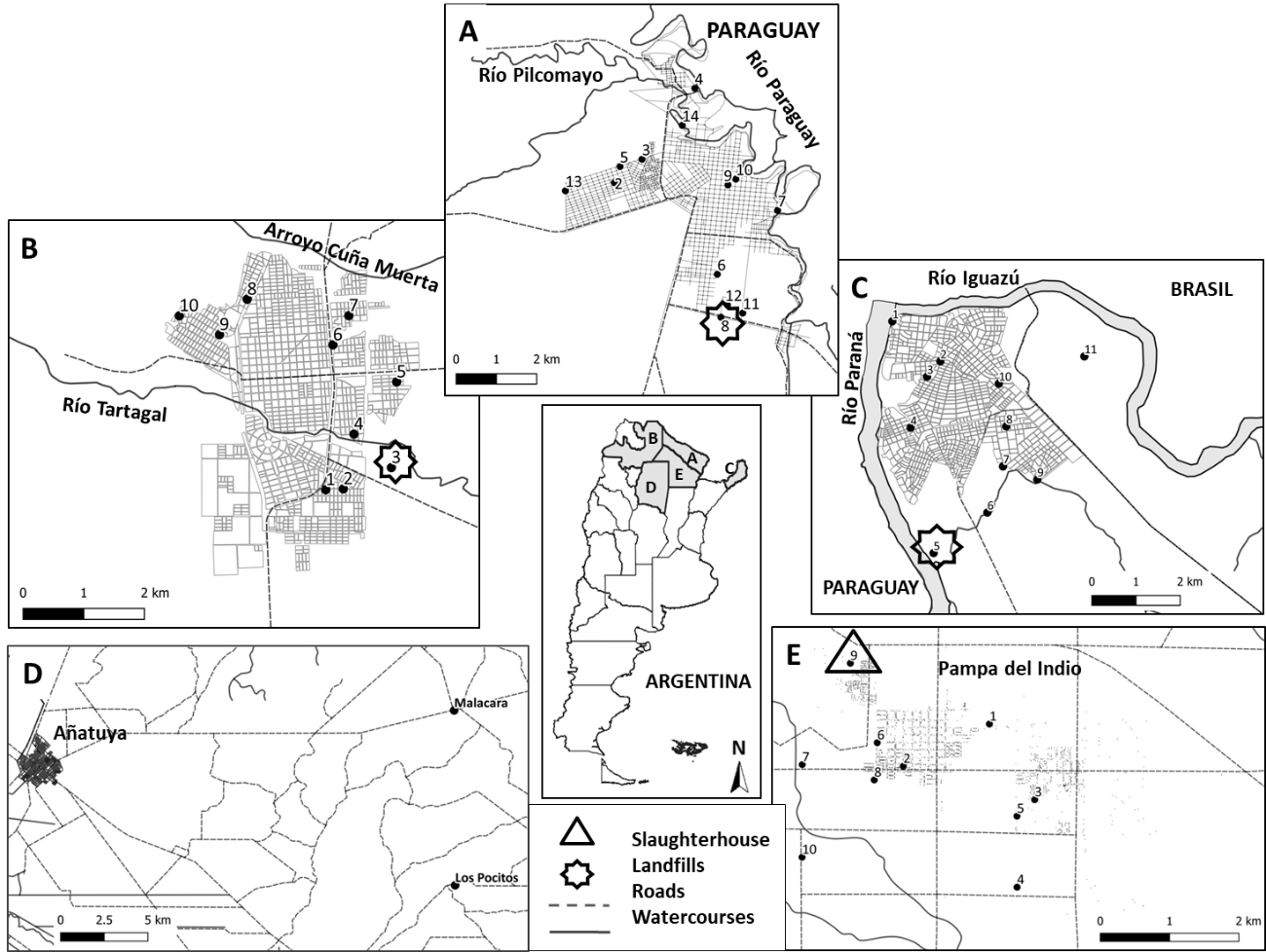
Figura 1. Mapas de los sitios de muestreo. A-Clorinda, Formosa. B-Tartagal, Salta. C-Puerto Iguazú, Misiones. D-Añatuya, Santiago del Estero. E-Pampa del Indio, Chaco.
Tabla 2. Cebadores utilizados para la detección del material genético de leptospiras de los subgrupos P1 y P2

Resultados
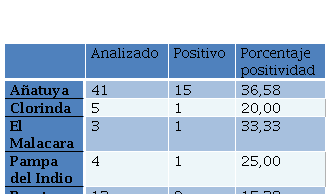
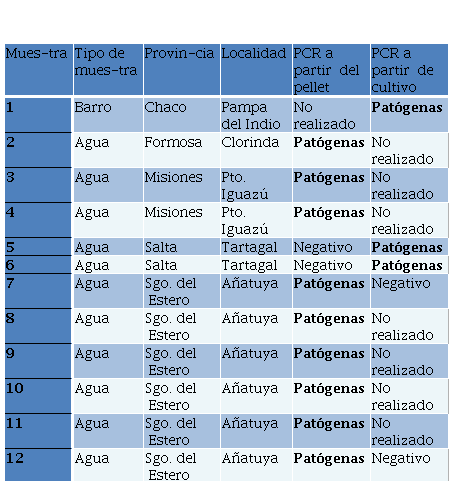
De las 89 muestras analizadas, 22 (24,7%) resultaron positivas a alguna de las pruebas diagnósticas empleadas para la detección de leptospiras. La prevalencia por tipo de muestra fue de 27,8% para las aguas y 11,8% para los barros. Todos los amplicones obtenidos en la PCR presentaron el mismo tamaño que el control positivo del clado de las leptospiras patógenas (P1). No se obtuvieron muestras positivas compatibles con especies del grupo P2.
Los resultados positivos obtenidos se resumen en las Tablas 4 y 5. Las muestras que resultaron positivas en El Malacara, Pampa del indio, Puerto Iguazú, Clorinda y Tartagal, son muestras colectadas en basurales o cerca de basurales (<100 metros de distancia), con el consiguiente riesgo de presencia de roedores y caninos. En cambio, las muestras de Añatuya, fueron colectadas de diferentes fuentes de agua para consumo (ya sea humano o animal), incluyendo pozos comunitarios o individuales, agua de lluvia almacenada o represas presentes en las viviendas de los habitantes de la región. Según los datos colectados en terreno, en ambos lotes rurales incluidos en el muestreo, El Malacara y Los Pocitos-Tacañita, se observó presencia de diferentes animales (cabras, gallinas, cerdos, caballos). A su vez, todas las viviendas muestreadas poseían perros (en general, más de uno).
Discusión
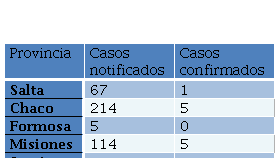
Todas las localidades muestreadas presentaron al menos una muestra positiva a alguna de las pruebas realizadas. Este es el primer trabajo en el país en analizar muestras ambientales de dichas localidades. Este hecho, sumado a que en este trabajo se hallaron muestras positivas en regiones que, por su clima más bien árido, no se consideran de riesgo epidemiológico para la leptospirosis (Salta, Santiago del Estero, Chaco, Formosa), pone de manifiesto la necesidad de profundizar el estudio de la leptospirosis en el territorio argentino, incluyendo aquellas regiones geográficas hasta ahora no tenidas en cuenta para la enfermedad. A pesar de que existen antecedentes en alguna de ellas, como el aislamiento de una cepa de un aborto en caprinos en Salta (Micheloud et al., 2015) y notificación de datos en el Sistema Nacional de Vigilancia Epidemiológica por Laboratorios de Argentina (SIVILA) (Tabla 6), la información disponible es aún escasa, dado que no existen estudios previos de detección de estos patógenos en el ambiente en estas regiones. La mayor disponibilidad de información permitirá profundizar en el conocimiento de la epidemiología de la enfermedad, lo cual facilitará la toma de decisiones para la prevención de la enfermedad en humanos.
Tabla 4. Cebadores utilizados para la detección del material genético de leptospiras de los subgrupos
La leptospirosis, como la mayoría de las enfermedades zoonóticas, representa un gran riesgo principalmente para aquellas personas de bajos recursos socio-económicos que viven en condiciones de precariedad. La urbanización no planificada junto con la estrecha convivencia con una gran densidad de animales de compañía, domésticos y sinantrópicos genera un nicho ecológico-epidemiológico ideal para el desarrollo de enfermedades zoonóticas y vectoriales en estas poblaciones (Adler, 2015).
Tabla 6. casos acumulados de leptospirosis hasta la semana epidemiológica n° 49 del año 2019 (desde el 1/1/2019 al 9/12/2019), según el Sistema Nacional de Vigilancia de la Salud – SNVS-C2/SIVILA para las regiones estudiadas en el presente trabajo (Ministerio de Salud de la Nación, 2019).
El presente trabajo preliminar demuestra la necesidad de realizar estudios ulteriores respecto a la presencia de este tipo de patógenos en distintas muestras ambientales colectadas en regiones habitadas por poblaciones vulnerables en todo el territorio nacional.
La detección de ADN de especies patógenas de Leptospira spp. en muestras ambientales en las inmediaciones de las viviendas de estas poblaciones debería alertar a los sistemas de salud humana para tener en consideración a la leptospirosis como una posible enfermedad frente a la aparición de casos con sintomatología compatible. Por otro lado, el presente trabajo abre las puertas para la realización de este tipo de estudios en nuevas zonas geográficas no consideradas anteriormente para esta enfermedad.