Introducción
Uno de los factores determinantes para el éxito a largo plazo de una restauración implantosoportada es la correcta colocación del implante dental en posición tridimensional en el reborde alveolar, determinada por la restauración protética. 1-3 La presencia de un reborde alveolar atrófico es una situación desfavorable para lograr una rehabilitación implantoasisti-da que asegure salud, estética y función.
El tratamiento con implantes de longitud estándar (mayor a 7 mm) ha sido ampliamente aceptado como un método confiable y adecuado para la rehabilitación oral de pacientes edéntulos. 4-7 La reabsorción ósea que se produce ante la ausencia de piezas dentarias en los sectores posteriores del maxilar inferior genera una mayor proximidad al nervio dentario inferior, lo que podría limitar el uso de implantes de longitud estándar. 8 , 9 Para vencer estas limitaciones, se han desarrollado diferentes estrategias. Algunas de ellas son: regeneración ósea vertical, realización de injertos en bloque y corrimiento del nervio dentario inferior. 10, 13 Sin bien estas técnicas han demostrado ser exitosas, son complejas, requieren de la destreza del operador, conllevan incomodidad para el paciente, implican un mayor costo y alargan los tiempos del tratamiento. 14 Por este motivo, se ha planteado la alternativa de tratamiento en rebordes alveolares atróficos con implantes cortos (longitud menor o igual a 6 mm). 9,15, 16
Los implantes cortos se consideran efectivos para la rehabilitación de pacientes con un reborde alveolar posteroinferior atrófico. 17-19 Sin embargo, algunos autores informaron que su uso se asocia a una tasa de supervivencia más baja en comparación con el de implantes de longitud estándar. 14 , 20
Actualmente, hay una marcada tendencia a utilizar protocolos mínimamente invasivos con el fin de evitar la morbilidad que producen las cirugías rege-nerativas. 21 La cirugía guiada permitiría la ubicación de implantes de longitud estándar protéticamente orientados, optimizando el tejido óseo residual en función de la anatomía del reborde alveolar, lo cual reduce el riesgo de lesiones neurovasculares. 22
El objetivo de este trabajo es presentar el uso de la cirugía guiada en la resolución quirúrgico-protética de un caso clínico con colocación de implantes de longitud estándar en un maxilar inferior atrófico, sin regeneración ósea.
Caso clínico
Una mujer de 66 años se presentó en la Cátedra de Odontología Integral Adultos de la Facultad de Odontología de la Universidad de Buenos Aires (FOUBA) para realizar un tratamiento odontológico integral. Ante la ausencia de las piezas dentarias pos-teroinferiores, se planteó la posibilidad de instalación de implantes. Se efectuó el análisis clínico, fotográfico y radiográfico para el diagnóstico y la elaboración de un plan de tratamiento rehabilitador. La paciente manifestó no padecer ninguna alteración sistémica ni recibir medicación.
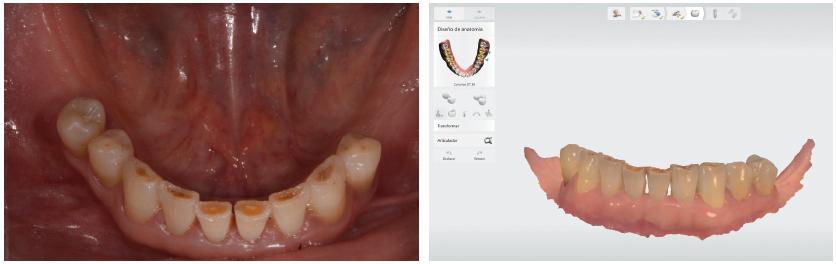
Se realizó una tomografía cone beam (ProMax 3D Max®; Planmeca, Helsinki, Finlandia) en la Cátedra de Diagnóstico por Imágenes de la FOUBA para determinar el volumen óseo disponible para la instalación de implantes. Luego se escanearon ambos maxilares con un escáner intraoral TRIOS® (3Shape, Copenhague, Dinamarca). Los archivos STL (standard tessellation language) del escaneado intraoral (fig. 1) y los DICOM ( digital imaging and communications in medicine ) de la tomografía cone beam (fig. 2) fueron importados por el programa Im-plant Studio® (3Shape).
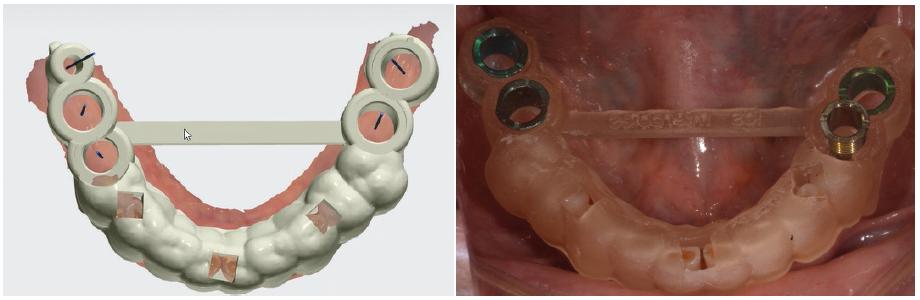
Con este mismo programa se solaparon las imágenes del escaneado con las tomográficas. Luego se diseñaron virtualmente las coronas 36, 37, 45 y 46 en la posición protética ideal y se ubicaron los implantes en el reborde residual, guiados por las coronas diseñadas; de este modo se obtuvo la relación implanto-protética más conveniente, respetando estructuras anatómicas vitales (fig. 3).
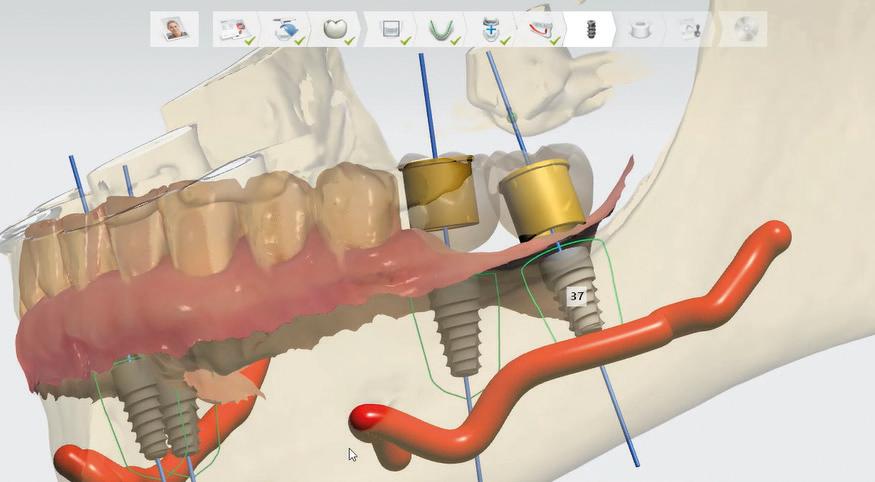
Figura 3 Solapado de archivos STL y DICOM, encerado digital y ubicación 3D de los implantes con el programa 3Shape Implant Studio.
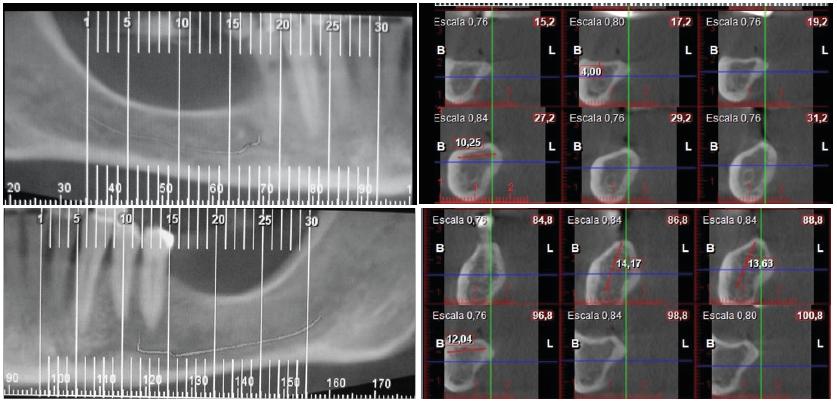
Se seleccionaron implantes de diseño cónico Tapered Internal® (BioHorizons, Birmingham, AL, Estados Unidos) de dimensiones que aseguraran mantener un margen de seguridad de tejido óseo de 2 mm alrededor de cada implante y 1,5 mm en la porción cervical, y con una altura y un diámetro que permitieran respetar la ubicación 3D según la restauración protética (fig. 4).
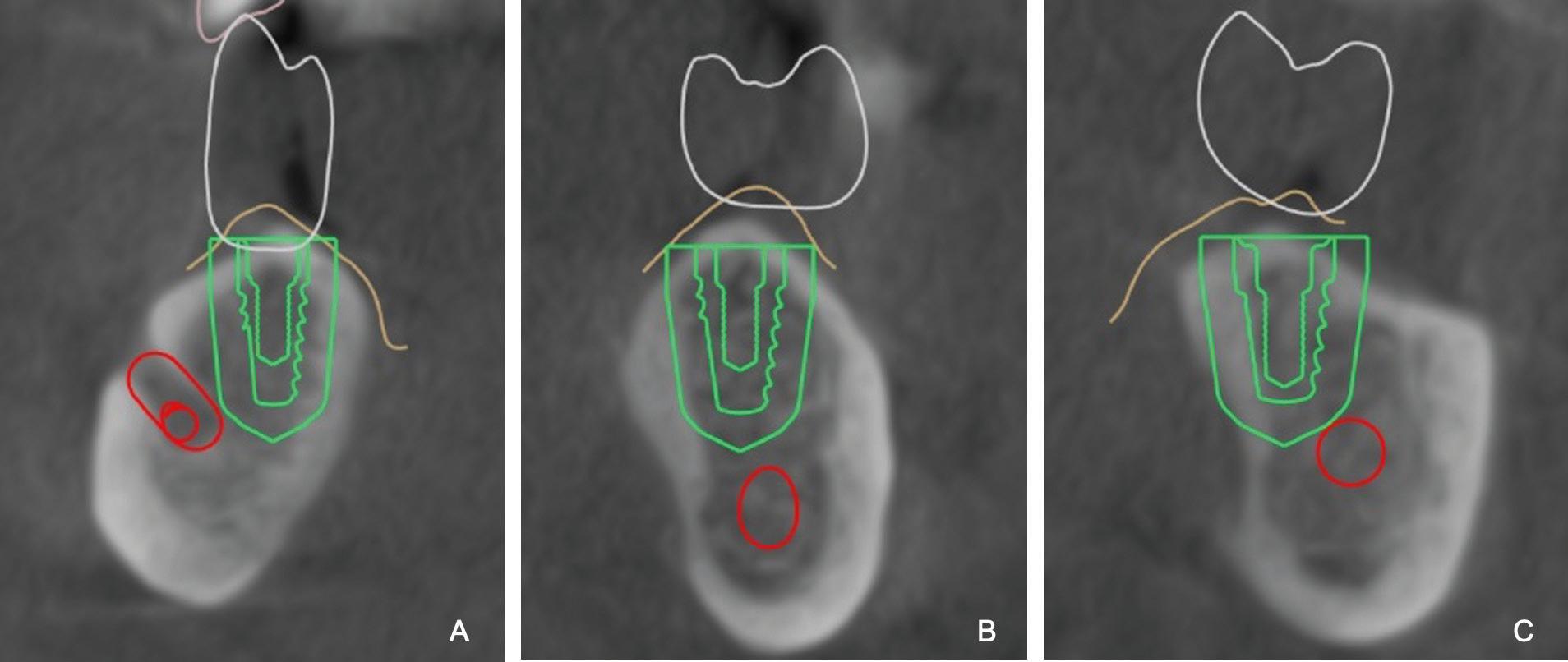
Figura 4 Cortes paraxiales en los que se observa la posición de los implantes con 2 mm de margen de seguridad, delimitados por la línea verde exterior. A: Implante 45; B: Implante 36; C: Implante 37.
Se obtuvo el protocolo quirúrgico de fresado adecuado para la marca y el diseño de los implantes seleccionados a partir de lo proyectado con el programa de diseño implantológico (fig. 5).
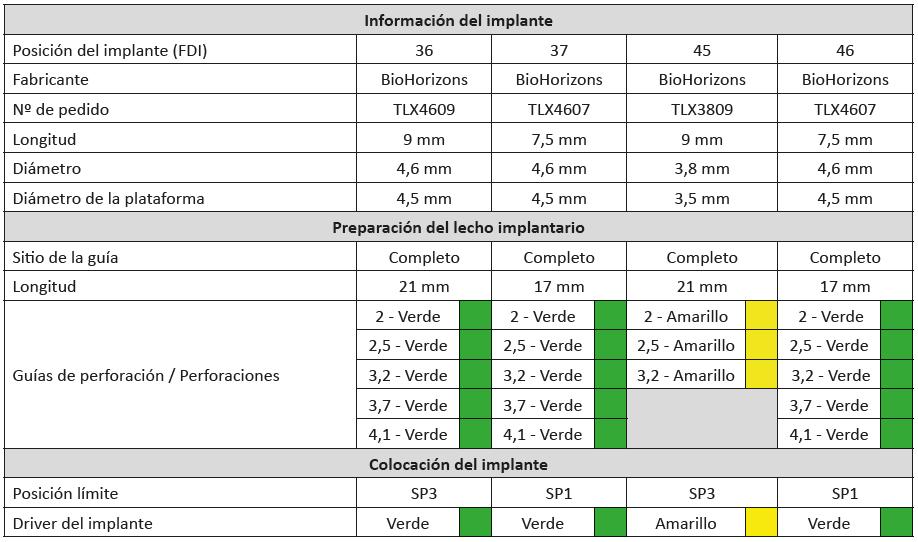
Figura 5 Protocolo quirúrgico de fresado para implantes BioHorizons a partir de lo proyectado con el programa de diseño.
Una vez definida la posición de los implantes, se diseñó virtualmente una guía quirúrgica dentosopor-tada de precisión confeccionada por impresión 3D Moonray D® (Sprintray, Los Ángeles, CA, Estados Unidos) con resina para impresión NextDent SG® (NextDent B.V., Soesterberg, Países Bajos). Luego se le agregaron cuatro cilindros maestros ubicados apicocoronalmente, según la altura y el ancho de los implantes seleccionados (fig. 6).
La paciente firmó el consentimiento informado autorizando los procedimientos clínicos y la publicación del caso de manera anónima.
Como medicación preoperatoria, se le indicaron 2 g de amoxicilina 1 hora antes de la cirugía. Previamente al acto quirúrgico, realizó un buche de 15 ml de gluconato de clorhexidina al 0,12% durante 30 segundos. Se aplicó anestesia local infiltrativa con carticaína 4% y l-adrenalina 1:100000. Se realizó una incisión supracrestal y se elevó un colgajo mu-coperióstico (fig. 7A). Se posicionó la guía quirúrgica para realizar el fresado de cada lecho implantario siguiendo el protocolo quirúrgico brindado por el programa de diseño y utilizando la caja ad hoc (BioHorizons). Para cada sitio implantario, se ubicó en el cilindro maestro la secuencia de llaves guía de acuerdo con el diámetro de la fresa a utilizar (fig. 7B), las cuales definen el eje de fresado, limitando el movimiento en sentido horizontal. A su vez, en sentido vertical, la profundización de la fresa quedó determinada previamente por el programa de diseño, teniendo en cuenta la longitud del implante, la altura de los cilindros maestros y su ubicación en la guía en sentido apicocoronal. Una vez estipulado el protocolo de fresado con la longitud de la fresa correspondiente, se realizó la ostectomía hasta que la fresa hiciera tope con la llave guía (figs. 7C y 8). De esta forma, se logró la preparación de un lecho quirúrgico acorde a la ubicación de los implantes proyectada en el diseño (fig. 7D).
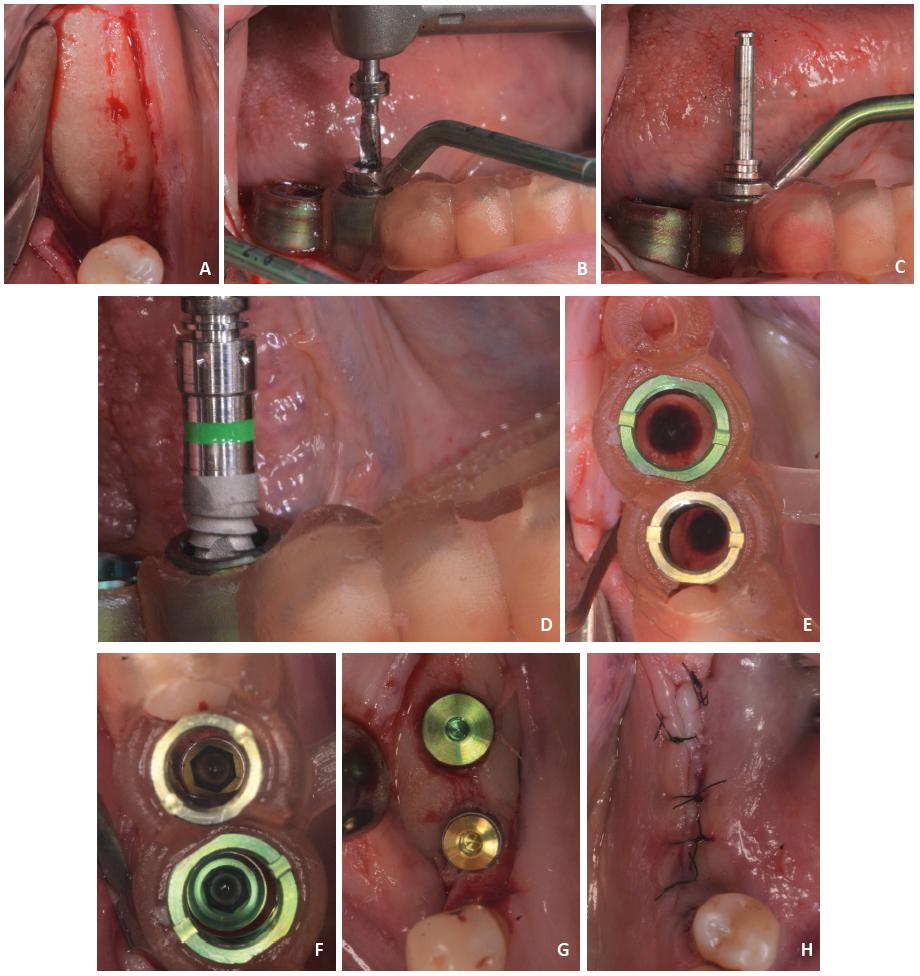
Figura 7 Procedimiento quirúrgico. A: Elevación de colgajo mucoperióstico; B: Fresado a través de llave guía ubicada dentro del cilindro maestro; C: Tope de la fresa con la llave; D: Preparación de lechos implantarios; E: Inserción del implante con driver; F: Implantes en su posición planificada; G: Tapas de cierre al ras; H: Sutura puntos simples.
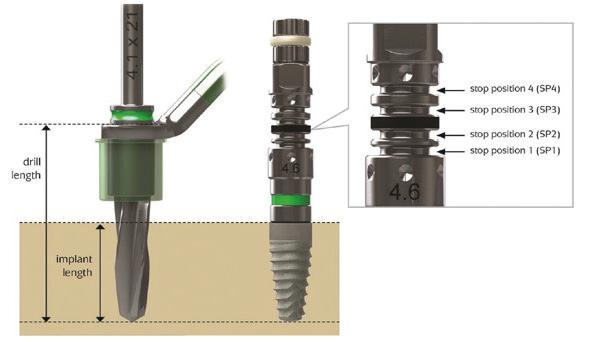
Figura 8 Esquema de la fresa con tope en la llave guía correspondiente, y del driver con marcas de profundización del implante.
Para la inserción de cada implante a través del cilindro maestro se utilizó un driver (fig. 7E), que permitió la instalación en la posición planificada, profundizando hasta la marca (SP 1, 2, 3, 4) (fig. 8) indicada en el protocolo de fresado. Se posicionaron a 15 rpm, alcanzando un torque óptimo (50 N) (fig. 7F). Se colocaron las tapas al ras, se reposicionaron los colgajos y se suturó con náilon 5.0, con puntos simples (fig. 7G-H).
Como medicación posoperatoria analgésica, se indicaron 400 mg de ibuprofeno cada 8 horas durante 2 días y la aplicación de gluconato de clorhexidina al 0,12% en gel en la zona intervenida cada 12 horas durante 7 días.
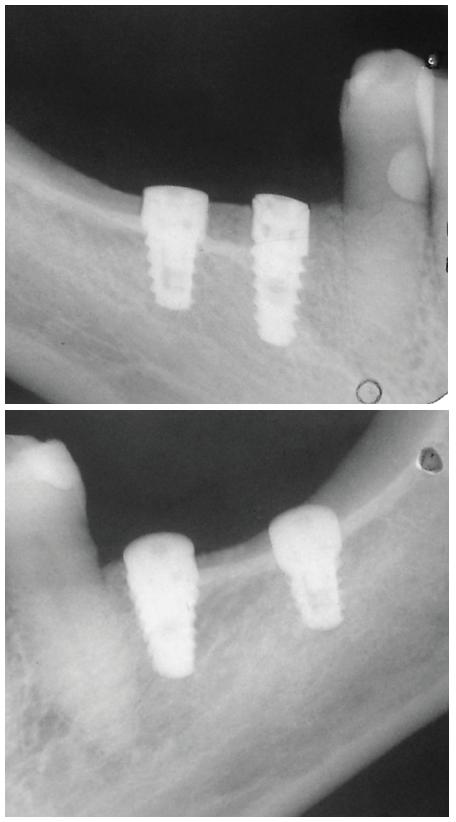
A los 7 días se realizó el primer control y se retiró la sutura. Luego se efectuaron controles mensuales hasta el tercer mes, en los que se observó la correcta cicatrización de los tejidos blandos. La paciente manifestó no sentir dolor ni sintomatología asociada a la afección del nervio dentario inferior. A los 3 meses se efectuó un control radiográfico (fig. 9) y la cirugía de activación de los implantes, en la cual se colocaron las tapas de cicatrización. Se procedió a evaluar la estabilidad de los implantes por medio de un análisis de frecuencia de resonancia utilizando un Osstell ISQ® (Osstell, Gotemburgo, Suecia). Para la rehabilitación protética se tomaron impresiones digitales con un escáner intraoral TRIOS® (3Shape) y se confeccionaron coronas de zirconia monolíticas cemento-atornilladas sobre pilares TiBase® (Bio-Horizons) (fig. 10).
Discusión
En este caso clínico fueron instalados, mediante cirugía guiada, 4 implantes de longitud estándar en los sectores posteroinferiores de un reborde alveolar de deficiente altura ósea. El uso de una guía de precisión permitió su colocación siguiendo la posición 3D previamente planificada en el encerado digital. De esta forma, se logró una óptima rehabilitación con coronas cemento-atornilladas, sin la necesidad de realizar regeneración ósea y sin lesionar estructuras anatómicas y neurovasculares.
La cirugía guiada en implantología fue desarrollada para mejorar la precisión en la colocación de los implantes, al superar ciertas limitaciones de las guías quirúrgicas convencionales. 1 , 24 Durante la cirugía, la posición planificada del implante se transfiere al sitio quirúrgico mediante una guía de precisión impresa en 3D o fresada, teniendo en cuenta la futura rehabilitación protética y la disponibilidad ósea del reborde alveolar. 1 , 25 Esta técnica podría reducir el riesgo de complicaciones tales como el daño del nervio mandibular, perforaciones sinusales, fenestraciones y dehiscencias óseas, y el daño de la raíz del diente adyacente. 26 , 27 Además ayuda a disminuir el malestar posoperatorio, ya que permite colocar el implante sin realizar la elevación de un colgajo mucoperióstico, lo cual implica un menor trauma quirúrgico. 28
El estudio de imágenes tomográficas permite analizar las características del defecto óseo, y mediante el uso del programa de planificación de implantes es posible predecir la necesidad de procedimientos de regeneración ósea guiada. 29 Varios autores clasificaron la morfología del maxilar inferior según su sección transversal y la disposición de la concavidad lingual, y en función de esto midieron el riesgo de lesionar el nervio dentario inferior intraquirúrgicamente. 22, 30 Chan et al. 22 proponen tres tipos de morfología: C, P y U. Esta última presenta una marcada concavidad lingual que otorga al reborde una prominencia ósea coronal a aquella. En nuestro caso clínico, esto nos brindó la posibilidad de colocar los implantes hacia lingual sin comprometer su angulación ni la futura rehabilitación protética (fig. 4A). Sin embargo, esta situación depende en gran parte de la ubicación de la concavidad lingual en sentido apicocoronal, ya que cuanto más hacia la basal se encuentre, mayor será la posibilidad de colocar implantes más largos y con más margen de seguridad. No obstante, la marcada concavidad lingual implica un elevado riesgo de perforar la cortical lingual, lo cual se reduciría con la cirugía guiada, que permite una planificación previa de las dimensiones de los implantes y su colocación de manera más precisa. 22, 30, 31
Asimismo, teniendo en cuenta que el nervio dentario inferior discurre desde la espina de Spix hacia el agujero mentoniano de forma posteroanterior y de lingual a vestibular, 32 la planificación digital nos permitió evaluar la posibilidad de colocar el implante por detrás del nervio, en sector de premolares, donde este se encuentra más vestibularizado 33 (fig. 4A). El estudio pormenorizado de la anatomía del maxilar inferior permitiría la optimización del reborde residual para colocar implantes de manera protéticamente guiada, en busca de una cirugía mínimamente invasiva. 34
En la cirugía guiada, la precisión se define como la coincidencia entre la posición del implante planeada con el programa y la posición alcanzada en la boca del paciente. 34 Varios autores estudiaron si esta precisión es mayor que con una técnica quirúrgica convencional. 1,28,35, 36 Smitkarn et al. 1 encontraron mayor precisión en los implantes colocados mediante cirugía guiada. A nivel apical, la diferencia fue de 2,1 mm con la técnica convencional y de 1,3 mm con el uso de guías de precisión; a la altura del hombro del implante, 1,5 mm y 1 mm; y la variación de la angulación fue de 6,9 y 3,1 grados respectivamente. Estos resultados están en concordancia con los obtenidos por otros autores. 37
La desviación respecto de la posición planificada podría deberse a errores en la adquisición de imágenes, el procesamiento de los datos, la confección de la guía quirúrgica, la estabilidad de la guía durante el fresado, errores humanos o la suma de los anterio-res. 34 , 38 Las imágenes 3D de las tomografías tienden a sobreestimar el volumen óseo en aproximadamente 0,25-0,5 mm, en comparación con las mediciones histológicas. 39 , 40 Estas discrepancias son particularmente relevantes en ciertas situaciones clínicas, ya que a menudo se recomienda la cirugía guiada en relación con la colocación de implantes sin colgajo o para evitar procedimientos de aumento óseo. 29 Contemplando esta situación, el programa de diseño prevé en la planificación y la elección de los implantes un margen de seguridad de 2 mm de tejido óseo alrededor de cada implante y de 1,5 mm en la porción cervical, disminuyendo así el riesgo de lesiones de estructuras anatómicas vitales. 8 Esto determina la elección del largo y el diámetro de los implantes, que en este caso son cónicos (figs. 4 y 5).
El tiempo intraoperatorio podría considerarse una ventaja, pero ha sido demostrado que, a pesar de que la duración de la cirugía guiada es menor, su planificación y la confección de la guía quirúrgica implican tiempos similares o mayores que en una cirugía con-vencional. 41
Por otro lado, entre las limitaciones de la técnica, la apertura bucal del paciente es un factor determinante en la cirugía guiada, ya que la confección del lecho quirúrgico se realiza con fresas largas a través de la guía. Además, el costo es más elevado que en las cirugías convencionales debido a la confección de la guía, los cilindros maestros y la necesidad de contar con un sistema de fresas particulares. 24,37,38, 41 Sin embargo, estos protocolos podrían tener una influencia positiva en la percepción del tratamiento por parte del paciente y brindarían la posibilidad de cirugías más rápidas y menos invasivas.