Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de cardiología
versión On-line ISSN 1850-3748
Rev. argent. cardiol. vol.84 no.1 Ciudad Autónoma de Buenos Aires feb. 2016
CONSENSO
Consenso de Enfermedad Tromboembólica Aguda
DIRECTOR
Dr. Jorge UbaldiniMTSAC
CODIRECTOR
Dr. Jorge Bilbao
SECRETARIOS
Dr. Mario César Spennato
Dr. José Bonorino
COMITÉ DE REDACCIÓN
Dr. Jorge UbaldiniMTSAC
Dr. Jorge Bilbao
Dr. José Bonorino
Dr. Mario César Spennato
Dr. Luis Alberto Flores
Dr. Mario Kenar
Dr. Marcelo Casey
Dr. José Ceresetto
Dr. Julio Chertcoff
Dr. Miguel GonzálezMTSAC
Dr. Héctor Gómez Santa MaríaMTSAC
Dr. Guillermo Jaimovich
Dr. Adrián LescanoMTSAC
Dr. Carlos Rojas Matas
Dr. José ÁlvarezMTSAC
COMITÉ DE REVISIÓN
Dr. Jorge ThiererMTSAC
Dr. Ernesto DurontoMTSAC
Dr. Sergio VariniMTSAC
Dr. Roberto BoughenMTSAC
Dr. Norberto VulcanoMTSAC
ÁREA DE CONSENSOS Y NORMAS SAC
Director
Dr. Mariano FalconiMTSAC
Coordinador
Dr. Ignacio BluroMTSAC
Secretario
Dr. Gustavo GiuntaMTSAC
Vocales
Dr. Maximiliano De AbreuMTSAC
Dr. Nicolás González
Dr. Sebastián PeraltaMTSAC
Dr. Gastón Procopio
Dr. Mario César Spennato
Comité Asesor
Dr. Ernesto DurontoMTSAC
Dr. Eduardo SampóMTSAC
Dr. Jorge UbaldiniMTSAC
Secretaria Administrativa
Sra. Liliana Capdevila
Índice
– Introducción, 75
– Epidemiología, evolución natural y factores de riesgo de la enfermedad tromboembólica aguda, 75
– Diagnóstico, 75
– Recomendaciones de métodos diagnósticos por imágenes, 79
– Estratificación del riesgo, 79
– Tromboembolia de pulmón de riesgo alto, 80
– Tromboembolia de pulmón de riesgo bajo, 85
– Tromboembolia de pulmón de riesgo intermedio, 85
– Medidas generales y tratamiento farmacológico, 87
– Tratamiento invasivo en hemodinamia, 89
– Bibliografía, 90
| Abreviaturas | ||||
| Angio-TAC | Angiotomografía axial computarizada | PAFI | Relación de la presión arterial de oxígeno y la fracción | inspirada |
| ARM | Asistencia respiratoria mecánica | de oxígeno (PAO2/FIO2) | ||
| AVK | Antagonistas de la vitamina K | PAP | Presión arterial pulmonar | |
| BNP | Péptido natriurético cerebral | PAS | Presión arterial sistólica | |
| ECMO | Oxigenador con membrana extracorpórea | PEEP | Presión positiva al final de la espiración | |
| EP | Embolia de pulmón | RIN | Razón internacional normatizada | |
| ET | Enfermedad tromboembólica | rt-PA | Activador tisular del plasminógeno recombinante | |
| ETV | Enfermedad tromboembólica venosa | RVP | Resistencia vascular pulmonar | |
| FC | Frecuencia cardíaca | TAC | Tomografía axial computarizada | |
| HBPM | Heparina de bajo peso molecular | TAM | Tensión arterial media | |
| HNF | Heparina no fraccionada | TEP | Tromboembolia de pulmón | |
| KPTT | Tiempo de tromboplastina parcial activada | TSE | Tenecteplase | |
| NACO | Nuevos anticoagulantes orales | TVP | Trombosis venosa profunda | |
| NO | Óxido nítrico | V/Q | Ventilación/perfusión | |
| NT-proBNP | Fracción N terminal del propéptido natriurético | VD | Ventrículo derecho | |
| cerebral | VI | Ventrículo izquierdo | ||
INTRODUCCIÓN
La tromboembolia de pulmón (TEP) es una urgencia cardiovascular de una incidencia anual de 70 casos por cada 100.000 habitantes. La frecuencia anual de aparición de la enfermedad se acrecienta en personas añosas y a su vez se incrementa frente a la presencia de múltiples comorbilidades.
El pronóstico de la enfermedad puede variar ampliamente con dependencia de la forma de presentación. Dentro de este amplio abanico de posibilidades encontramos en uno de los extremos a la TEP de riesgo alto con una mortalidad elevada y en el otro extremo, a la TEP de riesgo bajo con escasa repercusión hemodiná-mica, de baja mortalidad.
En la mayoría de los casos la presentación clínica es poco específica y frecuentemente se asocia con otras patologías con signos y síntomas que se superponen, lo cual genera demoras diagnósticas.
Un diagnóstico a tiempo es fundamental para establecer una terapéutica que intente desviar el pronóstico desfavorable de la enfermedad, más aún en sus formas más graves.
La mayoría de los eventos de embolia pulmonar están relacionados con la trombosis venosa profunda (TVP) proximal de los miembros inferiores. Esta entidad se asocia con condiciones que determinan hipercoagulabilidad sanguínea, tanto congénitas como adquiridas; sin embargo, un porcentaje significativo de pacientes presentan enfermedad tromboembólica (ET) idiopática. La profilaxis, así como el diagnóstico precoz y el tratamiento adecuado de la ET son cruciales para obtener los mejores resultados.
El objetivo del presente documento es brindar una guía práctica acerca del diagnóstico, la estratificación del riesgo y el tratamiento de la ET aguda.
EPIDEMIOLOGÍA, EVOLUCIÓN NATURAL Y FACTORES DE RIESGO DE LA ENFERMEDAD TROMBOEMBÓLICA AGUDA
Epidemiología
La TVP y la embolia de pulmón (EP) conforman la ET. La ET representa la tercera causa de muerte cardiovascular después del infarto de miocardio y el accidente cerebrovascular y se considera entre las principales causas de muerte intrahospitalaria.
Su diagnóstico es dificultoso, ya que no tiene una presentación clínica específica.
La mortalidad de la TEP de riesgo alto es mayor del 15%, con cifras superiores al 60% en casos de paro cardiocirculatorio o shock. La TEP de riesgo intermedio presenta una mortalidad del 3% al 15% y la TEP de riesgo bajo tiene una mortalidad menor del 1%.
Evolución natural
La TEP no tratada se asocia con una mortalidad cercana al 30%. Los episodios con deterioro hemodinámico y la embolia recurrente representan la causa más frecuente de muerte.
La mayor edad se correlaciona con aumento de la mortalidad. Las tasas son 8 veces superiores en pacientes mayores de 80 años que en los menores de 50 años.
La TVP y la EP suelen ser recurrentes, por lo que es importante identificar a los pacientes con mayor riesgo de presentarla. La ausencia de una causa que la justifique induce a la búsqueda de trombofilias o de una neoplasia oculta.
Factores de riesgo
Los factores de riesgo primarios y secundarios conocidos están en relación con la clásica tríada de Virchow: estasis venosa, hipercoagulabilidad sanguínea y lesiones en las paredes vasculares. Actualmente se considera que la tromboembolia venosa es el resultado de la interacción entre factores de riesgo relacionados con el paciente y con el contexto (Tabla 1).
El factor de riesgo más importante es la edad. La prevalencia es mayor en el sexo masculino, al igual que la recidiva de E T.
Sin el uso de profilaxis, la frecuencia de TVP en pacientes sometidos a una simple cirugía de hernia puede ser de hasta el 5%, en cirugías mayores abdominales es del 15% al 30%, en la cirugía de cadera es del 50-70% y en lesiones medulares graves es del 50% al 100%.
Debemos tener en cuenta que el 25% de las embolias posoperatorias pueden producirse luego del alta hospitalaria, especialmente en la cirugía ortopédica mayor o por cáncer.
Las trombofilias hereditarias, que incluyen el déficit de antitrombina III, de proteínas C y S y una mutación del factor V de Leiden, son factores de riesgo independiente para ET.
DIAGNÓSTICO
Presentación clínica de la tromboembolia de pulmón
En la TEP, los signos y los síntomas no son específicos y la sospecha clínica es fundamental para un diagnóstico precoz. Los síntomas y los signos más frecuentes son disnea, taquipnea, palpitaciones, dolor de pecho, ansiedad, fiebre, síncope o presíncope y hemoptisis. (1)
La hipotensión arterial y el shock son poco frecuentes, pero tienen mayor jerarquía porque se correlacionan con grandes trombos centrales en las arterias pulmonares. Su persistencia es un predictor de alta mortalidad temprana.
El síncope es infrecuente, pero define una TEP de mayor riesgo con posible inestabilidad hemodi-námica.
El dolor de pecho es frecuente y puede ser ocasionado por irritación pleural con o sin infarto pulmonar, con dolor en puntada de costado, habitualmente ins-piratorio, ocasionado por trombos distales. Cuando los trombos son centrales, el dolor de pecho es más grave y de características anginosas por isquemia del ventrículo derecho (VD); en estos casos debe hacerse
Tabla 1. Factores predisponentes para enfermedad trombo-embólica, relacionados con el paciente y el contexto clínico el diagnóstico diferencial con otras causas graves de dolor torácico como el síndrome coronario agudo o la disección aórtica.
| Factor predisponente Relacionado con | Relacionado con el |
| el paciente | contexto |
| Factores predisponentes fuertes (odds ratio > 10) | |
| Fractura (cadera o pierna) | + |
| Prótesis de cadera o rodilla | + |
| Cirugía general mayor | + |
| Traumatismo mayor | + |
| Lesión medular | + |
| Factores predisponentes moderados (odds ratio 2-9) | |
| Cirugía artroscópica de rodilla | + |
| Accesos venosos centrales | + |
| Quimioterapia | + |
| Insuficiencia cardíaca o respiratoria crónicas + | |
| Terapia de sustitución hormonal + | |
| Malignidad + | |
| Uso de anticonceptivos orales + | |
| Accidente cerebrovascular con plejía + | |
| Embarazo o posparto + | + |
| Tromboembolia venosa previa + | |
| Trombofilia + | |
| Factores predisponentes leves (odds ratio < 2) | |
| Reposo en cama > 3 días | + |
| Inmovilidad por viaje prolongado (auto, avión) | + |
| Edad avanzada + | |
| Cirugía laparoscópica | + |
| Obesidad + | |
| Embarazo/anteparto + | |
| Terreno varicoso + |
La disnea puede ser súbita y ser el único síntoma. Puede ser transitoria y ante la falta de signos y síntomas de insuficiencia cardíaca izquierda o enfermedad del parénquima pulmonar debe aumentar la sospecha de TEP.
En los gases en sangre la hipoxemia se considera un hallazgo frecuente, pero el 40% de los pacientes tienen una saturación de oxígeno normal y un 20% tienen un gradiente A-a normal; la hipocapnia puede ser el único signo sugestivo de TEP y es ocasionado por la taquipnea. Un patrón que debe instalar la sospecha es el de hipoxemia con hipocapnia.
La coexistencia de disnea, hipoxemia y una radiografía de tórax normal sugiere TEP ante la falta de otro diagnóstico alternativo.
Evaluación de la probabilidad clínica
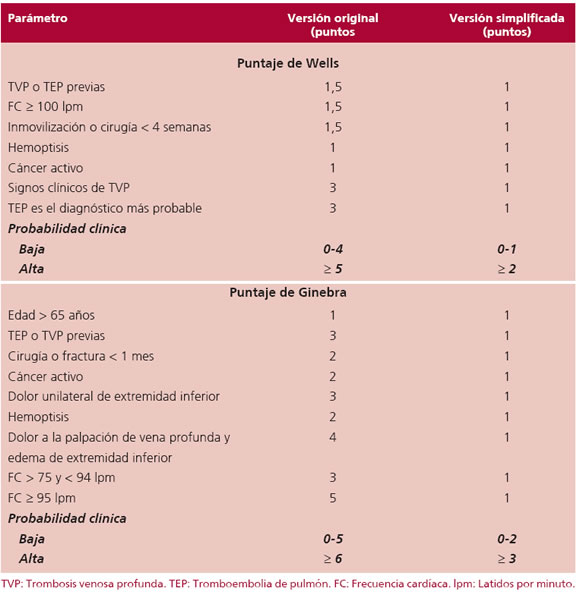
A pesar de la limitada sensibilidad y especificidad de los distintos signos y síntomas, la combinación de ellos permite establecer la probabilidad clínica de TEP. Los puntajes más utilizados son el de Wells y el de Ginebra (Tabla 2). Ambos están extensamente validados y permiten establecer, de acuerdo con la sospecha clínica, la probabilidad baja o alta de TEP. (2)
Marcadores bioquímicos para el diagnóstico
Dímero D
El nivel de dímero D está elevado en presencia de trombosis aguda, ya que se trata de un producto de degradación del fibrinógeno.
Un resultado negativo de la prueba de dímero D y el dímero D normal alejan la probabilidad de TVP o TEP. Un valor elevado tampoco confirma el diagnóstico de TEP, ya que existen otras entidades productoras de fibrina que pueden elevar el dímero D, como cáncer, traumatismo, inflamación, sangrado y necrosis.
La sensibilidad del dímero D cuando se utilizan ELISA (enzyme linked immunosorbent assay) o las pruebas de alta sensibilidad es cercana al 95%, por lo que puede emplearse para descartar TEP en pacientes con preprueba de moderada a baja probabilidad cuando su resultado es negativo. (3)
La prueba del látex y/o la prueba de aglutinación en sangre tienen una sensibilidad moderada, < 95%, y su valor negativo tendría utilidad en pacientes con baja probabilidad clínica de TEP.
Tabla 2. Parámetros utilizados para establecer la probabilidad de tromboembolia de pulmón en pacientes con sospecha clínica. Puntajes de Wells y Ginebra
El valor del dímero D persistentemente elevado también puede utilizarse como factor pronóstico y como marcador de riesgo de recurrencia, por lo que es útil para una anticoagulación extendida (criterios DASH).
Marcadores de disfunción del ventrículo derecho
La sobrecarga de presión del VD está asociada con incremento del estrés parietal y la liberación del péptido natriurético cerebral (BNP) o de NT-proBNP.
El nivel en el plasma de péptidos refleja la gravedad del compromiso hemodinámico y posible disfunción del VD por TEP.
En un metaanálisis sobre 1.132 pacientes con TEP se encontró que el 51% tenían elevado el BNP o el NT-proBNP; estos pacientes tuvieron un 10% de mortalidad temprana. (4)
Pero otro estudio demostró que los pacientes con TEP sin inestabilidad clínica y normotensos con BNP o NT-proBNP elevado tenían un valor predictivo positivo bajo para mortalidad temprana.
Un nivel bajo de BNP o de NT-proBNP podría identificar a pacientes con un resultado clínico favorable. Los pacientes con TEP hemodinámicamente estables con niveles bajos de estos marcadores serían candidatos para un alta hospitalaria temprana.
Marcadores de lesión miocárdica
La elevación de la concentración de troponina en sus distintas opciones en plasma en la TEP se ha asociado con un pronóstico adverso.
En un metaanálisis sobre 1.985 pacientes con TEP, la elevación de troponina T o I se observó en el 50% de los pacientes y se asoció con mayor mortalidad. (5) Sin embargo, otros autores sugieren que la elevación de tro-ponina en pacientes normotensos es de valor limitado. El valor predictivo positivo de la elevación de troponina en pacientes con TEP se correlaciona con una mortalidad temprana del 12% al 44% y el valor predictivo negativo es alto. Existe evidencia del valor predictivo positivo de la troponina ultrasensible, pero aún no está claro el valor de corte. En un estudio prospectivo multicéntrico sobre 526 pacientes, un valor bajo de troponina T ultrasensible, < 14 pg/ml, en pacientes con TEP normotensos tuvo un valor predictivo negativo del 98%. (6)
También han demostrado un incremento del riesgo la elevación de troponinas T o I y la elevación de BNP o NT-proBNP. Las proteínas ligadoras de ácidos grasos cardíacos h-FABP (heart-type fatty acidbinding protein), (7) unas pequeñas proteínas citoplasmáticas presentes en tejidos con abundante actividad metabólica de ácidos grasos, son marcadores de lesión y también han demostrado tener valor pronóstico en la TEP; este método aún no se encuentra disponible en nuestro medio.
Radiografía de tórax
Es un estudio de amplia disponibilidad y bajo costo. Es una herramienta importante en el algoritmo diagnóstico para excluir otras entidades que pueden simular una TEP. En el estudio ICOPER, la radiografía fue anormal en el 75% de los pacientes evaluados, con hallazgos muy inespecíficos. Entre los signos más frecuentes debemos destacar: incremento de la silueta cardíaca (27%), derrame pleural (23%), elevación de un hemidiafragma (20%), aumento del diámetro de la arteria pulmonar (19%) y atelectasia (18%).
Electrocardiograma
La taquicardia sinusal es la alteración más frecuente. La existencia de supradesnivel del segmento ST en AVR y V1 como expresión de isquemia grave del VD, la rotación horaria aguda del eje del QRS con aparición de la patente S1 Q3 T3, la existencia de ondas T negativas de V1 a V4 como expresión de dilatación e isquemia del VD y el bloqueo agudo incompleto o completo de rama derecha por distensión de la banda modeladora del VD conllevan peor pronóstico. (8, 9)
Diagnóstico por imágenes
Ecocardiograma transtorácico
El ecocardiograma es indispensable en la evaluación de un paciente con TEP, ya que permite sospechar el diagnóstico frente al hallazgo de dilatación del VD o existencia de hipertensión pulmonar y, en los casos definidos, permite estratificar el riesgo. Es la herramienta diagnóstica y de estratificación para la TEP con compromiso hemodinámico. En un paciente con shock por TEP, la disfunción del VD es la regla, por lo cual su funcionalidad normal nos aleja del diagnóstico de la causa del shock por TEP.
El signo de McConnell es un hallazgo específico aunque infrecuente, que se expresa por la hipocinesia de la pared lateral del VD, con preservación de la motilidad en la región apical. Otro dato es la presencia de hipertensión pulmonar sistólica, en general con velocidades pico de insuficiencia tricuspídea de entre 3 y 3,6 metros/seg. El ecocardiograma tiene implicaciones en el pronóstico, donde la dilatación del VD y en particular el compromiso significativo de la función son predictores independientes de mortalidad. Otro marcador de mala evolución es la presencia de trombos en tránsito en cavidades derechas. En este caso, la asociación con foramen oval permeable (presente en el 22% de la población) adiciona el riesgo de embolia sistémica paradójica.
Ecocardiografía transesofágica
Su utilidad radica en la posibilidad de detectar trombos en el tronco o las ramas proximales de arterias pulmonares cuando la tomografía no está disponible y en especial en pacientes ventilados. Configura un estudio de segunda elección y de gran aporte cuando no se dispone de otra información confirmatoria. Permite además descartar otras patologías cardiovasculares como disección aórtica o insuficiencia mitral aguda.
Centellograma de ventilación/perfusión El valor diagnóstico del centellograma de ventilación/ perfusión (V/Q) depende de la calidad del estudio y su análisis. Se deben incluir las seis posiciones de imágenes como se estableció en el estudio PIOPED I (anterior, posterior y cuatro oblicuas). Un centellograma normal excluye el diagnóstico de TEP. Menos del 15% de las TEP tienen un estudio de alta probabilidad y la mayoría (65-80%) tienen una probabilidad intermedia, lo que hace necesario otro estudio para confirmar el diagnóstico. Por este motivo, en los últimos años ha tomado protagonismo la angiotomografía axial compu-tarizada (angio-TAC) multicorte. Sin embargo, cuando este método no está disponible o no se considera adecuado (paciente inestable, alergia al yodo, embarazo o insuficiencia renal grave), el centellograma V/Q sigue siendo una herramienta útil, especialmente en los individuos sin enfermedad cardiopulmonar previa. Una radiografía de tórax normal aumenta significativamente la especificidad del método. Una perfusión pulmonar anormal con una radiografía tórax normal sugiere TEP.
Tomografía computarizada
Es el método de elección inicial para confirmar el diagnóstico de TEP. La presencia de defectos intralu-minales en el tronco de la arteria pulmonar o las ramas lobulares tiene un valor predictivo positivo del 85%. Los defectos subsegmentarios presentan mayores limitaciones en el diagnóstico. Estos últimos constituyen entre el 10% y el 30% de las embolias pulmonares. Los nuevos equipos con cabezales múltiples aumentan las chances de diagnosticar trombos periféricos y evaluar su grado de organización (indicativo de su antigüedad). Además, permiten obtener una angiografía del territorio de la vena cava inferior y eventualmente descartar TVP.
Sus limitaciones son el embarazo, la sensibilidad al contraste y la insuficiencia renal.
En el estudio PIOPED II, realizado con TAC multi-corte, la sensibilidad fue del 83% y la especificidad del 96%. En pacientes con una probabilidad clínica baja-intermedia, la TAC posee un elevado valor predictivo negativo (96-89%), pero con alta probabilidad este valor disminuye en forma significativa (valor predictivo positivo 60%); en este caso debe descartarse el diagnóstico con el método de referencia (patrón oro), que es la an-giografía pulmonar, cuando la sospecha clínica es alta.
Este estudio demostró que la evaluación con TAC con múltiples detectores presenta un rédito similar a la angiografía pulmonar.
Eco-Doppler en la trombosis venosa profunda
El diagnóstico de TVP es una manera indirecta para determinar la posibilidad de TEP. En presencia de TEP, la TVP es positiva en el 50% al 70% de los casos. Además, el 50% de los enfermos con TVP presentan evidencia de TEP asintomática. En los pacientes con TVP y TEP clínica, la presencia de trombosis pulmonar se confirma en el 90% de los casos.
El eco-Doppler venoso de los miembros inferiores es el método diagnóstico más útil, fácil y accesible para arribar al diagnóstico de TVP. La presencia de una vena no colapsable constituye el pilar confirmatorio, con una sensibilidad mayor del 90% y una especificidad del 95% para el diagnóstico de trombosis proximal. Sin embargo, un eco-Doppler venoso de los miembros inferiores es normal en un 30-50% de los pacientes con TEP; el método no excluye entonces el diagnóstico de TEP (aunque reduce su probabilidad). Esto se debe a la sensibilidad del método y a la presencia de trombosis eventual en otros territorios (pelviana, miembros superiores, etc.). La ausencia de TVP determinada por eco-Doppler se acompaña de un riesgo menor de recurrencia de TEP.
Angiorresonancia magnética con protocolo para tromboembolia de pulmón
Es una técnica no invasiva, con utilidades similares a las de la angiografía pulmonar. Posee alta sensibilidad y especificidad para el diagnóstico de TEP. Permite también evaluar la función y la dilatación del VD. Presenta algunas limitaciones, como el potencial desarrollo de nefroesclerosis por gadolinio, y la necesidad eventual de sedación y la duración prolongada del estudio.
Angiografía pulmonar
Es un método invasivo y patrón para el diagnóstico y confirmación de TEP. Se encuentra indicado en pacientes con riesgo clínico alto y pruebas no invasivas negativas o dudosas. Puede ser negativa en alrededor del 1-5% de los pacientes que efectivamente han padecido una TEP.
Sus ventajas son la rápida adquisición de imágenes, la posibilidad de evaluar otras entidades que pudieran estar generando los síntomas, la evaluación pronóstica según localización, magnitud del trombo y compromiso hemodinámico (evaluación de posibilidad de puntaje pulmonar agudo mediante los puntajes angiográficos de Miller I y II). En los pacientes críticos permite el intento de la reperfusión local con trombolíticos y el tratamiento endovascular con catéteres.
RECOMENDACIONES DE MÉTODOS DIAGNÓSTICOS POR IMÁGENES
Trombosis venosa profunda
Clase I
- Eco-Doppler venoso (Nivel de evidencia A).
- Venografía con contraste radiológico (limitada a la experiencia del centro) (Nivel de evidencia A).
- Venografía asociada con la tomografía computa-rizada pulmonar helicoidal multicorte (Nivel de evidencia A).
Tromboembolia de pulmón
Clase I
- Tomografía computarizada helicoidal multicorte (Nivel de evidencia A). - Angiografía pulmonar (Nivel de evidencia A) si no es posible confirmar el diagnóstico por otro método o está decidida la revascularización por trombectomía endovascular o quirúrgica.
Clase IIa
- Centellograma V/Q (Nivel de evidencia A).
- Tomografía computarizada helicoidal con un cabezal (Nivel de evidencia A).
- Eco-Doppler transesofágico (Nivel de evidencia A). En la Figura 1 se presenta un algoritmo diagnóstico para pacientes estables con sospecha clínica de TEP.
ESTRATIFICACIÓN DEL RIESGO
Las variables utilizadas para la estratificación del riesgo pueden ser clínicas, de laboratorio, electrocar-diográficas y de imágenes. Esta clasificación del riesgo deberá contemplar el riesgo de muerte o descompensación hemodinámica, pero también de sangrado mayor incluyendo la hemorragia intracraneal con el objetivo de establecer la conducta clínica y el tratamiento más adecuado. No existe consenso en la definición exacta de "submasivo" como está definido por la American Heart Association (AHA) o de "riesgo intermedio" según la definición de la European Society of Cardiology (ESC); sin embargo, se han identificado distintas variables para estratificar el riesgo de los pacientes con TEP.
1. TEP de riesgo alto (representan aproximadamente el 5% de todos los pacientes, tienen una mortalidad mayor del 15% a corto plazo), por lo que deberían ser tratados de manera más intensiva y eventualmente invasiva.
2. TEP de riesgo intermedio (representan aproximadamente el 30-50% de todos los pacientes sintomáticos). Involucra un espectro muy amplio de pacientes entre los cuales se encuentran aquellos con menor riesgo por presentar alguna variable de pronóstico adverso y pacientes con la suma de variables de riesgo o comorbilidades que lo transforman en un paciente de mayor riesgo. Una de ellas es el síncope, que en el contexto de la TEP debe pensarse en una embolia central proximal, que se fragmenta, permitiendo el restablecimiento de la circulación.
3. TEP de riesgo bajo (la mayoría de los pacientes con TEP), con una mortalidad a corto plazo menor del 1%. Estos pacientes se beneficiarían con una estrategia no invasiva con anticoagulación y egreso hospitalario precoz o eventual manejo ambulatorio en casos particulares.
En la estratificación de riesgo de la TEP deben utilizarse distintas variables pronósticas. Dentro de la evaluación clínica pueden utilizarse parámetros sencillos y evidentes como la percepción de disnea significativa (Escala de Borg > 8). La taquicardia persistente y especialmente la existencia de mayor frecuencia cardíaca que presión arterial sistólica (índice de shock: FC/PAS > 1). La hipoxemia, la desaturación de oxígeno y los parámetros de perfusión tisular alterados (ácido láctico > 2 mmol/L; saturación venosa central < 70 mm Hg) también son de utilidad para evaluar el riesgo.

Fig. 1. Algoritmo diagnóstico para pacientes estables con sospecha clínica de trombo-embolia de pulmón (TEP). ECG: Electrocardiograma. Rx: Radiografía. TAC: Tomografía axial computarizada. V/Q: Ventilación/perfusión. MMII: Miembros interiores.
La escala PESI (Pulmonary Embolism Severity Index) (Tabla 3) está ampliamente validada y también es útil en la estratificación del riesgo. (10, 11)
La dilatación del VD, ya sea medido por ecocardiograma o angio-TAC, el incremento del índice diámetro del VD/diámetro del ventrículo izquierdo (VI) > 0,9 y especialmente la disfunción grave del VD conllevan un pronóstico adverso. De la información que puede obtenerse de la angio-TAC, solo la dilatación del VD y la ubicación proximal de los trombos en el tronco de la arteria pulmonar o las ramas lobulares se han asociado con pronóstico adverso. Los pacientes con TVP extensa proximal o bilateral, trombo sésil o trombo en tránsito también se consideran de mayor riesgo (Tabla 4).
TROMBOEMBOLIA DE PULMÓN DE RIESGO ALTO
Definición
El riesgo alto está definido por la inestabilidad hemodinámica secundaria a la falla del VD y no por el grado de interrupción del árbol vascular pulmonar.
En la práctica, incluye cuatro grupos de pacientes: 1. Signos clínicos de hipoperfusión tisular, bajo gasto cardíaco con shock inminente y mala perfusión periférica (disnea en clase funcional I V, extremidades frías, livideces, sudoración, con sensorio alterado, habitualmente taquicárdicos y con caída del ritmo diurético).
2. Shock manifiesto con hipotensión (PAS < 90 mm Hg o una caída de al menos 40 mm Hg por 15-30 minutos) no explicable por otra causa (taquiarritmia, hipovolemia, taponamiento, sepsis, neumotórax hipertensivo).
3. Hipotensión sostenida que requiera apoyo inotró-pico o vasopresor, insuficiencia respiratoria grave con o sin requerimiento de asistencia respiratoria mecánica (ARM).
4. Paro cardiorrespiratorio. La inestabilidad hemodinámica se origina en la falla
súbita del VD secundaria al incremento brusco de la resistencia vascular pulmonar (RVP) producida por la obstrucción brusca de la arteria pulmonar o de algunas de sus ramas principales. El impacto de un evento em-bólico depende esencialmente del tamaño del émbolo, de su localización en el árbol vascular pulmonar, de la reserva cardiorrespiratoria preexistente y del estado general del paciente.
La sobrecarga aguda de presión produce aumento de la presión intracavitaria en el VD, lo que ocasiona una disminución de la presión de perfusión coronaria con isquemia, disfunción y dilatación del VD. Esto genera aumento de la tensión ventricular y aumento del consumo de oxígeno perpetuando la isquemia. La dilatación aguda del VD produce disminución de la distensibilidad del VI, con disminución de la precarga de este y disminución del gasto cardíaco y shock. La dilatación del VD también puede generar insuficiencia tricuspídea significativa con disminución del gasto cardíaco derecho, con disminución de la precarga y del gasto cardíaco del VI.
Aunque los trombos en tránsito se observan solo en el 4% de los pacientes, esta condición se considera de riesgo alto por mayor mortalidad y porque la asociación
Tabla 3. Estratificación de riesgo en la tromboembolia de pulmón. Escala PESI (Pulmonary Embolism Severity Index)
| Escala PESI | |||||
| Variable | Puntos | ||||
| Edad | 1 punto por año de edad | ||||
| Género masculino | 10 | ||||
| Cáncer | 30 | ||||
| Insuficiencia cardíaca | 10 | ||||
| Enfermedad pulmonar crónica | 10 | ||||
| FC > 110 lpm | 20 | ||||
| Presión arterial < 100 mm Hg | 30 | ||||
| Frecuencia respiratoria = 30/min | 20 | ||||
| Temperatura axilar < 36 ºC | 20 | ||||
| Alteración del estado mental | 60 | ||||
| Saturación de oxígeno < 90% | 20 | ||||
| Clase I (riesgo muy bajo): < 65 puntos | . Clase II | (riesgo bajo): | 65-85 | puntos. | Clase III (riesgo |
| intermedio): 86-105 puntos. Clase IV (riesgo alto): 106-125 puntos. | Clase V | (riesgo muy alto): | |||
| > 125 puntos. | |||||
| Escala PESI | simplificada | ||||
| Variable | Puntos | ||||
| Edad > 80 años | 1 | ||||
| Cáncer | 1 | ||||
| Enfermedad cardiopulmonar crónica | 1 | ||||
| FC > 110 lpm | 1 | ||||
| Presión arterial sistólica < 100 mm Hg | 1 | ||||
| Saturación de oxígeno < 90% | 1 | ||||
| Riesgo bajo: 0 puntos. Riesgo alto = 1 | punto. | ||||
FC: Frecuencia cardíaca. lpm: Latidos por minuto.
Tabla 4. Variables pronósticas útiles para la estratificación de riesgo en la tromboembolia de pulmón

En la Figura 2 se representa esquemáticamente la fisiopatología del shock en la TEP. En la Figura 3 se muestra el algoritmo diagnóstico inicial frente al paciente con sospecha de TEP con compromiso hemodinámico.

Fig. 2. Fisiopatología del shock en la tromboembolia de pulmón. VD: Ventrículo derecho. VI: Ventrículo izquierdo.

Fig. 3. Algoritmo diagnóstico inicial frente al paciente con sospecha de tromboembolia de pulmón (TEP) con compromiso hemodinámico. TAC: Tomografía axial computarizada. VD: Ventrículo derecho.
Ecocardiografía
En un enfermo hemodinámicamente inestable, el ecocardiograma es una herramienta útil porque abre una serie importante de diagnósticos diferenciales: taponamiento cardíaco, infarto agudo de miocardio, disección aórtica, insuficiencia valvular aguda.
Es el primer estudio a realizar en la cabecera del paciente inestable con imposibilidad de traslado para realizar estudios complementarios. La sobrecarga aguda de presión del VD en ausencia de enfermedad valvular o ventricular izquierda con o sin hipertensión pulmonar confirma la sospecha de TEP de riesgo alto. Un VD normal descarta la TEP como causa de la descompensación hemodinámica.
Arteriografía pulmonar y cateterismo derecho
La arteriografía pulmonar es el patrón oro para el diagnóstico de TEP. Pero la angio-TAC multicorte la ha equiparado con equivalente sensibilidad y especificidad por su disponibilidad. Diversos metaanálisis demostraron que una angio-TAC multicorte negativa, al igual que una angiografía negativa, excluye la TEP.
En el caso de la TEP de riesgo alto, el cateterismo permite confirmar el diagnóstico y ofrece la posibilidad de realizar maniobras terapéuticas de reperfusión locales, especialmente en pacientes inestables con riesgo alto de sangrado que no son candidatos a una trombecto-mía quirúrgica y en aquellos pacientes con fracaso de la fibrinólisis sistémica. En casos seleccionados donde exista fuerte sospecha de enfermedad coronaria asociada debe realizarse también una coronariografía diagnóstica.
Tratamiento
La terapéutica apropiada en el paciente con TEP y colapso hemodinámico es la reperfusión de los vasos ocluidos lo antes posible y con el método más efectivo y en relación con el paciente: (12, 13) trombolíticos sistémicos, tratamiento endovascular con o sin fibri-nolíticos o la trombectomía quirúrgica. Los pacientes con TEP de riesgo alto deben recibir un sostén he-modinámico adecuado destinado a prevenir y tratar el shock mientras se decide la terapia de reperfusión. Los pacientes sin contraindicaciones pueden recibir trombolíticos sistémicos (Clase I, Nivel de evidencia B). En aquellos pacientes con contraindicaciones, riesgo alto de sangrado o sospecha de trombo organizado que, probablemente, no responderán a fibrinolíticos podrá considerarse en centros con experiencia la trombecto-mía quirúrgica (Clase Ib, Nivel de evidencia C) o por hemodinamia (Clase IIa, Nivel de evidencia C). En pacientes con trombo en cavidad cardíaca derecha y existencia de comunicación interauricular, indicación de asistencia circulatoria derecha o ECMO se preferirá el tratamiento quirúrgico. Frente a la persistencia de inestabilidad hemodinámica luego de la infusión de trombolíticos deberá considerarse la trombectomía por hemodinamia o quirúrgica.
Reanimación inicial
Expansión con cristaloides: En la mayoría de los pacientes con shock de cualquier etiología, la expansión empírica con volumen suele ser uno de los primeros gestos terapéuticos. Si la causa del shock es por falla del VD, la expansión tiene un papel limitado, ya que la sobreexpansión (> 15 mm Hg de presión venosa central) resulta perjudicial, agravando la isquemia y perpetuando o precipitando el shock por múltiples mecanismos. El aumento de la presión intracavitaria en el VD puede reducir el gradiente de perfusión coronaria del VD, desplazar el septum interventricular aumentando las presiones de fin de diástole del VI con eventual disminución del gasto cardíaco y, en consecuencia, de la perfusión coronaria. Si el VD no está críticamente dilatado, se puede intentar una expansión con cristaloides con precaución. Si con 500 a 1.000 ml no hay respuesta, se sugiere detener la expansión y comenzar con inotrópicos y vasopresores para aumentar la tensión arterial media (TAM) a 70-80 mm Hg y mejorar el gradiente de perfusión entre la aorta y la coronaria derecha mientras se decide una estrategia de reperfusión.
Drogas y dispositivos para el tratamiento del shock por tromboembolia de pulmón
Es necesario mantener una presión media adecuada para minimizar la isquemia ventricular derecha (el VD se irriga tanto en diástole como en sístole). Se sugiere la combinación de drogas de acuerdo con la disponibilidad y la experiencia de cada centro (p. ej., noradrenalina para sostener la presión arterial junto con dobutamina para incrementar el gasto cardíaco y vasodilatar el lecho vascular pulmonar). Es importante recordar que el sostén inotrópico debería ser un puente a la reperfusión en la mayoría de los casos.
Dobutamina: Es un inotrópico betaagonista con fuerte acción vasodilatadora pulmonar y periférica. Tiene efecto cronotrópico positivo, por lo que debe utilizarse con cautela en pacientes con taquicardia.
Milrinona: Es un inhibidor de la fosfodiesterasa III, con efecto inotrópico positivo y acción vasodilatadora pulmonar y periférica. Es una droga especialmente útil en los pacientes con taquicardia que requieren inotropismo.
Noradrenalina: Es la droga más eficaz para aumentar la TAM. Tiene fuerte efecto vasoconstrictor por efecto alfa 1, produciendo incremento tanto de la presión sistémica como pulmonar. Tiene leve efecto beta 1 inotrópico, lo cual la hace apropiada para pacientes taquicárdicos e hipotensos.
Adrenalina: Es una catecolamina con actividad alfa y beta. En dosis bajas es inotrópica, vasodilatadora. En dosis altas se intensifica el efecto alfa 1, produciendo vasoconstricción sistémica y pulmonar. Deberían evitarse las dosis altas por el efecto taquicardizante.
Dopamina: Tiene efecto inotrópico beta, alfa y do-paminérgico. En dosis bajas (hasta 3 mg/kg/min) tiene efecto dopaminérgico (diurético) y no tiene efecto vasoconstrictor sistémico. Con dosis más elevadas se manifiesta un efecto beta 1 y beta 2 y alfa 1 vasoconstrictor periférico, que eleva la presión arterial sistémica.
Vasopresina: Se une a los receptores de membrana específicos de vasopresina V1 (AVPR1A) en el músculo liso vascular y estimula la activación de la proteincina-sa C, a través del segundo mensajero, aumentando la concentración de calcio libre intracelular, lo que da por resultado la contracción del músculo liso vascular. Se utiliza como droga de segundo orden cuando se alcanzan dosis máximas de algún simpaticomimético y no se consigue aumentar la TAM. En la práctica, se adiciona vasopresina cuando no se alcanzan los objetivos con noradrenalina en dosis de 0,5 mg/kg/min. La dosis varía entre 0,01 y 0,04 U/min. Es ideal en pacientes que requieren incremento de la presión arterial y no se quiera producir mayor taquicardia.
Fenilefrina: Es un agonista alfa 1 puro, por lo que tiene efecto vasoconstrictor sin efecto cronotrópico positivo. La dosis es de 0,1-0,5 mg/kg/min.
Óxido nítrico (NO): El NO inhalado es un potente vasodilatador pulmonar selectivo, de vida media corta, sin efecto en la circulación sistémica, lo que permite su utilización en pacientes con falla del VD e inestabilidad hemodinámica. Disminuir la RVP es crucial en el tratamiento de la hipertensión pulmonar aguda con falla del VD grave que no logra compensarse con los inodilatadores. Se usa habitualmente con el paciente ventilado, pero puede administrarse mediante cánula nasal o máscara facial. Su administración prolongada en concentraciones altas puede provocar metahe-moglobinemia. La supresión debe ser gradual, ya que puede generarse un aumento brusco de la RVP por efecto rebote. Es una herramienta costosa y requiere experiencia en su manejo.
Asistencia circulatoria mecánica del ventrículo derecho: Debe considerarse su utilización frente a un paciente inestable bajo dosis máximas de inodilatadores y vasopresores; su uso permite, asimismo, reducir la dosis de estos para atenuar la agresión isquémica y metabólica al VD. El ECMO veno-arterial es una herramienta útil en la TEP con la combinación de falla del VD asociada con hipoxemia; es una asistencia parcial que puede aportar un apoyo de hasta 4,5 litros y garantiza una mejor oxigenación. Es una herramienta costosa y de corta duración (de 7 a 14 días). Puede ser central (por esternotomía), colocado en quirófano o por vía periférica (por punción) y disponible en la cabecera del paciente (Clase IIa, Nivel de evidencia B). No se indica ECMO si hay alteración de la coagulación porque requiere anticoagulación plena. Algunos autores han obtenido buenos resultados utilizando este método como puente a la reperfusión por trombectomía quirúrgica o endovascular por he-modinamia, o como puente a la recuperación o a una asistencia de mayor duración.
Las asistencias de moderada (Levitronic) o larga duración (Thoratec, Aviomed) del VD o biventri-culares están reservadas para pacientes que requieren un período más prolongado para su recuperación. No están indicadas en pacientes con falla multiorgánica grave y enfermedades terminales o trastornos neuro-lógicos (Tabla 5).
Tratamiento de la insuficiencia respiratoria Hipoxemia: La alteración V/Q y el shunt son los mecanismos más comúnmente involucrados para generar hipoxemia en la TEP. La vasoconstricción en la hipoxia alveolar es una respuesta fisiológica que trata de redistribuir el flujo pulmonar hacia las áreas del pulmón mejor ventiladas. Existen áreas alveolares ventiladas no perfundidas y áreas perfundidas no ventiladas. La imposibilidad de corregir la hipoxemia con oxígeno suplementario pone de manifiesto la existencia de shunt de sangre venosa de derecha a izquierda a través del corazón, los pulmones o ambos. Cuando la hipoxia es generalizada, se producen vasoconstricción arterial pulmonar difusa y, como consecuencia, un agravamiento de la hipertensión pulmonar que genera mayor claudicación del VD.
Hipercapnia: Se conoce desde hace tiempo el efecto vasoconstrictor pulmonar de la hipercapnia. El aumento de CO2 puede incrementar la RVP y la presión arterial pulmonar (PAP) de forma significativa. Esto condiciona una caída del gasto cardíaco y un incremento del volumen de fin de diástole del VD.
Asistencia respiratoria mecánica: Ante todo deben considerarse dos aspectos importantes. Uno está relacionado con la sedación en el momento de intubar al paciente; debe efectuarse con cautela evitando los bolos intravenosos, ya que pueden precipitar el shock o generar una hipotensión irreversible por isquemia del VD y paro cardiorrespiratorio. La descarga adre-nérgica endógena secundaria a la hipoxemia sostiene la presión arterial y dicho mecanismo compensador puede interrumpirse con la sedación. El otro aspecto está relacionado con el hecho de que la administración de presión positiva en la vía aérea puede incrementar aún más la presión en la arteria pulmonar, precipitando la claudicación del VD y eventualmente empeorando la hipoxemia por aumento del shunt intracardíaco de derecha a izquierda, además de reducir el retorno venoso al VD por aumento de la presión intratorácica.
Tabla 5. Inotrópicos y vasopresores útiles para el manejo de la inestabilidad hemodinámica
| Droga | Mecanismo de acción | Dosis |
| Adrenalina | Agonista a y b adrenérgico | 0,1 a 0,5 µg/kg/min |
| ampolla 1 mg | (7 a 35 µg/min) | |
| Dobutamina | Agonista b1 adrenérgico con | 5 a 10 µg/kg/min |
| ampolla 250 mg | leve efecto b2 y a | |
| Dopamina | Agonista a1 y b1 adrenérgico | 5 a 10 µg/kg/min |
| ampolla 200 mg | con leve efecto b2, dopaminérgico | |
| Fenilefrina | Agonista a1 adrenérgico | 0,1 a 0,5 µg/kg/min |
| ampolla 10 mg | ||
| Milrinona | Inhibidor de la fosfodiesterasa III | 0,375 a 0,75 µg/kg/min |
| ampolla 10 mg | Ajustar dosis en falla renal | |
| Noradrenalina | Agonista a1 y b1 adrenérgico | 0,1 a 0,5 mg/kg/min |
| ampolla 4 mg | sin efecto b2 | (7 a 35 µg/min) |
| Vasopresina | Agonistas receptores V1 vascular | |
| ampolla 20 UI | y activación proteincinasa C | 0,01 a 0,04 unidades/min |
En nuestra opinión, deben ventilarse los pacientes con: 1) shock grave refractario al sostén hemodinámico con dosis óptimas de inotrópicos y precarga adecuada del VD y 2) insuficiencia respiratoria con hipoxemia significativa refractaria (PAFI < 200). La ventilación no invasiva no debería indicarse en este grupo de pacientes. Se recomienda especialmente evitar volúmenes corrientes altos y presión positiva al final de la espiración (PEEP) elevada.
La recomendación de algunos autores es controlar la presión plateau, manteniéndola, de ser posible, por debajo de 28 cm de H2O y evitar una PEEP superior a los 5 cm de H2O, ya que la PEEP es de utilidad dado que recluta alvéolos previamente cerrados sin sobredistender el pulmón sano. La sobredistensión incrementa innecesariamente la RVP y deteriora la función pulmonar, con la consecuente depresión del VD, que da por resultado a su vez mayor disminución del gasto cardíaco.
La hiperventilación se puede emplear para bajar la PAP (p. ej., en la vasoconstricción inducida por acido-sis). En estos casos es conveniente controlar la presión de la vía aérea y las curvas de flujo-tiempo para evitar la hiperinsuflación del pulmón que puede ser inducida por las altas frecuencias.
Ante un paciente con hipoxemia refractaria, en centros con experiencia puede considerarse la utilización del ECMO veno-venoso y en el caso de inestabilidad hemodinámica, el ECMO veno-arterial.
TROMBOEMBOLIA DE PULMÓN DE RIESGO BAJO
Los pacientes con mejor pronóstico son los que no presentan ninguna de las variables de riesgo que definen la TEP de riesgo alto o de riesgo intermedio, es decir, se trata de pacientes estables hemodinámicamente, sin dilatación ni disfunción del VD, sin elevación de biomarcadores de daño miocárdico ni alteraciones elec-trocardiográficas de riesgo. Definen un subgrupo con una mortalidad cercana al 1%. Para su determinación, las escalas clínicas como el PESI (Pulmonary Embolism Severity Index) o el SPESI (PESI simplificado) (14) y los predictores de riesgo tomográficos son de gran utilidad y se han validado ampliamente. El mayor valor del PESI consiste en identificar a los pacientes de riesgo bajo. (15-17)
El tratamiento comienza con un anticoagulante parenteral, habitualmente una heparina de bajo peso molecular (HBPM) durante al menos cinco días en superposición con antagonistas de la vitamina K (AVK) hasta alcanzar una RIN de entre 2 y 3. Debido a las diferentes vidas medias de los factores circulantes, el efecto anticoagulante no se logra antes de los 4-7 días de tratamiento.
Si bien los AVK pueden utilizarse desde el primer día, es recomendable asociarlos a los anticoagulantes parenterales por 48 a 72 horas.
Los nuevos anticoagulantes orales (NACO) podrían considerarse en este subgrupo de pacientes siempre que
tengan las condiciones clínicas adecuadas (depuración de creatinina > 30 ml/min, sin falla hepática, posibilidad de costear la medicación, tener buena adherencia, sin cáncer activo, embarazo o utilización de doble antiagregación plaquetaria concomitante) (Figura 4).
TROMBOEMBOLIA DE PULMÓN DE RIESGO INTERMEDIO
La definición actual de TEP de riesgo intermedio involucra a los pacientes con PAS > 90 mm Hg que presentan una o más variables de riesgo (véase Tabla 2).
Sin embargo, solo la inestabilidad hemodinámica ha demostrado que posee valor pronóstico por sí misma. La mortalidad temprana en la TEP es ocasionada por falla aguda del VD y shock cardiogénico. (18) Posteriormente, el riesgo de muerte durante la internación está determinado por la embolia recurrente y la enfermedad de base o condición clínica preexistente. Los objetivos primordiales son la pronta reperfusión para aliviar la sobrecarga de presión sobre el VD, la prevención de eventos tromboembólicos recurrentes y la mejoría de la función del VD.
La utilización conjunta de distintas variables son las que han demostrado que tienen mayor valor pronóstico.
Tratamiento fibrinolítico en la tromboembolia de pulmón de riesgo intermedio
La mayoría de los pacientes con TEP de riesgo intermedio tratados solo con terapia anticoagulante evolucionan favorablemente y presentan una mortalidad cercana al 3%, por lo que el beneficio de un eventual tratamiento fibrinolítico se neutralizaría por el riesgo de sangrado. La tasa de sangrado mayor en los distintos ensayos es del 20%, mientras que la de hemorragia intracerebral mortal es del 2% al 5%. (19)
Ningún estudio a la fecha ha demostrado reducción de la mortalidad en la TEP de riesgo intermedio. (20) En los últimos años se ha verificado en distintos me-taanálisis una tendencia a reducción de la mortalidad temprana en las TEP de riesgo alto y de riesgo intermedio en pacientes menores de 65 años a expensas de un riesgo de sangrado mayor. (21)
El tratamiento fibrinolítico no está indicado de rutina en la TEP de riesgo intermedio. El mayor beneficio se obtendría en pacientes menores de 75 años con disfunción grave del VD más la existencia de factores de riesgo mayor: hipoxemia grave persistente (saturo-metría < 90%), elevación de troponinas, tendencia a la hipotensión, inestabilidad hemodinámica incipiente o signos clínicos o subclínicos de shock (oliguria, mala perfusión periférica, taquicardia persistente > 110 latidos/min).
En este tipo de pacientes que presentan múltiples variables de riesgo de pronóstico adverso, la estrategia de solo anticoagular, particularmente si el paciente tiene riesgo bajo de sangrado, lo expone al shock con una mortalidad alta. Por ello, en este escenario debería considerarse una terapia de reperfusión más efectiva con trombolíticos o trombectomía (quirúrgica o por hemodinamia). Los pacientes con dilatación leve del VD más alguna variable de riesgo no serían candidatos en principio para un tratamiento trombolítico; deberían ser revaluados en forma estrecha para detectar signos de inestabilidad incipiente que obliguen a considerar el tratamiento de reperfusión.

Fig. 4. Algoritmo para la estratificación de riesgo y la terapéutica inicial en la tromboembolia de pulmón (TEP). VD: Ventrículo derecho. BNP: Péptido natriurético cerebral. PESI: Pulmonary Embolism Severity Index. ECG: Electrocardiograma. CF: Clase funcional. PAFI: Relación de la presión arterial de oxígeno y la fracción inspirada de oxígeno (PAO2/FIO2).
El estudio PEITHO (22) comparó tenecteplase (TSE) más HBPM versus HBPM sola en pacientes normotensos que tuvieran disfunción o dilatación del VD por ecocardiograma o TAC y biomarcadores de daño miocárdico (troponina T o I). Se observó una tasa de mortalidad del 1,2% en el grupo trombolítico y del 1,8% en el grupo control, mientras que la tasa de hemorragia intracraneana fue del 2% en el grupo trombolítico y del 0,2% en el grupo control.
En dicho estudio se redujo el punto final combinado de muerte y colapso hemodinámico dentro de los 7 días, con una reducción del punto final primario en números absolutos del 5,6% versus 2,6%; RRA 3%. El 3,4% de los pacientes en el grupo de control que recibían solo anticoagulación (17/500) presentaron inestabilidad clínica que requirió tratamiento trombolítico, lo que sugiere que en estos pacientes la estrategia de solo anticoagulación puede resultar adecuada en un porcentaje importante de ellos. En el estudio PEITHO se observó un riesgo mayor de hemorragia intracerebral en mayores de 75 años con la dosis plena de TSE. Es de notar que los pacientes incluidos en este estudio no eran de riesgo alto, lo que se desprende de la mortalidad observada en el grupo control (1,8%).
El MOPETT (23) fue un estudio pequeño que incluyó pacientes con TEP de riesgo intermedio. Se utilizó la mitad de la dosis de alteplase (50 mg) y HBPM versus
HBPM sola. Se observó una reducción de la PAP y de TEP recurrente a los 28 meses de seguimiento sin incremento significativo del sangrado.
El estudio TOPCOAT, (24) también pequeño, comparó TSE con HBPM en pacientes con TEP de riesgo intermedio. En este estudio se evaluó la evolución intrahospitalaria, a los 50 días y a los 3 meses de seguimiento; se encontró una reducción de los días de internación y se constató una mejora de la calidad de vida SF-36.
En los últimos años ha surgido evidencia sobre la utilidad del tratamiento endovascular en la TEP de riesgo intermedio-alto y la posibilidad de utilizar dosis menores de fibrinolíticos locales, con eventual menor riesgo de sangrado. El estudio ULTIMA (25) (Ultra-sound Accelerated Thrombolysis of Pulmonary Embo-lism) incluyó 59 pacientes con TEP sintomática, con evidencia por TAC de embolia en al menos una rama principal o arteria lobular proximal de lóbulo inferior y un índice diámetro del VD/diámetro del VI = 1 en la vista de 4 cámaras apical. Mostró que el tratamiento fibrinolítico con 10 a 20 mg de rt-PA en infusión local durante 15 horas y guiado por catéter versus solo anticoagulación con HBPM redujo de manera significativa el índice diámetro del VD/diámetro del VI dentro de las 24 horas sin incremento en el riesgo de sangrado.
El estudio SEATTLE I fue un estudio retrospectivo de seguridad y eficacia del tratamiento con dosis bajas de fibrinolíticos guiados por catéter. El SEATTLE II (26) fue un ensayo prospectivo, multicéntrico con solo una rama de tratamiento, en el que se evaluó en 150 pacientes la eficacia de la utilización de trombolíticos locales guiados por catéteres en pacientes con TEP de riesgo alto (20%) y de riesgo intermedio (80%). La media de reducción del índice diámetro del VD/diámetro del VI fue de 1,55 preprocedimiento a 1,13 a las 48 horas del procedimiento (p < 0,0001) (Figura 4).
Los fibrinolíticos más utilizados en nuestro medio son: estreptoquinasa 1,5 millones UI durante 2 horas sin heparina intravenosa al mismo tiempo, y alteplase (rt-PA) 100 mg en infusión durante 2 horas o, en casos de colapso hemodi-námico inminente, 0,6 mg/kg durante 15 minutos (dosis máxima 50 mg). Puede considerarse o no heparina sódica concomitante según el riesgo de sangrado cuando se opta por rt-PA.
Evaluación del riesgo de sangrado
La utilización de anticoagulantes o trombolíticos implica la identificación de los pacientes con mayor riesgo de sangrado. El beneficio del tratamiento fibrinolítico en las TEP de riesgo intermedio pareciera que es menor que en las de riesgo alto por el elevado riesgo de sangrado mayor, especialmente en mayores de 65 años. (27)
En la actualidad no disponemos de escalas para evaluar riesgo de sangrado con trombolíticos que se hayan validado suficientemente, (28, 29) por lo que extrapolamos los datos de escalas de riesgo de sangrado con anticoagulación. El registro RIETE (30) incluyó pacientes principalmente con TVP, aunque también con TEP. Clasifica a los pacientes en riesgo bajo, intermedio y alto de sangrado acorde al puntaje obtenido. Otra escala que puede utilizarse es la del American College of Chest Physicians, (31) que también los divide en riesgo de sangrado bajo, intermedio o alto. La edad mayor de 75 años por sí sola debería considerarse de riesgo alto (Tabla 6).
La indicación de trombolíticos para las TEP de riesgo intermedio (en ausencia de contraindicaciones) deberá considerarse en los pacientes que presentan una relación VD/VI > 0,9 por TAC o ecocardiograma y la suma de al menos dos variables de riesgo (esta clase de TEP son identificadas como de riesgo intermedio-alto): troponina, BNP o NT-proBNP elevados e hipoxemia grave persistente. Existen además otras variables indicadoras de colapso hemodinámico inminente dentro de las cuales sugerimos considerar: PAFI < 300, ácido láctico > 2 mOsm/L, saturación de oxígeno de catéter venoso central < 70%, índice FC/PAS > 1, trombo central en arteria pulmonar. Considerar además la presencia de un riesgo bajo a intermedio de sangrado según los puntajes. Los pacientes con riesgo elevado de sangrado para la utilización de trombolíticos serían candidatos para una reperfusión por trombectomía quirúrgica o por hemodinamia. En nuestro medio, esta última opción aparece como la más aconsejable, teniendo en cuenta que la cirugía requiere un equipo quirúrgico experimentado para llevarla a la práctica.
Tabla 6. Estratificación de riesgo de sangrado. Escala RIETE modificada
| Variable | Puntaje | ||
| Hemorragia mayor reciente (un mes) | 2,0 | ||
| Creatinina > 1,2 mg/dl | 1,5 | ||
| Anemia | 1,5 | ||
| Cáncer | 1 | ||
| Edad > 75 años | 5 | ||
| Riesgo bajo: 0. Riesgo intermedio: 1-4. | Riesgo | alto: | > 4. |
Más allá de las mencionadas variables hemodinámicas sugestivas de colapso hemodinámico, destacamos la importancia de solicitarlas e interpretarlas en el contexto clínico del paciente. La visión clínica del médico tratante cobra vital importancia cuando se solicita un método auxiliar diagnóstico, como también en el momento de decidir una conducta terapéutica.
MEDIDAS GENERALES Y TRATAMIENTO FARMACOLÓGICO
Medidas generales
En pacientes con TEP/TVP se recomienda la deambulación precoz, en la medida en que sea tolerada y no exista condición clínica de riesgo (trombosis extensa iliofemo-ral, trombo móvil, inestabilidad clínica o hemodinámi-ca). En caso de trombosis extensa y/o TEP de riesgo moderado y alto se recomienda la deambulación a partir del quinto al séptimo día de iniciada la anticoagulación. También se recomienda el uso de medias elásticas graduadas hasta la pantorrilla de 20 mm Hg de presión para tratar de reducir el riesgo de síndrome postrombótico (Clase IIa, Nivel de evidencia C).
Tratamiento anticoagulante
La terapéutica anticoagulante para la TVP y la TEP es similar, ya que ambas son manifestaciones de la misma enfermedad, denominada enfermedad tromboembólica venosa (ETV). Sin embargo, los pacientes que padecen TEP presentan una mortalidad significativamente mayor. La TEP recurrente es tres veces mayor en los que ya la han padecido previamente.
La anticoagulación tiene el objetivo de interrumpir la progresión de los fenómenos trombóticos, mientras que la fibrinólisis endógena actuará sobre los trombos ya formados.
En los pacientes con alta sospecha clínica de E T, y en ausencia de contraindicaciones, se sugiere comenzar el tratamiento lo más precozmente posible hasta que se pueda descartar o confirmar de manera fehaciente el diagnóstico (Clase I, Nivel de evidencia C).
Si la sospecha clínica es intermedia y los resultados demorarán más de 4 horas, se sugiere comenzar con tratamiento anticoagulante (Clase IIa, Nivel de evidencia C).
Si es de baja sospecha clínica, no se sugiere tratar a los pacientes mientras se esperan los resultados de pruebas diagnósticas en las siguientes 24 horas (Clase IIa, Nivel de evidencia C).
En pacientes con TVP aguda de miembros inferiores se recomienda la iniciación precoz de anticoagulantes orales (el mismo día que comenzó el anticoagulante parenteral). Continuar con anticoagulación parenteral, de ser posible, por un mínimo de 5 días hasta que la RIN sea igual o mayor de 2 por lo menos por 24 horas (Clase Ib, Nivel de evidencia B).
En pacientes con TVP aguda aislada se sugiere HBPM, anticoagulantes directos orales o fondaparinux en lugar de heparina no fraccionada (HNF) intravenosa o subcutánea (Clase IIa, Nivel de evidencia C).
En pacientes con TVP aguda proximal con contraindicaciones para anticoagulación está indicado el filtro de vena cava (Clase I, Nivel de evidencia B).
En pacientes con TEP se puede comenzar el tratamiento anticoagulante oral simultáneamente con el parenteral y mantener este último hasta lograr una RIN = 2 durante al menos 24 horas (Clase I, Nivel de evidencia B).
En pacientes con TEP de riesgo intermedio o alto que puedan ser candidatos a tratamiento fibrinolítico, intervención por catéteres o embolectomía quirúrgica debe utilizarse heparina sódica no fraccionada para eventualmente suspenderla y minimizar el riesgo de sangrado (Clase II, Nivel de evidencia B).
En la actualidad se recomienda el régimen acelerado de trombolíticos (Clase II, Nivel de evidencia C).
En pacientes con TEP de riesgo alto y no provocado se sugiere anticoagulación con enoxaparina durante al menos 3 o 4 semanas antes de rotar a la vía oral (Clase IIb, Nivel de evidencia C).
Los filtros de vena cava deben considerarse en los pacientes con TEP y contraindicación absoluta para anticoagulación y en aquellos con recurrencia a pesar de dosis terapéuticas de anticoagulación (Clase IIa, Nivel de evidencia C).
En los casos en que se considere que la recurrencia de TEP podrá ocasionar la muerte del paciente (escasa reserva cardiorrespiratoria) es razonable colocar un filtro de vena cava removible hasta superar dicha condición (Clase IIb, Nivel de evidencia C).
En pacientes que tengan colocado un filtro de vena cava inferior y no posean contraindicación para anticoagulación debe asegurarse un nivel óptimo de esta por el elevado riesgo de trombosis que genera el dispositivo (Clase IIa, Nivel de evidencia B).
Los filtros de vena cava removibles en pacientes sin contraindicación para anticoagulación deberían ser retirados antes de los 15 o 30 días y una vez superada la condición clínica que motivó su colocación, por el riesgo de complicaciones asociadas con el dispositivo (trombosis, infección, migración), sumado a la falta de evidencia de reducción de mortalidad a largo plazo (Clase IIa, Nivel de evidencia B).
Luego del retiro del filtro de vena cava inferior removible podría considerarse la anticoagulación con heparina durante las 48-72 horas posteriores (Clase IIb, Nivel de evidencia C).
Heparina no fraccionada
La anticoagulación con HNF es el tratamiento clásico inicial de la ETV. Las ventajas de esta droga biológica son su vida media corta, la inhibición de su efecto anticoagulante por la protamina y su bajo costo. Su desventaja es que requiere monitorización permanente. Se ha demostrado que cuanto mayor es la demora en obtener tiempos adecuados de anticoagulación, mayor es la posibilidad de progresión de la trombosis y también mayor la posibilidad de recidiva. Es por esto que se recomienda alcanzar tiempos útiles dentro de las 24 horas de comenzado el tratamiento.
Se inicia con un bolo de 5.000 UI por vía intravenosa, seguido por un goteo de 15-18 UI/kg/hora. El objetivo es alcanzar rápidamente un KPTT de 1,5 a 2,5 veces el basal. Se recomienda controlar el KPTT cada 4 horas hasta alcanzar el valor deseado, y luego cada 24 horas. Se recomienda ajustar las dosis de heparina siguiendo un nomograma.
El tratamiento con HNF no está exento de complicaciones, como el sangrado. Otro inconveniente es la variabilidad en su efecto por su acción indirecta a través de la antitrombina y por su unión a proteínas plasmáticas. Una complicación importante, que se observa en el 1% al 3% de los casos, es la trombocitopenia inmune que suele aparecer luego del quinto día del tratamiento. Para detectarla debe efectuarse un recuento de plaquetas, y si estas caen por debajo de 100.000/ mm3, o a la mitad del valor basal, debe interrumpirse el tratamiento con heparina. Este riesgo es algo inferior cuando se emplean HBPM. En la Argentina se puede utilizar la bivalirudina (no siempre accesible y de alto costo) como anticoagulante alternativo, especialmente si el paciente tiene insuficiencia renal grave. Se administra un bolo inicial de 0,10 mg/kg, seguido por una infusión de 0,10-0,25 mg/kg/hora, ajustando la dosis para mantener un KPTT de dos veces el valor basal. Las otras drogas que se pueden utilizar en trombocitopenia inmune son el fondaparinux o los NACO (rivaroxabán, dabigatrán y apixabán).
La HNF continúa siendo la droga de elección para cierto grupo de pacientes (insuficiencia renal, obesidad mórbida y en el perioperatorio) por la posibilidad de su rápida eliminación (vida media corta) y por su catabolismo extrarrenal (Clase Ia, Nivel de evidencia C). Se desaconseja el empleo de la heparina en forma de bolos intermitentes, ya que se incrementa considerablemente el riesgo de sangrado.
Heparinas de bajo peso molecular
Las HBPM actúan sobre el factor Xa y, en menor medida, sobre la trombina. Por esta razón, el KPTT no es un parámetro adecuado para evaluar su actividad. Tienen una biodisponibilidad cercana al 90% y una vida media prolongada, lo que las hace más predecibles. (32) Por esto, a excepción de algunas situaciones especiales (insuficiencia renal, embarazo, obesidad extrema), no es necesario monitorizar la coagulación. Si fuera necesario, se puede medir el factor Xa a las 4 horas de la dosis administrada por vía subcutánea. Se consideran niveles terapéuticos en la ETV entre 0,6 y 1,2 UAXa/ml.
Tienen menos incidencia de trombocitopenia autoinmune y de osteoporosis. Su efectividad es al menos similar a la de la HNF y en algunos estudios resultó superior. En los enfermos con cáncer son el tratamiento de elección durante los primeros 3 a 6 meses (Clase IIa, Nivel de evidencia B). Tienen las desventajas de que se eliminan casi exclusivamente por vía renal y de que solo son parcialmente inhibidas por la protamina. Por lo tanto, en pacientes con riesgo alto de sangrado y/o insuficiencia renal significativa se prefiere continuar utilizando HNF. Una vez suspendida la HBPM, su efecto cesa en aproximadamente 24 horas.
La dosis recomendadas son: nadroparina 86 UI/kg cada 12 horas o 171 UI/kg cada 24 horas y enoxaparina 1 mg/kg/ cada 12 horas o 1,5 mg/kg cada 24 horas por vía subcutánea.
Pentasacáridos
Fondaparinux: Es una droga anticoagulante indirecta, ya que, como las heparinas, actúa potenciando la antitrombina. Pero a diferencia de ellas, es un producto de síntesis con actividad anti-Xa pura. Puede utilizarse como anticoagulante parenteral desde la etapa aguda y es una alternativa de tratamiento al igual que las HBPM (Clase I, Nivel de evidencia A). Se administra por vía subcutánea en una dosis de 7,5 mg/día para el tratamiento de pacientes que pesan entre 50 y 100 kg. En los pacientes de menos de 50 kg deben usarse 5 mg/ día y en los de más de 100 kg, 10 mg/día. No tiene ni necesita controles de laboratorio y su vida media es de 17 horas, lo que permite una sola aplicación al día. No tiene antagonista específico y es tan efectivo y seguro como las heparinas en el tratamiento inicial de la ETV.
Anticoagulantes orales directos
Los NACO directos son una alternativa válida de anticoagulación con AVK (33) (Clase I, Nivel de evidencia B).
El dabigatrán, (34) el rivaroxabán, (35) el apixabán (36) y el edoxabán (37) (este último se encuentra en proceso de aprobación por la ANMAT) son antagonistas sintéticos y específicos contra ciertos factores de la coagulación y están aprobados para el tratamiento de la ETV. Algunas de las ventajas con estos fármacos son: puede evitarse el uso inicial de heparina (en el caso del rivaroxabán y el apixabán), no requieren monitori-zación de la coagulación, no generan trombocitopenia inmune, tienen un rápido comienzo de acción de 2 horas, no interfieren con los alimentos y poseen muy escasa interacción con otros medicamentos. Su vida media es corta y tienen depuración hepática y renal. Por otro lado, no pueden evaluarse con las pruebas habituales de la coagulación, con lo que se pierde un elemento de mucha importancia al evaluar un sangrado, un nuevo evento trombótico o para coordinar una cirugía de urgencia. Tampoco tienen antídoto y
solo se han considerado los concentrados de factores protrombínicos para los antagonistas del factor Xa en caso de un sangrado grave, pero con escasa experiencia clínica, aunque pareciera que estas drogas tienen menor riesgo de sangrado.
Tanto el rivaroxabán como el apixabán pueden utilizarse desde el inicio de la etapa aguda, aunque con una dosis mayor, y son una alternativa al tratamiento parenteral asociado con AVK.
TRATAMIENTO INVASIVO EN HEMODINAMIA
El objetivo primario es aliviar la sobrecarga aguda de presión sobre el VD y lograr la estabilidad hemodiná-mica del paciente. Los dispositivos más frecuentemente utilizados incluyen catéteres y balones para fragmentar y desplazar los émbolos, sistemas reolíticos de lisis y extracción, dispositivos de tromboaspiración y sistemas combinados para administración local de trombolíticos y lisis mecánica. En una revisión acerca de la utilización de diferentes sistemas de fragmentación, lisis mecánica y/o aspiración en más de 300 pacientes con TEP masiva, la tasa de éxito, definida como la mejoría inmediata del estado hemodinámico del paciente, fue superior al 80% y la tasa de mortalidad osciló entre el 0% y el 25%, aunque en un porcentaje elevado de los casos también se administraron fibrinolíticos locales o sistémicos. (38) En un metaanálisis (39) sobre 594 pacientes de seis estudios prospectivos y 29 retrospectivos en los que se utilizaron catéteres para fragmentación, aspiración o lisis reolítica de los trombos con o sin fibrinolíticos, se obtuvo mejoría clínica (estabilidad hemodinámica, mejor oxigenación y sobrevida) en el 87% de los pacientes; los autores concluyeron que la trombectomía por catéter es un tratamiento relativamente seguro y eficaz para la embolia pulmonar masiva aguda (Clase IIa, Nivel de evidencia C), sugiriendo además que en centros con experiencia debe considerarse un tratamiento de primera línea en esos pacientes. En la TEP de riesgo intermedio también podrían ser útiles especialmente en pacientes con contraindicación para trombolíticos, riesgo alto de sangrado o en quienes se presuma que por la evolución de los síntomas (> 14 días) el tratamiento trombolítico sistémico no resultará efectivo por estar fuera de ventana para los líticos (Clase IIb, Nivel de evidencia B).
Dispositivos y procedimientos
Fragmentación y desplazamiento de los grandes trombos proximales: En toda la anatomía vascular, la suma de las áreas de sección de los vasos periféricos de derivación es siempre mayor que el área de sección del vaso principal y es por esto que la fragmentación y el desplazamiento de los trombos desde los vasos proximales hacia el lecho distal permite disminuir la sobrecarga ventricular derecha grave. Se ha descripto la utilización de catéteres angiográficos convencionales o modificados y de balones de angioplastia con resultados diversos, y son los métodos más utilizados en nuestro medio. La asociación de fibrinolíticos locales al tratamiento mecánico endovascular permitiría obtener mejores resultados.
Embolectomía rotacional aspirativa: Existe escasa experiencia con la utilización de dispositivos capaces de fragmentar los trombos mediante un movimiento rotacional y aspirar los residuos hacia el exterior. La embolectomía rotacional aspirativa se ha presentado como una alternativa terapéutica en pacientes con TEP masiva. En la serie más reciente de 16 pacientes con TEP masiva se logró la extracción de trombos en el 94% de los pacientes tratados, con una caída significativa en la presión media de la arteria pulmonar.
Embolectomía por aspiración: La aspiración de trombos utilizando catéteres de angioplastia, vainas sin válvula o cánulas conectadas a sistemas de aspiración continua solo se ha comunicado en forma anecdótica.
Sistemas reolíticos para fragmentación y aspiración: Estos sistemas facilitan la maceración del trombo mediante la inyección de solución salina a alta presión y la aspiración de los residuos, con lo que se logra una mejoría en la presión de arteria pulmonar y en el índice de Miller.
Trombólisis dirigida por catéteres: En la actualidad existen dos formas de administrar trombolíti-cos localmente dentro de un émbolo pulmonar: a través de catéteres multiperforados o mediante un catéter de infusión que tiene un filamento capaz de emitir además ondas ultrasónicas, lo que facilita la rotura del trombo y la penetración de la droga en su interior.
BIBLIOGRAFÍA
1. Ubaldini J, Chertcoff J, Sampó E, Casey M, Ceresetto J, Boughen R y cols. Consenso de enfermedad tromboembólica. Consenso Argentino SAC. Rev Argent Cardiol 2009;77:411-28.
2. Klok FA, Kruisman E, Spaan J, Nijkeuter M, Righini M, Aujesky D, et al. Comparison of the revised Geneva score with the Wells rule for assessing clinical probability of pulmonary embolism. J Thromb Haemost 2008;6:40-4. http://doi.org/dfjwtc
3. Carrier M, Righini M, Djurabi RK, Huisman M V, Perrier A, Wells PS, et al. VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism. A systematic review of management outcome studies. Thromb Haemost 2009;101:886-92. http://doi.org/c2khwp
4. Klok FA, Mos IC, Huisman M V. Brain-type natriuretic peptide lev-els in the prediction of adverse outcome in patients with pulmonary embolism: a systematic review and meta-analysis. Am J Respir Crit Care Med 2008;178:425-30. http://doi.org/bgn537
5. Becattini C, Vedovati MC, Agnelli G. Prognostic value of tropo-nins in acute pulmonary embolism: a meta-analysis. Circulation 2007;116:427-33. http://doi.org/cjqx7t
6. Lankeit M, Jiménez D, Kostrubiec M, Dellas C, Hasenfuss G, Pruszczyk P, et al. Predictive value of the high-sensitivity troponin T assay and the simplified pulmonary embolism severity index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study. Circulation 2011;124:2716-24. http:// doi.org/dbj636
7. Puls M, Dellas C, Lankeit M, Olschewski M, Binder L, Geibel A, et al. Heart-type fatty acid-binding protein permits early risk stratification of pulmonary embolism. Eur Heart J 2007;28:224-9. http://doi.org/cp6wxv
8. Toosi MS, Merlino JD, Leeper K V. Electrocardiographic score and short-term outcomes of acute pulmonary embolism. Am J Cardiol 2007;100:1172-6. http://doi.org/c8fk86
9. Escobar C, Jiménez D, Martí D, Lobo JL, Díaz G, Gallego P, et al. Prognostic value of electrocardiographic findings in hemodynamically stable patients with acute symptomatic pulmonary embolism. Rev Esp Cardiol 2008;61:244-50. http://doi.org/fm36xk
10. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Man-agement of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS) Authors/Task Force Members: Stavros Konstantinides (Chair-person) (Germany/Greece), Adam Torbicki (Co-chairperson), et al. ESC Committee for Practice Guidelines. European Heart Journal. http://doi.org/9vr
11. Jiménez D, Aujesky D, Moores L, Gómez V, Lobo JL, Uresandi F, et al. Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism. Arch Intern Med 2010;170:1383-9. http://doi.org/dmn7ps
12. Stein PD, Fadi Matta F. The treatment of unstable pulmonary embolism in the elderly and those with comorbid conditions. Am J Med 2013;126:304-10. http://doi.org/f2wv6v
13. Marti C, John G, Konstantinides S, Combescure C, Sanchez O, Lankeit M, Meyer G, Perrier A. Systematic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J 2015;36:605-14. http://doi.org/9vs
14. Jiménez D, Aujesky D, Moores L, Gómez V, Lobo JL, Uresandi F, et al., for the RIETE investigators. Simplification of the Pulmonary Embolism Severity Index for prognosticating patients with acute symptomatic pulmonary embolism. Arch Intern Med 2010;170:1383-9. http://doi.org/dmn7ps
15. Binder L, Pieske B, Olschewski M, Geibel A, Klostermann B, Reiner C, et al. N-terminal pro-brain natriuretic peptide or troponin testing followed by echocardiography for risk stratification of acute pulmonary embolism. Circulation 2005;112:1573-9. http://doi.org/ bf7dwf
16. Palmieri V, Gallotta G, Rendina D, De Bonis S, Russo V, Posti-glione A, et al. Troponin I and right ventricular dysfunction for risk assessment in patients with nonmassive pulmonary embolism in the Emergency Department in combination with clinically based risk score. Intern Emerg Med 2008;3:131-8. http://doi.org/c23mbh
17. Aujesky D, Obrosky DS, Stone RA, Auble TE, Perrier A, Cornuz J, et al. Derivation and validation of a prognostic model for pulmonary embolism. Am J Respir Crit Care Med 2005;172:1041-6. http://doi. org/dvpgd2
18. Jiménez D, Uresandi F, Otero R, Lobo JL, Monreal M, Martí D, et al. Troponin-based risk stratification of patients with acute nonmas-sive pulmonary embolism: systematic review and metaanalysis. Chest 2009;136:974-82. http://doi.org/d5n3zt
19. Konstantinides S, Marder VJ. Thrombolysis in venous throm-boembolism. En: Colman RW, Marder VJ, Clowes AW, George JN, Goldhaber SZ, editors. Hemostasis and thrombosis. Philadelphia: Lippincott Williams and Wilkins 2006;13:17-29. http://doi.org/d9z6xm
20. Wan S, Quinlan DJ, Agnelli G, Eikelboom J W. Thrombolysis compared with heparin for the initial treatment of pulmonary embo-lism: a meta-analysis of the randomized controlled trials. Circulation 2004;110:744-9. http://doi.org/trc
21. Chatterjee S, Chakraborty A, Weinberg I, Kadakia M, Wilensky RL, Sardar P, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage. A meta-analysis. JAMA 2014;311:2414-21. http://doi.org/9vt
22. Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-West-endorf J, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014;370:1402-11. http://doi.org/9vt
23. Sharifi M, Bay C, Skrocki L, Rahimi F, Mehdipour M. Moderate pulmonary embolism treated with thrombolysis (from the "MOPETT" Trial). Am J Cardiol 2013;111:273-7.
24. Kline JA, Nordenholz KE, Courtney DM, Kabrhel C, Jones AE, Rondina MT, et al. Treatment of submassive pulmonary embolism with tenecteplase or placebo: cardiopulmonary outcomes at 3 months: multicenter double-blind, placebo controlled randomized trial. J Thromb Haemost 2014;12:459-68. http://doi.org/9vv
25. Kucher N, Boekstegers P, Müller OJ, Kupatt C, Beyer-Westendorf J, Heitzer T, et al. Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation 2014;129:479-86. http://doi.org/9vw
26. Piazza G, Hohlfelder B, Jaff MR, Ouriel K, Engelhardt TC, Ster-ling KM. A prospective, single-arm, multicenter trial of ultrasound-facilitated, catheter-directed, low-dose fibrinolysis for acute massive and submassive pulmonary embolism. SEATTLE II. JACC Cardiovasc Intervent 2015;8:1382-92. http://doi.org/9vx
27. Mikkola KM, Patel SR, Parker JA, Grodstein F, Goldhaber SZ. Increasing age is a major risk factor for hemorrhagic complications after pulmonary embolism thrombolysis. Am Heart J 1997;134:69-72. http://doi.org/cpvh2k
28. Klok FA, Niemann C, Dellas C, Hasenfuß G, Konstantinides S, Lankeit M. Performance of five different bleeding-prediction scores in patients with acute pulmonary embolism. J Thromb Thrombolysis 2016;41:312-20.
29. Curtis GM, Lam S W, Reddy AJ, Bauer SR. Risk factors associ-ated with bleeding after alteplase administration for pulmonary embolism: A case-control study. Pharmacotherapy 2014;34:818-25. http://doi.org/9vz
30. Ruiz-Giménez N, Suárez C, González R, Nieto JA, Todolí JA, Samperiz AL, et al, RIETE Investigators. Predictive variables for major bleeding events in patients presenting with documented acute venous thromboembolism. Findings from the RIETE Registry. Thromb Haemost 2008;100:26-31.
31. Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. Antithrombotic therapy for VTE disease: Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guide-lines. Chest 2012;141:419S-94S.
32. Quinlan DJ, McQuillan A, Eikelboom J W. Low-molecular-weight heparin compared with intravenous unfractionated heparin for treatment of pulmonary embolism. A meta-analysis of randomized, controlled trials. Ann Intern Med 2004;140:175-83. http://doi.org/9v2
33. van der Hulle T, Kooiman J, den Exter PL, Dekkers OM, Klok FA, Huisman M V. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis. J Thromb Haemost 2014;12:320-8. http://doi.org/9v3
34. Schulman S, Kearon C, Kakkar AK, Mismetti P, Schellong S, Eriksson H, et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N Engl J Med 2009;361:2342-52. http://doi.org/dsm8kh
35. Bauersachs R, Berkowitz SD, Brenner B, Buller HR, Decousus H, Gallus AS, et al. Oral rivaroxaban for symptomatic venous thrombo-embolism. N Engl J Med 2010;363:2499-510. http://doi.org/dg8w5c
36. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. Oral apixaban for the treatment of acute venous thromboembolism. N Engl J Med 2013;369:799-808. http://doi.org/9v4
37. Büller HR, Décousus H, Grosso MA, Mercuri M, Middeldorp S, Prins MH, et al. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013;369:1406-15. http://doi.org/9v5
38. Skaf E, Beemath A, Siddiqui T, Janjua M, Patel NR, Stein PD. Catheter-tip embolectomy in the management of acute massive pul-monary embolism. Am J Cardiol 2007;99:415-20. http://doi.org/9v5
39. Kuo WT, Gould MK, Louie JD, Rosenberg JK, Sze DY, Hofmann LV. Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and metaanalysis of modern techniques. J Vasc Interv Radiol 2009;20:1431-40. http://doi.org/bhc2c3














