Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.26 supl.1 San Salvador de Jujuy dic. 2012
TRABAJO
Categorización del estado de conservación de de las lagartijas y anfisbenas de la República Argentina
Cristian Simón Abdala1, José Luís Acosta2, Juan Carlos Acosta3, Blanca Beatriz Álvarez2, Federico Arias4, Luciano Javier Avila5, Mirta Graciela Blanco3, Marcelo Bonino6, Jorgelina Mariela Boretto7, Gabriela Brancatelli8, María Florencia Breitman5, Mario Roberto Cabrera9, Samanta Cairo8, Valeria Corbalán10, Alejandra Hernando2, Nora Ruth Ibargüengoytía7, Federico Kacoliris11, Alejandro Laspiur3, Ricardo Montero1, Mariana Morando5, Nicolás Pelegrin12, Cristian Hernán Fulvio Pérez5, Andrés Sebastián Quinteros4, Romina Valeria Semhan1, María Esther Tedesco2, Laura Vega13, Sergio Martín Zalba8
1 Instituto de Herpetología, Fundación Miguel Lillo- CONICET -Facultad de Ciencias Naturales e IML. Universidad Nacional de Tucumán. Miguel Lillo 205, (4000) Tucumán, Argentina.
2 Laboratorio de Herpetología. Facultad de Ciencias Exactas y Naturales y Agrimensura. Universidad Nacional del Nordeste. Av. Libertad 5470. (3400) Corrientes, Argentina.
3 Departamento de Biología, Facultad de Ciencias Exactas y Naturales. Universidad Nacional de San Juan. (5400), San Juan, Argentina.
4 IBIGEO-CONICET, Facultad de Ciencias Naturales, Universidad Nacional de Salta, Avenida Bolivia 5150. (4400), Salta, Argentina.
5 CENPAT-CONICET, Boulevard Almirante Brown 2915, (U9120ACD), Puerto Madryn, Chubut, Argentina.
6 Instituto de Investigaciones en Biodiversidad y Medioambiente (INIBIOMA) CONICET-UNCOMA, (8400), Bariloche, Argentina.
7 Departamento de Zoología, Centro Regional Universitario Bariloche, Universidad Nacional del Comahue - (INIBIOMA-CONICET), Quintral 1250. (8400), San Carlos de Bariloche, Río Negro, Argentina.
8 GEKKO - Grupo de Estudios en Conservación y Manejo, Universidad Nacional del Sur, San Juan 670 (8000), Bahía Blanca, Argentina.
9 CONICET- Departamento de Diversidad Biológica y Ecología, Universidad Nacional de Córdoba, Avenida Vélez Sarsfield 299 (5000), Córdoba, Argentina
10 Instituto Argentino de Investigaciones de las Zonas Áridas - IADIZA - CCT - Mendoza - CONICET. Av. Ruiz Leal s/n, Parque Gral. San Martín, Mendoza, Argentina.
11 Sección Herpetología, División Zoología Vertebrados, Museo de La Plata. Paseo del Bosque, s/n (1900), Buenos
Aires, Argentina.
12 Centro de Zoología Aplicada FCEFyN - Universidad Nacional de Córdoba - Instituto de Diversidad y Ecología Animal (IDEA) - CONICET. Av. Vélez Sarsfield 299 (5000) Córdoba, Argentina.
13 Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, Funes 3350, Mar del Plata, Buenos Aires, Argentina.
Recibido: 10/08/11
Revisado: 24/10/11
Aceptado: 11/10/12
RESUMEN
Luego de la elaboración de la primera lista roja de la herpetofauna de la República Argentina, realizada en el año 2000, son numerosos los cambios y estudios efectuados en los diferentes grupos de saurios de la Argentina. Si bien hay avances realizados en todas las ramas de la biología relacionadas a las lagartijas, los progresos taxonómicos y ecológicos son los más evidentes. Debido a estos progresos, y a la implementación de sustanciales modificaciones con respecto a la metodología que se utilizara en el año 2000, un grupo de veintisiete especialistas de diferentes instituciones académicas de la Argentina aportaron información biológica, ecológica, geográfica y taxonómica en un taller que permitió reevaluar el estado de conservación de las 256 especies de lagartijas y anfisbenas de la Argentina. Los resultados obtenidos indican que setenta y ocho especies se encuentran incluidas en la lista roja (una En Peligro, nueve Amenazadas y 68 Vulnerables), 31 Insuficientemente Conocidas y 147 No Amenazadas. Con respecto a la categorización anterior de la AHA, se agregaron 94 especies, de las cuales 87 son nuevos taxa, cuatro revalidadas, y otras tres especies fueron incorporadas a la fauna argentina. Asimismo cinco especies fueron extraídas del listado de la fauna de la República Argentina. En comparación con los resultados obtenidas en la categorización del año 2000, observamos que el número de especies Amenazadas se incrementó de cinco a nueve especies y de siete a 68 especies como Vulnerable, incluyendo a los géneros Phymaturus y Anisolepis. Asimismo, se categorizó como Insuficientemente Conocida a 31 especies contra 108 del año 2000. Estos resultados son en parte debido al incremento en el conocimiento sistemático, biológico, ecológico y biogeográficos de las lagartijas y anfisbenas de la Argentina, por el cambio radical de la metodología utilizada y también por los efectos de la presión antrópica sobre las especies y/o sus habitats.
PALABRAS CLAVE : Lagartijas; Anfisbenas, Conservación; Listas rojas; Evaluación; Argentina.
ABSTRACT
After the first herpetofaunal red list for Argentina, which was published in the year 2000, there had been numerous changes and studies made on different groups of lizards from Argentina. Although there had been contributions in all areas of lizard biology, those made in taxonomy and ecology are the most evident. Due to these and the implementation of substantial modifications with respect to the methodology used in the year 2000, a group of twenty-seven specialists from different Argentinian institutions contributed biological, ecological, geographic and taxonomic information to a workshop that allowed re-evaluation of the conservation status of the 256 lizard and amphisbaenian species from Argentina. Results indicate that 78 species are included in the red list (one Endangered, nine Threatened, and 68 Vulnerable), 31 are insufficiently known and 147 Non-threatened. Compared with the previous AHA categorization, 94 new species have been added, of which 87 are new taxa, four revalidations, and three species were incorporated to the Argentina fauna; five species were deleted from the Argentina list. Compared with the 2000 yr results, threatened species increased from five to nine species, and vulnerable species increased from seven to 68, including all species of the genera Phymaturus and Anisolepis. There are 31 species considered as insufficiently known against 108 listed in this category in 2000. These results are partially based on the increase in systematic, biological, ecological and biogeographical knowledge of lizards and amphisbaenians, and by the radical change in methodology and by effects of anthropogenic pressure on species and/or their habitats.
KEY WORDS: Lizards; Anphisbaenians; Conservation; Red lists; Assessment; Argentina.
INTRODUCCIÓN
Las lagartijas y anfisbenas están presentes en los más diversos ambientes de la Argentina, ocupando todas las regiones fitogeográficas conocidas (Cabrera y Willink, 1980). Dentro del gran conjunto de saurios del país, varias especies tienen una distribución muy restringida, revelando microendemismos significativos, mientras que otras especies presentan especializaciones ecológicas (Cei, 1986, 1993; Avila et al., 2000; Morando, 2004; Abdala, 2005; Lobo et al., 2010a; Scrocchi et al., 2010). Las especies que son endémicas o que presentan especializaciones ecológicas se encuentran en un delicado balance con su hábitat, por lo tanto la alteración de sus ambientes expone a estas lagartijas a un alto grado de vulnerabilidad (Abdala et al., 2012). Debido al crecimiento humano y sus actividades, la destrucción y la degradación del hábitat son la principal causa de pérdida de biodiversidad (Turner, 1996; Primack et al., 2001). Este factor afecta tanto a los saurios como a los demás animales terrestres de la Argentina y del mundo (Sodhi y Ehrlich, 2010). Es evidente que el avance de la frontera agropecuaria (principalmente por la plantación de soja) es el factor que causa mayores efectos negativos en las poblaciones de saurios (Bennet, 2004; Rudd, 2011). Los continuos y extensivos desmontes en áreas tan sensibles y diversas, como en las regiones fitogeográficas del Chaco, Yungas, Monte y Espinal, han traído como consecuencias la disminución de varias poblaciones de especies de saurios, las cuales se ven reflejadas en la categorización actual.
Otros factores derivados de la actividad humana que actúan negativamente en las poblaciones de lagartijas de Argentina son el sobrepastoreo, la minería, la extracción petrolera, y las actividades turísticas (Pelegrin et al., 2009; Pelegrin y Bucher, 2010, 2012; Abdala et al., 2012). El sobrepastoreo es producido por la excesiva carga de animales domésticos por encima de la capacidad de la vegetación y el suelo; este fenómeno produce una disminución drástica de la vegetación y compactación del suelo modificando el hábitat del área. Este fenómeno se acentúa en la estepa patagónica, así como en zonas de Chaco, Puna, Prepuna y Altoandina. La minería a cielo abierto y extracción petrolera producen grandes modificaciones en el ambiente, que afectan directamente a las poblaciones de saurios debido a la importante remoción de las capas de suelo. Asimismo, los desechos, deposición y tránsito de material producidos por la actividad minera, y la fragmentación del área mediante caminos y rutas, también afectan las poblaciones de lagartijas. Las actividades recreativas y turísticas presentan, en casos puntuales, efectos nocivos para las poblaciones de lagartijas, principalmente cuando los ambientes son frágiles o las especies que habitan en los mismos tienen requerimientos de hábitat muy complejos. Los casos más representativos se dan en lugares de grandes médanos, donde habitan lagartijas muy especializadas a dichos ambientes, en los cuales se desarrollan travesías con vehículos todo terreno (Kacoliris et al., 2009; Abdala et al., 2012).
El cambio climático global es otro factor que afecta a las poblaciones de saurios. Cerca del 45% de las especies de saurios de la Argentina tienen modo reproductivo vivíparo. Estas especies, que habitan a elevada altitud (o latitud), serían las más afectadas por el cambio climático global, según el estudio de Sinervo et al. (2010). Dicho estudio, también expresa que el 6% de las especies y el 16% de las poblaciones estarán extintas para el año 2050, y entre el 20% y el 30% de las poblaciones para el 2080. Es fundamental seguir realizando estudios que permitan evaluar el verdadero efecto del cambio climático global en las poblaciones de saurios de la Argentina.
Otro factor que afecta en menor medida a las poblaciones de saurios locales es la introducción de especies exóticas, las cuales compiten con éstas por los refugios, nichos tróficos, reproductivos, etc. (Álvarez et al., 2002; Baldo et al., 2008; Rödder et al., 2008).
Es indudable que es necesario emplear estrategias de conservación a diferentes escalas regionales para aminorar los efectos producidos por la actividad humana (Primack et al., 2001). Una acción directa y efectiva para priorizar las medidas de conservación a emplear, es la categorización de especies amenazadas (EA), cuyo objetivo es proporcionar listados de especies que presentan altos riesgos de extinguirse (Primack et al., 2001). Estas listas son mundialmente conocidas como Listas Rojas y es la IUCN (www.iucnredlist.org), quien lidera la elaboración de las mismas a nivel global. Sin embargo, es imprescindible que se confeccionen listas rojas a nivel regional (Gärdenfors et al., 2001), y de esa manera desarrollar acciones concretas de conservación.
Varios trabajos relacionados al estado de conservación de las lagartijas de diferentes áreas o provincias de la Argentina se han publicado en los últimos 20 años, destacándose los de Úbeda et al. (1994), Bertonati (1994), Úbeda y Grigera (1995), Avila y Acosta (1996), Grigera y Úbeda (1997), Acosta y Murúa (1998), Cei et al. (2003), Abdala et al. (2004), Chébez et al. (2005), Scolaro (2005, 2006), Chébez (2008), Scrocchi et al. (2010). Corbalán et al., (2011) y Abdala et al. (2012). Sin embargo, en el año 2000 se concretó, de manera práctica y legal, la evaluación y categorización de las lagartijas y anfisbenas de Argentina (Avila et al., 2000). Desde entonces, el incremento del grupo de especialistas que ha volcado sus investigaciones en el estudio de los saurios es realmente sorprendente. Este aumento de investigadores se ve reflejado en los diversos trabajos relacionados a las lagartijas en las más diversas áreas de la biología. Sin lugar a dudas, los estudios taxonómicos han experimentado un incremento sustancial, permitiendo que el número de especies de lagartijas de la Argentina se eleve de 167 en el año 2000 a 256 en el 2012. Asimismo, los trabajos ecológicos, etológicos, biogeográficos, filogenéticos, morfológicos y fitogeográficos han aportado un conjunto de información crucial y fundamental para llevar a cabo esta nueva categorización de los saurios de la república Argentina.
En la primera categorización de la herpetofauna Argentina (Lavilla et al., 2000) se utilizó la metodología de Reca et al. (1994) modificada; en este trabajo se implementó el mismo método pero con cambios sustanciales (Giraudo et al., 2012).
Es evidente que el crecimiento en el número de investigadores e información aportada en el estudio de los saurios, sumado a los cambios metodológicos propuestos por Giraudo et al. (2012), han posibilitado categorizar sólo un porcentaje bajo de especies como Insuficientemente Conocida (IC), a diferencia de la categorización anterior (Avila et al., 2000).
MATERIALES Y MÉTODOS
Para confeccionar el listado total de especies de lagartijas y anfisbenas de la Argentina, se tomó como base el esquema propuesto en la categorización del año 2000 (Avila et al., 2000). El listado de especies categorizadas en el presente trabajo incluye novedades taxonómicas desde el año 2000 hasta el 30 de marzo de 2012. Dichas novedades taxonómicas incluyen cambios nomenclatoriales, nuevos taxa descritos, así como especies incorporadas y otras eliminadas del listado de la fauna Argentina. La nueva lista registra un total de 246 taxa de lagartijas y 10 de anfisbenas reconocidos para Argentina. Asimismo, esta categorización ha incorporado las novedades en la distribución (datos publicados e inéditos) y en aspectos ecológicos de gran cantidad de especies. La nomeclatura y ordenamiento taxonómico sigue básicamente a Conrad (2008), con modificaciones de Frost et al., (2001) para las familias Leiosauridae, Liolaemidae, Tropiduridae y Polychrotidae; a Montero y Autino (2009) para Amphisbaenia; a Gamble et al. (2008) para la familia Phyllodactylidae; a Doan (2003) para la familia Gymnophthalmidae y a Giugliano et al. (2007) para la familia Teiidae.
La categoría de los taxones se basó en la revisión metodológica y recomendaciones publicadas en este volumen (Giraudo et al., 2012), utilizada por los evaluadores para asignar valores a seis variables analizadas incluyendo: Distribución nacional y grado de endemismo (DINAC), Rareza ecológica (RARECOL), Efectos humanos (EFHU), Potencial reproductivo (POTRE), Tamaño (TAM) y Abundancia (ABUND). Se asignaron valores a dichas variables indicándose para cada especie los evaluadores responsables de la información utilizada, proveniente de datos propios y/o de la literatura científica. Una vez obtenidos los valores de cada especie se realizó una reunión plenaria entre los evaluadores en donde se discutieron las categorías asignadas a las especies. Las categorías asignadas se basaron tanto en los valores umbrales teóricos sugeridos en la propuesta metodológica (Vulnerable entre 18 y 19, Amenazada entre 20 y 23, En Peligro entre 24 y 30, No Amenazados entre 0 y 12), recomendándose revisar caso por caso a los taxones con valores entre 13 y 17, como en el análisis de las incertidumbres que fueron consensuadas entre los evaluadores (ver Giraudo et al., 2012 para mayores detalles).
RESULTADOS
Comentarios taxonómicos
Los cambios nomenclaturales y taxonómicos desde la última categorización (Avila et al., 2000) hasta la actual se detallan a continuación.
Cambios nomenclaturales en lagartijas y anfisbenas propuestos desde la primera categorización
1. Representantes de los géneros Anisolepis, Diplolaemus, Leiosaurus, Pristidactylus y Urostrophus listados dentro de la familia Polychrotidae en la categorización anterior (Avila et al., 2000), se incluyen en la familia Leiosauridae de acuerdo con Frost et al. (2001).
2. Representantes de los géneros Liolaemus y Phymaturus listados dentro de la familia Tropiduridae en la categorización anterior (Avila et al., 2000), se incluyen en la familia Liolaemidae de acuerdo con Frost et al. (2001).
3. En acuerdo con la hipótesis filogenética de Frost et al. (2001), la familia Polychrotidae está representada en Argentina solamente por el género Polychrus.
4. En acuerdo con la hipótesis filogenética de Frost et al. (2001), la familia Tropiduridae está representada en Argentina por los géneros Stenocercus y Tropidurus.
5. Representantes de los géneros Homonota y Phyllopezus listados dentro de la familia Gekkonidae en la categorización anterior (Avila et al., 2000), se incluyen en la familia Phyllodactylidae de acuerdo con Gamble et al. (2008).
6. Representantes del género Pantodactylus de la categorización anterior (Avila et al., 2000) ahora son considerados dentro del género Cercosaura de acuerdo con Doan (2003).
7. Amphisbaena heterozonata: Esta especie era considerada en la última categorización (Avila et al., 2000) una subespecie de Amphisbaena darwini. Fue elevada a nivel específico por Gans (2005).
8. Amphisbaena plumbea: Esta especie era considerada en la última categorización (Avila et al., 2000) una subespecie de Amphisbaena angustifrons. Fue elevada a nivel específico por Gans (2005).
9. Amphisbaena prunicolor: Esta especie era considerada en la última categorización (Avila et al., 2000) como Amphisbaena prunicolor prunicolor. Fue elevada a nivel específico por Gans (2005).
10. Liolaemus abdalai: Incluye las poblaciones argentinas que fueran consideradas en la última categorización (Avila et al., 2000) como Liolaemus lemniscatus (especie que queda restringida a Chile) de acuerdo con Quinteros (2012).
11. Liolaemus boulengeri: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Liolaemus inacayali, Liolaemus josei, Liolaemus loboi, Liolaemus senguer y Liolaemus tehuelche de acuerdo con Abdala (2003, 2005)
12. Liolaemus chlorostictus: Elevada a nivel específico por Díaz Gómez (2007). Considerada subespecie de Liolaemus orientalis, en la categorización anterior (Avila et al., 2000).
13. Liolaemus ditadai: Elevada a nivel específico por Abdala (2007). Considerada subespecie de Liolaemus anomalus, en la categorización anterior (Avila et al., 2000).
14. Liolaemus dorbignyi: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000, ahora son consideradas como Liolaemus huayra, Liolaemus inti, Liolaemus scrocchii y Liolaemus vulcanus de acuerdo con Abdala et al. (2008); Quinteros et al. (2008a) y Quinteros y Abdala (2011).
15. Liolaemus darwinii: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Liolaemus grosseorum de acuerdo con Etheridge (2001).
16. Liolaemus elongatus: Parte de las poblaciones que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como especies diferentes: Liolaemus choique, Liolaemus smaug y Liolaemus parvus, de acuerdo con Abdala et al. (2010) y Quinteros et al. (2008b).
17. Liolaemus goetschi: Considerada en la última categorización (Avila et al., 2000) sinónimo junior de Liolaemus melanops. Revalidada por Cei y Scolaro (2003).
18. Liolaemus lentus: Considerada en la última categorización (Avila et al., 2000) sinónimo junior de Liolaemus anomalus. Revalidada por Abdala (2005).
19. Liolaemus lineomaculatus: Parte de sus poblaciones que, fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como especies diferentes: Liolaemus avilae y Liolaemus morandae de acuerdo con Breitman et al. (2011a).
20. Liolaemus magellanicus: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Liolaemus caparensis de acuerdo con Breitman et al. (2011b).
21. Liolaemus ornatus: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Liolaemus crepuscularis y Liolaemus lavillai de acuerdo con Abdala y Díaz Gómez (2006) y Abdala y Lobo (2006).
22. Liolaemus quilmes: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Liolaemus espinozai de acuerdo con Abdala (2005).
23. Phymaturus antofagastensis: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como Phymaturus laurenti de acuerdo con Lobo et al. (2010).
24. Phymaturus palluma: Considerada en la primera categorización (Ávila et al., 2000) como Phymaturus flagellifer. Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000, ahora son consideradas como especies diferentes: Phymaturus dorsimaculatus, Phymaturus gynechlomus, Phymaturus roigorum y Phymaturus querque, de acuerdo con Corbalán et al. (2009); Lobo y Quinteros (2005); Lobo y Abdala (2007) y Lobo et al. (2010b).
25. Phymaturus patagonicus: Parte de sus poblaciones, que fueran incluidas en la categorización del año 2000 (Avila et al., 2000), ahora son consideradas como especies diferentes: Phymaturus spurcus, Phymaturus calcogaster, Phymaturus spectabilis y Phymaturus tenebrosus de acuerdo con Scolaro y Cei (2003) y Lobo y Quinteros (2005).
26. Phymaturus spurcus: Considerada en la última categorización (Avila et al., 2000) sinónimo junior de Phymaturus patagonicus. Revalidada por Lobo y Quinteros (2005).
27. Pristidactylus araucanus: Considerada en la última categorización (Avila et al., 2000) sinónimo junior de Pristidactylus fasciatus. Fue revalidada por Cei et al. (2001).
Especies de lagartijas incorporadas a la fauna Argentina
Liolaemus araucanensis Descripta para Chile (Müller y Hellmich, 1932) y citada para Argentina por Scolaro (2006).
Liolaemus puritamensis Descripta para Chile por Núñez y Fox (1989) y citada para Argentina por Quinteros y Abdala (2007).
Liolaemus scolaroi: Descripta para Chile por Pincheira-Donoso y Núñez (2005) y citada para la Argentina por Scolaro (2006).
Especies de lagartijas que fueron excluidas de la fauna Argentina
Liolaemus alticolor: Parte de sus poblaciones, que fueran incluidas en la primera categorización (Avila et al., 2000), ahora son consideradas como especies diferentes: Liolaemus chaltin y Liolaemus puna. La distribución de Liolaemus alticolor queda restringida para Bolivia y Chile.
Liolaemus constanzae: Fue considerada en la primera categorización (Avila et al., 2000), sin embargo no hay ninguna publicación que evidencie su presencia en la Argentina.
Liolaemus lemniscatus: Actualmente esta especie está restringida a Chile y las poblaciones consideradas en Argentina corresponden a Liolaemus abdalai.
Liolaemus monticola: Fue considerada en la primera categorización (Avila et al., 2000), sin embargo no hay ninguna publicación que evidencie su presencia en la Argentina.
Liolaemus pictus pictus: Actualmente está especie está restringida a Chile según Avila et al. (2006)
Especies descriptas con posterioridad a la primera categorización e incluidas en el nuevo listado de especies de lagartijas y anfisbenas de la República Argentina
Leiosauridae
Diplolaemus sexcinctus Cei, Scolaro y Videla, 2003
Leiosaurus jaguaris Laspiur, Abdala y Acosta, 2007
Pristidactylus nigroiugulus Cei, Scolaro y Videla, 2001
Liolaemidae
Liolaemus abdalai Quinteros, 2012
Liolaemus antumalguen Avila, Morando, Pérez y Sites, 2010
Liolaemus avilae Breitman, Parra, Pérez y Sites, 2011
Liolaemus azarai Ávila 2003
Liolaemus camarones Abdala, Díaz Gómez y Juárez Heredia, 2012
Liolaemus caparensis Breitman, Pérez, Parra, Morando, Sites y Avila, 2011
Liolaemus casamiquelai Avila, Pérez, Morando y Sites, 2010
Liolaemus cazianiae Lobo, Slodki y Valdecantos, 2010
Liolaemus chacabucoense Núñez y Scolaro, 2009
Liolaemus chaltin Lobo y Espinoza, 2004
Liolaemus chehuachekenk Ávila, Morando y Sites, 2008
Liolaemus choique Abdala, Quinteros, Scrocchi y Stazzonelli, 2010
Liolaemus cinereus Monguillot, Cabrera, Acosta y Villavicencio, 2006
Liolaemus crepuscularis Abdala y Díaz Gómez, 2006
Liolaemus cuyumhue Ávila, Morando, Pérez y Sites, 2009
Liolaemus cyaneinotatus Martínez, Avila, Pérez, Pérez, Sites y Morando, 2011
Liolaemus diaguita Abdala, Quinteros, Arias, Portelli y Palavechino, 2011
Liolaemus dicktracyi Espinoza y Lobo, 2003
Liolaemus dumerilli Abdala, Semhan, Moreno Azocar, Bonino, Paz y Cruz, 2012
Liolaemus espinozai Abdala, 2005
Liolaemus flavipiceus Cei y Videla, 2003
Liolaemus gracielae Abdala, Acosta, Cabrera, Villavicencio y Marinero, 2009
Liolaemus grosseorum Etheridge, 2001
Liolaemus gununakuna Ávila, Morando, Pérez y Sites, 2004
Liolaemus halonastes Lobo, Slodki y Valdecantos, 2010
Liolaemus heliodermis Espinoza, Lobo y Cruz, 2000
Liolaemus huayra Abdala, Quinteros y Espinoza, 2008
Liolaemus inacayali Abdala, 2003
Liolaemus inti Abdala, Quinteros y Espinoza, 2008
Liolaemus josei Abdala, 2005
Liolaemus kolengh Abdala y Lobo, 2006
Liolaemus lavillai Abdala y Lobo, 2006
Liolaemus loboi Abdala, 2003
Liolaemus mapuche Abdala, 2002
Liolaemus martorii Abdala, 2003
Liolaemus montanezi Cabrera y Monguillot, 2006
Liolaemus morandae Breitman, Parra, Pérez y Sites, 2011
Liolaemus morenoi Etheridge y Christie, 2003
Liolaemus orko Abdala y Quinteros, 2008
Liolaemus parvus Quinteros, Abdala, Díaz Gómez y Scrocchi, 2008
Liolaemus piriphlogos Quinteros, 2012
Liolaemus puelche Ávila, Morando, Pérez y Sites, 2007
Liolaemus puna Lobo y Espinoza, 2004
Liolaemus punmahuida Ávila, Pérez y Morando, 2003
Liolaemus purul Abdala, Semhan, Moreno Azocar, Bonino, Paz y Cruz, 2012
Liolaemus sagei Etheridge y Christie, 2003
Liolaemus scrocchii Quinteros, Abdala y Lobo, 2008
Liolaemus senguer Abdala, 2005
Liolaemus shehuen Abdala, Díaz Gómez y Juárez Heredia, 2012
Liolaemus shitan Abdala, Quinteros, Scrocchi y Stazzonelli, 2010
Liolaemus smaug Abdala, Quinteros, Scrocchi y Stazzonelli, 2010
Liolaemus talampaya Ávila, Morando, Pérez y Sites, 2004
Liolaemus tandiliensis Vega, Vellagamba y Lobo, 2008
Liolaemus tehuelche Abdala, 2003
Liolaemus tregenzai Pincheira-Donoso y Scolaro, 2007
Liolaemus tromen Abdala, Semhan, Moreno Azocar, Bonino, Paz y Cruz, 2012
Liolaemus tulkas Quinteros, Abdala, Gómez y Scrocchi, 2008
Liolaemus umbrifer Espinoza y Lobo, 2003
Liolaemus uptoni Scolaro y Cei, 2006
Liolaemus vulcanus Quinteros y Abdala, 2011
Liolaemus yanalcu Martínez Oliver y Lobo, 2002
Phymaturus calcogaster Cei y Scolaro, 2003
Phymaturus castillensis Scolaro y Pincheira-Donoso, 2010
Phymaturus ceii Scolaro e Ibargüengoytía, 2007
Phymaturus delyhei Avila, Perez, Perez y Morando, 2011
Phymaturus denotatus Lobo, Nenda y Slodki, 2012
Phymaturus desuetus Scolaro y Tappari, 2009
Phymaturus dorsimaculatus Lobo y Quinteros, 2005
Phymaturus etheridgei Lobo, Abdala y Valdecantos, 2010
Phymaturus excelsus Lobo y Quinteros, 2005
Phymaturus extrilidus Lobo, Espinoza, Sanabria y Quiroga, 2012
Phymaturus felixi Lobo, Abdala y Valdecantos, 2010
Phymaturus gynechlomus Corbalán, Scolaro y Debandi, 2009
Phymaturus laurenti Lobo, Abdala y Valdecantos, 2010
Phymaturus manuelae Scolaro e Ibargüengoytía, 2008
Phymaturus querque Lobo, Abdala y Valdecantos, 2010
Phymaturus roigorum Lobo y Abdala, 2007
Phymaturus sitesi Avila, Pérez, Pérez y Morando, 2011
Phymaturus spectabilis Lobo y Quinteros, 2005
Phymaturus tenebrosus Lobo y Quinteros, 2005
Phymaturus verdugo Cei y Videla, 2003
Phymaturus videlai Scolaro y Pincheira-Donoso, 2010
Teiidae
Cnemidophorus tergolaevigatus Cabrera, 2004
Amphisbaenidae
Amphisbaena hiata Montero y Céspedez, 2002
Lista actualizada de categorías de conservación de las lagartijas y anfisbenas de la República Argentina
Los resultados de este trabajo se exhiben en las Tablas 1 a 4, las cuales presentan la información disponible sobre las lagartijas y anfisbenas de Argentina a nivel genérico y específico. La nueva lista registra un total de 256 taxa reconocidos para la Argentina, incluyendo 10 especies de anfisbenas y 246 de lagartijas (Tabla 1). Los resultados obtenidos indican que del total de lagartijas y anfisbenas, 78 especies enfrentan algún grado de riesgo para su conservación (una En Peligro, nueve Amenazadas y 68 Vulnerables); las restantes se consideran No Amenazadas (147 taxa) o Insuficientemente Conocidas (31 taxa) (Tabla 2).
Tabla 1. Familias y géneros de lagartijas y anfisbenas de la República Argentina. Se indica entre paréntesis, el número de taxones reconocidos.

Tabla 2. Valores asignados a los taxones de lagartijas y anfisbenas de la República Argentina para cada variable descripta en Giraudo et al., (2012) y categoría de conservación asociada. La abreviaturas de las variables indican: DINAC: Distribución Nacional y grado de endemismo; RARECOL: Rareza ecológica; EFHU: Efectos Humanos; POTRE: Potencial Reproductivo; TAM: Tamaño; ABUND: Abundancia. Las abreviaturas de las categorías de conservación son: NA: No Amenazada; EP: En Peligro; A: Amenazada; VU: Vulnerable; IC: Insuficientemente Conocida..gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
Comparaciones con listados anteriores, categorización del 2000 y las listas rojas de la UICN
La primera categorización de lagartijas y anfisbenas (Avila et al. 2000) incluía 167 especies de saurios, mientras que la actual abarca 256, evidenciando un crecimiento importante en el número de taxa en la última década (Tabla 1). El promedio de nuevos taxa de lagartijas para la Argentina se va acrecentando año a año, dato que queda evidenciado al comparar el número actual de especies (260 según Avila et al., 2012), con el trabajo de Avila et al. (2010), el cual incluye un listado de lagartijas y anfisbenas para la Argentina hasta diciembre de 2010 y contiene 242 especies (14 especies menos que en este trabajo). Este crecimiento se debe principalmente a la descripción de más de 60 especies de Liolaemus y 20 de Phymaturus en la última década. En el listado actual de saurios no se ha suprimido ninguna especie por considerarla extinta a escala local o global o por retracción de sus rangos de distribución en la región.
En comparación con la categorización anterior (Avila et al., 2000) (Fig. 1), cabe resaltar que a pesar de haberse incrementado considerablemente el número de lagartijas para la Argentina, se pudo categorizar más del 87% de las especies quedando sólo el 12.1% (31 especies) como Insuficientemente Conocida (IC). En la categorización anterior el porcentaje de especies Insuficientemente Conocida (IC) era del 64.6% (108 especies). Otro dato importante, es que el número de especies con la categoría Vulnerable (VU) ascendió del 4.2 % (siete especies) en el año 2000 al 26.5% (68 especies), incluyendo a todo el género Phymaturus bajo esa categoría. El número de especies En Peligro (EP) disminuyó a la mitad con respecto a la categorización del 2000 (sólo Liolaemus rabinoi ha sido asignada con esta categoría, mientras que Pristidactylus casuhatiensis cambió de En Peligro a Amenazada), mientras que el número de especies Amenazadas (AM) creció de cinco a nueve especies. El número de especies No Amenazadas (NA) ascendió del 27 % (45 especies) al 57.4 % (147 especies). El aumento de especies categorizadas como Amenazadas (AM) y Vulnerables (VU) manifiesta el incremento de los factores que actúan negativamente en el estado de conservación de los saurios de la Argentina.
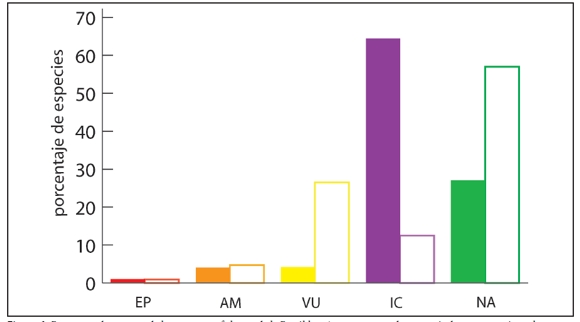
Figura 1. Porcentaje de especies de lagartijas y anfisbenas de la República Argentina en cada categoría de conservación en la categorización 2000 (barras llenas) y en la categorización actual (barras vacías). EP: En Peligro; AM: Amenazadas; VU: Vulnerables; IC: Insuficientemente Conocidas; NA: No Amenazadas.
La información reunida nos permite evaluar la riqueza y estado de conservación de lagartijas y anfisbenas en una escala provincial de la República Argentina (Tabla 3). Los resultados indican que, en general, las provincias del centro-oeste y Patagonia son las que poseen los mayores valores de riqueza de lagartijas y anfisbenas: Mendoza (54 especies), Salta (53 especies), Neuquén (50 especies), Catamarca (48 especies), Río Negro (46 especies), Chubut (39 especies) y San Juan (38 especies). Tierra del Fuego posee sólo una especie, siendo Liolaemus magellanicus la lagartija con distribución más austral del planeta. Los resultados obtenidos indican que Mendoza es la provincia con mayor número de especies con algún grado de amenaza (15 especies), seguido por Río Negro (11 especies), Catamarca, Neuquén y Salta (con 10 especies).
Tabla 3. Distribución por provincias de las lagartijas y anfisbenas de la República Argentina, indicando su categoría de conservación actual y el número de especies por provincia. IC:.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)
En relación al número de especies de cada provincia, Buenos Aires, Mendoza y Córdoba tienen el mayor porcentaje de especies amenazadas con poco más del 27%, Chaco (24.1%), Río Negro (23.9%), Santiago del Estero (23.33%) y Catamarca y Formosa (20.8%) (Fig. 2). En el caso particular de la provincia de Buenos Aires el elevado porcentaje de especies amenazadas se debe tanto al alto grado de transformación ambiental por desarrollo urbano y agrícola, como a características propias de la historia y bio-ecología de las especies. Las cinco especies de lagartijas amenazadas en esta provincia poseen un rango de distribución limitado y entre ellas cuatro ocurren solamente en esta provincia. Estas cuatro especies muestran además un alto grado de adaptación a la vida en hábitats particulares dentro del territorio nacional, como son la selva en galería en el caso de Anisolepis undulatus, las dunas costeras en el caso de Liolaemus multimaculatus y los pastizales serranos de Tandilia y Ventania en el caso de Liolaemus tandiliensis y Pristidactylus cashuatiensis respectivamente.
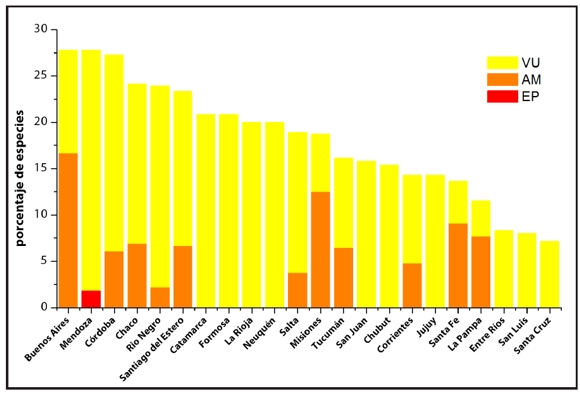
Figura 2. Porcentaje de taxones de lagartos y anfisbenas en cada categoría de amenaza (AM: Amenazada, EP: EN Peligro, VU: Vulnerable) en las provincias argentinas.
Estos hábitats ocupan un área muy restringida de la provincia y actualmente se encuentran altamente disturbados por diversos tipos de actividades antrópicas. En la provincia de Mendoza, el mayor porcentaje de especies amenazadas tiene relación con dos factores primordiales: (1) la elevada riqueza de especies y, especialmente de endemismos, registradas mayormente en los ecosistemas Andino y Patagónico (Payunia); (2) las actividades humanas. La región de la Payunia (al sur de la provincia) posee una elevada heterogeneidad ambiental, con intrusiones de vegetación del Monte, estepa patagónica y pastizales pampeanos, permitiendo tanto la existencia de elementos propios de estas regiones así como de endemismos (Corbalán y Debandi, 2008). Teniendo en cuenta que el grado de endemismo (DINAC) es una variable que contribuye al índice de amenaza, muchas especies fueron asignadas a la categoría Vulnerable. Las actividades humanas también juegan un papel importante de amenaza en esta provincia. El caso más problemático lo constituye el uso intensivo de vehículos de doble tracción en los médanos del Nihuil, incluyendo las competencias internacionales como el Rally Dakar, poniendo en peligro la única población conocida de Liolaemus rabinoi (única especie de lagartija categorizada En Peligro). Otras actividades como la construcción de diques y rutas también constituyen una amenaza para especies de distribución restringida. Un caso puntual es la pavimentación de la ruta internacional N° 145, que provocó la desaparición de varias poblaciones de Phymaturus verdugo por destrucción del hábitat y podría afectar las poblaciones de la especie endémica Liolaemus flavipiceus. Las actividades mineras y petroleras también son un factor de amenaza, ya que están ubicadas en áreas de alta riqueza de especies y/o endemismos, debiendo intensificar los controles y monitoreos estrictos por parte del gobierno provincial.
Las provincias chaqueñas tuvieron en general altos porcentajes de especies en algún grado de amenaza (Fig. 2). A pesar que Chaco y Formosa albergan una moderada cantidad de especies de lagartos, en comparación con las provincias del oeste argentino, alrededor de un cuarto de las especies registradas para sus territorios presentan cierto grado de amenaza, esto se debe a que las mismas son de hábitos arborícolas o están asociadas al bosque chaqueño. El que se encuentra actualmente con severas modificaciones por el avance de las fronteras agropecuarias, siendo el desmonte el principal factor que amenaza a las poblaciones de estos saurios. La pérdida de há bitat por deforestación en las provincias chaqueñas ocurre a altas tasas anuales (período 1998-2006, tasa media de deforestación: 1.18%) (Unidad de Manejo del Sistema de Evaluación Forestal, 2007), siendo Córdoba la provincia con la mayor tasa anual de pérdida de bosque nativo en toda la región chaqueña (período 2002-2006: 2.52%) seguida por Santiago del Estero (2.17%) y Salta (1.54%). Asimismo, si bien la tasa de deforestación en las provincias de Formosa y Chaco se encuentra entre las más bajas de la región, se observó una tendencia creciente entre el período 1998-2002 (Formosa: 0.16%, Chaco: 0.57%) y 2002-2006 (Formosa: 0.25%, Chaco: 0.65%) (Unidad de Manejo del Sistema de Evaluación Forestal, 2007). La pérdida de bosques nativos se relaciona principalmente con la conversión a cultivos, principalmente soja (Paruelo et al., 2005). En algunas provincias los incendios forestales constituyen un importante factor de pérdida de hábitat. En la provincia de Córdoba, por ejemplo, se quemaron en promedio aproximadamente 38365 ha por año entre 2007 y 2010, de los cuales aproximadamente 5557 ha eran de bosque nativo (Programa Nacional de Estadísticas Forestales, 2011). La degradación del bosque chaqueño debido a fuego, tala y sobrepastoreo afecta a la fauna de lagartos del Chaco Árido de diversas formas, incluyendo la disminución de sus abundancias poblacionales y modificaciones en la selección de microhabitats (Pelegrin et al., 2009; Pelegrin y Bucher, 2010; 2012).
La comparación de la actual categorización y la lista roja de la IUCN (2012) (Tabla 4) es disímil debido a que la IUCN sólo ha evaluado el 11.7 % (30 especies) de las lagartijas y anfisbenas de la Argentina. De las 30 especies evaluadas solo tres están categorizadas como Vulnerables, 19 como No Amenazadas y ocho como Insuficientemente Conocida (Tabla 5).
Tabla 4. Comparaciones entre el número de especies categorizadas a nivel familia entre las categorías de conservación establecidas a nivel global en las Listas Rojas de la IUCN (2012) y las establecidas en la República Argentina. Se comparan categorías homologadas entre ambas listas (ver Giraudo et al., 2012): CR: En Peligro Crítico (Critically Endangered) / EP: En Peligro; EN: En Peligro (Endangered) / AM: Amenazada; VU: Vulnerable / VU: Vulnerable; DD: Data Deficient / IC: Insuficientemente Conocida; LC: Preocupación Menor (Least Concern) / NA: No Amenazada. NE: No evaluadas. No existen lagartijas ni anfisbenas Extinguidas (EX), Extinguidas en la Naturaleza (EW) o Cercanas a la Amenaza (NT, Near Threatened) en la Argentina.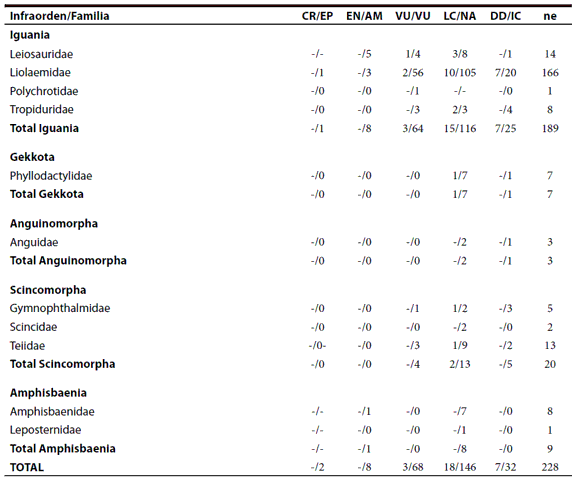
Tabla 5. Comparación entre las categorías de conservación establecidas en las Listas Rojas de la República Argentina y a nivel global (IUCN, 2012). En el caso que existan diferencias se indica las posibles causas. EP: En Peligro; AM: Amenazada; VU: Vulnerable; IC: Insuficientemente Conocida; NA: No Amenazada; LC: Preocupación Menor (Least Concern)..gif)
.gif)
Consideraciones finales
El presente trabajo constituye un importante esfuerzo a favor de la conservación de las lagartijas y anfisbenas de Argentina, representando la información incorporada en los últimos años un importante salto cuantitativo y cualitativo. Sin embargo, es necesario aumentar el conocimiento sobre la biología de nuestras lagartijas y anfisbenas, en especial de aquellas especies insuficientemente conocidas. Asimismo los resultados indican que hay varias consideraciones que deberán tenerse en cuenta con el fin de desarrollar estrategias particulares de conservación. Los principales aspectos a considerar se refieren a las especies que tienen algún grado de amenaza (EP, AM, VU), así como las especies Insuficientemente conocidas (IC).
A nivel taxonómico de familia, Leiosauridae contiene la mayor cantidad de especies con alguna categoría de riesgo o amenaza (50 %). De las 18 especies que componen la familia, cinco tienen la categoría de Amenazada (AM) y cuatro Vulnerable (VU). Dentro de Leiosauridae se deberá tener consideración especial para el género Urostrophus, representado en la Argentina por una especie, a la cual se le ha asignado la categoría de Amenazada (AM). Anisolepis es el género no monotípico del país más comprometido en cuanto a su estado de conservación, ya que es el único género que tiene todas las especies que habitan en la Argentina con la categoría Amenazada (AM). Otro género de la familia Leiosauridae que presenta un alto porcentaje de especies con algún grado de amenaza (50 %) es el género Pristidactylus, que contiene una especie con la categoría Amenazada (AM) y dos como Vulnerable (VU).
La familia Liolaemidae está presente en Argentina con los géneros Liolaemus y Phymaturus. El género Liolaemus es el más diverso del país (el segundo en el mundo) y está representado por 152 especies, de las cuales una tiene la categoría En Peligro (EP), tres Amenazada (AM) y 24 Vulnerable (VU). Estos datos indican que el 17.7 % de las especies de los Liolaemus de Argentina tiene algún grado de amenaza. Sin embargo, el género Phymaturus muestra otra realidad, tornándose un caso único dentro de la herpetofauna Argentina, ya que la totalidad de las especies (32) tienen la categoría de Vulnerable (VU). El consenso entre los especialistas que decidieron incluir a todo el género Phymaturus como Vulnerable (VU) radicó en los aspectos biológicos esenciales muy especializados, como su modo de vida (saxícola), su tipo de reproducción (vivíparo) y su dieta (herbívoro). Igualmente se consideró el estado de las poblaciones, que en la mayoría de las especies son poco abundantes, así como el marcado endemismo presente en numerosos taxa integrantes del género.
Dentro de la familia Tropiduridae se destaca el vacío de información para el género Stenocercus, representado en Argentina por seis especies, de las cuales cuatro están categorizadas como Insuficientemente Conocida. Asimismo, de las cuatro especies que tiene el género Tropidurus en la Argentina, dos están con la categoría Vulnerable (VU), dato que deberá ser tomado en cuenta debido a que en la categoría anterior (Avila et al., 2000) ninguna especie del género presentó alguna categoría de amenaza.
En las familias Phyllodactylidae, Anguidae y Scincidae ninguna especie tiene asignada alguna categoría de amenaza. La situación en los Gymnophthalmidae de la Argentina es similar al de las familias nombradas anteriormente, ya que de las seis especies (tres géneros) que conforman la familia sólo Vanzosaura rubricauda tiene la categoría de Vulnerable (VU).
Dentro de los cinco géneros (14 especies) que integran la familia Teiidae, sólo tres tienen la categoría de Vulnerable (VU), dos especies (33 %) del género Cnemidophorus y una (50 %) de Kentropyx.
Finalmente en la familia Amphisbaenidae, de las 10 especies que están presentes en Argentina, sólo una (Amphisbaena borelli) tiene la categoría de Amenazada (AM), sugiriendo que las anfisbenas no presentan mayores riesgos de conservación.
La información obtenida no debe tratarse como meros datos estadísticos, sino que debe ser el detonante para desarrollar nuevos y efectivos planes de conservación que permitan detener los procesos que están influyendo en el deterioro de las poblaciones amenazadas. Asimismo, los planes de conservación deben incluir estudios y análisis más detallados de las causas y procesos que actualmente están afectando a dichas especies, así como también estudios relacionados a la biología de las especies. El desarrollo de nuevos planes de conservación por parte de diferentes entidades gubernamentales y no gubernamentales no debe encasillarse en la prohibición de la intervención del hombre, sino que debe contemplar la manera de aminorar sus acciones. Asimismo, es imprescindible el trabajo mancomunado entre los diferentes entes de gobiernos y los investigadores-especialistas, para desarrollar y ejecutar los planes de conservación que permitan un mayor conocimiento y preservación de las especies de lagartijas y anfisbenas de la Argentina. La prohibición o impedimento, por parte de las autoridades de gobierno, para desarrollar estudios científicos con las especies amenazadas, marcaría una involución al evidente crecimiento en el conocimiento de la herpetofauna argentina experimentado en los últimos 10 años.
LITERATURA CITADA
1. Abdala, C.S. 2003. Cuatro nuevas especies del género Liolaemus (Iguania: Liolaemini), pertenecientes al grupo boulengeri, de la Patagonia, Argentina. Cuadernos de Herpetología 17: 3-32. [ Links ]
2. Abdala, C.S. 2005a. Sistemática y filogenia del grupo de L. boulengeri (Iguania: Liolemidae, Liolaemus) en base a caracteres morfológicos y moleculares. Tesis Doctoral, Universidad Nacional de Tucumán. [ Links ]
3. Abdala, C.S. 2005b. Dos nuevas especies del género Liolaemus (Iguania: Liolaemidae) y redescripción de Liolaemus boulengeri (Koslowsky, 1898). Cuadernos de Herpetología 19: 3-33. [ Links ]
4. Abdala, C.S. & Díaz Gómez, J.M. 2006. A new species of the Liolaemus darwinii group (Iguania: Liolaemidae) from Catamarca Province, Argentina. Zootaxa 1317: 21-33. [ Links ]
5. Abdala, C.S. & Lobo, F. 2006. Nueva especie para el grupo de Liolaemus darwinii (Iguania: Liolaemidae) del noroeste de Argentina. Cuadernos de Herpetología 19: 3-18. [ Links ]
6. Abdala, C.S.; Quinteros, S. & Espinoza, R.E. 2008. Two new species of Liolaemus (Iguania: Liolaemidae) from northwestern Argentina. Herpetologica 64: 458-471. [ Links ]
7. Abdala, C.S.; Quinteros, A.S.; Scrocchi, G.J. & Stazzonelli, J.C. 2010. Three new species of the Liolaemus petrophilus group (Iguania: Liolaemidae) from Argentina. Cuadernos de Herpetología 24: 25-40. [ Links ]
8. Abdala, C.S.; Scrocchi, G. & Montero, R. 2012. Desde la categorización del 2000: Muchas más lagartijas, los mismos problemas. En: Manejo de Fauna en la Argentina: Acciones para la Conservación de especies Amenazadas. Secretaría de Ambiente y Desarrollo Sustentable de la Nación. en prensa [ Links ]
9. Abdala, V.; Montero, R. & Moro, S. 2004. Lagartos y anfisbenas del litoral fluvial argentino y áreas de influencia. Estado del conocimiento: 303-316 . En: Aceñolaza, F.G. (ed.) Temas de la Biodiversidad del Litoral fluvial argentino, INSUGEO Miscelánea 12, Tucumán. [ Links ]
10. Acosta, J.C. & Murua, F. 1998. Lista preliminar y estado de conservación de los reptiles del Parque Nacional Ischigualasto. Multequina 7: 49-59. [ Links ]
11. Álvarez, B.B.; Aguirre, R.H.; Céspedez, J.A.; Hernando, A.B. & Tedesco, M.E. 2002. Atlas de Anfibios y Reptiles de las Provincias de Corrientes, Chaco y Formosa (Argentina I. (Anuros, Cecílidos, Saurios, Amphisbénidos y Serpientes). Universidad Nacional del Nordeste, Corrientes. [ Links ]
12. Avila, L.J. & Acosta, J.C. 1996. Evaluación del estado de conservación de la fauna de saurios, anfisbénidos y anfibios de la provincia de Córdoba (Argentina). Facena 12: 77-92. [ Links ]
13. Avila, L. J.; Montero, R. & Morando, M. 2000. Categorización de las lagartijas y anfisbenas de Argentina: 51-74. En: Lavilla E., E. Richard y G. Scrocchi (eds.). Categorización de los Anfibios y Reptiles de la República Argentina. Asociación Herpetológica Argentina, Tucumán. [ Links ]
14. Avila, L.J.; Frutos, N.; Morando, M.; Pérez, C.H.F. & Kozykariski, M. 2006. Reptilia, Iguania, Liolaemini, Liolaemus petrophilus and Liolaemus pictus: distribution extension, filling gaps, new records. Check List 2: 65-69. [ Links ]
15. Avila, L.J.; Martinez, L.E. & Morando, M. 2010. Lista de las lagartijas y anfisbenas de Argentina: una actualización [en línea]. Ver. 1.0. 1 Diciembre 2010. Centro Nacional Patagónico CENPAT-CONICET. Puerto Madryn, Chubut, Argentina. <http://www.losquesevan.com> [ Links ]
16. Avila, L.J. Martinez, L.E., Morando, M. 2012. Checklist of lizards and amphisbaenians of Argentina: an update. Zootaxa. en prensa. [ Links ]
17. Baldo, D.; Borteiro, C.; Brusquetti, F.; García, J.E. & Prigioni, C. 2008. Reptilia, Gekkonidae, Hemidactylus mabouia, Tarentola mauritanica: Distribution extension and anthropogenic dispersal. Check List 4: 434-438. [ Links ]
18. Bennet, A.F. 2004. Enlazando el paisaje: el papel de los corredores y la conectividad en la conservación de la vida silvestre. IUCN, San José de Costa Rica. [ Links ]
19. Bertonatti, C. 1994. Lista propuesta de anfibios y reptiles amenazados de extinción. Cuadernos de Herpetología 8: 164-171 [ Links ]
20. Breitman, M.F.; Parra, M.; Fulvio Pérez, C.H. & Sites, Jr., J.W. 2011a. Two new species of lizards from the Liolaemus lineomaculatus section (Squamata: Iguania: Liolaemidae) from southern Patagonia. Zootaxa 3120: 1-28. [ Links ]
21. Breitman, M.F.; Pérez, C.H.F.; Parra, M.; Morando, M.; Sites, Jr, J.W. & Avila, L.J. 2011b. New species of lizard from the magellanicus clade of the Liolaemus lineomaculatus section (Squamata: Iguania: Liolaemidae) from southern Patagonia. Zootaxa 3123: 32-48. [ Links ]
22. Cabrera, A.L. & Willink, A. 1980. Biogeografía de América Latina. Monografía 13 (Serie de Biología). Secretaría General de la Organización de los Estados Americanos (OEA), Departamento de Asuntos Científicos y Tecnológicos, [ Links ]
23. Cei, J.M. 1986. Reptiles del centro, centro-oeste y sur de la Argentina. Herpetofauna de las zonas áridas y semiáridas. Museo Regionale di Scienze Naturali Torino. Monografie 4: 1-527. [ Links ]
24. Cei, J.M. 1993. Reptiles del noroeste, nordeste y este de la Argentina. Museo Regionale di Scienze Naturali, Torino, Monografie 14: 1-949. [ Links ]
25. Cei, J.M. & Scolaro, J.A. 2003. Rectificación taxonómica y nomenclatural del presente status del taxón Liolaemus melanops Burmeister 1888. Facena 19: 163-164. [ Links ]
26. Cei, J.M.; Scolaro, J.A. & Videla, F. 2001. The present status of Argentinean polychrotid species of the genus Pristidactylus and description of its southernmost taxon as a new species. Journal of Herpetology 35: 597-605. [ Links ]
27. Cei, J.M.; Scolaro, J.A. & Videla, F. 2003. A taxonomic revision of recognized Argentine species of the leiosaurid genus Diplolaemus (Reptilia, Squamata, Leiosauridae). Facena 19: 87-106. [ Links ]
28. Chebez, J.C. 2008. Los que se van. Fauna argentina amenazada. Tomo 1: Problemática Ambiental, Anfibios y Reptiles. Editorial Albatros, Buenos Aires. [ Links ]
29. Chebez, J.C.; Rey, N.R. & Williams, J.D. 2005. Los reptiles de los Parques Nacionales de la Argentina. Editorial L.O.L.A., Buenos Aires. [ Links ]
30. Conrad, J.L. 2008. Phylogeny and systematics of Squamata (Reptilia) based on morphology. Bulletin of the American Museum of Natural History 310: 1-183. [ Links ]
31. Corbalán, V. & Debandi, G. 2008. La lacertofauna de Mendoza: lista actualizada, distribución y riqueza. Cuadernos de Herpetología 22: 5-24. [ Links ]
32. Corbalán, V.; Scolaro, A. & Debandi, G. 2009. A new species of the genus Phymaturus of the flagellifer group from Central-Western Mendoza, Argentina (Reptilia: Iguania: Liolaemidae). Zootaxa 2021: 42-56. [ Links ]
33. Corbalán, V.; Tognelli, M.F.; Scolaro, J.A. & Roig-Juñent, S.A. 2011. Lizards as conservation targets in Argentinean Patagonia. Journal for Nature Conservation 19: 60-67. [ Links ]
34. Díaz Gómez, J.M. 2007. Reptilia, Iguania, Liolaemidae, Liolaemus, Puna, Prepuna, and mountain ranges, Northwestern, Argentina. Check List 3: 105-118. [ Links ]
35. Doan, T.M. 2003. A new phylogenetic classification for the gymnophthalmid genera Cercosaura, Pantodactylus and Prionodactylus (Reptilia: Squamata). Zoological Journal of the Linnean Society 137: 101-115. [ Links ]
36. Etheridge, R.E. 2001. A new species of Liolaemus (Reptilia: Squamata: Liolaemidae) from Mendoza Province, Argentina. Cuadernos de Herpetología 15: 3-15. [ Links ]
37. Frost, D.; Etheridge, R.; Janies, D. & Titus, T.A. 2001. Total evidence, sequence alignment, evolution of polychrotid lizards, and a reclassification of the Iguania (Squamata: Iguania). American Museum Novitates 3343: 1-38. [ Links ]
38. Gans, C. 2005. Checklist and bibliography of the Amphisbaenia of the world. Bulletin of the American Museum of Natural History 289: 1-130. [ Links ]
39. Gamble, T.; Bauer, A.M.; Greenbaum, E. & Jackman, T. R. 2008. Out of the blue: a novel, trans-Atlantic clade of geckos (Gekkota, Squamata). Zoologica Scripta 37: 355-366. [ Links ]
40. Gärdenfors, U.; Hilton-Taylor, C.; Mace, G. & Rodríguez, J.P. 2001. The application of IUCN Red List criteria at regional levels. Conservation Biology 15: 1206-1212. [ Links ]
41. Giraudo, A.R.; Duré, M.; Schaefer, E.; Lescano, J.N.; Etchepare, E.; Akmentins, M.S.; Natale, G.; Arzamendia; V.; Bellini, G. [ Links ]; 42. Ghirardi, R. & Bonino, M. 2012. Revisión de la metodología utilizada para categorizar especies amenazadas de la herpetofauna Argentina. Cuadernos de Herpetología 26 (supl. 1): 117-130. [ Links ]
43. Giugliano, L.G.; Garcia Collevatti, R. & Colli, G.R. 2007. Molecular dating and phylogenetic relationships among Teiidae (Squamata) inferred by molecular and morphological data. Molecular Phylogenetics and Evolution 45: 168-179. [ Links ]
44. Grigera, D. & Úbeda, C. 1997. Recategorización del estado de conservación de la fauna de la Patagonia Argentina, Antartida e Islas del Atlántico Sur: un análisis de sus resultados. Gayana Zoología 61: 113-124. [ Links ]
45. IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. <www.iucnredlist.org>. Último acceso: 15 de Septiembre de 2012. [ Links ]
46. Kacoliris, F.; Celsi, C.E. & Monserrat, A.L. 2009. Microhabitat use by the sand dune lizard Liolaemus multimaculatus in a pampean coastal area in Argentina. Herpetological Journal 19: 61-67. [ Links ]
47. Lavilla, E.O.; Richard, E. & Scrocchi, G.J. (eds.). 2000. Categorización de los Anfibios y Reptiles de la República Argentina. Asociación Herpetológica Argentina, San Miguel de Tucumán. [ Links ]
48. Lobo, F. J. & Quinteros, S. 2005. A morphology-based phylogeny of Phymaturus (Iguania: Liolaemidae) with the description of four new species from Argentina. Papéis Avulsos de Zoologia 45: 143-177. [ Links ]
49. Lobo, F. & Abdala, C.S. 2007. Descripción de una nueva especie de Phymaturus del grupo de P. palluma, de la Provincia de Mendoza, Argentina. Cuadernos de Herpetología 21: 103-113. [ Links ]
50. Lobo, F.; Espinoza, R.E. & Quinteros, A.S. 2010a. A critical review and systematic discussion of recent classification proposals for liolaemid lizards. Zootaxa 2549: 1-30. [ Links ]
51. Lobo, F.; Abdala, C.S & Valdecantos, S. 2010b. Taxonomic studies of the genus Phymaturus (Iguania: Liolaemidae): Description of four new species. South American Journal of Herpetology 5: 102-126. [ Links ]
52. Montero, R. & Autino, A.G. 2009. Sistemática y filogenia de los Vertebrados, con énfasis en la fauna argentina. Segunda edición. Edición Independiente, Tucumán. [ Links ]
53. Morando, M. 2004. Sistemática y filogenia de grupos de especies de los géneros Phymaturus y Liolaemus (Squamata: Tropiduridae: Liolaeminae). Tesis Doctoral Universidad Nacional de Tucumán. [ Links ]
54. Müller, L. & Hellmich, W. 1932. Beiträge zur Kentnis der Herpetofauna Chiles. IV Liolaemus altissimus altissimus, Liolaemus altissimus araucaniensis. Zoologische Anzeiger 98: 197-208. [ Links ]
55. Núñez, H. & Fox, S. 1989. A new species of Iguanid lizard previously confused with Liolaemus multiformis (Squamata: Iguanidae). Copeia 1989: 456-460. [ Links ]
56. Paruelo, J.M.; Guerschman, J.P. & Verón, S.R. 2005 Expansión agrícola y cambios en el uso del suelo. Ciencia Hoy 15: 14-23. [ Links ]
57. Pelegrin, N.; Chani, J.M.; Echevarria, A.L.; & Bucher, E.H. 2009. Effects of forest degradation on abundance and microhabitat selection by ground dwelling Chaco lizards. Amphibia-Reptilia 30: 265-271. [ Links ]
58. Pelegrin, N. & Bucher E.H. 2010. Long-term effects of a wildfire on a lizard assemblage in the Arid Chaco forest. Journal of Arid Environments 74: 368-372. [ Links ]
59. Pelegrin, N. & Bucher E.H. 2012. Effects of habitat degradation on the lizard assemblage in the Arid Chaco, central Argentina. Journal of Arid Environments 79: 13-19. [ Links ]
60. Pincheira-Donoso, D. & Núñez, H. 2005. Las especies chilenas del género Liolaemus (Iguania, Tropiduridae, Liolaeminae). Taxonomía, sistemática y evolución. Publicación Ocasional del Museo Nacional de Historia Natural de Chile 59: 7-486. [ Links ]
61. Primack, R.; Roíz; R., Feinsinger, P.; Dirzo, R. & Massardo, F. 2001. Fundamentos de Conservación Biológica. Perspectivas Latinoamericanas. FCE, Méjico. [ Links ]
62. Programa Nacional de Estadística Forestal. 2011. Estadística de incendios forestales 2007-2008-2209-2010. Secretaría de Ambiente y Desarrollo Sustentable de la Nación. ISSN 1850-7239 (versión digital). Disponible en: <http://www.ambiente.gov.ar/?idarticulo=7816> Último acceso: 12 de Octubre de 2011. [ Links ]
63. Quinteros, A.S. 2012. Taxonomy of the Liolaemus alticolor-bibronii group (Iguania: Liolaemidae), with descriptions of two new species. Herpetologica 68: 100-120. [ Links ]
64. Quinteros, S. & Abdala, C.S. 2007. Liolaemus puritamensis Nuñez y Fox, 1989 (Iguania: Liolaemidae). Cuadernos de Herpetología 21: 117. [ Links ]
65. Quinteros, S.; Abdala, C.S. & Lobo, F. 2008a. Redescription of Liolaemus dorbignyi, Koslowsky, 1898 and description of a new species of Liolaemus (Iguania: Liolaemidae). Zootaxa 1717: 51-67. [ Links ]
66. Quinteros, S.; Abdala, C.S.; Díaz Gómez, J.M. & Scrocchi, G.J. 2008b. Dos nuevas especies de Liolaemus (Iguanidae: Liolemini) del centro oeste de la Argentina. South American Journal of Herpetology 3: 101-111. [ Links ]
67. Quinteros, S. & Abdala, C.S. 2011. A new species of the Liolaemus montanus section (Iguania: Liolaemidae) from Northwestern Argentina. Zootaxa 2789: 35-48. [ Links ]
68. Reca, A.; Úbeda, C.A. & Grigera, D. 1994. Conservación de la fauna de tetrápodos. Un índice para su evaluación. Mastozoología Neotropical 1: 17-28. [ Links ]
69. Rödder, D.; Solé, M. & Böhme, W. 2008. Predicting the potential distributions of two alien invasive Housegeckos (Gekkonidae: Hemidactylus frenatus, Hemidactylus mabouia). North-Western Journal of Zoology 4: 236-246. [ Links ]
70. Rudd, M.A. 2011. Scientists' opinions on the global status and management of biological diversity. Conservation Biology 25: 1165-1175. [ Links ]
71. Scolaro, A. 2005. Reptiles Patagónicos: Sur. Guia de Campo. Ediciones Universidad Nacional de la Patagonia, Trelew. [ Links ]
72. Scolaro, A. 2006. Reptiles Patagónicos: Norte. Una Guía de Campo. Ediciones Universidad Nacional de la Patagonia, Comodoro Rivadavia. [ Links ]
73. Scolaro, J.A. & Cei, J.M. 2003. Una excepcional nueva especie de Phymaturus de la Precordillera de Chubut, Argentina (Liolaemidae, Iguania, Lacertilia, Reptilia). Facena 19: 107-112. [ Links ]
74. Scrocchi, G. ; Abdala, C.S. ; Nori, J. & Zaher, H. 2010. Reptiles de la provincia de Río Negro, Argentina. Fondo Editorial Rionegrino, Viedma. [ Links ]
75. Sinervo, B.; Mendez De La Cruz, F.; Miles, D.B.; Heulin, B.; Bastiaans, E.; Villagran Santa Cruz, M.; Lara Resendiz, R.; Martinez Mendez, N.; Calderon Espinosa, M.L.; Meza Lazaro, R.N.; Gadsden, H.; Avila, L.J.; Morando, M.; De La Riva, I.J.; Victoriano, P.; Duarte Rocha, C.F.; Ibargüengoytía, N.; Aguilar Puntriano, C.; Massot, M.; Lepetz, V.; Oksanen, T.A.; Chapple, D.G.; Bauer, A.M.; Branch, W.R.; Clobert, J. & Sites, J.W. Jr. 2010. Erosion of lizard diversity by climate change and altered thermal niches. Science 328: 894-899. [ Links ]
76. Sodhi, N.S. & Ehrlich, P.R. 2010. Conservation Biology for All. Oxford University Press, Oxford. [ Links ]
77. Turner, I.M. 1996. Species loss in fragments of tropical rain forest: a review of the evidence. Journal of Applied Ecology 33: 200-205. [ Links ]
78. Úbeda, C.A.; Grigera, D. & Reca, A.R. 1994. Estado de conservación de la Herpetofauna del Parque y Reserva Nacional Nahuel Huapi, Argentina. Cuadernos de Herpetología 8: 155-163. [ Links ]
79. Úbeda, C.A. & Grigera, D. 1995. Recalificación del estado de conservación de la fauna silvestre argentina. Región Patagónica. Secretaría de Recursos Naturales y Ambiente Humano y Consejo Asesor Regional Patagónico de Fauna Silvestre, Buenos Aires. [ Links ]
80. Unidad de Manejo del Sistema de Evaluación Forestal (UMSEF). 2007. Monitoreo de Bosque Nativo. Período 1998-2002 y 2002-2006 (Datos preliminares). Dirección de Bosques, Secretaría de Ambiente y Desarrollo Sustentable, Buenos Aires. [ Links ]














